Isolement, caractérisation et étude in vitro de l’activité
anti-inflammatoire de différentes souches probiotiques
Mémoire
Sabrine Naïmi
Maîtrise en microbiologie agroalimentaire
Maître ès sciences (M. Sc)
Québec, Canada
Résumé
L'obésité et les maladies métaboliques telles que le diabète de type 2 sont associées à une inflammation chronique de faible intensité. Plusieurs études ont démontré qu’un régime riche en gras induit une modification de la composition du microbiote intestinal ainsi qu'une augmentation de la concentration en lipopolysacharides (LPS) dans la circulation sanguine. Ces LPS sont considérés comme étant le facteur déclencheur d'une inflammation chronique induisant un ensemble de désordres métaboliques. Selon des études récentes, les probiotiques contribueraient à la prévention de ces maladies métaboliques en réduisant l'inflammation provoquée par les LPS. Toutefois, ce processus inflammatoire est complexe et seules quelques pistes sont évoquées à ce jour. Ce mémoire a pour but 1) d'identifier et de caractériser de nouvelles souches probiotiques appartenant aux genres Lactobacillus, Propionibacterium et Bifidobacterium isolées à partir du fromage, du lait cru et de fèces de bébé et d'adultes et 2) d'étudier in vitro l'activité anti-inflammatoire des bactéries tuées par la chaleur et du surnageant de culture de chacune de ces souches en utilisant le modèle de macrophage murin J774.1. L'effet anti-inflammatoire de ces extraits bactériens a été évalué en mesurant la production d'oxide nitrique (NO) et des cytokines pro-inflammatoires (TNF-α et IL-6) et anti-inflammatoire (IL-10) en absence et en présence de LPS d'Escherichia coli serotype O55:B5. Parmi les cinquante-deux souches testées, trois souches de Lactobacillus, deux souches de Bifidobacterium et une souche de Propionibacterium ont démontré des effets anti-inflammatoires en réduisant la production de NO et d'IL-6 et en stimulant la production d'IL-10 en condition basale et en présence de LPS. Ces souches feront prochainement l’objet d’une étude in vivo chez des souris obèses insulino-résistantes pour confirmer leurs profils anti-inflammatoires.
Abstract
Obesity and related metabolic diseases such as type 2 diabetes are associated with chronic low-grade inflammation. Several studies have shown that a high-fat diet induces a change in the composition of the intestinal microbiota and an increase in lipopolysaccharides (LPS) serum levels. LPS are considered as the trigger for chronic inflammation inducing a set of metabolic disorders. According to recent studies, probiotics contribute to the prevention of metabolic diseases by reducing inflammation caused by LPS. However, the inflammatory process is complex and only a few tracks are discussed. This study aims to 1) identify and characterize new probiotic strains of Lactobacillus, Propionibacterium and Bifidobacterium isolated from cheese, raw milk and feces of infants and adults and 2) to study in vitro the anti-inflammatory activity of heat-killed bacteria and the conditioned media of each of these strains using the murine macrophage cell line J774.1. The anti-inflammatory effect of these bacterial extracts was evaluated by measuring the production of nitric oxide (NO), the pro-inflammatory cytokines (TNF-α and IL-6) and the anti-inflammatory cytokine (IL-10) in the absence and presence of LPS from Escherichia coli serotype O55:B5. Among the fifty two strains tested, three Lactobacillus, two Bifidobacterium and one Propionibacterium showed anti-inflammatory effects by reducing the production of NO and IL-6 and stimulating the production of IL-10 in basal condition and in presence of LPS. These strains will be used in an in vivo study in obese insulin resistant mice to confirm their anti-inflammatory profiles.
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... xi
Liste des figures ... xiii
Remerciements ... xvii
Avant-propos ... xix
Introduction générale... 1
Chapitre I. Revue de littérature ... 3
1.Obésité et désordres métaboliques chez l’humain ... 4
1.1. Problématique de l'obésité ... 4
1.2. Les désordres métaboliques associés à l’obésité ... 9
2. Le microbiote intestinal humain ... 14
2.1. Caractéristiques du microbiote intestinal ... 14
2.2. Fonctions du microbiote intestinal ... 14
3. Lien entre le microbiote intestinal et les maladies métaboliques associés à l’obésité ... 17
4. Lien entre les LPS et les maladies métaboliques associées à l’obésité ... 22
4.1. Structure des lipopolysaccharides (LPS) ... 22
4.2. Signalisation du LPS ... 24
4.3. Endotoxémie métabolique ... 26
5. Nouvelle approche thérapeutique : Les probiotiques ... 28
5.1. Concept des probiotiques ... 28
5.2. Définition et propriétés des probiotiques ... 28
5.3. Classification des probiotiques ... 30
5.4. Mécanismes d’actions des probiotiques ... 31
5.5. Allégations santé associées à la consommation des probiotiques ... 35
5.6. Critères de sélection des probiotiques... 35
5.7. Les probiotiques et les désordres métaboliques associées à l'obésité ... 36
6. Hypothèse et objectifs ... 38
6.1. Hypothèse ... 38
Chapitre II. Isolation, identification and characterization of probiotic strains of Lactobacillus and
Propionibacterium from cheese and raw milk ... 39
Résumé ... 40
Abstract ... 41
Introduction ... 42
Materials & methods ... 43
Isolation and phenotypic identification of bacterial isolates ... 43
Bacterial growth conditions ... 43
DNA extraction ... 44
PCR reaction ... 44
Sequence analysis ... 44
RAPD reaction ... 44
Results & discussion ... 45
Biochemical characterization of bacterial isolates ... 45
Sequence analysis of 16S rDNA... 45
RAPD analysis ... 47
Conclusion ... 49
Acknowledgments ... 49
List of tables ... 50
List of figures ... 54
Chapitre III. In vitro anti-inflammatory effects of different probiotic strains on murine macrophage nitric oxide and cytokine production ... 57
Résumé ... 58
Abstract ... 59
Introduction ... 60
Materials & Methods ... 61
Bacterial strains and culture conditions ... 61
Preparation of bacterial extracts ... 61
Murine macrophage cells treatment ... 61
NO determination ... 62
Effects of bacterial extracts on cytokine production in J774.1 macrophage cell line ... 63 Discussion ... 64 Conclusion ... 67 Acknowledgments ... 68 List of table ... 69 List of figures ... 70 Conclusion générale... 75 Bibliographie ... 77
Liste des tableaux
Chapitre I
Tableau I. 1. Classification internationale de l'OMS en fonction de l'indice de masse corporelle (IMC) (WHO 2006) ... 5 Tableau I. 2. Liste des microorganismes considérés comme des probiotiques (Holzapfel, Haberer et al. 2001) ... 31
Chapitre II
Table 1. Source and characteristics of presumptive Lactobacillus isolates used in this study ... 50 Table2. Sources and characteristics of presumptive Propionibacterium isolates used in this study ... 51 Table 3. Percentages of homology of the 16S rDNA sequence obtained from Lactobacillus isolates to 16S rDNA of reference strains held in GenBank ... 52 Table 4. Percentages of homology of the 16S rDNA sequence obtained from Propionibacterium isolates to 16S rDNA of reference strains held in Genbank ... 53
Chapitre III
Liste des figures
Chapitre I
Figure I. 1. Illustration schématique de l'effet néfaste de l'augmentation de l'adiposité corporelle sur la
sensibilité de l'organisme à l'insuline et sur la tolérance au glucose (Kopelman 2000) ... 10 Figure I. 2. Illustration schématique des mécanismes physiopathologiques qui interviennent dans le
développement de l'hypertension artérielle chez les sujets obèses (Hall 2003)... 12 Figure I. 3. Arbre phylogénétique des principaux phyla du tractus intestinal humain et leur présence relative (en%) chez des européens adultes en bonne santé (Diamant, Blaak et al. 2011) ... 15 Figure I. 4. Les principales fonctions des bactéries commensales qui composent le microbiote intestinal (O'Hara and Shanahan 2006) ... 16 Figure I. 5. Facteurs influençant la composition du microbiote intestinal et les effets de la dysbiose sur la santé de l'hôte (Sommer and Bäckhed 2013) ... 18 Figure I. 6. Effets de l'obésité sur l'écologie du microbiote intestinal chez les souris (Ley, Bäckhed et al. 2005) ... 19 Figure I. 7. Effet de la perte de poids sur la composition du microbiote intestinal chez les patients obèses (Ley, Turnbaugh et al. 2006) ... 19 Figure I. 8. Les liens possibles entre le microbiote intestinal et les désordres métaboliques associés à l'obésité (Vrieze, Holleman et al. 2010) ... 21 Figure I. 9. La structure générale du LPS des bactéries à gram négatif (Erridge, Bennett-Guerrero et al. 2002) ... 23 Figure I. 10. Structure du core chez certaines bactéries pathogènes à Gram négatif (Erridge, Bennett-Guerrero et al. 2002) ... 23 Figure I. 11. Illustration schématique de la signalisation du LPS (Luche 2011) ... 25 Figure I. 12. Illustration schématique de l'endotoxémie métabolique et ses conséquences. Adapté de (Serino, Luche et al. 2009) ... 27 Figure I. 13. Les principaux bienfaits des probiotiques (Nagpal, Kumar et al. 2012) ... 29 Figure I. 14. Illustration schématique des principaux mécanismes d'action des probiotiques (Bermudez-Brito, Plaza-Diaz et al. 2012) ... 34
Chapitre II
Figure1. 1% (w/v) agarose gel electrophoresis of PCR-amplified 16S rRNA from presumptive Lactobacillus isolates, M: molecular weight marker (1kb) ... 54 Figure 2. 1% (w/v) agarose gel electrophoresis of PCR-amplified 16S rRNA from presumptive
Propionibacterium isolates, M: molecular weight marker (1kb ... 54 Figure 3. RAPD amplification profiles with the primer CRA 22 of different isolates of Lactobacillus, M:
molecular weight marker (2-Log), N: negative control ... 55 Figure 4. RAPD amplification profiles with the primer CRA 22 of different isolates of Propionibacterium, M; molecular weight marker (2-Log), N: negative control ... 55
Chapitre III
Figure 1. Effect of heat-killed bacterial strains on NO production by J774.1 macrophage cell line. Bacterial strains were randomly divided into 8 groups: (a) group 1, (b) group 2, (c) group 3, (d) group 4, (e) group 5, (f) group 6, (g) group 7 and (h) group 8. Data are presented as means ± the standard error of the mean (SEM) for n= 4 experiments in each group. Statistical analysis were done by paired t-test, Asterisks (*) are used to indicate differences between heat-killed bacterial strains and control groups in both basal and LPS-stimulated macrophage cells (p<0.05 vs. respective control condition). ... 70 Figure 2. Effect of conditioned media of bacterial strains on NO production by J774.1 macrophage cell line. Bacterial strains were randomly divided into 8 groups: (a) group 1, (b) group 2, (c) group 3, (d) group 4, (e) group 5, (f) group 6, (g) group 7 and (h) group 8. Data are presented as means ± the standard error of the mean (SEM) for n= 2 experiments in each group. Statistical analysis were done by paired t-test, Asterisks (*) are used to indicate differences between heat-killed bacterial strains and control groups in both basal and LPS-stimulated macrophage cells (p<0.05 vs. respective control condition). ... 71 Figure 3. Effect of selected heat-killed bacterial strains on IL-6 production by J774.1 macrophage cell linein (a) basal and (b) LPS treatment. Data are presented as means ± the standard error of the mean (SEM) for n= 4 experiments in each strain. Statistical analysis were done by paired t-test, Asterisks (*) are used to indicate differences between heat-killed bacterial strains and control group in both basal and LPS-stimulated
macrophage cells (p<0.05 vs. respective control condition). ... 72 Figure 4. Effect of selected heat-killed bacterial strains on IL-10 production by J774.1 macrophage cell linein (a) basal and (b) LPS treatment. Data are presented as means ± the standard error of the mean (SEM) for n= 4 experiments in each strain. Statistical analysis were done by paired t-test, Asterisks (*) are used to indicate differences between heat-killed bacterial strains and control group in both basal and LPS-stimulated
macrophage cells (p<0.05 vs. respective control condition). ... 73 Figure 5. Effect of selected heat-killed bacterial strains on TNF-α production by J774.1 macrophage cell line in basal condition. Data are presented as means ± the standard error of the mean (SEM) for n= 4 experiments in each strain. Statistical analysis were done by paired t-test, Asterisks (*) are used to indicate differences between heat-killed bacterial strains and control group in basal condition (p<0.05 vs. respective control condition). ... 74
« La science n'a jamais tout à fait raison,
mais elle a rarement tout à fait tort, et, en
général, elle a plus de chance d'avoir raison
que les théories non scientifiques. Il est donc
rationnel de l'accepter à titre d'hypothèse.»
Remerciements
Ces travaux de maîtrise n'auraient pas été possibles sans l'aide et le soutien de nombreuses personnes que je tiens à remercier. Tout d'abord, J’aimerais remercier sincèrement mon directeur de recherche, Dr Ismail Fliss, qui m’a accueilli dans son laboratoire et m’a offert l’opportunité de réaliser mon projet de maîtrise. Je le remercie également pour son encadrement, ses conseils, et son aide précieuse qu’il m’a accordée durant toute la période de ma maîtrise. Je remercie aussi ma co-directrice, Dre Julie Jean, pour son aide et son intérêt qu’elle a porté au cours de ce projet. Je tiens également à remercier Dr Denis Roy d'avoir accepté d'évaluer mon mémoire.
J’adresse aussi mes remerciements à Dre Julie Audy pour sa contribution aux travaux d’isolement et d’identification des souches probiotiques ainsi que sa mise au point des protocoles et méthodes de biologie moléculaires utilisées dans cette étude.
Je tiens à exprimer mes chaleureux remerciements à Dr André Marette qui m’a accueilli dans son équipe de recherche pour la réalisation du deuxième volet de mon projet. J’ai eu la chance d’apprendre beaucoup de
nouvelles choses, d’élargir mes connaissances et de développer mon esprit scientifique. Un très grand merci à Dre Geneviève Pilon et Bruno Marcotte, du laboratoire du Dr Marette, pour leur amabilité, leur
disponibilité et leur aide précieuse durant la période de la réalisation de l’étude in vitro. Votre bonne humeur quotidienne et vos encouragements m’ont énormément facilité l’accomplissement de ce travail.
Je profite aussi de l’occasion pour remercier l’organisme subventionnaire, soit le Conseil de recherches en sciences naturelles et en génie du Canada (CRSNG), qui a contribué au financement de ce projet. Je remercie également nos partenaires industriels, Agropur cooperative et Ultima foods Inc. pour leur implication dans ce travail de recherche.
Je ne pourrais passer à côté d’une merveilleuse famille, mes très chers Naceur, Isabelle, Myriam et Gilbert. Je vous serai éternellement reconnaissante pour votre accueil chaleureux dès mon arrivée au Québec, votre soutien, vos encouragements et votre confiance.
Toute ma gratitude et tout mon amour à mes parents Mokhtar et Fatima pour leur appui et fierté tout au long de mes études. Je remercie également toute ma famille et mes amis pour leur soutien et encouragement. Enfin, je remercie toute personne, qui a participé de près ou de loin, à la réussite de ce travail.
Avant-propos
Le présent mémoire comporte une introduction générale suivie de trois chapitres et d'une conclusion générale. L’introduction présente la problématique, l’hypothèse et les objectifs de cette étude. Le premier chapitre correspond à une revue de littérature récente qui met en évidence les connaissances actuelles sur le
microbiote intestinal et son lien avec l’obésité et les désordres métaboliques qui lui sont associées. Ce chapitre présente également les travaux les plus pertinents portant sur les probiotiques qui constituent à ce
jour une nouvelle approche thérapeutique permettant de prévenir les maladies métaboliques liées à l’obésité. Le second chapitre, rédigé sous forme d’article scientifique et intitulé « Isolation, identification and characterization of probiotic strains of Lactobacillus and Propionibacterium from cheese and raw milk » porte sur l’identification génétique des différents isolats bactériens en utilisant des techniques de biologie moléculaire, soient la PCR et la RAPD.
Le troisième chapitre est rédigé également sous forme d’article scientifique et porte le titre de « In vitro anti-inflammatory effects of different probiotic strains on murine macrophage nitric oxide and cytokine production ». Dans ce chapitre, l’activité anti-inflammatoire des différentes souches probiotiques, précédemment identifiées et caractérisées, est évaluée in vitro en utilisant un modèle de macrophage murin J774.1.
Finalement, la dernière section de ce mémoire est consacrée à la conclusion générale qui inclue les perspectives.
Introduction générale
Au cours des dernières années, l’obésité est devenue un problème de santé publique qui a atteint des proportions épidémiques surtout dans les pays industrialisés (Viola, Arno et al. 2013). Selon les dernières estimations de l’OMS, le monde comptait 1.4 milliard de personnes en surpoids âgées de 20 ans et plus, parmi lesquelles plus de 200 millions d’hommes et près de 300 millions de femmes sont obèses(WHO 2008). Ainsi, plus d’un adulte sur dix dans le monde était obèse. Des tendances similaires ont été également observées au Canada. En effet, 18,4 % des Canadiens âgés de18 ans et plus, soit environ 4.7 millions d’adultes, étaient obèses(Statistics Canada 2012). Cette épidémie s'explique principalement par un déséquilibre énergétique entre un excès d'apport calorique, provenant souvent d'aliments très riches en gras et /ou en sucres, et une dépense énergétique réduite due à un manque d'activité physique (King, Mainous III et al. 2009; Wright and Aronne 2012).
L’obésité constitue un fardeau économique qui ne cesse de s'alourdir. Il a été estimé en 1997, que les coûts directs liés au traitement des maladies associées à l’obésité et à la recherche dans ce domaine s’élevaient à 1,8 milliard de dollars, soit 2,4% du total des dépenses des soins de santé au Canada(Birmingham, Muller et al. 1999). En 2001, le fardeau économique de l’obésité a été évalué à 4,3 milliards de dollars, dont 2,7 milliards de dollars en coûts indirects(Katzmarzyk and Janssen 2004). Entre 2000 et 2008, le fardeau économique annuel de l’obésité au Canada a augmenté de 735 millions de dollars, passant de 3,9 milliards à 4,6 milliards de dollars(PHAC 2011). Selon les estimations de l'agence de la santé publique du Canada, le fardeau économique de l’obésité varie annuellement de 4,6 milliards de dollars à 7,1 milliards de dollars. Plusieurs études ont démontré que l’obésité constitue la principale cause des maladies métaboliques (Grundy 2004; James, Rigby et al. 2004; Després and Lemieux 2006). En effet, l'obésité accroît considérablement le risque de maladies chroniques graves tel que le diabète de type 2, l’hypertension et les maladies cardiovasculaires (Rahmouni, Correia et al. 2005; Kahn, Hull et al. 2006; Van Gaal, Mertens et al. 2006). Ces facteurs de risque constituent ce qu’on appelle le syndrome métabolique(Alberti, Zimmet et al. 2005).
Ces maladies chroniques reliées au surpoids ont été récemment associées à une inflammation chronique de faible intensité (Hotamisligil 2006; Shoelson, Lee et al. 2006). En effet, il a été démontré qu’un régime riche en gras induit une modification de la composition du microbiote intestinal entrainant ainsi une dysbiose intestinale(Ley, Bäckhed et al. 2005). Cette dernière contribue à la production de lipopolysachaccarides (LPS), dérivés des bactéries à Gram négatif, et entraine l’altération de la perméabilité intestinale ce qui favorise le passage accru des LPS dans la circulation sanguine (Cani and Delzenne 2009). Ces LPS sont considérés
comme étant le facteur déclencheur d'une inflammation chronique qui contribue au développement des désordres métaboliques(Cani, Amar et al. 2007).
Une nouvelle approche thérapeutique a été mise en évidence dans plusieurs travaux de recherche permettant de moduler le microbiote intestinal via l’alimentation et ainsi lutter contre les maladies métaboliques liées à l’obésité. Cette nouvelle approche fait intervenir les probiotiques. Ces derniers représentent un secteur en pleine expansion et constituent actuellement un concept innovateur dans le domaine agroalimentaire(Grajek, Olejnik et al. 2005). De nombreux effets bénéfiques ont été associés à la consommation des produits laitiers probiotiques (Saarela, Mogensen et al. 2000; Ouwehand, Bianchi Salvadori et al. 2003). Le marché des produits laitiers probiotiques fait l'objet d'un véritable succès mondial et connaît également une véritable expansion au Canada, grâce à l'industrie des yogourts et des fromages probiotiques (Parvez, Malik et al. 2006; CDIC 2012). Certaines études récentes ont démontré que les bactéries lactiques pourraient intervenir dans le traitement de certaines maladies chroniques reliées au syndrome métabolique (Chang, Park et al. 2011). En effet, les bactéries lactiques contribueraient à la prévention de l’obésité et les maladies chroniques qui lui ont associées en réduisant l'inflammation provoquée par les LPS (Andreasen, Larsen et al. 2010; Cano, Santacruz et al. 2013). Toutefois, l’activité anti-inflammatoire des souches probiotiques est encore peu élucidée et seules quelques pistes sont évoquées à ce jour.
Le présent projet a pour objectif d’identifier et de sélectionner, à travers un modèle in vitro, des souches à fort potentiel probiotique capables de réduire l’inflammation et de prévenir les désordres métaboliques associés à l’obésité.
1.Obésité et désordres métaboliques chez l’humain
1.1. Problématique de l'obésité
1.1.1. Définition et prévalence de l'obésité
L'obésité correspond à un état d’individu caractérisé par une accumulation excessive de graisse corporelle qui peut nuire à la santé(Kopelman 2000). En 1997, l'obésité a été reconnue comme une maladie chronique par l'organisation mondiale de la santé (OMS)(WHO 2000).
L'obésité constitue un problème de santé majeur dont le taux a connu une forte augmentation au cours des dernières années au point qu’on parle d’épidémie d’obésité (Bray 1998; Pi‐Sunyer 2002). En effet, le nombre de cas d'obésité dans le monde a doublé depuis 1980 (WHO 2013). Selon les dernières estimations de l'OMS en 2008, 35% des adultes âgés de 20 ans et plus étaient en surpoids et 11% étaient obèses à l'échelle mondiale (WHO 2013). L'OMS prévoit qu’ 2015, le nombre d’adultes obèses atteindra les 700 millions (WHO 2006).
De nombreux pays ont vu leurs taux d'obésité augmenter au cours des dernières décennies particulièrement les pays développés. En effet, les États-Unis représentent les taux d'obésité les plus élevés au monde avec environ 34,3% d'adultes obèses en 2006 (OCDE 2009). Des taux similaires ont été observés entre 2004 et 2008 dans d'autres pays tels que le Mexique (30%), la Nouvelle-Zélande (26.5%) et le Royaume-Uni (24%). L'obésité toucherait également 24.3% des adultes canadiens entre 2007 et 2009, soit environ le quart de la population adulte au Canada(Shields, Tremblay et al. 2010). Selon statistique Canada, le taux d’obésité chez les hommes est passé de 16,0 % en 2003 à 19,0 % en 2009, tandis que chez les femmes, le taux d’obésité est passé de 14,5 % en 2003 à 16,7 % en 2009 jusqu'à son augmentation en 2012 avec 18,0 %(Statistique Canada 2012).
1.1.2. Types d'obésité
Il est connu que la distribution de la masse grasse chez l'être humain est hétérogène et peut varier d'un individu à l'autre selon certains facteurs tel que le sexe et l'âge (Björntorp 1987). On distingue chez l'humain quatre types d'obésité en fonction de la répartition des tissus adipeux dans les divers compartiments corporels.
Dans le premier type, on retrouve l'obésité androïde qui se caractérise par une morphologie en forme de « pomme» et dont l'excès de graisse est accumulé au niveau du tronc et de l'abdomen (Arner 1997). Ce
On retrouve ce type d'obésité généralement chez la femme. On distingue également l'obésité généralisée qui se caractérise par la concentration de l'excès de graisse aussi bien au niveau de la partie supérieure que dans la partie inférieure du corps et sans localisation préférentielle. Le quatrième type représente l'obésité viscérale qui se caractérise par une répartition de la masse graisseuse au niveau de l'abdomen et autour des viscères (Björntorp 1993).
1.1.3. Diagnostic de l'obésité
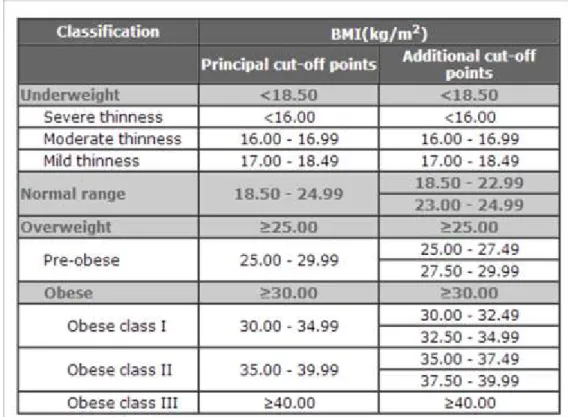
On ne peut se fier uniquement au poids d’une personne pour déterminer si elle est obèse ou si elle est en surpoids. Plusieurs mesures ont été utilisées afin de prédire l'impact de l'obésité sur la santé. Le principal indicateur de mesure utilisé est l'indice de masse corporelle IMC (BMI en anglais). L’IMC est l’outil le plus commun et le plus utile pour mesurer le surpoids et l’obésité dans une population
adulte. Cet indice se calcule en divisant le poids, qui est exprimé en kilogrammes, par le carré de la taille de la personne exprimé en mètre (WHO 2006). Par exemple, si une personne pèse 63,5 kg et mesure 1,68 m son
IMC est calculé comme suit: 63.5/1.68 ² = 22,5 kg/m²(Bray 1998). Selon l'OMS, un IMC compris entre 18,5 et 25 kg/m² est considéré comme normal chez un adulte. Lorsque l'IMC dépasse les 30 kg/m², on parle d'obésité (Tableau 1).
1.1.4. Causes de l'obésité
L'obésité est une maladie multifactorielle associant plusieurs facteurs environnementaux, comportementaux et génétiques. Cette maladie s'observe lorsque les apports caloriques sont supérieurs aux dépenses énergétiques du sujet, favorisant le stockage d'énergie sous forme de tissu adipeux et ainsi une prise de poids(Friedman 2000). Cet excès de poids peut être atteint de différentes manières et peut résulter d'une interaction entre un ensemble de différents facteurs ce qui suggère la complexité de l'obésité.
1.1.4.1. Facteurs environnementaux
De multiples causes externes interviennent dans le développement de l'obésité même chez les personnes qui
n'ont pas des prédispositions héréditaires. Ces causes externes comprenant les habitudes alimentaires, la culture, le statut social, ainsi que l'évolution du mode de vie, jouent un rôle important dans
l'évolution de l'obésité.
1.1.4.1.1. Mauvaises habitudes alimentaires
L’obésité peut résulter en premier lieu d'une mauvaise alimentation. Au cours des dernières années, un changement dans les habitudes alimentaires a été observé à l’échelle mondiale et qui se caractérise par une plus grande consommation d’aliments très caloriques riches en gras et en sucres mais pauvres en vitamines, en minéraux et autres micronutriments. En effet, la consommation d'aliments trop gras, trop sucrés, trop salés et surtout en trop grande quantité contribue au développement de l'obésité(Bray and Popkin 1998; Ba, JC et al. 2004).Certains aliments contenant des hydrates de carbone tels que le riz, le pain et les pâtes alimentaires ,ou bien riches en matières grasses tels que les aliments frits ou les produits d'origine animale représentent la principale cause de la prise de poids(Golay and Bobbioni 1997). En outre, une faible consommation d'aliments riches en fibres, tels que les céréales et les légumineuses, en calcium tels que les produits laitiers, en vitamines tels que les fruits et les légumes, est donc plus susceptible de mener à l'obésité. La consommation des boissons sucrées tels que les sodas constituent une source importante de calories et entrainent ainsi l'obésité(Ludwig, Peterson et al. 2001).
D'autre part, certains troubles du comportement alimentaire tels que le grignotage entre les repas, l'adoption d'un régime amaigrissant strict ainsi que les compulsions alimentaires pour certains aliments jouent également un rôle important dans la prise de poids(Irving and Neumark-Sztainer 2002).
1.1.4.1.2. Manque de l'activité physique
Par conséquent, lorsqu’un individu consomme plus de calories qu'il n'en dépense, son organisme stockera le surplus de graisse ce qui aboutit au développement de l’obésité.
Selon l’OMS, L’insuffisance de l’activité physique est à l’origine d’environ 1,9 million de décès par an à travers le monde(WHO 2006).Ce mode de vie sédentaire est de plus en plus adopté au cours des dernières années. Ceci est principalement dû à la modernisation de la société qui se traduit par l’évolution des modes de transport (voiture, transports en commun, ascenseurs, etc.) et des nouvelles technologies (télévision, ordinateur, consoles de jeux, etc.)(Hu, Li et al. 2003). Cette tendance inquiétante affecte maintenant les enfants et les adolescents ce qui favorise l’augmentation de la prévalence de l’obésité(Rey-Lopez, Vicente-Rodríguez et al. 2008).
1.1.4.1.3. Environnement socioculturel
Les facteurs socioculturels sont également responsables de la progression de l’obésité. Le marketing et la publicité ont profondément modifié les apports alimentaires journaliers. Ces facteurs qui s'accroissent considérablement dans notre société et qui se traduisent par la commercialisation de portions plus grosses, la restauration rapide connue par les «fast-food» et la diminution du nombre de repas préparés à la maison, entraînent le recours accru à une alimentation déséquilibrée et malsaine et contribuent ainsi au développement de l’obésité(Maddock 2004; Rosenheck 2008).
1.1.4.1.4. Troubles psychologiques et comportementaux
Certaines formes de difficultés sociales telles que le chômage, l'échec scolaire, le décès d'un proche, la séparation, ou encore le stress, l'anxiété, la dépression, peuvent entrainer une tendance à manger sans avoir faim ou au-delà de la satiété favorisant ainsi l'obésité. En effet, il a été démontré que certaines personnes obèses mangent d'une manière compulsive en réponse à des troubles psychologiques ou à des émotions négatives(McElroy, Kotwal et al. 2004; Simon, Von Korff et al. 2006). Ces facteurs psychologiques peuvent également provoquer l'obésité en déréglant le système neurohormonal qui contrôle le métabolisme des graisses(Allison, Newcomer et al. 2009).
1.1.4.2. Facteurs génétiques
Au cours des dernières années, il a été prouvé que l’hérédité pourrait être responsable de l’obésité. Des études effectuées auprès des jumeaux et des sujets adoptés ont démontré que le risque d’obésité d’un
individu augmente lorsqu’il possède des parents obèses (Maes, Neale et al. 1997)(Comuzzie and Allison 1998). En effet, des adultes ayant été adoptés en bas âge ont plus tendance à présenter un poids semblable à celui de leurs parents biologiques qu'à celui de leurs parents adoptifs. D'autre part, des jumeaux identiques présentent souvent un poids équivalent, même s'ils ont été élevés séparément. La présence de l’obésité sur
plusieurs générations au sein d’une même famille expliquerait aussi l’implication de l’hérédité dans le développement de l’obésité (Farooqi and O’Rahilly 2007).
Il a été également démontré que les facteurs génétiques expliquent environ 70% de la variation des phénotypes liés à l'obésité tels que l'indice de masse corporelle, les taux de leptine, la répartition du tissu adipeux ou la masse grasse, l’épaisseur des plis cutanés, la capacité à oxyder les graisses ou à les stocker, l’adaptabilité aux changements d'environnement alimentaire, les préférences gustatives, etc. (Walley, Asher et al. 2009; Meyre and Froguel 2012).
De nombreuses études ont démontré que certains gènes subissant une mutation génétique contribuent au développement de l’obésité. Huit gènes (LEP, LEPR, MC4R, POMC, PCSK1, BDNF, NTKR2, SIM1) identifiés chez la souris puis chez l'homme, étaient responsables de l'obésité monogénique (Meyre and Froguel 2010). Cette forme d'obésité est caractérisée par la présence d'une mutation unique sur l'un de ces huit gènes (Farooqi and O'Rahilly 2005). Par ailleurs, d'autres gènes ont été identifiés comme étant responsables de l'obésité polygénique, c'est à dire une obésité liée à plusieurs gènes mutés, et dont la plupart des personnes obèses sont atteintes de cette forme d'obésité (Hinney and Hebebrand 2008). Parmi ces gènes, on trouve CNR1 (cannabinoid receptor 1) qui intervient dans le développement de l'obésité et du syndrome métabolique lorsqu'il subit des mutations(Schleinitz, Carmienke et al. 2010). On trouve également le gène FTO (Fat mass and Obesity-associated gene) dont certaines mutations augmentent de 67 pour cent le risque d’obésité (Frayling, Timpson et al. 2007). Toutefois, la contribution de ces mutations géniques dans l'accroissement de la prédisposition à l'obésité demeure encore incomprise.
Ainsi, la combinaison entre les facteurs environnementaux et les prédispositions génétiques aboutissent au développement de l'obésité. Malheureusement, l'obésité est une maladie qui s'accompagne souvent de certaines complications métaboliques qui peuvent avoir des conséquences négatives considérables pour la santé.
1.2. Les désordres métaboliques associés à l’obésité
Plusieurs études cliniques et expérimentales ont associé l'obésité à un ensemble de désordres métaboliques tel que le diabète de type 2, les maladies cardiovasculaires, l'hypertension artérielle, l'athérosclérose, etc. (Hotamisligil 2006; Ogden, Yanovski et al. 2007).
1.2.1. Le diabète de type 2
Il est reconnu que les risques de développer certaines complications chroniques s’accroissent avec l’augmentation de l’adiposité corporelle. En effet, l'accumulation de tissu adipeux à l’intérieur de la cavité abdominale est associée au diabète de type 2 (Després and Lemieux 2006).
Le diabète de type 2 appelé également diabète non insulinodépendant (DNID) ou diabète insulinorésistant est une maladie chronique caractérisée par une intolérance au glucose et une
hyperinsulinémie résultant d’un état de résistance du métabolisme à l’action de l’insuline (WHO 1999). D'après l'OMS, environ 90% des diabétiques rencontrés dans le monde sont atteints de diabète de type 2 dont la majorité sont obèses ou présentent un excès de poids(WHO 2013).
Chez un sujet atteint de diabète de type 2, l’organisme est incapable de réguler la glycémie, c’est-à-dire le taux de glucose dans le sang ce qui aboutit à une hyperglycémie. Le pancréas se met alors à secréter davantage d'insuline jusqu'à l'épuisement. Lorsque la sécrétion d'insuline diminue, le taux de glucose demeure anormalement élevé.
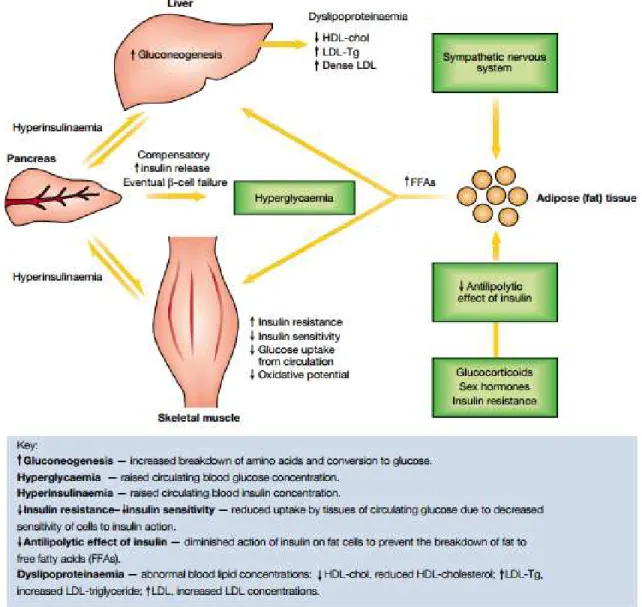
Plusieurs études ont démontré que l'obésité, particulièrement sa forme intra-abdominale, contribuerait au développement de la résistance à l’insuline en augmentant la mise en circulation de substrats lipidiques et leur entrée dans les tissus (Kopelman 2000). En effet, l'augmentation de l'adiposité intra-abdominale chez un sujet obèse entraine une élévation du taux de dégradation des graisses connue sous le nom de lipolyse (Figure 1). Cette dernière aboutie à une libération excessive d'acides gras libres (AGL) dans la circulation sanguine. Ces AGL ont un effet néfaste sur l'absorption de l'insuline par le foie. Ceci entraine l'augmentation de la néoglucogenèse hépatique (dégradation des acides aminés et leur conversion en glucose), l'augmentation de la production du glucose par le foie et une dyslipidémie systémique. Ces facteurs contribuent au développement d'une hyperinsulinémie systémique (augmentation de la concentration de l'insuline dans le sang) ainsi qu'à la diminution de la sensitivité de l'insuline squelettique accompagnée d'une réduction de l'absorption du glucose. Les cellules ß pancréatiques compensaient alors l'excès de glucose en produisant plus d'insuline jusqu'à épuisement. Par conséquent, le taux de glucose dans le sang augmente (hyperglycémie) ce qui entraine le diabète de type 2.
Figure I. 1. Illustration schématique de l'effet néfaste de l'augmentation de l'adiposité corporelle sur la sensibilité de l'organisme à l'insuline et sur la tolérance au glucose (Kopelman 2000)
1.2.2. L’hypertension artérielle
L'hypertension artérielle (HTA) fait également partie des désordres métaboliques causés par l'obésité. L’HTA est une maladie caractérisée par une élévation anormale et permanente de la pression artérielle au niveau des vaisseaux sanguins(Pickering 1972). En effet, le sang est transporté dans les artères à partir du cœur vers toutes les parties du corps. La tension artérielle est créée par la pression exercée par le sang sur la paroi intérieure des artères. Un certain niveau de pression est nécessaire pour que le sang puisse circuler dans tout l'organisme. Cependant, lorsque cette pression dépasse les valeurs normales, on parle d'hypertension artérielle.
L’HTA est exprimée en millimètre de mercure (mmHg). Chez un adulte hypertendue, la tension artérielle est supérieure ou égale à 140 mmHg quand le cœur se contracte (pression systolique) et à 90 mmHg quand le cœur se relâche (pression diastolique)(Carretero and Oparil 2000). Les personnes atteintes de HTA ne présentent généralement aucun symptôme. Toutefois, l'HTA peut causer des maux de tête, des étourdissements, des palpitations cardiaques et de l'essoufflement.
Plusieurs études ont démontré que l'obésité présente un facteur de risque important entrainant l'hypertension artérielle. Il a été estimé que 30% des personnes obèses sont hypertendues dont la plupart souffrent d'une obésité abdominale (Wilson, D'Agostino et al. 2002). En outre, l’HTA est 6 fois plus fréquente chez les sujets obèses que les sujets non obèses (Stamler, Stamler et al. 1978).
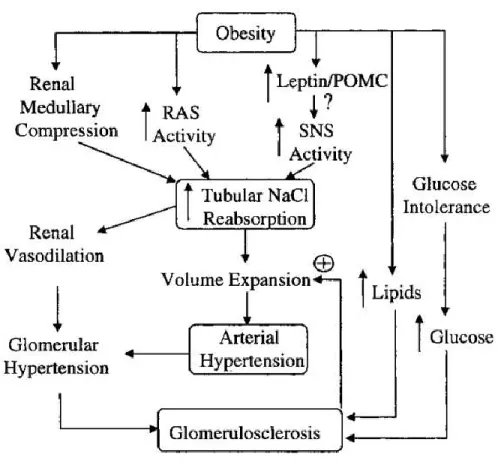
L'élévation de la pression artérielle chez les sujets obèses serait liée à plusieurs mécanismes physiopathologiques (Figure 2). Des études ont démontré que l'obésité est généralement accompagnée par une augmentation de la sensibilité au sel (Rocchini, Key et al. 1989). En effet, lors d'une alimentation riche en sel, les sujets obèses sont incapables de réguler l'excrétion du sel ce qui conduit à une augmentation de la réabsorption du sodium au niveau du tubule rénal proximal. Ceci entraine l'augmentation de la pression artérielle afin d'éliminer la rétention sodée. D'autre part, il a été démontré que l'obésité est accompagnée par une augmentation de l'activité du système nerveux sympathique (SNS) qui intervient dans le contrôle de l'excrétion du sel entrainant ainsi une vasoconstriction artérielle (diminution du diamètre des artères) et une diminution de la perfusion rénale (Kotsis, Stabouli et al. 2010). Ceci abouti à l'activation du système rénine-angiotensine (RAS) qui intervient dans la rétention du sodium et de l'eau au niveau du rein provoquant une augmentation du volume sanguin et entrainant ainsi l'élévation de la pression artérielle générale .
D’autres études ont démontré que chez les sujets obèses, présentant généralement une résistance à l'insuline et une intolérance au glucose, le taux plasmatique d'insuline est élevé. Ceci entraine l'activation du système sympathique contribuant ainsi à l'augmentation de la pression artérielle (Hall 2003).
La leptine, une hormone qui contrôle la satiété et le métabolisme des graisses, serait également impliquée dans l'élévation de la pression artérielle chez les personnes obèses via l'activation du SNS (Rosmond, Chagnon et al. 2000).
Figure I. 2. Illustration schématique des mécanismes physiopathologiques qui interviennent dans le développement de l'hypertension artérielle chez les sujets obèses (Hall 2003)
1.2.3. Le syndrome de l'apnée du sommeil
Plusieurs études ont démontré qu'il existe un lien entre l'augmentation du poids corporel et le risque de développer une apnée du sommeil. En effet, la plupart des personnes atteintes d'une apnée du sommet ont un IMC > 30 (Chua and Chediak 1994).
L'apnée du sommet est un phénomène survenant habituellement chez les personnes obèses et qui se manifeste par des arrêts involontaires de la respiration durant le sommeil surtout en position allongée(Vgontzas, Papanicolaou et al. 2000). Pendant le sommeil, l'augmentation de la masse graisse au niveau de la poitrine et de l'abdomen entraine une diminution du volume des poumons (Kopelman 2000). Ceci abouti à une hypoventilation alvéolaire (Diminution des échanges gazeux dans les alvéoles pulmonaires) et des épisodes transitoires de l'apnée qui sont accompagnés par une chute de la saturation artérielle en oxygène (hypoxie) et une augmentation de dioxyde de carbone artériel (hypercapnie). Chez certains individus, ces facteurs conduisent à une somnolence pendant la journée (hypersomnolence) avec hypoxie persistante et hypercapnie accompagnée par le développement de l'hypertension pulmonaire, d'insuffisance cardiaque et, éventuellement, une insuffisance respiratoire.
1.2.4.Les maladies cardiovasculaires
L’obésité constitue également un facteur de risque cardiovasculaire (Grundy 2004; Van Gaal, Mertens et al. 2006). En effet, l'augmentation du poids corporel entraine une élévation de la masse maigre et grasse. Ceci abouti à l'augmentation du volume sanguin total, qui à son tour contribue à une augmentation du volume d'éjection systolique (volume sanguin éjecté par le cœur à chaque contraction) et du débit cardiaque. L'augmentation de la pré-charge et la post-charge cardiaque contribue à la dilatation du ventricule gauche du cœur entrainant une hypertrophie excentrique. Ceci entraine l'épuisement des oreillettes et des ventricules du cœur d'où le développement d'une insuffisance cardiaque.
2. Le microbiote intestinal humain
2.1. Caractéristiques du microbiote intestinal
Le microbiote intestinal désigne l'ensemble des micro-organismes, majoritairement des bactéries, qui résident au niveau du tube digestif. On estime que chez un humain adulte, le microbiote intestinal renferme plus de 1000 espèces bactériennes différentes correspondant à 1014 bactéries c'est-à-dire dix fois plus que le nombre
totale de cellules eucaryotes humaines (Xu and Gordon 2003; Xu, Mahowald et al. 2007). C'est également l'équivalent à une masse totale de 1 à 2 kg (Ley, Peterson et al. 2006).
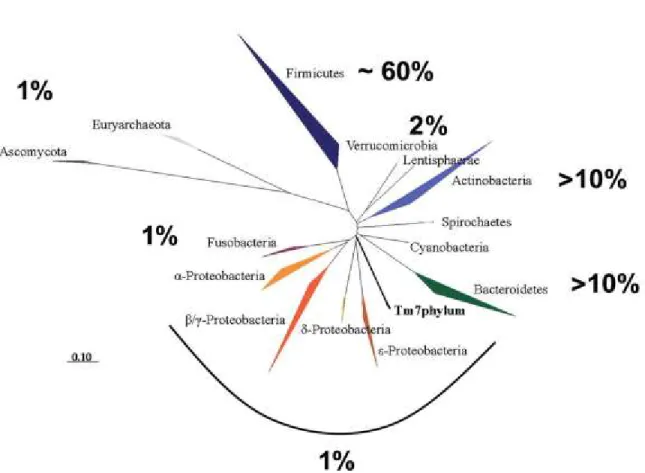
La majorité des bactéries intestinales présentes chez l'homme sont des anaérobies et appartiennent à deux phyla dominants : les Gram+ Firmicutes et les Gram- Bacteroidetes (Eckburg, Bik et al. 2005). On retrouve également d'autres grands phyla tels qu’Actinobacteria, Verrucomicrobia, Proteobacteria et Methanobacteriales ainsi que plusieurs mineurs comme Spirochaetes, Cyanobacteria, Fusobacteria (Figure 3). Ces espèces très majoritairement commensales ainsi que diverses levures et autres micro-organismes coexistent dans un équilibre écologique et dynamique et ne jouent pas de rôles pathogènes.
À ce jour, le microbiote intestinal humain n’a pas encore été totalement décrit. En effet, la grande majorité des espèces bactériennes qui composent le microbiote intestinal ne sont pas détectables par des méthodes classiques basées sur la culture bactérienne (Zoetendal, Vaughan et al. 2006). Cette difficulté a été surmontée grâce à la découverte de nouvelles méthodes de biologie moléculaire basées principalement sur l’étude de l’ARNr 16S des bactéries (Andersson, Lindberg et al. 2008; Zoetendal, Rajilić-Stojanović et al. 2008). L'utilisation de ces outils moléculaires a donc permis de mieux connaître le microbiote intestinal dont certains chercheurs le considèrent comme un organe à part entière placé dans un organisme hôte.
2.2. Fonctions du microbiote intestinal
Plusieurs travaux récents soulignent l'importance du microbiote intestinal ainsi que son rôle essentiel pour la santé et le bien-être de l’hôte (Figure 4).
En effet, le microbiote intestinal permet la fermentation des fibres alimentaires non digestibles et leur transformation en métabolites. Ces derniers peuvent être absorbés par la muqueuse intestinale et ainsi servir de substrat énergétique pour l’hôte (Turnbaugh, Ley et al. 2006).
Les bactéries intestinales jouent également un rôle dans la synthèse de nutriments particuliers tel que les vitamines B12 et K, l’acide folique et la biotine (O'Hara and Shanahan 2006; Zoetendal, Vaughan
du lait tel que le lactose et d'autres sucres simples en acide lactique nécessaire pour la production d'énergie dans les muscles (Gorbach 1990).
Figure I. 3. Arbre phylogénétique des principaux phyla du tractus intestinal humain et leur présence relative (en%) chez des européens adultes en bonne santé (Diamant, Blaak et al. 2011)
Les bactéries commensales sont aussi impliquées dans la défense antimicrobienne contre les micro-organismes pathogènes au niveau intestinal. Cette action antimicrobienne peut être effectuée d'une façon directe grâce au phénomène de compétition permettant aux bactéries commensales d'empêcher l'adhésion des germes infectieux aux parois intestinales(Servin and Coconnier 2003). Les bactéries présentes dans le microbiote intestinal pourraient également limiter la croissance des pathogènes en exercent une action antimicrobienne indirecte. Cette dernière se réalise grâce à la production de différents composés antimicrobiens tel que les bactériocines (Klaenhammer 1993), les acides organiques tels que l'acide lactique et l'acide acétique, qui sont produits respectivement par les lactobacilles et les bifidobactéries via la fermentation des hexoses(Servin 2004), et le peroxyde d'hydrogène (H2O2) produit par certaines bactéries
lactiques et qui inhibe le développement de nombreux germes pathogènes (Ouwehand and Vesterlund 2004). Le microbiote intestinal intervient également dans le renforcement du système immunitaire intestinal (Ouwehand, Isolauri et al. 2002). En effet, les bactéries commensales permettent la stimulation de l’immunité adaptative, tel que la production des anticorps de type IgA (Shu and Gill 2002), ainsi que l'immunité innée tel que la production des macrophages, des monocytes, etc. Le microbiote intestinal permet aussi la maturation intestinale et le renforcement de la barrière mucosale (Bäckhed, Ley et al. 2005).
Ainsi, le microbiote intestinal joue un rôle important non seulement au niveau du tube digestif mais également au niveau systémique et des études récentes ont démontré qu'il serait en lien avec les maladies métaboliques et plus particulièrement avec l'excès du poids.
3. Lien entre le microbiote intestinal et les maladies métaboliques
associés à l’obésité
Le microbiote intestinal constitue un habitat dynamique qui abrite un ensemble de microorganismes
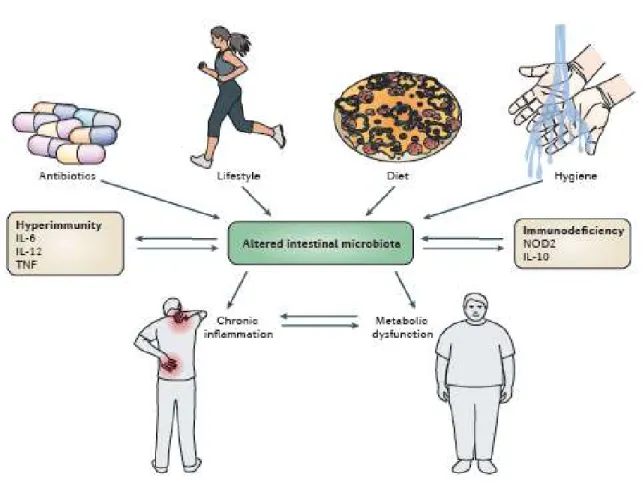
symbiotiques et qui peut subir des changements constants et rapides dans ses paramètres physiologiques (Sommer and Bäckhed 2013). Ces changement peuvent être dus à certains facteurs tel que le régime alimentaire de l'hôte, le mode de vie, l'hygiène ainsi que l'utilisation d'antibiotiques, pouvant ainsi affecter la composition du microbiote intestinal (Figure 5).
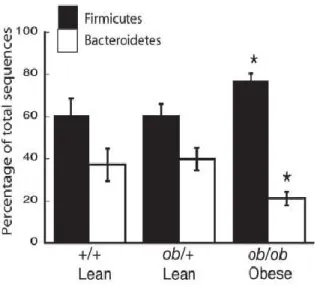
La composition du microbiote intestinal diffère d'une façon significative d'un individu à l'autre. Des études récentes ont suggéré l'existence de différences dans la composition du microbiote intestinal entre les sujets obèses et les sujets non obèses(Ley, Bäckhed et al. 2005). En effet, une réduction d'environ
50 % du nombre des bactéries du groupe Bacteroidetes a été observée chez des souris ob/ob génétiquement obèses ainsi qu'une augmentation proportionnelle des bactéries du groupe Firmicutes comparativement aux souris saines hétérozygotes ob/+ ou sauvages (Figure 6).
Ces résultats ont été confirmés plus tard par la même équipe chez l'humain(Ley, Turnbaugh et al. 2006). En effet, des sujets obèses ont été soumis à une diète amaigrissante appauvrie en lipides ou en glucides pendant un an. Le séquençage des gènes bactériens dans les matières fécales de ces patients obèses a permis de retrouver une forte diminution du rapport Firmicutes / Bacteroidetes similaire à celui observé chez des sujets sains (Figure 7). Tout au long de l’expérience, une augmentation du taux des Bacteroidetes a été observée et ce de façon proportionnelle à la perte de poids. Ces résultats suggèrent que le poids corporel intervient dans la gestion de la composition du microbiote intestinal indépendamment de la nature du régime alimentaire.
Ces résultats ont été confirmés par une autre étude qui a démontré l’existence de liens entre la composition du microbiote et l’absorption, la régulation et l’entreposage d’énergie (DiBaise, Zhang et al. 2008). En outre, il a été démontré que l'interaction entre les microorganismes intestinaux aurait aussi un rôle important au niveau de l'homéostasie de l'énergie (Cani, Neyrinck et al. 2007).
Plusieurs autres études ont également fait le lien entre le microbiote intestinal et l'obésité. En effet, une étude portant sur la composition de la flore intestinale chez des enfants avec un surplus de poids a été comparée à celle des enfants normaux(Kalliomäki, Collado et al. 2008). Cette comparaison a permis de remarquer que la flore intestinale des enfants normaux comporte un nombre plus élevé de Bifidobacterium spp. et une quantité plus grande de Staphylococcusaureus chez les enfants avec un surplus de poids.
Ainsi, la colonisation intestinale en jeune âge par des souches de Staphylococcus aureus produisant des toxines permet de provoquer l’inflammation qui contribue au développement de l’obésité. Ceci a été confirmé par une autre étude démontrant que la réduction des nombre de Bifidobacterium spp. est associée au surpoids chez des adolescents en comparaison avec des adolescents de poids normal (Santacruz, Marcos et al. 2009).
Figure I. 5. Facteurs influençant la composition du microbiote intestinal et les effets de la dysbiose sur la santé de l'hôte (Sommer and Bäckhed 2013)
Figure I. 6. Effets de l'obésité sur l'écologie du microbiote intestinal chez les souris (Ley, Bäckhed et al. 2005)
Figure I. 7. Effet de la perte de poids sur la composition du microbiote intestinal chez les patients obèses (Ley, Turnbaugh et al. 2006)
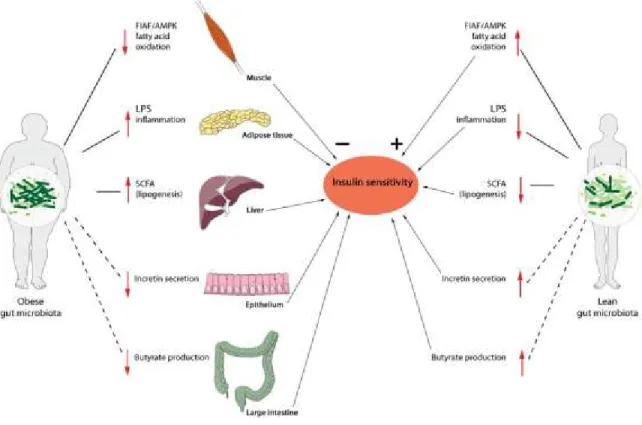
De nombreuses études ont établi des liens entre le microbiote intestinal et les désordres métaboliques associés à l'obésité. En effet, le microbiote intestinal est considéré comme étant un facteur environnemental influençant le stockage des graisses. Une étude utilisant des souris conventionnelles et des souris axéniques dépourvues de microbiote intestinal (germ-free mice) a démontré que le microbiote intestinal facilite l’extraction d’énergie à partir des nutriments ingérés, aide au stockage de cette énergie au niveau des tissus adipeux et fournit de l’énergie et des nutriments nécessaires à la croissance et au développement de la microflore colique (Bäckhed, Ding et al. 2004). Dans cette même étude, les auteurs ont démontré que la colonisation des souris axéniques avec le microbiote de souris conventionnelles entraine une augmentation de 60% de la masse graisseuse corporelle qui est associée avec une augmentation de la résistance à l'insuline malgré la faible prise alimentaire.
Une autre étude a également démontré que la transplantation du microbiote intestinal à partir de souris obèses (ob/ob) vers des souris conventionnelles entraine une augmentation significative de la masse grasse totale en comparant avec une transplantation effectuée à partir de souris maigres(Turnbaugh, Ley et al. 2006). Ces résultats soulignent l'importance et l'efficacité du microbiote intestinal dans le stockage d'énergie à partir des aliments ingérés chez les personnes obèses.
Les études sur les souris conventionnelles et les souris axéniques ont aussi démontré que le microbiote intestinal est impliqué dans l'augmentation de la production du glucose et des triacylglycérides par le foie (Figure 8). En effet, l'inoculation du microbiote intestinal inhibe l'expression de la protéine FIAF
(Fasting-induced adipocyte factor) ce qui entraine la suppression de l'inhibiteur de la lipoprotéine lipase (LPL) et donc d'augmentation de l'activité de la LPL. Cette dernière favorise l'augmentation de l'absorption des acides gras et l'accumulation des triglycérides dans les adipocytes.
En outre, il a été démontré que chez les souris axéniques, il y a une augmentation du taux des phosphorylations de l'AMPK (protéine kinase activée par l'AMP) dans le muscle et le foie, ce qui stimulerait l'oxydation du NEFA (Non-esterified fatty acids) et par conséquent conduirait à la diminution du stockage des acides gras.
Ainsi, les sujets maigres semblent être protégés contre l'obésité par deux mécanismes complémentaires
mais indépendants entrainant la diminution du stockage des acides gras soient des niveaux élevés de la FIAF et l'augmentation de l'activité de l'AMPK.
La GPR41 est sécrétée par les cellules entéroendocrines de l'intestin. L'activation de la GPR41 entraine la production du peptide YY (PYY), une hormone sécrétée par les cellules entéroendocrines qui,
normalement, inhibe la motilité intestinale, augmente la vitesse du transit intestinal et réduit l'extraction de l'énergie à partir de l'alimentation affectant ainsi l'utilisation du glucose périphérique (Samuel, Shaito et al. 2008).
En plus de son rôle dans le métabolisme énergétique, le microbiote intestinal est impliqué dans le
développement d'une inflammation systémique de faible intensité dont l'origine reste encore peu connue. Des études récentes ont démontré qu'il existe un mécanisme liant le microbiote intestinal et les désordres
métaboliques associés à l'obésité. Il s'agit des lipopolysaccharides (LPS) bactériens, dérivés des bactéries Gram négatif qui sont présentes dans le microbiote intestinal. Les LPS agissent en tant que déclencheurs d'une inflammation et des désordres métaboliques induits par une alimentation hyperlipidique (Cani, Amar et al. 2007).
Figure I. 8. Les liens possibles entre le microbiote intestinal et les désordres métaboliques associés à l'obésité (Vrieze, Holleman et al. 2010)
4. Lien entre les LPS et les maladies métaboliques associées à
l’obésité
4.1. Structure des lipopolysaccharides (LPS)
Les lipopolysaccharides (LPS) appelés également lipoglycanes, sont des complexes macromoléculaires qui constituent le composant principal de la membrane externe des bactéries Gram-négatif(Yuki, Taki et al.
1993). Il s'agit d'endotoxines dotées de propriétés toxiques qui induisent une réaction inflammatoire(Loppnow, Libby et al. 1990). Les lipopolysaccharides sont constitués de deux parties principales : une partie lipidique appelée lipide A permettant l’ancrage à la membrane, et une partie polysaccharidique débordant la membrane externe (Figure 9).
Le lipide A est constitué de deux sucres aminés (glucosamines ou parfois 3-aminoglucosamine) liés par une liaison bêta 1-6, phosphorylés et liés à des acides gras hydroxylés sur leur troisième atome de carbone ainsi qu'à un ou deux autres acides gras non hydroxylés(Galanos, Luderitz et al. 1985).
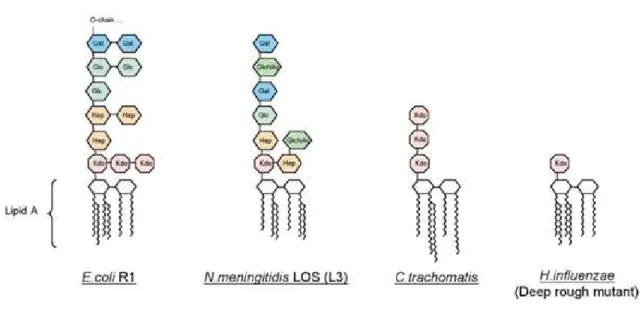
La partie polysaccharidique est constituée d’un noyau appelé core interne lié au lipide A et d’un
deuxième noyau appelé core externe lié à une chaîne de polysaccharides appelés chaîne O. La structure du core est similaire pour les souches d’une même espèce mais varie selon les espèces bactériennes (Figure 11). Le core interne est constitué généralement par des sucres inhabituels tel que l'heptose et l'acide 3-désoxy-α-D-manno-octulosonique appelé également Kdo. Les résidus Kdo sont toujours présent dans le LPS et leur nombre est variable (généralement deux ou trois) selon les espèces bactériennes.
Le core externe est généralement composé de sucres plus courants tels que le glucose, le galactose, la N-acétylgalactosamine et la N-acétylglucosamine. Ainsi, le core externe est structurellement plus variable que le core interne.
La chaîne O appelée également antigène O est la partie la plus variable du LPS. Elle est constituée de motifs répétitifs comprenant chacun de un à huit résidus glycosyle dont le nombre est variable en fonction des espèces bactériennes. L'antigène O est responsable de la spécificité antigénique permettant de décrire des sérotypes au sein d'une même espèce bactérienne.
Figure I. 9. La structure générale du LPS des bactéries à gram négatif (Erridge, Bennett-Guerrero et al. 2002)
4.2. Signalisation du LPS
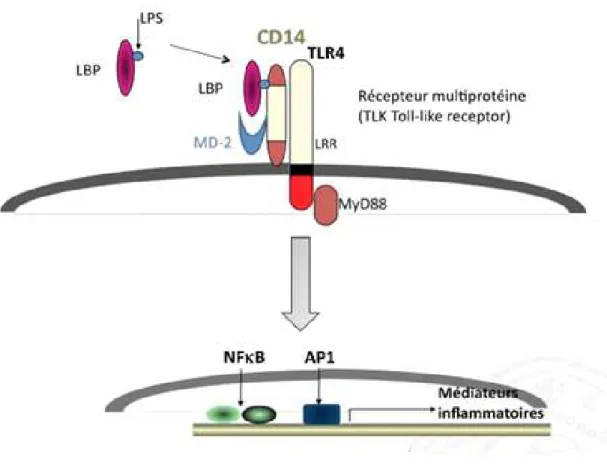
Les LPS sont des endotoxines reconnues depuis longtemps comme étant un facteur clé de l'induction d'une forte réponse immunitaire aboutissant à un choc septique ou septicémie chez l'être humain. La première molécule mise en jeu dans la reconnaissance du LPS est la LBP (LPS binding proteine)
(Palsson-McDermott and O'Neill 2004). Il s'agit d'une protéine de la phase aiguë secrétée par le foie et circulant dans le sang où elle reconnait et forme une haute affinité avec le lipide A du LPS. Une fois que le LPS est fixé à la LBP, cette protéine va permettre le transfert du LPS vers le récepteur CD14 .
Le récepteur membranaire CD14 est une glycoprotéine de 53 kDa ancré à la membrane plasmique des cellules immunitaires par un glycosylphosphatidylinositol (GPI). Le récepteur CD14 ne possède pas de domaines transmembranaires ou intracellulaires. Donc, il ne peut pas être considéré comme étant l'initiateur de l'activation de la réponse immunitaire.
Le complexe CD14/LPS est reconnu alors par le récepteur TLR4 (Toll-like receptor 4)(Miller, Ernst et al. 2005). Ce dernier est associé à une protéine accessoire appelée MD-2 (myeloid differentiation protein-2) au niveau
de la partie extracellulaire. Lorsque le complexe TLR4/MD-2 interagit avec le LPS lié à CD14, un signal est envoyé au noyau cellulaire et active le facteur de transcription NF-kB (nuclear factor-kappa B) et AP-1 (activator protein 1)entrainant ainsi la sécrétion de cytokines pro-inflammatoires, y compris le facteur
de nécrose tumorale α (TNF- α), l'interleukine-1 (IL-1), le Monocyte chimoattractant protein-1 (MCP-1), L'oxyde nitrique synthase (iNOS), etc., induisant en conséquence une inflammation systémique (Figure 12).
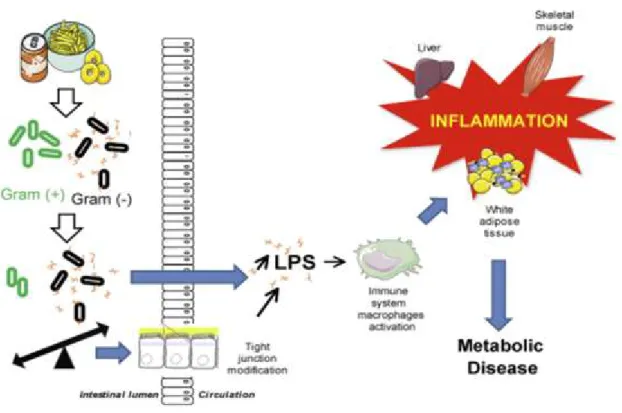
4.3. Endotoxémie métabolique
L'étude de Cani et al. en 2007 fut la première à suggérer que les LPS contribueraient de façon significative au développement d'une inflammation chronique de faible intensité associée à l'obésité (Cani, Amar et al.
2007). En effet, les auteurs ont démontré que l'ingestion d'une alimentation hyperlipidique était associée à une augmentation des taux circulants de LPS issue de la paroi des bactéries Gram négatif présentes dans
le tractus gastro-intestinal. Cette augmentation des taux plasmatiques d’endotoxines a été qualifiée d' « endotoxémie métabolique ».
Comme expliqué précédemment, un régime hyperlipidique est responsable d’une augmentation du rapport Firmicutes / Bacteroidetes et d'une diminution drastique du nombre de Bifidobacterium spp. favorisant ainsi les bactéries Gram négatif par rapport aux Gram positif. Ceci entraine l'élévation de la production d’endotoxine par les bactéries Gram négatif au sein du microbiote intestinal. Cette dysbiose intestinale (altération de l'équilibre normal de la flore bactérienne intestinale) aboutit à des dérégulations de la perméabilité intestinale et une altération de la fonction barrière de l’intestin (Cani and Delzenne 2011).
Normalement, l’épithélium intestinal constitue une véritable barrière continue permettant d'empêcher le passage anarchique des LPS ainsi que d’autres molécules d’origine bactérienne dans l’organisme. Cependant, certains événements endogènes ou exogènes tels que la consommation d’alcool, le stress ou l’exposition à des radiations ionisantes, peuvent altérer les fonctions protectrices de cette barrière.
Il a été démontré qu'une dysbiose intestinale induite par une alimentation riche en gras entraine une augmentation de la perméabilité intestinale en induisant une diminution de l’expression des gènes codant pour deux protéines clé des jonctions serrées (appelées aussi zonula occludens) soient la ZO-1 et l'occludine (Cani, Delzenne et al. 2008). Lorsque ces jonctions serrées sont agressées, la muqueuse
intestinale est altérée et son étanchéité n'est plus assurée. Par conséquent, la porosité intestinale laisse s'infiltrer les LPS dans la circulation sanguine(Cani, Bibiloni et al. 2008).
Lorsque les LPS se trouvent dans la circulation sanguine, ils se lient aux protéines de liaison LBP activant ainsi la voie de transduction de signal du LPS (LPS /CD14/TLR4) ce qui aboutit à la surexpression des facteurs pro-inflammatoires(Lumeng and Saltiel 2011). Ces derniers provoquent un processus inflammatoire chronique (inflammation au niveau du foie, tissu adipeux, muscle) contribuant au développement des maladies métaboliques tel que le diabète de type 2 (Delzenne, Neyrinck et al. 2011).
Figure I. 12. Illustration schématique de l'endotoxémie métabolique et ses conséquences. Adapté de (Serino, Luche et al. 2009)
5. Nouvelle approche thérapeutique : Les probiotiques
Face à l'augmentation de la prévalence des maladies métaboliques liées à l'obésité, plusieurs travaux de recherche réalisés depuis les dernières années laissent entrevoir des perspectives prometteuses quant aux effets préventifs de la modulation du microbiote intestinal à travers l'alimentation. En effet, de nombreuses études ont démontré que certains constituants alimentaires sont capables de
modifier qualitativement le microbiote intestinal en ciblant spécifiquement certaines bactéries. Un des produits qui peuvent avoir une influence sur le microbiote sont les probiotiques.
5.1. Concept des probiotiques
Le concept des probiotiques est bien loin d’être nouveau. Il est né à partir des observations faites en 1907 par le biologiste russeElie Metchnikoff, lauréat du prix Nobel de médecine et physiologie (Gordon 2008). Il a établi un lien entre la longévité « inhabituelle » de certaines populations rurales en Bulgarie et leur grande consommation de produits laitiers fermentés(Anukam and Reid 2007). Il a pu alors identifier deux souches bactériennes nécessaires à la fermentation : Lactobacillus bulgaricus (bacille bulgare) et Streptococcus thermophilus. La présence de ces souches dans le tube digestif crée un environnement défavorable à l’implantation de pathogènes entériques. Metchnikoff fut ainsi le premier à suggérer que la consommation des bactéries lactiques présentes dans ces laits fermentés pourrait avoir un effet bénéfique sur la santé.
5.2. Définition et propriétés des probiotiques
Plusieurs définitions ont été proposées depuis la théorie de Metchnikoff pour définir le terme probiotique (Salminen, Ouwehand et al. 1999; Schrezenmeir and de Vrese 2001; Sanders 2008). La définition la plus utilisée est celle proposée par un comité d’experts, qui définit les probiotiques comme
étant des microorganismes vivants qui, lorsqu'ils sont ingérés en quantité adéquate, produisent des bienfaits sur la santé de l’hôte (WHO/FAO 2001). Il s’agit le plus souvent de bactéries ou de levures qui peuvent être intégrés dans différents types de produits, y compris les aliments (notamment les produits laitiers fermentés), les substances médicamenteuses et les suppléments alimentaires. Ces microorganismes constituent la flore buccale, intestinale et vaginale.
Plusieurs études ont démontré les multiples effets bénéfiques des probiotiques (Figure 13). En effet, les probiotiques interviennent dans la prévention et le traitement de plusieurs diarrhées, notamment la diarrhée
du voyageur et la diarrhée associée à la prise d'antibiotiques(Beausoleil, Fortier et al. 2007; McFarland 2007). Ils sont aussi impliqués dans la réduction et le traitement de certaines infections gastro-intestinales(Salminen,
Les probiotiques améliorent aussi la digestion des aliments et jouent un rôle dans la réduction des symptômes de l'intolérance au lactose(Nagpal, Yadav et al. 2007). Les probiotiques possèdent aussi une action antimicrobienne grâce à la production des bactériocines(Klaenhammer 1988). Certains probiotiques ont démontré leur capacité à prévenir certaines maladies chroniques telles que la maladie de Crohn, l'obésité et le diabète(Schultz, Timmer et al. 2004; Yadav, Jain et al. 2007). D’autres travaux laissent présager qu’ils pourraient également jouer un rôle important dans la prévention du cancer du côlon (Wollowski, Rechkemmer et al. 2001).