Caractérisation des sous-produits de la désinfection
dans un système municipal d’eau potable
Cas d’étude : Ville de St-Jérôme
MémoireAlain Marcoux
Maîtrise en génie des eaux
Maître ès sciences (M.Sc.)
Québec, Canada
Résumé
Ce mémoire présente les résultats d’une campagne d’échantillonnage des sous-produits de la désinfection (SPD) dans un système municipal d’eau potable. En plus des familles de SPD les plus connues (c.-à-d. les trihalométhanes (THM) et les acides halo-acétiques (AHA)), trois familles de SPD émergents (SPDE) sont également étudiées (les haloacétonitriles (HAN), les halonitrométhanes (HNM) et les halocétones (HK)). L’étude de ces cinq familles de SPD présente un grand intérêt puisque plusieurs de ces composés pourraient être cancérigènes. Lors des échantillonnages, les concentrations en SPD et certains paramètre physico-chimiques ont été mesurés à divers points de l’usine de traitement (UTE) et du réseau de distribution d’eau potable. Les résultats obtenus sont analysés d’un point spatial et d’un point de vue temporel afin d’identifier les facteurs déterminants de la variabilité des cinq familles de SPD étudiées. Les conclusions de cette analyse permettent d’identifier les points les plus critiques du système étudié et d’identifier des pistes de solution pour réduire les concentrations en SPD dans l’eau potable. Les résultats montrent, entre autres, que la majorité des SPD sont formés à l’intérieur de l’UTE et que, par conséquent, les interventions visant à limiter la formation de SPD devraient principalement cibler la chaîne de traitement et le réservoir de l’UTE.
Abstract
This Master’s thesis presents the results of a sampling campaign of disinfection by-products (DBPs) in a municipal drinking water system. In addition to the regulated DBP families (i.e. trihalomethanes (THMs) and haloacetic acids (HAAs)), three families of non-regulated disin-fection by-products (NrDBPs) are also studied (haloacetonitriles (HANs), halonitromethanes (HNMs) and haloketones (HKs)). The study of these five DBP families is of great interest since several of these compounds could be carcinogenic. During the sampling campaigns, DBP concentrations and some physicochemical parameters were measured at various points within the treatment plant (WTP) and the drinking water distribution network. Results obtained are analyzed from a spatial and temporal point of view to identify the main factors influenc-ing the variability of the five DBP families studied. Conclusions of this analysis are used to identify the most critical points in the system and to identify potential solutions to reduce the DBP concentrations in the drinking water network. Results show, among other things, that a considerable proportion of the maximum observed DBP concentrations is generated within the WTP and therefore, interventions to limit the formation of DBPs should focus on the treatment chain and the WTP tank.
Table des matières
Résumé iii
Abstract v
Table des matières vii
Liste des tableaux ix
Liste des figures xi
Liste des abbréviations xiii
Remerciements xix
1 Introduction 1
1.1 Mise en contexte . . . 1
1.2 État des connaissances . . . 2
1.2.1 Chlore . . . 2 1.2.2 Sous-produits de la désinfection. . . 6 1.3 Objectifs de l’étude . . . 11 2 Méthodologie 13 2.1 Cas d’étude . . . 13 2.1.1 Contexte . . . 13
2.1.2 Usine de traitement (UTE) . . . 15
2.1.3 Réseau de distribution (RDE) . . . 17
2.2 Campagnes d’échantillonnage . . . 19
2.2.1 Méthodes d’analyse et d’échantillonnage . . . 21
2.3 Temps de séjour théorique . . . 23
2.4 Analyse statistique . . . 24
3 Résultats et discussion 29 3.1 Eau brute . . . 29
3.2 Carbone organique total (COT) . . . 30
3.3 Température . . . 30
3.4 Temps de séjour (TDS) et concentration en chlore résiduel libre (CCRL) . . 33
3.5 Sous-produits de la désinfection (SPD) . . . 36
3.5.1 Résultats de l’analyse statistique . . . 36
3.5.3 Acides haloacétiques (AHA) . . . 47
3.5.4 Haloacétonitriles (HAN) . . . 53
3.5.5 Halonitrométhane (HNM) . . . 55
3.5.6 Halocétones (HK) . . . 60
3.5.7 Points de suivi optimaux. . . 66
4 Conclusions 69 Bibliographie 73 Annexes 79 A Méthodes d’analyse des SPD . . . 79
B Base de données complète . . . 83
Liste des tableaux
1.1 Concentrations moyennes en SPDE obtenues lors d’autres études en Amérique
du Nord . . . 10
1.2 Évaluation du potentiel cancérigène de certains SPD par l’IARC (1999a,b, 2013,
2014) . . . 10
2.1 Dates des échantillonnages pour l’UTE, le RDE de St-Jérôme et le RDE de
Mirabel . . . 20
2.2 Paramètres analysés pour chaque point durant une campagne d’échantillonnage 22
3.1 Qualité de l’eau brute à l’UTE de St-Jérôme . . . 29
3.2 Comparaison entre le classement des points selon la CCRL et le TDS théorique
calculé par le modèle hydraulique du RDE de St-Jérôme . . . 35
3.3 Coefficients et valeurs de p pour les corrélations de la température de l’eau et
de la CCRL avec les concentrations de chaque famille de SPD . . . 38
3.4 Groupes de points d’échantillonnage significativement différents (p<0,05) pour
chaque famille de SPD . . . 39
3.5 Groupes de campagnes d’échantillonnage significativement différentes (p<0,05)
pour chaque famille de SPD . . . 40
3.6 Comparaison entre les concentrations moyennes en HAN mesurées dans les RDE
de St-Jérôme et de Mirabel et celles obtenues lors d’autres études . . . 54
3.7 Comparaison entre les concentrations moyennes en CPK mesurées dans les RDE
de St-Jérôme et de Mirabel et celles obtenues lors d’autres études . . . 58
3.8 Comparaison entre les concentrations moyennes en HK2 mesurées dans les RDE
de St-Jérôme et de Mirabel et celles obtenues lors d’autres études . . . 62
3.9 Valeur de Rx,moy pour chaque point d’échantillonnage du RDE de St-Jérôme et
Liste des figures
1.1 Représentation schématique du risque microbiologique et du risque lié aux SPD
en fonction du niveau de désinfection (adapté de Sadiq et Rodriguez, 2004) . . 2
1.2 Effet du pH et de la température sur l’équilibre entre l’acide hypochloreux et
l’ion hypochlorite (adapté de Crittenden et al., 2005) . . . 3
1.3 Concentration et temps de contact nécessaires à différentes formes de chlore
pour éliminer 99% des bactéries E. coli (2 à 6°C) (adapté de Sigg et al., 2006) . 4
1.4 Facteurs influençant la dégradation du chlore (Binet, 2010) . . . 5
1.5 Cytotoxicité et génotoxicité de différentes familles de SPD et SPDE (adapté de
Plewa et al., 2008) . . . 9
2.1 Répartition des différents types d’occupation du territoire dans le bassin versant
de la rivière du Nord (adapté de Abrinord, 2013) . . . 14
2.2 Proportions des différents types d’occupation du territoire dans le bassin versant
de la rivière du Nord (Abrinord, 2014) . . . 15
2.3 Schéma de la chaîne de traitement à l’UTE de St-Jérôme . . . 16
2.4 Réseau de distribution d’eau potable de St-Jérôme . . . 17
2.5 Réseau de distribution d’eau potable de St-Jérôme et d’une partie de Mirabel . 18
2.6 Localisation des points d’échantillonnage à l’UTE de St-Jérôme . . . 20
2.7 Localisation des points d’échantillonnage dans le RDE de St-Jérôme . . . 26
2.8 Localisation des points d’échantillonnage dans le RDE de St-Augustin (Mirabel) 27
2.9 Temps de séjour théoriques aux 15 points d’échantillonnage du RDE de St-Jérôme 27
3.1 Paramètres de qualité de l’eau brute pour chaque campagne d’échantillonnage :
(a) température, (b) absorbance UV-254nm après filtration et COD, (c) pH . . 31
3.2 Carbone organique total (COT) dans le RDE de St-Jérôme pour chaque
cam-pagne d’échantillonnage . . . 32
3.3 Température de l’eau brute et température moyenne de l’eau dans les RDE de
St-Jérôme et Mirabel, pour chaque campagne d’échantillonnage . . . 32
3.4 Concentrations en chlore résiduel libre dans les RDE de (a) St-Jérôme et (b)
Mirabel, pour chaque point d’échantillonnage . . . 34
3.5 Résultats schématisés des comparaisons multiples pour les AHA6 dans le RDE
de St-Jérôme . . . 41
3.6 Concentrations en THM4 pour chaque point d’échantillonnage (a) de l’UTE,
(b) du RDE de St-Jérôme et (c) du RDE de Mirabel . . . 43
3.7 Concentrations en THM4 pour chaque campagne d’échantillonnage (a) du point
3.8 Concentrations en AHA6 pour chaque point d’échantillonnage (a) de l’UTE,
(b) du RDE de St-Jérôme et (c) du RDE de Mirabel . . . 48
3.9 Concentrations en AHA6 pour chaque campagne d’échantillonnage (a) du point
ED à la sortie de l’UTE, (b) du RDE de St-Jérôme et (c) du RDE de Mirabel . 51
3.10 Concentrations en HAN3 pour chaque point d’échantillonnage . . . 54
3.11 Concentrations en HAN3 pour chaque campagne d’échantillonnage (a) du point
ED à la sortie de l’UTE, (b) du RDE de St-Jérôme et (c) du RDE de Mirabel . 56
3.12 Concentrations en CPK pour chaque point d’échantillonnage . . . 57
3.13 Concentrations en CPK pour chaque campagne d’échantillonnage (a) du point
ED à la sortie de l’UTE, (b) du RDE de St-Jérôme et (c) du RDE de Mirabel . 59
3.14 Concentrations pour chaque point d’échantillonnage en (a) 11DCPone et (b)
111TCPone . . . 61
3.15 Concentrations en 11DCPone pour chaque campagne d’échantillonnage (a) du point ED à la sortie de l’UTE, (b) du RDE de St-Jérôme et (c) du RDE de
Mirabel . . . 64
3.16 Concentrations en 111TCPone pour chaque campagne d’échantillonnage (a) du point ED à la sortie de l’UTE, (b) du RDE de St-Jérôme et (c) du RDE de
Mirabel . . . 65
3.17 Points d’échantillonnage présentant les concentrations les plus élevées en THM4
(grands cercles verts) et en AHA6 (petits cercles bleus). . . 68
Liste des abbréviations
Rx,i Ratio de la concentration du point d’échantillonnage x lors de la campagne i
par rapport à celle du point présentant la concentration maximale pour cette campagne
Rx,moy Moyenne des ratios (Rx,i) du point d’échantillonnage x
111TCPone 1,1,1-trichloro-2-propanone
11DCPone 1,1-dichloro-2-propanone
ABCA Acide bromochloroacétique
ADBA Acide dibromoacétique
ADCA Acide dichloroacétique
AHA Acides haloacétiques
AHA5 Groupe de cinq acides haloacétiques (AMCA, ADCA, ATCA, AMBA et ADBA)
AHA6 Groupe de six acides haloacétiques (AMCA, ADCA, ATCA, AMBA, ADBA et
ABCA)
AMBA Acide monobromoacétique
AMCA Acide monochloroacétique
ATCA Acide trichloroacétique
BCAN Bromochloroacétonitrile
BDCM Bromodichlorométhane
CCRL Concentration en chlore résiduel libre
CHO Chinese hamster ovary
COD Carbone organique dissous
COT Carbone organique total
CPK Trichloronitrométhane (chloropicrine)
CREPUL Chaire de recherche industrielle CRSNG en gestion et surveillance de la qualité
de l’eau potable - Université Laval
DBAN Dibromoacétonitrile
DCAN Dichloroacétonitrile
EPA Environmental Protection Agency
HAN Haloacétonitriles
HAN3 Groupe de trois haloacétonitriles (DCAN, BCAN et TCAN)
HAN4 Groupe de quatre haloacétonitriles (DCAN, BCAN, TCAN et DBAN)
HK Halocétones
HK2 Groupe de deux halocétones (11DCPone et 111TCPone)
HNM Halonitrométhanes
IARC International Agency for Research on Cancer
LQM Limite de quantification minimale
MON Matière organique naturelle
NH4Cl Chlorure d’ammonium
p Probabilité d’obtenir un résultat égal ou plus extrême si l’hypothèse nulle est
vraie
RDE Réseau de distribution d’eau potable
RQEP Règlement sur la qualité de l’eau potable
SPD Sous-produits de la désinfection
SPDE Sous-produits de la désinfection émergents
SPDE6 Groupe de six sous-produits de la désinfection émergents (DCAN, BCAN,
TCAN, CPK, 11DCPone et 111TCPone)
STEP Station d’épuration des eaux usées
T◦ eau Température de l’eau
TBM Tribromométhane (bromoforme)
TCAN Trichloroacétonitrile
TCM Trichlorométhane (chloroforme)
TDS Temps de séjour de l’eau
THM Trihalométhanes
THM4 Groupe de quatre trihalométhanes (TCM, BDCM, DBCM et TBM)
UTE Usine de traitement d’eau potable
UV-254nm Absorbance UV à 254 nanomètres UV-254nm-f Absorbance UV à 254 nanomètres filtrée
À l’échelle cosmique, l’eau liquide est plus rare que l’or.
Remerciements
Je souhaite d’abord remercier ma directrice de recherche Geneviève Pelletier et mon co-directeur de recherche Manuel J. Rodriguez pour m’avoir fait confiance en acceptant de su-perviser ma maîtrise et en me confiant la responsabilité de démarrer le projet de St-Jérôme. Je tiens également à les remercier pour leur présence et leur soutien constant tout au long de mes deux années d’étude avec eux. Leur aide et leur expertise m’ont permis d’apprendre énor-mément et de produire un travail dont je suis fier. J’aimerais de plus remercier les professeurs Christian Bouchard et Caetano Dorea pour leur soutien et leur intérêt envers mon projet. J’aimerais ensuite remercier tous les membres et partenaires de la Chaire de recherche
indus-trielle CRSNG en gestion et surveillance de la qualité de l’eau potable pour leur soutien moral
et financier à mon projet de recherche. Plus particulièrement, j’aimerais remercier Simon Bri-sebois et ses collègues de la Ville de Saint-Jérôme pour m’avoir permis d’étudier leur système d’eau potable et m’avoir soutenu activement tout au long de mes travaux. De plus, je souhaite remercier le CRSNG, l’Université Laval et encore une fois Manuel J. Rodriguez pour tous les efforts qu’ils ont déployés afin de rendre possible la création de cette Chaire.
Il est également important pour moi de souligner la contribution des nombreuses personnes ayant participé à la préparation des campagnes d’échantillonnage ainsi qu’à la collecte et l’ana-lyse des nombreux échantillons prélevés durant mon projet. Je tiens à remercier spécialement Benoît Labelle et Alain Quintin de la Ville de Saint-Jérôme pour leur aide exceptionnelle avant, pendant et après les échantillonnages, de même que tous les échantillonneurs des villes de Saint-Jérôme et de Mirabel, ainsi que Simon Chartrand et Frédéric Morency pour la co-ordination du projet à Mirabel. De plus, je tiens à remercier Sabrina Simard de l’Université Laval pour son aide durant la préparation des échantillonnages et pour la supervision des ana-lyses au laboratoire. De même, je remercie toute son équipe du laboratoire d’environnement : Mélanie Roy, Shantala Poisson, Marie-Eve Bourque, Gabrielle Santerre, Cynthia Gonthier et Sarah Roy.
De plus, j’aimerais remercier Simon Rochette pour son aide concernant les questions techniques et informatiques, Caroline B.-Doucet et Christelle Legay pour leur aide dans l’analyse des données et la production de graphiques ainsi que Francine Baril pour son aide pour toutes les questions administratives. Finalement, j’aimerais remercier ma famille pour son soutien extraordinaire tout au long de mes études et son intérêt envers tous mes projets, ainsi que ma conjointe Amélie pour son support inconditionnel, sa compréhension et ses encouragements.
1.
Introduction
1.1
Mise en contexte
La qualité de l’eau potable distribuée par les municipalités est primordiale d’une part pour la santé de ceux qui la consomment, et d’autre part pour conserver la confiance des citoyens envers l’eau du robinet. Cette qualité est composée essentiellement de deux éléments : les paramètres esthétiques (goût, odeur, couleur) et les paramètres concernant la santé (microor-ganismes pathogènes, substances toxiques). Afin d’atteindre les standards de qualité fixés par les organismes gouvernementaux, les municipalités effectuent un traitement plus ou moins complexe de l’eau avant de la distribuer aux consommateurs. Très souvent, ce traitement in-clut une désinfection primaire ainsi qu’une désinfection secondaire. La désinfection primaire a pour objectif de réduire sous un seuil acceptable le risque lié aux microorganismes pathogènes présents dans l’eau brute tandis que la désinfection secondaire vise à empêcher la recroissance microbienne dans le réseau de distribution d’eau potable (RDE). Pour répondre à ces besoins, des désinfectants (c.-à-d. des substances ayant un potentiel d’oxydation élevé) sont ajoutés à l’eau durant le traitement. Depuis maintenant plusieurs décennies, le chlore et ses composés sont les désinfectants les plus utilisés dans le monde pour le traitement de l’eau potable. Le chlore est en effet un désinfectant efficace et peu dispendieux.
Le potentiel d’oxydation des désinfectants leur permet de jouer plusieurs rôles dans les usines de traitement d’eau potable (UTE). En effet, en plus d’inactiver les microorganismes patho-gènes, ils aident à l’enlèvement des goûts et odeurs, à l’oxydation du fer et du manganèse, à l’optimisation de la coagulation et de la filtration et à la limitation des algues dans les
dé-canteurs et les filtres (Sadiq et Rodriguez,2004). Toutefois, ils réagissent également avec les
matières organiques et inorganiques présentent dans l’eau et forment ainsi des sous-produits de la désinfection (SPD), lesquels sont potentiellement nocifs pour la santé. Ainsi, tel que
sché-matisé à la figure 1.1, lorsque la désinfection de l’eau est effectuée, le risque microbiologique
est diminué mais le risque lié aux SPD est augmenté. Notons toutefois que le risque micro-biologique est un risque immédiat tandis que le risque lié aux SPD est un risque chronique. En effet, une eau contaminée par des microorganismes pathogènes peut causer des problèmes de santé lorsqu’elle est consommée une seule fois tandis qu’à l’opposé, une eau contenant une concentration importante de SPD (tout en restant dans les ordres de grandeur observés dans l’eau potable) peut causer des problèmes de santé lorsqu’elle est consommé à de nombreuses reprises durant plusieurs années. En raison de cette distinction entre les deux catégories de risques présents dans l’eau, les mesures entreprises pour réduire la présence de SPD dans l’eau ne devraient en aucun cas accroître le risque microbiologique.
Figure 1.1 – Représentation schématique du risque microbiologique et du risque lié aux SPD
en fonction du niveau de désinfection (adapté deSadiq et Rodriguez,2004)
1.2
État des connaissances
1.2.1 Chlore
Le chlore et ses composés sont les désinfectants les plus utilisés en raison de leur faible coût et
de leur potentiel d’oxydation élevé (Sadiq et Rodriguez,2004). Dans un RDE, la concentration
en chlore varie dans le temps et l’espace. Ainsi, l’appellation « chlore résiduel total » est souvent utilisée pour exprimer la concentration de chlore présente dans l’eau à un certain point du RDE et à un certain moment. Le chlore résiduel total peut également être divisé en chlore résiduel libre et chlore résiduel combiné. Le chlore résiduel libre comprend la fraction du chlore n’ayant pas encore réagi avec les matières présentes dans l’eau tandis que le chlore résiduel combiné comprend la fraction ayant réagi avec de l’ammoniac (dont la monochloramine, la dichloramine et la trichloramine).
Au Québec, le Règlement sur la qualité de l’eau potable (RQEP) (Québec, 2015) oblige les
municipalités effectuant une désinfection de l’eau à conserver une concentration en chlore résiduel libre (CCRL) à la sortie de l’UTE de 0,3 mg/L au minimum (ou de 1,0 mg/L de chloramines au minimum si ceux-ci sont utilisés). Bien que le chlore est généralement utilisé pour la désinfection sous trois formes différentes soit le chlore libre, le dioxyde de chlore et les chloramines, seules les deux premières seront abordées ici puisque ce sont les formes qui sont d’intérêt pour la présente étude.
Chlore libre
Lorsque le chlore libre est utilisé, il est souvent injecté dans l’eau sous forme gazeuse (Cl2(g))
et réagit alors rapidement pour former de l’acide chlorhydrique (HCl) et de l’acide hypo-2
chloreux (HOCl) (équation 1.1). L’acide chlorhydrique étant un acide fort, celui-ci est ionisé
complètement en ions hydrogène (H+) et en ions chlorure (Cl−) (équation 1.2). Toutefois,
l’acide hypochloreux étant un acide faible, il n’est que partiellement ionisé en ions hydrogène
et en ions hypochlorite (OCl−) (équation 1.3). Il existe donc une relation d’équilibre entre la
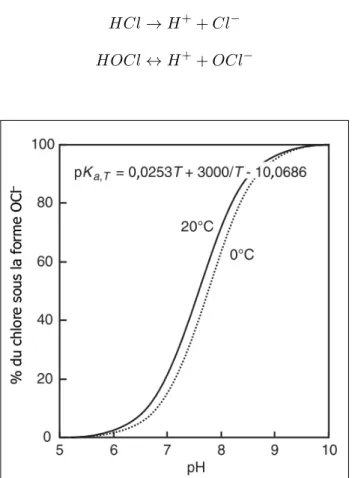
concentration en acide hypochloreux et celle en ions hypochlorite. Cette relation, dépendante principalement du pH et d’une façon moins importante de la température de l’eau, est illustrée
à la figure 1.2. Or, il est connu que le pouvoir désinfectant de l’acide hypochloreux est
beau-coup supérieur à celui de l’ion hypochlorite (figure 1.3) (Crittenden et al., 2005; Sigg et al.,
2006). Ainsi, pour atteindre le même niveau de désinfection, un temps de contact plus long ou
une concentration en chlore libre plus élevée sera nécessaire lorsque le pH est plus élevé. Il en découle qu’il est généralement préféreable que le pH lors de la désinfection soit inférieur à 7,5.
Cl2(g)+ H2O → HCl + HOCl (1.1)
HCl → H++ Cl− (1.2)
HOCl ↔ H++ OCl− (1.3)
Figure 1.2 – Effet du pH et de la température sur l’équilibre entre l’acide hypochloreux et
l’ion hypochlorite (adapté deCrittenden et al.,2005)
Le chlore peut également être ajouté dans l’eau sous forme d’hypochlorite de sodium ou d’un autre sel d’hypochlorite. Dans ce cas, le sel d’hypochlorite est complètement dissocié dans l’eau et la concentration en ions hypochlorite résultante est soumise au même équilibre avec l’acide
Figure 1.3 – Concentration et temps de contact nécessaires à différentes formes de chlore
pour éliminer 99% des bactéries E. coli (2 à 6°C) (adapté deSigg et al.,2006)
hypochloreux (équation1.3). Notons toutefois que durant son entreposage, l’hypochlorite peut
se dégrader et former des ions chlorates dont la concentration dans l’eau est réglementée dans
le RQEP (Québec, 2015). Ainsi, si les conditions d’entreposage sont inadéquates
(concen-tration, pH, température, lumière, etc.), cette dégradation peut être relativement rapide et nuire significativement à l’efficacité de la désinfection en plus d’introduire des ions chlorates
dans l’eau, lesquels présentent un risque pour la santé (Crittenden et al.,2005;Santé Canada,
2008a).
Dégradation du chlore dans un RDE
Lorsqu’il est ajouté dans l’eau, le chlore libre réagit peu à peu avec les matières organiques et inorganiques présentes, causant ainsi une diminution graduelle de la CCRL tout au long du RDE. Cette dégradation est un enjeu important puisqu’il est recommandé de conserver une CCRL détectable au minimum en tout temps et en tout point d’un RDE afin d’empêcher une
recontamination de l’eau en réseau (Santé Canada,2009a).
La dégradation du chlore dans un RDE est un phénomène complexe qui dépend non seulement des paramètres de l’eau mais aussi des caractéristiques des conduites. Ainsi, tel que schématisé
à la figure 1.4, la dégradation du chlore est souvent considérée comme la somme de deux
phénomènes : la dégradation par les parois des conduites (« effet paroi ») et la dégradation
dans le volume d’eau lui-même (« effet eau ») (Binet,2010;Brown et al.,2011). La dégradation
au niveau des parois est causée par les matériaux des conduites, les tubercules de corrosion et les biofilms tandis que la dégradation dans l’eau est causée par la matière organique naturelle (MON), les écailles de corrosion, le détachement de morceaux de biofilm et éventuellement
par les recontaminations au fil du réseau (Binet,2010;Brown et al.,2011).
Figure 1.4 – Facteurs influençant la dégradation du chlore (Binet,2010)
Plusieurs modèles ont été suggérés pour tenter de mieux décrire la dégradation du chlore : premier ordre, deuxième ordre, énième ordre, dégradation du chlore liée à celle d’un autre
réactif, etc. (Vieira et al.,2004;Brown et al.,2011). Certains modèles utilisent également une
succession de différentes équations ou de différentes constantes cinétiques. En effet, il est connu que si la réaction du chlore avec les matières organiques est lente et peut s’étaler sur plusieurs heures ou plusieurs jours, la réaction avec les matières inorganiques est beaucoup plus rapide
(souvent seulement quelques secondes) (Brown et al., 2011). Toutefois, dans un RDE, il est
raisonnable d’assumer que toutes les réactions rapides se sont déjà produites puisque l’eau a séjournée plusieurs heures dans l’UTE. Ainsi, plusieurs auteurs s’entendent pour dire que la dégradation du chlore dans un RDE peut être décrite de manière satisfaisante par une simple relation de premier ordre dont les paramètres sont une constante de dégradation (déterminée par les caractéristiques de l’eau et des conduites) et le temps de séjour de l’eau (TDS) dans les
conduites (Powell et al.,2000;Brown et al.,2010,2011). L’équation1.4présente cette relation
où C est la concentration en chlore au temps t, C0 est la concentration en chlore initiale et k
est la constante de dégradation.
C = C0.e−k.t (1.4)
Dioxyde de chlore
La désinfection à l’aide de dioxyde de chlore présente deux principaux avantages. D’une part,
son efficacité ne dépend pas du pH (Sigg et al., 2006), et d’autre part, le dioxyde de chlore
forme généralement moins de THM et d’AHA que le chlore libre (Sadiq et Rodriguez,2004;
Crittenden et al., 2005; Sigg et al., 2006). Toutefois, le dioxyde de chlore doit être utilisé prudemment puisqu’il est responsable de la formation de deux autres SPD (les chlorites et
dioxyde de chlore doit la plupart du temps être généré sur place, ce qui complique l’opération
de l’UTE (Crittenden et al.,2005;Sigg et al.,2006).
1.2.2 Sous-produits de la désinfection
Tel que mentionné précédemment, le chlore injecté dans l’eau réagit avec les substances orga-niques et inorgaorga-niques présentes, ce qui entraîne la formation de divers SPD. Bien que plusieurs centaines de ces SPD aient été répertoriés, le comportement de la majorité de ceux-ci demeure
mal connu (Sadiq et Rodriguez,2004;Richardson et al., 2007). En effet, si le comportement
des trihalométhanes (THM), des acides haloacétiques (AHA), des chlorites et des chlorates est assez bien connu, il n’en est pas de même pour de nombreux autres SPD. Ceux-ci dont la présence, la formation et la toxicité dans l’eau potable sont mal connues sont généralement appelés sous-produits de la désinfection émergents (SPDE).
L’étude de la formation des SPD est complexe puisque suite à la désinfection de l’eau, un grand nombre de réactions différentes et interdépendantes se produisent simultanément et à des vitesses différentes. D’une manière générale, la formation des SPD est influencée par le type et la dose de désinfectant appliqué, par la nature et la concentration des matières organiques et inorganiques présentes dans l’eau et par les conditions d’opération (température, pH, et
temps de contact entre l’eau et le désinfectant) (Chen et Weisel, 1998; Sadiq et Rodriguez,
2004;Crittenden et al.,2005).
Bien que les différents SPD puissent se comporter de manières différentes dans l’eau potable, il est connu que la concentration totale des SPD est généralement plus élevée lorsque la
tem-pérature et la concentration en MON de l’eau sont plus élevées (Brown et al., 2011). Ainsi,
pour un même RDE situé dans le sud de la province de Québec, les concentrations en THM et AHA mesurées durant l’été peuvent être plus de quatre fois supérieures à celles observées
durant l’hiver (Rodriguez et al., 2007). Rodriguez et al. (2007) expliquent que cela est dû à
l’importante différence de température de l’eau entre les saisons ainsi qu’à la variation saison-nière de la qualité de l’eau brute. D’autre part, le TDS a également un effet marqué sur la formation des SPD. En effet, la concentration en THM tend à augmenter rapidement avec le
TDS puis à se stabiliser (Rodriguez et al.,2007;Brown et al.,2010). Ainsi, dans un RDE, les
points les plus susceptibles d’avoir une concentration en THM élevée sont ceux où le TDS est le plus élevé. Toutefois, la même affirmation n’est pas nécessairement vraie pour les AHA. En effet, plusieurs études ont montré que lorsque le TDS est suffisament élevé, la concentration
en AHA dans l’eau diminue (Speight et Singer,2005;Baribeau et al.,2006;Rodriguez et al.,
2007), faisant en sorte que les points les plus vulnérables pour ces composés ne sont pas
né-cessairement ceux ayant le TDS le plus élevé. L’hypothèse la plus répandue pour expliquer cette diminution est celle d’une biodégration des AHA par les microorganismes se trouvant
dans le biofilm à l’intérieur des conduites (Baribeau et al., 2006; Rodriguez et al., 2007). De
plus, Speight et Singer (2005) expliquent que la dégradation des AHA est dépendante de la température, de facteurs hydrodynamiques, du chlore résiduel et du TDS. Finalement, le pH a également une influence sur la formation des SPD. En effet, un pH élevé favorise la formation
des THM et nuit à la formation des AHA (Crittenden et al.,2005;Brown et al.,2011).
Trihalométhanes (THM) et acides haloacétiques (AHA)
Outre les chlorites et les chlorates, les THM et AHA sont les deux familles de SPD les mieux connues. Parmi les THM, les espèces les plus communes dans l’eau potable sont le chlo-roforme (trichlorométhane, TCM), le bromodichlorométhane (BDCM), le dibromochloromé-thane (DBCM) et le bromoforme (tribromomédibromochloromé-thane, TBM). Plusieurs études montrent que ces quatre trihalométhanes (THM4) pourraient être cancérigènes et avoir des effets
poten-tiellement nocifs sur le foie, les reins et la reproduction (Sadiq et Rodriguez, 2004; Santé
Canada, 2009b; WHO, 2011). Toutefois, ces études ont majoritairement été réalisées sur de petits animaux de laboratoire tels que des rats et des souris et ne permettent pas de conclure
avec certitude qu’il existe un lien entre les SPD et la santé chez l’humain (Santé Canada,
2009b;WHO,2011). Considérant cela, l’International Agency for Research on Cancer (IARC,
1999a,b) classe certains THM4 comme étant possiblement cancérigènes. Pour cette raison, plu-sieurs gouvernements à travers le monde choisissent de réglementer la présence de THM4 dans
l’eau potable. Au Québec, le gouvernement provincial (Québec, 2015) fixe la concentration
moyenne annuelle maximale en THM4 à 80 µg/L tandis Santé Canada (2014) recommande
une concentration moyenne maximale en THM4 de 100 µg/L. D’autre part, l’Organisation
mondiale de la santé (WHO, 2011) recommande une concentration maximale de 300 µg/L
pour le TCM, 60 µg/L pour le BDCM, 100 µg/L pour le DBCM et 100 µg/L pour le TBM. Du côté des AHA, les espèces les plus communes dans l’eau potable sont l’acide monochloroa-cétique (AMCA), l’acide dichloroamonochloroa-cétique (ADCA), l’acide trichloroamonochloroa-cétique (ATCA), l’acide monobromoacétique (AMBA), l’acide dibromoacétique (ADBA) et l’acide bromochloroacé-tique (ABCA). L’appellation AHA6 désigne ce groupe de six composés tandis que l’appella-tion AHA5, utilisée dans plusieurs normes, exclut l’ABCA. Plusieurs études (majoritairement réalisées sur des petits animaux) montrent que certains de ces AHA pourraient être
cancé-rigènes et avoir certains autres effets négatifs sur la santé (Sadiq et Rodriguez,2004;WHO,
2011; Santé Canada, 2008b). Pour cette raison, le gouvernement du Québec (2015) fixe la
concentration moyenne annuelle maximale en AHA5 à 60 µg/L et Santé Canada (2014)
re-commande une concentration moyenne maximale en AHA5 de 80 µg/L. De plus, la WHO
(2011) recommande une concentration maximale de 20 µg/L pour l’AMCA, 50 µg/L pour
Sous-produits de la désinfection émergents (SPDE)
L’appellation SPDE désigne tous les SPD pour lesquels les connaissances sont insuffisantes
et regroupe plusieurs centaines de composés. Richardson et al. (2007) identifient toutefois
47 SPDE dont l’étude est à prioriser en raison de leur présence régulière dans l’eau potable et/ou de leurs effets potentiels sur la santé. Lors de l’élaboration de sa méthode d’analyse des SPDE, la Chaire de recherche industrielle CRSNG en gestion et surveillance de la qualité de
l’eau potable de l’Université Laval (CREPUL) a sélectionné deux familles de composés parmi
ces SPDE prioritaires en raison de leur toxicité et de leur présence dans l’eau (fréquence et concentration) ainsi qu’une troisième famille pouvant être analysée à l’aide de la même
mé-thode d’analyse que les deux autres (Mercier Shanks,2012). Ainsi, les haloacétonitriles (HAN),
les halonitrométhanes (HNM) et les halocétones (HK) sont les trois familles de composés ayant
été choisies, les HAN et HNM faisant partie des SPDE prioritaires identifiés parRichardson
et al.(2007). Parmi les HAN, les trois composés retenus sont le dichloroacétonitrile (DCAN), le bromochloroacétonitrile (BCAN) et le trichloroacétonitrile (TCAN). Dans la famille des HNM, uniquement le trichloronitrométhane (chloropicrine, CPK) a été choisi. Finalement, parmi les HK, les deux composés retenus sont la 1,1-dichloro-2-propanone (11DCPone) et la 1,1,1-trichloro-2-propanone (111TCPone). Ainsi, au total six composés (SPDE6) ont été rete-nus par la CREPUL pour les analyses, dont trois HAN (HAN3), un HNM (CPK) et deux HK (HK2).
En raison du manque de connaissances scientifiques concernant les SPDE6, il existe très peu
de normes ou de recommandations pour ces composés. La WHO (2011) a tout de même
émis une recommandation provisoire de 20 µg/L pour le DCAN. Toutefois, certains auteurs suggèrent que plusieurs SPDE ont un potentiel de toxicité supérieur à celui des THM et des
AHA (Richardson et al., 2007; Plewa et al., 2008). En effet, les essais effectués par Plewa
et al. (2008) sur des cellules CHO (Chinese hamster ovary), montrent que la cytotoxicité (capacité d’altérer les cellules) et la génotoxicité (capacité d’altérer le génome des cellules) de plusieurs SPDE peuvent être jusqu’à cent fois plus élevées que celles des THM et AHA. Cela
est présenté à la figure1.5 qui montre la toxicité d’un groupe de six halométhanes (incluant
les THM4), d’un groupe de douze AHA (incluant les AHA6), du groupe AHA5, de neuf HNM (incluant la CPK) et de sept HAN (incluant les HAN3). Notons toutefois que les toxicités
présentées à la figure1.5 doivent être considérés avec prudence puisque les concentrations en
SPDE observées dans les systèmes d’eau potable sont généralement beaucoup plus petites que celles en THM et AHA. Toutefois, il apparaît qu’à concentrations égales, les HNM et les HAN ont une cytotoxicité et une génotoxicité plus élevées. D’autre part, les résultats présentés par
Plewa et al.(2008) montrent également que les SPD à base de carbone ont généralement une cytotoxicité et une génotoxicité de beaucoup inférieures à celles des SPD contenant de l’azote. Cela permet de croire que les HK, tout comme les THM et les AHA, sont moins toxiques que les HNM et les HAN.
Figure 1.5 – Cytotoxicité et génotoxicité de différentes familles de SPD et SPDE (adapté de
Plewa et al.,2008)
Les rares études ayant porté sur le comportement des SPDE présentent plusieurs résultats non significatifs ou contradictoires d’une étude à l’autre. En effet, dans une première étude,
Santé Canada(1996) observe une augmentation des concentrations en DCAN, CPK et 111TC-Pone dans tous les RDE étudiés lorsque la température augmente et seulement dans certains RDE lorsque le TDS augmente. La 11DCPone était également étudiée mais aucun
comporte-ment significatif n’a été observé. Dans une deuxième étude, Chen et Weisel (1998) observent
une augmentation des concentrations en HAN3 et CPK lorsque la température augmente, mais n’observent aucun comportement significatif lorsque le TDS varie. Finalement, dans une
troisième étude plus récente, Mercier Shanks et al. (2013) observent une augmentation des
concentrations en TCAN, DCAN, CPK et 111TCPone et une diminution de la concentration en 11DCPone lorsque la température augmente. De plus, ils observent une augmentation des concentrations de l’ensemble des SPDE6 lorsque le TDS augmente sauf pour le 11DCPone dont la concentration augmente d’abord légèrement puis diminue en fonction du TDS. D’autre études disponibles dans la littérature ont plutôt tenté de dresser un portrait régional des SPDE en déterminant les concentrations moyennes observées dans un ensemble de RDE.
C’est le cas notament des études deWilliams et al. (1997), de la CREPUL(2010) et de
Guil-herme (2014). Quelques résultats de ces études sont présentés au tableau 1.1, de même que
certains résultats de l’étude de Weinberg et al. (2002), malgré que ces derniers ne concernent
qu’un seul RDE. Les résultats de Williams et al. (1997) proviennent de trente-cinq RDE
ca-nadiens échantillonnés à l’été 1993 sur trois points d’échantillonnage pour chaque réseau. Les
résultats de Weinberg et al. (2002) proviennent d’un seul RDE des États-Unis échantillonné
au mois d’août 2001 à un seul point d’échantillonnage. Les résultats de la CREPUL (2010)
proviennent de 3 RDE québécois échantillonnés au mois d’août 2010 sur six points
d’échan-tillonnage pour chaque réseau. Finalement, les résultats de Guilherme (2014) proviennent de
treize petits RDE québécois (population desservie inférieure à 10 000 habitants) et huit petits RDE terre-neuviens échantillonnés au mois d’août 2011 sur trois points d’échantillonnage pour
que des systèmes municipaux employant le chlore comme désinfectant primaire et secondaire. Ainsi, les données présentées permettent de déterminer l’ordre de grandeur des concentrations en SPDE généralement mesurées dans une eau potable chlorée en Amérique du Nord. No-tons toutefois que pour ces études, les concentrations en HAN sont données pour les quatre principales espèces de cette famille (HAN4 : DCAN, BCAN, TCAN et dibromoacétonitrile (DBAN)) et non pas pour les HAN3 (comme c’est le cas dans le présent travail), exception
faite deWilliams et al.(1997) qui ne présentent des résultats que pour le DCAN.
Tableau 1.1 – Concentrations moyennes en SPDE obtenues lors d’autres études en Amérique du Nord
Lieu Période HAN4 CPK HK2
(nbr de RDE) (µg/L) (µg/L) (µg/L)
Guilherme (2014) - QC Québec (13) août 2011 2,63 0,36 3,98
CREPUL (2010) Québec (3) août 2010 3,45 < 0,01 3,25
Guilherme (2014) - NL Terre-Neuve (8) août 2011 3,65 0,42 9,64
Williams et al.(1997) Canada (35) été 1993 (DCAN = 2,9) 0,3 3,3
Weinberg et al. (2002) États-Unis (1) août 2001 9,4 < 0,1 7
Potentiel cancérigène
L’IARC classe certains composés chimiques selon leur potentiel cancérigène pour l’humain. La classification est divisée en cinq groupes. Le groupe 1 regroupe les composés cancérigènes, le groupe 2A les composés probablement cancérigènes, le groupe 2B les composés possiblement cancérigènes, le groupe 3 les composés dont le potentiel n’a pas pu être établi et le groupe 4 les
composés probablement non-cancérigènes (IARC, 2006). Un classement dans le groupe 3 ne
signifie pas qu’un composé n’est pas cancérigène. Généralement, cela signifie que davantage de
recherches sont nécessaires afin d’établir le potentiel cancérigène du composé (IARC,2006). Le
tableau1.2présente le classement attribué à certains des SPD étudiés. Ce tableau montre bien
que plusieurs SPD sont possiblement cancérigènes, mais également que le potentiel cancérigène de plusieurs d’entre eux demeure incertain.
1.3
Objectifs de l’étude
L’étude présentée ici a comme principal objectif d’évaluer les concentrations de plusieurs SPD dans un système municipal de production et de distribution d’eau potable et de décrire leur variation d’un point de vue spatial et d’un point de vue temporel. D’autre part, un objectif secondaire du projet est de décrire l’impact d’une modification du type de désinfection s’étant produite durant la période étudiée. De façon plus large, ce projet s’inscrit dans la 10
Tableau 1.2 – Évaluation du potentiel cancérigène de certains SPD par l’IARC (1999a,b, 2013,2014) SPD Groupe THM TCM 2B BDCM 2B DBCM 3 TBM 3 AHA ADCA 2B ATCA 2B ADBA 2B ABCA 2B HAN DCAN 3 TCAN 3 BCAN 3
programmation de la CREPUL et vise à dresser un portrait global de la qualité de l’eau dans le systeme étudié et à constituer une importante base de données permettant d’améliorer les connaissances sur la qualité de l’eau potable distribuée dans les villes et d’orienter les travaux futurs de la Chaire.
D’autre part, les résultats présentés dans ce travail pourront être utilisés par les gestionnaires du système étudié pour déterminer les emplacements et les périodes de l’année ayant une plus grande vulnérabilité face aux SPD, pour choisir les points de suivi des THM et des AHA dans le RDE et pour optimiser la stratégie de désinfection employée à l’UTE. Également, les résultats permettront d’enrichir les connaissances actuelles sur le comportement des THM, des AHA et des SPDE dans un système municipal d’eau potable. La contribution au niveau des SPDE est particulièrement importante puisque les connaissances actuelles à leur sujet sont plus limitées et puisque l’ampleur de l’étude permet d’observer la variation spatio-temporelle des SPDE de manière plus détaillée que les études précédentes.
2.
Méthodologie
2.1
Cas d’étude
2.1.1 Contexte
Le cas retenu pour l’étude est celui de la Ville de St-Jérôme, une municipalité située à environ 40 km au nord-ouest de Montréal dans la région des Laurentides. Plus particulièrement, l’UTE de même que le principal RDE de la Ville sont étudiés. Les installations tirent leur eau brute de la rivière du Nord et permettent d’alimenter en eau potable la majorité du territoire de la Ville de St-Jérôme (environ 62 000 personnes) de même que quatre quartiers de la Ville de Mirabel (environ 9000 personnes). La Ville de St-Jérôme connaît toutefois un développement rapide et il est attendu que la demande moyenne annuelle augmentera de plus de 50% d’ici
2048, passant d’environ 45 000 m3/jour (en 2010) à plus de 70 000 m3/jour (Groupe Tanguay,
2010). La Ville prévoit en effet la création durant cette période de plus de 20 000 nouveaux
logements ainsi que de quatre nouvelles zones industrielles (Groupe Tanguay,2010).
Le bassin versant de la rivière du Nord couvre près de 2300 km2et son territoire est recouvert
par plusieurs types d’occupation du sol. La répartition sur le territoire du bassin versant de
ces différents types d’occupation est présentée à la figure 2.1 et les proportions des types
d’occupation sont présentées à la figure 2.2. Les figures 2.1 et 2.2 montrent que le bassin
versant est constitué en grande partie de zones forestières, mais aussi de zones agricoles situées principalement en aval de St-Jérôme, de zones urbaines et industrielles et de plusieurs zones récréotouristiques, résidentielles et de villégiature. D’autre part, plusieurs municipalités sont situées sur le bassin versant en amont de St-Jérôme, les plus importantes étant St-Sauveur (environ 10 200 habitants), Ste-Agathe-des-Monts (environ 10 400 habitants) et Ste-Adèle
(environ 12 600 habitants) (Institut de la statistique du Québec, 2013). On retrouve ainsi
onze stations d’épuration des eaux usées (STEP) qui rejettent leurs eaux dans la rivière du
Nord ou l’un de ses tributaires en amont de la prise d’eau de St-Jérôme (Abrinord,2014). Ces
STEP (2 systèmes à boues activées et 9 systèmes à étangs aérés) ont été conçues pour desservir entre 160 et 13 500 personnes chacune pour un débit de conception total équivalent à plus de
50 000 personnes (MAMROT,2013). Une de ces STEP recueille également des eaux d’origine
industrielle provenant d’une fonderie de fer (Abrinord,2014). D’autre part, lorsque la capacité
des STEP ou des réseaux d’égouts est dépassée, des rejets d’eaux partiellement ou non traitées ont lieu. Or, cinq des neuf STEP situées en amont de St-Jérôme reçoivent un débit moyen
annuel supérieur à leur débit de conception (Abrinord,2014). À titre d’exemple, plus de 420
ceux-Figure 2.1 – Répartition des différents types d’occupation du territoire dans le bassin versant
de la rivière du Nord (adapté deAbrinord,2013)
ci s’étant produits en temps de pluie ou de fonte des neiges (MAMOT, 2014). Finalement, le climat continental subhumide de la région est caractérisé par des écarts de température importants entre les saisons, ce qui cause des variations importantes de la température de
l’eau brute (environ 30◦C de différence entre la température moyenne de janvier et celle de
juillet) (Abrinord,2014;Environnement Canada,2015).
Figure 2.2 – Proportions des différents types d’occupation du territoire dans le bassin versant
de la rivière du Nord (Abrinord,2014)
2.1.2 Usine de traitement (UTE)
La chaîne de traitement de l’UTE est présentée à la figure 2.3et consiste en une décantation,
une filtration, une désinfection aux rayons UV et plusieurs points de chloration. La décantation se fait sur deux chaînes de traitement en parallèle qui reçoivent chacune 50% du débit entrant à l’UTE. La première chaîne consiste en une décantation « statique » accélérée par l’ajout d’alun et d’un polymère tandis que la deuxième consiste en une décantation « dynamique »
réalisée à l’aide de la technologie Actiflo® qui accélère la décantation par l’ajout d’alun, d’un
polymère et d’un micro-sable. Une filtration est ensuite effectuée sur 12 filtres en parallèle (6 en aval de la décantation statique et 6 en aval de la décantation dynamique) composés de sable et d’anthracite. Une désinfection aux rayons UV complète la chaîne de traitement, puis est suivie
d’un réservoir de 38 950 m3 . Tel que montré sur la figure 2.3, cinq injections de chlore sont
également effectuées tout au long du traitement. Le point 1, situé en amont de la décantation statique, est utilisé pour l’ajout de 0,40 mg/L de chlore gazeux. Les points 2 et 3, situés en amont des filtres, sont utilisés pour l’ajout de 1,00 à 3,00 mg/L de chlore gazeux, dans le but d’obtenir une CCRL d’environ 0,40 mg/L à l’entrée des filtres. Finalement, le point 4, situé en amont de la désinfection UV, sert à l’ajout de 0,80 à 2,20 mg/L de chlore gazeux et le point
Figure 2.3 – Schéma de la chaîne de traitement à l’UTE de St-Jérôme
5, situé à l’amont du réservoir, sert à l’ajout de 0,25 à 0,70 mg/L de dioxyde de chlore. Les doses appliquées à ces deux derniers points sont ajustées afin d’obtenir une CCRL d’environ 0,90 mg/L et une concentration maximale en dioxyde de chlore de 0,05 mg/L à l’entrée du RDE. La limite maximale fixée pour le dioxyde de chlore a comme objectif de limiter les goûts et odeurs dans l’eau distribuée.
Les dates choisies pour la période d’échantillonnage de la présente étude concordent avec une transition vers une nouvelle méthode de chloration à l’UTE. En effet, le chlore gazeux est progressivement remplacé par de l’hypochlorite de sodium durant le mois de septembre (lors
des 15e, 16e, 17e et 18e semaines d’échantillonnage). De plus, l’injection de dioxyde de chlore
est arrêtée à partir de la deuxième semaine d’octobre (21e semaine d’échantillonnage). Pour
compenser l’absence du dioxyde de chlore, les dosages aux points 2, 3 et 4 (figure 2.3) sont
ajustés afin d’obtenir des CCRL de 0,55 mg/L à l’entrée des filtres et de 1,00 mg/L à l’entrée du RDE. Cette situation est temporaire et ne vise qu’à permettre l’installation d’un nouveau
générateur de dioxyde de chlore. Puisque, tel qu’expliqué à la section 1.2.1, le dioxyde de
chlore forme généralement peu de THM et d’AHA, il est attendu que ce changement cause une augmentation des SPD mesurés dans le réservoir de l’UTE et dans le RDE. Pour cette raison,
lors de la présentation des résultats de SPD à la section3.5, la comparaison des concentrations
observées aux différents points d’échantillonnage sera faite en excluant les résultats des trois dernières campagnes. Cette modification permettra d’éviter de présenter une variabilité des concentrations artificiellement haussée en raison de l’arrêt du dioxyde de chlore. Toutefois, l’impact de cet arrêt pourra être observé lors de la comparaison des concentrations mesurées lors des différentes campagnes d’échantillonnage.
Finalement, la dernière étape de l’UTE est un réservoir de 38 950 m3. Celui-ci permet d’assurer
un temps de contact entre le chlore et l’eau suffisamment élevé pour assurer une désinfection adéquate. De plus, il joue le rôle de réserves d’équilibre, d’incendie et d’urgence pour le RDE. Le réservoir est divisé en trois sections principales présentant toutes de nombreuses chicanes. L’objectif de cette conception est de créer un écoulement se rapprochant le plus possible d’un écoulement de type piston et d’ainsi limiter les zones de stagnation ou de court-circuitage dans 16
le réservoir.
2.1.3 Réseau de distribution (RDE)
La figure 2.4 présente le détail du RDE dans la Ville de St-Jérôme. Ce plan montre bien
l’ossature principale du réseau (en noir sur la figure 2.4) qui est constituée de 34 km de
conduites de 400 à 600 mm et qui a pour objectif d’acheminer l’eau le plus rapidement possible
aux différents quartiers. Le reste du réseau (en gris sur la figure2.4) est constitué de près de
300 km de conduites de 50 à 350 mm qui acheminent l’eau à l’intérieur des différents quartiers. La majorité du réseau est alimenté de façon gravitaire à partir de l’usine, mais quatre postes de pompage sont tout de même nécessaires afin de fournir une pression acceptable aux quartiers les plus au nord et les plus à l’ouest.
Figure 2.4 – Réseau de distribution d’eau potable de St-Jérôme
La figure 2.5 présente une vue globale de toute l’étendue du RDE alimentant St-Jérôme et
une partie de Mirabel. Tel que montré sur cette figure, quatre quartiers de la Ville de Mirabel sont alimentés par le RDE via six points d’alimentation. Le quartier St-Augustin (point #3
sur la figure2.5) a été retenu pour la partie de l’étude sur le territoire de la Ville de Mirabel.
Ce quartier, en raison de son éloignement du réseau principal, est vraisemblablement celui où les TDS sont les plus élevés et la qualité de l’eau la plus vulnérable. Il est alimenté à partir de
Figure 2.5 – Réseau de distribution d’eau potable de St-Jérôme et d’une partie de Mirabel
la conduite de 450 mm du boulevard du Grand-Héron à St-Jérôme via une conduite de plus de 15 km. Cette conduite a un diamètre de 450 mm sur 9,8 km entre St-Jérôme et l’aéroport international de Mirabel, puis un diamètre de 600 mm sur 5,9 km entre l’aéroport et le quartier
St-Augustin. Un réservoir de 4689 m3sans point de chloration est situé à l’entrée du quartier
St-Augustin en parallèle de la conduite (réservoir « offline »). La demande moyenne annuelle
de Mirabel en eau provenant du RDE de St-Jérôme est de 6379 m3/jour, dont 693 m3/jour
pour la zone aéroportuaire et 2818 m3/jour pour le quartier St-Augustin.
Le cas d’étude présente un grand intérêt scientifique en raison de sa grande étendue et du grand réservoir situé à la sortie de l’UTE. En effet, cette configuration est propice à la présence de longs TDS et permet donc d’étudier les concentrations en SPD pour des points présentant 18
une grande variété de TDS. De plus, le type de traitement utilisé à l’UTE de même que le changement du type de chloration durant la période étudiée présentent également un grand intérêt. En effet, la chaîne de traitement utilisée à l’UTE permet de comparer deux systèmes de décantation différents, d’étudier l’impact du chlore injecté à différentes étapes du traitement et d’observer l’impact d’un arrêt de l’utilisation du dioxyde de chlore.
2.2
Campagnes d’échantillonnage
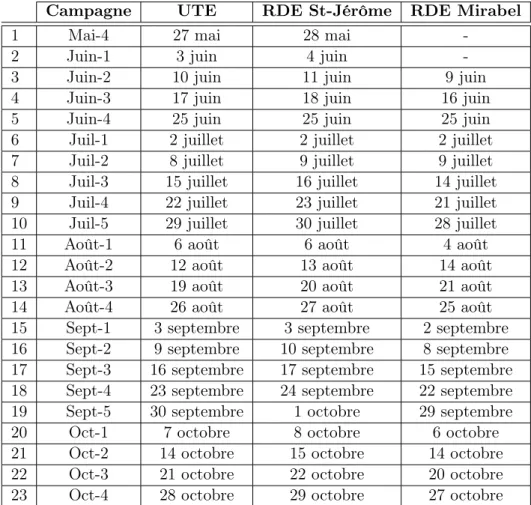
La période d’échantillonnage s’étend de la fin mai à la fin octobre 2014. Les échantillons sont prélevés à 29 points d’échantillonnage une fois par semaine durant 23 semaines. Neuf points d’échantillonnage sont situés à l’UTE tout au long de la chaîne de traitement et du réservoir, quinze sont situés sur le territoire de St-Jérôme et cinq sont situés dans le quartier St-Augustin à Mirabel. Les mesures in situ et le prélèvement d’échantillons ont été réalisés par le personnel des villes de St-Jérôme et de Mirabel. Les échantillons ont été expédiés par la suite à l’Université Laval pour être analysés. Bien que la situation idéale aurait été d’échantillonner la « même eau » à chaque point d’échantillonnage, certains problèmes de logistique nous ont contraint à effectuer les échantillonnages lors de journées différentes pour l’UTE, le RDE de St-Jérôme et le RDE de Mirabel. Les dates d’échantillonnage pour les trois secteurs sont
présentées dans le tableau2.1. Notons toutefois que la présence de TDS relativement élevés et
l’absence de connaissances précises sur ceux-ci en début d’étude auraient de toute façon rendu très difficile l’échantillonnage de la « même eau » à tous les points. L’analyse des résultats a donc été faite selon l’hypothèse que les données récoltées lors des campagnes d’échantillonnage sont représentatives de la qualité moyenne de l’eau aux différents points d’échantillonnage du système.
La figure 2.6 montre l’emplacement des points d’échantillonnage à l’UTE par rapport aux
différentes étapes du traitement. Les neuf points ont été choisis afin de suivre la qualité de l’eau à toutes les étapes du traitement et de mesurer l’impact de chaque point de chloration. La
figure 2.7montre la localisation des points d’échantillonnage dans le RDE de St-Jérôme. Les
points choisis sont les quinze points déjà utilisés par la Ville de St-Jérôme pour le suivi de la qualité de l’eau exigé par le RQEP. Ces points couvrent bien l’ensemble du territoire desservi par le RDE avec des points près des conduites maîtresses et d’autres plus éloignés. Sept de ces points sont considérés en milieu de réseau et huit sont considérés en extrémité de réseau.
La figure2.8montre la localisation des points d’échantillonnage à Mirabel. Tel qu’indiqué sur
cette figure, un point est situé à l’entrée du réservoir, un à la sortie du réservoir, un en milieu de réseau et deux en extrémité de réseau. Ces points permettent de mesurer l’effet du réservoir positionné en parallèle de la conduite sur la qualité de l’eau et d’avoir une idée générale de celle-ci à l’intérieur du quartier.
Tableau 2.1 – Dates des échantillonnages pour l’UTE, le RDE de St-Jérôme et le RDE de Mirabel
Campagne UTE RDE St-Jérôme RDE Mirabel
1 Mai-4 27 mai 28 mai
-2 Juin-1 3 juin 4 juin
-3 Juin-2 10 juin 11 juin 9 juin
4 Juin-3 17 juin 18 juin 16 juin
5 Juin-4 25 juin 25 juin 25 juin
6 Juil-1 2 juillet 2 juillet 2 juillet
7 Juil-2 8 juillet 9 juillet 9 juillet
8 Juil-3 15 juillet 16 juillet 14 juillet
9 Juil-4 22 juillet 23 juillet 21 juillet
10 Juil-5 29 juillet 30 juillet 28 juillet
11 Août-1 6 août 6 août 4 août
12 Août-2 12 août 13 août 14 août
13 Août-3 19 août 20 août 21 août
14 Août-4 26 août 27 août 25 août
15 Sept-1 3 septembre 3 septembre 2 septembre
16 Sept-2 9 septembre 10 septembre 8 septembre
17 Sept-3 16 septembre 17 septembre 15 septembre
18 Sept-4 23 septembre 24 septembre 22 septembre
19 Sept-5 30 septembre 1 octobre 29 septembre
20 Oct-1 7 octobre 8 octobre 6 octobre
21 Oct-2 14 octobre 15 octobre 14 octobre
22 Oct-3 21 octobre 22 octobre 20 octobre
23 Oct-4 28 octobre 29 octobre 27 octobre
Figure 2.6 – Localisation des points d’échantillonnage à l’UTE de St-Jérôme
2.2.1 Méthodes d’analyse et d’échantillonnage
Les paramètres analysés durant les campagnes d’échantillonnage sont : la température de l’eau
(T◦ eau), la CCRL, la concentration en chlore total, la conductivité, l’absorbance UV à 254
nm filtrée (UV-254nm-f) ou non filtrée (UV-254nm), le carbone organique dissous (COD), le carbone organique total (COT), le pH et les concentrations en SPD (THM4, AHA6, SPDE6). Chacun de ces paramètres est mesuré sur l’ensemble des points d’échantillonnage ou une partie de ceux-ci, selon que cela soit jugé pertinent ou non en fonction de l’intérêt scientifique de la
mesure et des ressources disponibles. Le tableau2.2présente l’ensemble des mesures effectuées
pour chaque point durant une campagne d’échantillonnage.
La température de l’eau est mesurée à tous les points à l’aide d’un thermomètre à alcool standard. La concentration en chlore libre et en chlore total est mesurée à l’aide d’un colori-mètre HACH Pocket Colorimeter II pour les points à l’UTE et sur le RDE de St-Jérôme et à l’aide d’un test à disque de couleur Hach CN-66 pour les points sur le RDE de Mirabel. La conductivité est mesurée uniquement à l’eau brute à l’aide d’un conductimètre WTW Multi 340i. Pour les quatre premiers points d’échantillonnage à l’UTE, l’UV-254nm-f et le COD sont mesurés après une filtration sur filtre de 0,7 µm afin de ne caractériser que la partie dissoute de la MON présente dans l’eau. Cela permet de mesurer l’effet du processus de coagulation, floculation et décantation sur la MON dissoute. Pour tous les autres points, l’UV-254nm est mesurée sans filtration et le COT est mesuré après une filtration sur filtre de 2 µm. Bien que la mesure du COT ne nécessite théoriquement pas de filtration, celle-ci est effectuée afin d’éviter d’endommager l’analyseur de carbone total GE Sievers 5310C utilisé pour la mesure du COD et du COT. L’UV-254nm est quant à elle mesurée à l’aide d’un spectrophotomètre HACH DR 5000.
Les protocoles d’analyse des SPD sont dérivés des méthodes standards de l’Environmental
Protection Agency (EPA) aux États-Unis. Un court résumé des méthodes d’analyses utilisées
pour cette étude est présenté ici tandis qu’une description détaillée peut être consultée à
l’an-nexe A. Pour les THM, l’analyse consiste en une microextraction sur phase solide réalisée à
l’aide d’un PAL Combi-xt, suivie d’une analyse par un chromatographe à phase gazeuse couplé à un spectrophotomètre de masse à trappe ionique (GC-MS) Varian Saturn 2100T. Cette mé-thode a une limite de quantification minimale (LQM) de 3,0 µg/L pour le TCM, de 2,4 µg/L pour le BDCM, de 2,7 µg/L pour le DBCM et de 2,3 µg/L pour le TBM. Pour les AHA6, l’analyse consiste en une extraction liquide-liquide réalisée manuellement et incluant une déri-vation pour obtenir les esters de méthyle voulus, suivie d’une analyse par un chromatographe en phase gazeuse couplé à un détecteur à capture d’électron (GC-ECD) PerkinElmer Auto-System XL avec une colonne DB-1701. Cette méthode a une LQM de 1,0 µg/L pour chaque AHA mesuré. Finalement, pour les SPDE6, l’analyse consiste en une extraction liquide-liquide réalisée manuellement, suivie d’une analyse par un GC-ECD PerkinElmer Clarus 500 à deux
Tableau 2.2 – Paramètres analysés pour chaque point durant une campagne d’échantillon-nage
Point T◦ eau
et pH Chlore Conductivité UV-254nm COD /COT et AHA6THM4 SPDE6
EB X X filtrée COD
DS X X filtrée COD X X
FS X X filtrée COD X
FD X X filtrée COD X
AVU X X non-filtrée COT X X
APU X X non-filtrée COT X
BX X X non-filtrée COT X CH X X non-filtrée COT X ED X X non-filtrée COT X X 1 X X non-filtrée X 2 X X non-filtrée X 3 X X non-filtrée X 4 X X non-filtrée X 5 X X non-filtrée COT X X 6 X X non-filtrée X 7 X X non-filtrée X 8 X X non-filtrée COT X X 9 X X non-filtrée COT X X 10 X X non-filtrée X 11 X X non-filtrée X 12 X X non-filtrée X 13 X X non-filtrée X 14 X X non-filtrée X 15 X X non-filtrée COT X X M1 X X non-filtrée COT X X M2 X X non-filtrée COT X X M3 X X non-filtrée X M4 X X non-filtrée COT X X M5 X X non-filtrée X 22
colonnes (DB-1 et DB-5). Cette méthode a une LQM de 0,01 µg/L pour chaque SPDE mesuré. Le prélèvement des échantillons est réalisé par le personnel des villes de St-Jérôme et de Mirabel à l’aide des contenants fournis par l’Université Laval. Pour l’analyse des THM4 et
des AHA6, des vials de 40 mL contenant du chlorure d’ammonium (NH4Cl) sont utilisés. Le
NH4Cl est un agent déchlorant qui transforme le chlore résiduel en chloramine, ralentissant
ainsi de manière importante la formation ou dégradation des différents SPD (Brisson,2010).
Les vials doivent être remplis à ras-bord sans aucune bulle d’air puisque plusieurs des composés étudiés sont très volatils. Pour l’analyse des SPDE6, des vials ambrés de 60 mL contenant du
NH4Cl et un tampon phosphate (1% Na2HPO4/ 99% KH2PO4, poids/poids) sont utilisés. Le
tampon phosphate permet de maintenir l’échantillon à un pH d’environ 5 et ainsi d’assurer la
conservation des HAN (Mercier Shanks et al.,2013). Ces vials doivent également être remplis à
ras-bord sans aucune bulle d’air. Finalement, une bouteille de plastique de 500 mL est remplie à chaque point d’échantillonnage pour les analyses physico-chimiques réalisées en laboratoire.
Les échantillons prélevés sont conservés à une température d’environ 4◦C en tout temps et
doivent être expédiés dans des glacières jusqu’à l’Université Laval et analysés dans un délai de 48 heures. Le délai acceptable est toutefois plus élevé pour l’analyse des SPD.
2.3
Temps de séjour théorique
Un modèle hydraulique du RDE de St-Jérôme est fourni par la Ville. Celui-ci a été conçu en 2009 par le Groupe Tanguay sur un logiciel privé puis transféré en format EPANET pour l’étude actuelle. Le Groupe Tanguay a conçu le modèle à partir des plans des conduites et déterminé le coefficient Hazen-Williams de celles-ci à l’aide d’une formule empirique tenant compte de l’âge du matériau de chaque conduite. La version du modèle fournie pour l’étude actuelle comprend les demandes moyennes annuelles en eau pour l’année 2010 sans patron de consommation (état stationnaire). Le modèle permet de déterminer un TDS théorique pour chacun des quinze points d’échantillonnage du RDE de St-Jérôme. Ceux-ci sont présentés à
la figure2.9. Cependant, les consommations des développements récents n’étant pas prises en
compte, plusieurs nœuds ayant une consommation de 0 L/s sont regroupés à certains endroits du modèle, ce qui semble causer certaines aberrations du point de vue des TDS calculés
localement. À titre d’exemple, le point d’échantillonnage numéro 6 (figure2.9) qui est situé à
proximité d’un grand nombre de nœuds ayant un débit nul, a un TDS calculé par le modèle beaucoup plus élevé que tous les autres points (environ 39 heures). Toutefois, le modèle obtient malgré cela des TDS réalistes pour la majorité des autres points d’échantillonnage. Ceux-ci varient entre une et douze heures et peuvent être séparés essentiellement en deux catégories : les TDS courts et les TDS longs. La première catégorie regroupe les points ayant un TDS plus petit ou égal à six heures, c’est-à-dire les points 1, 2, 3, 4, 5, 8 et 9. Ces points sont
tous situés relativement près de l’UTE ou d’une conduite maîtresse. La deuxième catégorie regroupe les points ayant un TDS de neuf à douze heures, c’est-à-dire les points 7, 10, 11, 12, 13, 14 et 15. Ces points sont tous situés relativement loin de l’UTE ou d’une conduite
maîtresse. Notons que bien que sur la figure2.9le point 13 semble être situé à proximité d’une
conduite maîtresse, il n’y est en réalité pas directement connecté.
D’autre part, il est également possible de calculer un TDS théorique dans le réservoir situé à
la sortie de l’UTE. Considérant une demande moyenne annuelle à l’UTE de 44 931 m3/jour
et un volume du réservoir de 38 950 m3(Groupe Tanguay,2010), le TDS moyen théorique du
réservoir est d’environ 21 heures.
Bien que les TDS dans le RDE de Mirabel sont inconnus, il est possible de calculer le TDS théorique dans la conduite reliant le RDE de St-Jérôme au quartier St-Augustin. Celui-ci est d’environ 25 heures. De plus, le modèle hydraulique de la Ville de St-Jérôme permet de déterminer que le TDS théorique de l’eau à la jonction entre les RDE de St-Jérôme et de Mirabel est d’environ 5 heures, ce qui donne un TDS théorique total d’environ 30 heures entre la sortie de l’UTE et l’entrée du quartier St-Augustin.
Une connaissance précise des TDS peut aider grandement à l’interprétation des concentrations en chlore et en SPD mesurées dans un système municipal d’eau potable. En effet, tel que décrit
à la section1.2, le TDS est un des paramètres influençant de manière importante la CCRL et la
concentration des différents SPD présents dans l’eau. D’autre part, le TDS peut d’autant plus influencer les concentrations observées dans l’eau du fait que les différentes réactions entre le chlore et les matières organiques et inorganiques ne se produisent pas toutes à la même vitesse (Brown et al.,2011). Ainsi, lorsque le TDS est particulièrement court, certaines réactions se seront déjà entièrement produites tandis que d’autres auront à peine débutées. Il n’est donc pas rare d’observer des vitesses de formation ou de dégradation différentes lors des premières minutes ou heures suivant l’injection de chlore dans l’eau par rapport à celle observées durant les heures ou jours suivants. Dans le cas de St-Jérôme, cette différence est essentiellement observable au niveau de l’UTE puisqu’au niveau du RDE, l’eau ayant déjà séjourné plus de 24 heures dans l’UTE et son réservoir, toutes les réactions rapides sont bien sûr déjà terminées.
2.4
Analyse statistique
Une analyse de la variabilité des concentrations des différents SPD étudiés est également réa-lisée afin de déterminer la variabilité pouvant être attribuée au lieu d’échantillonnage et celle pouvant être attribuée à la journée d’échantillonnage. L’analyse statistique réalisée consiste à déterminer si une différence statistiquement significative est observée entre les concentrations moyennes des différents points d’échantillonnage ou des différentes campagnes d’échantillon-nage. Un test d’effets fixes est donc réalisé afin de déterminer si le facteur « point » est signi-24
ficatif. Pour cela, la valeur p du test (probabilité d’obtenir un résultat égal ou plus extrême si l’hypothèse nulle est vraie, l’hypothèse nulle étant ici que le facteur « point » n’est pas
signi-ficatif -Biau et al.(2010)) est calculée. Si la valeur p est inférieure à 0,05, le facteur « point »
est considéré significatif et une comparaison multiple des différents points d’échantillonnage est ensuite réalisée afin de regrouper ensemble les points non significativement différents. La même procédure est suivie afin de déterminer si le facteur « campagne » est significatif. D’autre part, les corrélations de Pearson et de Spearman ont également été mesurées entre chaque SPD étudié et certains paramètres physico-chimiques. La corrélation de Pearson est réalisée sur les vraies valeurs et est plus élevée lorsque la relation entre les variables est li-néaire tandis que la corrélation de Spearman est réalisée sur les rangs des valeurs et est plus élevée lorsque la relation entre les variables est monotone (c.-à-d. uniquement croissante ou
uniquement décroissante) (Hauke et Kossowski,2011). Tout comme pour le test précédent, la
valeur p est calculée afin de déterminer si les corrélations sont statistiquement significatives (l’hypothèse nulle étant ici l’absence de corrélation). Lorsque la valeur p est inférieure à 0,05, la corrélation est considérée significative.
Toutes ces analyses sont réalisées dans le logiciel SAS à l’aide des procédures MIXED et CORR (SAS,2015,2013).
Figure 2.7 – Localisation des points d’échantillonnage dans le RDE de St-Jérôme
Figure 2.8 – Localisation des points d’échantillonnage dans le RDE de St-Augustin (Mirabel)
Figure 2.9 – Temps de séjour théoriques aux 15 points d’échantillonnage du RDE de St-Jérôme