THÈSE
Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS UFR de médecine et de pharmacie
Ischémie reperfusion en transplantation d’organes mécanismes et innovations thérapeutiques -IRTOMIT (Poitiers)
(Diplôme National - Arrêté du 7 août 2006) École doctorale : Biologie-santé - Bio-santé (Limoges)
Secteur de recherche : Biologie
Présentée par :
Sylvain Le Pape
Rôle de la réponse au mauvais repliement protéique dans
l'endothélium vasculaire au cours de l'hypoxie-réoxygénation
Directeur(s) de Thèse : Thierry Hauet, Raphaël Thuillier Soutenue le 25 novembre 2014 devant le jury Jury :
Président Thierry Hauet Professeur et praticien hospitalier, Université de Poitiers Rapporteur Nicolas Pallet Professeur et praticien hospitalier, Université Descartes, Paris Rapporteur François Amblard Directeur de recherche, Institut Curie, Paris
Membre Raphaël Thuillier Ingénieur de recherche INSERM, Université de Poitiers Membre Nicolas Bourmeyster Maître de conférences, STIM, Université de Poitiers
Membre Éric Chevet Directeur de recherche INSERM, GREF, Université de Bordeaux
Pour citer cette thèse :
Sylvain Le Pape. Rôle de la réponse au mauvais repliement protéique dans l'endothélium vasculaire au cours de l'hypoxie-réoxygénation [En ligne]. Thèse Biologie. Poitiers : Université de Poitiers, 2014. Disponible sur Internet <http://theses.univ-poitiers.fr>
Université de Poitiers
École doctorale Biosanté
Faculté de médecine et de pharmacie
T H È S E
en vue d’obtenir le titre deDocteur ès sciences
de l’Université de Poitiers
Mention : B
IOLOGIEPrésentée et soutenue par
Sylvain L
E
P
APE
Rôle de la réponse au mauvais repliement
protéique dans l’endothélium vasculaire
au cours de l’hypoxie-réoxygénation
Thèse co-dirigée par le Pr Thierry H
AUETet le Dr Raphaël T
HUILLIERpréparée au sein de l’unité Inserm 1082 - IRTOMIT
dirigée par le Pr Thierry H
AUET2
Jury
Rapporteurs : Dr François AMBLARD, PhD (Biologie moléculaire et Physique) - Institut Curie
Directeur de Recherche de 2eclasse - CNRS 168 (Paris)
Dr Nicolas PALLET, MD, PhD (Biochimie et Biologie moléculaire) - Université Paris Descartes Maître de Conférence Universitaire - Praticien Hospitalier - INSERM 1147 (Paris)
Examinateurs : Dr Éric CHEVET, PhD (Biologie moléculaire) - Université de Bordeaux
Directeur de Recherche de 2eclasse - INSERM 1053 – GREF (Bordeaux)
Dr Nicolas BOURMEYSTER, MD, PhD (Biologie cellulaire) - Université de Poitiers
Maître de Conférence Universitaire - CNRS FRE3511 – IPBC (Poitiers)
Directeurs : Pr Thierry HAUET, MD, PhD (Biochimie et Biologie moléculaire) - Université de Poitiers
Professeur Universitaire - Praticien Hospitalier - INSERM 1082 – IRTOMIT (Poitiers)
Dr Raphaël THUILLIER, PhD (Biologie cellulaire) - Université de Poitiers
«Un problème sans solution est un problème mal posé.»
Albert Einstein
«Un problème créé ne peut être résolu en réfléchissant de la même manière qu’il a été créé.» Albert Einstein
«Un expert est une personne qui a fait toutes erreurs qui peuvent être faites dans un domaine
très étroit.» Niels Bohr
«Les deux mots les plus brefs et les plus anciens, oui et non, sont ceux qui exigent le plus de
réflexion.» Pythagore
«Dans les mathématiques vous ne comprenez pas des choses. Vous vous habituez juste à elles.» Johann von Neumann
«On fait la science avec des faits, comme on fait une maison avec des pierres : mais une accumulation de faits n’est pas plus une science qu’un tas de pierres n’est une maison.»
Henri Poincaré
« On peut aussi bâtir quelque chose de beau avec les pierres qui entravent le chemin.»
i
Remerciements
À mon directeur de thèse, le Pr HAUET Thierry, je te remercie de m’avoir ouvert les portes de l’unité INSERM UMR 1082 (à l’époque INSERM UMR 927), de m’avoir laissé la liberté de la gestion de ma thèse et d’avoir accepté mes horaires qui étaient pour le moins singuliers. Je n’oublierai pas cette fin d’après-midi hivernale où je t’ai confié mon sentiment, que tu partageais également, que l’UPR serait plus fructueuse que mon second projet de thèse et que tu m’as soutenu en m’accordant ta confiance. J’espère ne pas t’avoir déçu dans ce choix en tant que jeune droïde et ne pas avoir été trop «cavalier» pour obtenir les outils de biologie moléculaire qui étaient nécessaires pour la vérification des hypothèses posées au cours de ce projet. Maintenant que ce projet a été lancé, j’espère pouvoir continuer à le suivre et y participer tout en favorisant la préparation aux ECN comme tu me le conseilles.
À mon codirecteur de thèse, le Dr THUILLIER Raphaël, cela fait maintenant quelques années que l’on passe ensemble. Tu m’as fourni un sujet qui m’avait passionné à l’époque : les télomères. Je me rappelle encore être rentré chez moi en me disant que ça «sonnait bien» sans savoir ce que cela pouvait bien vouloir dire, . . . mais ça semblait intéressant ! Et ce fut le cas. C’est amusant que la découverte des télomères fût récompensée d’un prix Nobel l’année où tu me proposais ce sujet de M1 et qu’à la fin de ma thèse sur l’UPR, ce soit un prix Lasker qui soit remis à deux pionniers de l’UPR : je te suspecte de faire partie des commissions de sélection. . . L’enseignement principal qui a découlé de ce Master 1 a été le fait qu’une hypothèse n’était pas toujours vérifiée et qu’il fallait chercher en comprendre les raisons (d’ailleurs, toutes mes hypothèses se sont soldées par des résultats inverses durant ma thèse). Après mon escapade à Nantes (qui fût un véritable tournant), je suis revenu signer pour trois ans et j’ai eu la chance que tu m’aies laissé naviguer en toute liberté. Je t’en remercie infiniment car beaucoup de directeurs auraient serré la vis en voyant leur étudiant «s’éparpiller» à faire des maths, bidouiller des logiciels (les lignes de commande ne sont pas si mystérieuses et ne provoquent pas systématiquement des céphalées !) et surtout mettre en place des collaborations. Tu m’as également offert la chance de ne jamais me freiner ou bloquer lorsque je proposais des expérimentations qui, malheureusement, ne sont pas encore toutes achevées à l’heure actuelle. Je te remercie
ii
Raphaël pour la confiance que tu m’as accordée, mais également de m’avoir vu comme un chercheur en devenir plutôt qu’un simple étudiant à qui l’on demande de réaliser des expériences. Nos discussions parfois énergiques étaient vraiment intéressantes ! Cependant, le chemin avant de devenir un vrai chercheur est long et complexe, un jour peut-être aurai-je la prétention à ce titre. . .
Enfin, merci pour ce dinner à San Francisco où tu m’as fait découvrir qu’il était possible de mélanger une boisson aux racines avec de la glace vanille. . . ! Tu m’as permis de m’indiquer les clés permettant de survivre dans ce monde pas toujours amical qu’est le monde de la recherche et permis de me laisser faire mes propres erreurs afin d’en tirer des leçons. Bon courage pour cette année de concours et à très vite car je continuerai de hanter le laboratoire de jour comme de nuit. . .
Au Pr MAUCO Gérard, merci d’avoir accepté d’envoyer mon dossier à l’École de l’INSERM malgré le fait que j’étais un «carré». Vous m’avez offert une opportunité inestimable qui m’a permis d’élargir mes horizons et de faire de merveilleuses rencontres. Merci également de m’avoir ouvert les portes du laboratoire qui était sous votre direction à l’époque de mon Master 1. À l’époque, vous m’aviez restreint dans le nombre de références pour mon mémoire. . . j’espère donc que vous ne m’en voudrez pas d’en avoir mis un petit peu plus dans ce manuscrit !
Je remercie le Dr CHEVET Éric d’avoir accepté de venir évaluer ce travail de thèse malgré un emploi du temps très dense. Vos travaux m’ont permis de mieux comprendre le fonctionnement des voies IRE1α-XBP1 et ATF6, qui cependant, me semblent toujours aussi (si ce n’est pas plus) mystérieuses malgré ces trois ans de travail.
Je remercie également le Dr BOURMEYSTER Nicolas d’avoir accepté de participer au jury. Cette situation est singulière pour moi, car c’est vous qui m’avez appris pour la pre-mière fois l’existence des protéines G et de leurs récepteurs à sept domaines transmem-branaires à l’époque de ma première année de médecine.
iii
malgré de nombreuses contraintes. Je suis très heureux que vous participiez à l’évaluation de ce travail de thèse étant donné que vos travaux comptent parmi les tout premiers que j’ai lus pour aborder ce réseau de signalisation aux régulations multiples et complexes qu’est l’UPR.
Enfin, je remercie le Dr AMBLARD François d’avoir accepté d’évaluer ce manuscrit de thèse. Cela m’est particulièrement cher étant donné que vous faites partie de l’équipe pédagogique de l’École de l’INSERM - Liliane Bettencourt Schueller. Je vous remercie pour ces discussions enthousiasmantes lors des journées de septembre. Notamment, je garde en tête la possibilité d’évaluer la production de chaleur en single-cell à l’aide de cette caméra infrarouge à très haute sensibilité que vous avez développée au sein de votre laboratoire. Merci pour vos cours à l’École de février qui étaient plus que stimulants (même si nous ne dormions pas beaucoup afin d’analyser des articles sur la physique de la microscopie à force atomique !). Merci pour tout ce que vous faites pour nous. Nous rencontrons de nombreuses difficultés, mais qui sont bien moindres en comparaison de celles que vous rencontrez pour défendre ce double cursus.
Je remercie Matthias CHATELLAIS, ingénieur à l’Institut de Transplantation Et de Recherche en Transplantation (ITERT, ex-ITUN) à l’époque de mon Master 2 Recherche, qui m’a transmis son savoir-faire en culture cellulaire et qui m’a permis d’être plus rigou-reux dans les gestes techniques et la génération des hypothèses. Il me reste cependant beaucoup à faire sur ces deux points. . . Dans tous les cas, c’est grâce à ta vision et tes enseignements que j’ai pu oser développer les techniques nécessaires pour ce projet.
Certaines personnes m’ont permis d’étayer ma curiosité pour les mathématiques et la physique théorique, je pense notamment à Jean-Louis SIKORAV (CEA, Saclay), Jean-Claude SIKORAV (ENS, Lyon) et Jean-Pierre BOURGUIGNON (ex-directeur de l’Institut des Hautes Études Scientifiques, Bures-sur-Yvette). Merci pour votre patience et les enseignements que vous m’avez procurés ainsi que les possibilités que vous m’avez offertes. J’espère que vous ne m’en voulez pas d’avoir dévié ma trajectoire vers les sciences du Vivant. . .
iv
Je pense également aux personnes qui m’ont transmis la rigueur, la détermination et la persévérance, je vous remercie donc Gilles HENRY et Ginette HENRY. Mon violon me suit toujours, mais malheureusement, le temps me manque pour le pratiquer comme vous me l’avez enseigné. . .
Je remercie également mes compagnons de galère : Édouard aussi brillant le jour au laboratoire que la nuit à l’internat, Vivien qui se promène dans les champs vectoriels comme on le ferait sur un chemin de bord de mer, Solenne qui je l’espère ne m’en voudra pas pour les longues discussions sur la qPCR («alors transfo’ Log ou pas ?»). . . Merci également à Anaïs (félicitations Docteur !) et Grégoire pour ces franches parties de rigolade (notamment lors d’un «caps» au lac d’Égleton) ! Jacques, le laboratoire a gagné un super chercheur et un réel boutentrain, c’est dommage que nos bureaux fussent si éloignés ! What, what, what. . . ? Je te laisse continuer. . .
Mon Clément, cette thèse m’a permis d’avoir la chance de te connaître : tu es une personne exceptionnelle en tous points. Nous n’avons malheureusement pas eu le temps (ma faute. . . ) de faire tout ce que l’on aurait souhaité. Ce n’est vraiment que partie remise. Tu as une belle année américaine devant toi et un avenir plus que prometteur dans la recherche scientifique. L’avenir nous dira si tu rapporteras tes qualités en France ou si tu t’épanouiras outre-Atlantique. Dans tous les cas, sois certain que je serai toujours à tes côtés. Que les vents te soient favorables et à très vite !
Je remercie également les personnes aux doigts de fée qui font avancer les projets du laboratoire :
— Virginie, merci pour ces rires partagés, pour avoir été mes yeux à de nombreuses reprises surtout lorsque je cherchais des objets se situant sous mes yeux et pour ta bienveillance (promis, j’essaierai de faire attention de manger comme il le faut. . . ), — Sandrine, merci pour tes conseils concernant les Western-Blots : à quand l’écusson
«Western-Blot Angel’s» sur ta blouse ? !
v
Delphine de m’avoir surveillé afin d’éviter que je manipule dans le noir (c’est surtout mes yeux qui te remercient pour ça), mais également pour tes conseils concernant les enseignements notamment pour relever le «défi des 1resannées». . . Je vous souhaite d’entreprendre des projets plus heureux et fructueux les uns que les autres avec le Pr SEGUIN François,
— Sonia, je te remercie en particulier pour ces courses à pied durant lesquelles tu nous en faisais baver dans les côtes avec Nicolas ! Fais attention de ne pas trop forcer et si tu cherches un lièvre (pas trop rapide. . . ) pour un marathon, n’hésite pas !
— Sihem et Maïté, merci pour votre gentillesse qui me permettait de supporter la frus-tration des manipulations qui échouaient (plus nombreuses que les réussites . . . ). . . Et courage pour le sport Sihem, il ne faut pas baisser les bras (n’oublie pas d’y aller pianopour éviter les blessures. . . ) !
— Françoise et Christine, rien ne serait possible sans vous, merci pour votre patience et vos compétences indispensables à la bonne gestion l’Unité INSERM 1082.
Merci à vous, Nathalie et Béatrice, vous m’avez permis de m’immerger brièvement dans le monde délicat de la microscopie électronique. Merci pour votre gentillesse et votre patience que vous m’avez témoignées durant ces trois années, ce fut un réel plaisir de travailler ensemble.
Je te remercie Patrick, tu as été pour moi le gardien de la précision. Je te remercie pour le temps que tu m’as accordé pour discuter et notamment pour toutes tes questions aux-quelles je ne savais pas répondre (il en reste encore beaucoup. . . ), mais qui me poussaient à affûter mon argumentaire avant de porter une conclusion sur mes observations. Promis, je continuerai de te demander comment tu vas chaque fois que nous nous croiserons. . .
Je te remercie Frédéric pour ta bienveillance et ton jugement toujours objectif, ton enthousiasme permanent, mais également de m’avoir permis de participer à tes projets passionnants qui auront des applications certaines en transplantation. Je n’oublierai pas deux des premiers conseils que tu m’as donnés et qui sont fondamentaux en recherche : «Avant toute chose, clarifie ta question de départ» et «Lorsque tu démarreras ton projet,
vi
favorise toujours les expérimentations faciles à mettre en œuvre avant d’entreprendre les expérimentations plus compliquées et risquées.» Pour le premier conseil, je pense l’avoir plus ou moins suivi (tu me diras certainement moins. . . ), le deuxième reste encore à travailler ! Bon courage pour la suite et je surveillerai tes appels dans les services !
Sébastien, le premier jour où je t’ai croisé (il y a maintenant près de 6 ans), j’ai immédiatement su qu’on ne pouvait pas être malheureux à tes côtés. C’est maintenant confirmé ! Tu as été une vraie source de bonheur durant ces quelques années passées ensemble ; tu m’as même fait apprécier les cascades de la coagulation (que je suis toujours incapable de te réécrire au tableau par ailleurs. . . ) ! Ta passion pour l’hémostase et l’immunologie alliée à tes talents de pédagogue et ton humour feraient de toi le prof’ idéal ! J’espère ne pas te laisser le souvenir d’un thésard obnubilé par les statistiques et la qPCR. . . P.S. Fais attention à ta santé !
Nicolas, la première fois que je t’ai rencontré fut lors d’une fin de journée où je vins avec un ami de l’École de l’INSERM pour te demander si tu «faisais des siRNAs», évidemment, en ne sachant pas du tout ce que cela signifiait. . . Suite à cela et dès mon Master 1, tu m’as transmis ta passion pour la biologie moléculaire et tout au long de ces années, tu m’as permis de m’épanouir dans la recherche en m’encourageant même dans l’échec. Tu m’as transmis une grande quantité de conseils (trop nombreux pour les transmettre ici). Merci pour ce raid inoubliable que tu nous as fait vivre avec Pierre et pour tous les fous rires que l’on a partagés dans le «bureau du fond», c’était tout simplement génial ! N’oublie pas, tes 40 ans approchent à grands pas et si tu ne veux pas que les Grizzlis se délectent de toi, il va falloir courir plus vite que moi. . . !
Je remercie le Dr PINSARD Michel pour ses encouragements concernant l’intérêt des mathématiques en biologie et en médecine, cela m’a motivé à terminer l’approche bioinformatique développée dans ce manuscrit. Merci également au Pr JAYLE Christophe pour avoir soutenu mes travaux de thèse lors des Journées de Recherche Tours-Poitiers, cela m’a permis de croire en l’intérêt des cliniciens pour ce projet. Pr BARROU Benoit, je vous remercie très sincèrement pour les discussions que nous avons eues aux détours de
vii
congrès et notamment à San Francisco ; je n’aurai pas pu réaliser cela sans votre aide plus que précieuse.
Merci également aux chirurgiens qui m’ont permis de découvrir les techniques chirurgicales de la transplantation : le duo Jérôme et Jacques (De profundis morpionibus. . . ), mais également Thibault et Xavier. Merci également à Tackwa et Souleymane pour les bons moments partagés, sans oublier mes amis de l’École de l’INSERM (notamment Marc, Simon, Charlotte, Annaick, Charlotte, Marine, Anna, Sophie, Nader, Thomas, Naïl...) !
Je remercie également deux personnes qui sont de véritables sources d’inspiration, les Drs COUDROY Rémi et KERFORNE Thomas, votre investissement dans la clinique et la recherche m’ont encouragé à poursuivre ce cursus. Merci pour tout le temps que vous avez pris à m’expliquer l’anesthésie et la réanimation durant les transplantations rénales et hépatiques, mais également en dehors du cadre expérimental. J’espère un jour pouvoir suivre vos pas. À très vite dans les couloirs du CHU !
Un grand merci à notre bande de Tours (qui s’est expatriée à Poitiers pour la majorité. . . ) pour votre soutien et votre bonne humeur constante durant ces 3 années où l’on a pu se retrouver pour d’excellentes soirées. Merci à toi Louise (je tairai ton surnom. . . ) pour ces soirées improvisées à la sortie du service. Merci aussi à toi la terreur, pardonne-moi, Cécile, pour tes incrustes à l’appartement (oui les sticks mozza’ seront au programme à ta prochaine venue, si mademoiselle daigne venir !). Merci à toi, Clémence, ton franc-parler me surprendra et m’amusera toujours autant. Merci à vous deux les globe-trotteurs amoureux, Anaïs et Thomas, je bosse sur le permis moto pour que l’on puisse (enfin) se faire des virées à quatre ! Merci également au trio Nico, Marion et Sullivan (alias Tic) pour ces fous rires mémorables !
Ma bande de loulous (JC, Camille, Pablo, Marie, Joe, Aude, Antho et Audrey). . . J’ai trop de bons moments à raconter (trop d’indiscrets surtout) et les mots ne sont pas assez forts pour vous témoigner à quel point vous comptez pour moi et à quel point votre soutien m’a été indispensable de la P2 jusqu’à maintenant (un peu plus pour toto, mon jumeau d’Évry, avec nos retours du tutorat de P1 dans le Noctambus. . . ). Je suis désolé
viii
de ne pas avoir pu nous consacrer plus de temps, mais j’ai la chance que vous ayez compris que mes cellules ne prenaient pas de repos le weekend et les soirées. . . Vous êtes tout simplement extraordinaires ! Nous allons enfin pouvoir nous retrouver, à l’extérieur comme dans les couloirs du CHU !
Michaël, au jour où j’écris ces lignes nous devrions fêter nos «noces» de cristal. . . 15 années à se supporter ! Et dire que je te disais que les 8 ans du secondaire seraient interminables, je m’étais planté dans mes estimations. . . J’aurais dû multiplier par trois à l’époque. . . Bref, ce n’était que la première erreur parmi les nombreuses autres que nous avons faites durant cette quinzaine d’années ! Malgré la distance, notre amitié n’a jamais faibli et je suis certain que ce ne sera jamais le cas. Garde le cap que tu as su maintenir et n’oublie pas nos challenges des dix prochaines années : Norseman, marathon des sables et UTMB !
Mon grand frère, mon mi·cho·ko (je ne vais pas dévoiler tes surnoms plus. . . familiers), popyx pour tes amis, Sébastien pour le plus grand nombre. Je reprends une phrase utilisée lors de mon discours et qui a apparemment marqué les esprits à votre mariage avec Laure : «Ça fait 25 ans que l’on se connaît. . . » et 25 ans que tu es mon modèle. Comme tous frères, nous avons eu des bas (très peu heureusement !), mais surtout des hauts. Je sais que tu as initialement douté de mon parcours, mais j’ai la conviction que tu t’inquiétais plutôt du long et tortueux chemin que je m’apprêtais à emprunter qui, pour la première fois, n’avait pas été balisé par tes soins. J’espère que tu pourras mettre des images sur les concepts que j’essayais de partager avec toi ; je t’assure que c’est plus simple qu’une PTH ! En espé-rant que nos plannings entreront plus fréquemment en phase pour que l’on puisse se voir !
Cette thèse me donne l’occasion de remercier mes grands-parents qui ont également contribué de façon directe ou indirecte à l’aboutissement de ce parcours. Merci pour tous les bons moments partagés ensemble, que ce fusse lors de mon apprentissage du français avec toi papy Roland, les parties de tennis et les discussions sur la physique des lasers et des micro-puces avec toi papy Raymond (pardonne-moi pour ces trajets silencieux que tu subissais lorsque tu m’emmenais au C.N.R. de Rueil-Malmaison), les fous rires avec toi
ix
mamy Éliane (un oubli de sac sur une aire d’autoroute ou encore un problème d’assise sur le vélo dans les Landes, sans compter la nuit glaciale après s’être fait emporter par une lame de fond. . . il y en a trop pour citer toutes nos anecdotes), mais également à toi mamy Léone ; je n’ai pas eu la chance de te connaître aussi longtemps que je l’aurais souhaité, mais avec les histoires que l’on me racontait sur toi et ma merveilleuse mère, je sais que tu étais une femme exceptionnelle. Mon goût pour l’enseignement a certainement pour origine ta passion et celle de papy Roland.
À mes parents sans qui absolument rien n’aurait été possible. Votre amour et votre soutien perpétuel, aussi bien moral que logistique, m’ont sans aucun doute permis de réaliser mes rêves. J’ai eu la chance d’être très gâté, mais vous me faisiez me rendre compte de la chance que j’avais de l’être. En regardant en arrière, je me rends compte de la tâche infiniment complexe que vous avez réalisée et que vous continuez de réaliser. Vous m’avez permis d’entreprendre tout ce que je voulais (oui, j’ai bien dit gâté. . . ) aussi bien en sport qu’en art. Vous m’avez permis de voyager à travers presque tous les continents et m’avez offert la liberté de partir à l’étranger pour vivre ma passion de la musique. Cette confiance, vous me l’avez témoignée également lorsque je vous ai demandé de faire le C.N.E.D. pour pratiquer encore plus le violon. Un autre témoin de votre confiance est celui de mon départ sur Poitiers. . . Je n’arrive plus à compter le nombre de sacrifices que vous avez faits pour nous deux avec Sébastien, je suis incapable de vous dire à quel point je vous en remercie et à quel point je vous aime, j’espère que nos parcours de vie pourront vous le témoigner. Si une définition de la perfection parentale existait, nul doute que vous en seriez les détenteurs.
Célina, les superlatifs me manquent lorsque je parle de toi et que je décris ô combien tu comptes pour moi. Je crois, ou plutôt je sais que cette thèse t’a encore plus épuisée que moi. Tu as subi mes refus de weekend, mes réveils nocturnes ainsi que mes nuits blanches qui, à de nombreuses reprises, me donnaient l’impression de partir en vacances lorsque je rentrais chez nous. Je te remercie d’avoir fait semblant de me croire lorsque je te disais que c’étaient les dernières manip’, les dernières cinétiques, les dernières nuits ou weekends passés à travailler. Tu m’as supporté sans relâche et relevé à chaque fois
x
que je tombais sans tarir d’encouragements. Merci pour ta patience, notre époque entre Paris-Nantes-Tours et Poitiers est enfin terminée ; on en a usé des jeans sur les strapontins et des forfaits téléphoniques pour passer le temps lors des (trop vraiment trop) nombreux retards de la S.N.C.F. . . Je te remercie également pour la joie et le bonheur quotidien que tu m’apportes depuis notre rencontre. Merci de me supporter aussi bien dans les études que dans le sport, et ce – comme ce fût le cas avec cette thèse – sur des épreuves longues comme l’Ironman de Nice (avec la nécessité d’une bonne crème solaire. . . ), voire très longues avec les ultra-trails. . . Très peu de fiancées sacrifieraient des journées à attendre et encourager à chaque ravitaillement. . . Et encore moins à offrir des vêtements techniques sur une course ! ! ! Merci pour ta joie de vivre qui est indispensable pour supporter un ronchon comme moi. . . Je t’aime et je ne te le témoignerai jamais assez.
Table des matières
Liste des Abréviations xxi
I Contexte et justifications de l’étude
1
1 La transplantation d’organes & l’ischémie–reperfusion 3
1.1 Les grandes étapes de la transplantation et de la conservation d’organes . . 4
1.1.1 Le chemin vers le succès de la transplantation rénale . . . 4
1.1.2 Les origines de la transplantation. . . 8
1.1.3 La méthode scientifique et la transplantation . . . 10
1.1.4 La régénération tissulaire . . . 10
1.1.5 Le phénomène de tolérance . . . 12
1.1.6 La conservation des organes . . . 13
1.1.7 La transplantation d’organes : la révolution du Dr CARREL Alexis . 18 2 Physiopathologie de l’ischémie-reperfusion en transplantation 21 2.1 L’impact clinique de l’ischémie-reperfusion . . . 22
2.2 Les processus cellulaires au cours du syndrome d’ischémie-reperfusion. . . 25
2.2.1 L’endothélium. . . 25
2.2.2 Le complément . . . 31
2.2.3 Le système immunitaire . . . 32
2.2.4 Les modifications biochimiques au cours de l’ischémie-reperfusion . 37 2.3 Les possibilités interventionnelles de prévention des lésions d’ischémie-reperfusion. . . 40
3 Le stress du réticulum endoplasmique 45 3.1 Le réticulum endoplasmique . . . 46
3.2 La protéine chaperonne BiP : la clé de l’UPR. . . 48
3.3 Les voies de signalisation de la réponse aux protéines mal repliées (UPR). . 51
3.3.1 La voie IRE1–XBP-1(s) . . . 52
xii Table des matières
3.3.3 La voie ATF6 . . . 60
3.3.4 Les voies de l’UPR : un orchestre ou des solistes ? . . . 63
3.4 Le stress du réticulum et l’inflammation . . . 64
3.5 Les différents types de morts cellulaires . . . 68
3.5.1 La nécroptose . . . 69 3.5.2 La parthanatose . . . 71 3.5.3 La ferroptose et l’oxytose . . . 72 3.5.4 La NETose et ETose . . . 73 3.5.5 La pyroptose et la pyronécrose . . . 73 3.5.6 L’anoïkis . . . 74 3.5.7 L’entose . . . 75
3.5.8 La mort cellulaire induite par l’autophagie . . . 75
3.5.9 La catastrophe mitotique . . . 76
3.5.10 L’apoptose . . . 76
3.6 La mort cellulaire et le réticulum endoplasmique . . . 80
4 Les mathématiques et la biologie 85 4.1 Boîte à outils mathématiques . . . 86
4.1.1 Le groupe : objet central de l’algèbre . . . 88
4.1.2 Les anneaux : des groupes avec une L.C.I. supplémentaire . . . 90
4.1.3 Les idéaux : des parties d’anneaux uniques . . . 93
4.1.4 Les corps : des anneaux ayant des éléments symétriques . . . 95
4.2 La géométrie algébrique et le vol des oiseaux . . . 100
4.3 Polynômes et division polynomiale multivariée . . . 103
4.4 Les bases de Gröbner : application des systèmes dynamiques polynomiaux probabilistes à l’interprétation des données biologiques . . . 108
4.5 L’éventail de Gröbner et ses cônes : utilité statistique. . . 121
4.6 L’algorithme TSNI : Time Series Network Identification . . . 141
5 Motivations de l’étude 143 6 Matériel & méthodes 147 6.1 Culture cellulaire . . . 148
Table des matières xiii
6.1.1 Amplification . . . 148
6.1.2 Congélation . . . 149
6.1.3 Décongélation. . . 149
6.2 Hypoxie – réoxygénation. . . 149
6.3 Modulation de la réponse au mauvais repliement protéique . . . 150
6.4 Viabilité et mortalité cellulaire . . . 151
6.5 Transcription inverse et réaction de polymérisation en chaîne en temps réel (RT-PCR) . . . 152
6.5.1 Extraction des ARNm . . . 152
6.5.2 Transcription inverse. . . 152
6.5.3 PCR. . . 152
6.5.4 La PCR quantitative ou en temps réel (qPCR). . . 154
6.6 Western-blot . . . 158
6.6.1 Extraction et quantification des protéines . . . 158
6.6.2 Migration et transfert. . . 158
6.6.3 Anticorps et révélation . . . 159
6.7 Transfection siRNAs . . . 160
6.8 Prédiction miRNAs et analyse des micropuces à ADN . . . 160
6.9 Microscopie électronique à transmission (MET) . . . 162
6.10 Electrophoretic Mobility Shift Assay – Retard sur gel . . . 162
6.11 Construction et transduction des vecteurs lentiviraux . . . 164
6.12 Ischémie froide des reins de porcs Large White . . . 164
6.13 Analyses statistiques . . . 165
7 Résultats des expériences 169 7.1 Modèle d’hypoxie hypothermique – réoxygénation normothermique . . . . 170
7.2 Rôle de la réponse au mauvais repliement protéique au cours de l’hypoxie-réoxygénation . . . 173
7.2.1 Voie ATF6 . . . 176
7.2.2 Voie PERK-eIF2α-ATF4 . . . 183
7.2.3 Voie IRE1α-XBP1 . . . 190
xiv Table des matières
7.3 Étude préclinique de l’UPR au cours de la préservation rénale statique . . . 215
8 Les systèmes dynamiques polynomiaux probabilistes et l’identification de gènes critiques au cours de l’hypoxie-réoxygénation 217 8.1 Introduction de la méthode algébrique . . . 220
8.1.1 Utilisation des codes sources . . . 232
8.2 Identification des acteurs majeurs de l’UPR dans l’adaptation à l’hypoxie-réoxygénation des cellules endothéliales . . . 235
8.2.1 Identification des voies IRE1α-XBP1 et ATF6 comme voies régula-trices de la survie cellulaire au cours de l’hypoxie-réoxygénation . . 235
8.2.2 Limites de notre approche algébrique : les données issues des tech-nologies à haut débit . . . 238
II Discussion et perspectives
245
A Membranes des Western-blots et découpage 273 B Codes sources des fonctions du logiciel EasyqpcR 281 B.1 Fonction nrmData . . . 281B.2 Fonction badCt . . . 285
B.3 Fonction calData . . . 286
B.4 Fonction slope . . . 286
B.5 Fonction totData . . . 288
C Protocole d’analyse des micropuces à ADN 291 D Codes sources des systèmes dynamiques polynomiaux probabilistes 297 D.1 Fonction func.m2 . . . 297
D.2 Fonction PolynomialDynamicalSystems.m2. . . 301
D.3 Fonction For.pl . . . 310
D.4 Fonction dpind.g . . . 311
E Cartes des plasmides 313
Table des figures
1.2 La transplantation de la jambe noire par les Saints Côme et Damien : une
fresque du XVesiècle . . . . 8
2.1 Nombre de publications sur l’ischémie-reperfusion référencées dans Pub-Med par année. . . 25
3.1 Les grandes étapes de l’UPR. . . 49
3.2 Schéma des voies de l’UPR. . . 51
3.3 Fonctions physiologiques et pathologiques de l’UPR. . . 53
3.4 Les différents types de nécrose régulée . . . 70
4.1 Représentation artistique de l’idéal 2Z de l’anneau(Z,+,×). . . 95
4.2 L’équation du cercle de centre 0 et rayon 1 : x2+y2=1 . . . 101
4.3 Vol des oiseaux et représentation graphique de son LagrangienL . . . 102
4.4 Représentation schématique de l’idéal I=x4y2, x3y4, x2y5 . . . 111
4.5 Analogie entre les bases de Gröbner d’un idéal et l’hématopoïèse . . . 122
4.6 L’éventail de Gröbner de l’idéal I=y−x2, z−x3 (1) . . . 130
4.7 L’éventail de Gröbner de l’idéal I=y−x2, z−x3 (2) . . . 134
4.8 Les Sudokus peuvent être résolus grâce aux bases de Gröbner. . . 136
4.8 Les Sudokus peuvent être résolus grâce aux bases de Gröbner. . . 137
4.9 Vol des oiseaux et représentation graphique de son LagrangienL(1) . . . . 139
4.9 Vol des oiseaux et représentation graphique de son LagrangienL(2) . . . . 140
7.1 Mesures des taux d’oxygène au cours de l’hypoxie-réoxygénation . . . 171
7.2 L’hypoxie-réoxygénation induit des lésions ultrastructurales dans les HAEC 172 7.3 L’hypoxie-réoxygénation affecte la survie des HAEC. . . 173
7.4 La modulation globale de l’UPR n’affecte pas la survie cellulaire au cours de l’hypoxie-réoxygénation . . . 174
7.6 L’hypoxie-réoxygénation active la voie ATF6 dans les HAEC (1) . . . 177
xvi Table des figures
7.7 Validation de l’inhibition de la voie ATF6 par l’AEBSF. . . 179
7.8 Validation des siRNA ciblant ATF6 . . . 179
7.9 ATF6 favorise la mort cellulaire au cours de l’hypoxie-réoxygénation . . . . 181
7.10 ATF6 n’est pas impliquée dans la survie des fibroblastes murins embryon-naires au cours de l’hypoxie-réoxygénation . . . 182
7.11 Récapitulatif de la voie ATF6 au cours de l’hypoxie-réoxygénation . . . 182
7.12 L’hypoxie-réoxygénation active la voie ATF4 dans les HAEC (1) . . . 183
7.12 L’hypoxie-réoxygénation active la voie ATF4 dans les HAEC (2) . . . 185
7.13 Validation du salubrinal et des siRNA ciblant PERK et ATF4 . . . 187
7.14 Le maintien de l’activation de l’axe eIF2α-ATF4 favorise la survie cellulaire au cours de l’hypoxie-réoxygénation . . . 188
7.15 PERK n’est pas impliquée dans la survie des fibroblastes murins embryon-naires au cours de l’hypoxie-réoxygénation . . . 188
7.16 Récapitulatif de la voie PERK-eIF2α-ATF4 au cours de l’hypoxie-réoxygénation . . . 189
7.17 L’hypoxie-réoxygénation active la voie IRE1α-XBP1 dans les HAEC (1) . . . 192
7.18 L’hypoxie-réoxygénation active la voie IRE1α-XBP1 dans les HAEC (2) . . . 193
7.19 Validation de l’inhibiteur de l’activité endoribonucléase d’IRE1α, STF083010 194 7.20 Validation des siRNA ciblant IRE1α et XBP1. . . 195
7.21 La voie IRE1α-XBP1 a un rôle dual sur la survie cellulaire au cours de l’hypoxie-réoxygénation . . . 197
7.22 IRE1α et XBP1 contrôlent de manière opposée le niveau d’expression de l’ARNm de CHOP . . . 199
7.23 IRE1α est nécessaire pour la survie des cellules murines embryonnaires au cours de l’hypoxie-réoxygénation. . . 200
7.24 Récapitulatif de la voie IRE1α-XBP1 au cours de l’hypoxie-réoxygénation . 201 7.25 Les voies de l’UPR sont en équilibre dans les HAEC au cours de l’hypoxie-réoxygénation (1) . . . 203
7.25 Les voies de l’UPR sont en équilibre dans les HAEC au cours de l’hypoxie-réoxygénation (2) . . . 204
Table des figures xvii
7.26 Les voies de l’UPR sont liées dans les HAEC au cours de
l’hypoxie-réoxygénation . . . 205
7.27 ATF6 est déterminant dans la mort des cellules endothéliales au cours de l’hypoxie-réoxygénation . . . 207
7.28 Fenêtres de traitement des modulateurs de l’UPR au cours de l’hypoxie-réoxygénation . . . 208
7.29 Les niveaux d’expression et les cinétiques de variation des principaux mé-diateurs de l’UPR sont affectés réciproquement dans les cellules murines embryonnaires knocked-out pour IRE1α, PERK et ATF6 . . . 212
7.30 L’ischémie froide altère le réticulum endoplasmique et active l’UPR . . . 215
7.31 L’ischémie froide altère le réticulum endoplasmique et active l’UPR . . . 216
8.1 Vue schématique de notre approche d’identification . . . 221
8.2 IRE1α et XBP1 sont nécessaires pour la survie des cellules endothéliales du-rant l’hypoxie-réoxygénation . . . 237
8.3 L’inhibition de l’activité RNase d’IRE1α ou d’ATF6 améliore la survie des cellules endothéliales face à l’HR . . . 238
8.4 IRE1α est nécessaire pour la survie des cellules murines embryonnaires du-rant l’hypoxie-réoxygénation . . . 239
8.5 Différence entre les représentations polynomiales tropicales et classiques (1) 243 8.5 Différence entre les représentations polynomiales tropicales et classiques (2) 244 E.1 Plasmide pENTR1a.DHFR.YFP . . . 314
E.1 Plasmide pENTR1a.DHFR.ATF6 . . . 315
E.1 Plasmide pENTR1a.YFP.FKBP . . . 316
E.1 Plasmide pENTR1a.XBP1s.FKBP . . . 317
E.1 Plasmide de destination pLenti6.2-V5-DEST. . . 318
E.1 Plasmide lentiviral pLenti.DHFR.YFP . . . 319
E.1 Plasmide lentiviral pLenti.DHFR.ATF6. . . 320
E.1 Plasmide lentiviral pLenti.YFP.FKBP . . . 321
Liste des tableaux
2.1 Pathologies liées à l’ischémie-reperfusion . . . 23
3.1 Phénotype des knockouts des différents médiateurs de l’UPR . . . 81
4.2 Addition dans Z/3Z . . . 96
4.3 Addition dans Z/4Z . . . 96
4.4 Multiplication dans Z/3Z . . . 97
4.5 Multiplication dans Z/4Z . . . 97
6.1 Volumes utilisés pour la réalisation des séquences d’hypoxie et de réoxygé-nation . . . 150
6.2 Amorces humaines et murines utilisées pour les qPCR . . . 157
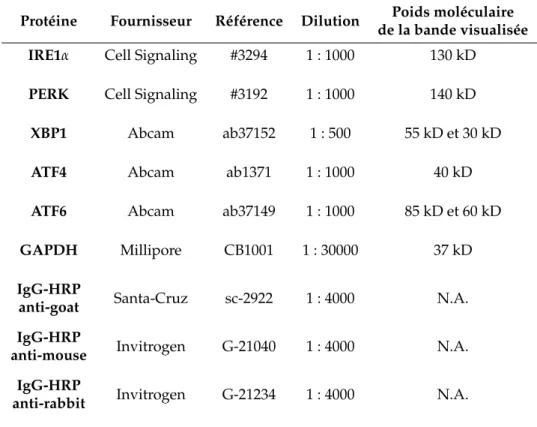
6.3 Anticorps utilisés pour la réalisation des Western-blots . . . 159
6.4 Tableau récapitulatif du nombre de HAEC en fonction de la surface . . . 161
6.5 Sondes d’ADN biotinylées utilisées pour les EMSA . . . 163
8.1 Données de RT-qPCR provenant des HAEC soumises à une séquence d’hy-poxie hypothermique de 0h, 6h, 12h ou 24h . . . 221
8.2 Données discrétisées des résultats de qPCR obtenus à partir des HAEC ex-posées à 0h, 6h, 12h ou 24h d’hypoxie . . . 223
8.3 Indices de coopérativité de Deegan-Packel de notre SDPp . . . 230
8.4 Indices de coopérativité de Deegan-Packel des gènes de l’UPR analysés dans des HAEC soumises à une séquence d’hypoxie-réoxygénation . . . 236
8.5 Score de perturbation TSNI des gènes de l’UPR analysés dans des HAEC soumises à une séquence d’hypoxie-réoxygénation. . . 236
8.6 Score de perturbation TSNI des gènes de l’UPR analysés dans des FME sou-mises à une séquence d’hypoxie-réoxygénation. . . 240
8.7 Indices de coopérativité de Deegan-Packel des gènes de l’UPR analysés dans des FME soumis à une séquence d’hypoxie-réoxygénation . . . 241
Liste des Abréviations
ADN Acide désoxyribonucléique
ADNc Acide désoxyribonucléique complémentaire
ADP Adénosine diphosphate
AEBSF 4-(2-aminoéthyl)benzenesulfonyl-fluoride Akt/PKB Protein kinase B
AMPK AMP-activated protein kinase
ANT Adenine nucleotide translocator
AP-1 Activator protein 1
APAF1 Apoptotic protease activating factor 1
ARE Anti-oxidant response element
ARN Acide ribonucléique
ARNm Acide ribonucléique messager
ASC Apoptosis-associates speck-like protein containing CARD ASK1 Apoptosis signal-regulating kinase 1
ATF4 Activating transcription factor 4 ATF6 Activating transcription factor 6
ATF6f Fragment N-terminal d’ATF6
ATP Adénosine triphosphate
AVC Accident vasculaire cérébral BAK BCL-2 antagonist or killer
BAX BCL-2-associated X protein
BCA Acide bicinchoninique
xxii Liste des tableaux
BFU Burst-forming unit
BI1 Bax inhibitor 1
BID BH3 interacting-domain death agonist BIM Bcl-2 interacting mediator of cell death BiP Ca2+-dissociated heavy-chain binding protein
BSA Bovine serum albumin
bZIP Basic leucine-zipper
CCL2 Chemokine (C-C motif) ligand 2
CE Cellule endothéliale
CFU Colony-forming unit
cGMP Cyclic guanosine monophosphate
CGRP Calcitonin gene-related peptide
CHOP C/EBP-homologous protein 10
cIAP Cellular inhibitor of apoptosis
CME Cellule murine embryonnaire
CRE cAMP responsive element
CREBH Cyclic AMP-responsive element-binding protein
CRP C reactive protein
CTSB Cathepsin B
DAMP Damage-associated molecular patterns
DEPC Diethyl pyrocarbonate
DHFR Dihydrofolate reductase
DISC Death-inducing signaling complex
DPIp Indice de Deegan-Packel
Liste des tableaux xxiii
ECL Electrochemiluminescence
ECM Extracellular matrix
EDEM ER degradation enhancer, mannosidase alpha-like EDTA Ethylène diamine tétra acétique
eEF2 Eukaryotic translation elongation factor 2 EGFR Epidermal growth factor receptor
eIF2α Eukaryotic translation initiation factor 2α EMSA Electrophoretic mobility shift assay eNOS endothelial nitric oxide synthase
ERAD Endoplasmic reticulum-associated protein degradation
Erdj Endoplasmic reticulum DnaJ homolog
ERK Extracellular signal-regulated kinases
ERN1 Endoplasmic reticulum to nucleus signaling 1 ERO1 ER membrane-associated oxidoreductin 1 ERSE Endoplasmic reticulum stress response element
ET1 Endothelin 1
FADD Fas-associated death domain
FKBP FK506 binding-protein 1A, 12kDa
FLICE FADD-like IL-1β-converting enzyme FLIPL FLICE-like inhibitory protein long isoform
FLK-1 Fetal liver kinase 1
FME Fibroblaste murin embryonnaire
FOXO Forkhead box O
GADD34 Growth arrest and DNA damage-inducible protein 34kDa GAPDH Glyceraldehyde 3-phosphate dehydrogenase
xxiv Liste des tableaux
GCN2 General control non derepressible 2
GEPA Génétique et expérimentation en productions animales
GFP Green fluorescent protein
GLUT-1 Glucose transporter 1 GLUT-3 Glucose transporter 3
GPX4 GSH peroxidase 4
GRP78 Glucose-regulated protein, 78kDa
GSH Glutathion réduit
GSSG Glutathion oxydé
HAEC Cellule endothéliale d’aorte humaine
HBS HIF-binding site
HerpUD Homocysteine-inducible, endoplasmic reticulum stress-inducible, ubiquitin-like domain
HH Hypoxie hypothemique
HIF Hypoxia-inducible factor
HLA Human leukocyte antigen
HMGB-1 High mobility group box 1
HO-1 Heme oxygenase 1
HR Hypoxie hypothermique–Réoxygénation normothermique
HRE Hypoxia responsive element
HRI Heme-regulated initiation factor 2α kinase
HRP Horseradish peroxidase
HSP Heat-shock protein
HSPA5 Heat shock protein 70 kDa protein 5 HUVEC Human umbilical vein endothelial cell
Liste des tableaux xxv
IκB Inhibitor of κB
ICAM-1 Intercellular adhesion molecule 1
IFN Interferon
IKK Kinase IκB
IL Interleukine
INRA Institut National de la Recherche Agronomique IP3R Inositol trisphosphate receptor
IPSC Incuded-pluripotent stem cells
IR Ischémie-reperfusion
IRE1 Inositol-requiring enzyme 1 ISR Integrated stress response
JNK c-Jun N-terminal kinases
KO Knock-out
L.C.I. Loi de composition interne
LMP Lysosomal membrane permeabilization
LPS Lipopolysaccharides
MAPK Mitogen-activated protein kinases
MASP Mannose-binding lectin-associated serine protease
MBL Mannose-binding lectin
MCP1 Monocyte chemotactic protein 1
MDM2 Murine double-minute 2
MET Microscopie électronique à transmission
MHC Major histocompatibility complex
miRNA Micro ribonucleic acid
xxvi Liste des tableaux
MOMP Mitochondrial outer membrane permeabilization MPT Pore de transition mitochondrial
mTOR Mammalian target of rapamycin
NADPH Nicotinamide adenine dinucleotide phosphate
NEMO NF–κB essential modulator
NFκB Nuclear factor-κB
NF-Y Nuclear factor Y
NK Natural killer
NLRP3 NOD-, LRR- and pyrin domain-containing 3
NO Oxyde nitrique
NOX NADPH oxydase
NQO1 NAD(P)H–quinone oxidoreductase 1
Nrf2 Nuclear factor erythroid 2-related factor
ODDD Oxygen-dependent degradation domain
PARP Poly(ADP-ribose) polymerase
PBA Sodium phenylbutyrate
PBS Phosphate buffered saline
PCR Polymerase chain reaction
PDI Protein disulfide isomerase
PERK Protein kinase RNA-like endoplasmic reticulum (ER) kinase
PHD Prolyl-4-hydroxylase
PIDD p53-induced protein with a death domain
PKC Protein kinase C
PKR Protein kinase, interferon-inducible double stranded RNA-dependent
Liste des tableaux xxvii
PP1 Protein phophatase 1
PRR Pattern-recognition receptors
PUMA p53 upregulated modulator of apoptosis PVDF Polyvinylidene difluoride
qPCR Quantitative polymerase chain reaction RAIDD RIP-associated protein with a death domain
RE Réticulum endoplasmique
RER Réticulum endoplasmique rugueux
rHRE RNA hypoxia response element
RIDD Regulated IRE1-dependent decay of mRNA
RIP Receptor-interacting protein RIPK Receptor-interacting protein kinase
RN Réoxygénation normothermique
RNase Activité endoribonucléase d’IRE1α
ROCK1 RHO-associated, coiled-coil containing protein kinase 1 ROS Espèces radicalaires oxygénées
RT-PCR Real time - Polymerase chain reaction
S1P Site 1 protease
S2P Site 2 protease
SDP Systèmes dynamiques polynomiaux
SDPp Systèmes dynamiques polynomiaux probabilistes SDRA Syndrome de détresse respiratoire aiguë
SERCA Sarcoplasmic/endoplasmic reticulum Ca2+transport–ATPase
siRNA Small interfering ribonucleic acid
xxviii Liste des tableaux
SREBP Sterol regulatory element-binding protein SSD Short series discretization
STF STF083010
tAIF Truncated apoptosis-inducing factor
TBE Tris – Borate – EDTA
TBS-T Tris Buffer Saline - Tween 20
TLR Toll-like receptors
TM Tunicamycine
TNFα Tumor necrosis factor α
TNFR Tumor necrosis factor α receptor
TRADD TNFR1-associated death domain
TRAF Tumor necrosis factor α receptor associated factor TSNI Time series network identification
TXNIP Thioredoxin-interacting protein uORF Untranslated open reading frame
UPR Unfolded protein response
UW University of Wisconsin
VCAM-1 Vascular cell adhesion molecule 1
VDAC Mitochondrial voltage-dependent anion-selective channels
VIH Virus de l’immunodéficience humaine
WB Western-Blot
XBP1 X box binding-protein 1
XBP1s Isoforme épissée de XBP1 XBP1u Isoforme non épissée de XBP1
Liste des tableaux xxix
XTT 2,3-bis-(2-methoxy-4-nitro-5-sulfophenyl)-2H-tetrazolium-5-carboxanilide
Première partie
Contexte et justifications de
l’étude
C
HAPITRE
1
La transplantation d’organes &
l’ischémie–reperfusion
Sommaire
1.1 Les grandes étapes de la transplantation et de la conservation d’organes . . . 4 1.1.1 Le chemin vers le succès de la transplantation rénale . . . 4 1.1.2 Les origines de la transplantation. . . 8 1.1.3 La méthode scientifique et la transplantation . . . 10 1.1.4 La régénération tissulaire . . . 10 1.1.5 Le phénomène de tolérance . . . 12 1.1.6 La conservation des organes . . . 13 1.1.7 La transplantation d’organes : la révolution du Dr CARREL Alexis . . . 18
L
A TRANSPLANTATIONest l’acte chirurgical consistant à apporter à un organisme re-ceveur un organe entier provenant d’un organisme donneur afin de remplacer l’or-gane ayant perdu sa fonction physiologique. Malgré un usage courant dans la société et également dans le cercle médical, le terme transplantation est à différencier de la greffe qui est l’acte chirurgical consistant à apporter un tissu ou une partie d’un organe à une per-sonne ou un animal ; par exemple la greffe de peau chez un patient présentant une brûlure du 3edegré étendue ou une greffe de moelle osseuse chez des patients présentant une aplasie médullaire.Dans ce chapitre, nous allons parcourir succinctement les développements de la trans-plantation d’organe et présenter le syndrome d’ischémie–reperfusion (IR) qui est le pro-cessus pathologique que nous avons étudié au cours de cette thèse. Nous parlerons
princi-4 Chapitre 1. La transplantation d’organes & l’ischémie–reperfusion
palement de la transplantation des organes solides axée volontairement sur la transplanta-tion rénale, ainsi, les greffes de tissus et de cellules souches ne seront pas ou peu abordées.
1.1 Les grandes étapes de la transplantation et de la
conser-vation d’organes
Les informations concernant cette partie sont principalement tirées du travail extra-ordinaire du chirurgien David HAMILTON qui est maintenant docteur honoris causa à la Medical School of St-Andrews University où il y enseigne l’Histoire de la Médecine. Les informations de cette partie sont principalement issues de son livre A History of Organ Transplantation [Hamilton 2012]. Cette partie est évidemment très loin d’être exhaustive et a seulement pour modeste dessein de sélectionner quelques-unes des grandes étapes de l’Histoire de la Transplantation. Nous conseillons vivement aux lecteurs désireux de la découvrir de façon exhaustive de se référer à cet ouvrage du Dr HAMILTON David [ Ha-milton 2012].
1.1.1 Le chemin vers le succès de la transplantation rénale
Lorsque nous discutons autour de nous, nous pouvons observer que dans l’opinion générale, la transplantation a débuté seulement au milieu du XXe. Il est vrai que c’est à partir de cette période que les succès les plus retentissants ont jailli : première transplan-tation rénale réussie en 1954 (équipe du Dr MURRAY Joseph), première transplantransplan-tation hépatique réussie en 1963 (équipe du Dr STARZL Thomas), première transplantation pan-créatique en 1966 (équipe des Drs LILLCH Richard et KELLY William) ou encore première transplantation cardiaque réussie en 1967 (équipe du Dr BARNARD Christiaan). Cepen-dant, ces réussites sont le résultat des nombreux travaux pionniers qui les ont précédés. Ils représentent donc la partie émergée de l’iceberg. . . Nous allons retracer brièvement le parcours de la transplantation rénale où de nombreuses étapes ont marqué le chemin vers la réussite médiatisée de 1954.
En 1902, le Dr ULLMANN Emerich (1861–1937) a réussi la première isotransplan-tation sur un chien en prélevant son rein et en l’anastomosant aux vaisseaux de son cou. Il observa une faible production d’urines [Ullmann 1902]. Cette même année, le
1.1. Les grandes étapes de la transplantation et de la conservation d’organes 5
Dr VON DECASTELLO Alfred (1872–1960) réussit la première allotransplantation rénale entre deux chiens [von Decastello 1902]. Trois ans plus tard, en 1905, le chirurgien rou-main Nicolas FLORESCO fit avancer la technique chirurgicale de la transplantation grâce à trois découvertes fondamentales : la première fût l’insertion de l’uretère du donneur dans la vessie du receveur lors de la transplantation ; la deuxième fut l’utilisation d’anticoagu-lants en testant l’ajout de têtes de sangsues (dont le principe actif, l’hirudine, était contenu dans leurs glandes salivaires), la peptone ou encore l’helicorubine ; et enfin, troisième-ment, il utilisa une solution saline (la solution de Locke) pour rincer le sang contenu dans le rein du donneur en démontrant que cela n’altérait pas la fonction du transplant [ Flo-resco 1905]. Deux ans plus tard, en 1907, le Dr STICH Rudolf a été le premier à positionner le transplant rénal en position hétérotopique au niveau du pelvis, technique qui est utili-sée de nos jours [Stich 1907]. Cette même année, le chirurgien parisien Théodor TUFFIER remarqua l’ébullition concernant la transplantation et déclara : «la transplantation des or-ganes est à l’ordre du jour».
À Lyon, c’était effectivement le cas et le Dr JABOULAY Matthieu (1860–1913) réa-lisa une xénotransplantation rénale sur l’Homme. Il la réaréa-lisa à partir d’une chèvre et d’un porc sur deux patients insuffisants rénaux chroniques en les transplantant sur leur bras. Les transplantations ont fonctionné immédiatement avec une diurèse de 1.5 L avant que n’apparaisse une thrombose du transplant au 3e jour [Jaboulay 1906]. En 1910, le Dr UNGER Ernst (1875–1938) utilisa un macaque, qui est le primate non humain le plus proche de l’Homme, pour réaliser une transplantation en bloc (c.-à-d., contenant une par-tie de l’aorte et de la veine cave) des deux reins sur une jeune fille atteinte d’insuffisance rénale terminale [Unger 1910]. Cependant, le rein ne produisit pas d’urine, probablement du fait des nombreux désordres métaboliques et cardiaques qui purent concourir à ré-duire la perfusion des reins. La patiente décéda 32 h plus tard. Pour la première fois, ces reins transplantés ont été analysés par microscopie par l’anatomopathologiste berlinois, le Pr BENDA Carl qui ne vit pas de signes de rejet «irréversible». À noter que la pre-mière étude anatomopathologique fût réalisée par deux successeurs du Dr JABOULAY, les Dr VILLARD Eugène et Dr PERRIN Émile qui ont publié la première micrographie d’un rein auto-transplanté [Villard & Perrin 1913] et que la première observation du rejet rénal humain fût réalisée par le Dr INGEBRIGTSEN Ragnvald (1882–1975) en Norvège où il
dé-6 Chapitre 1. La transplantation d’organes & l’ischémie–reperfusion
crivit pour la première fois l’infiltration et l’accumulation de lymphocytes dans les reins rejetés [Ingebrigtsen 1914]. La première transplantation entre humains a été réalisée en 1933 par le Dr VORONOI Yu (1895–1961) ; il transplanta un rein provenant d’un donneur cadavérique au niveau de l’aine [Voronoi 1933]. L’organe fût rejeté. Cependant, il est à no-ter qu’il était le premier à avoir vérifié l’état de santé du donneur avant la transplantation (tuberculose et syphilis). Deux explications de ce rejet sont possibles : la première était la durée prolongée d’ischémie tiède de 6 h (à l’époque, la pensée était de conserver l’organe à température corporelle pour préserver le principe de viabilité) ; la deuxième, connue du Dr VORONOI, était l’incompatibilité entre les groupes ABO (le receveur était du groupe O, c’est-à-dire ayant des anticorps anti-A et anti-B alors que le donneur était du groupe B, c’est-à-dire qu’il présentait l’antigène B) facilitant un rejet hyperaigu. Cependant, il n’y eut pas de rejet immédiat. Précisons que les premières transplantations rénales des années 1950 ont eu lieu sans vérification du groupe ABO ; le Dr STARZL Thomas – le père de la transplantation hépatique – et le Dr HUME David ont transplanté des reins de donneurs du B chez des receveurs du groupe O et A sans voir de rejet immédiat. L’Histoire de la transplantation rénale a également été marquée un soir de 1947, aux alentours de minuit, par trois jeunes chirurgiens, les Drs HUME David (1917–1973), HUFNAGEL Charles et le LANDSTEINER Ernest qui étaient réunis dans une petite salle à la lumière de leurs lampes frontales et qui ont tenté de traiter une patiente présentant une insuffisance rénale aiguë du post-partum en lui transplantant un rein provenant d’un patient décédé au ni-veau du coude, dans le même esprit que les premières xénotransplantations. La fonction rénale a été immédiate, mais au bout du 3ejour, la diurèse disparut et ils durent retirer l’organe. L’insuffisance rénale aiguë de la patiente se résolut trois jours plus tard sans que le rôle de l’allotransplantation y soit clairement attribué. Une série de 9 transplantations s’en est suivie à Boston de l’année 1951 à l’année 1953 [Hume et al. 1955]. Concernant le Dr VORONOI Yu, il réalisa ses dernières transplantations en 1949, mais, sous la contrainte du père de la greffe de cornée de 1931, le Dr FILATOV Vladimir (1875–1956), il dû trans-planter des reins humains conservés entre un jour et 20 jours, car le Dr FILATOV pensait que la préservation hypothermique était un «biostimulateur» augmentant la viabilité des cellules et favorisant ainsi la survie du transplant [Voronoi 1950].
transplan-1.1. Les grandes étapes de la transplantation et de la conservation d’organes 7
tation rénale à Chicago sur un patient atteint d’une polykystose rénale. Le transplant cadavérique survécut plusieurs mois, mais les résultats, pourtant pas clairs, ont été im-médiatement transmis à la communauté scientifique et aux médias. L’American Urology Association l’a d’ailleurs écarté de la scène pour avoir transmis comme vrais des résul-tats préliminaires bien que le public, lui, fût enthousiaste [Lawler et al. 1951]. Cette ini-tiative a encouragé les équipes de Paris et de Boston à continuer cet effort, préliminaire à la réussite de la transplantation rénale. Ils ont cependant retenu la leçon de ne pas faire de publicité et de retarder la publication des résultats, tout comme les présenta-tions dans les congrès, avant d’être certains des faits. La nouvelle de l’opération réali-sée par le Dr LAWLER fût transmise par France-Soir et les patients souffrants d’insuffi-sance rénale terminale commençaient à demander à être opérés de la même manière. Les neuf transplantations rénales parisiennes ont été réalisées dans trois centres : le centre médico-chirurgical Foch (équipe des Drs KÜSS René et LEGRAIN Marcel), l’hôpital Ne-cker (équipe des Drs OECONOMOS, DUBOST, AUVERT et du Pr HAMBURGER Jean) et l’autre à Créteil par le Dr SARTELLE. La première transplantation française fût réalisée en 1951 par les Drs DUBOST et SERVELLE où le donneur était un patient condamné à mort ; le temps entre la mort et le prélèvement fut de deux heures du fait du contexte peu favo-rable à ces opérations à l’époque. Les deux reins furent envoyés aux deux équipes, mais les transplants présentèrent une non-fonction primaire bien que l’étude anatomopatholo-gique n’ait pas montré de signes de rejet. Les résultats furent publiés, mais un confrère anonyme décria l’acte dans les journaux avec cette phrase cinglante : «Quand est-ce que nos collègues arrêteront d’expérimenter sur les êtres humains ?»
Les chirurgiens parisiens ont réussi la première transplantation à partir d’un donneur vivant qui était un proche du patient. Elle eut lieu le 26 décembre 1952 et fût dirigée par le Dr HAMBURGER Jean. Cela fit la une des tabloïdes nationaux et internationaux. Le transplant cessa de fonctionner 22 jours plus tard et le patient mourut peu de temps après [Michon et al. 1953]. L’enthousiasme français était à son apogée. Outre-Atlantique, c’est en 1954 que la première transplantation historique entre deux vrais jumeaux fût réa-lisée par l’équipe du Dr MURRAY Joseph qui avait repris la transplantation à Boston suite au départ du Dr HUME David. Nous voyons ainsi que le parcours vers le succès de la transplantation rénale fût long, fastidieux et que de nombreux succès n’ont pas eu la
cou-8 Chapitre 1. La transplantation d’organes & l’ischémie–reperfusion
verture médiatique qu’ils méritaient. Écartons-nous à présent de la transplantation rénale et parcourons quelques dates clés de l’Histoire de la transplantation d’organes.
1.1.2 Les origines de la transplantation
Des histoires relatant le remplacement magique d’organes perdus font partie du folk-lore de l’Ancien Monde et sont retrouvés de l’Islande jusqu’en Afrique. . . Le plus ancien écrit de remplacement de tissu connu à ce jour date du VIesiècle av. J.-C. : Su´sruta Samhita. Su´sruta était un chirurgien indien qui élabora la technique de la greffe de peau. Au début du XIXesiècle, cette technique antique était encore réalisée en Inde et a permis l’émer-gence de la chirurgie plastique en Europe. Parmi les grands évènements de la transplan-tation, nous pouvons citer la transplantation d’une jambe d’un éthiopien mort de froid à un patient ayant une jambe nécrosée par les Saints Côme (Saint patron des chirurgiens) et Damien (Saint patron des pharmaciens ; Figure1.2).
FIGURE1.2 –La transplantation de la jambe noire par les Saints Côme et Damien : une
1.1. Les grandes étapes de la transplantation et de la conservation d’organes 9
L’époque médiévale, associée à l’accumulation des connaissances séculaires et l’appari-tion de l’Humanisme a vu décliner les croyances en des forces supernaturelles permettant la restauration d’organes ou de tissus endommagés. François RABELAIS a tourné à la dé-rision ces croyances dans sa description satirique du remplacement de la tête d’Épistémon par Panurge dans son œuvre Pantagruel (1534) [Rabelais 1534]. Cette œuvre est intéres-sante du point de vue de la transplantation : il évoque l’antisepsie (avec l’usage du vin blanc pour nettoyer le cou d’Épistémon) et aussi la logique de la confrontation des parties anatomiques similaires afin de leur permettre de se régénérer (le tendon face au tendon, le spondyle face au spondyle et la veine face à la veine). Il évoque une méthode qui est encore à l’étude à l’heure actuelle, notamment dans notre laboratoire, sur la température de conservation de l’organe qu’il pense devoir être à température corporelle (37°C). Cette opinion a persisté jusqu’au milieu des années 1920 avant d’être abandonnée au profit de la conservation hypothermique (4°C). . . puis d’être de nouveau d’actualité [Brockmann et al.2009].
Quelques années plus tard, l’Italie vit naître un des pionniers de la transplantation, le célèbre chirurgien Tagliacozzi (1545–1599). Il publia un traité sur la réparation chirurgicale de la mutilation par la transplantation : De curtorum chirurgia per insitionem. Les patients de Tagliacozzi étaient des nobles. Au début, c’était à cause de la guerre ou de duels qu’ils venaient pour le remplacement de leur nez, de leurs oreilles ou de leurs lèvres perdus ou mutilés. Mais une nouvelle raison apparut : la syphilis (infection sexuellement trans-missible causée par Treponema pallidum, un micro-organisme de la famille des spirochètes) qui s’était propagée à travers l’Europe à partir de Naples. Tagliacozzi traitait d’abord la né-crose nasale puis traitait la syphilis par du mercure. Il présenta sa technique, avouant s’être inspiré de la tradition du père et du fils Branca (qui furent les premiers chirurgiens siciliens à réaliser l’acte de rhinoplastie) et des techniques tirées de l’horticulture (greffes de bour-geons) permettant la régénération de la peau à l’aide d’un lambeau pris sur le bras. Ses travaux ont été hautement décriés et ont ainsi été mis de côté jusque dans les années 1800. Le problème éthique des opérations de Tagliacozzi était qu’il utilisait des esclaves pour en récupérer leur nez afin de les transplanter sur ses nobles patients. Cela permettait, à condi-tion que la transplantacondi-tion réussisse, de rendre la liberté à l’esclave. L’esclave mourrait peu de temps après et il était dit que le greffon nasal mourrait au même moment. Cette histoire
10 Chapitre 1. La transplantation d’organes & l’ischémie–reperfusion
a amené le philosophe Tommaso CAMPANELLA (1568–1639) à énoncer qu’étant donné que l’âme et le corps sont indivisibles, la mort du donneur produit inévitablement la mort du greffon, peu importe la distance géographique séparant le donneur du greffon. Avec les connaissances actuelles, cet écrit peut prêter à sourire, car nous pouvons maintenant conserver des organes de façon relativement prolongée (moins de 4h pour le cœur et les poumons et jusqu’à 24h pour le rein) et leur survie suivant la transplantation, notamment pour les reins, est d’une vingtaine d’années en moyenne [Agence de la Biomédecine 2013].
1.1.3 La méthode scientifique et la transplantation
Jusqu’au XVIesiècle, la connaissance scientifique était obtenue de façon peu organi-sée. Les années 1600 ont été témoins de l’essor de l’investigation par l’expérimentation : l’unique étude des écrits anciens n’était plus vue comme unique source de progrès. C’est Francis BACON (1561–1626) qui dans son texte fondateur Novum organum (1620), décrit une nouvelle méthode permettant une structuration de l’innovation scientifique : les don-nées obtenues sont recueillies permettant alors une analyse pure aboutissant à une conclu-sion. Suite à la Révolution anglaise et à la guerre civile du milieu du XVIIe siècle, une refonte des institutions eut lieu avec notamment l’apparition de la Royal Society of Lon-don (qui est en réalité le College for the Promoting of Physico-Mathematical-Experimental Learning). La devise de la Société, basée sur la pensée baconienne, était claire :
Nullius in verba(“Ne croire personne sur parole”).
1.1.4 La régénération tissulaire
La réussite des transplantations actuelles n’aurait pas été possible sans les découvertes réalisées par certains grands scientifiques du XVIIIe: Abraham TREMBLEY (1710–1784) réalisa des travaux inestimables sur la régénération des hydres qu’il découvrit en analy-sant de l’eau douce au microscope. Cette espèce était en réalité déjà connue depuis 1702 sous le nom d’«animalcules» par le père de la microscopie, Antonie VON LEEUWEN-HOECK. Son approche méthodologique était nouvelle : pour convaincre les plus scep-tiques de ses résultats concernant la régénération des hydres, il avait rédigé un proto-cole d’ensemencement, d’observation et d’analyse des hydres, mais également réalisé une
1.1. Les grandes étapes de la transplantation et de la conservation d’organes 11
échantillothèque d’hydres qu’il envoyait à ses collègues afin qu’ils reproduisent ses tech-niques et qu’ils constatent par eux-mêmes les faits biologiques qu’il avait observés.
L’idée de régénérer les tissus au lieu d’en greffer de nouveaux était ainsi née. Abra-ham TREMBLEY a également été le premier à étudier les cellules souches qui sont ac-tuellement sur le devant de la scène notamment un type particulier de cellules différen-ciées reprogrammées en cellules souches appelées cellules souches pluripotentes induites (IPSC) [Robinton & Daley 2012]. Ces dernières sont issues de la dédifférenciation de cel-lules somatiques (par exemple des fibroblastes de peau) d’un patient en celcel-lules souches pluripotentes grâce à l’ajout de certains facteurs de transcription permettant leur repro-grammation. L’avantage est donc de produire des cellules souches autologues évitant tout risque de rejet lors de leur injection en vue de régénérer les tissus de ce patient.
Si dans un futur proche la régénération tissulaire devient une possibilité thérapeutique, les patients peuvent cependant bénéficier d’un traitement qui, depuis les années 1950 avec les travaux du Pr HAMBURGER Jean et auparavant par le Dr KOLFF Willem (1911–2009), a révolutionné la prise en charge des patients insuffisants rénaux : la dialyse ou rein arti-ficielqui permet d’éliminer les déchets azotés que le rein pathologique n’est plus capable d’éliminer. Là encore, ce succès n’aurait pu avoir lieu sans l’invention de son principe par un grand scientifique du XVIIIesiècle, Thomas GRAHAM (1805–1869) qui énonça sa Loi de diffusion des gaz. Notons que la technique de la fistule artérioveineuse utilisée en hémo-dialyse avait été créée bien avant par le neurologue Paul BROCA (1824–1880).
De nos jours, de nombreux chercheurs travaillent non plus à créer un rein artificiel (sauf à miniaturiser les appareils déjà existants), mais bien à créer de véritables organes à partir de cellules. D’encourageants, mais encore préliminaires, résultats ont été publiés concernant la génération d’un rein, d’un foie ou encore d’un poumon [Ott et al. 2010,Song et al.2013,Takebe et al. 2013]. Le procédé utilisé est la décellularisation de l’organe à l’aide d’un agent tensioactif (du SDS principalement) permettant d’obtenir la «charpente» fi-breuse puis l’ajout soit d’un mélange de cellules endothéliales (pour former les vaisseaux) et de cellules parenchymateuses (cellules tubulaires pour le rein, pneumocytes pour le poumon) soit d’IPSC pour générer l’organe.


![Tableau 4.4 – Multiplication dans Z/3Z . Explication : 2 × 2 = 1 car 4 = 1 × 3 + 1 = 1 [ 3 ] = 1](https://thumb-eu.123doks.com/thumbv2/123doknet/7918188.265161/131.892.409.505.165.267/tableau-multiplication-z-explication.webp)