Impact populationnel de la vaccination contre les
virus du papillome humain : revue systématique et
synthèse des prédictions de 16 modèles
mathématiques dynamiques
Mémoire
Élodie Bénard
Maîtrise en épidémiologie
Maître ès sciences (M.Sc.)
Québec, Canada
© Élodie Bénard, 2016
Impact populationnel de la vaccination contre les
virus du papillome humain : revue systématique et
synthèse des prédictions de 16 modèles
mathématiques dynamiques
Mémoire
Élodie Bénard
Sous la direction de :
iii
Résumé
Introduction: En 2015, 65 pays avaient des programmes de vaccination contre les VPH. La modélisation mathématique a joué un rôle crucial dans leur implantation.
Objectifs: Nous avons réalisé une revue systématique et analysé les prédictions de modèles mathématiques de l’efficacité populationnelle de la vaccination sur la prévalence des VPH-16/18/6/11 chez les femmes et les hommes, afin d’évaluer la robustesse/variabilité des prédictions concernant l’immunité de groupe, le bénéfice ajouté par la vaccination des garçons et l’élimination potentielle des VPH-16/18/6/11.
Méthodes: Nous avons cherché dans Medline/Embase afin d’identifier les modèles dynamiques simulant l’impact populationnel de la vaccination sur les infections par les VPH-16/18/6/11 chez les femmes et les hommes. Les équipes participantes ont réalisé des prédictions pour 19 simulations standardisées. Nous avons calculé la réduction relative de la prévalence (RRprev) 70 ans après l’introduction de la vaccination. Les résultats présentés
correspondent à la médiane(10ème;90èmeperccentiles) des prédictions. Les cibles de la
vaccination étaient les filles seulement ou les filles&garçons.
Résultats: 16/19 équipes éligibles ont transmis leurs prédictions. Lorsque 40% des filles sont vaccinées, la RRprev du VPH-16 est 53%(46%;68%) chez les femmes et
36%(28%;61%) chez les hommes. Lorsque 80% des filles sont vaccinées, la RRprev est
93%(90%;100%) chez les femmes et 83%(75%;100%) chez les hommes. Vacciner aussi les garçons augmente la RRprev de 18%(13%;32%) chez les femmes et 35%(27%;39%) chez les
hommes à 40% de couverture, et 7%(0%;10%) et 16%(1%;25%) à 80% de couverture. Les RRprev étaient plus élevées pour les VPH-18/6/11 (vs. VPH-16). Si 80% des filles&garçons
sont vaccinés, les VPH-16/18/6/11 pourraient être éliminés.
Interprétation: Même si les modèles diffèrent entre eux, les prédictions s’accordent sur: 1)immunité de groupe élevée même à basse couverture, 2)RRprev supérieures pour les
iv
qu’ajouter les garçons, 4)vacciner 80% des filles&garçons pourraient éliminer les VPH-16/18/6/11.
v
Abstract
Background: As of 2015, 65 countries have introduced HPV vaccination programmes. Mathematical models have played a key role in the implementation of these programmes.
Objectives: We conducted a systematic review and pooled-analysis of model predictions of population-level effectiveness of HPV vaccination against HPV-16/18/6/11 infection in women and men, to examine the robustness/variability of predicted populationnal effects, incremental benefit of vaccinating boys, and potential for HPV vaccine-type elimination.
Methods: We searched Medline and Embase (2009-2015) for transmission-dynamic modeling studies predicting the population-level impact of vaccination on HPV-16/18/6/11 infections among women and men in high-income countries. Participating modeling teams produced predictions for 19 standardized scenarios. We derived pooled relative reduction in HPV prevalence (RRprev) 70 years after vaccination, using the median (10th;90thpercentile)
of model predictions. Strategies investigated were Girls-Only and Girls&Boys vaccination at 12 years of age.
Findings: 16/19 eligible models, from ten high-income countries provided predictions. With 40% Girls-Only vaccination coverage, HPV-16 RRprev among women and men was
53%(46%;68%) and 36%(28%;61%), respectively. With 80% Girls-Only vaccination coverage, HPV-16 RRprev among women and men was 93%(90%;100%) and
83%(75%;100%), respectively. Vaccinating boys in addition to girls increased HPV-16 RRprev among women and men by 18%(13%;32%) and 35%(27%;39%) for 40% coverage,
and 7%(0%;10%) and 16%(1%;25%) for 80% coverage, respectively. RRprev were greater
for HPV-18/6/11 than HPV-16 for all scenarios. Finally at 80% coverage, most models predicted that Girls&Boys vaccination would eliminate HPV-16/18/6/11, with a median RRprev of 100% for women and men for all types.
Interpretation: Although HPV models differ in structure, data used for calibration and setting, population-level predictions were generally concordant: 1) strong herd effects from
vi
vaccinating Girls-Only, even with low coverage, 2) greater post-vaccination reductions in HPV-18/6/11 infection (vs. HPV-16), 3) increasing coverage in girls provides greater impact than including boys, and 4) reaching 80% coverage in Girls&Boys could eliminate HPV-16/18/6/11.
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... x
Liste des figures ... xi
Remerciements ... xii
Introduction ... 1
Objectifs ... 4
Revue de la littérature ... 5
1. Épidémiologie des VPH ... 5
1.1. Les virus du papillome humain ... 5
1.2. Infections aux différents sites anatomiques ... 5
1.2.1. Génital ... 5
1.2.2. Autres sites ... 6
1.2.3. Durée des infections par les VPH ... 7
2. Maladies liées aux VPH ... 8
2.1. Cancer du col de l’utérus ... 8
2.1.1. VPH et cancer du col de l’utérus ... 8
2.1.2. Histoire naturelle ... 8
2.1.3. Épidémiologie ... 10
2.2. Autres cancers liés aux VPH ... 11
2.3. Condylomes ... 12
3. Lutte contre les infections par les VPH ... 13
3.1. Les différents types de prévention ... 13
3.2. Les vaccins contre les VPH ... 14
3.2.1. Concept d’immunité de groupe ... 14
3.2.2. Le taux de reproduction de base (R0) ... 14
3.2.2. Description des vaccins contre le VPH ... 15
3.2.3. Résultats d’études cliniques ... 16
3.2.4. Programmes de vaccination ... 19
3.3. Dépistage du cancer du col de l’utérus... 20
3.3.1. Programmes de dépistage ... 20
viii
3.3.3. Avenir des programmes de dépistage ... 23
4. Facteurs de risque ... 23
4.1. Infections par les VPH ... 23
4.2. Cancer du col de l’utérus ... 24
5. Les modèles mathématiques en général ... 24
5.1. Les attributs généraux des modèles ... 24
5.2. La population dans les modèles ... 25
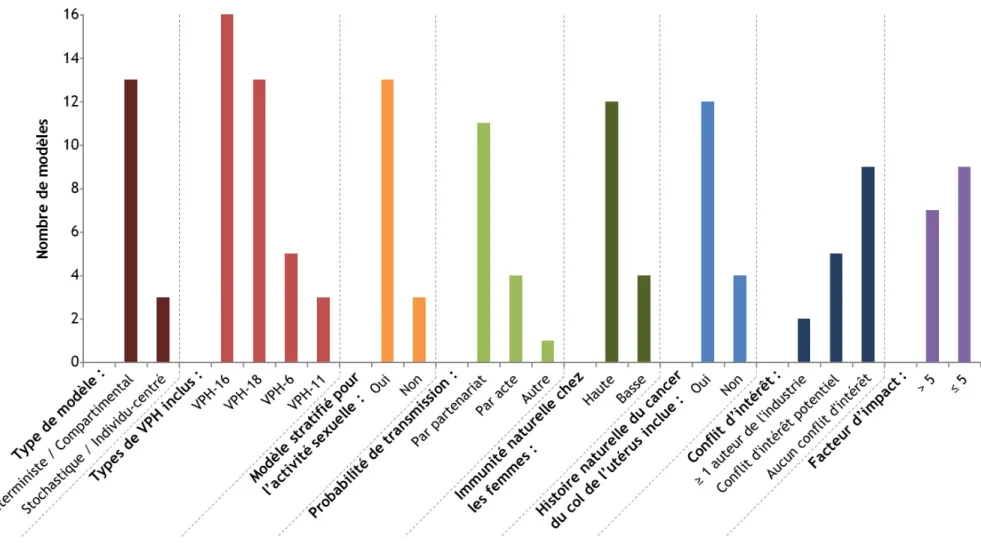
6. Les modèles mathématiques qui simulent les effets populationnels de la vaccination contre les VPH ... 26
6.1. La population ... 26
6.2. Paramètres de transmission et d’infection des VPH ... 26
6.2.1. Partenariat et probabilité de transmission du VPH ... 26
6.2.2. Types de VPH inclus dans le modèle ... 27
6.3. Caractéristiques des vaccins modélisés ... 27
6.3.1. Efficacité vaccinale... 27
6.3.2. Durée de protection du vaccin ... 28
6.4. Données utilisées lors de la calibration ... 28
Méthodes ... 30
1. Stratégie de recherche des articles et critères de sélection ... 30
2. Collecte, production de données et évaluation de la qualité des études ... 31
2.1. Développement des outils de collecte des données ... 31
2.1.1. Questionnaire des caractéristiques des modèles ... 31
2.1.2. Simulations standardisées ... 32
2.2. Évaluation de la qualité des études ... 34
2.3. Production de données ... 34
3. Analyses des données ... 35
4. Ma contribution ... 37
Résultats ... 38
1. Études identifiées et sélectionnées ... 38
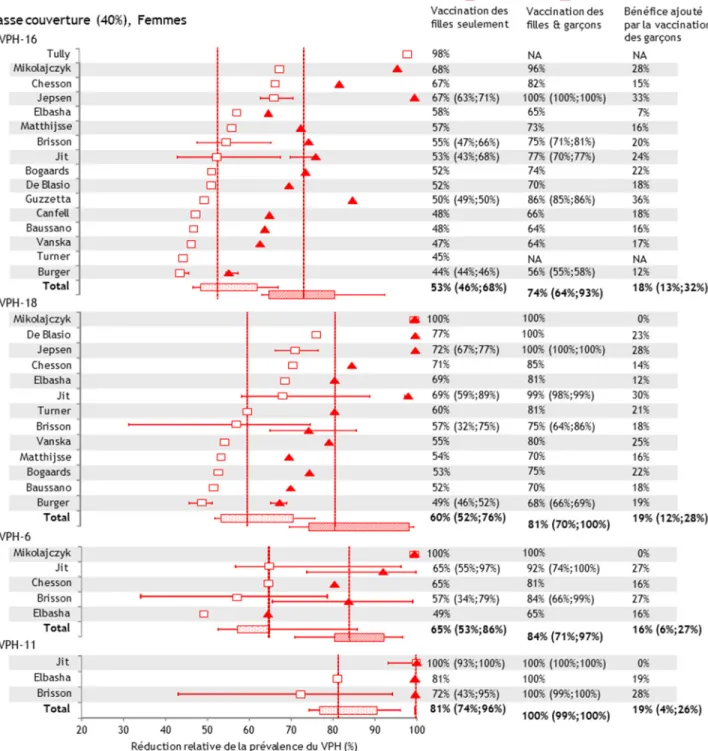
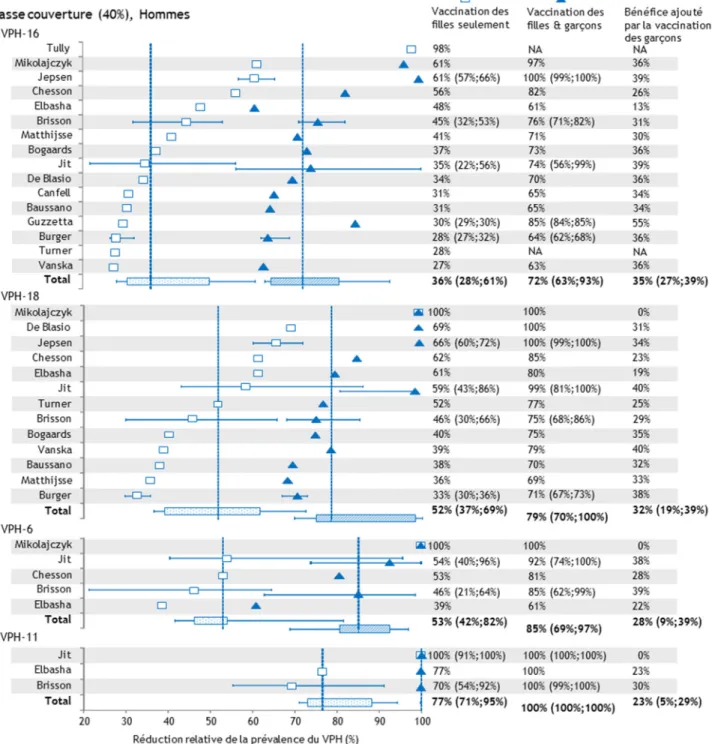
2. Impact populationnel de la vaccination après 70 ans pour un contexte de basse couverture vaccinale (40%) ... 45
3. Impact populationnel de la vaccination après 70 ans dans un contexte de haute couverture vaccinale (80%) ... 48
4. Influence de la couverture vaccinale sur l’efficacité populationnelle de la vaccination ... 51
ix
5. Analyses de sensibilité ... 53
6. Identification des sources d’hétérogénéité entre les prédictions des modèles ... 55
Discussion ... 62
1. Validité et robustesse des prédictions ... 62
2. Élimination potentielle des VPH ... 65
3. Implication de l’immunité de groupe dans les politiques de santé publique ... 66
4. Généralisation ... 67 5. Limites ... 67 6. Forces ... 68 Conclusion ... 70 Références ... 71 ANNEXES ... 86
Annexe I : Stratégies de recherche ... 87
Annexe II : Questionnaire de description des modèles ... 88
x
Liste des tableaux
Tableau 1 : Résumé des prévalences des infections par les VPH selon le type, le genre et le site d’infection (données de l’Amérique du Nord) ... 7 Tableau 2 : Évolution des lésions précancéreuses ... 10 Tableau 3 : Nombre total de cancers diagnostiqués dans un site relié aux VPH et pourcentage des cancers attribués aux VPH, en 2008 en Amérique du Nord ... 12 Tableau 4 : Composition d’une dose de vaccin (0,5 mL) ... 16 Tableau 5 : Efficacité vaccinale (EV) et protection croisée des vaccins bivalent chez les femmes et quadrivalent chez les femmes et les hommes ... 18 Tableau 6 : Résumé des recommandations les plus récentes selon le diagnostic cytologique et l’âge des femmes au Québec ... 22 Tableau 7 : Description des simulations ... 33 Tableau 8 : Caractéristiques des modèles inclus dans la revue systématique ... 41 Tableau 9 : Réduction de la prévalence chez les femmes et les hommes pour 80% des filles vaccinées versus 40% des filles et 40% des garçons vaccinés ... 51 Tableau 10 : Sources potentielles d’hétérogénéité entre les prédictions de la réduction relative de la prévalence (RRprev) du VPH-16 : méta-régression univariée. ... 56
Annexe III : Résumés des prédictions des modèles de la réduction relative de la prévalence du VPH (RRprev) 70 ans après le début de la vaccination pour différentes stratégies de
vaccination ... 92
xi
Liste des figures
Figure 1 : Histoire naturelle du cancer du col de l’utérus ... 9 Figure 2 : Identification et sélection des modèles ... 39 Figure 3 : Classification des modèles inclus dans la revue systématique. ... 40 Figure 4 : Prédictions des modèles de la réduction relative de la prévalence des VPH-16, 18, 6 et 11 chez les femmes pour une couverture vaccinale de 40%, 70 ans après le début de la vaccination. ... 46 Figure 5 : Prédictions des modèles de la réduction relative de la prévalence des VPH-16, 18, 6 et 11 chez les hommes pour une couverture vaccinale de 40%, 70 ans après le début de la vaccination. ... 47 Figure 6 : Prédictions des modèles de la réduction relative de la prévalence des VPH-16, 18, 6 et 11 chez les femmes pour une couverture vaccinale de 80%, 70 ans après le début de la vaccination. ... 49 Figure 7 : Prédictions des modèles de la réduction relative de la prévalence des VPH-16, 18, 6 et 11 chez les hommes pour une couverture vaccinale de 80%, 70 ans après le début de la vaccination. ... 50 Figure 8 : Résumés des prédictions des modèles selon la couverture et le type de VPH. .... 52 Figure 9 : Résultats des analyses de sensibilité pour le VPH-16 chez les femmes et les hommes. ... 54 Figure 10 : Résultats des analyses stratifiées selon l’activité sexuelle et l’immunité naturelle développée par les femmes pour le VPH-16 chez les femmes et les hommes. ... 61 Annexe IV : Résumés des prédictions des modèles de la réduction relative de la prévalence du VPH au cours du temps ... 96 Annexe V : Délais entre deux partenariats successifs dans les modèles où les partenariats sont instantanés et dans les modèles qui tiennent compte de la durée des partenariats ... 98
xii
Remerciements
Je tiens tout d’abord à remercier mon directeur de recherche, Marc Brisson. Merci pour son soutien tout au long de mes travaux, pour ses conseils, ses idées et pour sa rigueur scientifique. Merci de m’avoir fait confiance pour réaliser ce projet.
Un grand merci à Mélanie Drolet qui est un véritable pilier dans notre équipe. Elle est une source de motivation et un modèle d’inspiration. Merci pour ses encouragements, ses conseils, sa disponibilité et sa gentillesse.
Je souhaite également remercier Jean-François Laprise et Talia Malagon qui ont toujours répondu présents quand j’avais besoin de leur aide. Merci aussi à Myrto Mondor pour son aide, sa patience et sa disponibilité.
Merci à tous les membres qui font de notre équipe, une équipe dynamique et sympathique dans laquelle il fait bon travailler.
Finalement, je remercie aussi ma famille, particulièrement ma mère, qui, malgré la distance, m’a toujours soutenue et encouragée.
1
Introduction
Les infections par les virus du papillome humain (VPH) sont parmi les infections sexuellement transmissibles les plus courantes, plus de 40 types de VPH peuvent infecter le tractus anogénital (1). Ces virus sont reconnus comme étant une cause nécessaire du cancer du col de l’utérus (1-3), le 4ème cancer le plus commun parmi les femmes dans le monde après les cancers du sein, du colon et du poumon (4). En 2012, le fardeau du cancer du col de l’utérus était estimé à plus de 528 000 nouveaux cas et 266 000 décès mondialement (4). Les VPH sont aussi associés aux cancers anogénitaux (vulve, anus, vagin, pénis), aux cancers oropharyngés et sont la cause de condylomes anogénitaux (5-9). Trois vaccins contre les VPH ont été développés et parmi eux, le vaccin le plus utilisé présentement dans les programmes de vaccination est le vaccin quadrivalent qui protège contre les VPH-16, 18, 6 et 11 (10). Les types 16 et 18 sont responsables d’environ 70% des cancers du col de l’utérus et les types 6 et 11 sont associés à plus de 85% des condylomes anogénitaux (11, 12).
La vaccination semble être la voie la plus prometteuse pour réduire le fardeau des maladies liées aux VPH. En effet, la vaccination contre les maladies infectieuses présente une caractéristique unique : la vaccination à grande échelle ne permet pas uniquement de réduire l’incidence de la maladie chez les personnes immunisées, elle protège également indirectement les personnes non vaccinées contre l’infection (immunité de groupe) (13, 14). En 2015, 65 pays avaient mis en place des programmes de vaccination contre les VPH ciblant les jeunes filles et quelques pays incluent également les garçons dans leur programme (15-19). La décision de ces pays de mettre en place des programmes de vaccination était basée sur l’innocuité et l’efficacité du vaccin démontrées dans des études cliniques randomisées, ainsi que sur les prédictions d’efficacité populationnelles et de coût-efficacité issues des modèles mathématiques.
Plus de 40 modèles ont été développés afin de guider les décisions en matière de vaccination contre les VPH (20-23). Parmi la gamme de modèles utilisés, certains, relativement simples, ne considéraient que les effets directs de la vaccination chez les
2
jeunes filles vaccinées, alors que d’autres, plus complexes, considéraient également les effets indirects chez les personnes non-vaccinées (immunité de groupe chez les garçons, les femmes plus âgées et les filles non-vaccinées) (20-23). Les modèles qui permettent de reproduire les effets de l’immunité de groupe sont dits dynamiques. Tous les modèles ont prédit que la vaccination des filles pourrait considérablement réduire le fardeau des maladies liées aux VPH parmi les filles vaccinées (20, 21, 24). La concordance des prédictions des modèles concernant les effets directs de la vaccination s’explique par le fait que les effets directs dépendent de facteurs connus et bien documentés, tels que l’efficacité vaccinale et la proportion de maladies liées aux VPH causées par les types vaccinaux (25). Cependant, les modèles ont produit des résultats plus variables concernant l’impact additionnel de la vaccination des garçons (26-29). En effet, le bénéfice marginal de la vaccination des garçons dépend de l’amplitude de l’immunité de groupe engendrée par la vaccination des filles (30-32). Or, il reste encore beaucoup d’incertitudes quant aux effets indirects de la vaccination et plusieurs questions liées à l’immunité de groupe se posent encore, telles que l’impact de la vaccination des jeunes filles sur les personnes non-vaccinées (par exemple, garçons et femmes plus âgées), l’amplitude de l’immunité de groupe, la vitesse à laquelle apparaîtront les bénéfices de l’immunité de groupe, et la couverture vaccinale qui doit être atteinte pour observer les effets de l’immunité de groupe (32-34).
L’immunité de groupe a joué un rôle clé dans le succès de stratégies de vaccination dans le passé et a mené à l’élimination de plusieurs maladies dans certains pays (35-38). Une meilleure compréhension des effets populationnels à long terme de la vaccination contre les VPH est cruciale afin de guider les décisions concernant les stratégies de vaccination. Les modèles mathématiques permettent d’étudier les questions liées aux effets populationnels de la vaccination qui ne peuvent faire l’objet d’études épidémiologiques classiques. Cependant, même si les modèles mathématiques sont de puissants outils, ils reposent sur de nombreuses simplifications et hypothèses, pouvant mener à questionner la validité et la robustesse des prédictions. La question suivante reste jusqu’à maintenant sans réponse : les modèles mathématiques de la transmission des VPH donnent-ils des résultats cohérents entre eux et des conclusions générales peuvent-elles en être tirées, particulièrement en ce
3
4
Objectifs
L’objectif principal de cette étude est de synthétiser et comparer les prédictions de différents modèles mathématiques dynamiques des effets à long terme de la vaccination contre les VPH sur la prévalence des infections par les VPH-16, 18, 6 et/ou 11 chez les femmes et les hommes de pays à revenus élevés.
Les objectifs spécifiques sont :
1. Identifier de façon systématique les différents modèles mathématiques dynamiques qui simulent les effets de la vaccination contre les VPH dans les pays à revenus élevés. 2. Décrire et comparer les prédictions des modèles afin de : 1) quantifier les effets directs
de la vaccination et l’immunité de groupe engendrée par la vaccination des filles seulement chez les femmes et les hommes, 2) évaluer l’impact additionnel de vacciner les garçons sur la prévalence des VPH-16, 18, 6 et 11 chez les femmes et les hommes et 3) évaluer le potentiel d’élimination des VPH-16, 18, 6 et 11 chez les femmes et les hommes suite à la vaccination.
5
Revue de la littérature
1. Épidémiologie des VPH1.1. Les virus du papillome humain
Les infections par les VPH sont les infections sexuellement transmissibles les plus courantes dans le monde (39-41). Il existe plus d’une centaine de génotypes de VPH (42). Les VPH dits muqueux peuvent infecter les cellules basales de l’épithélium des muqueuses anogénitales, de la bouche, de la gorge et des voies respiratoires (42). Ces VPH sont associés à diverses maladies, allant de verrues au cancer. Ils sont classés en deux groupes selon leur potentiel oncogénique : les VPH à haut risque qui incluent, par exemple, les VPH-16, 18, 31, 33, 45, 52, 58; et les VPH à faible risque parmi lesquels on retrouve, entre autres, les VPH-6 et 11 (43). La transmission du VPH se fait majoritairement lors des contacts sexuels (44). Plus de 40 génotypes de VPH muqueux peuvent ainsi infecter le tractus anogénital (44).
1.2. Infections aux différents sites anatomiques
1.2.1. Génital
En Amérique du Nord, la prévalence des VPH, tous types confondus, au site génital est globalement plus élevée chez les hommes (18-70 ans) que chez les femmes (14-69 ans) : 40-61% et 20-30% respectivement (45-51). Parmi les VPH à haut risque, la prévalence du VPH-16 est de 5-11% chez les hommes et 1-4% chez les femmes et celle du VPH-18 est de 0.5-3% chez les hommes et 0.4-3% chez les femmes (45-50, 52). Parmi les VPH à faible risque, la prévalence du VPH-6 est de 2-6% chez les hommes et 1-2% chez les femmes et pour le VPH-11, la prévalence est inférieure à 1% à la fois chez les hommes et les femmes (45-50, 52) (tableau 1).
6
L’âge semble avoir une faible influence sur la prévalence chez les hommes, alors que chez les femmes, la prévalence varie beaucoup avec l’âge. En effet, la prévalence des VPH tous types atteint un pic de 45-50% chez les femmes autour de 20 ans et diminue ensuite graduellement jusqu’à moins de 3% chez les femmes âgées de plus de 65 ans (46, 53-55). Chez les hommes âgées entre 18 et 70 ans, l’écart entre les prévalences des différents groupes d’âges ne dépasse pas 10% (45, 47, 48).
1.2.2. Autres sites
Les VPH peuvent également infecter le site anal et le site oral. Les infections anales sont fréquentes tant chez les femmes que les hommes. Les études menées chez les femmes ont montré que les prévalences des VPH, tous types confondus, sont comparables au site génital (20-30%) et au site anal (27-32%) (46, 49, 50, 56, 57). Comme pour les infections génitales, la prévalence des infections anales chez les femmes diminue avec l’âge (58). Chez les hommes, la prévalence des VPH au site anal varie considérablement selon l’orientation sexuelle (59-61). En effet, la prévalence des VPH, tous types confondus, est beaucoup plus élevée chez les hommes ayant des relations sexuelles avec d’autres hommes (HARSAH, 51-75%) que chez les hommes ayant des relations sexuelles uniquement avec des femmes (HARSAF, 10-25%) (48, 53, 59, 61-63). Au site oral, les prévalences observées chez les hommes et les femmes sont semblables, entre 2% et 7% (51, 64-67). La prévalence des infections par les VPH au site oral, tous types confondus, varie en fonction de l’âge : on observe des pics de la prévalence chez les individus des deux genres âgés de 30-34 ans (7.4%) et 60-64 ans (11.4%) (67).
7
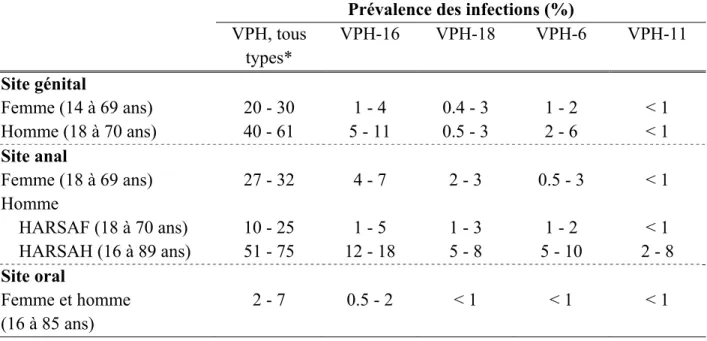
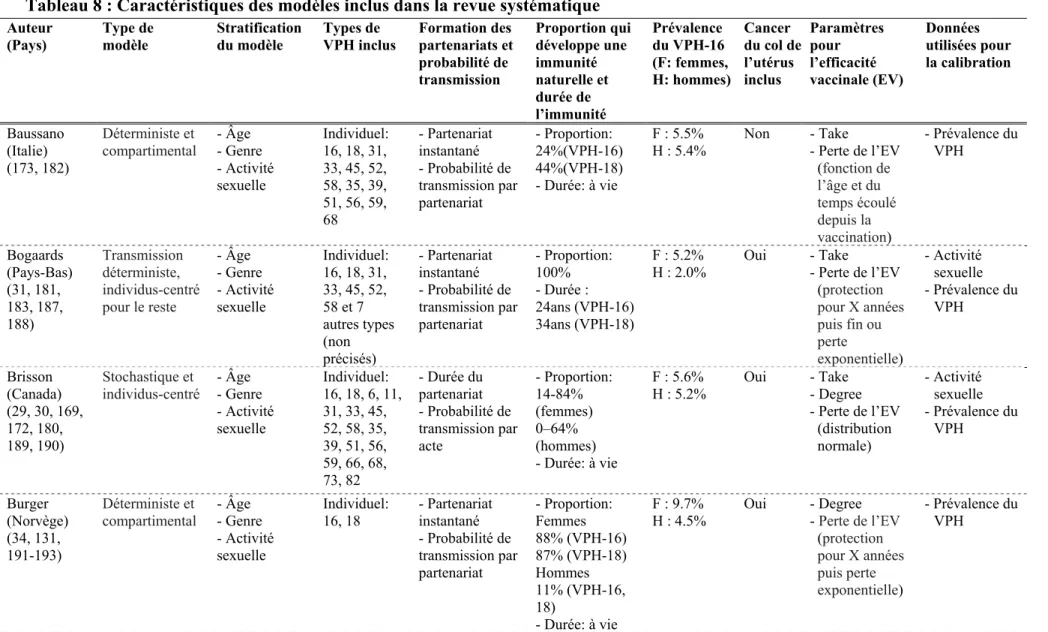
Tableau 1 : Résumé des prévalences des infections par les VPH selon le type, le genre et le site d’infection (données de l’Amérique du Nord) (45-51, 57-59, 61-69)
Prévalence des infections (%)
VPH, tous types* VPH-16 VPH-18 VPH-6 VPH-11 Site génital Femme (14 à 69 ans) 20 - 30 1 - 4 0.4 - 3 1 - 2 < 1 Homme (18 à 70 ans) 40 - 61 5 - 11 0.5 - 3 2 - 6 < 1 Site anal Femme (18 à 69 ans) 27 - 32 4 - 7 2 - 3 0.5 - 3 < 1 Homme HARSAF (18 à 70 ans) 10 - 25 1 - 5 1 - 3 1 - 2 < 1 HARSAH (16 à 89 ans) 51 - 75 12 - 18 5 - 8 5 - 10 2 - 8 Site oral Femme et homme (16 à 85 ans) 2 - 7 0.5 - 2 < 1 < 1 < 1 *inclus : VPH 16, 18, 6, 11, 31, 33, 45, 52, 58, 84, 62, 61, 83, 54, 81, 55, 42, 72, 40, 71, 53, 51, 70, 39, 73, 68, 56, 59, 66, 82, 67
1.2.3. Durée des infections par les VPH
Quel que soit le site de l’infection, environ 90% des infections par les VPH durent moins de 2 ans et sont éliminées naturellement (54, 70, 71). Les durées médianes d’infection sont similaires chez les hommes et les femmes, elles ont été estimées entre 4 et 20 mois, les VPH à haut risque ayant des durées d’infection plus longues que les VPH à faible risque (70, 72-78).
8 2. Maladies liées aux VPH
2.1. Cancer du col de l’utérus
Les principaux types de cancer du col de l’utérus sont le carcinome épidermoïde et l’adénocarcinome. Le carcinome épidermoïde se développe à partir de cellules aplaties et minces, les cellules malpighiennes, qui recouvrent l’extérieur du col de l’utérus; alors que l’adénocarcinome se développe à partir des cellules glandulaires qui produisent du mucus et tapissent l’intérieur du col. Le carcinome épidermoïde est le type de cancer du col le plus fréquemment rencontré, il représente plus de 80% des cas (79).
2.1.1. VPH et cancer du col de l’utérus
L’infection par les VPH est pratiquement toujours associée au cancer du col de l’utérus : plus de 99% des échantillons de cancers analysés contiennent de l’ADN de VPH (2, 80). Il est maintenant reconnu que l’infection par les VPH est une cause nécessaire au développement du cancer du col de l’utérus (1-3, 43, 80). Les VPH-16 et 18 ont les potentiels oncogéniques les plus élevés, ils sont associés à 70% des cas de cancer du col de l’utérus (42, 43). Le VPH-16 est lié à 49-59% des cas, il est surtout retrouvé chez les femmes de moins de 40 ans et dans les tumeurs plus différenciées (1, 3, 43). Le VPH-18 est associé à 12-36% des cas de cancers du col de l’utérus, particulièrement des adénocarcinomes (1, 3, 43). Les VPH-31, 33, 45, 52 et 58 sont associés à environ 20% des cancers du col (43, 81). Ces 9 génotypes (16, 18, 31, 33, 45, 52 et 58) sont responsables de 90% des cas de cancers du col de l’utérus (43, 81).
2.1.2. Histoire naturelle
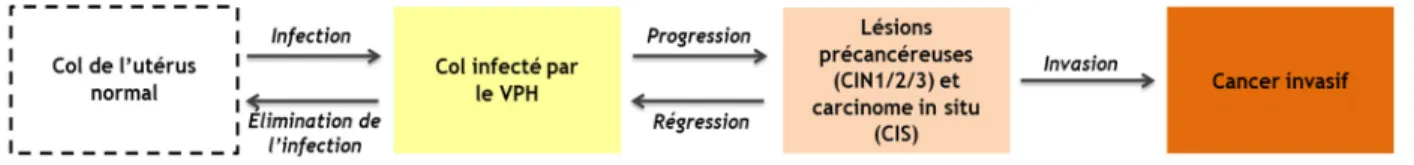
L’histoire naturelle du cancer du col de l’utérus débute par l’infection par les VPH, elle passe ensuite par différents grades de lésions précancéreuses pour progresser vers le cancer. La progression de l’histoire naturelle du cancer du col est lente; plusieurs décennies peuvent s’écouler entre l’infection et le cancer invasif (figure 1).
9
Figure 1 : Histoire naturelle du cancer du col de l’utérus
CIN : néoplasies cervicales intraépithéliales.
Si une infection persiste pendant plus de 4 ans, il y a très peu de chance qu’elle régresse naturellement (74, 80, 82). Ces infections, dites « persistantes », ont un risque élevé de progression vers les lésions précancéreuses et les cancers (80, 83-86).
Les lésions précancéreuses sont appelées néoplasies cervicales intraépithéliales (CIN). Les CIN sont classées de CIN1 à CIN3 en fonction du degré de transformation des cellules. Lorsque seules les cellules basales de la muqueuse du col sont concernées (1/3 de l’épithélium) on parle de CIN1; lorsque les 2/3 de l’épithélium sont constitués de cellules anormales, il s’agit de CIN2 et quand plus des 2/3 de l’épithélium sont concernés on parle de CIN3, voire de carcinome in situ (CIS) quand la totalité de l’épithélium est remplacé par des cellules anormales. Quand les cellules anormales dépassent la membrane basale, on parle de cancer invasif.
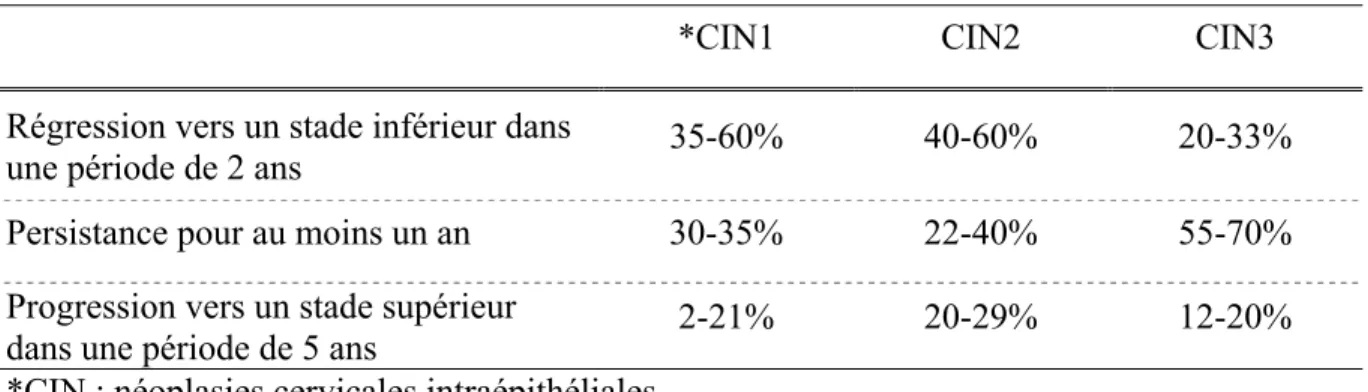
Les lésions précancéreuses peuvent régresser vers un stade inférieur, certaines lésions peuvent ainsi disparaitre naturellement. C’est le cas, par exemple, de la majorité des CIN1, ces lésions sont les plus fréquemment observées et elles disparaissent généralement d’elles-mêmes (87-92). Cependant, il y a des lésions qui ne régressent pas naturellement, elles sont alors dites persistantes. De plus, une partie des lésions va également progresser vers un stade supérieur. Par exemple, on estime que 2-21% des CIN1 vont évoluer vers des CIN2/3, 20-29% des CIN2 vont progresser vers des CIN3 et 12-20% des CIN3 vont mener à un cancer invasif (tableau 2) (87-92).
10
Tableau 2 : Évolution des lésions précancéreuses (87-92)
*CIN1 CIN2 CIN3 Régression vers un stade inférieur dans
une période de 2 ans 35-60% 40-60% 20-33%
Persistance pour au moins un an 30-35% 22-40% 55-70% Progression vers un stade supérieur
dans une période de 5 ans 2-21% 20-29% 12-20%
*CIN : néoplasies cervicales intraépithéliales.
Les cancers du col de l’utérus sont classés en différents stades selon l’état d’avancement de la maladie. La classification la plus utilisée est celle de la Fédération internationale de gynécologie et d'obstétrique (FIGO) qui classe le cancer du col de l’utérus en quatre stades : au stade I, le cancer est limité au col utérin; au stade II, le cancer s’étend au-delà du col, il affecte au maximum les 2/3 supérieurs du vagin mais n’atteint pas la paroi pelvienne; au stade III, le cancer a envahi le dernier tiers du vagin et possiblement la paroi pelvienne; et au stade IV, le cancer a envahi la paroi pelvienne, il affecte les muqueuses de la vessie, du rectum ou s’est propagé au-delà du bassin (11, 79). La probabilité de survie est grandement affectée par le stade auquel la maladie est diagnostiquée. Dans les pays développés, la probabilité de survie à 5 ans est 80-90% pour le stade I, 50-65% pour le stade II, 25-35% pour le stade III et 0-15% pour le stade IV (93).
2.1.3. Épidémiologie
Le cancer du col de l’utérus est le 4ème cancer le plus commun parmi les femmes dans le monde après les cancers du sein, du colon et du poumon (4). En 2012, on estimait le fardeau du cancer du col de l’utérus à plus de 528 000 nouveaux cas et 266 000 décès mondialement (4). Environ 85% des cas sont retrouvés dans les pays en voie de développement où le cancer du col de l’utérus représente 15% des cas de cancers diagnostiqués chez la femme (4). Les taux d’incidence les plus élevés sont observés en Amérique Latine (33.5 / 100 000 femme-années), en Afrique subsaharienne (31.0 / 100 000 femme-années), et en Asie (18.3 à 26.5 / 100 000 femme-années) (94). Dans les pays
11
développés, le cancer du col de l’utérus représente 3.5% des cancers féminins (94). Les taux d’incidence les plus faibles (moins de 15.0 / 100 000 femme-années) sont observés en Europe, en Amérique du Nord et au Japon (94). Les différences dans les taux d’incidence entre les pays développés et en développement sont dues principalement à la mise en place de programmes de dépistage dans les pays développés. Au Canada, en 2012, le nombre de nouveaux cas de cancer du col de l’utérus était de 1350 et le nombre de décès associés de 390, le taux d’incidence standardisé pour l’âge a été estimé à 7.6 / 100 000 femme-années (4). Toujours au Canada, le risque à vie de développer un cancer du col de l’utérus a été évalué à 0.7% et la survie observée à 5 ans de ce cancer, tous stades confondus, est de 71% (4, 94, 95).
2.2. Autres cancers liés aux VPH
En plus du cancer du col de l’utérus, les VPH sont associés aux cancers anogénitaux (anus, vagin, pénis, vulve) et oropharyngés (5-9). Le Tableau 3 présente le nombre de cancers diagnostiqués dans un site relié aux VPH et le nombre de cancers attribués aux VPH en 2008 en Amérique du Nord. Les cancers anogénitaux et oropharyngés sont attribués aux VPH si de l’ADN de VPH à haut risque est détecté dans les tissus cancéreux (96). Les VPH-16 et 18 sont responsables de la majorité des cancers causés par les VPH. En effet, ces deux types sont responsables d’environ 70% des cancers du col de l’utérus, 40% des cancers de la vulve et du vagin, 35% des cancers du pénis, 70% des cancers de l’anus et 50% des cancers oropharyngés (tableau 3) (97-100).
12
Tableau 3 : Nombre total de cancers diagnostiqués dans un site relié aux VPH et pourcentage des cancers attribués aux VPH, en 2008 en Amérique du Nord(96-102)
Nombre de cancers diagnostiqués dans un site relié aux
VPH Nombre de cancers attribués aux VPH, tous types (% correspondant) Nombre de cancers attribués aux VPH-16 et 18 (% correspondant) Total ≈ 35 000 ≈ 26 000 (≈ 74%) ≈ 19 400 (≈ 55%) Incluant, selon le site
primaire du cancer : Col de l’utérus Autres organes génitaux féminins (vulve, vagin) Pénis Anus Oropharynx ≈ 12 000 ≈ 4 300 ≈ 1 400 ≈ 4 700 ≈ 11 000 ≈ 12 000 (100%) ≈ 2 900 (≈ 65%) ≈ 670 (≈ 50%) ≈ 3 900 (≈ 90%) ≈ 6 200 (≈ 60%) ≈ 8 400 (≈ 70%) ≈ 1 700 (≈ 40%) ≈ 500 (≈ 35%) ≈ 3 300 (≈ 70%) ≈ 5 500 (≈ 50%) 2.3. Condylomes
Les VPH-6 et 11 sont responsables de plus de 85% des condylomes. Le risque à vie d’avoir des condylomes est estimé à 7-8% (103). En Amérique du Nord, la prévalence des condylomes atteint un pic chez les personnes dans la vingtaine (103-105). En effet, dans ce groupe d’âge la prévalence des condylomes peut atteindre 5% (104, 106). La prévalence diminue ensuite avec l’âge (107).
13 3. Lutte contre les infections par les VPH
La lutte contre les maladies infectieuses, telles que les infections par les VPH, se compose de quatre volets : la prévention, le contrôle, l’élimination et l’éradication. Le contrôle se définit comme la réduction de la prévalence, l’incidence et/ou la mortalité d’une maladie à un niveau où celle-ci n’est plus un problème de santé publique. L’élimination est la réduction à zéro de l’incidence de la maladie à l’intérieur d’une zone géographique (par exemple, un pays). L’éradication correspond à la réduction à zéro de l’incidence de la maladie dans le monde entier. La prévention, quant à elle, regroupe différentes stratégies qui varient selon le type de prévention.
3.1. Les différents types de prévention
Il existe trois niveaux de prévention en santé publique : la prévention primaire, la prévention secondaire et la prévention tertiaire.
La prévention primaire concerne toutes les actions menées en amont et qui ont pour but d’empêcher l’apparition de la maladie ; la prévention secondaire vise à détecter la maladie plus tôt possible ; et la prévention tertiaire consiste à arrêter la progression de la maladie et éviter ou diminuer les complications et les rechutes (108).
Les personnes infectées par le VPH sont souvent asymptomatiques et, par conséquent, l’infection n’est pas diagnostiquée. Même en l’absence de symptômes, l’infection est transmissible et peut évoluer vers des lésions précancéreuses. À cause de ces caractéristiques, les préventions primaire et secondaire occupent une place essentielle dans les stratégies de prévention du VPH et des maladies qui y sont associées. La principale stratégie de prévention primaire utilisée contre les VPH est la vaccination prophylactique. La prévention secondaire se fait via le dépistage du cancer du col de l’utérus.
14 3.2. Les vaccins contre les VPH
3.2.1. Concept d’immunité de groupe
La vaccination a pour objectif de protéger les individus susceptibles contre les infections. En plus de protéger directement les personnes vaccinées, la vaccination protège aussi les personnes non vaccinées en interrompant les chaînes de transmission de la maladie : cette protection indirecte des individus susceptibles par les personnes vaccinées est appelée immunité de groupe (109).
3.2.2. Le taux de reproduction de base (R0)
Le taux de reproduction de base, R0, se définit comme le nombre moyen d’individus qu’une
personne infectieuse peut infecter pendant la période où elle est contagieuse. Dans une population entièrement susceptible, une maladie infectieuse peut se maintenir, voire se propager, dans la population si un individu infectieux contamine au moins un autre individu au cours de sa période infectieuse (R0 ≥ 1) (110). Si R0 < 1, la maladie ne peut pas se
maintenir dans la population et finit par être éliminée. Lorsqu’une partie de la population est immunisée (par exemple, après avoir été vaccinée ou naturellement infectée), le taux de reproduction net ou effectif, R, se définit comme suit : R = R0 × S, où S représente la
proportion d’individus susceptibles dans la population. Comme précédemment, si R0 × S ≥
1, la maladie peut se maintenir, voire se propager, dans la population. Pour que la maladie ne puisse pas se maintenir dans la population, il faut que R0 × S < 1, ce qui est équivalent à
S < ோଵ . Cette dernière équation nous permet de déterminer la proportion de la population, p, qui doit être immunisée pour arrêter la transmission de la maladie. En effet, pour s’assurer que S < ோଵ , il faut que p > 1 – ோଵ . Dans un contexte de vaccination, p représente donc la couverture vaccinale minimale à atteindre afin de pouvoir éliminer la maladie. Plus le R0 d’une maladie est élevé, plus la couverture vaccinale nécessaire pour
15
3.2.2. Description des vaccins contre le VPH
Trois vaccins prophylactiques contre les VPH ont été homologués au Canada : un vaccin bivalent (VPH-16 et 18), un vaccin quadrivalent (VPH-16, 18, 6 et 11) et, très récemment, un vaccin nonavalent (VPH-16, 18, 6, 11, 31, 33, 45, 52 et 58). Les neuf génotypes inclus dans la formulation de ce dernier vaccin sont responsables de 90% des cas de cancer du col (43, 81). Ces trois vaccins utilisent la protéine L1 du VPH comme antigène (111-113). Ces protéines sont retrouvées dans la capside du virus (114). Les protéines L1 contenues dans le vaccin bivalent sont produites en culture de cellules d’insectes et celles contenues dans les vaccins quadrivalent et nonavalent sont obtenues par culture de levures (111-113). Une fois produites, les protéines L1 s’auto-assemblent en pseudoparticules virales. Dans chaque vaccin, un adjuvant est ajouté afin de stimuler d’avantage le système immunitaire (tableau 4).
16
Tableau 4 : Composition d’une dose de vaccin (0,5 mL)
(113, 115-118)
Vaccin Antigènes Adjuvant
Bivalent 20 μg de VPH-16 20 μg de VPH-18
500 μg d’hydroxyde d’aluminium et 50 μg de lipide mono phosphoryle A
3-désacylé Quadrivalent 20 μg de VPH-6 40 μg de VPH-11 40 μg de VPH-16 20 μg de VPH-18 225 μg de sulfate d'hydroxy phosphate d'aluminium amorphe Nonavalent 30 µg de VPH-6 40 µg de VPH-11 60 µg de VPH-16 40 µg de VPH-18 20 µg de VPH-31 20 µg de VPH-33 20 µg de VPH-45 20 µg de VPH-52 20 µg de VPH-58 500 μg de sulfate d'hydroxy phosphate d'aluminium amorphe
3.2.3. Résultats d’études cliniques
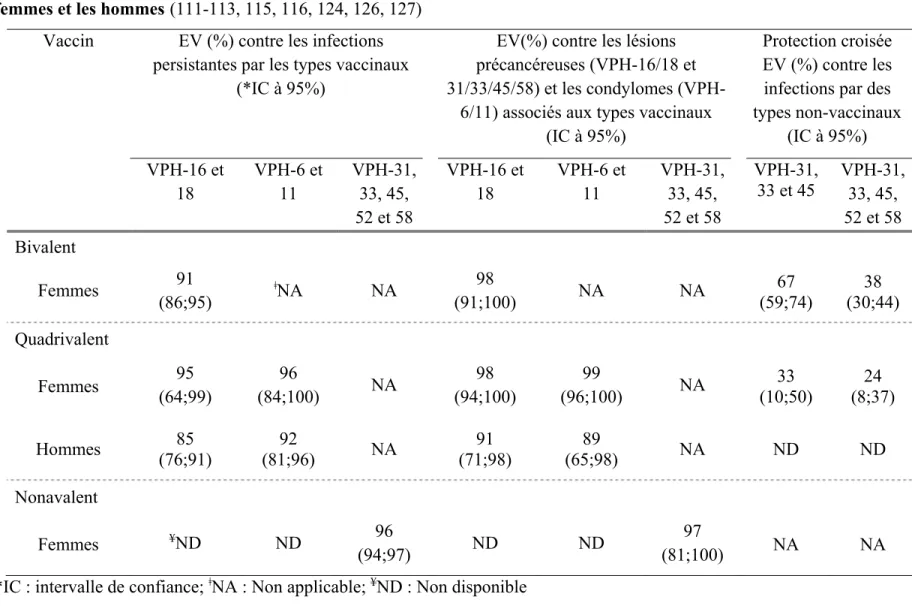
Chez les femmes naïves (résultats négatifs au test PCR pour l’ADN des VPH et au test de sérologie pour la détection d’anticorps anti-VPH), les résultats des essais cliniques randomisés ont démontré une grande efficacité des trois vaccins à prévenir les infections persistantes et les lésions précancéreuses (cervicales, vulvaires, vaginales et anales) associées aux génotypes vaccinaux (tableau 5) (115-123). De plus, ces études ont également montré que les vaccins bivalent et quadrivalent confèrent une protection croisée, c’est-à-dire un degré de protection contre des génotypes non-vaccinaux (tableau 5) (122,
17
124, 125). Finalement, le vaccin quadrivalent s’est aussi avéré très efficace pour prévenir les condylomes associés aux VPH-6 et 11 (112, 113, 123).
Chez les hommes naïfs, le vaccin quadrivalent a également démontré une grande efficacité pour prévenir les infections et les lésions génitales externes (incluant les lésions précancéreuses au pénis et les condylomes) associés aux types vaccinaux (tableau 5) (112, 113).
Le vaccin nonavalent est très récent et contrairement aux vaccins bivalent et quadrivalent, son efficacité n’a pas été évaluée par rapport à un placebo. De telles études n’auraient pas été acceptables car, dans de nombreux pays, la vaccination contre les VPH faisait déjà partie des soins de santé offerts dans le cadre de la prévention des infections et des maladies liées aux VPH. L’efficacité du vaccin nonavalent à prévenir les infections persistantes et les lésions précancéreuses causées par les VPH-31, 33, 45, 52 et 58 a donc été évaluée en utilisant le vaccin quadrivalent comme comparateur (126). Puisque les vaccins quadrivalent et nonavalent protègent tous deux contre les VPH-16, 18, 6 et 11, il était impossible d’évaluer l’efficacité du vaccin nonavalent à prévenir les infections persistantes et les lésions précancéreuses causées par les VPH-16, 18, 6 et 11 en utilisant le vaccin quadrivalent comme comparateur. Pour ces quatre types (VPH-16, 18, 6 et 11), c’est donc l’immunogénicité des deux vaccins qui a été mesurée et comparée. L’immunigénicité se définit comme étant la capacité d’un antigène (ici, le vaccin) à induire une réponse immunitaire spécifique. Les vaccins quadrivalent et nonavalent ont induit des réponses immunitaires semblables. En effet, pour les deux vaccins, 98.7% à 100% des sujets vaccinés ont produit des anticorps contre les VPH-16, 18, 6 et 11 (113).
18
Tableau 5 : Efficacité vaccinale (EV) et protection croisée des vaccins bivalent chez les femmes et quadrivalent chez les femmes et les hommes (111-113, 115, 116, 124, 126, 127)
Vaccin EV (%) contre les infections
persistantes par les types vaccinaux (*IC à 95%)
EV(%) contre les lésions précancéreuses (VPH-16/18 et 31/33/45/58) et les condylomes
(VPH-6/11) associés aux types vaccinaux (IC à 95%)
Protection croisée EV (%) contre les infections par des types non-vaccinaux (IC à 95%) VPH-16 et 18 VPH-6 et 11 VPH-31, 33, 45, 52 et 58 VPH-16 et 18 VPH-6 et 11 VPH-31, 33, 45, 52 et 58 VPH-31, 33 et 45 VPH-31, 33, 45, 52 et 58 Bivalent Femmes 91 (86;95) ǂNA NA 98 (91;100) NA NA 67 (59;74) 38 (30;44) Quadrivalent Femmes (64;99) 95 (84;100) 96 NA 98 (94;100) 99 (96;100) NA (10;50) 33 (8;37) 24 Hommes (76;91) 85 (81;96) 92 NA (71;98) 91 (65;98) 89 NA ND ND Nonavalent Femmes ¥ND ND 96 (94;97) ND ND 97 (81;100) NA NA
19
3.2.4. Programmes de vaccination
Les vaccins quadrivalent et bivalent sont disponibles depuis 2006 et 2007 respectivement. Ils ont été approuvés dans plus de 120 pays parmi lesquels plus de 65 pays ont mis en place des programmes de vaccination (10, 15, 16, 118). Le vaccin le plus utilisé dans les programmes est le vaccin quadrivalent. Le vaccin nonavalent n’est encore utilisé dans aucun programme de vaccination, car il est très récent. Il a été approuvé en décembre 2014 par la Food and Drug Administration et son usage dans des programmes de vaccination a été recommandé en 2015 par le Advisory Committee on Immunization Practices (ACIP) du centre pour le contrôle et la prévention des maladies (CDC) aux États-Unis (128, 129).
Les programmes de vaccination diffèrent selon les pays. Tous les programmes de vaccination incluent les jeunes filles et quelques pays ont décidé récemment d’inclure également les garçons (10, 130, 131). L’âge cible de la vaccination (entre 9 et 13 ans) et la couverture vaccinale (~50% à 85%) varient selon les pays, les plus hautes couvertures vaccinales sont observées dans les pays qui ont mis en place des programmes de vaccination dans les écoles (103, 132-142).
Au Canada, les programmes de vaccination dépendent des provinces. Toutes les provinces ont un programme de vaccination mis en place dans les écoles, mais les caractéristiques des programmes (par exemple, âge à la vaccination, vaccination de rattrapage, etc.) varient selon les provinces. Au Québec, depuis 2008, les jeunes filles sont vaccinées en 4ème année
du primaire et la couverture vaccinale est 75%-80% (143, 144). À partir de septembre 2016, les jeunes garçons du même âge seront également vaccinés (143). De plus, dans le cadre du programme québécois d’immunisation, d’autres personnes peuvent également se faire vacciner gratuitement. Ces personnes doivent faire partie d’une des catégories suivantes : les filles entre 9 et 17 ans ; les femmes et les hommes âgés de 18 à 26 ans dont le système immunitaire est affaibli ou qui sont infectés par le virus de l’immunodéficience humaine (VIH) ; les hommes de 26 ans ou moins qui ont, ou qui prévoient avoir, des relations sexuelles avec d’autres hommes (143).
20
La décision d’implanter des programmes de vaccination des jeunes filles contre les VPH était basée sur l’innocuité et l’efficacité du vaccin qui ont été démontrés lors d’études cliniques randomisées (111-113, 124, 127). Les prédictions d’efficacité populationnelle et de coût-efficacité issues des modèles mathématiques ont aussi joué un rôle important dans cette prise de décision (14, 24, 26-29). Tous les modèles ont donné des résultats similaires concernant les effets directs de la vaccination: la vaccination des jeunes filles pourrait considérablement réduire le fardeau causé par les maladies liées aux VPH parmi les filles protégées par la vaccination (18). Toutefois, la question d’ajouter les garçons dans les programmes de vaccination se pose encore, car le bénéfice marginal de la vaccination des garçons dépendent de l’amplitude de l’immunité de groupe engendrée par la vaccination des filles (30-32). Or, il reste encore beaucoup d’incertitude quant aux effets indirects de la vaccination, tels que l’impact de la vaccination des jeunes filles sur les garçons, l’amplitude de l’immunité de groupe, la vitesse d’apparition des bénéfices de l’immunité de groupe, ou encore la couverture vaccinale à atteindre afin de pouvoir observer les effets de l’immunité de groupe (32-34).
3.3. Dépistage du cancer du col de l’utérus
3.3.1. Programmes de dépistage
Les programmes de dépistage du cancer du col de l’utérus permettent de détecter et de traiter les lésions risquant de progresser vers le cancer (145). Ces programmes ont permis de réduire l’incidence du cancer du col de l’utérus dans les pays développés au cours des cinquante dernières années (145). Au Canada, le taux d’incidence du cancer du col est passé de 15.4 / 100 000 femme-années en 1977 à 7.5 / 100 000 femme-années en 2012 (79). Les données de surveillance montrent que ce taux tend à se stabiliser depuis quelques années (146). Au Québec, les lignes directrices sur le dépistage du cancer du col utérin recommandent aux femmes âgées de 21 à 65 ans de passer un test de dépistage tous les 2 à 3 ans (147).
21
3.3.2. Tests et méthodes de détection
Le test le plus couramment utilisé jusqu’à maintenant dans les programmes de dépistage est le test du frottis de Papanicolaou (Pap test) (147). Ce test cytologique consiste à prélever des cellules du col de l’utérus par grattage afin de permettre leur examen au microscope (sur une lame de verre ou en milieu liquide). Le diagnostic cytologique peut être (147):
- Aucune cellule anormale détectée ;
- Lésion épidermoïde intraépithéliale de bas grade (LSIL, correspond aux CIN1) : changements précoces dans les cellules, elles diffèrent légèrement des cellules normales ;
- Lésion épidermoïde intraépithéliale de haut grade (HSIL, correspond aux CIN2/3) : changements importants dans la taille et la forme des cellules, augmentation du risque de développer un cancer ;
- Cellules atypiques épidermoïdes ne permettant pas d’exclure une lésion épidermoïde de haut grade (ASC-H) : présence de cellules anormales qui pourraient être des HSIL ;
- Cellules atypiques épidermoïdes de signification indéterminée (ASC-US) : impossibilité de poser un diagnostic clair ;
- Cellules atypiques glandulaires (AGC) : changements dans les cellules glandulaires de l’endocol, augmentation du risque de développer un cancer ;
- Adénocarcinome in situ (AIS) : présence de cellules cancéreuses dans l’endocol mais qui ne se sont pas encore propagées aux tissus plus profonds.
Lorsqu’une femme reçoit un diagnostic cytologique de LSIL, HSIL, ASC-H, AGC ou AIS, elle est orientée en colposcopie (147). La colposcopie est un examen qui consiste à observer le vagin et le col de l’utérus à l’aide d’un colposcope (appareil grossissant). Cet examen permet de visualiser les cellules anormales de façon plus détaillée afin de préciser le diagnostic. La colposcopie peut être accompagnée d’une biopsie. Pour les résultats ASC-US, les recommandations varient selon l’âge de la femme. Les femmes de moins de 30 ans repassent un Pap test 6 mois et 12 mois après avoir reçu le diagnostic ASC-US initial (147). Si le résultat d’un de ces deux tests est ASC-US ou plus grave (LSIL, HSIL, ASC-H, AGC,
22
AIS), elles sont orientées en colposcopie (147). Les femmes de plus de 30 ans qui reçoivent un résultats cytologique ASC-US passent un test VPH (147). Le test VPH permet de détecter la présence d’ADN de VPH oncogènes. Si le test VPH est positif, elles sont orientées en colposcopie, si le résultat est négatif, elles repassent un Pap test un an plus tard (147) (tableau 6). Le test VPH est recommandé uniquement pour les femmes de plus de 30 ans, car chez les femmes plus jeunes, les infections par les VPH sont très courantes et la grande majorité de ces infections se résorbent naturellement (54, 70, 71).
Tableau 6 : Résumé des recommandations les plus récentes selon le diagnostic cytologique et l’âge des femmes au Québec
Âge Fréquence de dépistage recommandée Si diagnostic LSIL, HSIL, ASC-H, AGC ou AIS Si diagnostic ASC-US
20 ans et moins Dépistage non recommandé 21-29 ans Pap test tous les
2-3 ans
Colposcopie Repasser un Pap test après 6 et 12 mois
Colposcopie si diagnostic ASC-US ou plus grave 30-65 ans Pap test tous les
2-3 ans
Colposcopie Test VPH
si positif : colposcopie si négatif : repasser un Pap
après 1 an 66 ans et plus Pap test non
recommandé sauf si absence de résultats antérieurs Colposcopie Test VPH si positif : colposcopie si négatif : repasser un Pap
après 1 an
Ces recommandations correspondent aux lignes directrices émises par l’Institut national de santé publique du Québec (INSPQ) en 2011. En 2013, de nouvelles recommandations pour le dépistage du cancer du col de l’utérus ont été publiées par le Groupe d'étude canadien sur les soins de santé préventifs. Cependant, le ministère de la santé et des services sociaux du
23
Québec (MSSS) a pris la décision de conserver les lignes directrices émises par l’INSPQ en 2011 (148).
3.3.3. Avenir des programmes de dépistage
Dans les pays qui ont mis en place des programmes de vaccination, les programmes de dépistage du cancer de col de l’utérus pourraient être amenés à changer dans les prochaines années, particulièrement dans les pays où la couverture vaccinale est élevée. En effet, les premières cohortes de filles vaccinées vont bientôt atteindre l’âge de participer au dépistage et comme une grande proportion de ces jeunes filles sera immunisée, le problème des infections fréquentes à cet âge ne se posera plus. Les recommandations concernant le dépistage seront donc appelées à être révisées afin de trouver la stratégie optimale de dépistage dans cette ère post-vaccination. Par ailleurs, les tests VPH sont de plus en plus performants; ils permettent à la fois de détecter l’ADN de VPH oncogènes mais aussi de génotyper les VPH (149). Les tests VPH pourraient être de plus en plus utilisés dans l’avenir.
4. Facteurs de risque
4.1. Infections par les VPH
Comme les VPH se transmettent majoritairement par contact sexuel, le principal facteur de risque est le comportement sexuel (150). En effet, le risque de contracter l’infection est influencé par le nombre total de partenaires sexuels, par le nombre de partenaires récents (par exemple, le nombre de nouveaux partenaires par année) et par l’âge au premier rapport sexuel (150, 151). De plus, l’infection peut se transmettre même lors de contacts sexuels sans pénétration, ce qui rend l’usage du préservatif moins efficace pour prévenir la transmission du virus (152-154). Chez les hommes, la probabilité de contracter et de transmettre le VPH semble être diminuée par la circoncision (155).
24 4.2. Cancer du col de l’utérus
Chez les femmes, la non-participation au dépistage du cancer du col de l’utérus est associée à une augmentation du risque de développer un cancer du col. Ainsi, près de 60% des cas de cancers du col de l’utérus au Canada sont diagnostiqués chez les femmes qui n’ont pas participé au dépistage depuis au moins cinq ans (156).
5. Les modèles mathématiques en général
Les études de modélisation mathématique permettent, par exemple, d’étudier des phénomènes complexes, tels que l’immunité de groupe; de prédire les effets d’une intervention en santé à long terme et de réaliser des analyses de coûts-efficacité. Étudier de telles questions dans des études épidémiologiques classiques serait impossible pour des raisons d’éthique ou de faisabilité (157).
5.1. Les attributs généraux des modèles
Les modèles utilisés comme outil d’aide à la décision en matière de vaccination se distinguent par leurs caractéristiques (158). Voici les principales caractéristiques des modèles :
- Les modèles statiques et dynamiques : les modèles dynamiques tiennent compte de l’immunité de groupe, ils permettent donc de simuler à la fois les effets directs et les effets indirects de la vaccination alors que les modèles statiques ne prennent pas en compte l’immunité de groupe et permettent donc de simuler les effets directs uniquement (109, 159-164). Tenir compte des effets d’immunité de groupe est important lorsqu’on évalue l’efficacité populationnelle d’un programme de vaccination, car ces effets peuvent être très élevés (26-29, 33, 165-169).
- Les modèles déterministes et stochastiques : dans un modèle déterministe, les taux de transition entre les différents états de l’histoire naturelle de la maladie (par
25
exemple : infecté, CIN1/2/3, cancer) sont constants, il n’y a pas de transitions dues au hasard (158). À l’inverse, un modèle stochastique tient compte des transitions causées par des fluctuations aléatoires. Chaque événement qui survient chez un individu (par exemple, contracter l’infection, développer des lésions précancéreuses, etc.) peut être affecté par des fluctuations aléatoires.
- Les modèles compartimentaux et individus-centrés : dans un modèle compartimental, les individus sont divisés dans des compartiments (par exemple, les différents états de la maladie). Toutes les personnes d’un même compartiment sont homogènes et sont donc soumises aux mêmes risques (158). Dans un compartiment, les personnes ne sont pas représentées de façon individuelle, elles sont représentées par une moyenne de personnes. Alors que dans un modèle individus-centrés, chaque individu est explicitement représenté et est soumis aux risques déterminés par ses propres caractéristiques.
5.2. La population dans les modèles
La population d’un modèle peut être ouverte ou fermée. Lorsque la population est ouverte, les individus peuvent entrer et sortir du modèle (par exemple, naissance et décès) (21). Si la population est fermée, il n’y a aucune nouvelle entrée; c’est le cas lorsqu’on simule une cohorte qui est suivie pour un certain lapse de temps (21). La population peut être stratifiée selon différentes caractéristiques, telles que le genre, l’âge, le comportement sexuel, la participation aux programmes de dépistage, etc. Seules les caractéristiques pertinentes devraient être incluses dans le modèle; elles sont déterminées en fonction de leur lien avec la maladie. Par exemple, pour une maladie infectieuse, il est important d’intégrer dans le modèle les facteurs de risque associés à la transmission et à la progression de la maladie.
26
6. Les modèles mathématiques qui simulent les effets populationnels de la vaccination contre les VPH
Plusieurs modèles ont été développés afin de guider les décisions en matière de vaccination contre les VPH dans différents pays. Un modèle peut intégrer des données démographiques, épidémiologiques et économiques, spécifiques au pays pour lequel il a été développé.
6.1. La population
Les modèles dynamiques qui simulent les effets de la vaccination contre les VPH ont généralement des populations ouvertes, car ces modèles s’intéressent aux effets populationnels de la vaccination, incluant l’immunité de groupe (24, 27, 168, 170, 171). La population de ces modèles est stratifiée, au minimum, selon le genre et l’âge. L’âge peut être modélisé de façon continue ou par groupe (par exemple, des groupes d’âge de cinq ans : 15-19 ans, 20-24 ans, etc.) (34, 172, 173). Puisque les VPH sont transmis sexuellement, la majorité des modèles incluent aussi une stratification selon l’activité sexuelle (14, 28, 172). La population est alors divisée en différents niveau d’activité sexuelle : plus le niveau est élevé, plus l’individu a un nombre élevé de partenaires au cours de sa vie. Si les partenariats ne sont constitués que d’individus de sexes opposés (relation hétérosexuelle), la population du modèle n’est pas stratifiée selon l’orientation sexuelle.
6.2. Paramètres de transmission et d’infection des VPH
6.2.1. Partenariat et probabilité de transmission du VPH
La probabilité de transmission est la probabilité qu’un individu infecté par le VPH transmette l’infection à son ou sa partenaire susceptible (169). Selon les modèles, la probabilité de transmission dans un partenariat peut varier selon le type de VPH et le sens de la transmission (de femme à homme ou d’homme à femme). La plupart des modèles considèrent que les partenariats sont instantanés (ils ne durent pas dans le temps); la probabilité de transmission est alors définie par partenariat (169, 173, 174). À l’inverse,
27
certains modèles tiennent compte de la durée des partenariats en modélisant explicitement leurs formations et leurs séparations. Dans ces modèles, la probabilité de transmission du VPH au sein d’un partenariat est définie par acte sexuel (172, 175, 176).
6.2.2. Types de VPH inclus dans le modèle
Les modèles peuvent inclure un seul ou plusieurs types de VPH qui peuvent être modélisés de façon individuelle ou groupée (43). Les premiers modèles ne contenaient qu’un type ou un groupe pour tous les VPH (26, 43, 165, 177). Ensuite, des types supplémentaires ont été ajoutés aux modèles, ce qui a permis d’évaluer l’impact de la vaccination sur les condylomes ainsi que sur les lésions précancéreuses et les cancers associés à d’autres types que les VPH-16 et 18 (27, 166, 178).
Quand les VPH sont groupés, par exemple les VPH-16/18, cela crée un « super-type de VPH » avec une prévalence égale aux prévalences des VPH-16 et 18 combinées. Les paramètres du modèle sont alors ajustés pour pouvoir reproduire la prévalence combinée des types individuels (169, 174, 179, 180), entraînant ainsi une augmentation du R0.
L’augmentation du R0 a pour conséquence de rendre le « super-type de VPH » plus difficile
à contrôler avec la vaccination (169). Grouper les types peut donc biaiser les prédictions du modèle en sous-estimant l’efficacité populationnelle de la vaccination. Il est donc conseillé de modéliser les types de VPH de façon individuelle. Lorsque les types sont modélisés de façon individuelle, des valeurs de paramètres propres à chaque type sont utilisées pour modéliser l’histoire naturelle de l’infection de chaque VPH (14, 171, 181).
6.3. Caractéristiques des vaccins modélisés
6.3.1. Efficacité vaccinale
L’efficacité vaccinale peut varier selon les types de VPH (tableau 5, section 3.2.3.). Elle peut être modélisée en utilisant deux paramètres, le take et le degree (169). Le take correspond à la probabilité qu’un individu vacciné développe une immunité (169). Par
28
exemple, un take de 95% signifie que 95% des personnes vaccinées contre les VPH développent une immunité. Le degree correspond au degré de protection contre l’infection par acte (ou partenariat) (169). Par exemple, un degree de 95% signifie que les personnes vaccinées ont une probabilité de 95% de ne pas être infecté par le VPH lors d’un contact sexuel avec un individu infecté. Certains modèles modélisent l’efficacité en utilisant uniquement le take ou le degree alors que d’autres modèles utilisent les deux paramètres (29, 32, 182).
6.3.2. Durée de protection du vaccin
Les vaccins contre les VPH étant relativement récents, il n’y a pas encore de données disponibles sur la protection vaccinale à long terme (par exemple, plus de 10-15 ans). Afin de pouvoir prédire l’impact de la durée de protection du vaccin sur l’efficacité populationnelle des programmes de vaccination, les modèles peuvent simuler différentes durées de protection. Les personnes vaccinées peuvent être protégées à vie ou il peut y avoir une perte de la protection vaccinale après un certain nombre d’années. La perte de la protection vaccinale peut être modélisée de différentes façons. Par exemple, elle peut suivre une distribution normale (la perte s’échelonne autour de la durée moyenne de protection), uniforme (tous les individus vaccinés perdent brusquement leur protection après un nombre d’années fixé) ou exponentielle (après un nombre d’années fixé, les individus vaccinés perdent leur protection à un taux constant).
6.4. Données utilisées lors de la calibration
Bien qu’il existe différentes méthodes pour calibrer un modèle, elles ont toutes le même objectif : identifier les valeurs des paramètres du modèle qui reproduisent le mieux les données empiriques préalablement identifiées. Parmi les données couramment utilisées lors de la calibration, on retrouve des données épidémiologiques et des données sur le comportement sexuel. Les données épidémiologiques incluent la prévalence ou l’incidence du VPH, l’incidence des lésions précancéreuses, l’incidence du cancer du col; ces données peuvent être stratifiées par type de VPH, âge et/ou genre. Parmi les données sur le
29
comportement sexuel, le nombre de partenaires sexuels au cours de la dernière année ou le pourcentage de la population sexuellement actif peuvent être utilisés lors de la calibration (171, 175, 176, 183).
30
Méthodes
La méthode consiste essentiellement en une revue systématique de la littérature ayant pour buts d’identifier tous les modèles mathématiques dynamiques qui simulent les effets de la vaccination contre les VPH dans les pays à revenus élevés et de résumer les prédictions des différents modèles. Nous avons contacté les auteurs des études retenues dans la revue systématique et leur avons demandé de 1) compléter un questionnaire de description pour leur modèle et 2) réaliser une série de simulations standardisées conçues pour cette étude. Puisque le modèle HPV-ADVISE, développé par notre équipe, faisait partie des modèles identifiés dans la revue systématique, j’ai utilisé ce modèle dans le cadre de ma maîtrise afin de réaliser les mêmes simulations que celles demandées aux autres participants.
1. Stratégie de recherche des articles et critères de sélection
Nous avons réalisé une revue systématique de la littérature en suivant les lignes directrices PRISMA (184). Pour être éligibles, les études devaient identifier un modèle mathématique qui respectait les critères d’inclusion suivants : 1) être dynamique ; 2) simuler les effets populationnels de la vaccination contre les VPH sur la prévalence des infections ; 3) inclure les VPH de types 16, 18, 6 et/ou 11 et 4) s’appliquer à un pays à revenus élevés (selon la classification de l’Organisation Mondiale de la Santé). Nous avons effectué des recherches dans les bases de données Medline (via Pubmed) et Embase afin de trouver les études correspondant aux critères d’inclusion publiées entre le 1er janvier 2009 et le 14 avril 2015.
Nous nous sommes restreint aux publications faites depuis 2009 afin d’identifier des modèles toujours utilisés. Nous avons utilisé une combinaison de “Medical Subject Heading” (Mesh) et de mots retrouvés dans les titres et résumés des études : ("models, theoretical" or "mathematical model" or "models, statistical" or "cost-benefit analysis" or "cost-effectiveness" or "risk-benefit analysis") and ("papillomavirus vaccines" or "papillomavirus vaccination" or "human papillomavirus vaccine" or "HPV vaccine" or "HPV vaccination") (voir Annexe I pour les stratégies de recherches complètes utilisées dans les deux bases de données). Aucune restriction n’a été appliquée quant à la langue de publication des études. La sélection des études a été effectuée indépendamment par trois
31
évaluateurs (Marc Brisson (MB), Mélanie Drolet (MD) et Élodie Bénard (ÉB)). Nous avons procédé en trois étapes. D’abord, nous avons effectué une première ronde d’exclusion basée sur les titres et résumés de toutes les études. Ensuite, nous avons lu les études restantes et exclu celles qui ne correspondaient pas aux critères d’inclusion. Finalement, nous avons vérifié la liste de références de toutes les études retenues. Afin d’identifier des études additionnelles potentiellement éligibles, nous avons également cherché parmi les résumés de conférences portant sur les VPH (the European Research Organisation on Genital Infection and Neoplasia [EUROGIN] Congress 2013 et the International Papillomavirus Conference 2014).
Nous avons décidé a priori de classer les études retenues par équipes de recherche, car nous nous attendions à ce que plusieurs études aient été publiées par la même équipe qui utilise le même modèle. MB a ensuite contacté le chercheur principal ou l’auteur de correspondance de l’équipe afin de vérifier leur intérêt envers notre étude. Pour être incluses, les équipes de recherche devaient être en mesure de réaliser de nouvelles simulations selon des paramètres standardisés afin que les résultats des différents modèles soient comparables entre eux. Si une équipe de recherche avaient différentes version de leur modèle (par exemple, si le modèle était calibré pour différents pays ou si le modèle avait été amélioré au cours du temps), la version la plus récente du modèle a été incluse dans la revue systématique de façon à s’assurer de l’indépendance entre les prédictions des modèles.
2. Collecte, production de données et évaluation de la qualité des études
2.1. Développement des outils de collecte des données
2.1.1. Questionnaire des caractéristiques des modèles
Afin de recueillir des informations détaillées sur les caractéristiques des modèles identifiés dans la revue systématique, nous avons développé un questionnaire de description des caractéristiques des modèles. Ce questionnaire a été pré-testé et approuvé par un comité
32
consultatif constitué de huit modélisateurs mathématiques de six pays (Canada, États-Unis, Royaume-Uni, Finlande, Pays-Bas et Australie) et il a été complété par chacune des équipes de recherche.
Le questionnaire de description des caractéristiques des modèles comprend des informations sur :
- les attributs généraux du modèle : pays pour lequel le modèle a été développé, type de modèle, type de population ;
- les stratifications de la population du modèle : âge, genre, activité sexuelle, orientation sexuelle ;
- les paramètres de transmission du VPH : types de VPH inclus dans le modèle, modélisation des types de VPH en groupe ou individuellement, probabilité de transmission, immunité naturelle, inclusion de l’histoire naturelle du cancer du col de l’utérus dans le modèle ;
- les caractéristiques du vaccin : efficacité vaccinale en fonction du type de VPH, façon dont sont modélisées l’efficacité vaccinale et la perte de la protection vaccinale;
- et la calibration du modèle : types de données utilisées pour calibrer le modèle. Le questionnaire complet est fourni en annexe (Annexe II).
2.1.2. Simulations standardisées
Nous avons déterminé une série de 19 simulations avec des paramètres standardisés. Les prédictions demandées à chaque équipe de recherche concernaient l’impact de la vaccination sur la prévalence des infections par les VPH-16, 18, 6 et/ou 11 chez les femmes et les hommes sur une période de 70 ans après le début de la vaccination. Les équipes pouvaient nous transmettre la réduction relative (%) de la prévalence des infections par les VPH-16, 18, 6 et/ou 11 (versus la période pré-vaccination ou le scénario sans vaccination) ou la prévalence dans le temps des infections par les VPH-16, 18, 6 et/ou 11. Pour chaque simulation, nous avons fixé les paramètres suivants : population cible de la vaccination (filles seulement, filles et garçons), couverture vaccinale (de 0% à 100%), durée de
33
protection du vaccin (20 ans et protection à vie) et efficacité vaccinale (90% et 100%) (tableau 7). En faisant varier la population cible de la vaccination et la couverture vaccinale dans les différents scénarios, nous avons voulu mesurer les effets directs de la vaccination, quantifier l’immunité de groupe et évaluer le bénéfice additionnel de la vaccination des garçons. Les scénarios des simulations ont également été révisés et approuvés par le comité consultatif.
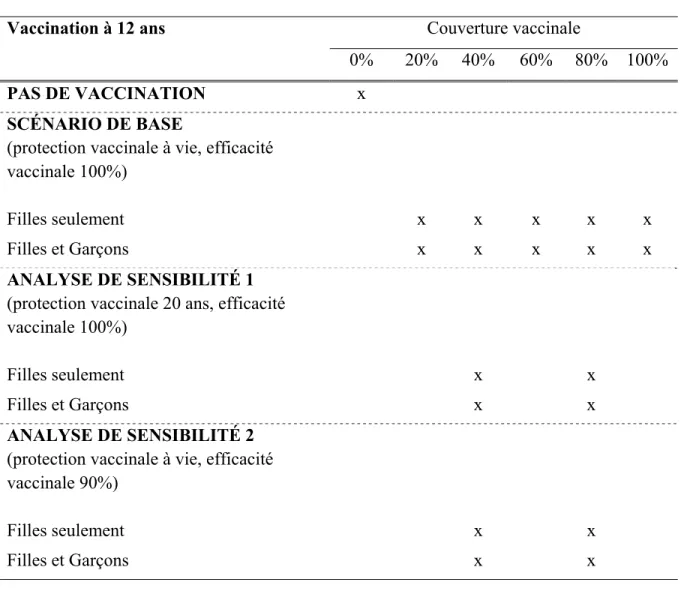
Tableau 7 : Description des simulations
Vaccination à 12 ans Couverture vaccinale
0% 20% 40% 60% 80% 100%
PAS DE VACCINATION x
SCÉNARIO DE BASE
(protection vaccinale à vie, efficacité vaccinale 100%)
Filles seulement x x x x x
Filles et Garçons x x x x x
ANALYSE DE SENSIBILITÉ 1 (protection vaccinale 20 ans, efficacité vaccinale 100%)
Filles seulement x x
Filles et Garçons x x
ANALYSE DE SENSIBILITÉ 2 (protection vaccinale à vie, efficacité vaccinale 90%)
Filles seulement x x