vV
4
U L
I
^ ^ THESED 3
PRESENTEEA L'ECOLE DES GRADUES
DE L'UNIVERSITE LAVAL
POUR L1 OBTENTION
DU GRADE DE MAITRE ES SCIENCES (M.Sc.)
PAR
DOMINIQUE DUMONT
PHARMACIEN DE LA FACULTE DES SCIENCES PHARMACEUTIQUES ET BIOLOGIQUES
UNIVERSITE PARIS - SUD
CONTRIBUTION A L'ETUDE DU CONTROLE DE LA SECRETION DE L'a-MSH PAR LE LOBE INTERMEDIAIRE
DE L'HYPOPHYSE DU RAT
AVANT-PROPOS IV
LISTE DES ABREVIATIONS VI
INTRODUCTION 1
CHAPITRE I - Etat des connaissances sur les:
1. Mécanismes de contrôle de la sécrétion de l'a-MSH et autres hormones du lobe intermédiaire de
1'hypophyse 13
1.1 - Action des neuropeptides hypothalamiques 14 1.2 - Action des neurotransmetteurs 15 1.2.1 - Expérimentation in vitro 16 1.2.2 - Expérimentation in vivo 22 1.3 - Action des stéroïdes endocriniens 24
1.4 - Action du stress 26
2. Méthodes de dosage de l'a-MSH dans le plasma de rat 27
CHAPITRE II - Description de la méthode radioimmunologique utilisée pour le dosage de 1' a-MSH dans le plasma
de rat 30 ■ 1. Principe général 31 2. Matériels et réactifs 33 2.1 - Produits utilisés 33 2.2 - Iodation de l'a-MSH 34 2.3 - Gamme de standards 35
2.4 - Plasma humain désactivé 35
3. Prélèvements de sang 36
4. Technique de dosage 36
4.1 - Protocole 36
4.2 - Sensibilité 37
4.3 - Calculs 37
CHAPITRE III - Etude de 1'influence de divers traitements sur
le taux de l'a-MSH plasmatique chez le rat 42 1 2 3
1. Action du CRF 43
2. Action des agonistes adrénergiques
2.1 Agoniste a^: phénylëphrine 44
2.2 Agoniste .82: isoprotêrénol 44
3. Action du stress 112
3.1 - Matériel et méthodes 112
CHAPITRE IV - Production d'antiséra contre l’a-MSH 116
1. Généralités 116
2. Couplage de 1'o-MSH 117
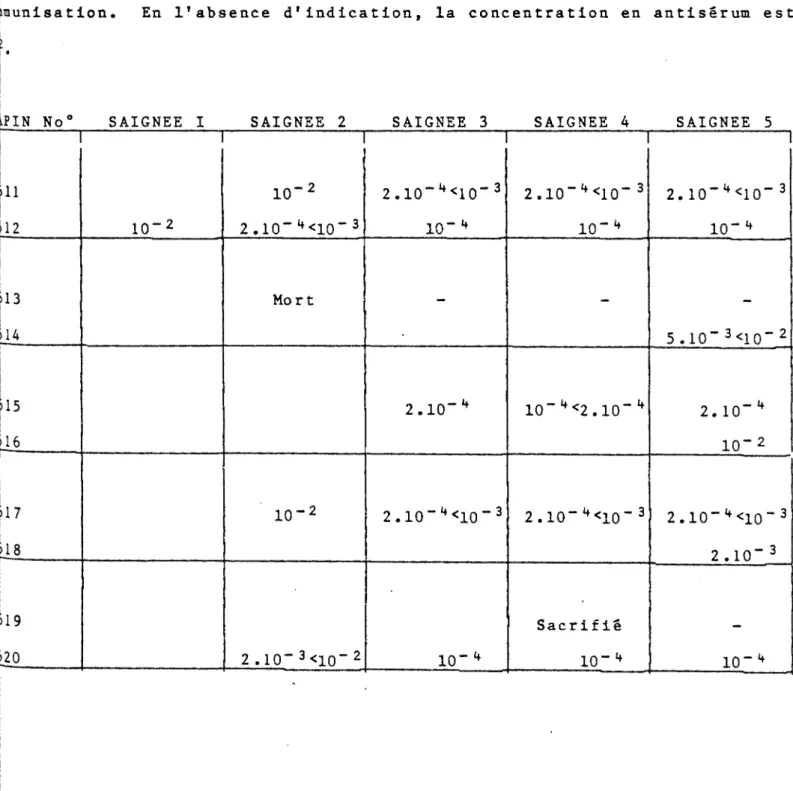
3. Traitement des animaux et prélèvement des antiséra 118 4. Titre et spécificité des antiséra 120
CONCLUSIONS 13/5
BIBLIOGRAPHIE 139
Nota: La pagination des publications incluses dans le texte se distingue par un astérique. La numérotation des figures et des références leur est propre.
AVANT-PROPOS
Ce travail a été réalisé au Centre de Recherches en Endocrinologie Moléculaire du Centre Hospitalier de 1* Université Laval.
Il s’intégre dans le cadre des travaux qui sont poursuivis dans ce laboratoire depuis plusieurs années dans le domaine de la connaissance des sites d'action des hormones, de l'identification des médiateurs impliqués dans la régulation de leur sécrétion et de l'étude des inter actions entre hormones et autres substances biologiques dans diverses manifestations physiologiques.
Ces recherches, d'intérêt fondamental, sont à 1'origine d'impor tantes applications pratiques telles que la contraception, le traite ment de la stérilité ou encore la thérapeutique de certaines tumeurs hormono-dépendantes (cancer du sein et de la prostate) .
C'est avec une amicale bienveillance que le Docteur F. Labrie qui dirige ce laboratoire m'a accueilli dans son équipe de recherche. La matérialisation de ce travail est pour moi l'occasion de le remercier très sincèrement de l'intérêt avec lequel il en a suivi la progression.
Mes remerciements vont également à ses collaborateurs de longue date, Jean Côté, qui m'a initié aux techniques de dosages radioimmuno logiques dont il connaît tous les secrets et a toujours fait preuve à mon égard d'une très grande disponibilité.
Louise Proulx-Ferland, qui avec beaucoup de gentillesse m'a fait profité de sa grande expérience dans les essais sur l'animal.
Ma gratitude s'adresse également à tous les chercheurs et techni ciens du laboratoire qui ont participé aux travaux dont les résultats sont rassemblés dans cette thèse.
L'aide d'André Petitclerc dans la préparation des immunosera m'a été très précieuse.
La contribution d'Elaine Leclerc à la dactylographie et à la mise en page du texte a grandement facilité ma tâche dans l'achèvement de sa rédaction.
Ce travail inclus des articles déjà parus ou soumis pour
publication dans des revues scientifiques. Ils concernent le sujet traité étendu à d'autres aspects s'y rapportant étudiés par d'autres chercheurs du laboratoire. Ces articles sont reproduits dans
Ach: acétylcholine
ACTH : adrenocorticotropic hormone, corticotropine AMP: adenosine 35 *-monophosphate
CLIP: corticotropin-like intermediate lobe peptide CRF: corticotropin-releasing factor
DA: dopamine E: epinephrine
EDTA: ëthylènediaminetëtraacëtate de sodium FSH: follicle-stimulating hormone
FSH-RH: follicle-stimulating hormone-releasing hormone GABA: gamma-aminobutyric acid
GH: growth hormone
GH-RH: growth hormone-releasing hormone GTP: guanosine 5 *-triphosphate
5-HT: 5-hydroxytryptamine LH: luteinizing hormone
LH-RH: luteinizing hormone-releasing hormone LPH: lipotropin
MIF: melanocyte-stimulating hormone release-inhibiting factor MSH: melanocyte-stimulating hormone
MSH-RH: melanocyte-stimulating hormone-releasing hormone NE: norepinephrine
PRL: prolactine
RIA: radioimmunoassay
INTRODUCTION
Au cours de ces vingt dernières années, de nombreux travaux ont été consacrés à l’étude des hormones hypophysaires.
Un rôle fondamental a été reconnu à 1'hypothalamus dans le contrô le de leur sécrétion. Ce contrôle s'exerce par 1'intermédiaire d'hor mones hypothalamiques stimulant ou inhibant leur libération. L* influ ence des neurotransmetteurs a été plus récemment étudiée. Si certains des mécanismes impliqués sont aujourd'hui bien élucidés, d'autres
restent encore mal connus.
Un bref rappel sur 1'anatomie de 1'hypophyse de rat, animal sur lequel a été effectuée l'expérimentation faisant l'objet de ce travail, permettra de mieux comprendre son fonctionnement.
L'hypophyse est une petite glande logée dans la selle turcique immédiatement en dessous de 1'éminence médiane de l'hypothalamus
(Figure 1). Elle est constituée de trois lobes : le lobe antérieur, le lobe intermédiaire et le lobe postérieur. A la dissection, le lobe neurointermédiaire formé des lobes postérieur et intermédiaire est
facilement clivé du lobe antérieur. La séparation des cellules formant le lobe intermédiaire ou pars intermedia nécessite une digestion enzy matique (Meunier et Labrie, 1982). Les lobes antérieur et intermédiaire constituent l'anté ou adénohypophyse. Cette dernière provient du point de vue embryologique d'une évagination de l'intestin primitif anté rieur, la poche de Rathké alors que le lobe postérieur résulte d'une extension du tissu nerveux diencéphalique d'où le nom de neurohypophy se. L'adénohypophyse est reliée à 1'hypothalamus au niveau de l'émi nence médiane par un système vasculaire porte qui collecte les neurosé- crëtlons provenant notamment du noyau supraoptique.
FIGURE I: (d'après Halasz et c o11 . (19 6 5)
Représentation schématique de la localisation des aires hypophy- siotropes (région hachurée), ARC, noyau arqué; CA, commis sure antérieu re; CALL, corps calleux; CHO, chiasma optique; CP, commissure posté rieure ; DM, noyau dorso-mëdian; FX, fornix; HL, noyau habénulaire laté ral; HM, noyau habénulaire médian; LAHY, lobe antérieur de 1'hypophyse ; LPHY, lobe postérieur de 1' hypophyse ; MM, noyau mamtni 1 lai r e médian;
NAH, noyau hypothalamique antérieur ; PM, noyau prëmammillaire; PV,
noyau paraventriculaire; SCH, noyau suprachiasmatique; SO, noyau supra- optique ; VM, noyau ventromëdian.
Il n’existe aucune connexion nerveuse entre le lobe antérieur et l’hypothalamus, des fibres aminergiques reliant ce dernier au lobe intermédiaire. La liaison avec la neurohypophyse est exclusivement nerveuse. Elle est constituée par les axones de neurones provenant des noyaux paraventriculaire et supraoptique. Le système vasculaire porte hypophysaire est la principale voie d’irrigation sanguine de 1'adénohy- pophyse. Des travaux récents ont montré que 1'éminence médiane est la porte d'entrée de substances venant du cerveau, de 1'hypophyse et de la périphérie par les artères hypophysaires supérieures débouchant dans l’espace subdural (Palkovits et Mezey, 1981). La neurohypophyse est irriguée par les artères inférieures hypophysaires. Les artères hypo physaires supérieures et inférieures sont des branches des carotides internes . Par ailleurs, on a constaté la présence dans la tige pitui taire de vaisseaux d'origine neurohypophysaire reliés aux veines porta les ainsi qu’un lit capillaire entre les neuro et adénohypophyse (Page et coll . , 1980). Le sang capillaire est collecté à la sortie de la' glande dans les veines hypophysaires.
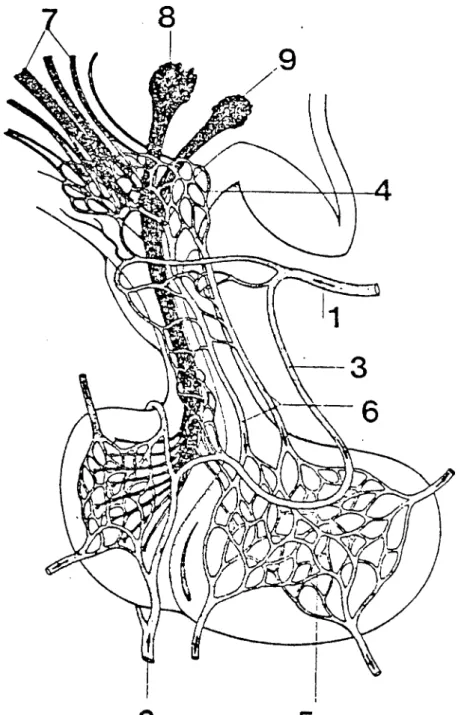
Un schéma simplifié des relations vasculaires et nerveuses entre 1’hypophyse et l’hypothalamus est représenté sur la Figure II.
La nature du contrôle exercé sur la sécrétion des hormones adéno- hypophysaires par les principales hormones et substances libérées par 1’hypo thalamus est indiquée dans le Tableau I:
FIGURE II: (D’après Krieger, 1980)
Ce dessin montre les communications vasculaires et nerveuses entre 1’hypophyse et 1’hypothalamus. Un plexus capillaire innervé dans
1'éminence médiane de 1'hypothalamus se jette dans la circulation vei neuse porte, laquelle traverse la tige pituitaire puis se disperse en un réseau capillaire terminal dans le parenchyme de 11 hypophyse anté rieure. L1 hypophyse postérieure a une jonction nerveuse directe avec 1’hypothalamus par un important trajet de fibres nerveuses provenant des noyaux supraoptique et paraventriculaire de 1’hypothalamus anté rieur.
Légende : 1: artère hypophysaire supérieure; 2: artère hypophysaire inférieure ; 3: artère trabéculaire ; 4: plexus primaire; 5: plexus
secondaire ; 6: veines portales longues ; 7: nerfs vers le plexus primai re; 8: noyau paraventriculaire; 9: noyau supraoptique.
TABLEAU I
Hormone s et substances hypothalamiques exerçant un effet stimulant ou inhibiteur sur la sécrétion des hormones adënohypophysaires
HORMONES ET SUBSTANCES NATURE HORMONES ADENOHYPOPHYSAIRES HYPOTHALAMIQUES DU CONTROLE SECRETEES
CRF s timulant ACTH --TRH s timulant / TRH^/ LHRH/FSHRH s timulant LH/FSH GHRH s timulant GH SOMATOSTATINE inhibiteur DOPAMINE inhibiteur PRL MSHRH s timulant ct-MS H MIF inhibiteur ??? s timulant CLIP (—) Lobe antérieur Lobe intermédiaire (—) Edwardson et Donaldson (1979)
A 1'exception de la dopamine qui résulte de 1'hydroxylation puis de la décarboxylation de tyrosine, dont le rôle de médiateur de l'in flux nerveux est bien connu, toutes les autres substances libérées par l'hypothalamus contrôlant la sécrétion hormonale adênohypophysaires sont des polypeptides.
Avant la découverte récente de l'activité inhibitrice de la dopa mine sur la sécrétion de la prolactine par le lobe antérieur, aujourd' hui clairement reconnue (Caron et coll., 1978), le rôle des neurotrans metteurs â ce niveau était considéré comme improbable (Buckingham,
1977) bien que dès 1951, il ait été suggéré par Long que la libération de l'ACTH dans le stress pouvait être consécutive à la décharge d'adré naline par les glandes surrénales.
L'impact des neurotransmetteurs sur la libération des hormones, hypophysaires peut s'exercer soit au niveau de l'hypothalamus qui
reçoit des afférences neuronales de multiples régions cérébrales, soit directement au niveau de l'hypophyse ou même à ces deux niveaux.
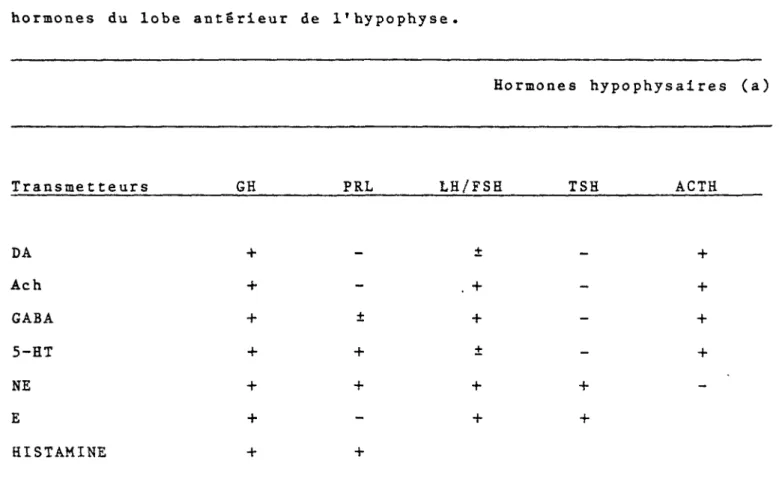
In vivo, en l'absence de lésion ou d'injection dans certaines structures spécifiques, la sécrétion de l'hormone considérée est la résultante d'activités à différents niveaux. Les résultats des travaux effectués sur la sécrétion des hormones du lobe antérieur (ACTH, GH, TSH, LH/FSH, PRL) sont schématiquement rapportés dans le Tableau II.
TABLEAU II: d’après Snyder et coll. (1980)
Effet des neuro transmetteurs cérébraux sur la libération in vivo des hormones du lobe antérieur de 1’hypophyse.
Hormones hypophysaires (a)
Transmetteurs GH PRL LH/FSH TSH ACTH DA + ± + Ach + - . + - + GABA + ± + - + 5-HT + + ± - + NE + + + + -E + - + + HISTAMINE + +
Ce tableau a été établi â partir des revues de Weiner et Ganong (1978), Krulich (1979), Negro-Vilar et coll. (1980).
a) Les augmentations des taux d'hormones dans le plasma sont indiquées par -T et les diminutions par - ;
b) Les transmetteurs pour lesquels des récepteurs membranaires au niveau de l’hypophpyse ont été démontrés par des études de liaison directe.
Les hormones sécrétées par les cellules corcicotrophes des lobes antérieur et Intermédiaire proviennent d’un même précurseur peptidique la proopiocortine qui est scindée par des protéases présentes dans les mêmes cellules corticotrophes en ACTH (corticotropin) et 8-LPH. Ces
hormones sont à leur tour clivées en fragments suivant la spécificité des enzymes présentes comme l'indique le diagramme ci-aprês:
3i k ACTH 1 ACTH \ 39 a-MSH CH .CO ---'NH. 2 1 13 Z CUP 18 39 3-LPH y-LPH /3-endorphin y-MSH met-enkephalin 41 58 61 65
Diagramme: d'après Edwardson et Donaldson (1979)
Ce diagramme montre les rapports structuraux entre les peptides appa rentés 3 la corticotropine et à la lipotropine provenant tous d'un précurseur commun gluco-protéinique, de poids moléculaire approximati vement de 31,000 (31K). Les processus enzymatiques conduisant du pré curseur aux fragments plus petits ne sont pas connus et les flèches indiquent seulement les séquences homologues (représentation non à l'échelle).
Le lobe intermédiaire de 1* hypophyse de rat est constitué par une population de cellules homogènes dont la sécrétion de 1'a-MSH est le peptide majeur (Meunier et Labrie, 1982).
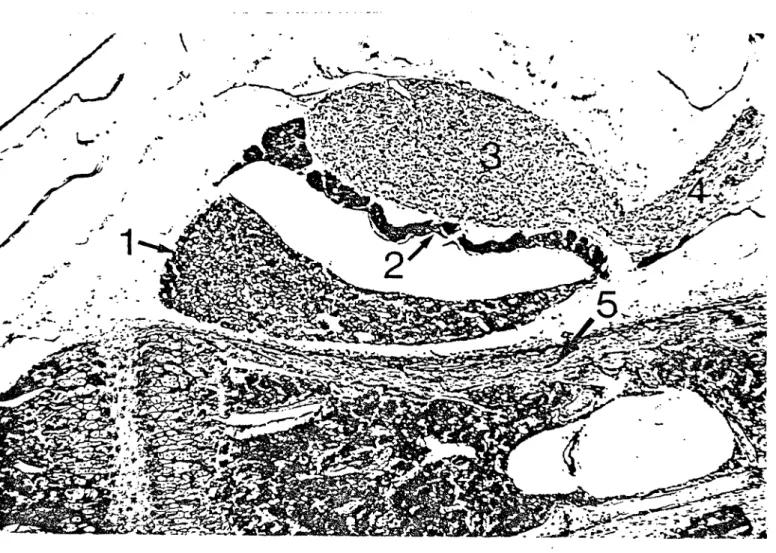
La Figure III donne une représentation histologique de 11 hypophyse de rat.
FIGURE III: Coupe histologique de 11 hypophyse de rat
Aspect général : 1 lobe antérieur; 2: lobe intermédiaire ; 3: lobe postérieur ; 4: tige pituitaire ; 5: selle turcique.
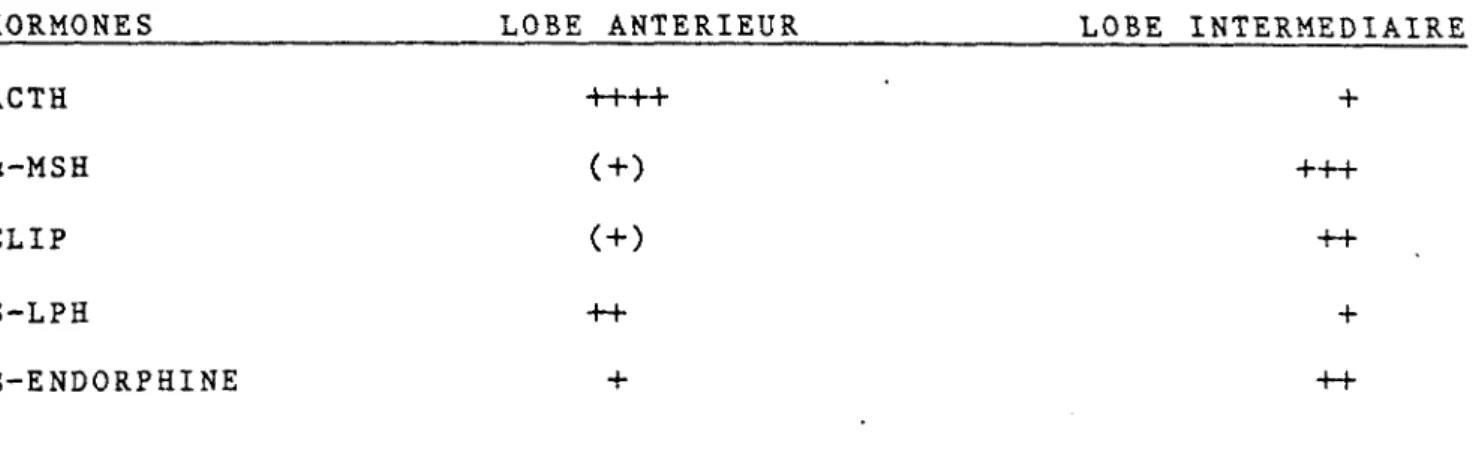
La comparaison des taux d'hormones sécrétées par des lobes
antErieur et intermédiaire est schématiquement donnée dans le Tableau III:
TABLEAU III: Comparaison des taux d'hormones adénohypophysaires
sécrétées par chacun des deux lobes. Le nombre de + est fonction de la quantité d'hormone sécrétée.
HORMONES LOBE ANTERIEUR LOBE INTERMEDIAIRE
ACTH ++++ +
a-MSH (+) +++
CLIP ( + ) ++
B-LPH -H- +
B-ENDORPHINE + ++
Indépendamment de leur localisation dans 1'adënohypophyse, les hormones hypophysaires (a-MSH, B-LPH, ACTH) ont été trouvées dans différentes structures cérébrales (hypothalamus, thalamus, cerveau médian) (Eskay et coll., 1979; Pelletier, 1979). Leur rôle est mal connu. Elles pourraient intervenir dans différentes manifestations du comportement (apprentissage, mémoire...) (Bohus et de Klost, 1979).
Les recherches sur la sécrétion des hormones hypophysaires ont longtemps été limitées par les jprocédés de dosage. Seules des méthodes biologiques longues, difficiles et le plus souvent peu sensibles
étaient utilisables. L'apparition des techniques radioimmunologiques a ouvert des perspectives nouvelles qui se sont révélées fructueuses.
L'ensemble des considérations envisagées souligne la complexité de la structure de la glande hypophyse, de la nature des hormones qu'elle sécrète et des mécanismes qui en sous-tendent la régulation de la sé crétion.
Le contrôle de la sécrétion de l'a-MSH par le lobe intermédiaire est particulièrement encore mal connu.
Parallèlement aux études in vitro effectuées au laboratoire par Hélène Meunier sur l'influence de divers principes biologiques et agents pharmacologiques sur la libération de cette hormone par des cellules de lobe intermédiaire en culture, il était intéressant de rechercher l'activité des mêmes composés in vivo, condition évidemment plus représentative de la réalité fonctionnelle. En effet, dans le modèle in vitro l'activité observée est exclusivement due à l'impact hypophysaire des composés étudiés alors que dans les essais sur l'ani mal entier, elle reflète l'ensemble des mécanismes qu'ils sont suscep
tibles d'induire par des impacts multiples.
Les résultats obtenus dans ces conditions font l'objet de ce tra vail qui comprend quatre chapitres.
Le chapitre I a trait aux données bibliographiques sur les méca nismes de contrôle de la sécrétion de l'a-MSH et autres hormones du lobe intermédiaire de l'hypophyse ainsi que sur les méthodes de dosage de l'a-MSH dans le plasma de rat.
Le chapitre II concerne la mise au point d'une technique radioim munologique de dosage de l’a-MSH dans le plasma utilisable dans une expérimentation sur l'animal.
Le chapitre III rend compte de l'influence de divers traitements (administration de CRF, d'agonistes adrénergiques, exposition à un stress) sur la libération de l'a-MSH.
Le chapitre IV décrit les conditions techniques mises en oeuvre en vue de la production d'antisérum contre l'a-MSH ayant une grande
sensibilité et spécificité.
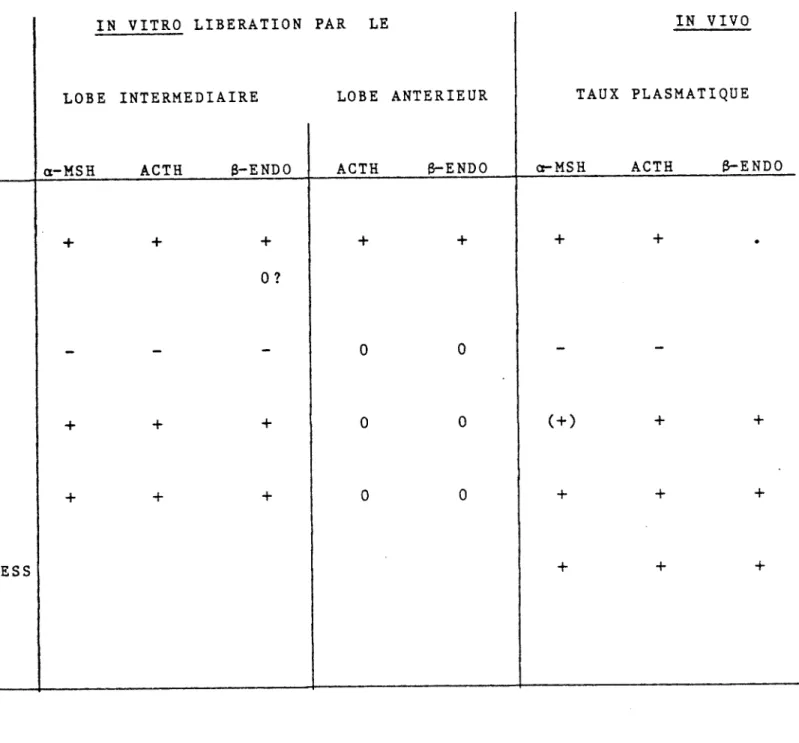
Enfin, en conclusion au travail, une représentation schématique des mécanismes les plus probables impliqués dans la régulation de la sécrétion de l'a-MSH est proposée.
CHAPITRE I
Etat des connaissances sur les mécanismes de contrôle de la sécrétion de 1'a-MSH et autres hormones du lobe intermédiaire de 1’hypophyse et les méthodes de dosage de 1'a-MSH dans le plasma de rat.
1. CONTROLE DE LA SECRETION DE L'a-MSH ET AUTRES HORMONES DU LOBE INTERMEDIAIRE
1.1. ACTION DES NEUROPEPTIDES HYPOTHALAMIQUES
La découverte des facteurs hypothalamiques responsables du contrô le des hormones du lobe antérieur (TRH, ACTH, LH/FSH, GH) incita la recherche de neuropeptides susceptibles d'agir sur la sécrétion des hormones du lobe intermédiaire.
Taleisnik et coll. (1966) ont observé que 1'injection d'extraits d'hypothalamus de rats S d'autres rats provoque une réduction de la concentration en o-MSH dans 1'hypophyse des animaux traités. Cet effet est attribué à un facteur, le MSH-re1easing factor ou MSH/RH qui libère 1'hormone hypophysaire.
Parallèlement, Kastin et Schally (1967 ) ont isolé de 11 hypothala mus de différentes espèces animales (rat, lapin, porc, mouton...) un
facteur dont 1'injection â des rats est suivie d'une élévation du taux hypophysaire en a-MSH par inhibition de sa sécrétion. Ce facteur est le MSH release-inhibiting factor ou MIF identifié à un tripeptide Pro- Leu-Gly-NH2 qui n'est autre que 1'extrémité C-terminale de l'ocytoci ne .
Kraicer et Morris (1976), Kraicer et coll., 1978 ; Briaud et coll. (1978) constatèrent que des extraits hypothalamiques pouvaient stimuler la sécrétion de 1'ACTH par le lobe intermédiaire.
Kraicer et Morris (1976) et Kraicer (1977) ont par ailleurs signa lé qu'une préparation purifiée de CRF, active.sur le lobe antérieur, était sans effet sur la sécrétion du lobe intermédiaire.
Vale et coll. (1978, 1979), utilisant une préparation purifiée de CRF, ont constaté, qu'à 1'inverse des cellules corticotrophes du lobe
antérieur, des cultures cellulaires de lobe Intermédiaire ne secré taient pas de 8-endorphine. D'autres peptides étudiés dans les mêmes conditions tels que le MIF , la bombésine, la substance P, la neuroten- sine, la vasopressine, le TRH, se sont également révélés sans effet sur la sécrétion de la S-endorphine.
Edwardson et Donaldson (1979) ont observé que des extraits hypo thalamiques pouvaient libérer du CLIP dans un perfusât de lobe neuroin termédiaire sans entraîner la libération de l'a-MSH.
1.2 ACTION DES NEUROTRANSMETTEURS
Dès 1966, Smelik démontra la présence de fibres catécholaminergi- ques dans le lobe intermédiaire de nombreuses espèces animales, y com pris le rat. Quelques années plus tard, Bjorklund et coll. (1973)
mirent en évidence que les fibres neuronales entourant les cellules de la pars intermedia contenant de la dopamine avaient leur corps cellu laire dans le noyau arqué de l'hypothalamus.
Par ailleurs, Tornatis et Taleisnik (1968) constatèrent une diminu tion des taux de l'a-MSH hypophysaire chez des rats traités à la rëser- pine.
Ces diverses observations laissaient envisager que la libération de l'a-MSH pouvait être sous le contrôle des catëcholamines.
Des recherches ont été réalisées in vitro et in vivo, concernant les agents dopaminergiques et adrénergiques.
1.2.1. Expérimentation In vitro
Diverses conditions expérimentales ont été utilisées:
- Superfusion de lobes neurointermédiaires de rats au moyen de Krebs-Ringer bicarbonaté et glucosé, oxygéné, puis dosage sur des fragments de peau de grenouille in vitro (Tilders et coll. , 1975 ; 1980; Smelik et Tilders, 1979).
- Incubation de glandes hypophysaires de rats ou de lobes neuroin termédiaires de grenouilles et dosage biologique sur des fragments de peau de grenouille par une méthode de photoréflexion (Bower et coll. , 1974).
- Culture de cellules de lobes intermédiaires sur milieu de Dulbecco modifié et dosage de l'a-MSH par RIA (Meunier et Labrie, 1982).
- Perfusion de cellules du lobe intermédiaire fraîchement séparées et fixées sur un support de biogel et dosage biologique, radioimmunologi que et par radiorécepteur (Kraicer et coll., 1981).
- Incubation de suspensions de cellules du lobe intermédiaire ou neuro- intermédiaires fraîchement préparées dans une solution saline de Earle équilibrée par un mélange 0 2 + CO 2• Dosage de l'a-MSH par RIA (Côté et coll., 1980; Munemura et coll., 1980).
1.2.1.1. Action de la dopamine et des agents dopaminergiques
rapporté-rent que la dopamine s’oppose â la sécrétion de 1'a-MSH et de l'ACTH par le lobe intermédiaire.
Smelik et Tilders (1979) ont confirmé ces résultats et de plus constaté que la dopamine est inactive sur la libération de l'ACTH par le lobe antérieur. Ils ont également observé avec Schmitt et coll . (1979) que la libération de 1'a-MSH est inhibée par perfusion d'un agent dépolarisant le K+ tandis que celle de l'ACTH est stimulée. Ce dernier effet en désaccord avec l'inhibition par la dopamine serait, selon les auteurs, due à la libération d'un facteur neurogêne dans la préparation. Il est cependant à noter que pour Briaud et coll. (1979) la dopamine stimule la sécrétion de l’ACTH par le lobe intermédiaire.
Tilders et coll. (1975) ont montré dans des conditions d'essais similaires, en utilisant des glandes prélevées chez des rats ayant été préalablement lésés au niveau de l'éminence médiane ou traités a la rëserpine, qu’une perfusion de K4- n'entraîne pas de libération de 1 ' a- MSH. Ces expériences indiquent bien que l'inhibition de la libération de 1'a-MSH sous l'effet de K+ s'exerce par l'intermédiaire des neurones dopaminergiques.
Meunier et Labrie (1982) ont comparé l'activité inhibitrice de nombreux agonistes dopaminergiques sur l'adényl cyclase par la mesure du taux basal d'AMP cyclique dans des cellules en culture. Les résul tats obtenus ont conduit â l'ordre d'activité décroissant suivant: lisuride > 2-bromo-a-ergocryptine > pergolide > dihydroergocryptine > apomorphine > lergotrile > dopamine. Cet effet est antagonisé par les antidopaminergiques. L'ordre d'activité des composés étudiés est le suivant: spiropéridol > thiopropërazine > dompëridone > halopëridol > sulpiride > fluphënazine > pimozide > butaclamol. Les agonistes dopami nergiques réduisent également le taux d'AMP cyclique stimulé par l'iso-
en évidence de 11 Inhibit ion par les dopaminergiques de l’activité de l'adënyl cyclase du lobe intermédiaire a remis en cause la classifica tion proposée par Kebabian et Calne (1979) fondée sur la distinction entre récepteurs couplés â l'adënyl cyclase, désignés par DI, et récep teurs non couplés, désignés par D2, les premiers étant localisés en particulier dans la parathyroïde et le striatum, les seconds dans 1 *adénohypophyse. Meunier et Labrie (1982) proposent d'utiliser une terminologie en rapport avec le sens de l'interaction avec le système adényl cyclase :
- DA+ stimulant de l'adënyl cyclase (parathyroIdie et striatum) - DA_ inhibiteur de l'enzyme (antéhypophyse)
- DAq non couplé â l'adënyl cyclase.
Des résultats, similaires à ceux de Meunier et Labrie sur l'inhi bition de la sécrétion de l'a-MSH par les dopaminergiques, ont été obtenus par Munemura et coll. (1980). Ils ont de plus mis en évidence que les antagonistes dopaminergiques s'opposent à l'inhibition de la dopamine vis-à-vis de l'augmentation de 1'AMP cyclique stimulée par l'isoprotërënol. L'étude de la norëpinëphrine et de 1 'épinêphrine les a conduit â conclure qu'elles pourraient avoir une action agoniste dopaminergique comme le montre, en ce qui concerne la formation d'AMP cyclique, la réduction par un bloqueur dopaminergique de l'inhibition observée vis-à-vis de l'isoprotërënol.
Côté et coll. (1981) ont constaté que 1'apomorphine réduit la
stimulation par le GTP de l'adënyl cyclase qu'il s'agisse de l'activité basale ou de l'activité stimulée par l'isoprotërënol.
D'après Vale et coll. (1979) la dopamine et 1'apomorphine sont des inhibiteurs puissants de la sécrétion spontanée et stimulée par l'iso- butyl-3-méthylxanthine (IBMX) de la 8-endorphine. Comme pour l'ACTH,
les agonistes dopaminergiques n'inhibent pas la sécrétion de la g- endorphine par le lobe antérieur.
Selon Kraicer et coll. (1981), l'action inhibitrice de la dopamine sur la sécrétion par le lobe intermédiaire de l'a-MSH et de 1'ACTH
s'exerce aussi sur d'autres peptides tels que le CLIP, la g-LPH, la g- endorphine. L'inhibition de la dopamine sur ces deux derniers peptides est antagonisëe par la dompëridone (Vermes et coll., 1980).
1.2. 1.2. Action des agents adrénergiques
Bower et coll., dès 1974, ont recherché 1'action de plusieurs agonistes adrénergiques (épinéphrine, norëpinéphrine, phënyléphrine, isoprotérénol) sur la sécrétion de l'a-MSH. Ils ont constaté avec les agonistes a-adrénerglques, à forte concentration, une inhibition de la sécrétion de l’a-MSH comme avec les dopaminergiques et à faible concen tration, une augmentation plus ou moins nette. L'isoprotérénol, doué d'une activité agoniste g-adrénergique, s'est révélé activateur de la sécrétion. Cette dernière propriété a largement été confirmée au cours des recherches ultérieures.
® s p r e s Tilders et coll. (1980) , la stimulation par 1'isoprotérë — nol de la libération de l'a-MSH est parallèle à celle de 1'ACTH tant en amplitude qu'en durée. Cet effet est antagonisé par le propranolol. L épinephrine exerce la même action à faible concentration. A forte concentration, la sécrétion de 1'ACTH est diminuée, cette inhibition, qui est antagonisëe par un bloqueur dopaminergique, pourrait être due à une stimulation des récepteurs dopaminergiques .
Contrairement à ce qui a été observé au niveau du lobe intermé diaire, 1'isoprotérénol n'augmente pas la sécrétion de
adrénergiques exercent par contre à ce niveau une activité stimulante (Giguère et coll., 1981; Vale et coll., 1979).
Côté et coll. (1980) ont montré que la stimulation des récepteurs 8-adrénergiques du lobe intermédiaire accroît 1'activité de l'adényl cyclase, 1'accumulation en AMP cyclique et parallèlement la libération de 1' ct-MSH.
Meunier et Labrie (1982) ont, dans le but de déterminer la spéci ficité des récepteurs 8 concernés, examiné toute une série d'agonistes et d'antagonistes adrénergiques sur le système adënyl cyclase. Pour une augmentation de quatre â six fois de la concentration en AMP cyclique, l'ordre d'activité décroissante des agonis tes est le suivant : zintërol > hydroxy-benzyl-isoprotërénol > isoprotërénol
>
sotërénol > procatërol > épinëphrine > norépinéphrine. Ce classement suggère la nature 62 des récepteurs.L'activité de 1'isoprotërénol est plus ou moins nettement inhibée par les antagonistes g-adrënergiques. Le dichloro-isoprotërénol s'oppo se totalement à son action. Le faible pouvoir antagoniste de composés plus spécifiquement 01 tels que le practolol et le métoprolol renforce l'idée de la nature 02 des récepteurs.
La stéréosélectivité de ces récepteurs est démontrée par la plus haute activité des isomères (-) de 1'isoprotërénol, de 1'épinëphrine et du propranolol comparée â celle des isomères (+) correspondants.
Meunier et Labrie (1982 ), contrairement â Munemura et coll. (1980), ont observé une stimulation de 1'activité basale de l'AMP
cyclique par 1'épinëphrine et la norê piné phrine qu'ils attribuent à une plus grande réactivité fonctionnelle des récepteurs dans leurs condi tions d'essais. L'activité de ces composés est augmentée en présence d'un bloqueur dopaminergique, 1'halopéridol, qui renforce leur spécifi cité pour le récepteur 8-adrénergique.
L * activité mixte 8-adrénergique et dopaminergique de ces composés, ainsi mise en évidence, ressort également des travaux de Munemura et coll. (1980) qui de plus, ont constaté la réduction par le propranolol de la stimulation par 11épinéphrine et la norëpinéphrine en présence d’un bloqueur dopaminergique. L’ensemble de ces constatations suggère que les neurones sympathiques qui innervent le lobe intermédiaire
pourraient contrôler la libération de 1'a-MSH.
D'après Vermes et coll. (1980), 1'isoprotérënol stimule la
sécrétion de la g-endorphine qui est bloquée par le propranolol. Le propranolol seul est sans effet. L'isoprotérënol est inactif sur la sécrétion de la g-endorphine par le lobe antérieur.
1.2.1.3. Autres neurotransmetteurs
Sérétonime
Des résultats contradictoires ont été rapportés en ce qui concerne son activité sur la sécrétion de l'ACTH. Pour Briaud et coll. (1979) elle est inactive, pour Kraicer et coll. (1978, 1980) elle la stimule.
Elle est sans effet sur la sécrétion de la g-endorphine (Vale et coll., 1979; Vermes et coll., 1980).
Acétylcholine et cholinergiques
L'acétylcholine est sans effet sur la sécrétion de l'ACTH du lobe intermédiaire de même que sur celle du lobe antérieur (Briaud et coll., 1979).
Le carbachol ou carbamoyl-choline est inactif sur la sécrétion de la g-endorphine par des cellules de lobe intermédiaire en culture (Vale et coll., 1979).
1.2.2. Expérimentation in vivo
Dès les premières recherches, il a Eté constaté que des traite ments divers, chimiques (phënothiazines, morphine...) ou physiques
(stress, obscurité), étaient à 1'origine de variations dans les taux hypophysaires et plasmatiques de l'a-MSH. Une diminution du taux pituitaire et une élévation simultanée du taux plasmatique observées dans la plupart des cas, a suggéré une libération de 11 hormone par la glande. Une action sur sa synthèse a été proposée pour justifier une dissociation entre les deux effets (Kastin et coll. , 1969).
Tous les essais faisant l'objet de ces recherches ont été réali sées sur le rat, vigile ou anesthésié. Les composés étudiés ont été administrés soit en injection rapide, le plus souvent par voie intrapé ritonéale (Kastin et coll., 1969; Oliver et coll., 1976; Penny et Thody, 1976 ; 1978 ; Usategui et coll., 1976; Thody et coll., 19 7 5) soit en perfusion intraveineuse (Tilders et coll. , 1980 ; Smelik et Tilders, 1979; Smelik, 1981; Be rkenbos ch et coll., 1981). Des essais ont été réalisés après lésions de certaines structures dans le but de localiser les effets observés. Les dosages ont été effectués par voie biologique (Kastin et coll., 1969) ou dans, la plupart des cas, par RIA.
1.2.2.1. Action de la dopamine et des agents dopaminergiques
Les bloqueurs dopaminergiques comme la trifluopérazine (Kastin et coll., 1969 ; Thody et coll., 1975 ; Penny et Thody, 19 7 6) , 1'halopë ridol (Oliver et coll., 1976; Usatégui et coll., 1976; Penny et Thody, 1978) entraînent une diminution du taux pituitaire et une élévation du taux plasmatique de l'a-MSH.
norépiné-phrine), de même que 1'a-mëthy1-paratyrosine, qui s’oppose à la synthè se des catëcholamines par inhibition de la tyrosine hydroxylase, don nent également lieu à une élévation prolongée du taux de l’a-MSH plas matique (Penny et Thody, 1978).
Une diminution du taux de l’hormone dans le plasma est par contre constatée après traitement par un agoniste dopaminergique comme la bromocryptine (Penny et Thody, 1978).
Chez des rats dont les connections hypothalamo-hypophysaires ont été détruites par lésions de l'éminence médiane, Tilders et Smelik
(1978) ont constaté que des bloqueurs dopaminergiques (halopéridol, pimozide) abaissent la teneur en o-MSH de l'hypophyse après récupéra tion du taux basal tandis que des agonistes dopaminergiques (apomorphi- ne, bromocryptine) préviennent l'abaissement de la teneur en a-MSH dû à la lésion. Cette expérimentation comme la suivante démontre bien que l'impact dopaminergique a lieu au niveau de l'hypophyse même.
Plus récemment, en effet, Smelik (1981) a rapporté qu'un antagoni ste dopaminergique dépourvu d'effet central, la dompéridone, provoque une élévation dose-dépendante des taux plasmatiques de 1'a-MSH, de
l'ACTH et de la corticostérone. Ce résultat est en faveur d'un blocage des récepteurs dopaminergiques au niveau hypophysaire étant donné que la dompéridone ne franchit pas la barrière hëmatoencëphalique.
1.2.2.2. Action des agents adrénergiques
L'isoprotérénol entraîne une élévation du taux de corticostérone et d’a-MSH circulantes chez l'animal intact. Après lésion électrother mique de la région ventromédiane et de l’hypothalamus comprenant le noyau arqué et l'éminence médiane, l'activité de 1'isoprotërënol sur le taux de corticostérone est inchangé. Cette constatation suggère une
action directe de 1'isoprotërënol sur 1 * hypophyse. L*isoprotërënol est d'autre part sans effet chez l'animal hypophysectomisë. Par ailleurs, l'élëvation du taux de corticostërone induite par 1'Isoprotërënol est complètement antagonisée par le propranolol (Smelik et Tilders, 1979; Tilders et coll., 1980).
De même, 1'épinëphrine provoque une augmentation parallèle des taux plasmatiques de l'a-MSH, de l'ACTH, de la corticostërone et de la 8-endorphine. Ce s effets sont supprimés par un prétraitement par le propranolol (Smelik, 1981; Berkenbosch et coll., 1981; Tilders et coll., 1982). Il avait ëtë précédemment constaté que 1 'épinëphrine était inactive sur la libération de l'ACTH chez le rat ayant subi une ablation du lobe neurointermêdiaire (Smelik, 1960).
Les catëcholamines peuvent libérer l'ACTH du lobe intermédiaire en quantité suffisante pour activer le cortex surrénalien.
Une étude critique du contrôle dopaminergique et adrénergique de la sécrétion de l'ACTH et de la 8-endorphine, argumentée sur les résul tats d'essais in vivo, est rapportée dans la discussion de l'article annexé (pp. ) .
1.3 ACTION DES STEROÏDES ENDOCRINIENS
La sécrétion des hormones du lobe antérieur de l'hypophyse est par action de feedback sous le contrôle des hormones surrénaliennes,
sexuelles et thyroïdiennes (Labrie et coll., 1979).
L'inhibition de la sécrétion de l'ACTH par action de feedback négatif des corticostëroïdes est bien connue. Cet effet s'exerce au niveau de l'hypophyse, de l'hypothalamus et probablement même de
centres nerveux supérieurs (Jones et coll., 1979; Buckingham et Hodges, 1979).
L'action inhibitrice de la corticostërone sur la sécrétion de 1 * ACTH par des cellules hypophysaires isolées (Portanova et Sayers, 1973) ou par des demi-hypophyses (Fleischer et Vale, 1968) a été rapportée.
Giguêre et Labrie (1982 ) ont constaté que les glucocorticoïdes (triamcinolone acétonide, dexaméthasone, cortisol, corticostërone) inhibent la sécrétion de 1'ACTH stimulée par 1'ëpinéphrine dans des cultures de cellules de lobe antérieur alors que les hormones sexuelles (oestradiol, dihydrotestostërone, R5020 - composé progestomimëtique) sont inactives.
Des résultats similaires ont été obtenus lorsque les cellules sont stimulées par un extrait hypothalamique doué d*"activité CRF", le bro- mo-AMP cyclique ou 1’isobutyl-3-méthylxanthine (IBMX) (Côté, 1982).
Contrairement à ce qui a été observé avec les glucocorticoïdes sur le lobe antérieur, la dexaméthasone a été trouvée sans effet sur la sécrétion de 1'ACTH in vitro par le lobe neurointermêdiaire (Fischer et Moriarty, 1977).
De même la sécrétion de la 8-endorphine par des cellules de lobe neurointermédiaire en culture n’est pas modifiée par les glucocorticoï des (Vale et coll. , 1979).
In vivo, chez le rat intact traité à la dexaméthas one et chez le rat surrénalectomisë, le taux plasma tique de 1' a-MSH est inchangé tandis que le taux de 1'ACTH est respectivement diminué et augmenté (Usategui et coll., 1976).
La dexaméthasone.est également sans effet sur 1’élévation de
1’a-MSH provoquée par un stress à l'éther ou par injection d'halopëri- dol alors qu'elle s'oppose dans les mêmes conditions à 1'augmenta tion de 1'ACTH (Kastin et coll., 1969 ; Oliver et coll., 1976).
1.4 ACTION DU STRESS
Les différentes formes de stress (physique ou psychologique) en traînent des modifications dans la concentration des amines biogènes dans le système nerveux central ainsi que dans le sang (Palkovits, 1979). L'interaction des amines sur la sécrétion des hormones hypotha lamiques et pituitaires a été abondamment étudiée mais les mécanismes impliqués sont encore mal connus. La plupart des travaux concernent la libération des hormones du lobe antérieur de 1'hypophyse et plus parti culièrement de 1'ACTH.
La sécrétion d'o-MSH par le lobe intermédiaire après stress a été signalée par plusieurs auteurs (Kastin et coll. , 1969 ; Oliver et coll., 1976; Usategui et coll., 1976), cet effet s'accompagne d'une diminution de son taux dans le lobe neurointermédiaire (Thody et coll., 197 5 ) .
Dans un stress par contrainte ou évitement passif, il a été observé que 1'augmentation de 1'o-MSH plasmatique s'accompagne de celle de la 0- endorphine et que ces réponses sont antagonisëes par le propranolol
(Be rkenbo s ch et coll., 1981).
Dans un travail récent, Monnet et Lichtensteiger (1981) ont mis en évidence des différences dans les taux de 1'o-MSH sérique suivant la nature du stress appliqué. Parallèlement, ils ont noté que les neuro nes dopaminergiques du noyau arqué, qui comme on le sait contrôlent la libération des hormones du lobe intermédiaire, donnent une réponse positive par histomicrofluorimétrie après un stress physique et non après un stress psychologique.
Toute une série de travaux ont, au cours de ces dernières années, été consacrés à l'étude de la sécrétion de 1'ACTH par le lobe intermé diaire (Smelik et Tilders, 1979 ; Tilders et coll., 1980 ; Smelik, 1981) . Moalhe-Voloss (1955, 1958) avait antérieurement rapporté que des
stimuli émotionnels induisent une réduction du taux de l'ACTH dans le lobe intermédiaire sans changer celui du lobe antérieur tandis que ce dernier est sélectivement affecté par des stimulis physiques. De plus, l'activation surrénalienne en réponse
S
un stress psychologique est très réduite après extirpation du lobe neurointermédiaire tandis qu'el le est normale après un stress physique (Smelik et Tilders, 1979).Smelik (1981) suggère que des stimuli capables d'entraîner une décharge surrénalienne peuvent provoquer la libération de l'a-MSH et de l'ACTH par stimulation directe par les catécholamines circulantes des récepteurs g-adrénergiques localisés au niveau du lobe intermédiaire. De tels stimuli pourraient simultanément réduire l'inhibition dopami nergique de l'hypothalamus sur le lobe intermédiaire de l'hypophyse. La
possibilité d'une action directe au niveau du lobe intermédiaire rejoint l'hypothèse proposée par Long, dès 1952, qui rapportait la
libération de l'ACTH à l'adrénaline sécrétée par la surrénale au moment du stress. La découverte du contrôle du lobe antérieur par le CRF a conduit à abandonner cette hypothèse. Il n'est toutefois pas exclu que les deux mécanismes co-existent.
2. METHODES DE DOSAGE DE L'a-MSH DANS LE PLASMA DE RAT
Dans les premiers travaux sur la sécrétion des hormones mëlanotro-piques, leur évaluation, réalisée par voie biologique, était fondée sur la propriété qu'elles possèdent de provoquer une expansion des mélano-phores de la peau des vertébrés inférieurs. Les méthodes par réflexion de fragments de peau isolée de grenouille, douées d'une sensibilité suffisante pour mesurer les taux d'hormones mëlanotropiques dans le
plasma, ont le plus généralement été utilisées avant l'introduction des méthodes radioimmunologiques (pour références, Thody et coll., 1975, Wilson et Morgan, 1979).
La première méthode de dosage par RIA de 1' o-MSH a été décrite par Ross et coll. (1966), des variantes 5 cette méthode ont depuis été
rapportées. Les caractéristiques des méthodes de dosage de 1 * a-MSH dans le plasma de rat sont rassemblées dans le tableau IV.
Elles concernent :
*la préparation de l'antisérum *le procédé d'iodation de 1 * a-MSH
*1'extraction éventuelle de 1'a-MSH du plasma *le milieu réactionnel du dosage
*la séparation des formes libre et liée à 11 anticorps *la sensibilité du dosage
*les taux normaux
Les différences entre les diverses techniques sont peu importan tes . Elles ont pour but d* améliorer la sensibilité et la rapidité du dosage. La sensibilité dépend beaucoup de la qualité de l'antisérum utilisé et éventuellement du procédé d1 extraction de 1'hormone du plas ma. Une réduction de la durée d * incubation entre 11 hormone marquée et 11 incubat de l'antisérum et de 1'hormone froide permet Egalement d'amé liorer la sensibilité (Wilson et Morgan, 1980). La suppression du stade d * extraction dans un but de simplification de la méthode a conduit à des résultats satisfaisants.
Il est à noter que les taux évalués par RIA représentent environ 80% de ceux obtenus par les méthodes biologiques (Thody et coll.,
ANTISERUM
Sérum lapin ou mou ton immunisé par cfr-HSH eyntli. couplée à SAB par ECDl
Sérum lapin immunisé couplée â SA1
par o-MSH synthétique a par ECDI
Sérum lapin lmraunlaé par o-MSIl synth. cou plée ï SAB par 1 cy- clohexyl 3 (2-morpho- llno ethyl)carbodllmldi
Sérum lapin Immunisé par o-MSIl synth. couplé 8 SAH par ECDI
StSrum lapin immunisé par o-MSIl extraite d'hypophyses de porc couplée 8 SAL ou polylyslne par ECDl
Vols d'Immunisation IV puls ID SC + IM + IP SC puls ID SC SC + IM
,25I-a-HSH tampon phosphate pH 7.5) or-MSt! synthétique + Na 125I + CT( 1 ) arrêt réaction par MBS, chromato graphie sur colonne
o-MSH synth. + Na12SI + CT(3) tampon phosphate (pH 7.4) arrêt réaction par MBS fixation sur QUSO élut ion par acétone
MSH synth. + Na12il + CT(3)
tampon acétate(pll 4) arrêt réaction par MBS
fixation sur QUSO
o-MSH synth. 4Na *2*I + lactoperoxydase + H 0^
tampon acétate (pH 5.6) arrêt réaction par NaN3 chromatographie sur Séphadex
o-MSH synth. 4Na IZ3I + CT (3)
tampon phosphate (pH 7.5)
arrêt réaction par MBS fixation sur QUSO elution par HCl (0.IN) pule chromato- tographle sur
Séphadex par SAB ÉXTÜÀdflON o-MSIl
du plasma
Fixation sur résine cationique, elution par acide acétique ou dosage direct
1) Extraction par Dosage
ethanol direct
2) Fixation sur sphérosll sur 3) Elution par ethanol plasma
ammoniacal
Fixation sur talc Elution par ethanol
Extraction par acide acétique/ acétone
Fixation sur Florl- sll, élutlon par éthanol ammoniacal MILIEU REACTIONNEL DU DOSAGE Tampon phosphate- lysosyme (pli 7.4)
Tampon phosphate - SAH (pH 7.4) Tampon véronal-SAH (pH 8.6) Tampon phosphate-SAL (PH 7.5) Tampon phosphate- albumine oeuf (pH 7.4) SEPARATION o-MSH LIBRE - LIE Précipitation du lié par PEG (2)
Adsorption du libre sur charbon/SAC/dextran (4)
Adsorption du libre sur charbon/SAB/ dextran
Précipitation par technique double anti corps: sérum chèvre antlglobullnea lapin
Précipitation par technique double anticorps : sérum Ine anti-lapin SENSIBILITE DU DOSAGE 50 pg/ml (sans extraction) 10 PB * PB . 6-10 pg 6 pg/ml 5 pg/ml TAUX NORMAL 1) 305 i 25 pg/ml 2) 182 t 22 pg/ml 222 1 10 pg/ml 64-142 pg/ml 160-215 pg/ml 25-73 pg/ml (D Island
SAL, SAB, SAC, SAH ■ Sérum albumine de lapin, de boeuf, de cheval, humaine (Z) Desbuquols et Aurbach (1971) IV, ID, IM “ Intraveineuse, intradermique, Intramusculaire (3) Greenwood et al. (1963)
SC ■ souecutanée (4) Herbert et al. (1965)
o-MSH synth - o-MSH synthétique
ECDI - I-éthyl-3 (3-dlméthylamlnopropyl) carbodllmlde PEG - Polyéthylène glycol
CT ” chloramine T MBS - métablsulflte
CHAPITRE II
scription de la méthode radioimmunologique utilisée pour le dosage de l'a-MSH dans le plasma de rat
I. METHODE UTILISEE POUR LE DOSAGE DE L’otmSH DANS LE PLASMA DE RAT
1. PRINCIPE GENERAL
Le dosage est réalisé par une méthode radioimmunologique dont le principe est rappelé ci-après :
Il consiste à mettre en présence 1'hormone à doser, 1'hormone corres pondante radioactive et l'antisérum. Pour une quantité dé terminée d * antisérum, il s ' établit un équilibre entre antigènes libres et combi nés radioactifs et non radioactifs. La quantité d'antigène non radio actif, c'est-à-dire 1'hormone à doser, est déduite de la quantité d'an tigènes radioactif sous l'une des deux formes.
Les réactions de compétition à la base du dosage radioimmunologi que sont représentées ci-après:
Antigène radioactif
Anticorps Complexe antigène-anticorps spécifique radioactif
Ag* + Ac ""...Ag* - Ac
+ Antigène non radioactif dans des solutions standard en quantité Ag connue ou des échantillons en
quantité inconnue
La méthode proposée est inspirée de celles décrites antérieurement (pp. ), elle s'applique directement au plasma sans extraction pré alable de 1 * hormone.
Elle comporte les étapes suivantes :
- Radioiodation de l'a-MSH synthétique (méthode de Hunter et Greenwood , 1962).
- Incubation antigène-anticorps
- Séparation de l'a-MSH libre et liée à 1'anticorps - Comptage de la radioactivité
Les conditions optimales concernant certaines de ces étapes ont été précisées. Des résultats obtenus, il ressort les conclusions suivantes :
Radioiodation: Un temps de contact de 90 secondes de la chlorami- ne-T dans le milieu réactionnel a fourni les résultats les plus favora bles. La détermination de ce temps de contact est importante car un excès de fixation d' 12^1 Sur la tyrosine (acide aminé en position 2) de l'a-MSH entraînerait une diminution d'affinité de son site antigénique sérine-tyrosine-sérine (acides aminés en position 1-2-3) pour l'anti corps.
- Incubation : le .pourcentage de liaison spécifique maximal, en fonction du temps et de la température a été obtenu après une incuba tion de 18 à 24 heures, à 4 °C (Figure IV).
La diminution de sensibilité et du taux de liaison spécifique, observés en présence de plasma, a conduit à établir les courbes
standard en présence d'une quantité égale de plasma de rats hypophysec- tomisés à celle de 1'échantillon à doser et non exclusivement
dans le tampon.
Une augmentation de la sensibilité du dosage est obtenue si au lieu d'incuber â 1'équilibre pendant 24 heures 1 * antigène marqué et 1'antigêne froid en présence de 1'anticorps, on ajoute 1'hormone marquée pendant une durée limitée à 2 heures, après prëincubation pendant 24 heures de 1'hormone froide et de l'antisérum. Dans ces conditions, seuls les sites antigèniques de haute affinité sont impliqués dans la réaction antigène-anticorps. Cette technique
d'addition retardée de 1'hormone marquée a été pour la première fois introduite pour le RIA de 1'insuline par Haies et Randle (1963). Elle a été récemment utilisée pour le dosage de 1'a-MSH par Wilson et Morgan (1979).
- Séparation : Un temps de contact entre 1'incubat et le mélange de séparation charcoal/sérum humain/dextran compris entre 5 et 60 minutes s'est montré sans influence sur les taux de liaisons spécifique et non spécifique (Figure V).
Ces diverses considérations ont conduit à adopter le protocole de dosage décrit ci-après:
2. MATERIEL ET REACTIFS
2.1 Produits utilisés
L'antisérum de lapin aimablement fourni par le Dr C. Oliver (Marseille) a été préparé selon la technique décrite par Usategui et coll., 1976).
Les autres produits sont commerciaux: + a-MSH synthétique (Beckman)
+ Na125! (5 mCi dans 10 pl de NaOH 0.1 N) New England Nuclear.
+ Chloramine T ou (N-chloro-p-toluène sulfonamide sodique) (Sigma) + QUSO G32-Philadelphia Quartz Co.
+ Dextran T-70 Pharmacia + Charcoal Norit A-Fisher.
Iodation de 1’a-MSH
Dans un tube de verre, à 1 pg d'a-MSH synthétique dilué dans 10 pl de tampon phosphate 0.01M (pH 7.4), on ajoute 10 pl d’une solution de Na125I équivalent à 1 mCi (solution mère diluée au l/5ième dans du tampon phosphate au moment de l’emploi), puis 10 pl d'une solution de chloramine T à 0.5 mg/ml dans du tampon phosphate 0.3 M (pH 7.4). La réaction est réalisée sous une hotte bien ventilée, à la température ambiante, en agitant pendant 90 secondes. Elle est arrêtée par addi tion de 0.5 ml de tampon phosphate 0.3 M (pH 7.4).
On purifie 1’a-MSH iodée en ajoutant 1 ml de plasma humain désac tivé et 10 mg de QUSO. On mélange sur agitateur Vortex pendant 30 secondes, centrifuge pendant 5 minutes â 3000 tours/minute en centrifu geuse réfrigérée et sépare le surnageant. Le QUSO sur lequel est fixé, 1’125I a-MSH est lavé avec 4 ml d'eau distillée. On agite au Vortex et centrifuge pendant 5 minutes comme précédemment. Le surnageant est séparé. On ajoute au culot 3 ml d'HCl 0.1 N qui extrait 1' 125I a~MSH. Après agitation au Vortex et centrifugation, le surnageant contenant
1' 12 5i a-MSH est recueilli.
Dans les conditions décrites, le pourcentage d’12^Iode incorporée est de l'ordre de 35%.
(Rapport : radioactivité du surnageant acide contenant 125I o-MSH x 100) radioactivité totale
La solution chlorhydrique obtenue, conservée à 40C, est directement utilisable pendant 2 semaines.
2.3 Gamme de standards:
L'a-MSH synthétique est conservée à -20 °C en solution dans du tampon phosphate 0.01 M (pH 7.4) à la concentration de 1 Mg/10 Ml dans des vials en polystyrene.
On prépare au moment de 1'emploi une solution à 100,000 pg/100 Ml dans du tampon albumine. A partir de cette dernière, on effectue les dilutions aux concentrations suivantes : 5,000, 2,500, 1,000, 500, 250, 100, 50, 25, 10, 5, 2.5, 1.0.5, 0.25, 0.1 pg/100 pi.
Tampon albumine :
NaH2P04 0.05 M 13.8 g
Na Cl 0.1M 11.7 g
bovine serum albumine purifiée 0.1% 2.0 g
NaN 3 0.1% 2.0 g
Eau déminéralisée asp 2 litres
Le pH est ajusté à 7.5 au moyen de Na OH concentrée.
2.4 Plasma humain désactivé:
Le plasma humain est désactivé par la chaleur et traité au charcoal A 100 ml de plasma humain, on ajoute 5 g de charcoal No rit A. On
chauffe à 40-50°C pendant 2 heures, sous agitation. On centrifuge à 5000 tours/minute pendant 30 minutes, décante et centrifuge à nouveau à 12,000 tours/minute pendant 30 minutes.
Le plasma traité est conservé congelé.
3. PRELEVEMENTS DE SANG:
Le plasma obtenu à partir de sang recueilli en présence d'EDTA disodi— que est conservé congelé à -20°C jusqu'au dosage. Il est alors décon gelé lentement et centrifugé à 3000 tours/minute, pendant 10 minutes.
4. TECHNIQUE DE DOSAGE
Dans un tube de verre, S 100 pl de plasma, on ajoute 50 pl d'antisérum dilué à 1/7500 ième dans du tampon albumine puis 100 Pl de tampon albu mine. On agite au Vortex et on laisse incuber 24 heures â 4°C. On ajoute alors 50 pl de solution d'125I a-MSH à 10000 cpm/50 Pl. On agite au Vortex et on laisse en contact pendant 2 heures à 4°C. Les fractions libre et liée d'125I a-MSH sont séparées par addition de 250 pl d'une suspension dans l'eau déminéralisée de dextran T-70, charcoal Norit A, sérum humain décongelé centrifugé à 3000 tours/minute pendant 15 minutes (0.25%, 2%, 10%). On centrifuge pendant 15 minutes à 3000 tours/minute. On sépare le surnageant par décantation puis la radioac tivité de ce dernier est mesurée pendant 1 minute sur compteur gamma automatique (Rack gamma LKB). L'essai est réalisé en duplicate.
Dans la gamme de standards, on remplace le tampon albumine par du plasma de rat hypophysectomisë. On prépare 4 tubes blancs (excès d' a- MSH froid 100 pl d'une solution à 100,000 pg/100 pl) et 4 tubes
4.2 Sensibilité du dosage:
Dans les conditions décrites, la courbe standard permet d * évaluer des doses allant de 1 à 500 pg/tube, avec un DE 5o variant de 18 à 24 pg/tube (Figure VI).
Remarque :
La liaison nette maximale obtenue dans ces conditions avec l'antisérum utilisé est d'environ 20%.
4.3 Calculs :
Les résultats des dosages ont été traités à 1'ordinateur au moyen d'un programme basé sur le modèle II de Rodbard et Lewald (19 70) . Les
courbes dose-réponse et les doses effectives 50 (DE 5 Q) ont été
calculées par des régressions itératives non linéaires des moindres carrés, selon Rodbard (1974).
La signification statistique a été déterminée selon le test à niveaux multiples de Kramer (1956).
Toutes les valeurs sont représentées par la moyenne
-
erreur standard (S.E.M.)LEGENDES DES FIGURES
Fig. IV. Influence du temps d'incubation et de la température sur le taux de liaison spécifique antigène-anticorps. L’essai est réalisé dans les conditions décrites pour le dosage.
Fig. V. Influence du temps de contact entre l’incubat et le mélange de séparation charcoal/sërum human/dextran sur les taux de liaisons
spécifique et non spécifique. L'essai est réalisé dans les conditions décrites pour le dosage.
Fig. VI. Exemple de courbe standard utilisée pour le dosage de l'ot-MSH. Rapport B/Bo en fonction des quantités d'a-MSH en pg/tube.
L
IA
IS
O
N
S
P
É
C
IF
IQ
U
E
(B
/T
%)
TEMPS D’INCUBATION (HEURES)
A l H t i n s i s :
L
IA
IS
O
N
(%
)
Q--D LIAISON TOTALE
#—# LIAISON SPÉCIFIQUE
0--0 LIAISON NON SPÉCIFIQUE
25
30
TEMPS DE CONTACT (MINUTES)
F I G U R E V
5
/
5
0
NO TL * 23B3.2SB
NO MS -
% NS- 7
L1M
-10H IBHH IBB01
IBB 1BBB 1000B
PE/TUBE
CHAPITRE III
Influence de divers traitements sur plasmatique chez le
le taux de rat
INFLUENCE DE DIFFERENTS TRAITEMENTS SUR LE TAUX DE L' o-MSH PLASMATIQUE
1. Action du CRF
La structure du CRF ovin récemment élucidée a conduit 3 la synthè se du neuropeptide correspondant. Il a été constaté que 1 * injection de ce composé â 1'animal entraîne une augmentation des taux plasmatiques de 1'ACTH et de l'a-MSH. L'élévation du taux de 1' o-MSH constitue une observation originale. Elle a donné lieu aux recherches dont les
résultats sont regroupés dans les articles annexés ( pp. 47*2.55* et pp. 77*-104*) .
L'absence d’inhibition de la sécrétion de l'a-MSH par les gluco corticoïdes à 1'inverse de ce qui est obtenu avec 1'ACTH, démontre que le même neuropeptide hypothalamique peut agir sur différents sites hypophysaires dont le contrôle est distinct. La stimulation de la
sécrétion de 1'a-MSH par le lobe intermédiaire peut donc être provoquée non seulement par les agonistes S-adrénergiques dont l'activité 3 ce niveau est déjà connue mais également par le CRF.
Des travaux effectués sur des cellules de lobe intermédiaire en culture montrent 3 l'appui des résultats précédents que le CRF exerce une action stimulante directe sur la sécrétion de l'a-MSH par les cel lules hypophysaires. Cet effet a lieu par le relais du système adényl- cyclase comme le met en évidence 1'augmentation du taux de 1'AMP cycli que dans le milieu après addition de CRF (Proulx-Ferland et coll. ,
2. ACTION DES AGENTS ADRENERGIQUES
Les travaux antérieurs effectués au laboratoire, in vitro, sur culture cellulaire ayant abouti à la conclusion que la libération de 1'ACTH par le lobe antérieur et à celle de l'a-MSH par le lobe intermédiaire étaient spécifiquement stimulées respectivement par les composés 01 et ^-adréner giques, dans cette étude, in vivo, un représentant des plus sélectifs de chacun de ces deux types d'agonistes a été retenu à savoir la phénylëphrine et le (-)isoprotërénol.
2.1. a-adrénergiques
Il a été constaté que l'injection de phénylëphrine
provoque une élévation des taux plasmatiques de 1'ACTH et de l'a-MSH. Les résultats de cette étude sont présentés dans les articles annexés (pp. 56*-75* et pp. 77*-104*) dans lesquels sont discutés les mécanismes impliqués dans la libération des deux hormones. L'élévation relativement faible et de courte durée des taux d'a-MSH ainsi que sa résistance à la dexaméthasone impliquent que la stimulation «-adrénergique intervient dans les mécanismes de libération de 1'a-MSH par le lobe intermédiaire. Les résultats de cette étude, joints à ceux des études in vitro, portent à conclure que la
stimulation a-adrënergique a lieu directement au niveau du lobe antérieur dans la libération de 1'ACTH tandis qu'elle s'exerce à un niveau suprapituitaire dans la sécrétion de l'a-MSH. A l'appui de cette hypothèse et en complément aux résultats rapportés dans les articles précités, il a été constaté que la phénylëphrine est inactive chez des animaux
spécifique des récepteurs a ^, est suivie d’une diminution légère et prolongée des taux de sécrétion de base de 1' ct- MSH. Chez des animaux prétraités au prazosin, l'activité stimulante de la sécrétion de 1 'a“MSH par la phénylëphrine est inhibée (Figure VIII).
2.2 g-adrénergiques :
Les résultats mentionnés dans le résumé de la communi cation et l'article annexé (pp. 88* et pp. 77*-104**) que l'injection d'isoprotërënol entraîne une augmentation des taux plasmatiques de l'ACTH et de l’a-MSH. L'élévation des taux de l'a-MSH est comparativement à celle de l'ACTH d'am plitude plus faible et de durée plus courte. Un prétraite ment par la dexaméthasone s'oppose à la sécrétion de l'ACTH provoquée par 1'isoprotërënol et est sans effet sur celle de l'a-MSH. Dans ces conditions, il apparaît clairement que la stimulation g-adrénergique intervient dans les mécanismes qui contrôlent la libération de l'hormone par le lobe inter médiaire. De plus, après lésion de l'hypothalamus, la ré ponse de l'ACTH consécutive à l'injection d'isoprotërënol est fortement diminuée alors que celle de l'a-MSH est
inchangée (Figure IX). Ce résultat en accord avec les cons tatations des études in vitro, selon lesquelles 1'isoprotë rënol libère de l'a-MSH de cellules en culture, indique que son action se manifeste directement sur le lobe intermédiai re. Par ailleurs, dans des essais complémentaires, en
le prazosin ne modifie pas la libération de l’a-MSH et le propranolol 1 * antagonise, résultats prouvant la spécificité
CRF STIMULATES a-MSH SECRETION FROM THE INTERMEDIATE LOBE OF THE RAT PITUITARY GLAND
Texte soumis à publication, paru dans Science 217: 62-63, 1982
The administration of synthetic ovine corticotropin releasing factor (CRF) leads to a rapid and parallel increa se of plasma levels of adrenocorticotropic (ACTE) and a- oelanocyte-stimulating hormone (a-MSH) in the rat. Prior treatment with dexamethasone almost completely blocks the ACTE response while the stimulation of plasma a-MSH levels remains unchanged. The present data demonstrate that CRF is a potent stimulator, not only of ACTE secretion from the corticotrophs of the anterior pituitary gland, but also of peptide secretion from the intermediate lobe. Such data suggest a so-far unrecognized role of a-MSH and 6-endorphin in the defense mechanisms of the stress response.
Recent elucidation of the structure of ovine CRF (cor ticotropin-releasing factor) (1) opens new possibilities for studies of the mechanisms controlling the pituitary adreno cortical responses to various stressful stimuli. This pep tide is a potent stimulator of ACTE secretion in vivo in the rat as well as in adenohypophysial cells in culture (1), thus demonstrating a direct action on anterior pituitary cells.
Since not only the corticotrophs of the anterior pitui tary gland but also the cells of the intermediate lobe of the pituitary gland secrete the same series of peptides derived from proopiocortin (2, 3), we have studied the ef fect of CRF administered in vivo on the plasma levels of ACTE (derived mainly from the adenohypophysis) and a-MSE (secreted almost exclusively by the intermediate lobe of the pituitary gland). In order to further discriminate between the effects of CRF exerted at the level of the anterior and intermediate lobes of the pituitary gland, we have used the property of glucocorticoids to specifically inhibit peptide secretion of adenohypophysial origin (4). The present data clearly demonstrate that CRF is a potent stimulator of pep tide secretion, not only in the corticotrophs of the adeno hypophysis but also somewhat unexpectedly in the homogenous cell population of the intermediate lobe of the pituitary gland (5).
As illustrated in Fig. 1A, the intravenous administra tion of 10 ug synthetic ovine CRF leads to an approximately
6-fold increase of plasma ACTE levels after 5 min with a maximal 7-fold increase at 15 and 30 min and a progressive
decrease toward basal levels at later time Intervals. A similar stimulatory effect and time-course of action of CRF is observed on plasma a-MSH levels (Fig. IB).
Since 99% of a-MSH is contained in the intermediate lobe while 90% of total pituitary ACTE is present in the anterior pituitary (Côté and Labrie, unpublished data), the above-described findings already suggest a stimulatory ef fect of CRF on the two lobes of the pituitary gland. Since glucocorticoids are specific inhibitors of peptide secretion (ACTH, 0-LPH, 0-endorphin, a-MSH and related peptides) ori ginating exclusively in the anterior pituitary gland and have no effect on the secretory activity of the intermediate lobe (4), we have studied the effect of treatment with dexa- methasone on the ACTE and a-MSH responses to CRF. Adminis
tration of 100 pg of dexamethasone 15 and 3h prior to CRF injection leads to a 75% inhibition of basal plasma ACTE levels (p < 0.01) while the slight inhibition of basal a-MSH levels is not significant. The most significant finding is however the observation of a 95% decrease of the ACTE res ponse to CRF by the corticosteroid while the a-MSH response remains unchanged (Fig. 1).
The present data clearly demonstrate that CRF is a
potent stimulator not only of adenohypophysial corticotrophs but also of the cells of the intermediate lobe. Both pitui
tary lobes are known to secrete in different amounts the same peptides derived from proopiocortin (3). This is well supported by the earlier demonstration of a common precursor for ACTE and 0-LPH and other related peptides (2). As men tioned above, ACTE and a-MSH are the predominant secretory
products in the anterior and intermediate lobes, respective
ly-While the stimulatory effect of CRF on ACTH secretion from corticotrophs of the anterior lobe can be explained by a direct action at the pituitary level (1), the equally potent action on the pars intermedia cells can be either direct or secondary to an action at a suprapituitary level. So far, the activity of the pars intermedia cells was known to be under the stimulatory influence of a ^2~adrenergic system and under inhibition by a dopaminergic receptor (6). In the event of a direct action of CRF, this peptide would thus be added to B-adrenergic agonists as a new stimulator of pars intermedia cells.
The physiological implication of this potent stimulato ry effect of CRF on the secretion of pars intermedia pepti des, mainly a-MSH and B-endorphin, could be of great inte rest for our understanding of the stress response. It may well indicate a so-far unrecognized role of a-MSH in the defense mechanisms or support the suggestion of an important role of circulating B-endorphin (7) in the response to
stress. As much as TRH can stimulate both TSH and prolactin release and somatostatin can inhibit growth hormone, prolac tin and TSH secretion (8), CRF is another hypothalamic
releasing peptide having multiple sites of action.
LOUISE PROULX-FERLAND, -FERNAND LABRIE DOMINIQUE DUMONT, JEAN COTE
Department of Molecular Endocrinology,
Le Centre Hospitalier de 1'Université Laval, Quebec G1V 4G2, Canada
DAVID H. COY, JAVIER SVEIRAF
V.A. Hospital and Tulane University School of Medicine New Orleans. LA. USA.
REFERENCES
1. W. Vale, J. Spless, C. Rivier and J. Rlvier. Science 213, 1394 (1981).
2. R.E. Mains, B.A. Eipper and N. Ling. Proc. Natl. Acad. Sci. (USA) 74, 3014 (1977); J.L. Roberts and E.
Herbert. Proc. Natl. Acad. Sci. (USA) 74, 4826 (1977).
3. J.C. Lissitzky, 0. Morin, A. Dupont, F. Labrie, N.G. Seidah, M. Chrétien, M. Lis and D.H. Coy, Life Sci. 22, 1715 (1978); D. Dubê, J.C. Lissitzky, R.
Leclerc and G. Pelletier. Endocrinology 102, 1283 (1978).
4. C. Oliver, R. Usategui, H. Vaudry, I. Rozenberg and A.M. Mourra. J. Endocrinol. 68, 351 (1976).
5. A. Howe, J. Endocrinol. 59, 385 (1973).
6. M.E. Hadley, V.J. Hruby and A. Bower. Gen. Comp. Endocrinol. 26, 24 (1975); F.J.H. Tilders, A.H. Mulder and P.G. Smelik. Neuroendocrinology 18, 125
(1975); M. Munemura, R.L. Eskay and J.W. Kebabian, Endocrinology 106, 1795 (1980); H. Meunier and F.
Labrie. Eur. J. Pharmacol, in press; H. Meunier and F. Labrie. Life Sci. in press.
7. S. Amir and Z. Amit. Life Sci. 23, 1143 (1978); J.
Rossier, E.D. French, C. Rivier, N. Ling, R. Guillemin, F.E. Bloom. Nature 270, 618 (1977).
8. A. Bélanger, F. Labrie, P. Borgeat, M. Savary, J. Côté, J. Drouin, A.V. Schally, D.H. Coy, H. Immer, K.
Sestanj, V. Nelson, M. Gotz. J. Mol. Cell. Endocrinol. 1, 329 (1974); J. Drouin, A. De Lëan, D. Rainville, Lachance and F. Labrie, Endocrinology 98, 514
(1976).
9. V. Raymond, J. Lëplne, J.C. Lissltzky, J. Côté and F. Labrie. Mol. Cell. Endocrinol. 16, 113 (1979); R. Usategui, C. Oliver, H. Vaudry, G. Lombardi, I. Rosenberg and A.M. Mourre. Endocrinology 98, 189 (1976).
10. D. Rodbard and J.E. Lewald. Acta Endocrinol. (Kopenhagen) [Suppl.] 147, 79 (1970).
Fig. 1. Effect of treatment with dexamethasone (100 yg ,
s.c.) 15 and 3 h before beginning of the experiment on basal plasma ACTH and a-MSH levels as well as on the ACTH and a— MSH responses to the intravenous administration of 10 yg of synthetic ovine CRF to adult female Sprague-Dawley rats ovariectomized two weeks previously. A catheter was Insert ed into the right superior vena cava under Surital (50 mg/kg, i.p.) anesthesia two days before in order to perform
the experiment in undisturbed freely-moving animals. CRF was synthesized by solid-phase methods and purified by pre parative reverse-phase high performance liquid chromatogra phy. Homogeneity was determined by analytical HPLC on 300 A Cig silica columns and by peptide mapping of enzymatic di gests on HPLC (D.H. Coy, manuscript in preparation). Blood samples (0.8 ml) were withdrawn at the indicated time inter vals after injection of CRF for measurement of plasma ACTH and a-MSH by radioimmunoassay (9). Data presented are ex pressed as means ± SEM of duplicate determinations of sam ples obtained from 8-10 animals per group. Radioimmunoassay data were analyzed using a program derived from Rodbard and Lewald (10). Statistical significance was measured using the multiple-range test of Duncan-Kramer (11).
2400
2100
1800
1500
1200
900
600
300
0O—□ CRF (10
fjG)
m—m
DEXAMETHASONE + CRF
ALPHA i-ADRENERGIC STIMULATION OF ACTH SECRETION AT THE ANTERIOR PITUITARY LEVEL IN VIVO IN THE RAT
LOUISE PROULX-FERLAND*, MICHEL BREAULT, JEAN COTE, DOMINIQUE DUMONT AND FERNAND LABRIE*,
Department of Molecular Endocrinology, Le Centre Hospitaller de l’Université Laval, Quebec G1V 4G2, Canada
*Chercheur-boursier of the Fonds de la recherche en santé du Québec. To whom requests for reprints should be addressed.