UNIVERSITE TOULOUSE III – PAUL SABATIER U.F.R sciences de la vie et de la terre
THESE
Pour obtenir le grade de
DOCTEUR DE L’UNIVERSITE TOULOUSE III Discipline : Innovation pharmacologique
Présentée et soutenue par Sandra DE BARROS
Le 29 octobre 2007
Les métalloprotéases matricielles 2 et 9 et la différenciation des
cellules progénitrices du tissu adipeux humain
JURY
Professeur Marie-Christine RIO Rapporteur
Docteur Jean-Philippe BASTARD Rapporteur
Docteur Annie QUIGNARD-BOULANGE Examinateur
Professeur Philippe VALET Président
A mes parents
A Christophe, Carole et Adrien, A Laurent.
Remerciements
En préambule à ce travail, je tiens à exprimer toute ma reconnaissance et mes sincères remerciements à tous ceux qui ont participé de près ou de loin à ce travail.
Je tiens à remercier le Professeur Marie-Christine RIO et le Docteur Jean-Philippe BASTARD d’avoir spontanément accepté d’évaluer ce travail en tant que rapporteur. J’exprime également ma gratitude au Professeur Philippe VALET et au Docteur Annie QUIGNARD-BOULANGE pour avoir si gentiment acceptés de participer à ce jury de thèse.
Les recherches qui ont fait l’objet de cette thèse ont été effectuées dans l’unité INSERM U858 équipe 1, encadrées par les Docteurs Jean GALITZKY, Virginie BOURLIER, Coralie SENGENES et Anne BOULOUMIE. Je leur suis très profondément reconnaissante de m’avoir apporté leur soutien, leur confiance et leur disponibilité au cours de ces trois années de thèse.
Je tiens tout particulièrement à remercier Max LAFONTAN pour ses précieux conseils.
Je dis un grand merci à tous les membres (ou ex-membres) de l’équipe des allées et particulièrement à Karine, Alec et Marie-Adeline pour toute l’aide qu’elles ont pu m’apporter.
J’adresse mes remerciements à l’ensemble du personnel de l’unité INSERM U858 et plus particulièrement à l’ex-unité INSERM U586 dirigé par le professeur Dominique LANGIN, pour les nombreux services rendus. Une petite attention particulière pour Danièle, Carine et Corinne régulièrement « nounous » des plaques taqman, ainsi que Pascale et Lydia pour toutes les questions administratives que j’ai pu rencontrer… Je tiens également à remercier les personnes du Laboratoire de Pharmacologie Médicale et Clinique, ainsi que celle du Centre de Pharmacovigilance, deux services dirigés par le Professeur Jean-Louis MONTASTRUC que je remercie.
Enfin, je ne saurai clore cette partie sans adresser mes sincères remerciements à ma famille. J’adresse un grand merci à mes parents, à mon frère, à Carole et à Adrien. Je remercie également Laurent pour sa présence, sa patience et son soutien quotidien.
Table des matières
Table des matières 4
Liste des figures 7
Liste destableaux 9
Principales abréviations utilisées 10
Avant propos 12
Introduction 14
I- Le tissu adipeux 14
A) Les fonctions du tissu adipeux 14
A.1) Les fonctions métaboliques du tissu adipeux 15 A.1.1) Le stockage des lipides : la lipogenèse et la synthèse des
triglycérides 15
A.1.2) La mobilisation des lipides : la lipolyse 16 A.2) Les fonctions sécrétoires du tissu adipeux 17
B) Le développement normal du tissu adipeux 18
B.1) Le processus de détermination adipocytaire 19 B.2) Le processus de différenciation adipocytaire 22
B.2.1) Les étapes du processus de différenciation adipocytaire 22 B.2.2) Contrôle transcriptionnel de la différenciation adipocytaire 23
B.2.2.1) Les PPARs 23
B.2.2.2) Les C/EBPs 24
B.2.2.3) Le facteur SREBP-1 24
B.2.2.4) Les autres facteurs de transcription 25 B.2.3) Régulation hormonale et intracellulaire de la
différenciation adipocytaire 25
B.3) La vascularisation du tissu adipeux 26
C) Le développement excessif du tissu adipeux : l’obésité 28 C.1) Les modifications cellulaires du tissu adipeux 29
C.1.1) Les adipocytes et les cellules progénitrices/souches 29
C.1.2) Les cellules endothéliales 29
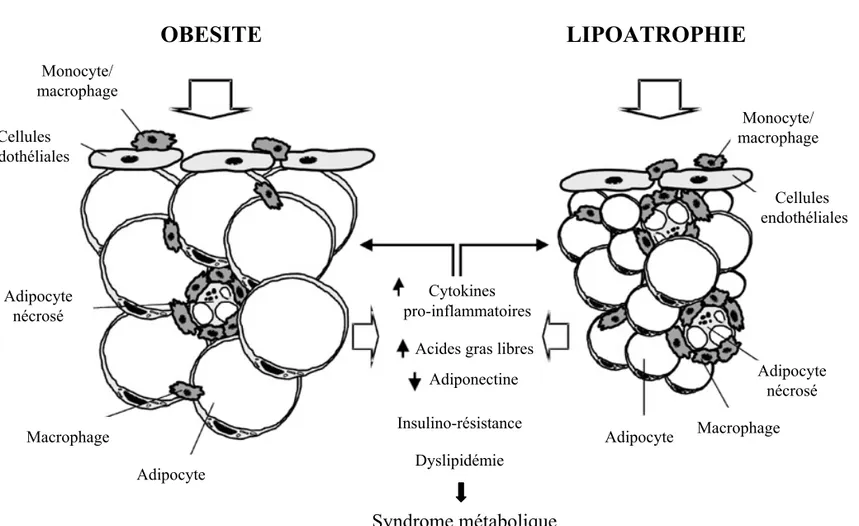
C.2) Les modifications des fonctions métaboliques du tissu adipeux 31 C.3) Les modifications des fonctions sécrétoires du tissu adipeux 32 D) La régression du tissu adipeux : la lipoatrophie 34
D.1) Les modifications cellulaires du tissu adipeux 35
D.1.1) Les adipocytes 35
D.1.2) Les cellules progénitrices/souches 37
D.1.3) Les cellules endothéliales 39
D.1.4) Les macrophages 40
D.2) Les modifications des fonctions métaboliques du tissu adipeux 40 D.3) Les modifications des fonctions sécrétoires du tissu adipeux 41
II- Les métalloprotéases matricielles 43
A) Classification et structure 43
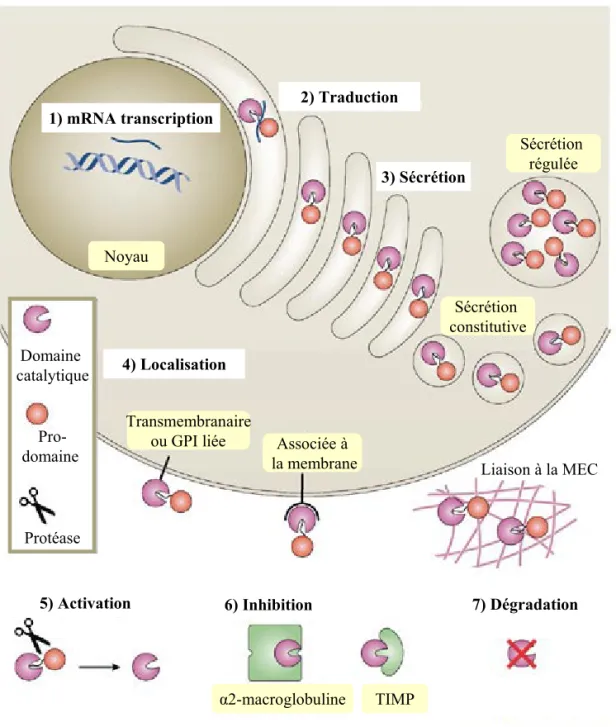
B) Les régulations des MMPs 45
B.1) Les Régulations transcriptionnelles et post-transcriptionnelles 45
B.2) Les régulations de la sécrétion 46
B.3) Les processus de maturation des MMPs 46
B.4) Les processus d’inhibition des MMPs 48
C) Mode d’action des MMPs 49
D) Les fonctions biologiques et pathologiques des MMPs 50
III- Les métalloprotéases matricielles dans le tissu adipeux 54
A) La régulation de l’adipogenèse 54
B) La régulation de l’angiogenèse 55
C) La régulation de l’infiltration macrophagique 55 D) Les régulateurs des MMPs dans le tissu adipeux 56
Objectifs 58
Résultats 59
I- Implication des MMPs dans la différenciation adipocytaire des
cellules de la fraction stroma-vasculaire du tissu adipeux humain 59
la différenciation adipocytaire 59 B) Influence d’un anticorps neutralisant dirigé contre MMP-9 sur la
différenciation adipocytaire 61
C) Détermination des mécanismes impliqués dans la chute de l’expression de
MMP-9 par les inhibiteurs de la protéase du VIH 62 D) Études préliminaires et perspectives sur l’étude des cibles moléculaires de
MMP- 9 65
II- Implication des MMPs dans la différenciation des cellules CD34+/CD31- isolées de la fraction stroma-vasculaire du tissu adipeux humain 68
A) Influence d’un inhibiteur des MMPs sur la différenciation adipocytaire
des cellules CD34+/CD31- 69
B) Mise au point d’une condition de culture permettant simultanément les
capacités adipogéniques et angiogéniques des cellules CD34+/CD31- 70 B.1) Etude de l’accumulation intracellulaire des triglycérides et de la
formation d’un réseau cellulaire positif pour le CD31 par les cellules
CD34+/CD31- cultivées dans un milieu mixte 70
B.2) Etude de l’expression en ARNm des marqueurs adipocytaires et endothéliaux par les cellules CD34+/CD31- cultivées dans un milieu
mixte 72
B.3) Etude cinétique sur l’évolution des cellules CD34+/CD31- au cours de la
culture en milieu mixte. 73
C) Implication des contacts cellule-cellule dans les capacités adipogéniques et
angiogéniques des cellules CD34+/CD31- 76
C.1) Influence de la densité cellulaire sur les cellules CD34+/CD31- cultivées
en milieu mixte 76
C.2) Influence de la communication cellulaire via les jonctions gaps sur les cellules CD34+/CD31- cultivées en milieu mixte 77
Conclusions et perspectives 80
Références bibliographiques 83
Liste des figures
Figure 1 : Le tissu adipeux
Figure 2 : Lipogenèse et synthèse des triglycérides dans l’adipocyte Figure 3 : Contrôle de la lipolyse dans l’adipocyte humain
Figure 4 : Les sécrétions du tissu adipeux
Figure 5 : Détermination et différenciation adipocytaires
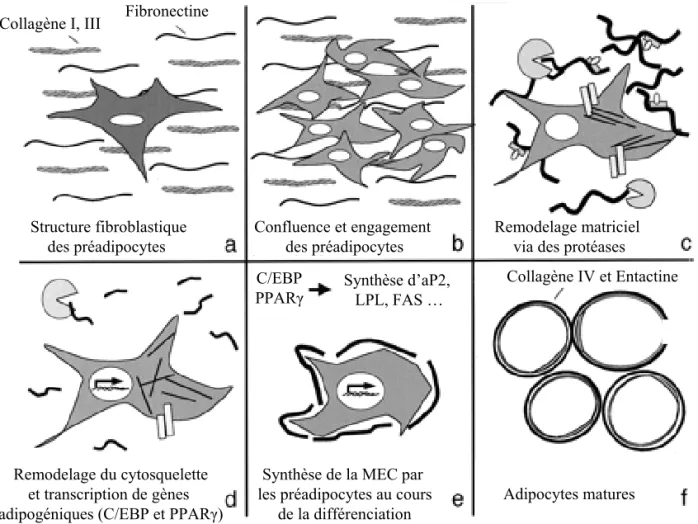
Figure 6: Evolution de la matrice extracellulaire et de la forme cellulaire au cours de la différenciation adipocytaire
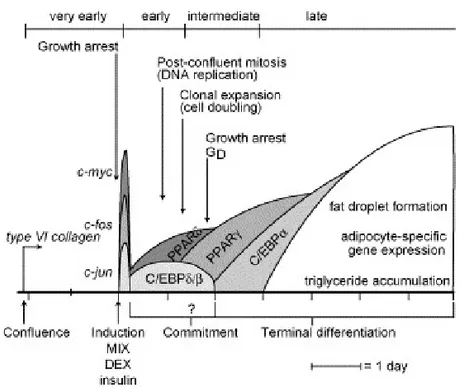
Figure 7 : Progression des facteurs de transcription au cours de l’adipogènese dans les préadipocytes de la lignée 3T3-L1
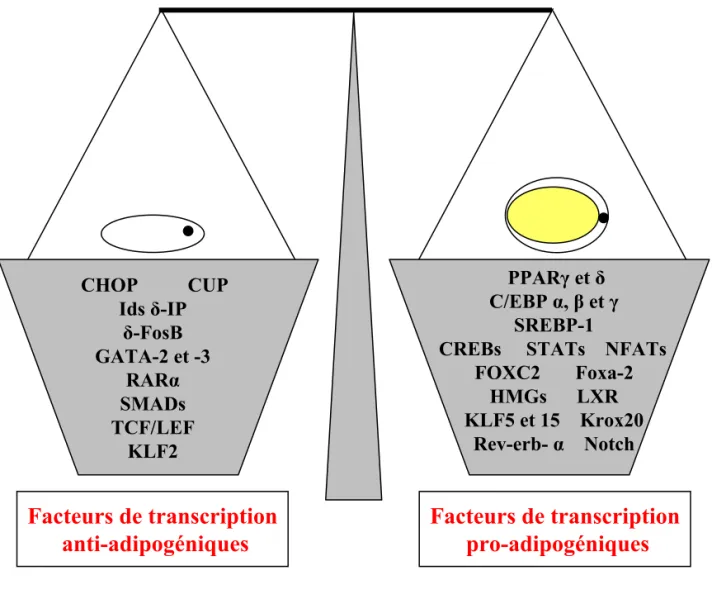
Figure 8 : Balance entre les facteurs de transcription pro- et anti-adipogéniques
Figure 9 : Comparaison entre les modifications du tissu adipeux lors d’une obésité ou d’une lipoatrophie
Figure 10 : Les métalloprotéases matricielles
Figure 11 : Régulation de l’activité des métalloprotéases matricielles
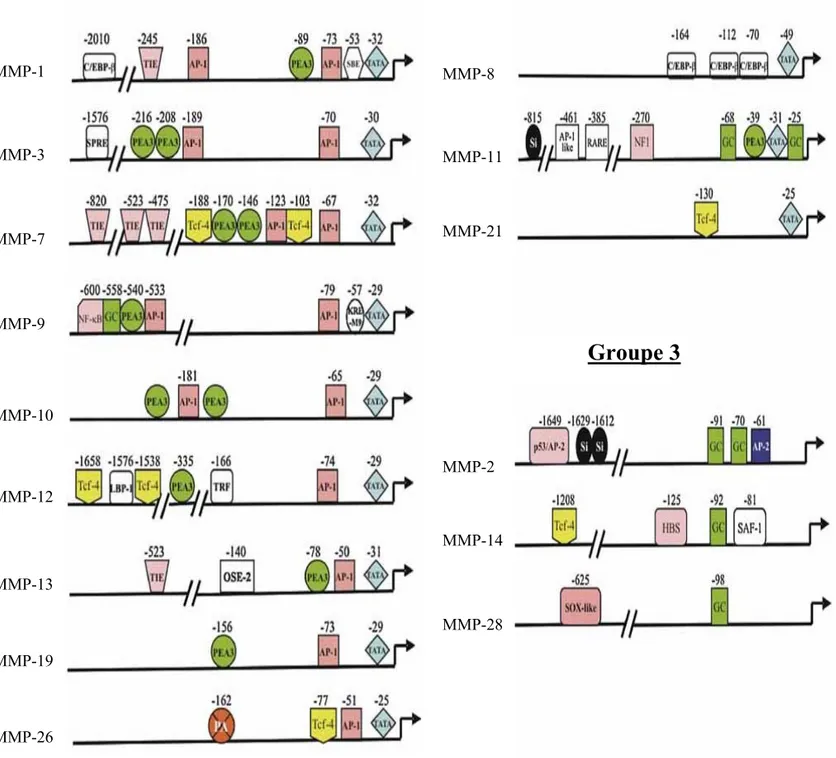
Figure 12 : Eléments de liaison aux facteurs de transcription sur les promoteurs des métalloprotéases matricielles
Figure 13 : Mode d’action des métalloprotéases matricielles
Figure 14 : Effet d’un anticorps neutralisant pour la MMP-9 sur la différenciation adipocytaire des cellules de la FSV du tissu adipeux humain
Figure 15 : Hypothèse du mode d’action des IPs-VIH sur l’expression génique de MMP-9 Figure 16 : Influence d’un substrat matriciel sur la différenciation adipocytaire des cellules de la FSV du TA humain
Figure 17 : Technique d’isolement des différentes populations de la FSV du tissu adipeux humain
Figure 18 : Sécrétion des MMP-2 et -9 au cours de la différenciation adipocytaire des cellules progénitrices CD34+/CD31- isolées
Figure 19 : Influence du batimastat sur la différenciation adipocytaire des cellules progénitrices CD34+/CD31-
Figure 20 : Détermination de l’accumulation des TGs et de la formation d’un réseau cellulaire positif pour le CD31 des cellules CD34+/CD31- cultivées en milieu adipogénique, endothélial ou mixte
Figure 21 : Détermination de l’expression en ARNm des marqueurs adipocytaires et endothéliaux des cellules CD34+/CD31- cultivées en milieu adipogénique, endothélial ou mixte
Figure 22 : Evolution du contenu en ADN, TGs et du réseau cellulaire positif pour le CD31 des cellules CD34+/CD31- cultivées en milieu mixte
Figure 23 : Evolution de l’expression en ARNm des marqueurs adipocytaires et endothéliaux des cellules CD34+/CD31- cultivées en milieu mixte
Figure 24 : Influence de la présence de cellules endothéliales matures sur la formation du réseau cellulaire positif pour le CD31 des cellules CD34+/CD31- cultivées en milieu mixte Figure 25 : Influence de la densité cellulaire sur les capacités adipogéniques et angiogéniques des cellules CD34+/CD31- cultivées en milieu mixte
Figure 26 : Evolution de l’expression en ARNm des connexines 43 et 45 des cellules CD34+/CD31- cultivées en milieu mixte
Figure 27 : Effet d’un inhibiteur des jonctions gaps sur les capacités adipogéniques et angiogéniques des cellules CD34+/CD31- cultivées en milieu mixte
Liste des tableaux
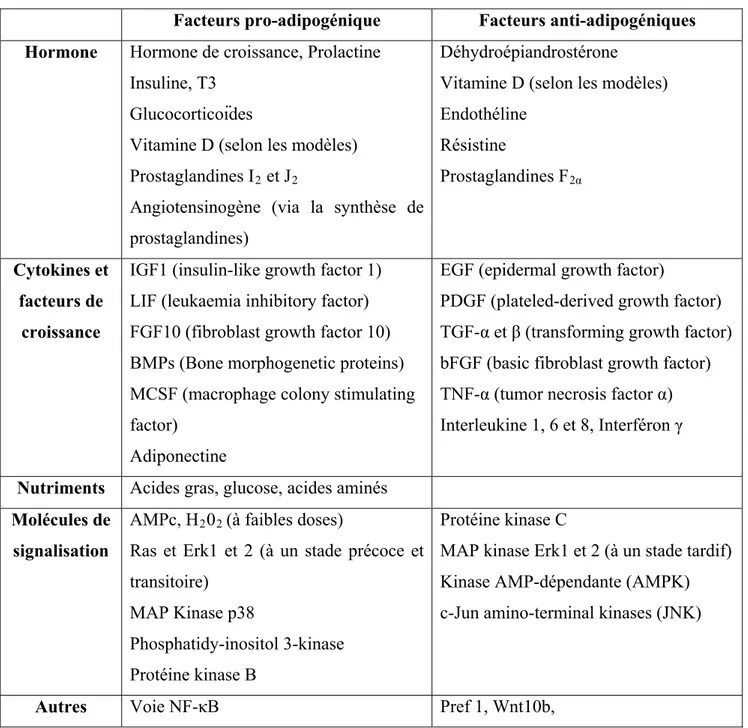
Tableau 1: Les différents modèles de culture cellulaire utilisés pour l’étude de l’adipogenèse Tableau 2: Facteurs extracellulaires et molécules de signalisation régulant l’adipogenèse Tableau 3 : Classification des adultes maigres, normaux, en surpoids et obèses selon l’IMC Tableau 4: Sécrétions du tissu adipeux modulées ou non au cours de l’obésité
Tableau 5: Classification des différentes lipoatrophies humaines
Tableau 6: Impact des IPs-VIH et des INRTs sur les sécrétions adipocytaires in vitro et in
vivo
Tableau 7: Classification des métalloprotéases matricielles Tableau 8 : Les activateurs des MMPs
Tableau 9: Phénotypes des souris déficientes pour les MMPs Tableau 10: Les inhibiteurs des MMPs dans le cancer
Tableau 11: Composition des milieux adipogénique, endothélial et mixte utilisés
Tableau 12: Détermination de l’expression en ARNm des marqueurs adipocytaires et endothéliaux par des adipocytes matures, des cellules progénitrices CD34+/CD31- et des cellules endothéliales capillaires CD34+/CD31+
Tableau 13: Expression en ARNm des connexines 43, 45, 40 et 37 dans des adipocytes matures, des cellules progénitrices CD34+/CD31- et des cellules endothéliales capillaires CD34+/CD31+
Principales abréviations utilisées
ACC : Acetyl Co-A carboxylase
ADAM: A Disintegrine And Metalloprotease domain AGA: 18α-glycyrrhetinic acid
AGNE: acide gras non estérifié AP-1: Activator protein-1 aP2 : fatty acid binding protein
ATGL : adipocyte triacylglycerol lipase bFGF : basic fibroblast growth factor bHLH : basic helix-loop helix
BMP : Bone morphogenetic protein CD : Cluster de différenciation
C/EBP : CCAAT/enhancer binding protein CHOP-10 : C/EBP homologous protein 10
CRABP-1 : Cytoplasmic retinoic acid binding protein-1 ECBM : Endothelial cell basal medium
ECGM : Endothelial cell growth medium FAS : Fatty acid synthase
FSV: Fraction stroma-vasculaire GLUT : Glucose transporteur GZA : glycyrrhizic acid IDV : Indinavir
IGF : Insulin growth factor IκB: Inhibitor NF-κB IL : Interleukine
IMC : Indice de masse corporelle
INRT : Inhibiteur nucléosidique de la réverse transcriptase INNRT: Inhibiteur non nucléosidique de la réverse transcriptase IPs-VIH : Inhibiteur de la protéase du VIH
LHS : Lipase hormono-sensible LPL : Lipoprotéine lipase
MEC : Matrice extracellulaire MMP : Métalloprotéase matricielle
MT-MMP : Métalloprotéase matricielle de type membranaire NF-κB : Nuclear factor kappa B
NFV : Nelfinavir
PAI-1 : Plasminogen activator inhibitor 1 PDGF : Platelet-derived growth factor PKA : Protein kinase A
RT-PCR :Real-time polymerase chain reaction RTV : Ritonavir
RXR : Récepteur de l’acide 9-cis-rétinoique SDF-1 : Stromal cell-derived factor-1 SQV : Saquinavir
SREBP: Sterol regulatory element binding protein TA : Tissu Adipeux
TCF/LEF : T-cell factor/lymphoid enhancer factor TIMP : Tissue inhibitor of matrix metalloproteinases TGs : Triglycérides
TNF-α : Tumor necrosis factor α
VEGF : Vascular endothelial growth factor VIH : Virus de l’immunodéficience humaine VLDL : Very low density lipoprotein
Avant-propos
Le tissu adipeux (TA) adulte peut subir des processus de développement excessif (surpoids, obésité) mais aussi des processus de régression (lipoatrophie). Ces deux phénomènes entraînent des altérations de la composition cellulaire et des fonctionsdu TA. Il est désormais reconnu qu’un excès ou une perte de masse grasse constitue un facteur aggravant de nombreuses pathologies telles que le diabète de type 2 et les désordres cardiovasculaires.
Le surpoids touche, aujourd’hui, près d’un milliard de personnes à l’échelle de la planète, soit un sixième de la population mondiale. Parmi elles, 300 millions sont obèses et l’obésité infantile est en plein essor. Les causes de l’obésité sont multiples et dépendent aussi bien de facteurs génétiques qu’environnementaux. A l’heure actuelle, quelques médicaments avec une indication pour l’obésité (orlistat, sibutramine) ont été développés mais leur efficacité reste insuffisante.
Les syndromes de lipodystrophies étaient des événements rares (moins de 1 cas sur 100000) et de causes principalement génétiques. Ces dix dernières années sont apparues des formes de lipodystrophies liées aux traitements antirétroviraux de l’infection par le virus de l’immunodéficience humaine (VIH). En effet, si l’utilisation des inhibiteurs de la protéase du VIH (IPs-VIH) et des inhibiteurs nucléosidiques de la reverse transcriptase (INRTs) ont permis de diminuer significativement la morbidité et la mortalité des patients infectés par le VIH, plus de 50% des patients traités ont développé un syndrome lipodystrophique se caractérisant par une redistribution des dépôts adipeux et des complications métaboliques. Le signe clinique majeur du syndrome lipodystrophique est une lipoatrophie au niveau de la face et des membres associée ou non à une accumulation du TA au niveau des régions dorso-cervicales et abdominales. Quelques approches thérapeutiques pour le traitement des lipoatrophies ont été développées (thiazolidinedione, metformine) mais elles agissent plus sur les complications métaboliques associées que sur l’altération du TA elle-même.
Ainsi, une meilleure connaissance des mécanismes impliqués dans l’extension et la régression de la masse grasse est maintenant nécessaire afin d’identifier de nouvelles cibles thérapeutiques. Dans ce chapitre d’introduction, nous allons dans une première partie nous intéresser au TA, à ses fonctions et à son développement normal. Nous aborderons aussi les modifications tant cellulaires que fonctionnelles que le TA subit lors d’une obésité ou d’une lipoatrophie. Puis dans une deuxième partie, nous nous intéresserons aux principaux acteurs
impliqués dans la régulation des phénomènes de remodelage tissulaire, les métalloprotéases matricielles ou MMPs. Leur classification, leur structure ainsi que la régulation de leur activité seront présentées. Enfin, leur mode d’action et les fonctions biologiques auxquelles ces protéases sont associées seront décrits. Enfin nous aborderons le rôle potentiel de ces enzymes dans la plasticité du TA.
Nos travaux de recherche portant sur la caractérisation (i) du rôle de la MMP-9 dans les processus de différenciation adipocytaire et (ii) des interactions entre les inhibiteurs de protéases utilisées lors de la thérapie du VIH avec les voies dépendantes de MMP-9, seront ensuite exposés. Enfin, une dernière partie de notre travail portant sur la caractérisation des cellules progénitrices du TA humain en condition de culture permettant d’exprimer leurs capacités angiogéniques et adipogéniques sera décrite.
Introduction
I. Le tissu adipeux
Le tissu adipeux (TA) est doué d’une importante plasticité. Il est en effet capable de croître ou d’involuer de manière spectaculaire. Avant de nous intéresser au développement excessif du TA ainsi qu’à sa capacité de régression, un aperçu de la fonction propre du TA nous semble nécessaire.
A) Les fonctions du tissu adipeux
Deux grands types de TA sont présents chez les mammifères : le TA blanc et le TA brun. Ces deux tissus ont des propriétés biochimiques et fonctionnelles distinctes. Le TA brun se retrouve surtout chez les rongeurs et, chez l’homme, il est initialement présent chez le nouveau-né et joue un rôle clé dans la gestion de la thermogenèse (libération d’énergie sous forme de chaleur). Le TA blanc, dont nous parlerons exclusivement dans la suite de ce travail, constitue la principale réserve d’énergie de l’organisme. Il comprend différents dépôts anatomiques localisés dans les territoires sous-cutanés et viscéraux. Cette notion de localisation du TA est essentielle puisque selon que le TA soit sous-cutané ou viscéral, son organisation cellulaire va varier ainsi que son activité métabolique et sécrétoire (81, 136, 270).
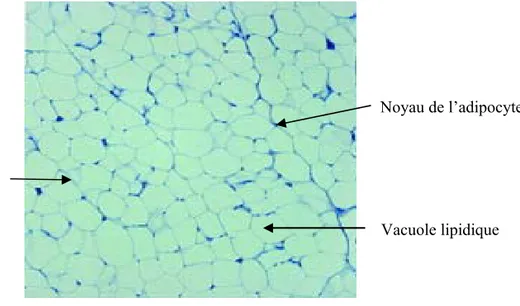
Au cours de ces dernières années, les recherches sur le TA ont permis de faire émerger les concepts et rôles clés du TA dans le contrôle des flux métaboliques ainsi que la notion de TA endocrine. Ainsi, le TA n’est plus décrit comme un simple tissu de soutien et de protection. Les adipocytes sont le type cellulaire majeur du TA. Ils assurent la fonction métabolique du tissu (stockage et dégradation des triglycérides (TGs)) mais sont également considérés comme une source cellulaire des sécrétions du TA. L’adipocyte est caractérisé par une morphologie polygonale et une grande taille avec un diamètre moyen de 70µm chez le sujet normo-pondéré. La quasi-totalité de la cellule est occupée par une unique vacuole lipidique et le cytoplasme et les organites constituent un fin liseré périphérique (figure 1A). Ces caractéristiques ainsi que sa flottaison in vitro permettent de le distinguer et de l’isoler facilement de la fraction non adipocytaire du TA, la fraction stroma-vasculaire (FSV),
Figure 1 : Le tissu adipeux (A) Morphologie des adipocytes (B) Composition cellulaire B A Microcirculation Adipocyte Préadipocyte Macrophage Cellulesouche/ progénitrice Vacuole lipidique Noyau de l’adipocyte Membrane cytoplasmique de l’adipocyte
contenant principalement des cellules progénitrices/souches, des cellules vasculaires et des cellules immuno-inflammatoires (figure 1B).
A.1) Les fonctions métaboliques du tissu adipeux
Brièvement, nous aborderons dans les paragraphes suivants les mécanismes et les voies de régulation des principales fonctions métaboliques adipocytaires : le stockage des lipides (lipogenèse et synthèse de TGs) et leur dégradation (la lipolyse).
A.1.1) Le stockage des lipides : la lipogenèse et la synthèse des triglycérides
Le stockage des lipides dans l’adipocyte se fait par 2 voies (figure 2). La première voie correspond à la capture directe des TGs associés aux chylomicrons et aux lipoprotéines de très faible densité (ou VLDL pour « very low density lipoprotein ») circulants, provenant de l’alimentation ou de la lipogenèse hépatique. La LPL (lipoprotéine lipase), produite et sécrétée par les adipocytes, est ancrée par des protéoglycanes à héparane sulfate à la surface endothéliale (87). En coopération avec GPIHBP1 (glycosylphosphatidylinositol-anchored high density lipoprotein-binding protein 1) récemment décrite comme étant exprimée à la surface endothéliale et comme jouant le rôle de récepteur potentiel aux chylomicrons et VLDL, la LPL hydrolyse les lipoprotéines (11, 297). Les acides gras non estérifiés issus de ce clivage sont ensuite recaptés par l’adipocyte, qui les transforme alors en acyl-Co enzyme A (Acyl-CoA). Ils seront ré-estérifiés en TGs en présence de glycérol. La deuxième voie correspond à la lipogenèse de novo. Le terme de lipogenèse proprement dit désigne la néosynthèse d’acides gras à partir du glucose. Après l’entrée du glucose dans l’adipocyte, grâce à des transporteurs spécifiques (GLUT-1 et 4), le glucose est dégradé en pyruvate par le processus de la glycolyse. A partir du pyruvate, l’acétyl-CoA carboxylase (ACC) et la synthase des acides gras (FAS, « fatty acid synthase ») interviennent de façon successive pour catalyser la formation des acides gras à longue chaîne saturée. L’action des différentes désaturases permet de synthétiser des acides gras plus ou moins saturés. Comme précédemment, ces acides gras sont ensuite ré-estérifiés pour donner les TGs. Il est nécessaire de préciser que chez les rongeurs, la lipogenèse est réalisée dans le foie et le TA. Par contre, chez l’homme, la lipogenèse est majoritairement hépatique et elle n’est qu’accessoire dans le TA (145), excepté suite à un régime alimentaire riche en glucides (105). De nombreux facteurs endocrines et paracrines tels que les catécholamines, l’hormone de croissance et la
Figure 2 : Lipogenèse et synthèse des triglycérides dans l’adipocyte
GLUT: glucose transporter; DHAP: dihydroxyacétone phosphate; TG: triglycérides; ACC: acétyl Coenzyme A (CoA) carboxylase; FAS: fatty acid synthase; AGNE: acide gras non estérifié; LPL: lipoprotéine lipase; VLDL: verylowdensitylipoprotein
D’après Fève B., Médecine clinique, 2003
Glucose GLUT Glucose TG Glucose-6-P Transporteur AGNE AGNE TG: Chylomicrons VLDL LPL LPL Vaisseau capillaire Acétyl-CoA Palmitate Acyl-CoA Pyruvate DHAP Glycéro l-3-P Malonyl-CoA Estérification ACC FAS Lipogenèse de novo Glycolyse Origine alimentaire des acides gras
leptine sont capables de contrôler le stockage des TGs mais le facteur majeur est l’insuline qui stimule cette voie en augmentant le captage du glucose via le recrutement du transporteur GLUT-4 à la membrane, et en activant les enzymes glycolytiques et lipogéniques (120). De façon intéressante, les effets inhibiteurs de la leptine et de l’hormone de croissance sur le stockage des TGs passent par l’inhibition des effets stimulateurs de l’insuline.
A.1.2) La mobilisation des lipides : la lipolyse
La lipolyse assure la dégradation des TGs contenus dans les vacuoles lipidiques de l’adipocyte, en glycérol et acides gras non estérifiés. Plusieurs lipases interviennent de façon séquentielle dans cette hydrolyse des réserves lipidiques (figure 3). La lipase hormono-sensible (LHS) clive les TGs en diglycérides puis les diglycérides en monoglycérides, et constitue l’enzyme limitante du processus lipolytique. La lipase des monoglycérides (LMG) dégrade ensuite les monoglycérides en glycérol et acides gras non estérifiés. Cependant, la mise en évidence d’une activité lipolytique diminuée mais toujours présente chez des souris invalidées pour le gène de la LHS a laissé supposer l’existence d’au moins une autre lipase capable d’hydrolyser les TGs dans les adipocytes (196). Trois laboratoires différents ont identifié une nouvelle lipase dénommée « adipocyte triacyglycerol lipase » (ATGL), isoforme ζ d’une phospholipase indépendante du calcium (iPLA2ζ) ou desnutrine (113, 277,
303). L’ATGL jouerait un rôle clé dans la lipolyse basale, mais l’hydrolyse des TGs et des diglycérides par la LHS demeurerait l’étape limitante dans la lipolyse stimulée par les principaux agents lipolytiques chez l’homme, les catécholamines et le peptide atrial natriuretique (142). Les mécanismes susceptibles de réguler l’activité de la LHS sont bien connus et sont présentés dans la figure 3 (135). L’activité de cette lipase dépend spécifiquement de sa phosphorylation réversible par une kinase dépendante de l’AMPc (PKA) (100) ou du GMPc (PKG) (240). La phosphorylation de la LHS active l’enzyme, en démasquant le site catalytique. Par ailleurs, cette phosphorylation permet une redistribution de la lipase du cytoplasme vers la vacuole lipidique. Les périlipines, protéines abondamment exprimées à la surface des gouttelettes lipidiques, interviennent dans la localisation et la stabilisation de la LHS à la surface des vacuoles. La phosphorylation des périlipines par la PKA et la PKG réduit leur ancrage à la gouttelette lipidique et favorise ainsi l’accès de la LHS à ses substrats lipidiques.
Figure 3 : Contrôle de la lipolyse dans l’adipocyte humain
Les catécholamines activent les récepteurs α2-adrénergiques (α2–AR) et β1/2/3-adrénergiques (β1/2/3– AR) modulant négativement et positivement l’activité de l’adénylyl-cyclase (AC) respectivement. Outre le récepteur α2–AR, de nombreux autres récepteurs sont couplés négativement à l’AC. C’est notamment le cas des récepteurs à l’adénosine (A1-R), aux prostaglandines (EP3-R), au neuropeptide Y (NPY-Y1-R) et à l’acide nicotinique (HM74A). L’AC produit de l’AMPc qui va activer une protéine kinase dépendante de l’AMPc (PKA). L’insuline possède une action antilipolytique. Son mécanisme d’action implique la phosphatidyl-inositol 3 kinase (PI3-K), la protéine kinase B (PKB/Akt) et la phosphodiestérase-3B (PDE-3B) qui diminue les taux intracellulaires d’AMPc transforméen 5’-AMP. L’ANP et le BNP stimulent le NPR-A dont l’activité guanylyl-cyclase (GC) génère du GMPc. Le GMPcstimule une protéine kinase dépendante du GMPc(PKG ou cGK-I). La PKA et la PKG activent par phosphorylation les périlipineset la lipase hormono-sensible(LHS) qui va transloquer à la vacuole lipidique et participer, avec l’adipocyte triacylglycérollipase (ATGL) et la monoglycéride lipase (LMG), à l’hydrolyse des triglycérides (TGs) en glycérol et acides gras non estérifiés (AGNE). A den yl yl c y c la s e αsγβ βγαi Gs Gi Inhibition Adrénaline (α2A -AR) Adénosine (A1 -R) Prostaglandines (EP3 -R)
Neuropeptide Y/peptide YY (NPY1 -R) Acide nicotinique (HM74A)
Activation Noradrénaline Adrénaline (β1 - β2 -AR) Parathormone (PTH-R) ATP AMPc PKA R C R C Inhibition Insuline (I-R) GC GC KHD GTP GMPc Activation
Atrial Natriuretic Peptide Brain Natriuretic Peptide (NPR-A) P-Tyr-P PI3K PKB Akt PDE-3B PDE-3B Ser-P
-+ + PKG R C R C 5’-AMP LHS Ser-P Membrane Plasmique + + + TG Diacylglycérol Monoglycéride AGNE Glycérol AGNE AGNE ATGL LMG
A.2) Les fonctions sécrétoires du tissu adipeux
D’un point de vue quantitatif, les acides gras libres, issus de la lipolyse et libérés dans la circulation sanguine, représentent le principal produit de sécrétion du TA (265). Cependant le TA est également capable de synthétiser et de sécréter une multitude de facteurs qui agissent soit localement de façon autocrine et/ou paracrine, soit parfois de façon endocrine. On désigne sous le terme « adipokines », l’ensemble des facteurs bioactifs produits et sécrétés par le TA. Historiquement, la LPL est la première adipokine découverte (49).
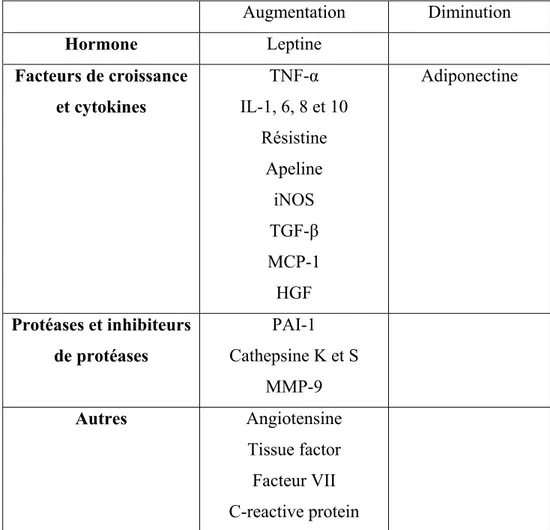
Toutefois, c’est la découverte de la leptine, hormone synthétisée par le TA et intervenant dans le contrôle de la prise alimentaire, qui a permis au TA d’acquérir le statut d’organe endocrine (302). Suite à cette découverte, d’autres facteurs produits et sécrétés par le TA ont été décrits, on en compte actuellement plus d’une cinquantaine qui diffèrent tant au niveau de leur structure que de leur fonction : des hormones (stéroïdes et glucocorticoïdes), des cytokines (TNFα, IL-6, IL-8), des facteurs de croissance (TGF-β), des protéases (MMP-2 et 9) et des anti-protéases (TIMP, PAI-1) (81). Plusieurs fonctions physiologiques leur sont associées, du contrôle du métabolisme lipidique, à l’angiogenèse et l’inflammation (figure 4). Excepté la leptine et l’adiponectine considérées comme spécifiques des adipocytes, les adipokines apparaissent comme étant également exprimées et produites par les cellules de la fraction non adipocytaire du TA, i.e la FSV (72). Des différences dans l’activité de sécrétion mais également dans le type d’adipokines ont été décrites dans les TA humains sous-cutanés et viscéraux (72, 136).
En résumé, l’adipocyte présente deux fonctions principales, le stockage des lipides selon le processus de lipogenèse ainsi que celui de la synthèse des TGs, et la mobilisation des lipides via le processus de lipolyse. Ces activités métaboliques sont étroitement régulées par des signaux neuro-humoraux. De plus, grâce à une capacité sécrétoire aussi multiple que variée, le TA joue un rôle endocrine permettant d’assurer une communication avec de nombreux organes et tissus mais aussi un rôle paracrine et autocrine permettant une communication locale entre les différents types cellulaires qui le composent.
Voyons à présent les mécanismes impliqués dans le développement normal de la masse grasse. Nous nous intéresserons ensuite aux modifications cellulaires du TA et de ses principales fonctions au cours d’un développement excessif ou d’une régression.
Figure 4 : Les sécrétions du tissu adipeux
Adipocytes Métabolisme lipidique et
des lipoprotéines Lipoprotéine lipase
Acylation stimulatingprotein(ASP) Prostaglandines
Acide lysophosphatidique(LPA) Retinolbindingprotein(RBP)
Cholesterylester transferaseprotein(CETP) Autotaxine(phospholipaseD)
Tonus vasculaire et angiogenèse Vascularendothelialgrowthfactor(VEGF) Monobutyrine
Leptine
FIAF (PGAR ou angiopoietinlike4) Angiopoietin2 Angiotensinogèneet Angiotensine II Metalloprotéasesde type 2 et 9 (MMP-2 et-9) Apeline Réponse immunitaire et inflammatoire Tumornecrosisfactorα(TNF-α) Interleukines 6 et 8 (IL-6 etIL-8)
Plasminogenactivatorinhibitor-1 (PAI-1) Haptoglobine
SerumamyloïdA (SAA)
Monocyte chemoattractantprotein(MCP-1) Métallothionéïne Métabolisme et homéostasie énergétique Leptine Adiponectine Résistine Interleukine 6 (IL-6) Apeline
B) Le développement normal du tissu adipeux
Le développement de lignées cellulaires fibroblastiques pluripotentes ou unipotentes a largement contribué à l’identification et à la compréhension des événements cellulaires et moléculaires impliqués dans la formation des adipocytes, i.e. la différenciation adipocytaire ou adipogenèse. Le tableau 1 présente les principaux modèles de préadipocytes utilisés in
vitro pour l’analyse de l’adipogenèse ainsi que leur origine tissulaire (d’après (91)). Notons
que la majorité de ces modèles cellulaires sont d’origine embryonnaire et murine.
Tableau 1: Les différents modèles de culture cellulaire utilisés pour l’étude de l’adipogenèse
Nature de la culture Phénotype Nom Origine tissulaire
Lignées totipotentes Cellules ES Blastocystes murins
Lignées pluripotentes Muscle, adipocyte blanc 10T1/2 hMADS Embryons de souris C3H TA humain
Lignées unipotentes Adipocyte blanc
Adipocyte brun 3T3-L1, 3T3-F442A Ob17 Clone TA1 Clone A31T Clone 1246 PAZ6 HIB 1B
Embryon de souris Swiss
TA épididymaire de souris ob/ob adulte Clone dérivé des 10T1/2 traités par 5-azacytidine
Lignée murine Balb/c3T3
Carcinome embryonnaire de souris C3H
Fœtus humain TA brun de souris Cultures Primaires Adipocytes
blanc ou bruns
FSV du TA TA blanc ou brun (rongeurs, lapins, porcs, hommes…)
Voyons à présent les voies de régulation des processus de détermination et de différenciation adipocytaires.
B.1) Le processus de détermination adipocytaire
Comme l’indique la figure 5, la détermination adipocytaire correspond à l’orientation d’une cellule précurseur, supposée d’origine mésenchymateuse, vers la lignée adipocytaire. Bien que les mécanismes impliqués dans ce processus soient encore peu connus, certains facteurs susceptibles d’orienter le précurseur mésenchymateux vers le lignage adipeuxont été identifiés (pour revue (79, 226)). C’est notamment le cas des voies de signalisation de delta fos B et de l’acide rétinoïque mais aussi de Wnt, une glycoprotéine sécrétée impliquée dans la croissance et le devenir cellulaire et des BMPs (bone morphogenic protein) appartenant à la superfamille du TGF-β et impliqués dans le devenir des cellules mésenchymateuses. Le facteur delta fos B inhibe l’adipogenèse en favorisant la différenciation ostéogénique (234). L’activation de la voie Wnt inhibe également la différenciation adipocytaire en favorisant l’orientation myogénique (230). Enfin, une exposition des cellules mésenchymateuses multipotentes CH310T1/2 à du BMP-4 engage les cellules vers un lignage adipogénique (261). L’influence du BMP-2 sur ces cellules CH310T1/2 semble en revanche plus complexe puisqu’à faibles concentrations il stimule l’engagement vers le lignage adipogénique alors qu’à de fortes concentrations il stimule l’engagement vers le lignage ostéogénique (283).
Il est à noter que l’origine des précurseurs des adipocytes n’est pas claire. Chez l’embryon, l’apparition d’adipocytes est concomitante à l’apparition du système vasculaire (52) et la culture de cellules souches embryonnaires murines en présence d’acide rétinoïque promeut la différenciation adipocytaire (58, 207). Chez l’adulte, des cellules mésenchymateuses de la moelle osseuse caractérisées par leur capacité d’adhésion sur plastique, leur capacité de prolifération et leur expression de différents marqueurs de surface tels que le CD105 et l’absence du marqueur des cellules souches hématopoïétiques CD34, sont capables in vitro de s’orienter vers des voies adipogéniques, chondrogéniques et ostéogéniques (210). De plus, des analyses clonales ont permis de montrer qu’une même cellule conservait ces capacités multiples de détermination (210). Récemment, une étude réalisée chez des souris soumises à un régime gras a permis de montrer par l’utilisation d’approches de repopulation des cellules de la moelle osseuse par des cellules souches qui expriment une protéine fluorescente verte (GFP) que certains adipocytes des dépôts profonds pourraient être originaires de cellules de la moelle osseuse (54). De plus, des cellules sanguines circulantes ont été montrées comme pouvant exprimer une capacité de différenciation adipocytaire, suggérant que des cellules de la moelle osseuse peuvent, sous des stimuli à préciser, être mobilisées dans la circulation sanguine et être recrutées dans les
Figure 5 : Détermination et différenciation adipocytaires
D’après GregoireF. M., Physiol. Rev., 1998.
Type cellulaire Evènements moléculaires Etapes
Précurseur multipotent Adipoblaste Chondrobastes Ostéoblastes Myoblastes Détermination •Voie Wnt •Delta Fos B •Acide rétinoïque Différenciation Phase exponentielle de croissance Préadipocyte Arrêt de croissance (confluence) Remodelage de la MEC et du cytosquelette Pref1 C/EBP βet δ PPAR γ C/EBP α •Gènes adipocytaires •Enzymes lipogéniques et synthèse de TG •Lipolyse •Activités sécrétoires Adipocyte mature Maturation terminale Expansion clonale (mitoses post-confluence) Engagement (commitment)
dépôts adipeux (101). Le TA adulte contient également au sein de la FSV des cellules résidentes capables d’exprimer des capacités multiples de différenciation (304). De plus, diverses approches in vivo ont montré la capacité réparatrice de ces cellules dans des modèles animaux d’ischémie vasculaire et cardiaque ou de dommages osseux et musculaires. La revue qui suit : « le TA un donneur de cellules souches » présente ces données.
biologie générale
biologie générale
LE TISSU ADIPEUX :
UN DONNEUR DE CELLULES SOUCHES ?*
Anne BOULOUMIÉ, Sandra DE BARROS, Marie MAUMUS, Jean GALITZKY, Coralie SENGENES
Les cellules souches sont caractérisées par leur capacité d’autorenouvelle-ment et leur capacité à produire des cellules différenciées fonctionnelles. Différents types de cellules souches sont définis en fonction de leur ori-gine et de leur devenir : (1) les cellules souches embryonnaires totipoten-tes capables de former toutotipoten-tes les couches embryonnaires ainsi que les annexes extra-embryonnaires qui supportent la croissance de l’embryon, (2) les cellules souches embryonnaires pluripotentes qui donnent nais-sance au mésoderme, endoderme et ectoderme, (3) les cellules souches multipotentes, capables de générer plusieurs types cellulaires, (4) les cellules progénitrices ou précurseurs qui présentent une capacité limitée d’autorenouvellement et qui se différencient en un type cellulaire défini [1].
Des progrès récents dans l’isolement et la caractérisa-tion des cellules souches/progénitrices ont conduit à la mise en évidence de cellules présentant certaines pro-priétés de cellules souches/progénitrices dans divers tissus adultes, tels que le cœur, le rein, le cerveau, le muscle et également le tissu adipeux. Ces cellules constitue-raient un réservoir de cellules réparatrices prêtes à être mobilisées et à se différencier en réponse à une isché-mie et/ou à un dommage. Ces cellules présentent un intérêt croissant en médecine réparative et régénérative avec un rôle thérapeutique potentiel dans une grande variété d’applications cliniques. Cependant, la présence de cellules souches/progénitrices dans les tissus adultes a conduit à de nombreuses questions et controverses quant à leurs identités et potentialités réelles de diffé-renciation [2].
Chez l’adulte, la moelle osseuse est considérée comme le tissu réservoir de cellules souches [3]. Deux familles au moins de cellules souches/progénitrices qui représentent une frac-tion mineure de la populafrac-tion totale de la moelle (0,001 à 0,01 % des cellules nuclées), ont été identifiées : les cellules souches hématopoiétiques qui comprennent des cellules multipotentes capables de reconstituer l’ensemble des lignées hématopoiétiques, des cellules progénitrices mono-potentes donnant naissance à un lignage, et les cellules sou-ches mésenchymateuses qui présentent la capacité de se différencier en cellules des tissus connectifs, dont les os, le tissu adipeux et le cartilage. Une population de cellules immatures capables de prolifération sans sénescence et capables de s’orienter vers des lignages distincts, i.e. endo-thélial, endodermal et neural in vitro et in vivo, a été égale-ment décrite dans la moelle adulte et définie comme « cellules souches adultes multipotentes » [4]. Cependant, leur exis-tence est soumise à de fortes controverses. Finalement, des cellules endothéliales progénitrices sont également présentes dans la moelle osseuse. Ces cellules contribueraient à la néo-vascularisation de tissus ischémiques après leur mobilisation et leur recrutement vers les sites ischémiques [5].
En plus de la moelle osseuse, d’autres sources de cellules souches/progénitrices ont été décrites chez l’adulte, tels que la peau [6], le muscle [7], le cerveau [8] et le tissu
Inserm, Équipe Avenir, INSERM U858, Institut de médecine moléculaire de Rangueil, Toulouse ; Université Paul Sabatier, Institut Louis Bugnard IFR31, Toulouse. Correspondance : Anne Bouloumié, INSERM équipe AVENIR, Faculté de méde-cine, 37, allées Jules Guesde, 31000 Toulouse.
biologie générale
Caractéristiques in vitro
des cellules souches/progénitrices du tissu adipeux humain
La présence de cellules progénitrices dans le tissu adipeux humain est reconnue depuis les travaux de Bjorntorp sur l’évolution de la cellularité de la masse adipeuse avec le développement de l’obésité.
Les préadipocytes
En effet, ses travaux ont montré clairement que l’obésité chez l’homme se caractérise par une phase d’hypertro-phie adipocytaire suivie d’une phase d’hyperplasie adi-pocytaire [10, 11]. Les adipocytes étant des cellules matures différenciées, incapables de proliférer. L’aug-mentation du nombre d’adipocytes dans le tissu adipeux (TA) de patients obèses est expliquée par la différencia-tion de cellules progénitrices présentes dans la fracdifférencia-tion stroma-vasculaire (FSV), i.e. la fraction non-adipocytaire, du TA [12]. En effet, l’isolement de la FSV de TA humain et sa mise en culture in vitro en condition adipogénique [13, 14], i.e. en présence de facteurs favorisant la diffé-renciation adipocytaire tels que l’insuline, la triodothryro-nine et le cortisol, conduit à la formation de cellules in vitro qui expriment des transcripts spécifiques des adipo-cytes. De plus, ces cellules différenciées présentent des activités fonctionnelles métaboliques, i.e. lipolyse et lipo-génèse, et sécrétoires (production de leptine) des adipo-cytes matures. Des expériences chez les rongeurs ont permis de plus de montrer que ces cellules forment in vitro des adipocytes matures fonctionnels au site de leur injection [15, 16]. Ces résultats démontrent la présence, au sein du TA, de cellules immatures capables de se dif-férencier in vitro et in vivo en adipocytes fonctionnels. Différenciation in vitro des cellules de la FSV du TA humain
Outre leur capacité de différenciation en adipocyte in vitro, de nombreux laboratoires ont, par la suite, montré que les cellules de la FSV humaine pouvaient acquérir selon les conditions de culture in vitro des marqueurs biochimiques caractéristiques de lignages cellulaires variés [17] : lignage ostéogénique [18], chondrogénique [19, 20] et myogénique [21, 22] mais également l’expression de marqueurs du lignage neuronal [21, 23], endothélial [24-26], épithélial [27-29] et même cardiaque [30]. De plus, des approches « clonales », c’est-à-dire d’analyse des capacités de différenciation des cellules dérivant d’une cellule unique après multiples passages, ont montré que plusieurs clones cellulaires pouvaient se différencier en plusieurs lignages [22, 23], suggérant la présence de cellules de type « cellules souches adultes multipotentes » et non pas seulement un mélange de population de cel-lules progénitrices unipotentes. Ces résultats sont en accord avec les résultats obtenus par le groupe de Chris-tian Dani [31] montrant dans la FSV isolée à partir de TA de jeunes donneurs, la présence de cellules plus immatures et multipotentes (hMADS ou Human Multipo-tent Adipose Derived Stem Cell). Des expériences paral-lèles chez les rongeurs mettaient également en évidence une plasticité importante des cellules de la FSV des TAs
Limites des approches in vitro sur les cellules de la FSV du TA humain
La majorité des approches réalisées in vitro utilisent des phases d’expansion cellulaire en présence de fortes concentrations de sérum, conditions associées à des alté-rations phénotypiques des cellules [35]. En effet, alors que les cellules natives, i.e. directement isolées, de la FSV humaine expriment des marqueurs membranaires de type CD34, marqueur des cellules souches hématopoiétiques, et sont dépourvues des marqueurs des cellules souches mésenchymateuses Stro-1 et CD105, les cellules placées en culture expriment un profil inverse, i.e. perte du CD34 et gain de CD105 et Stro-1 [25, 36-38]. De plus, peu ou pas d’analyses fonctionnelles ont été associées aux études relatives aux potentialités de différenciation des cellules. Ces analyses sont cependant nécessaires pour statuer clairement quant à la capacité réelle de différenciation en cellules fonctionnelles. De plus, certains résultats obtenus chez les rongeurs n’ont pas été confirmés chez l’homme suggérant que les capacités de différenciation des cellules de la FSV humaine sont plus restreintes que chez le rongeur. Enfin, la FSV du TA n’est pas constituée d’une population de cellules homogènes mais contient, comme son nom l’indi-que, des populations cellulaires de la composante vascu-laire [25] et de la composante stromale, i.e. macrophages et lymphocytes infiltrés [39].
Isolement des cellules progénitrices/souches natives de la FSV du TA humain
Afin d’isoler et de caractériser la population de cellules progénitrices présentes dans la FSV du TA humain, notre groupe a développé une approche d’immunosélection/ déplétion permettant d’isoler les différentes populations cellulaires. Nous avons ainsi démontré que les cellules « natives » positives pour le CD34 et négatives pour le marqueur endothélial CD31 sont la seule population cel-lulaire parmi les cellules endothéliales capillaires (CD34+/ CD31+), les macrophages (CD34–/CD14+) et les cellules CD34–/CD31–/CD14–, à présenter la capacité de se dif-férencier en adipocytes in vitro [38]. De plus, une partie de cette même population cellulaire possède, en milieu de culture endothélial, la capacité d’exprimer des marqueurs endothéliaux et de s’organiser en structures semblables à des capillaires [25]. Ces résultats montrent que la fraction cellulaire CD34+/CD31– native, i.e. n’ayant subi aucune étape d’expansion in vitro, de la FSV du TA humain pré-sente des propriétés de cellules progénitrices capables de donner naissance à des cellules qui expriment des mar-queurs phénotypiques des adipocytes et des cellules endo-théliales. Il reste à déterminer si cette population cellulaire native est constituée d’un mélange de cellules progénitrices unipotentes ou de cellules souches multipotentes.
Caractéristiques in vivo
des cellules souches/progénitrices du TA humain
Les approches in vitro ont donc apporté des observations intéressantes sur la plasticité potentielle des cellules dérivées de la FSV du TA humain, justifiant la mise en place d’appro-ches in vivo d’injection de cellules humaines dans des
biologie générale tissulaires afin de suivre la potentialité réparatrice de ces
cellules. Les mécanismes responsables des interactions entre cellules implantées et cellules hôtes restent à être caractérisés. Cependant, des travaux récents apportent des données intéressantes concernant la réponse de l’hôte ainsi que le comportement des cellules injectées en fonction des environnements locaux distincts.
Réponse immune de l’hôte
Les cellules dérivées de la FSV des TAs humains semblent présenter une nature non-immunogénique [40]. En effet, in vitro les cellules ne provoquent pas d’alloréactivité de lymphocytes incompatibles mais apparaissent de plus exercer des propriétés immunosuppréssives [40, 41]. De plus, in vivo, l’implantation des cellules humaines chez des souris immunocompétentes n’induit pas d’accumulation de lymphocytes au site d’implantation [31]. Les processus exacts impliqués nécessitent une caractérisation plus appro-fondie. Cependant, ces observations pourraient avoir un impact important en termes de thérapie allogénique ou pour le transfert de cellules dans un organisme hôte dérivées d’un autre donneur [42].
Mécanismes d’adressage des cellules
Plusieurs types de modes d’administration des cellules ont été utilisés de l’injection intraveineuse à l’application directe au site endommagé. Quand les cellules sont injectées par voie systémique chez la souris, les cellules s’infiltrent en conditions basales dans différents tissus [43] dont les poumons, le foie, le cœur, le thymus et le cerveau [44]. Toutefois, en présence de dommages tissulaires, une infil-tration plus élevée est observée au niveau du site endom-magé. Par exemple, une hépatectomie partielle chez la souris conduit à l’augmentation de l’infiltration des cellules dérivées de la FSV dans le foie [44]. Les mécanismes qui guident les cellules aux sites endommagés ne sont pas connus. Nous avons initié des expériences sur la capacité de migration des cellules CD34+/CD31–. Nos résultats montrent que les cellules migrent fortement en réponse à un gradient de facteurs produits par les cellules endo-théliales. Des recherches complémentaires sont nécessaires pour déterminer quels facteurs, tels que des chimiokines ou des signaux relatifs à l’état hypoxique, sont responsables de l’attraction des cellules souches/progénitrices de la FSV des TAs humains.
Devenir in vivo
Le principe de la thérapie cellulaire est que les cellules sou-ches/progénitrices vont au niveau du site endommagé se différencier sous l’influence de facteurs locaux en cellules d’un phénotype approprié. Cependant la différenciation « réelle » des cellules souches/progénitrices in vivo est soumise à controverse et plusieurs processus alternes ont été suggérés comme participant aux activités réparatrices des cellules telles que la fusion cellulaire aboutissant à la reprogrammation nucléaire et la production par les cellules souches/progénitrices de facteurs trophiques et « répara-teurs » agissant de manière paracrine sur les cellules hôtes. La capacité réparatrice des cellules souches/progénitrices de la FSV du TA humain a été clairement mise en évidence dans différents modèles chez la souris. Dans un modèle de souris immunotolérante avec une ischémie de la patte arrière provoquée par ligature de l’artère fémorale, l’injection de
CD34+/CD31– [25] conduit à une amélioration de la néovasularisation du membre ischémique. Toutefois, il reste à déterminer si cette néovascularisation est due à une incorportion des cellules injectées dans la vasculature de la souris et à leur différenciation en cellules endothéliales ou à la production locale par les cellules injectées de fac-teurs proangiogéniques [46, 47]. Des activités réparatrices de dommages osseux ont été également rapportées dans différents modèles murins [48, 49]. Enfin, l’injection des cellules souches multipotentes chez des souris « mdx », modèle de myopathie de Duchenne, est associée à une expression importante et prolongée de la dystrophine humaine, protéine nécessaire à l’intégrité de la fibre muscu-laire [31]. Des expériences en parallèle sur les cellules de la FSV murine montrent également des capacités réparatrices multiples [50-52].
Limites et questions
Un nombre important d’observations suggère que le proces-sus néoplastique impliquerait des cellules souches [53]. Une étude récente montre le risque de transformation des cellules de la FSV. En effet, la culture à long terme des cellules de la FSV du TA humain adulte a été associée à l’immortalisation et la transformation spontanée des cellules, conduisant in vivo à la formation de tumeur après injec-tion des cellules chez la souris athymique [54]. Des études complètes sont donc nécessaires pour établir clairement le risque associé à l’expansion in vitro des cellules de la FSV humaine.
Le déclin du potentiel régénératif est une signature du vieillissement et pourrait être dû à des changements relatifs à l’âge des cellules souches spécifiques des tissus. Des études récentes chez la souris montrent que le déclin de l’activité des cellules progénitrices lié au vieillissement peut être réversible suite à une exposition à un environnement « jeune » alors qu’à l’inverse l’environnement d’un animal âgé empêche la régénération tissulaire stimulée par des cellules progénitrices issues d’animaux « jeunes » [55]. Les études de l’équipe de C. Dani montrant la présence de cellules souches multipotentes dans la FSV ont été réali-sées chez des patients jeunes [31]. Il serait maintenant intéressant de déterminer l’impact de l’âge sur les cellules souches/progénitrices du tissu adipeux tant au niveau de leur potentialité intrinsèque que sur leur interaction avec l’envi-ronnement.
Finalement, la présence de ces cellules dans la FSV pose la question de leur origine et de leur spécificité. Récem-ment, Hong et al. [56] a décrit que les fibrocytes circulant CD45+ étaient capables en culture d’accumuler des trigly-cérides. Les études de Crossno et al. [57] réalisées chez la souris en transplantant des cellules de la moelle osseuse de souris transgéniques qui expriment la protéine fluores-cente verte (GFP) à des souris sauvages soumises à un régime riche en graisse, montrent l’apparition d’adipocytes GFP positifs dans les tissus adipeux. Ces deux études sug-gèrent que certaines cellules progénitrices du tissu adipeux pourraient avoir une origine sanguine/moelle osseuse. Nos expériences montrent que les cellules CD34+/CD31– circulantes sanguines ne présentent cependant pas les mêmes potentialités que les cellules CD34+/CD31– du tissu adipeux humain, i.e. production de colonies de cellules sanguines mais absence de différenciation adipocytaire
biologie générale gine, le micro-environnement dans lequel elles résident
définit leur potentialité et leur spécificité. Des études complémentaires sont donc nécessaires pour mieux définir l’influence du micro-environnement sur la potentialité des cellules souches/progénitrices.
Conclusion
De nombreuses données obtenues in vitro et in vivo montrent la présence au sein des TAs humains de popu-lations cellulaires présentant des capacités similaires aux cellules progénitrices/souches. La capacité multiple de dif-férenciation reste soumise à controverse et nécessite des recherches supplémentaires pour statuer clairement. Entre autres, des méthodes standardisées et validées d’isolement, de caractérisation, de sélection, de purification, de culture, de stockage et d’injection des cellules à partir du TA humain doivent être développées. Les cellules souches/progénitrices du TA humain pourraient, de part leur accessibilité et leur nombre au sein de la FSV, devenir un modèle cellulaire intéressant pour des approches de thérapie cellulaire pour la régénération et la réparation tissulaire [58, 59]. Toute-fois, de nombreux challenges scientifiques restent encore à être réalisés avant d’envisager de telles approches. Les mécanismes d’infiltration et d’adressage des cellules doivent être mieux caractérisés ainsi que le rôle relatif de la diffé-renciation, fusion et production de facteurs paracrines dans les effets réparateurs de ces cellules.
Résumé
De nombreux laboratoires ont montré que les cellules issues de la fraction stroma-vasculaire des tissus adipeux humains pouvaient exprimer in vitro selon les conditions de culture des marqueurs biochimiques de lignages cellulaires variés : adipogénique, ostéogénique, chondrogénique, myogénique, endothélial, neuronal et épithélial. De plus, diverses appro-ches in vivo ont montré la capacité réparatrice des cellules de la fraction stroma-vasculaire du tissu adipeux humain dans des modèles animaux d’ischémie vasculaire et cardiaque ou de dommages osseux et musculaires. Ces résultats sug-gèrent fortement que le tissu adipeux humain contient des cellules qui présentent des propriétés similaires à celles des cellules souches ou progénitrices. Toutefois, la nature exacte de ces cellules, leur potentialité réelle de différen-ciation in vivo ainsi que les mécanismes impliqués dans leur capacité de réparation et de régénération restent à être caractérisés pour envisager leur utilisation dans des appro-ches de régénération et réparation tissulaire.
Mots-clés : Cellule progénitrice – Préadipocyte – Cellules endothéliales – Réparation – Régénération.
Abstract
Several laboratories have shown that the cells from the stroma-vascular fraction of the human adipose tissue express, depending on cell culture conditions, bioche-mical markers of multiple cell lineages including adipo-genic, osteoadipo-genic, chondroadipo-genic, myoadipo-genic, endothelial,
in vivo approaches revealed the ability of the cells deri-ved from the stroma-vacsular fraction of adipose tissue to repair ischemic or damaged tissues. Altogether these data strongly suggest that the stroma-vascular fraction of the human adipose tissue contains cells that exhibit properties like stem/progenitor cells. However, the exact nature of the cells, their potentiality to lead to diffe-rentiated cells in vivo as well as the mechanisms involved in their repair capability remain to be characterized to consider their use in regenerative and reparative medi-cine.
Key-words: Progenitor – Preadipocyte – Endothelial cell – Repair – Regeneration.
Bibliographie
[1] Lakshmipathy U., Verfaillie C. – Stem cell plasticity. Blood
Rev., 2005, 19, 29-38.
[2] Pessina A., Gribaldo L. – The key role of adult stem cells:
therapeutic perspectives. Curr. Med. Res. Opin., 2006, 22,
2287-2300.
[3] Pittenger M.F., Mackay A.M., Beck S.C. et al. –
Multili-neage potential of adult human mesenchymal stem cells. Science, 1999, 284, 143-147.
[4] Jiang Y., Jahagirdar B.N., Reinhardt R.L. et al. –
Pluri-potency of mesenchymal stem cells derived from adult
marrow. Nature, 2002, 418, 41-49.
[5] Asahara T., Murohara T., Sullivan A. et al. – Isolation of
putative progenitor endothelial cells for angiogenesis. Science, 1997, 275, 964-967.
[6] Toma J.G., Akhavan M., Fernandes K.J. et al. – Isolation
of multipotent adult stem cells from the dermis of
mam-malian skin. Nat. Cell. Biol., 2001, 3, 778-784.
[7] Jackson K.A., Mi T., Goodell M.A. – Hematopoietic potential of stem cells isolated from murine skeletal muscle.
Proc. Natl. Acad. Sci. USA, 1999, 96, 14482-14486.
[8] Bjornson C.R., Rietze R.L., Reynolds B.A., Magli M.C., Vescovi A.L. – Turning brain into blood: a hematopoietic
fate adopted by adult neural stem cells in vivo. Science,
1999, 283, 534-537.
[9] Zuk P.A., Zhu M., Mizuno H. et al. – Multilineage cells from
human adipose tissue: implications for cell-based
thera-pies. Tissue Eng., 2001, 7, 211-228.
[10] Bjorntorp P., Gustafson A., Persson B. – Adipose tissue fat cell size and number in relation to metabolism in
endo-genous hypertriglyceridemia. Acta Med. Scand., 1971,
190, 363-367.
[11] Sjostrom L., Smith U., Krotkiewski M., Bjorntorp P. – Cel-lularity in different regions of adipose tissue in young men
and women. Metabolism, 1972, 21, 1143-1153.
[12] Bjorntorp P., Karlsson M., Pertoft H., Pettersson P., Sjos-trom L., Smith U. – Isolation and characterization of cells
from rat adipose tissue developing into adipocytes. J. Lipid
Res., 1978, 19, 316-324.
[13] Deslex S., Negrel R., Vannier C., Étienne J., Ailhaud G. – Differentiation of human adipocyte precursors in a
che-mically defined serum-free medium. Int. J. Obes., 1987,
11, 19-27.
[14] Hauner H., Entenmann G., Wabitsch M. et al. –
Promo-ting effect of glucocorticoids on the differentiation of human adipocyte precursor cells cultured in a chemically
defined medium. J. Clin. Invest., 1989, 84, 1663-1670.
[15] Vannier C., Gaillard D., Grimaldi P. et al. – Adipose
conversion of ob17 cells and hormone-related events. Int.
J. Obes., 1985, 9 (Suppl. 1), 41-53.
biologie générale
derived adult stem cells in nude mouse. Biochem.
Bio-phys. Res. Commun., 2006, 345, 631-637.
[17] Gimble J., Guilak F. – Adipose-derived adult stem cells: isolation, characterization, and differentiation potential. Cytotherapy, 2003, 5, 362-369.
[18] Halvorsen Y.D., Franklin D., Bond A.L. et al. – Extracel-lular matrix mineralization and osteoblast gene expression by human adipose tissue-derived stromal cells. Tissue Eng., 2001, 7, 729-741.
[19] Erickson G.R., Gimble J.M., Franklin D.M., Rice H.E., Awad H., Guilak F. – Chondrogenic potential of adipose tissue-derived stromal cells in vitro and in vivo. Biochem. Biophys. Res. Commun., 2002, 290, 763-769. [20] Estes B.T., Wu A.W., Guilak F. – Potent induction of
chondrocytic differentiation of human adipose-derived adult stem cells by bone morphogenetic protein 6. Arth-ritis Rheum., 2006, 54, 1222-1232.
[21] Zuk P.A., Zhu M., Ashjian P. et al. – Human adipose tis-sue is a source of multipotent stem cells. Mol. Biol. Cell., 2002, 13, 4279-4295.
[22] Rodriguez L.V., Alfonso Z., Zhang R., Leung J., Wu B., Ignarro L.J. – Clonogenic multipotent stem cells in human adipose tissue differentiate into functional smooth muscle cells. Proc. Natl. Acad. Sci. USA, 2006, 103, 12167-12172.
[23] Guilak F., Lott K.E., Awad H.A. et al. – Clonal analysis of the differentiation potential of human adipose-derived adult stem cells. J. Cell. Physiol., 2006, 206, 229-237. [24] Planat-Benard V., Silvestre J.S., Cousin B. et al. – Plas-ticity of human adipose lineage cells toward endothelial cells: physiological and therapeutic perspectives. Circula-tion, 2004, 109, 656-663.
[25] Miranville A., Heeschen C., Sengenes C., Curat C.A., Busse R., Bouloumie A. – Improvement of postnatal neo-vascularization by human adipose tissue-derived stem cells. Circulation, 2004, 110, 349-355.
[26] Martinez-Estrada O.M., Munoz-Santos Y., Julve J., Reina M., Vilaro S. – Human adipose tissue as a source of Flk-1+ cells: new method of differentiation and expan-sion. Cardiovasc. Res., 2005, 65, 328-333.
[27] Brzoska M., Geiger H., Gauer S., Baer P. – Epithelial dif-ferentiation of human adipose tissue-derived adult stem cells. Biochem. Biophys. Res. Commun., 2005, 330, 142-150.
[28] Talens-Visconti R., Bonora A., Jover R. et al. – Hepato-genic differentiation of human mesenchymal stem cells from adipose tissue in comparison with bone marrow mesenchymal stem cells. World J. Gastroenterol., 2006, 12, 5834-5845.
[29] Timper K., Seboek D., Eberhardt M. et al. – Human adi-pose tissue-derived mesenchymal stem cells differentiate into insulin, somatostatin, and glucagon expressing cells. Biochem. Biophys. Res. Commun., 2006, 341, 1135-1140.
[30] Gaustad K.G., Boquest A.C., Anderson B.E., Gerdes A.M., Collas P. – Differentiation of human adipose tissue stem cells using extracts of rat cardiomyocytes. Biochem. Bio-phys. Res. Commun., 2004, 314, 420-427.
[31] Rodriguez A.M., Pisani D., Dechesne C.A. et al. – Trans-plantation of a multipotent cell population from human adipose tissue induces dystrophin expression in the immu-nocompetent mdx mouse. J. Exp. Med., 2005, 201, 1397-1405.
[32] Planat-Benard V., Menard C., Andre M. et al. – Sponta-neous cardiomyocyte differentiation from adipose tissue stroma cells. Circ. Res., 2004, 94, 223-229.
[33] Cousin B., Andre M., Arnaud E., Penicaud L., Casteilla L. – Reconstitution of lethally irradiated mice by cells isolated from adipose tissue. Biochem. Biophys. Res. Commun.,
[34] Charriere G., Cousin B., Arnaud E. et al. – Preadipocyte conversion to macrophage. Evidence of plasticity. J. Biol. Chem., 2003, 278, 9850-9855.
[35] Javazon E.H., Beggs K.J., Flake A.W. – Mesenchymal stem cells: paradoxes of passaging. Exp. Hematol., 2004, 32, 414-425.
[36] McIntosh K., Zvonic S., Garrett S. et al. – The immuno-genicity of human adipose-derived cells: temporal chan-ges in vitro. Stem Cells, 2006, 24, 1246-1253. [37] Mitchell J.B., McIntosh K., Zvonic S. et al. –
Immunophe-notype of human adipose-derived cells: temporal changes in stromal-associated and stem cell-associated markers. Stem Cells, 2006, 24, 376-385.
[38] Sengenes C., Lolmede K., Zakaroff-Girard A., Busse R., Bouloumie A. – Preadipocytes in the human subcutaneous adipose tissue display distinct features from the adult mesenchymal and hematopoietic stem cells. J. Cell. Phy-siol., 2005, 205, 114-122.
[39] Bouloumie A., Curat C.A., Sengenes C., Lolmede K., Miranville A., Busse R. – Role of macrophage tissue infil-tration in metabolic diseases. Curr. Opin. Clin. Nutr. Metab. Care, 2005, 8, 347-354.
[40] Yanez R., Lamana M.L., Garcia-Castro J., Colmenero I., Ramirez M., Bueren J.A. – Adipose tissue-derived mesen-chymal stem cells have in vivo immunosuppressive pro-perties applicable for the control of the graft-versus-host disease. Stem Cells, 2006, 24, 2582-2591.
[41] Puissant B., Barreau C., Bourin P. et al. – Immunomo-dulatory effect of human adipose tissue-derived adult stem cells: comparison with bone marrow mesenchymal stem cells. Br. J. Haematol., 2005, 129, 118-129.
[42] Niemeyer P., Kornacker M., Mehlhorn A. et al. – Compa-rison of Immunological Properties of Bone Marrow Stro-mal Cells and Adipose Tissue-Derived Stem Cells Before and After Osteogenic Differentiation in Vitro. Tissue Eng., 2007, 13, 111-121.
[43] Meyerrose T.E., De Ugarte D.A., Hofling A.A. et al. – In vivo Distribution of Human Adipose-Derived MSC. Stem Cells, 2007, 25, 220-227.
[44] Kim D.H., Je C.M., Sin J.Y., Jung J.S. – Effect of partial hepatectomy on in vivo engraftment after intravenous administration of human adipose tissue stromal cells in mouse. Microsurgery, 2003, 23, 424-431.
[45] Moon M.H., Kim S.Y., Kim Y.J. et al. – Human adipose tissue-derived mesenchymal stem cells improve postnatal neovascularization in a mouse model of hindlimb ische-mia. Cell. Physiol. Biochem., 2006, 17, 279-290. [46] Rehman J., Traktuev D., Li J. et al. – Secretion of
angio-genic and antiapoptotic factors by human adipose stromal cells. Circulation, 2004, 109, 1292-1298.
[47] Sumi M., Sata M., Toya N., Yanaga K., Ohki T., Nagai R. – Transplantation of adipose stromal cells, but not mature adipocytes, augments ischemia-induced angiogenesis. Life Sci., 2007, 80, 559-565.
[48] Hattori H., Masuoka K., Sato M. et al. – Bone formation using human adipose tissue-derived stromal cells and a biodegradable scaffold. J. Biomed. Mater. Res. B. Appl. Biomater., 2006, 76, 230-239.
[49] Peterson B., Zhang J., Iglesias R. et al. – Healing of cri-tically sized femoral defects, using genecri-tically modified mesenchymal stem cells from human adipose tissue. Tis-sue Eng., 2005, 11, 120-129.
[50] Miyahara Y., Nagaya N., Kataoka M. et al. – Monolayered mesenchymal stem cells repair scarred myocardium after myocardial infarction. Nat. Med., 2006, 12, 459-465. [51] Bacou F., el Andalousi R.B., Daussin P.A. et al. –
Trans-plantation of adipose tissue-derived stromal cells increases mass and functional capacity of damaged skeletal muscle. Cell Transplant., 2004, 13, 103-111.
biologie générale derived stem cells. Plast. Reconstr. Surg., 2006, 117,
857-863.
[53] Marx J. – Cancer research. Mutant stem cells may seed cancer. Science, 2003, 301, 1308-1310.
[54] Rubio D., Garcia-Castro J., Martin M.C. et al. – Sponta-neous human adult stem cell transformation. Cancer Res., 2005, 65, 3035-3039.
[55] Conboy I.M., Conboy M.J., Wagers A.J., Girma E.R, Weissman I.L., Rando TA. – Rejuvenation of aged proge-nitor cells by exposure to a young systemic environment. Nature, 2005, 433, 760-764.
[56] Hong K.M., Burdick M.D., Phillips R.J., Heber D., Strie-ter R.M. – CharacStrie-terization of human fibrocytes as
circu-lating adipocyte progenitors and the formation of human adipose tissue in SCID mice. Faseb, 2005, 19, 2029-2031. [57] Crossno J.T., Majka S.M., Grazia T., Gill R.G., Klemm D.J. – Rosiglitazone promotes development of a novel adipocyte population from bone marrow-derived circulating proge-nitor cells. J. Clin. Invest., 2006, 116, 3220-3228. [58] Rodriguez A.M., Elabd C., Amri E.Z., Ailhaud., Dani C.
– The human adipose tissue is a source of multipotent stem cells. Biochimie, 2005, 87, 125-128.
[59] Casteilla L., Planat-Benard V., Cousin B. et al. – Plasticity of adipose tissue: a promising therapeutic avenue in the treatment of cardiovascular and blood diseases? Arch. Mal. Cœur Vaiss., 2005, 98, 922-926.