Université du Québec
INRS-Energie, Matériaux et Télécommunications
Synthèse et caractérisation de films minces
électrodéposés de cuivre - palladium
Par
Morgan Allemand
Mémoire présenté pour l’obtention du grade de Maître ès sciences (M. Sc.) en sciences de l’énergie et des matériaux
Jury d’évaluation
Examinateur externe Benoît Marsan
Département de chimie, Université du Québec à Montréal
Président du jury et
Examinateur interne Andreas Rüediger
INRS-Energie, Matériaux et Télécommunications Directeur de recherche Daniel Guay
INRS-Energie, Matériaux et Télécommunications
Résumé
L'hydrogène fait partie des sources d'énergie envisagées pour l'avenir dans des applications telles que les piles à combustible et les transports. La production d'hydrogène se faisant essentiellement à partir du vaporéformage du méthane, une étape de purification est nécessaire. C'est dans ce cadre que le projet de synthèse de membranes de cuivre-palladium (Cu-Pd) par électrodéposition pour purification de l'hydrogène trouve son sens. L'étude est basée sur la possibilité d'utiliser un procédé d'électrodéposition et d’en contrôler les paramètres pour fabriquer des films d'alliage Cu60Pd40 fins et denses, en vue de maximiser les flux de traitement de l'hydrogène.
Dans un premier temps, l’attention s’est portée sur la détermination des paramètres du procédé de coélectrodéposition. Les concentrations des sels de Cu(NO3)2 et de Pd(NO3)2 dans l’électrolyte de HNO3, permettant de déposer des films de composition proche de Cu60Pd40, sont de 6 mM et 4 mM, respectivement. Des tests de microbalance électrochimique ont servi à évaluer les vitesses de déposition des ions métalliques sur le substrat. Les paramètres de déposition ont été sélectionnés de telle sorte que les vitesses de déposition du Cu et du Pd soient maximales et identiques, soit d’environ 32 ng/s. Le potentiel appliqué est de -0.5 VECS et la déposition a lieu sur un substrat de titane. Ce travail a permis notamment de parvenir au contrôle de la composition des films déposés, à savoir Cu60Pd40, déterminée par des analyses EDS. Des analyses DRX ont aidé à confirmer l’obtention d’alliages de Cu-Pd monophasés, en mettant en évidence l’absence des pics de Cu et Pd purs dans les dépôts de Cu-Pd. Des tests sur l’influence de l’agitation et du mode d’application du potentiel sur la composition ont ensuite révélé que l’agitation est un facteur prédominant en comparaison aux autres paramètres.
Dans une seconde étape, le traitement thermique visant à opérer une transformation de phases de type A1 à B2 a été mis en place et optimisé. Il en résulte qu’un recuit à 400°C pour une durée de 5 h, suivi d’un refroidissement lent
en atmosphère contrôlée d’argon + 5% de H2, mène aux meilleurs résultats. Les analyses DRX ont confirmé la réussite du changement de phase.
Par la suite, l’influence des paramètres de déposition, tels que l’agitation et le mode d’application du potentiel de déposition, a été étudiée en vue de synthétiser les films les plus fins et denses possibles. La rugosité et l’aspect de surface ont été évalués, respectivement, par analyse du courant capacitif et par observations MEB. Les rugosités minimales ont été obtenues dans des conditions de déposition pulsée, avec Eon = -0.5 V, Eoff = -0.1 V, ton = 5 ms et toff = 5 ms, sous agitation modérée à 500 rpm. Des dépôts de Cu-Pd sur substrats poreux de titane ont montré être capables de recouvrir la totalité des aspérités. De même, la capacité des films à recouvrir des trous percés dans un échantillon de Ti a été démontrée trois fois supérieure à d’autres techniques de déposition, telle que la déposition par voie chimique (‘electroless deposition’).
Enfin, une étude de la déposition sur plusieurs substrats de natures diverses (acier inoxydable, aluminium, céramique conductrice, alliage de nickel, graphite) a mis en évidence la transposabilité de l’étude, offrant la possibilité de synthétiser des films de Cu-Pd sur des supports adaptés aux applications visées. Les résultats obtenus au cours de ces travaux ont mené à la publication d’un article dans un journal avec comité de lecture et deux présentations à des conférences.
Morgan Allemand Daniel Guay
Remerciements
En premier lieu, je tiens à remercier mon directeur de maîtrise, le professeur Daniel Guay, qui a permis à ce projet de voir le jour. Il m’a apporté son soutien et m’a enrichi de ses précieux conseils tout au long de ce travail. Il a fait preuve d'une grande écoute, et son aisance envers ses étudiants instaure une ambiance de travail plaisante et motivante.
J’adresse ensuite un grand merci à David Reyter, avec qui j'ai travaillé en étroite collaboration dans la première partie de ma maîtrise. Il a contribué activement à ma formation dans le laboratoire et a su répondre patiemment à toutes mes questions.
Je pense aussi à remercier mes collègues de travail, à savoir Manuel Martin, Jules Galipaud, Régis Imbeault, Sébastien Garbarino, Julie Gaudet et bien d’autres, pour leur aide et leur soutien, ainsi que leur bonne humeur quotidienne.
J’aimerais également remercier Christophe Chabanier pour son aide généreuse lors de l’utilisation des instruments de caractérisation.
Aussi, je n’oublie pas Léonard Pelletier, Louise Hudon et Hélène Sabourin, qui m’ont réellement rendu la vie plus facile en m’aidant à résoudre les petits problèmes techniques ou administratifs.
Je remercie par ailleurs les correcteurs de ce mémoire, qui ont généreusement accepté d’y impartir le temps nécessaire.
J’exprime enfin toute ma gratitude à ma famille et à mes amis, pour m'avoir soutenu tout au long de ce travail, s’être soucié de mon bien être et m’avoir appuyé dans mes convictions.
Table des matières
Résumé….. ... ii
Remerciements. ... iv
Table des matières ... v
Liste des figures ... vii
Liste des tableaux. ... xi
1. Introduction ... 1
1.1. Contexte de l’étude et problématique ... 1
1.1.1. Les besoins en hydrogène ... 1
1.1.2. Production de l’hydrogène ... 2 1.1.3. La purification de l’hydrogène ... 5 1.2. Plan du projet ... 13 2. Points théoriques ... 15 2.1. Electrodéposition ... 15 2.1.1. Généralités ... 15
2.2. Propriétés des matériaux déposés ... 26
2.2.1. Le Pd et l’hydrogène ... 26
2.2.2. La fragilisation des métaux à l’hydrogène ... 26
2.2.3. Les alliages de Cu-Pd ... 27
2.2.4. Importance de la morphologie des dépôts ... 32
2.3. Traitements thermiques ... 33
2.3.1. Les paramètres ... 33
3. Matériel et méthodes ... 37
3.1. Synthèse des films par électrodéposition ... 37
3.1.1. Montage ... 37
3.1.2. Bain électrolytique ... 40
3.1.3. Substrat pour la cathode ... 41
3.2. Traitement thermique ... 42 3.2.1. Le four ... 42 3.2.2. L’atmosphère ... 42 3.2.3. La trempe ... 42 3.3. Caractérisations électrochimiques ... 43 3.3.1. Voltammétrie cyclique ... 43
3.3.2. Détermination des vitesses de déposition par microbalance électrochimique… ... 43
3.3.3. Surface électrochimiquement active et facteur de rugosité ... 45
3.4. Caractérisations physico-chimiques ... 48
3.4.1. Microscopie ... 48
4. Contrôle de la composition ... 56
4.1. Potentiels et vitesses de déposition ... 56
4.1.1. Détermination des potentiels de déposition par voltammétrie linéaire ... 56
4.1.2. Vitesse de déposition des métaux évaluée par microbalance électrochimique.. ... 58
4.2. Variation des compositions électrolytiques ... 61
4.2.1. Compositions électrolytiques versus compositions des films ... 61
4.2.2. Obtention d’un alliage monophasé ... 62
4.3. Effet des paramètres de déposition ... 64
4.3.1. Dépôts sans agitation versus avec agitation ... 65
4.3.2. Dépôts pulsés versus potentiostatiques ... 66
5. Structure et morphologie ... 69
5.1. Transformation de phase ... 69
5.1.1. Paramètres du traitement thermique ... 69
5.1.2. Analyse des éléments purs ... 70
5.1.3. Les dépôts de Cu-Pd ... 72
5.2. Morphologie des films déposés ... 78
5.2.1. Sur substrat classique de Ti ... 78
5.2.2. Sur substrat poreux de Ti ... 82
5.2.3. Effet des paramètres de déposition sur la morphologie ... 86
5.2.4. Recouvrement des trous ... 90
5.3. Application de l’étude à d’autres substrats ... 92
Conclusion ... 99
Liste des références ... 102
Liste des figures
Figure 1 : Diagramme de répartition de la production de H2. ... 3
Figure 2 : Schéma synthétisant les étapes du procédé de reformage du méthane pour la production d’hydrogène. ... 4
Figure 3 : Schéma du principe des membranes perméables et sélectives [12]. ... 7
Figure 4 : Schéma des principales étapes du procédé d’électrodéposition (extrait de la référence [56]). ... 16
Figure 5 : Schéma du principe de la voltammétrie linéaire. ... 18
Figure 6 : Schéma illustrant les principes de déposition non pulsée (à gauche) et pulsée (à droite). ... 19
Figure 7 : Courbes de polarisation cathodique lors de la déposition de métaux A et B (inspiré de la référence [56]). ... 23
Figure 8 : Schéma montrant la concentration des espèces ioniques en fonction de la distance à la surface de la cathode selon que la solution est agitée (à gauche) ou non agitée (à droite). ... 25
Figure 9 : Diagramme de phases du système binaire Cu-Pd, en vue globale (en haut) et zoomée sur la structure B2 (en bas) [64]. ... 28
Figure 10 : Schéma d’une structure de type B2 [65]. ... 29
Figure 11 : Schéma d’une structure de type L12 [65]. ... 30
Figure 12 : Représentation schématique des alliages sous forme désordonnée (a) et ordonnée (b) [66]. ... 31
Figure 13 : Représentation schématique de la variation de température lors du traitement thermique. La température est tracée en fonction du temps. ... 34
Figure 14 : Photo de la cellule de déposition à trois compartiments. ... 38
Figure 15 : Photo de l’électrode de travail. ... 38
Figure 17 : Courbe brute d’une mesure de microbalance électrochimique montrant le potentiel de sortie de l’analyseur de fréquence en fonction du temps. ... 44 Figure 18 : Voltammétries cycliques, qui représentent le courant en fonction du
balayage en potentiel, pour différentes vitesses de balayage (60, 40, 20, 10, et 5 mV/s correspondant à a, b, c, d et e respectivement). ... 46 Figure 19 : Droite représentant la variation du courant capacitif mesuré à 0.1 VECS en
fonction de la vitesse de balayage. ... 46 Figure 20 : Photo de l'appareil MEB/EDS. ... 49 Figure 21 : Représentation schématique montrant la méthode d’évaluation de
l’épaisseur des dépôts épais par microscope optique. ... 51 Figure 22 : Diffraction des rayons X par un réseau cristallin (inspiré de la référence
[72]). ... 52 Figure 23 : Appareil de diffraction de rayons X AXS D8 Advance (Brucker) et
définition des angles de diffraction en mode θ-2θ [56]. ... 54 Figure 24 : Voltammétries linéaires sur un substrat de Ti en milieu HNO3 0.5 M a)
sans sel métallique, b) avec 10 mM de Cu(NO3)2, c) avec 10 mM de Pd(NO3)2. ... 58 Figure 25 : Variation des vitesses de déposition du Cu et du Pd en fonction du
potentiel de l’électrode. Des sels de Cu(NO3)2 et de Pd(NO3)2 à des concentrations de 1 mM ou 5 mM ont été utilisés. ... 59 Figure 26 : Variation des vitesses de déposition du Cu (en rouge) et du Pd (en noir)
en fonction de la concentration des espèces ioniques. Les données ont été recueillies à -0.50 V. Les vitesses de déposition sont exprimées ng/s (A) et en atomes/s (B). ... 60 Figure 27 : Composition (EDS) en palladium des films déposés en fonction de la
composition ionique Pd2+ du milieu électrolytique. ... 61 Figure 28 : Patrons de diffraction X des films de PdxCu10-x, A, B, C, D, E et F
correspondant à x = 10, 8, 6, 4, 2 et 0, respectivement. Les positions de référence proviennent des bases de données du logiciel EVA. ... 63 Figure 29 : Variation du paramètre de maille, calculés à partir des résultats DRX, en
Figure 30 : Patrons de diffraction (DRX) des éléments purs utilisés dans l’étude : (A) Ti, (B) Cu et (C) Pd. Le patron de diffraction du Ti a été mesuré expérimentalement sur un disque ayant été préalablement nettoyé, alors que les patrons du Cu et du Pd ont été ont été obtenus par simulation avec le logiciel ‘Diamond’. ... 71 Figure 31 : Patron de diffraction du Cu-Pd électrodéposé sur substrat de titane. ... 73 Figure 32 : Patron de diffraction du Cu-Pd électrodéposé sur substrat de titane et
chauffé à 400°C pendant 24 h sous Ar + H2. L’échantillon a été refroidi par trempe dans N2 liquide. ... 74 Figure 33 : Patrons de diffraction de dépôts de Cu-Pd recuits à 400°C pendant 24 h
et refroidi lentement, A) sous atmosphère réductrice d’argon + 5% de H2 et B) sous atmosphère neutre d’argon. ... 75 Figure 34 : Patrons de diffraction suite à un recuit à 400°C suivi A) d’un
refroidissement lent en atmosphère contrôlée (Ar+5%H2), et B) d’une trempe thermique à l’azote liquide. ... 76 Figure 35 : Patrons de diffraction pour les temps de recuit de 15 min, 30 min, 1 h, 5
h et 24 h, correspondant respectivement, à A, B, C, D et E. La température est de 400°C, sous Ar + 5% de H2 avec refroidissement lent. ... 77 Figure 36 : Images MEB du substrat de titane après polissage et nettoyage. Les
grossissements sont de a) x1000 et b) x10000. ... 79 Figure 37 : Images MEB d’un dépôt de Cu60Pd40 de 5 min à E = -0.5 V, sous
agitation mécanique de 500 rpm. Les grossissements sont de a) x1000 et b) x10000. ... 80 Figure 38 : Images MEB des films électrodéposés à E = -0.5 V pendant 5 min, sous
agitation à 500rpm. A, B, C, D, E et F correspondent à PdxCu10-x, avec x = 0, 2, 4, 6, 8 et 10, respectivement. Les clichés sont pris à un grossissement x10000. ... 81 Figure 39 : Images TEM A) de la fenêtre complète d'observation de l'échantillon, B)
pour le Pd (raie Lα1) et C) pour le Cu (raie Kα1). ... 82 Figure 40 : Photos de matériaux poreux synthétisés par la compagnie Chand
Eisenmann, dont les substrats de titane poreux sont issus. ... 83 Figure 41 : Images MEB d’un substrat de Ti poreux avec une taille de pores
Figure 42 : Images MEB d’un dépôt de Cu61Pd39 sur un substrat de Ti poreux avec E = -0.5 V, t = 5 min, sous agitation à 500 rpm, et aux grossissements a) x100, b) x1000 et c) x10000. ... 84 Figure 43 : Images MEB d’un dépôt sur substrat de Ti poreux avec E = -0.5 V, t = 30
min, sous agitation à 500 rpm, et aux grossissements a) x100, b) x1000 et c) x10000. ... 84 Figure 44 : Photos du test de la goutte d’eau sur des films de Cu60Pd40 déposé sur
substrat de Ti poreux, dans les conditions E = -0.5 V en mode potentiostatique, sous agitation à 500 rpm, avec a) t = 5 min et b) t = 30 min. ... 85 Figure 45 : Schéma du principe du test de perméabilité en milieu gazeux. ... 85 Figure 46 : Images MEB pour des films électrodéposés de Cu60Pd40 avec des vitesses
d’agitation mécanique de A) 0 rpm, B) 500 rpm et C) 1000 rpm. Les clichés de la série 1 (à gauche) sont pris à un grossissement x1000 et ceux de la série 2 (à droite) x 10000. ... 87 Figure 47 : Images MEB de la surface de dépôts de Cu60Pd40 présentant des facteurs
de rugosité A) Rf = 8, B) Rf = 15 et C) Rf = 90. Les images sont observées à un grossissement x1000 pour la série 1 (à gauche) et x10000 pour la série 2 (à droite). ... 89 Figure 48 : Images MEB de dépôts successifs de Cu59Pd41 sur substrat de Ti percé,
avec Eon = -0.5 V, Eoff = -0.1 V, ton = 5 ms et toff = 5 ms. La déposition sur a) substrat percé, dure (ton cumulé) : b) 2 h, c) 4 h, d) 6 h et e) 8 h. Les images sont observées à un grossissement x50. ... 90 Figure 49 : Epaisseur du dépôt et le temps de déposition (ton cumulé). ... 91 Figure 50 : Epaisseur nécessaire pour couvrir les trous en fonction du diamètre des
trous, a) pour le procédé d’électroless et b) pour les films électrodéposés. ... 91 Figure 51 : Images MEB des dépôts de Cu-Pd sur des substrats de a) aluminium, b)
céramique conductive, c) graphite, d) alliage de nickel, e) acier inoxydable et f) titane, au grossissement x10000. ... 94 Figure 52 : Patrons de diffraction des dépôts de Cu-Pd sur les substrats A) d’acier,
B) d'aluminium, C) de céramique, D) de graphite et E) d'alliage de nickel, après déposition (en bas), et après traitement thermique à 400°C (en haut). .... 96
Liste des tableaux
Tableau 1 : Composition des films en fonction de la vitesse d'agitation en déposition
pulsée. ... 65!
Tableau 2 : Composition des films (EDS) en fonction des paramètres de déposition pulsée. ... 66!
Tableau 3 : Effet de la vitesse d'agitation sur le Rf ... 86!
Tableau 4 : Effet des paramètres des pulses et du potentiel sur la rugosité des films. ... 88!
Tableau 5 : Composition des films déposés sur différents substrats. ... 94!
Tableau 6 : Paramètres de réseau des phases des dépôts de Cu-Pd pour chaque substrat avant et après traitement thermique et composition des films. ... 97!
1. Introduction
1.1. Contexte de l’étude et problématique
1.1.1. Les besoins en hydrogène
L’hydrogène joue un rôle grandissant dans des domaines tels que l’industrie chimique, le raffinage du pétrole et les technologies qui reposent sur les principes des énergies propres. Les besoins en énergies nouvelles s’expriment déjà, d’une part au travers des prévisions d’épuisement des ressources actuelles, d’autre part sous les considérations des facteurs environnementaux tels que la pollution. Le concept d’énergie propre est donc largement prisé et fortement encouragé par la recherche afin de trouver la ou les énergie(s) de remplacement à moyen et long terme. L’espoir de la découverte d’une énergie révolutionnaire unique s’amenuise, tandis que les regards se tournent vers le développement de plusieurs énergies d’origines variées : solaire, carburants et bio-gaz, éolien, hydraulique, etc. Dans ce contexte, l’hydrogène trouve également sa place, candidat comme vecteur d’énergie à faible émission de produits carbonés, dont les applications sont variées.
À l’heure actuelle, environ la moitié de l’hydrogène est utilisé pour la production de l’ammoniac, tandis que l’autre moitié se répartit dans des secteurs suivants :
• la pétrochimie pour désulfurer le pétrole et synthétiser des carburants plus propres ;
• la synthèse de fibres (nylon) et autres plastiques (mousse de polyuréthane) ; • comme agent réducteur dans la métallurgie de l’acier (lors des traitements
thermiques) ;
• les applications chimiques, notamment la synthèse de méthanol ;
• l’industrie du verre et plus particulièrement dans le procédé ‘FLOAT’ de fabrication du verre plat (atmosphère réductrice) ;
• l’électronique, comme gaz réducteur (lors de l’utilisation du cuivre par exemple) ;
• en aéronautique, sous forme liquide comme ergol pour la propulsion des étages cryogéniques des fusées Ariane ;
• enfin, comme vecteur d’énergie (sans émission d’oxydes de carbone) dans les piles à combustibles [1,2].
Cette dernière application fait l’objet, depuis les dernières décennies, de nombreuses recherches visant à en optimiser la capacité de stockage, l’autonomie, la durée de vie, etc. Elle nécessite également des taux de pureté élevés (généralement supérieurs à 99.9%), ce qui conditionne le mode de production ou la qualité de l’étape de purification. Les marchés visés pour plusieurs de ces applications sont colossaux, et la demande en hydrogène va en grandissant. Faut-il encore que les moyens de production soient adaptés aux exigences quantitatives et qualitatives.
En 2004, la production mondiale d’hydrogène était estimée aux alentours de 50 millions de tonnes, et de 57 millions de tonnes en 2008. Environ 50% de cette quantité sert à la production d'ammoniac, près de 37% au raffinage du pétrole et à la désulfuration, et 12% à la fabrication du méthanol [3,4,5].
1.1.2. Production de l’hydrogène
L’hydrogène peut être produit par diverses méthodes, dont une grande majorité (81%) sont issues des hydrocarbures (charbon, pétrole, gaz naturel), tel que présenté à la Figure 1. Les autres (nucléaire, électrique, bio-gaz, phyto-synthèse, etc) ne représentent que 19% des moyens de production [6].
L’hydrogène est un vecteur énergétique, ce qui signifie qu’on ne le trouve pas directement dans la nature sous sa forme H2. C’est un gaz qui se doit d’être fabriqué, ce qui s'avère être un défi en soi. Il faut donc le synthétiser par des procédés chimiques. Plusieurs filières existent et les deux grands principes sont l’électrolyse de l’eau et le reformage du méthane.
1.1.2.1. L’électrolyse de l’eau
Le procédé d'électrolyse de l'eau repose sur un principe simple : utiliser l'électricité pour dissocier les molécules d’H2O en gaz H2 et O2 selon la réaction :
H2O → H2 + ½ O2 (ΔH = 285 kJ/mol) (équation 1.1)
L'avantage de cette technique réside dans la haute pureté de l'hydrogène obtenu. En revanche, le coût énergétique de la réaction est tel que le procédé n'est utilisé que pour la production d'environ 4% de l'hydrogène mondial [7]. Aussi, ce mode de production soulève des questions sur l'origine de l'énergie électrique utilisée. Le terme ‘d'énergie propre’ dépend en effet de cela. L’origine de l’électricité utilisée dépend du marché et de chaque pays (au Québec par exemple, l’hydroélectricité est favorisée par rapport à la France où le nucléaire semblera plus propice). La notion de rendement (‘du puits à la roue’) est également importante. La synthèse d’hydrogène, de même que sa purification, son transport et son stockage, nécessitent plusieurs étapes, ce qui se traduit par des coûts énergétiques généralement plus élevés que l'énergie produite par l'hydrogène lors de son application.
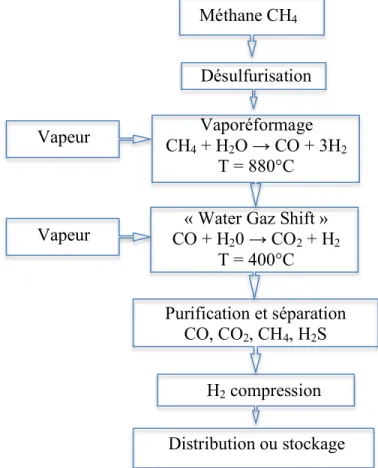
Figure 2 : Schéma synthétisant les étapes du procédé de vaporéformage du méthane pour la production d’hydrogène.
Méthane CH4 Désulfurisation Vaporéformage CH4 + H2O → CO + 3H2 T = 880°C Vapeur Vapeur
« Water Gaz Shift » CO + H20 → CO2 + H2 T = 400°C Purification et séparation CO, CO2, CH4, H2S H2 compression Distribution ou stockage 1.1.2.2. Le reformage du méthane
Parmi les procédés de production de H2 à partir de sources d’énergies carbonées, l'oxydation partielle, le reformage auto-thermique du gaz naturel et le vaporéformage sont prédominants. Ce dernier est expliqué plus en détails étant donné son utilisation industrielle importante. La Figure 2 schématise les étapes du procédé de vaporéformage.
On distingue deux étapes dans ce procédé de synthèse. D'abord, le méthane réagit avec la vapeur d'eau à haute température (800-900°C). Par la suite, les produits de la réaction (CO et H2) sont refroidis (350-450°C) et l'ajout de vapeur d'eau entraîne une réaction qui constitue la deuxième phase du procédé, appelée ‘Water Gaz Shift’ (WGS). Celle-ci permet de pousser la réaction vers la formation du H2 [8].
En sortie du réacteur, les gaz sont dans la proportion suivante : H2 (40 mol%) est mélangé à du CO2 (55 % mol.), du CO (3 % mol.) et du H2S (1-3 % mol. provenant du soufre présent dans la source initiale d’hydrocarbures). A ce stade du procédé, une étape de purification est nécessaire. Elle permet de séparer l'hydrogène de tous les autres gaz et impuretés résiduels tels que CO, CO2, CH4, H2O, H2S, O2, NOx, etc. Certaines applications telles que les piles à combustible à électrolyte polymère nécessitent des taux de CO2 ou H2S inférieurs à 1ppm [9].
1.1.3. La purification de l’hydrogène
Dans le cas de l’électrolyse de l’eau, H2 est suffisamment pur pour pouvoir être employé directement. C’est pourquoi cette étape ne concerne que l’hydrogène synthétisé par la filière carbone.
1.1.3.1. Les méthodes usuelles
Le principe utilisé est généralement celui d’un filtre moléculaire ou atomique. L’élément H étant le plus petit, il peut passer au travers du filtre et se séparer ainsi des autres gaz.
L'hydrogène a la capacité de se déplacer sous diverses formes au travers de certains matériaux. Dans tous les cas, il se produit un mouvement de matière qui entraîne l'obtention d'hydrogène purifié et séparé des impuretés initialement présentes. On distingue trois cas de transport de matière au travers du filtre : sous forme moléculaire, atomique ou ionique.
• Moléculaire : des membranes microporeuses sont employées, telles que des zéolithes, SiC, alumine. La taille des pores est suffisamment grande pour laisser passer les molécules du gaz à purifier et bloquer les autres molécules ;
• Atomique : les matériaux métalliques utilisés dans ce type de filtre sont à base de palladium, responsable de leur perméabilité à l'hydrogène. Ils sont soit sous forme de cermet (matériaux composites constitués d’une phase métallique et d’une autre céramique), soit d'alliage métallique. Le principe de la diffusion de l'hydrogène repose sur le déplacement des atomes d'hydrogène sous forme atomique d'un site interstitiel à l'autre de la maille de palladium (ou de ses alliages). Il sera détaillé plus loin ;
• Ionique : les membranes ont dans ce cas des propriétés conductrices et permettent le transport d'hydrogène sous forme ionique par l’utilisation d’un courant. Elles sont constituées d’un mélange de plusieurs céramiques ou des cermets.
Plusieurs méthodes existent en industrie pour séparer des composants d’un mélange gazeux. Notamment, la distillation cryogénique (qui repose sur la différence de température d’ébullition des composés), et la séparation via une membrane polymère (qui utilise la différence de perméabilité des gaz à séparer) sont deux méthodes qui permettent d'obtenir de l'hydrogène pur à 95% et 98%, respectivement. Ce taux est insuffisant pour plusieurs des applications visées, c'est pourquoi on leur préfère d'autres procédés : l'adsorption sur tamis moléculaires (‘Pressure Swing Adsorption, PSA’) ou la séparation par membrane métallique. Le PSA est le plus utilisé à l'heure actuelle en industrie pour purifier l'hydrogène en sortie de réacteur WGS. Le principe de cette méthode repose sur la séparation d’un mélange de gaz à haute pression en utilisant la différence d’affinité de chacune des espèces pour un certain matériau adsorbant, appelé tamis moléculaire. Chaque lit des tamis passe par des étapes d'adsorption, de dépressurisation, de purge à faible pression et de pressurisation afin d'assurer la continuité du flux de H2 dans l'unité PSA [10].Les taux de pureté atteints par la technique PSA sont supérieurs à 99.9%.
La technique PSA présente cependant plusieurs inconvénients qui diminuent le rendement du procédé ainsi que sa facilité d'utilisation et d'entretien. Premièrement, le fait que le fonctionnement des tamis moléculaire, placés en sortie du réacteur WGS, doive se faire à 40°C. Cela entraîne une baisse brutale de température de 400°C à 40°C traduite pas des coûts énergétiques importants. Deuxièmement, le PSA est équipé d'un système complexe de valves dont le rôle est de gérer les étapes de purges, de changement de pression et d'assurer le fonctionnement continu de la filtration. De grandes variations de température alourdissent et fragilisent les montages et réduisent de fait le rendement et l'efficacité du procédé. Des efforts importants portent actuellement sur le fait de parvenir à purifier l'hydrogène à haute température et de remplacer l'unité PSA par un procédé de purification basé sur la filtration par membranes sélectives. Les taux de pureté de H2 sont dans ce cas supérieurs à 99.5% et ce procédé fonctionne à haute température, ce qui allège les montages [6,11].
1.1.3.2. Principe des membranes sélectives
Le principe est présenté sur le schéma de la Figure 3. L’hydrogène moléculaire est adsorbé à la surface du filtre métallique. Il se dissocie en hydrogène atomique pour ensuite diffuser dans la membrane sous l'effet du gradient de concentration et de la différence de pression appliquée. Il se recombine de l'autre coté pour reformer H2. La membrane étant imperméable aux autres espèces, elle permet de séparer et purifier l'hydrogène gazeux.
Théoriquement, une membrane exempte de trous permettrait d'atteindre une sélectivité infinie, ce qui n’est bien sûr pas le cas en pratique. Le procédé est cependant fiable, facile à opérer et les montages restent simples en comparaison à la technologie PSA. De plus, il peut s'intégrer à divers types de réacteurs chimiques. Optimisé, il permettrait une nette amélioration des coûts liés à l'étape de purification de H2 en sortie des réacteurs.
Le flux de H2 au travers de la membrane (J) est une des valeurs qui doit être maximalisée. Dans le cas des membranes sélectives métalliques, l’équation qui régit le flux de l’hydrogène dans la membrane s’écrit :
J ∞ P * (PH2, amontn- PH2, avaln) / l (équation 1.2)
Les paramètres tels que la différence de pressions partielles en amont et en aval de la membrane (PH2, amontn- PH2, avaln), la perméabilité (P) du matériau vis-à-vis de H2 et l’épaisseur de la membrane (l) agissent sur le flux ; n est une valeur telle que 0.5 ≤ n ≤ 1.0 et dépend des conditions opératoires et des caractéristiques de la membrane [13]. De surcroît, la perméabilité est reliée à la solubilité (S) et à la diffusivité (D) par la relation :
P = D * S (équation 1.3)
Egalement, la perméabilité peut se traduire par :
P = P0 * exp(-Ea / RT) (équation 1.4)
où P0 est la constante de perméabilité, Ea l’énergie d’activation pour le transport de H et T
la température. Ainsi, il est possible d’élever de flux de H2 au travers de la membrane en augmentant P, (PH2, amontn- PH2, avaln) ou T et en diminuant l. L’augmentation de certains de ces paramètres ((PH2, amontn - PH2, avaln) ou T) est cependant plus coûteuse que la diminution de l’épaisseur de la membrane. Typiquement, une température de 300-600°C (selon les matériaux constituants la membrane) est adéquate pour la purification, et
augmenter T rendrait le procédé encore plus complexe pour des questions de dégradation thermique.
Le fait de diminuer l’épaisseur joue également un rôle positif sur le coût des matériaux. La réduction de l’épaisseur d’un facteur 2 engendre théoriquement une augmentation du flux du même facteur. De même, la quantité de matière nécessaire est diminuée par 2, ce qui est non négligeable étant donné que le Pd est un métal noble et coûteux. Dans le cadre de cette étude sur la fabrication des membranes, un des objectifs sera donc d’optimiser les méthodes de déposition pour diminuer l’épaisseur l tout en gardant un dépôt dense qui recouvre totalement le substrat, assurant une sélectivité maximale.
1.1.3.3. Le choix des matériaux pour les membranes
L’application de la différence de pression ainsi que la température d’opération engendrent des contraintes thermo-mécaniques importantes sur les matériaux en présence. La littérature est vaste sur le sujet des matériaux possibles [14] et ces considérations portent à choisir la solution suivante : déposer un matériau perméable à l’hydrogène directement sur un substrat poreux métallique. D’abord, cela permet de dissocier les fonctions ‘tenue mécanique’ et ‘perméabilité à l’hydrogène’ de la membrane. Ensuite, le fait d’utiliser un substrat poreux métallique plutôt que céramique diminue l’écart des coefficients d’expansion thermique du substrat et de la membrane, ce qui réduit le risque de décollement du film après déposition. Enfin, les matériaux métalliques offrent une tenue mécanique généralement satisfaisante pour supporter la différence de pression appliquée.
Aussi, les matériaux choisis doivent-ils accepter les fortes variations de température. En effet, ce projet visant principalement une amélioration de l'étape de purification et séparation en sortie des vaporéformeurs, il faut des filtres capables de résister à des contraintes de cyclage thermique. Ces variations entre hautes et basses températures sont très contraignantes, et les membranes métalliques peuvent certainement
remplir ces exigences. Plusieurs matériaux métalliques sont candidats quant à la perméabilité de l'hydrogène :
• certains métaux purs tels que le Pd, V, Ta, Ti. L'inconvénient majeur est la fragilisation par l'hydrogène (Pd) et la formation de couches inertes (V, Ta, Ti). S'ensuivent des limitations au niveau de la durée de vie (cyclabilité et tenue à long terme) ;
• des alliages amorphes (typiquement du groupe IV et V). En revanche, la thermodynamique favorise la recristallisation. La tenue mécanique et la perméabilité en sont affectées ;
• des métaux comme le Ta et le V recouverts de Pd. La composition et la structure de la membrane peuvent être modifiées par des problèmes de diffusion (amplifiés aux hautes températures), ce qui perturbe la perméabilité du matériau; • des alliages binaires de Pd avec Cu, Ag, Y, Ni, Rh, Ru, In, Au, Ce et Fe. Certains
de ces alliages ont montré des comportements intéressants, notamment en termes de sélectivité, de cyclabilité, ou encore de résistance à l'empoisonnement en présence de H2S. Les gammes de compositions sont cependant restreintes, et peu d'information existe sur les mécanismes responsables de ces propriétés. Enfin, certains alliages ternaires ont été étudiés, même si la gamme de composition est encore plus limitée [15].
L'utilisation du palladium sous forme alliée plutôt que pur réduit notablement la masse requise. De surcroît, les systèmes tels que le Cu-Pd possèdent une structure ouverte (cubique à corps centré, BCC) à haute température, plus favorable à la diffusion de l'hydrogène que les structures compactes (cubique à faces centrées, FCC). En effet, la compacité des structures BCC est de 0.68, tandis qu'elle est de 0.74 pour les FCC. Finalement, l'ajout d'un second élément peut permettre de diminuer la température critique au-delà de laquelle la transition α → β disparaît (la présence de cette transition cause la mauvaise tenue mécanique du Pd en cyclage).
A l'heure actuelle, les performances des membranes à base de Pd restent derrière les standards de l'industrie en termes de flux d'hydrogène. Il y a fort à parier que cela soit dû à un manque d'optimisation des procédés de déposition, notamment par voie chimique. Les dépôts sont en effet relativement épais et leur morphologie (rugosité) peu contrôlée. Le flux d'hydrogène pourrait être augmenté, et le coût diminué en optimisant les méthodes de déposition des membranes métalliques. C'est notamment ce qui est visé dans le cadre de ce projet.
Toujours est-il que le recours à des alliages de type Pd-M multiplie les possibilités et qu'il peut être difficile de justifier le choix de (M) et la proportion (x dans Pdx-M1-x) des éléments à allier au Pd. Cette complexité s'accroît naturellement dans le cas où l'on s'intéresse à des alliages ternaires de Pd, qui pourraient apporter des pistes intéressantes quant aux problèmes de cyclabilité de ces matériaux. Dans le cas de cette étude, le matériau M choisi est le cuivre. Plusieurs études existent sur le sujet mais restent incomplètes lorsqu’il s’agit du contrôle et de l’optimisation des paramètres du procédé d’électrodéposition [15].
1.1.3.4. Procédé d’électrodéposition
Depuis les dernières années, nombre de groupes de recherche se sont intéressés à la déposition par voie chimique (‘electroless deposition’) pour la synthèse de membranes perméables à l'hydrogène [16-18]. Cette technique permet de déposer un métal sans avoir recours à une source de courant externe, ce qui lui confère un avantage notable. Un agent de réduction s'oxyde et réduit un cation métallique tel que Pd2+ pour former un dépôt métallique (Pd) sur un substrat choisi. Des dépôts de composition mixte peuvent être obtenus en changeant la nature du cation métallique (Cu2+, Ag+, etc.) [19]et en effectuant des dépositions successives [20-25]. L'avantage majeur de cette méthode provient de sa simplicité et de sa facilité de mise en œuvre. Cependant, le faible nombre de paramètres limite les moyens d'action sur le contrôle de la morphologie des films déposés. Egalement, la formation d'alliages requière un traitement thermique assurant
l'interdiffusion des éléments métalliques [26]. Ceux-ci sont responsables de la piètre qualité du dépôt après recuit. Généralement, un dépôt de plus grande épaisseur permet de contourner ces limitations, ce qui réduit considérablement les performances des membranes en termes de flux et augmente les coûts (en matériaux notamment) [27].
Le procédé proposé dans le cadre de cette étude pour la déposition des films métalliques est l'électrodéposition. Il offre un certain contrôle sur la morphologie et les phénomènes de croissance des métaux [28]. De plus, les cations à déposer peuvent former directement un alliage en une seule étape, dans un unique bain électrolytique contenant toutes les espèces métalliques dissoutes [29-31]. La co-électrodéposition [32-37] est une technique idéale pour la synthèse de films denses. En agissant sur les paramètres de déposition (potentiel ou densité de courant, temps de déposition, temps d'attente entre les pulses de déposition, concentration de la solution en sels, etc.), la croissance d'une couche dense et adhérente au substrat sera favorisée. La composition des films sera modulée principalement par la composition des sels dissous en solution aqueuse [38]. Certaines études présentent la possibilité d'utiliser des additifs tels que des polariseurs, agissant sur le transfert de masse ou le transfert de charges [39-40]. Il sera possible d'y avoir également recours dans le cas où l'action sur les paramètres de déposition se révèle insuffisante quant à la densité des dépôts. Dans certains cas, un film mince (typiquement de l'ordre de 100 nm) peut être préalablement déposé à haute densité de courant et à faible concentration en cations métalliques en vue d'améliorer l'adhérence du dépôt sur le substrat. Cette couche pourra également prévenir la diffusion atomique entre le substrat et l'alliage, ainsi que les éventuels changements de composition, de tenue mécanique et de structure [41-43].
Le procédé d’électrodéposition est sensible à la densité de courant appliquée. Celle-ci peut influencer le taux de déposition, l’adhésion de la membrane au substrat et sa qualité finale [44]. La densité de courant varie localement en surface du substrat ; les surfaces extérieures ont tendance à avoir une plus grande densité de courant que les surfaces intérieures, puisqu’elles sont exposées aux fortes lignes de champs. De ce fait, la vitesse de déposition perpendiculairement au substrat est plus grande que parallèlement
au substrat. Ce phénomène est également rencontré dans la déposition par voie chimique. Aussi, les imperfections (trous, craques, marches, etc.) du substrat reçoivent des lignes de champ d’intensité irrégulière, ce qui favorise l’hétérogénéité du dépôt.
Lors de l’utilisation de substrats poreux, comme c’est le cas pour ce projet, des techniques d’impulsion de courant (ou de potentiel) seront appliquées, pendant lesquelles les cycles de déposition alternent avec les cycles de repos. Le but en est de réduire l’épaisseur de la couche de diffusion, favoriser les phénomènes de nucléation par rapport à la croissance des cristallites, de minimiser l’écart entre les taux de dépôt parallèles et perpendiculaires par rapport au substrat, et enfin d’augmenter la densité et la qualité finale des films [45-48].
1.2. Plan du projet
Ce mémoire de maîtrise s’organise de la manière suivante. A la suite de cette introduction, le chapitre 2 intitulé ‘Points théoriques’ développera les notions d’électrochimie permettant une bonne compréhension de l’exploitation des résultats. Il abordera également les méthodes de calculs qui ont permis d’extraire les résultats de l’étude ainsi que les raisons des choix des matériaux et des traitements appliqués. Le troisième chapitre précisera quel matériel a été utilisé pour les expériences et détaillera les méthodes de caractérisation physico-chimiques et électrochimiques des films synthétisés afin d’obtenir les informations les plus complètes possibles sur les propriétés de ces matériaux. La diffraction des rayons X (DRX) sera utilisée pour identifier la structure des matériaux, les phases en présence ou encore la taille des cristallites. La microscopie électronique à balayage (MEB) couplée à la spectrométrie à dispersion d'énergie (EDX) permettra de connaître, respectivement, la morphologie et la composition chimique des membranes. Ces différentes caractérisations seront effectuées à chaque étape de la fabrication des films et si nécessaire, après l’étape de traitement thermique. Toutes ces mesures et caractérisations seront réalisées au laboratoire de l’INRS-EMT. Les deux derniers chapitres exposeront et expliqueront les résultats obtenus tout au long du projet.
Le chapitre 4 se concentrera sur le contrôle de la composition des membranes en fonction des paramètres de déposition et des caractéristiques de l’électrolyte, tandis que le chapitre 5 présentera les résultats liés aux changements structuraux de la phase A1 à B2. Cette dernière partie détaillera les effets des paramètres de la déposition (agitation, mode de déposition pulsé, etc.) sur la morphologie. Elle présentera finalement les résultats de déposition de films de Cu-Pd sur des substrats de natures différentes. Ce mémoire se terminera par une conclusion répondant à la problématique initiale.
2. Points théoriques
2.1. Electrodéposition
2.1.1. Généralités
L’électrodéposition est une technique de synthèse de films minces appartenant à la discipline de l’électrochimie. Elle permet, par l’application d’un courant électrique (utilisé comme force motrice) circulant dans un liquide conducteur (électrolyte), d’assurer une réaction chimique. Celle-ci dépend directement de la nature des sels métalliques dissous dans le bain électrolytique. Le métal à déposer est alors présent sous forme ionique et se réduit pour former un dépôt métallique solide à la cathode. Les électrons assurant la réaction de réduction proviennent de la cathode. Au cours de la déposition, il faut veiller à ce que la source des ions métalliques à réduire soit en quantité suffisante dans l’électrolyte. Le phénomène est régi par l’équation suivante :
Mn+ + n *e- à M, où M est le métal considéré (équation 2.1)
Pour que la réaction de réduction ait lieu, il est nécessaire que le potentiel soit plus négatif que le potentiel réversible de la réaction considérée. Le procédé d’électrodéposition peut se décomposer en plusieurs étapes, qui sont illustrées à la Figure 4.
En premier lieu, un ion métallique se réduit. Il se dépose ensuite sous forme atomique à la surface du substrat, dans une étape de nucléation. L’emplacement de cet atome n’est pas complètement aléatoire. Certains sites du substrat, tels que les défauts (ponctuels, joints de grains, dislocations, pores, macles, etc.), présentent des énergies de nucléation plus faibles, ce qui favorise la déposition. L’atome déposé crée lui-même un site énergétique propice à la déposition d’autres ad-atomes, liés entre eux par des liaisons covalentes. Les amas d’atomes vont alors croître parallèlement et perpendiculairement à la surface. Cette étape représente la germination et la croissance des atomes déjà déposés. La surface du substrat sera ultimement recouverte par des couches superposées d’atomes, formant ainsi le dépôt métallique souhaité. La qualité initiale de la surface du substrat est généralement déterminante pour les caractéristiques morphologiques, mécaniques et structurales du film.
55
Figure III.7 : Principales étapes de l’électrodéposition.
Figure 4 : Schéma des principales étapes du procédé d’électrodéposition (extrait de la référence [56]).
2.1.1.1. Avantages du procédé d’électrodéposition
L’électrodéposition est généralement utilisée pour recouvrir un objet d’une couche métallique mince. Ses avantages majeurs sont sa facilité d’emploi, la possibilité d’ajuster les paramètres de déposition (potentiel, temps de déposition, température agitation, mode de déposition, etc.) et de créer des revêtements sur des pièces de géométries complexes. Cependant, le nombre élevé de paramètres variables peut rendre cette méthode de déposition difficile à optimiser. C’est pourquoi une étude systématique mettant en relief l’influence de chaque paramètre peut être menée, selon la propriété du film qu’il convient d’optimiser (rugosité, composition, etc.).
La technique de déposition auto-catalytique ou chimique (‘electroless deposition’) est également utilisée pour former un revêtement métallique sur une électrode. Cependant, elle ne requière pas de courant électrique et son principe de déposition se base sur les réactions chimiques induites par la présence d’un agent de réduction en solution aqueuse. Un des grands avantages est le fait de pouvoir l’utiliser sur des substrats non conducteurs électriques. Cependant, en comparaison avec l’électrodéposition, les taux de déposition sont bien inférieurs et le nombre de paramètres ajustables très réduit, ce qui limite les possibilités d’optimisation du procédé et des propriétés des films synthétisés.
2.1.1.2. Paramètres influençant les dépôts
La fonctionnalité et la qualité d’un film électrodéposé dépendent des caractéristiques du dépôt (structure, morphologie et rugosité de surface, composition, etc.). Ces caractéristiques sont contrôlées par les paramètres de déposition.
2.1.1.2.1. Potentiel et courant
L’électrodéposition peut s’effectuer soit en fixant le potentiel (potentiostatique), soit en fixant le courant (galvanostatique), soit en appliquant des impulsions de potentiel
ou de courant (pulsé). Cette dernière méthode, généralement employée afin d’améliorer la morphologie des dépôts, méritera une attention particulière et sera détaillée plus loin.
La Figure 5 schématise la réponse électrochimique typique d’une électrode soumise à l’application d’un balayage de potentiel vers les potentiels négatifs. On observe un pic de courant relié au phénomène de diffusion des espèces oxydées vers la surface de l’électrode. Il correspond, en d’autres termes, à la réduction d’un cation métallique Mn+ et à sa déposition à la surface de l’électrode, tel que suggéré dans l’équation 2.1.
Dans un premier temps, le courant (négatif par convention pour les courants de réduction) est constant tant que le potentiel n’est pas suffisamment négatif. A partir d’un certain potentiel (qui dépend de la nature des ions Mn+), l’intensité du courant augmente, indiquant que l’électrodéposition devient thermodynamiquement et cinétiquement favorable. Le courant détermine la vitesse de la réaction de réduction et a une influence notable sur l’aspect du dépôt. Pour des potentiels faibles, le transfert de charge gouverne la déposition. La vitesse de nucléation est par conséquent lente et le nombre de centres de nucléation faible, ce qui mène à la formation de dépôts poreux et rugueux. Pour des potentiels plus négatifs, les densités de courant sont élevées et l’électrodéposition est gouvernée par la diffusion. Les sites de nucléation sont plus nombreux du fait que l’énergie apportée par le potentiel est suffisamment élevée pour activer la surface. La vitesse de croissance est également élevée, favorisant la formation de structures
Potentiel (V) Courant (A) i = 0 Sens du balayage Electrodéposition Inertie du système
dendritiques. Dans les cas où le potentiel se rapproche de celui du dégagement d’hydrogène, les bulles formées à la surface de l’électrode contribueront à la formation d’un dépôt très poreux et de surface spécifique élevée.
2.1.1.2.2. Pulses
La déposition pulsée se définit par l’application d’une impulsion de potentiel (ou de courant) de quelques millisecondes immédiatement suivie d’une relaxation du système. Ce principe est schématisé à la Figure 6.
Le cas non pulsé correspond simplement à l’application d’un potentiel fixe pendant toute la durée de la déposition. Le cas pulsé fait intervenir plusieurs paramètres de réglage, tels que les potentiels de travail (Eon) et de repos (Eoff), chacun étant assigné à un temps de travail (ton) et un temps de repos (toff). La période de travail permet une déposition rapide des particules métalliques sur l’électrode. Celle de relâchement offre la possibilité aux espèces ioniques de l’électrolyte de repeupler la surface de l’échantillon de manière homogène. A cette étape, il n'y a en principe ni oxydation, ni réduction. Dans le cas d'une co-électrodéposition, le potentiel de repos est délicat à établir. Il faut éviter que l’une des espèces ne s'oxyde pendant que l’autre espèce se dépose, ce qui conduirait à des compositions éloignées de celles attendues. Cette technique permet de déposer des films généralement plus adhérents et denses que par les procédés classiques. De plus, elle améliore la vitesse de nucléation et favorise les phénomènes de transport de masse lors de la déposition[49-55].
E
Temps
E
depNon pulsé
E
Temps
E
onE
offt
ont
offPulsé
Figure 6 : Schéma illustrant les principes de déposition non pulsée (A) et pulsée (B).
2.1.1.2.3. Concentration des sels
La concentration ionique du milieu électrolytique est directement liée aux taux de déposition, à la morphologie et au recouvrement du substrat. En effet, la cinétique des étapes de nucléation et de croissance augmente avec la concentration des ions. Pour la nucléation, cela est vrai dans le cas d’une cinétique de nucléation d’ordre 1, c’est-à-dire n’étant pas limitée par l’énergie de surface. Une vitesse de déposition trop élevée pourra néanmoins avoir un effet néfaste sur la qualité finale du dépôt. Dans ce cas, il s’agira de trouver un compromis pour maximiser les taux de déposition tout en conservant des propriétés morphologiques et une tenue mécanique acceptables.
Lors de la synthèse de membranes bimétalliques, le ratio des sels entre bien sûr en ligne de compte. Il permet d’ajuster la composition finale des films (dans notre cas en cuivre et en palladium). Le système sera cependant plus complexe à maîtriser puisque deux métaux de nature différente ne se déposent pas aux mêmes vitesses et ne suivent pas obligatoirement les mêmes évolutions cinétiques face à l’application du potentiel.
Le fait d’augmenter la concentration des sels métalliques (jusqu’à une certaine valeur) permet une amélioration du rendement faradique de la réaction de réduction. Cela présente un intérêt certain lors de dépositions à fortes surtensions où la réduction de l’eau entre en compétition avec la réduction des ions métalliques[56].
2.1.1.2.4. Importance du substrat
Le choix du substrat de déposition est important et directement lié à l’application visée. Dans certains cas, le support est imposé ; par exemple, lorsqu’il s’agit de protéger une surface ou d’en améliorer les propriétés (anodisation, chromation, etc.). D’autres matériaux sont utilisés pour des applications bien spécifiques, où le substrat peut difficilement être remplacé. C’est le cas notamment du silicium dopé, employé pour ses propriétés électroniques et électromagnétiques reconnues. Par contre, pour des utilisations électrocatalytiques, le choix du substrat est prédominant en ce qui concerne les propriétés
des films déposés dessus. Plusieurs critères peuvent aider à la prise de décision selon l’application visée. Dans le cas de la synthèse de membranes auto-supportées par exemple, soit le substrat doit être le plus lisse possible [57], soit on peut utiliser un revêtement sacrificiel copolymère entre autres [16]. D’autres utilisations exigent une forte adhérence du dépôt au substrat. C’est le cas notamment du procédé de galvanisation à chaud avec électrodéposition pulsée visant à protéger l’acier de la corrosion [58]. Dans le cas de la synthèse d’un bimétallique, le substrat lui-même peut représenter un des métaux, tandis que le second sera électrodéposé. Un alliage pourra être obtenu au travers d’une étape de recuit assurant l’interdiffusion. Le substrat peut finalement être choisi en fonction de la structure du métal à déposer. Dans certains cas, des comparaisons cristallographiques, portant notamment sur les paramètres de maille des deux métaux, peuvent mener à des dépositions dites épitaxiales comportant des hétérojonctions, où les cristaux des deux métaux ont un certain nombre de symétries en commun. Il en résulte une adhérence élevée du film sur le substrat [59].
2.1.1.2.5. Temps de déposition et épaisseur
Le procédé d’électrodéposition d’un métal sur le substrat peut se décomposer en deux étapes successives. Dans un premier temps, les ions métalliques en solution se déposent sur le substrat. Par la suite, une fois que le substrat est complètement recouvert par le métal de déposition, le métal en solution se dépose sur lui-même (auto-déposition) à une cinétique qui lui est propre. La vitesse de déposition deviendra alors constante et l’épaisseur du dépôt sera proportionnelle au temps de déposition. De cette manière, l’épaisseur des films est ajustable en fonction des besoins et des substrats poreux, par exemple, nécessiteront des dépôts plus épais pour recouvrir totalement les pores.
2.1.1.3. Electrodéposition de bimétalliques
La synthèse de bimétalliques peut reposer sur deux principes de déposition distincts : l’électrodéposition successive ou la co-électrodéposition. Dans le premier cas, les métaux qui constituent le film sont déposés en plusieurs étapes et différents électrolytes pourront être utilisés. Dans ce cas, un traitement thermique assure l’interdiffusion des métaux pour généralement former un alliage. Ce procédé n’est pas employé dans cette étude, et la seconde méthode est donc celle qui sera développée. Elle est principalement appliquée pour la déposition d’alliages ou de films polyphasés, et ne nécessite qu’une unique étape de déposition dans un seul électrolyte contenant tous les ions métalliques d’intérêt.
Le principe de base de la co-électrodéposition est simple si l’on ne porte pas attention à la morphologie ou la tenue mécanique du film. Il suffit en effet de réaliser une électrolyse à forte densité de courant pour déposer les deux métaux à la cathode. Dans ce cas, la porosité, la composition et l’adhérence risquent d’être de piètre qualité, et le procédé n’offre aucune garantie d’obtenir un alliage. En revanche, plusieurs paramètres tels que le potentiel, l’agitation, la composition du bain, etc. sont accessibles pour moduler la déposition et influencer directement la composition, la porosité, la tenue mécanique et la qualité générale du film. Déterminer les conditions optimales de déposition s’avère bien entendu plus compliqué pour un alliage métallique que pour un seul métal. Des approches systématiques sont donc le plus souvent de rigueur.
2.1.1.3.1. Influence du potentiel
Le principe de co-électrodéposition repose sur la déposition simultanée de deux cations métalliques contenus dans l’électrolyte (An+ et Bn+) par l’application d’un potentiel (ou courant). Pour ce faire, le potentiel du substrat doit être inférieur aux potentiels de réduction des deux métaux A et B (Figure 7).
Pour que la co-électrodéposition soit le plus facile à réaliser et à contrôler, il est important que les potentiels standards de réduction des deux métaux soient les plus proches possibles. Dans le cas contraire, les vitesses de déposition risqueraient d’être très éloignées, ce qui favoriserait la déposition préférentielle de l’un des métaux. Cependant, des solutions existent pour réduire cet effet, notamment en modifiant le ratio des sels métalliques et leur concentration. Ce paramètre influence également la stœchiométrie des dépôts, et apparemment de manière plus importante lorsque la déposition est de type potentiostatique (ou galvanostatique) plutôt que pulsée.
2.1.1.3.2. Température et agitation
L’agitation et la température sont des paramètres tous deux liés au renouvellement de la double couche en ions métalliques. L’arrivée des espèces ioniques à la surface de l’électrode repose sur trois types de transfert de matière :
• la migration : c’est le déplacement de particules chargées sous l’effet d’un champ électrique ;
• la diffusion : c’est la mise en mouvement d’espèces sous l’influence d’un gradient de concentration ; Potentiel (V) Courant (A) i = 0 Sens du balayage EB EA A + B
Figure 7 : Courbes de polarisation cathodique lors de la déposition de métaux A et B (inspiré de la référence [56], p.60).
• la convection : c’est le transport d’espèces sous l’agitation (hydrodynamique) de la solution électrolytique.
L’effet que la température et l’agitation du bain ont sur la déposition et la composition des dépôts résulte de plusieurs phénomènes :
• l’augmentation de la température augmente le potentiel standard de déposition des cations (anoblissement). À potentiel donné, les taux de déposition des deux métaux seront donc plus élevés ;
• L’accroissement de la température augmente également la concentration des ions métalliques dans la couche de diffusion du fait des taux de diffusion et de convection supérieurs (notamment dus à l’élévation de l’agitation moléculaire) ; • L’action de l’agitation de l’électrolyte a pour effet de réduire l’épaisseur de la
couche de diffusion. De plus, l’influence de l’agitation est prédominante par rapport à la température ou la densité de courant. L’agitation repose sur le renouvellement des espèces ioniques en surface de la cathode, c’est-à-dire dans la double couche. De fait, les vitesses de déposition des métaux augmentent et la composition finale du dépôt se rapproche du ratio de concentration ionique du bain [60].
Le fait d'agiter l'électrolyte assure un renouvellement des espèces ioniques à l'interface de la cathode. La Figure 8 illustre ce principe en montrant la concentration ionique à l'interface en fonction de la distance de la surface de la cathode. Au cours de la déposition et en l'absence d'agitation mécanique, le profil de concentration ionique à l'interface possède l'allure du schéma de droite (8B). L'appauvrissement en Cu2+ et Pd2+ provient du fait qu'ils se sont déposés sur l'électrode. En présence d'agitation (8A), le profil de concentration proche de la surface de l’électrode se rapprochera de celui présent dans le cœur de l’électrolyte.
L'agitation peut également avoir une influence sur la morphologie des films. Le coefficient de rugosité (Rf), calculé de la façon décrite dans le chapitre 2, permettra de quantifier l’importance de l’agitation sur la surface des dépôts.
2.1.1.3.3. Composition du bain, ions complexes et pH
Parmi tous les paramètres qui entrent en compte dans la composition des dépôts, le ratio de concentration des sels (An+) / (Bn+) dans l’électrolyte est le plus influent. C’est donc sur ce ratio que l’on se base généralement pour s’approcher de la composition recherchée des films. Cependant, celle-ci diffère bien souvent du ratio exact des sels incorporés, du fait que l’un des deux métaux se dépose préférentiellement par rapport à l’autre. La méthode généralement employée consiste à faire varier le ratio tout en gardant une concentration totale en cations métalliques ((An+) + (Bn+)) constante. De cette manière, un balayage des compositions est possible et rend l’ajustement des concentrations plus facile.
Le pH est une variable qui a montré avoir une influence sur les films électrodéposés. Il est en revanche difficile de connaître l’importance de son action sur les propriétés finales des dépôts. Certaines études ont montré que le pH pouvait influencer la structure cristalline du dépôt d’alliages de Pd-Co [61]. Egalement, il a une action directe Figure 8 : Schéma montrant la concentration des espèces ioniques en fonction de la distance à la surface de la cathode selon que la solution est agitée (A) ou non agitée (B).
Concentration
Distance de la surface Distance de la surface Concentration [Cu2+], [Pd2+] en solution Sans agitation
A
B
Agitéesur la cinétique de la réaction de dégagement de l’hydrogène, elle même reliée à la tenue mécanique et à la porosité des dépôts. D’autres travaux ont mis en relief, d’une part, le lien entre la variation du pH et son influence directe sur le potentiel de réduction du Cu [62], et, d’autre part, son rôle dans la stabilité des complexes en solution [60].
2.2. Propriétés des matériaux déposés
2.2.1. Le Pd et l’hydrogène
Plusieurs métaux sont reconnus pour posséder de bonnes propriétés d’absorption vis-à-vis de l’hydrogène. C’est notamment le cas du palladium. Avant d’être absorbées dans le volume du matériau, les molécules d’hydrogène doivent d’abord passer par la surface du métal. Aussi, parmi les phénomènes de surface et de volume, l’un est toujours cinétiquement limitant par rapport à l’autre (généralement ceux de surface). Cela dépend de la qualité électrocatalytique de la surface (liée à la rugosité) et des propriétés de diffusion de l’hydrogène dans le volume.
2.2.2. La fragilisation des métaux à l’hydrogène
La présence d’hydrogène dans la structure d’un matériau métallique peut entraîner des détériorations importantes du métal et de ses propriétés mécaniques. Ce phénomène est particulièrement présent pour certains métaux, et notamment les aciers (lors de ruptures dites différées) et dans le cas de cette étude, le palladium. Une fois l’hydrogène localisé dans le réseau métallique, il peut provoquer plusieurs types de dégâts tels que :
• une précipitation sous forme d’hydrures, ce qui est valable pour le Ti et d’autres métaux réactifs à l’hydrogène (Zr, V, Ta, etc.) ;
• une recombinaison où l’hydrogène se retrouve sous forme moléculaire du fait de la présence de défauts macro- ou microscopiques. Cela induit des pressions internes colossales, responsables de déformations visibles du métal et qui prennent la forme d’éclatements ou de boursouflures ;
• une fragilisation mécanique du métal à cause des atomes d’hydrogène qui interagissent avec les dislocations de la maille cristalline. Il peut s’ensuivre une diminution de la capacité de déformation plastique du métal.
La prévention de ce phénomène est délicate et il n’existe pas de solution unique. Il s’agit généralement d’adapter les conditions d’opération afin de minimiser l’exposition du métal à l’hydrogène. Sinon, certaines études ont montré la possibilité de réduire ces effets en utilisant des alliages plutôt que des métaux purs. C’est le cas en particulier de l’ajout du cuivre au palladium [63].
2.2.3. Les alliages de Cu-Pd
2.2.3.1. Diagramme de phases
Les alliages de palladium-cuivre peuvent revêtir différentes structures selon leur composition et la température. La connaissance de ces deux données est contenue dans le diagramme de phases de l’alliage. Il est représenté à la Figure 9, en pourcentage massique et en pourcentage atomique.
Figure 9 : Diagramme de phases du système binaire Cu-Pd, en vue globale (en haut) et zoomée sur la structure B2 (en bas) [64].
α
α+β α+β
Dans un souci d’uniformité et pour alléger les notations, toutes les données de composition seront exprimées en pourcentage atomique (% at.). Plusieurs phases sont visibles et la première remarque porte sur le fait que la phase cubique à faces centrées, FCC (notée également α ou A1), est prédominante. Dans cette structure, les atomes de Pd et de Cu peuvent occuper indifféremment les sites fcc de la structure cristalline et former une solution solide. Cela signifie que la structure reste la même lorsque la composition varie, et que des phénomènes de substitution atomique interviennent pour adapter la teneur des éléments dans l’alliage.
La courbe de transition solide-liquide varie en composition entre 1065°C pour le Cu pur et 1555°C pour le Pd pur. Ensuite, quatre autres phases existent pour des compositions allant de 8 à 60 % at. de Pd :
• une phase β pour des compositions comprises entre 36 et 47 % at. de Pd. C’est la seule structure de type B2 (voir Figure 10), comparable à celle de la molécule de CsCl. Selon le degré d’ordonnancement des atomes de l’alliage, certains pics caractéristiques de la structure CsCl peuvent s’éteindre du fait de l’apparition de certaines symétries dans la maille ;
Figure 10 : Schéma d’une structure de type B2 [65].
Cu
Pd
54.7°• deux autres phases à faces centrées, nommées respectivement 1D-LPS (a) et 2D-LPS (b) dans la littérature. Elles sont les acronymes de ‘one (or two) dimensional long period superlattice’. Leur domaine d’existence s’étend de [18,5 à 25] et de [25,5 à 30] % at. de Pd, respectivement. Elles possèdent les caractéristiques des structures à faces centrées, mais n’appartiennent pas au réseau de bravais cubique. Les mailles élémentaires sont soit étirées dans une direction (tetragonal), soit déformées de telle sorte qu’un des angles de la maille n’est pas droit (monoclinique). Dans tous les cas, l’alliage formé dans cette gamme de composition est de type Cu3Pd ;
• Finalement, une phase dite ‘L12’ a été identifiée. Son domaine d’existence est compris entre 8 et 23 % at. de Pd et cette structure s’apparente à celle du AuCu3 (Figure 11). Les atomes aux sommets du cube sont de nature différente (Au) de ceux au centre des faces (Cu).
Dans le cadre de cette étude, l’intérêt se portera sur les phases A1 et B2 uniquement, reconnues pour leurs propriétés de diffusion de l’hydrogène [18, 63].
Figure 11 : Schéma d’une structure de type L12 [65].



![Figure 7 : Courbes de polarisation cathodique lors de la déposition de métaux A et B (inspiré de la référence [56], p.60)](https://thumb-eu.123doks.com/thumbv2/123doknet/5406314.126081/34.918.255.742.119.347/figure-courbes-polarisation-cathodique-déposition-métaux-inspiré-référence.webp)
![Figure 9 : Diagramme de phases du système binaire Cu-Pd, en vue globale (en haut) et zoomée sur la structure B2 (en bas) [64]](https://thumb-eu.123doks.com/thumbv2/123doknet/5406314.126081/39.918.224.732.133.912/figure-diagramme-phases-système-binaire-globale-zoomée-structure.webp)



