Effet du type de supplémentation protéique sur les
bilans nets splanchnique et mammaire des
nutriments azotés chez la vache laitière
Mémoire
Catherine Roy
Maîtrise en sciences animales
Maître ès sciences (M. Sc.)
Québec. Canada
iii
Résumé court
Ce projet de recherche visait à comprendre l’impact de l’utilisation de différents types de
supplémentations protéiques dans des rations à base d’ensilage d’herbe sur les performances
zootechniques de vaches laitières. Afin d’atteindre cet objectif, l’absorption des nutriments
azotés et leur utilisation subséquente par les tissus hépatique et mammaire a été déterminée
en mesurant les bilans nets de ces organes des nutriments azotés et le bilan azoté corporel.
Ainsi, trois sources de protéines ont été comparées, soit le tourteau de soya (SBM), le
tourteau de canola (CM) et le tourteau de canola additionné d’urée (CMU) avec une ration à
base d’ensilage d’herbe. L’utilisation du CM n’a pas permis d’améliorer les performances
laitières, ni l’ingestion de matière sèche par rapport au SBM. Cependant, CM avait tendance
à convertir plus efficacement l’azote alimentaire en protéine du lait (N lait : N ingéré) (P =
0,10) et à réduire l’azote uréique dans le lait (MUN) et l’urine (UUN) (P = 0,09), ce qui a
permis d’augmenter numériquement la proportion en protéine vraie de la protéine brute du
lait comparativement au traitement SBM (P = 0,17), avec une concentration plasmatique en
méthionine numériquement supérieure pour le CM (P = 0,18). Le traitement CMU a
augmenté considérablement la concentration en ammoniac dans le rumen (P < 0,001), avec
un MUN doublement supérieur au traitement témoin CM (P < 0,001) et un UUN augmentant
de 15 % (P < 0,001). Ce traitement n’a toutefois pas affecté la disponibilité des acides aminés
dans le foie ni les rendements en protéines du lait des vaches. En résumé, l’efficacité
d’utilisation de l’azote avait tendance à être supérieure pour le CM que le traitement SBM,
notamment suite à la réduction du MUN et UUN avec ce type de tourteau.
iv
Résumé long
L’efficacité d’utilisation de l’azote (N) alimentaire est un défi important pour l’industrie
laitière, notamment en raison de l’impact économique et environnemental de cet élément.
L’azote est le principal constituant des acides aminés (AA) et des protéines. Lorsque
dégradée dans le rumen, la protéine excédentaire augmente la concentration en ammoniac,
qui va ensuite s’accumuler de façon importante dans l’urine sous forme d’urée. Un moyen
d’éviter ces excès est d’équilibrer la quantité de protéines tout en tenant compte de la
quantité et qualité des acides aminés essentiels (AAE) des aliments. Le tourteau de canola
semble être une alternative au tourteau de soya puisque son profil en AAE est de très bonne
qualité et contient moins de protéines brutes que le tourteau de soya. L’objectif de ce projet
était d’étudier l’impact de l’inclusion du tourteau de canola en substitution au tourteau de
soya et un excès de protéine dégradable dans le rumen (PDR) sur l’absorption des nutriments
azotés à travers les tissus splanchniques (TSP) et mammaire ainsi que leur impact sur le
métabolisme azoté de la vache laitière.
Six vaches Holstein munies de canules ruminales et de cathéters sanguins ont été distribuées
dans un double carré latin 3 × 3 et ont reçues 3 rations à base d’ensilage d’herbe avec
différents suppléments protéiques, soit du 1) tourteau de soya (SBM), 2) tourteau de canola
(CM) et 3) CM plus de l’urée (15 g/kg MS) (CMU), et ce pour 3 périodes de 21 jours. Les
vaches étaient nourries à des intervalles de 2 heures, 12 fois par jour. L’implantation de cinq
cathéters sanguins (artère mésentérique, deux veines mésentériques, veine porte et hépatique)
a permis de calculer les bilans des nutriments (AAE, ammoniac, urée) à travers les TSP et la
glande mammaire. Des échantillons sanguins (n=6) ont été prélevés à chaque fin de période
afin d’obtenir ces estimations. De plus, l’estimation des bilans nécessitait la détermination
des débits plasmatiques portal et splanchnique, qui était obtenu à partir de la technique de
dilution d’acide amino-hippurique (PAH) perfusé dans une veine mésentérique. Les débits
plasmatiques mammaires ont été estimés à partir du principe de Fick, avec Phe+Tyr comme
marqueurs internes. Pour évaluer les effets sur le métabolisme azoté, le bilan azoté a été
calculé en fonction de l’azote ingéré et excrété dans l’urine, les fèces et le lait à dont les
analyses ont été effectuées à partir de la méthode Kjeldahl. Des échantillons d’urine et de
fèces spontanés ont été prélevés (n=3) à chaque fin de période pour l’estimation du flux
v
duodénal d’azote microbien réalisée à partir de la créatinine et des dérivés de bases puriques
de l’urine. La fibre NDF indigestible (iNDF) a été utilisé comme marqueur interne afin
d’estimer la quantité de fèces produite et l’azote fécal excrété par jour. Du liquide ruminal a
été prélevé 30 minutes avant et après le repas de 14h00 pour mesurer la concentration en
ammoniac
du liquide (n=2). Des moyennes de la production laitière et la matière sèche
ingérée ont été effectuées au cours des 4 derniers jours de chaque période expérimentale.
L’inclusion du CM en substitution au SBM n’a pas affecté la production laitière ni la
protéine vraie du lait malgré la différence en AAE et PB de ces deux aliments. Même si la
production laitière n’était pas différente entre CM et SBM, CM semblait être plus efficace
pour convertir N ingéré par rapport au lait (N lait : N ingéré) que SBM (28,8 vs 26,8 %
respectivement; P = 0,10), ce qui fait en sorte que le pourcentage de protéine vraie du lait
(exprimé en % de PB du lait) est numériquement plus élevé pour le CM que SBM (94,5 vs
94,1% respectivement; P = 0,17), avec un MUN inférieur (12,1 vs 13,4 mg/dL
respectivement; P = 0,09) et UUN inférieur lorsqu’exprimé par rapport à N ingéré (59,6 vs
65,8 % respectivement; P = 0,09). De plus, la concentration plasmatique en Met était
numériquement supérieure pour le CM que pour SBM (26,1 vs 21,6 µM respectivement; P =
0,18). Le traitement CMU réduisait considérablement l’efficacité de conversion de N ingéré
en N du lait (28,8 vs 23,9% respectivement ; P <0,01) et a augmenté l’excrétion d’azote
uréique dans l’urine et dans le lait par rapport au traitement CM (P < 0,001). La forte
augmentation de la concentration en ammoniac du liquide ruminal est responsable de ce
phénomène suite à une forte dégradation de la PDR dans le rumen (P < 0,001). Malgré les
effets négatifs sur l’environnement provoqués par ce traitement, la disponibilité des AA dans
le foie et les rendements en protéines du lait n’ont pas été affectés par l’excès de PDR dans la
ration. Toutefois, les bilans nets démontrent une forte synthèse hépatique de l’urée pour le
traitement CMU, ce qui nécessite l’utilisation d’AA comme l’aspartate (Asp), la glycine
(Gly) et l’histidine (His) dans le cycle de l’ornithine et pourrait avoir éventuellement un
impact à long terme sur la composition protéique du lait. En effet, en observant les bilans
nets de l’Asp, même si les résultats ne sont pas significativement différents entre CM et
CMU, on peut voir l’augmentation numérique de l’extraction hépatique de cet AA. Ceci
vi
pourrait démontrer leur implication dans la synthèse hépatique de l’urée, puisque le foie les
extraits plus de AA pour CMU que CM.
vii
Table des matières
Résumé court ... iii
Résumé long ... iv
Liste des tableaux ... x
Liste des figures ... xi
Liste des abréviations ... xii
Remerciements ... xiii
Avant-propos ... xiv
Introduction ... 1
CHAPITRE 1 ... 4
1.1 Apports et besoins protéiques chez la vache en lactation ... 4
1.1.1 Protéines synthétisées par les microbes du rumen ... 5
1.1.1.1 Substrats précurseurs de la protéine microbienne ... 6
1.1.1.2 Estimation de la synthèse de protéine microbienne par les dérivés de bases puriques excrétés dans l’urine ... 7
1.1.2 Protéine alimentaire non-dégradée dans le rumen ... 9
1.1.3 Équilibrer la ration en fonction des acides aminés essentiels ... 10
1.1.4 Indicateur d’efficacité d’utilisation de l’azote : urée du lait et plasmatique ... 12
1.2 Calculs des bilans ... 13
1.2.1 Bilan total azoté chez la vache laitière ... 13
1.2.2 Excrétion azotée urinaire et fécale ... 14
1.2.2.1 Azote urinaire ... 15
1.2.2.2 Azote fécal ... 16
1.2.3 Bilan net des tissus ... 20
1.2.3.1 Mesure des débits plasmatiques des tissus splanchniques et mammaire ... 21
1.3 Métabolisme des tissus splanchniques et mammaire ... 24
1.3.1 Tissus drainés par la veine porte ... 25
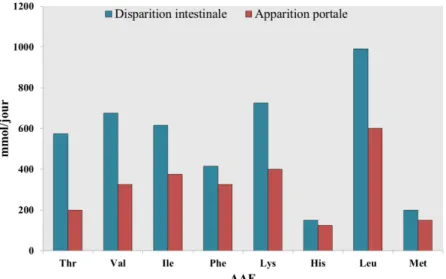
1.3.1.1 Disparition intestinale et apparition portale des acides aminés ... 25
1.3.1.2 Apparition portale de l’ammoniac ... 28
1.3.1.3 Retour de l’urée vers le tractus digestif ... 29
viii
1.3.2.1 Extraction hépatique des acides aminés ... 31
1.3.2.2 Synthèse de l’urée ... 35
1.3.3 Métabolisme mammaire ... 37
1.3.3.1 Efficacité de conversion de l'azote ingéré en lait ... 37
1.3.3.2 Métabolisme mammaire des acides aminés et synthèse de la protéine du lait ... 38
1.3.3.3 Effet de l’apport protéique sur les rendements en protéines et la production de lait ... 40
1.4 Supplément protéique de la ration ... 41
1.4.1 Utilisation du tourteau de canola chez les vaches laitières ... 42
1.4.1.1 Utilisation du tourteau de canola en substitution du tourteau de soya ... 42
1.4.1.2 Teneur en protéines et acides aminés du tourteau de canola ... 42
1.4.1.3 Effet du tourteau de canola sur les performances laitières ... 45
1.5 Conclusion et hypothèses de recherche ... 46
1.6 Liste des ouvrages cités ... 47
CHAPITRE 2 ... 57
Résumé ... 58
Abstract ... 60
2.1 Introduction ... 61
2.2 Material and Methods ... 62
2.2.1 Animals and Treatments ... 62
2.2.2 Sampling ... 64
2.2.3 Laboratory Analyses ... 65
2.2.4 Calculations and Statistical Analysis ... 67
2.3 Results ... 69
2.3.1 Milk yield and composition ... 69
2.3.2 Nitrogen balance and urinary excretion ... 70
2.3.3 Ruminal pH and ammonia concentration ... 70
2.3.4 Purines derivatives and microbial nitrogen flow in the duodenum ... 70
2.3.5 Arterial concentrations of amino acids, ammonia and urea ... 71
2.3.6 Splanchnic and mammary net fluxes of amino acids, ammonia and urea ... 71
2.4 Discussion ... 72
2.4.1 Comparison of protein source: canola meal and soybean meal ... 72
2.4.2 Effect of a high supply of RDP ... 73
ix 2.5 Conclusion ... 76 2.6 Acknowledgments ... 76 2.7 References ... 77 CHAPITRE 3 ... 96 3.1 Discussion ... 96
3.1.1 Substitution du tourteau de soya par du tourteau de canola ... 96
3.1.2 Excès de protéine dégradable dans une ration avec du tourteau de canola comme source protéique ... 97
3.2 Conclusion ... 98
x
Liste des tableaux
Chapitre 1
Tableau 1.1. Description des rations utilisées par l’Université du New Hampshire et évaluation de la ration (NRC, 2001) ... 11 Tableau 1.2. Métabolisme des acides aminés: de la lumière intestinale jusqu’au lait (mmol/h). ... 34 Tableau 1.3. Comparaison du contenu en acides aminés essentiels (AAE) du lait, des protéines
microbiennes, du tourteau de canola et du tourteau de soya (% des AAE). ... 44
Chapitre 2
Table 2.1. Composition of experimental diets and estimation from NRC (2001) ... 81 Table 2.2. Chemical composition of the feed ingredients ... 82 Table 2.3. Effect of protein source on dry matter intake and milk yield and composition in lactating
Holstein cows ... 83 Table 2.4. Effect of protein source on nitrogen balance in lactating Holstein cows ... 83 Table 2.5. Effect of protein source on urinary urea-N excretion and milk (MUN) concentration in
lactating Holstein cows ... 84 Table 2.6. Effect of protein source on ruminal pH and NH3-N concentration in lactating Holstein
cows ... 84 Table 2.7. Effect of protein source on purine derivatives (PD) and creatinine concentrations in urine,
and estimated microbial N supply (MN) in lactating Holstein cows ... 85 Table 2.8. Effect of protein source on arterial concentration of AA (μM), ammonia and urea-N (mM)
in lactating Holstein cows ... 86 Table 2.9. Splanchnic and mammary plasma flows (L/h) in lactating Holstein cows ... 87 Table 2.10. Effect of protein source on splanchnic and mammary net fluxes of essential AA (EAA,
mmol/h) in lactating Holstein cows ... 88 Table 2.11. Effect of protein source on splanchnic and mammary net fluxes of non essential AA
(NEAA, mmol/h) in lactating Holstein cows ... 90 Table 2.12. Effect of protein source on splanchnic net fluxes of NH3-N and urea-N (mmol/h) in
lactating Holstein cows ... 92 Table 2.13. Effect of protein source on AA hepatic extraction ratio and fractional removal ... 93 Table 2.14. Linking nitrogen available for absorption in the gut and for metabolism together ... 95
xi
Liste des figures
Chapitre 1
Figure 1.1. Parcours global de l'azote chez la vache laitière. ... 5 Figure 1.2. Relation entre le taux d'urée du lait (MUN; mg/dl) et l'azote excrété dans l'urine (UN; g/j)
: pente = 12,54 ± 0,24. ... 13 Figure 1.3. Effet de la variation du temps d’incubation (144. 216 et 288 h) sur la concentration en
NDF indigestible (iNDF) pour tous les ingrédients incubés chez des vaches consommant une quantité faible (190 g/kg MS), modéré (421 g/kg MS) et élevé (625 g/kg MS) en concentrés. .. 18 Figure 1.4. Présentation des éléments du principe de Fick à travers la glande mammaire chez la vache laitière. ... 24 Figure 1.5. Disparition intestinale et apparition portale des AAE chez la vache laitière. ... 28 Figure 1.6. Relation entre le flux net d’azote ammoniacal (NH3-N) à travers les tissus drainés par la
veine porte (TDVP) (g/j) et l’azote ingéré (g/j). Chaque point représente une moyenne
d’expérimentation individuelle. ... 29 Figure 1.7. Bilan net de la méthionine (groupe 1) et la lysine (groupe 2) à travers les tissus chez la
vache laitière. ... 32 Figure 1.8. Passage de la lysine (groupe 2) et méthionine (groupe 1) de l’intestin jusqu’au lait
(exprimé en % de l’apport net). ... 34 Figure 1.9. Perfusion de l'urée [15N15N] et analyses d'isotopomères de l'urée [15N15N], [14N15N] et
[14N14N] dans l'urine. ... 37
Figure 1.10. Relation entre le rendement en protéine du lait et l’apport duodénal en lysine. ... 38 Figure 1.11. Relation entre l’apport en protéine métabolisable PM (g/j) et les rendements en protéines du lait (g/j). ... 41 Figure 1.12. Relation positive entre les réponses de la concentration plasmatique en AAE totaux
xii
Liste des abréviations
Françaises[A] = Concentration artérielle. AA = Acides aminés. AACR = Acides aminés à chaîne ramifiée. AAE = Acides aminés essentiels. AANE = Acides aminés non-essentiels. Arg = Arginine. dpa =
Débit plasmatique artériel. dpm = Débit plasmatique mammaire. dpp = Débit plasmatique portal.
Glu = glutamate. GM = Glande mammaire. [H] = Concentration hépatique. HEP = Bilan net
hépatique. His = Histidine. iNDF = fibre NDF indigestible. Ile = Isoleucine. Leu = Leucine. Lys = Lysine. Met = Methionine. MS = Matière sèche. NDFD = Digestibilité de la fibre non-soluble dans un détergent neutre. NH3 = Ammoniac. NH3-N = azote ammoniacal. NPA = Apparition
portale nette. NPN = Azote non-protéique. [P] = Concentration portale. PAH = Acide para-aminohippurique. PB = Protéine brute. Phe = Phenylalanine. PDR = Protéine dégradable dans le rumen. PM = Protéine métabolisable. PMic = Protéine microbienne. PND = Protéine non dégradable dans le rumen. PV = Poids vif. TC = Tourteau de canola. TDVP = Tissus drainés par la veine porte. TDN = Concentration totale en nutriments digestibles. Thr = Thréonine. Trp = Tryptophane. TS = Tourteau de soya. TSP = Tissus splanchniques. Tyr = Tyrosine. Val = Valine. VP = Veine porte. VSH = Veine sus-hépatique.
Anglaises
AA = Amino acids. Ala = Alanine. Asn = Asparagine. Asp = Aspartate. BCAA=
Branched-chain amino acid. BUN = Blood urea-N. BW = Body weight. CM = Canola meal. CMU = Canola meal + urea. CNCPS = Cornell Net Carbohydrate and Protein System. CP = Crude protein. Cys = Cysteine. DM = Dry matter. DMI = Dry matter intake. EAA = Essential amino acids. Gln = Glutamine. Glu = Glutamic acid. Gly = Glycine. Haf = hepatic arterial flow. HEP = Liver. His = Histidine. Ile = Isoleucine. iNDF = Indigestible Neutral digestible fiber. Leu = Leucine. Lys = Lysine. Met = Methionine. MG = Mammary gland. MP = Metabolizable protein.
Mpf = Mammary plasma flow. MUN = Milk urea nitrogen. N = nitrogen. NDF = Neutral
detergent fiber. NEAA = Non-essential amino acids. NH3 = Ammonia. NH3-N = ammonia
nitrogen. NI = Nitrogen intake. NPA = Net portal absorption. pAH = para-aminohippurique acid.
PD = purine derivatives. PDmilk = Purine derivatives in milk. PDurine = Purine derivatives in
urine. PDV = Portal drained viscera. Phe = Phenylalanine. Ppf = plasma flow across portal drained viscera. Pro = Proline. RDP = Rumen degradable protein. RUP = Rumen undegradable protein. SBM = Soybean meal. SEM = Standard error of the mean. Ser = Serine. Spf = Plasma flow across splanchnic tissues. TCA = trichloroacetic acid; TDN = total digestible nutrients. Thr = Thréonine. Trp = Tryptophane. Tyr = Tyrosine. TSP = Splanchnic tissues.
xiii
Remerciements
Mes deux années passées au centre de recherche de Sherbrooke ont été pour moi une expérience très constructive, et m’ont permis à la fois de m’épanouir et de découvrir des aspects de moi que je ne connaissais pas encore. J’ai pu découvrir à quel point je suis passionnée du domaine de l’agriculture, et qu’il suffit de toujours se pousser plus loin pour obtenir ce que l’on veut.
Je tiens à remercier Agriculture et Agroalimentaire Canada et le Canadian Canola Council pour leur soutien financier pour ce projet de recherche.
Je voudrais remercier mon directeur de recherche, Dr Doris Pellerin, pour son support et ses conseils tout au long de mon apprentissage. Un gros merci à ma codirectrice de recherche Dre Hélène Lapierre, pour sa patience, sa compréhension, son écoute et sa bonne humeur contagieuse.
Je tiens à remercier toute l’équipe du centre laitier, et plus particulièrement Marie-Ève Bouchard, pour son excellent suivi auprès des animaux. Merci à Dr Daniel Ouellet, Danielle Bournival, Sylvie Dallaire et Laurence Fouquet pour l’aide apportée lors des journées de prélèvements et des analyses en laboratoire. Merci à Jocelyne Renaud de m’avoir accueillie dans son laboratoire, pour l’aide apportée lors des analyses et pour son dynamisme incroyable! Merci à Mario Léonard, pour sa patience, ses encouragements et pour le suivi apporté tout au long du projet. Je ne pouvais avoir mieux comme équipe! Merci pour ces deux belles années passées à Sherbrooke. Je tiens également à remercier ma chère amie Andréane Latour, de son hospitalité lors de mes déplacements à Québec, pour m’avoir changé les idées, m’avoir encouragé et fait rire lorsque j’étais à mon plus bas. Merci d’avoir été comme une deuxième maman pour moi.
Et finalement, merci à la femme de ma vie, ma mère Guylaine. Merci de m’avoir encouragé pendant ces deux années qui ont été à la fois éprouvantes, mais qui auront valu peine dans le futur.
xiv
Avant-propos
Le Chapitre 2 de ce mémoire est rédigé sous forme d’article scientifique. Je suis la première auteure de cet article; les co-auteurs de l’article sont les chercheurs H. Lapierre et D.R. Ouellet du Centre de recherche et de développement de Sherbrooke (Sherbrooke, Québec, Canada) et D. Pellerin de l’Université Laval (Québec, Canada). Leur aide apportée au cours de ce projet de recherche fut très appréciée. L’article a pour titre « The effect of the type of protein
supplementation on nitrogen and splanchnic metabolism in dairy cows fed a grass silage-based diet » et sera soumis pour publication dans le « Journal of Dairy Science ».
1
Introduction
L’azote est un élément de grande importance dans l’alimentation de la vache laitière. Cet élément constitue la base des acides aminés (AA). Les combinaisons de ces derniers, selon des séquences définies, permettent la fabrication de toutes les protéines corporelles; ceci inclue, entre autres, les tissus, les enzymes, les hormones protéiques telle l’insuline et les protéines du lait. Bien comprendre le métabolisme de l’azote par les tissus splanchniques et mammaire chez la vache en lactation peut avoir un impact économique et environnemental important. Si le contenu en azote de la ration, exprimé en protéine brute (PB = N × 6,25) est en excès, celui-ci est excrété dans l’environnement via l’urine et les fèces, mais principalement via l’urine. En effet, un surplus d’azote dans l’alimentation aura deux principales conséquences. Tout d’abord, un excès de protéine dégradable dans le rumen (PDR) crée un taux d’ammoniaque élevé dans le rumen, qui lorsque l’assimilation maximale par les microorganismes du rumen est dépassée, est redirigé vers le foie via la circulation sanguine, et transformé en urée. D’autre part, un excès de protéine métabolisable (PM), somme des protéines microbiennes et des protéines non-dégradables (PND) digérées, apporte un excès d’AA qui sera ultimement détoxifié en urée par le foie. Cette urée est en partie recyclée dans le système digestif par la salive et le sang, et environ 30% sera excrétée dans l'urine et le lait (Galindo, 2015), pourcentage qui peut varier en fonction des caractéristiques de la ration (Lapierre et Lobley, 2001).
Le taux d'urée dans le lait est un bon indicateur pour évaluer l'efficacité d'utilisation de la protéine dégradable de la ration (Hammond, 1997). Un lien serait présent entre l’urée sécrétée dans le lait et la concentration plasmatique de l’urée (Kohn et al., 2005). Dernièrement, les nutritionnistes s’intéressent davantage à augmenter l’efficacité de transfert de la protéine alimentaire de la ration en protéine vraie du lait, diminuant ainsi les coûts d’alimentation et les impacts environnementaux (Lapierre et al., 2009). En 2012, le pourcentage de protéines alimentaires des rations laitières se situait autour de 18,1% (Valacta, 2013). Ce pourcentage pourrait facilement être diminué à 16,5% sans affecter la production laitière, si les rations étaient équilibrées adéquatement en fournissant les AA requis (AAC, 2016). Cette baisse permettrait de diminuer l’excrétion azotée de plus de 17 000 tonnes par année au Canada (-15%), représentant ainsi une économie de 77,5 millions de dollars pour les fermes laitières canadiennes (AAC, 2016). Rappelons que l’azote excrété peut contribuer significativement à la pollution, notamment
2
par son impact sur l’eutrophisation des eaux superficielles, des eaux souterraines en nitrates, et sur l’acidification des sols et la formation de gaz à effet de serre lorsque transformé en oxyde nitreux (Hristov et al., 2011).
Le métabolisme des nutriments et composés azotés chez le ruminant est un système complexe. Une vache en lactation synthétise entre 3 et 5 kg de protéines par jour (Lapierre et al., 2002; Raggio et al., 2006a), ce qui dépasse largement les quantités digérés, indiquant ainsi un important « turnover » de la protéine des tissus et une contribution significative des AA des tissus au pool des AA utilisés pour la synthèse de la protéine du lait (Lapierre et al., 2002). L’absorption des nutriments azotés se fait par les tissus drainés par la veine porte (TDVP), et sont ensuite directement dirigés vers le foie, ces deux tissus formant les tissus splanchniques (TSP). Afin d'optimiser l'efficacité d'utilisation des nutriments azotés, mesurer leurs bilans nets à travers les TSP et la glande mammaire permet de mesurer la quantité nette utilisée ou relâchée par chacun des organes étudiés suite à des phénomènes d’absorption ou à différentes réactions anaboliques et cataboliques (Lapierre et al., 2002; Martineau et al., 2011). Équilibrer les rations en fonction des besoins en AA essentiels (AAE) et en protéine métabolisable (PM) permettrait d'améliorer leur efficacité d'utilisation par une utilisation plus judicieuse par les TDVP, le foie et la glande mammaire (Martineau et al., 2011).
Les producteurs laitiers canadiens ont tendance à préférer le tourteau de soya (TS) au tourteau de canola (TC) comme suppléments protéiques à cause de l’apport en PB (499 vs 378 g kg-1 MS) et en énergie métabolisable (13,5 vs 12,0 MJ kg-1MS) plus élevé (National Research Council (NRC), 2001). De plus, selon Agricultural and Food Research Council (AFRC; 1993), l’apport en PND de la PB serait plus élevé pour le TS que pour le TC. Cela dit, de nombreuses études évaluant l’effet de ces suppléments dans des rations à base d’ensilage d’herbe (Shingfield et al., 2003) ou de luzerne (Brito et Broderick, 2007) ne supportent pas ces conclusions.
Afin de mieux comprendre ce qui peut expliquer les différences de résultats obtenues entre le TC et le TB, ce mémoire présentera l'effet de différents types d’apport protéique, soit en modifiant le profil d’AA ou en augmentant l’azote non-protéique, sur le métabolisme des nutriments azotés chez la vache laitière. Ainsi, trois sources de protéines seront comparées, soit le tourteau de soya (SBM), le tourteau de canola (CM) et le tourteau de canola additionné d’urée (CMU) avec une
3 ration à base d’ensilage d’herbe. Le projet permettra d’étudier l’impact d’une substitution du TS par du TC ainsi que l’effet d’un apport en PDR élevé sur les bilans nets des nutriments azotés à travers les TSP et la glande mammaire chez la vache en lactation et sur le bilan corporel d’azote en contexte québécois de ration à base d’ensilage d’herbe.
4
CHAPITRE 1
Revue des travaux antérieurs
1.1 Apports et besoins protéiques chez la vache en lactation
Pour maintenir une bonne efficacité d’utilisation de la protéine, les nutritionnistes ont pour défi d’évaluer les apports et les besoins chez la vache en lactation et de les équilibrer (Lapierre et al., 2007). Les protéines fournissent les AAE au ruminant pour combler les besoins de protéosynthèse de tous les tissus. La qualité du profil en AA des aliments demeure un des principaux défis.
Au cours des dernières décennies, la notion de « protéine » a beaucoup évolué afin d’évaluer correctement ce que la vache assimile réellement. Le concept « protéine brute », soit la quantité d’azote multiplié par le facteur 6,25 (PB; PB = N × 6,25), était auparavant très utilisé (NRC, 2001). Cependant, l’absorption nette portale des AA peut être assurément plus influencée par le niveau d’énergie que par la PB dans la ration (Reynolds, 1992). En effet, l’absorption totale d’AA est reliée à la quantité de protéines digérées (NRC, 2001) : une augmentation de la PB ingérée n’améliorerait pas nécessairement cette absorption, tandis que le niveau d’énergie peut avoir un impact majeur sur la synthèse de protéines microbiennes (Reynolds, 1992). Ainsi, la PB
peut parfois être un piètre indicateur de la valeur nutritive protéique de la ration (Lapierre
et al., 2002). La notion de PB a ensuite été remplacée pour la formulation des rations par les concepts de « protéines dégradables » (PDR) et « protéines non-dégradables » (PND) dans le rumen. Dans le contexte actuel, les modèles utilisent maintenant la protéine métabolisable (PM), représentant la somme des protéines arrivant au duodénum et digérées dans le petit intestin, protéines issues des apports en protéines microbiennes et PND; les AA digérés et disponibles à l’animal découlent directement de la digestion de ces protéines. Ainsi, les rations sont maintenant formulées en fonction des PM, et parfois aussi des AAE, dont la vache aura besoin pour maintenir ses fonctions vitales et sa production laitière. Les composantes de la PM sont directement disponibles à la vache puisque après être arrivés au duodénum, elles y sont digérées et absorbées sous forme d’AA, ensuite acheminées vers le foie, puis vers les tissus périphériques, incluant la glande mammaire, pour y être extraites et utilisées pour la synthèse de protéines (Figure 1.1).
5 Figure 1.1. Parcours global de l'azote chez la vache laitière.
1.1.1 Protéines synthétisées par les microbes du rumen
Une fraction de la protéine alimentaire ingérée n’atteindra pas le duodénum car elle sera dégradée par les microorganismes du rumen. La dégradation de la protéine alimentaire dans le rumen débute par la protéolyse extracellulaire et libération des peptides et AA. Les AA sont ensuite désaminés par les bactéries, amenant une production d’ammoniac, substrat nécessaire à la croissance des microorganismes dans le milieu ruminal. Les microorganismes utilisent cet ammoniac ou des AA préformés afin d’assurer leurs besoins d’entretien et de croissance et utilisé pour la synthèse de la protéine microbienne (PMic). Une meilleure disponibilité de l’azote dégradable accroit l’activité cellulolytique et améliore la digestibilité de la ration (Bryant et Robinson, 1961). Les bactéries du rumen ont un rôle important sur la dégradation des particules alimentaires. Les protozoaires ont également un rôle important dans la dégradation des particules solides, et ont besoin d’azote pour assurer leur croissance et maintenir un équilibre de la flore bactérienne. L’efficacité de dégradation dépend de deux facteurs, soit l’énergie disponible et l’azote dégradable apporté dans la ration (Vérité et Peyraud, 1989).
6
La PMic est très digestible et possède un profil en AA de qualité (NRC, 2001), sauf pour un AA,
l’histidine (His). Elle contribue environ à un peu plus de 50 % du flux duodénal protéique chez la vache laitière (Clark et al., 1992).
1.1.1.1 Substrats précurseurs de la protéine microbienne
Ammoniac
Pour assurer une bonne croissance microbienne, une bonne dégradation des fourrages et la fabrication de protéines microbiennes, une quantité minimale d’ammoniac doit être présente dans le rumen. Il est recommandé par Hoover (1986) d’avoir une teneur entre 3,3 et 8 mg NH3-N/100 ml de fluide ruminal pour assurer un bon développement microbien et pour favoriser la digestion des parois des plantes fourragères. Un manque d’ammoniac avec un surplus d’énergie diminue la croissance bactérienne et dans le cas échéant, la synthèse de la PMic causé par ce déséquilibre.
Dans l’étude de Devant et al. (2000) effectuée avec des rations de tourteau de soya sur des génisses Friesian de 101 kg de poids vif, une faible concentration en PB (14 %) ou une faible dégradabilité de la PB (42 % de la PB) a occasionné une baisse de NH3-N sous le seuil de 5
mg/100 mL recommandé par Hoover (1986). À l’inverse, si l’apport en protéines dégradables est trop élevé, l’ammoniacdépasse la capacité maximale d’assimilation des bactéries, il y aura un transfert de l’ammoniac vers la circulation sanguine pour ensuite se rendre jusqu’au foie.
Urée
L’urée contribuant à la formation d’ammoniac dans le rumen peut provenir de deux sources. Elle peut être incorporée dans la ration comme apport en azote non-protéique (NPN), ou provenir du recyclage d’urée fabriquée par le foie, soit via la salive et par transfert d’urée artérielle à travers la paroi ruminale (Lapierre et Lobley, 2001). Les ruminants ont la capacité de synthétiser de l’urée pour prévenir l’intoxication suite à une trop forte absorption d’ammoniac (Huntington et Archibeque, 2000). L’urée peut être recyclée et réacheminée vers le système digestif via la salive et le sang, ou peut être excrétée dans l’urine (Huntington et Archibeque, 2000). Lorsque l’azote ingéré diminue, on peut noter une diminution de production d’ammoniac dans le rumen ainsi que de l’urée plasmatique et salivaire, une augmentation du taux de passage à travers la paroi ruminale et une diminution de l’urée excrétée dans l’urine (Muscher et al., 2010). Les microorganismes de la phase 4 (attachés sur la paroi ruminale) libèrent de l’uréase, hydrolysant ainsi l’urée recyclée en ammoniac et en CO2. Ce processus permet de puiser le maximum d’azote
7 pour combler les besoins des microorganismes lorsque l’azote alimentaire est présent en quantité limitée. Le phénomène inverse est observé lorsque l’azote ingéré augmente, et où l’urée est excrétée en quantité et proportion plus importante dans l’urine (Muscher et al., 2010).
AA libres
Le peu d’AA sous forme libre dans le rumen peuvent aussi servir de substrats pour la synthèse de la PMic. Ils peuvent être utilisés par la flore microbienne pour la synthèse directe de PMic ou être désaminés pour former de l’ammoniac et d’autres produits comme des acides gras, du CO2, du CH4 et de la chaleur.
Énergie
Cependant, non seulement l’azote, mais aussi l’énergie doit être apportée adéquatement à la ration de façon à créer un équilibre au sein de la flore microbienne. Un apport adéquat en glucides facilement fermentescibles (comme l’amidon) tout en équilibrant la protéine permet d’optimiser l’utilisation de l’ammoniac par les microorganismes et augmenter la synthèse de la protéine vraie du lait (Sannes et al., 2002). Les microorganismes ont une limite à l’utilisation de d’azote pour la synthèse de protéines microbiennes, même si l’énergie provenant des glucides est disponible en grande quantité (Nocek et Russell, 1988; Doepel et al., 2004). L’excès est donc lessivé hors du rumen et gaspillé. L’effet des glucides sur la production laitière est plus important que celui de l’azote dans la littérature, mais ces deux facteurs sont tout de même interdépendants l’un de l’autre pour la croissance des bactéries et la synthèse de la PMic (Nocek et Russell, 1988).
1.1.1.2 Estimation de la synthèse de protéine microbienne par les dérivés de bases
puriques excrétés dans l’urine
Traditionnellement, la mesure de la synthèse microbienne s’effectue par mesure du flux protéique duodénal ou omasal combinée à une estimation de la contribution de la population microbienne à ce flux protéique. Ces techniques sont cependant invasives et dispendieuses. Afin de faciliter l’estimation de la synthèse microbienne : des auteurs ont proposé une technique d’échantillonnage ponctuel d’urine permettant d’estimer le flux d’azote microbien (MN) en utilisant les dérivés de bases puriques dans l’urine afin de quantifier les protéines microbiennes (Chen et al., 1990; Chen et Gomes, 1992) et les concentrations de créatinine pour quantifier les volumes d’urine (e.g.Valadares et al., 1999) sur des animaux n’ayant pas de canules ruminales ou
8
duodénales. En effet, l'étude de Chen et al. (1990), effectuée chez le mouton, a permis de démontrer que l'excrétion urinaire des dérivés de bases puriques peut servir d'index pour connaitre le flux d’azote microbien au duodénum. Les acides nucléiques arrivant au petit intestin sont essentiellement d’origine microbienne (Chen et al., 1990), puisque les aliments contenus dans la ration ont généralement une teneur faible en purines. Les purines absorbées dans l'intestin sont ensuite dégradées et deviennent des dérivés de bases puriques. L'allantoïne est le principal dérivé de bases puriques excrété dans l'urine, cependant, les dérivés excrétés peuvent être sous d'autres formes: hypoxanthine, xanthine et en acide uréique (Chen et al., 1990). Puisque les purines sont principalement d'origine microbienne, on peut estimer la quantité de PMic absorbée
par le ruminant avec l'aide des dérivés de bases puriques excrétés dans l'urine (PDurine) et les
dérivés de bases puriques excrété dans le lait (PDlait). Les paramètres utilisés pour calculer
l’absorption des purines sont présentés à l’équation (1). L’équation (2) présente la contribution endogène des purines (0,385) et la récupération des purines absorbées comme dérivés de bases puriques dans l'urine et le lait (0,85; Chen et Gomes, 1992); l’absorption des purines peut ensuite être utilisée pour estimer le flux duodénal de l’azote microbien à l’aide des équations (2) ou (3) (Chen et Gomes, 1992), où l’équation (3) est la version simplifiée de l’équation (2).
𝐴𝑏𝑠𝑜𝑟𝑝𝑡𝑖𝑜𝑛 𝑑𝑒𝑠 𝑝𝑢𝑟𝑖𝑛𝑒𝑠
!!"#!=
!"#$%&' ! !"#$%& ! !,!"# × !"!,!" !,!"(1)
Où PDurine = dérivés de bases puriques (mmol/j) excrétés dans l'urine
PDlait = dérivés de bases puriques (mmol/j) excrétés dans le lait, estimé à 1
mmol/L (Chen et Gomes, 1992) PV = poids vif (kg)
𝐹𝑙𝑢𝑥 𝑁 𝑚𝑖𝑐𝑟𝑜𝑏𝑖𝑒𝑛
! !=
!,!!"×!,!"×!"""!"×!"(2)
𝐹𝑙𝑢𝑥 𝑁 𝑚𝑖𝑐𝑟𝑜𝑏𝑖𝑒𝑛
! != 𝑃𝐴 × 0,727
(3)
Où
PA = absorption des purines (mmol/j)
9
E
n plus de la concentration de dérivés de bases puriques dans l’urine, le volume urinaire doit être connu. Le taux de créatinine sécrété par l’animal en fonction de son poids vif peut être estimé car il est relié à la masse musculaire et est proportionnelle au poids vif de l’animal (Chizzoti et al., 2008). Il a été démontré dans une méta-analyse que le taux moyen de sécrétion de créatinine est d’environ 25,5 mg/kg PV chez une vache en lactation (Lapierre et al., 2016). Cette estimation est utilisée, bien que l’on sache que la concentration en créatinine peut varier en fonction de la quantité de protéines ingérées, de glucides non-fibreux et de NPN contenu dans la ration et le stade physiologique de l’animal (Chizzoti et al., 2008).Une fois que le taux de créatinine sécrété est estimé, on peut déterminer le volume d'urine total produit au cours de la journée, en mesurant la concentration de créatinine dans l’échantillon d’urine. Par exemple, si le taux de créatinine excrété est de 25,5 mg/kg PV (Lapierre et al., 2016) et que le poids vif d'une vache à l'étude est d'environ 600 kg, on estime alors que 15 300 mg de créatinine ait été excrété durant la journée (600 kg PV × 25,5 mg kg-1 PV). Donc, si la
concentration de créatinine est de 700 mg L-1 d'urine (déterminé en laboratoire), cela voudrait
dire que la vache a produit 21,86 L d'urine durant la journée (15 300 mg créatinine ÷ 700 mg L-1).
Une fois le volume total trouvé, on peut estimer l’excrétion totale des dérivés de bases puriques et appliquer l’équation 3 présentée ci-haut.
1.1.2 Protéine alimentaire non-dégradée dans le rumen
La PND est la fraction de la protéine alimentaire n’étant pas dégradée par la flore microbienne du rumen. Plusieurs facteurs peuvent influencer la quantité de PND disponible suite au passage dans le rumen, notamment le temps de rétention, le taux de dilution, la solubilité de la protéine, le taux d’ingestion et les traitements thermiques des ingrédients. Les traitements à la chaleur sont parmi les principales méthodes utilisées pour améliorer l’apport post-ruminal en AA provenant d’un supplément protéique (Mustafa et al., 2000). La PND peut être influencée par des traitements thermiques. En effet, la chaleur induite modifie la structure moléculaire des protéines, ce qui permet d’augmenter la quantité de PND arrivant dans l’intestin. Cependant, une température trop élevée peut rendre la PND non-digestible par la suite. Les résultats de Mir et al. (1984) suggèrent que la température à laquelle le TC est traité est un facteur qui a un effet plus marqué que la durée du traitement thermique.
10
Même si tout porte à croire que la substitution de la PDR par la PND puisse augmenter l’apport total en protéines au petit intestin et par conséquent améliorer la production de lait, très souvent, au contraire, cette substitution diminue la disponibilité de l’azote aux microorganismes, affectant négativement la croissance et la synthèse de PMic, et éventuellement l’absorption totale de AA et
la synthèse de la protéine du lait (Santos et al. 1998). Santos et al., (1998) ont montré que la synthèse de PMic pouvait réduire jusqu’à 76 % lorsque les rations sont riches en PND.
1.1.3 Équilibrer la ration en fonction des acides aminés essentiels
Quand on équilibre une ration pour les AAE, on doit tenir en compte des apports globaux d’AAE provenant de la PM et on se doit aussi de jumeler au mieux ces apports avec les besoins de la vache en lactation. La glande mammaire est le plus grand utilisateur d'AA, sur une base nette, chez la vache laitière (Lapierre et al., 2002). La synthèse de la protéine laitière est limitée par la quantité d’AAE et la qualité du profil en AAE des protéines digérées, provenant de la PM. Les AA comme l’histidine (His), l’isoleucine (Ile), la leucine (Leu), la lysine (Lys), la méthionine (Met), la phénylalanine (Phe), la thréonine (Thr), le tryptophane (Trp) et la valine (Val) sont considérés comme essentiels aux ruminants, et doivent être apportés par la ration pour combler les besoins métaboliques, puisqu’ils ne peuvent les synthétiser (Lapierre et al., 2002). Cela dit, l’apport en AAE doit provenir de la PM, et les besoins sont calculés soit en pourcentage de l'apport total en PM de la ration (NRC, 2001) ou en apport absolu (g/j : CNCPS, Fox et al., 2004). Les trois principaux AA limitants avec les rations typiques alimentées aux vaches en Amérique du Nord sont la Met, la Lys et l’His chez la vache en lactation (Schwab et Ordway, 2001). La Met est premier limitant lorsque la PND provient de la protéine de soja ou de protéines d'origine animale, et la Lys est premier limitant chez la PND du maïs et de ses produits dérivés (NRC, 2001; Schwab et Ordway, 2001). De récentes études ont démontré que l’His peut devenir limitante lorsque le taux de PB de la ration est bas et que la PMic constitue une fraction
importante de l’apport en AA (e.g. Giallongo et al., 2015). Actuellement, les recommandations du NRC (2001) sont disponibles seulement pour deux AA (Lys et Met; 7,2 % et 2,4 % de la PM, respectivement). Rulquin et al. (2001) proposent des recommandations pour d’autres AAE suite à des études effectuées avec des perfusions duodénales d’AA.
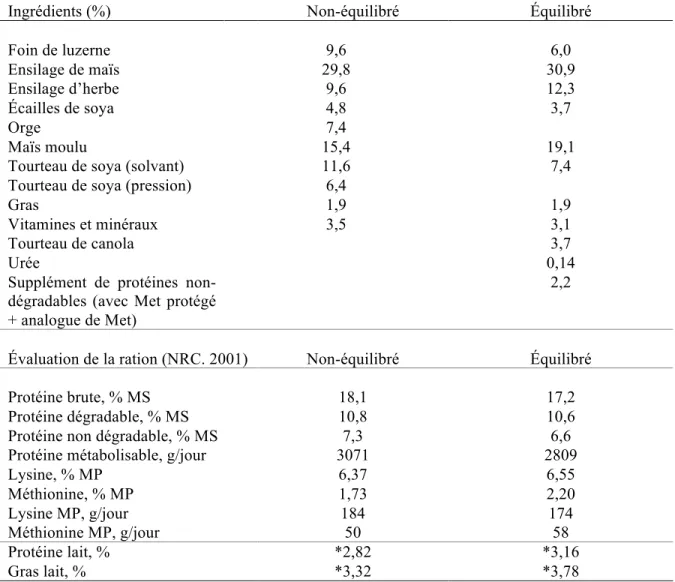
Le taux et le rendement en protéines du lait peuvent être améliorés en diminuant la quantité de PB si on apporte les AA les plus limitants dans la ration, plus particulièrement, l’His, la Lys et Met. Ainsi, Schwab et Ordway (2001) ont démontré qu’en réduisant le taux de PB de la ration de
11 18,1 à 17,2 % et en augmentant le pourcentage en Lys (de 6,34 à 6,55 % de la PM) et Met (de 1,73 à 2,20 % de la PM; Tableau 1.1.), on obtient un taux de protéines du lait plus élevé, et ce, pour les six fermes à l’étude (passant d’environ 2,70-2,83 % à 3,12-3,16 %). De plus, parallèlement à cette hausse du taux protéique, le MUN est à la baisse, soit de 14,5 à 12,4 mg/dL.
Tableau 1.1. Description des rations utilisées par l’Université du New Hampshire et évaluation de la ration (NRC, 2001)
Ingrédients (%) Non-équilibré Équilibré
Foin de luzerne 9,6 6,0 Ensilage de maïs 29,8 30,9 Ensilage d’herbe 9,6 12,3 Écailles de soya 4,8 3,7 Orge 7,4 Maïs moulu 15,4 19,1
Tourteau de soya (solvant) 11,6 7,4
Tourteau de soya (pression) 6,4
Gras 1,9 1,9
Vitamines et minéraux 3,5 3,1
Tourteau de canola 3,7
Urée 0,14
Supplément de protéines non-dégradables (avec Met protégé + analogue de Met)
2,2
Évaluation de la ration (NRC. 2001) Non-équilibré Équilibré
Protéine brute, % MS 18,1 17,2
Protéine dégradable, % MS 10,8 10,6
Protéine non dégradable, % MS 7,3 6,6
Protéine métabolisable, g/jour 3071 2809
Lysine, % MP 6,37 6,55 Méthionine, % MP 1,73 2,20 Lysine MP, g/jour 184 174 Méthionine MP, g/jour 50 58 Protéine lait, % *2,82 *3,16 Gras lait, % *3,32 *3,78 *Données de la ferme #6
12
1.1.4 Indicateur d’efficacité d’utilisation de l’azote : urée du lait et plasmatique
L’urée du lait permet de déterminer l’efficacité de l’utilisation de l’azote dans les rations sur les fermes. Tout d’abord, un déséquilibre des apports face aux besoins réels peut être observé à deux niveaux différents: soit un excès d’azote dégradable au rumen par rapport à la capacité d’assimilation des microbes du rumen résultant en un excès d’absorption d’ammoniac ou un excès d’apport en AA dans l’intestin par rapport aux besoins de l’organisme entier. Si l’apport en azote dégradable est en surplus et dépasse la capacité d’assimilation maximale des bactéries, une production massive d’ammoniac est formée dans le rumen, réduisant la motricité ruminale et l’activité microbienne. Ceci peut occasionner un manque d’appétit et une augmentation massive des rejets azotés urinaires (Kertz et al 1982; Choung et al., 1990). L’ammoniac en surplus est absorbé à travers la paroi ruminale, passe dans la circulation sanguine porte et est détoxifié en urée dans le foie (Lobley et al., 1995). D’autre part, un excès d’AA absorbé sera aussi détoxifié par le foie en urée.
Une forte production hépatique d’urée résultera en une excrétion importante d’azote uréique urinaire. En effet, les résultats de Jonker et al. (1998) montrent que l’azote excrété dans l’urine (UN) est directement proportionnel au MUN (Figure 1.2.). De plus, le MUN est étroitement corrélé au taux d’urée sanguin (BUN), ce qui relie le tout au contenu en azote dans l’urine (Kohn et al., 2005). Cependant, le BUN peut varier d’une étude à l’autre en fonction de l’espèce animale étudiée (Kohn, 2007). Des concentrations BUN et MUN supérieures à 19-20 mg/dL ont amené des problèmes de fertilité chez les primipares, soit une diminution du taux de conception et du taux de gestation (Hammond, 1997).
L’efficacité d’utilisation de l’azote par la vache peut donc être estimée à partir du MUN. Les données de la littérature suggèrent qu’une bonne ration doit permettre une plage de MUN entre 10 et 16 mg N/dL (Block et al., 1998). Cependant, des experts de l’Université de Pennsylvanie ont révisés ces derniers et ont proposé des seuils entre 8 et 14 mg N/dL (Ishler, 2017).
En dessous de 8 mg N/dL, il n’y a pas assez d’azote disponible pour les microorganismes ou trop d’énergie pour la quantité d’azote disponible, ce qui limite la croissance. Au contraire, un MUN dépassant 14 mg N/dL indique que la ration contient trop d’azote, et que celui-ci est excrété et
13 gaspillé. Broderick (2003) montrent qu’en comparant deux rations avec des teneurs différentes en PB (15,1 à 18,4 %), le MUN est de 9,2 et 15,9 mg N/dL respectivement (P < 0,01). L’efficacité de conversion de l'azote alimentaire en lait sur l'azote ingéré (N lait/N ingéré) diminue également, passant de 0,303 à 0,239 respectivement (P < 0,01). Cela dit, plus l'azote ingéré augmente (% PB), plus le MUN augmente et l’efficacité de conversion de l'azote alimentaire en lait diminue. En conclusion, cette étude a montré que de passer de 15,1 à 18,4 % PB, résulte en une diminution de la protéine ingérée convertie en protéine du lait de 31 à 25 %, une augmentation de l’azote excrété dans l’urine de 23 à 35 %, et l'azote fécale passe de 45 à 41 % de la protéine ingérée respectivement (Broderick, 2003).
Figure 1.2. Relation entre le taux d'urée du lait (MUN; mg/dl) et l'azote excrété dans l'urine (UN; g/j) : pente = 12,54 ± 0,24.
Tiré de Jonker et al., 1998.
1.2 Calculs des bilans
1.2.1 Bilan total azoté chez la vache laitière
Le bilan total en azote permet d’évaluer l'efficacité de l'utilisation de l'azote et l’utilisation ou la déposition de la masse corporelle azotée. Il met en relation l'azote ingéré et l’azote excrété (urine, fèces, lait), l’azote retenu étant calculé par la différence entre l’azote ingéré (I), et l’azote excrété dans le lait (L), les fèces (F), et l’urine (U; équation (4)), tandis que l’azote digéré est la différence entre I et F (aussi appelée la digestibilité apparente car ne prend pas en compte les sécrétions endogènes) (équation (6)).
14
𝐷𝑖𝑔𝑒𝑠𝑡𝑖𝑏𝑖𝑙𝑖𝑡é 𝑎𝑝𝑝𝑎𝑟𝑒𝑛𝑡𝑒 (𝑔 𝑁/𝑗) = 𝐼 − 𝐹 (5)
𝐷𝑖𝑔𝑒𝑠𝑡𝑖𝑏𝑖𝑙𝑖𝑡é 𝑑𝑒 𝑙′𝑎𝑧𝑜𝑡𝑒 % =
𝐼−𝐹𝐼×
100 (6)Lors de la mesure du bilan chez la vache laitière, il faut aussi tenir compte de l’azote sécrété dans le lait, c’est pourquoi le lait est pris en compte dans l’équation (4). Lorsque le bilan en azote est négatif, cela correspond à une quantité d’azote excrété supérieur à l’azote ingéré, ce qui indique une utilisation des réserves corporelles et peut avoir des conséquences négatives sur le métabolisme, tandis qu’un bilan positif est associé à une quantité d’azote ingéré plus élevé qu’excrété et indique une augmentation de la masse protéique corporelle. Des bilans négatifs sont surtout observés en début de lactation, lorsque la vache puise un maximum de nutriments pour combler les besoins de la lactation (Rémond et al., 1978).
1.2.2 Excrétion azotée urinaire et fécale
L’étude de Castillo et al. (2000) a démontré qu’environ 72 % de l’azote ingéré était excrété dans les fèces et l’urine. Au Québec, avec les 297 000 vaches inscrites au contrôle Valacta (2013), environ 26,5 % de l’azote ingéré se retrouvait dans le lait, tandis que 73,5 % était excrété dans l’urine et les fèces (Lapierre et al., 2015). Ce dernier pourcentage représenterait plus de 12 000 tonnes d’azote excrété par année. En général, on peut noter des pertes azotées plus importantes dans l’urine que dans les fèces, et que les pertes via l’urine ont un plus grand impact sur l’environnement que les fèces.
L'estimation de l'excrétion azotée est utile pour mesurer le statut protéique chez la vache en lactation (Lapierre et al., 2002). La quantité d’azote excrétée dépend grandement de l’azote ingéré (Castillo et al., 2000). Il a été démontré que si l’azote ingéré est supérieur à 400 g N/jour chez la vache laitière, une relation linéaire positive entre l’azote ingéré et l’azote excrété dans l’urine, les fèces et le lait est observé (Castillo et al., 2000). Des collectes totales ou ponctuelles d’urine et de fèces peuvent être effectuées (Benchaar et al., 2013). Les collectes totales sont cependant très laborieuses sur le terrain et demandent un suivi pointilleux. La technique peut être difficile à effectuer dans certaines conditions d’élevage (par exemple au pâturage), et crée un inconfort suite à l’implantation des entonnoirs sur la vulve ou de cathéters urinaires. Les entonnoirs doivent être ajustés, et peuvent occasionner des pertes ou être contaminés par les fèces tandis que les cathéters peuvent créer des infections. L’utilisation de la créatinine afin d’estimer
15 le volume urinaire qui a été discuté dans la section précédente s’avère une méthode alternative intéressante (Chen et Gomes, 1992).
La méthode de Kjeldahl est une des principales techniques utilisées pour déterminer le taux d’azote d’échantillons, comme les aliments, les fèces et l’urine (PanReac AppliChem, 2017). Elle consiste à obtenir une minéralisation suite à la dégradation de la matière organique en sels d’ammonium grâce à un catalyseur et de l’acide sulfurique à haute température (420°C). Les sels sont transformés en ions ammonium NH4+ et se volatilisent en ammoniac suite à l’ajout de soude.
La vapeur d’ammoniac condense et s’ajoute à une solution contenant du rouge de méthyle, un indicateur coloré, et de l’acide borique. L’acide borique retient l’ammoniac sous forme acide et puis sera titré par de l’acide chlorhydrique ou sulfurique, jusqu’à ce que la solution vire au rouge. Les résultats permettent d’obtenir le pourcentage d’azote de l’échantillon (PanReac AppliChem, 2017).
L’analyse de l’azote peut aussi être effectuée par combustion complète (LECO, 2016). La procédure consiste à bruler les échantillons à une forte température (900°C) en présence d’oxygène pour permettre la libération de CO2, H2O et N2. Ensuite, le passage à travers un tube
permet l’absorption de CO2 et H2O pour ainsi conduire le N2 à travers une colonne contenant un
détecteur thermal de conductivité pour le séparer du CO2 et H2O restant (LECO, 2016). Le
contenu peut ensuite être multiplié par un facteur de conversion pour obtenir le contenu en PB de l’échantillon désiré. Selon Etheridge et al. (1998), la méthode de Kjeldahl peut être remplacée par la méthode de combustion complète en nutrition animale pour les analyses de l’azote en laboratoire. Les réactifs utilisés pour la combustion complète seraient plus puissants, demandent moins de travail et la forte température de la combustion est plus efficace pour libérer l’azote des échantillons (Etheridge et al., 1998).
1.2.2.1 Azote urinaire
L’évaluation de l’effet d’une teneur de 210 g PB/kg MS et 290 g PB/kg MS sur l’azote urinaire a été évalué dans l’étude de Castillo et al. (2000) afin de calculer le bilan azoté chez des vaches laitières. L’augmentation de la PB a eu pour conséquence d’augmenter l’excrétion d’azote dans l’urine de 74 g N/jour (P < 0,001). Il a été observé dans cette même étude qu’en augmentant la dégradabilité (PDR) de la PB, l’azote excrété dans l’urine augmente également (P = 0,001). Ces résultats sont d’ailleurs observés dans d’autres études lorsqu’on augmente la PB et la
16
dégradabilité de PB dans la ration (Devant et al., 2000). En observant les conclusions de Marini et al. (2005), on remarque que l’azote urinaire augmente en fonction du % PB dans la ration, et que l’azote sous forme d’urée augmente considérablement suite à ce changement (effet linéaire; P < 0,001). Ainsi à des ingestions élevées de PB, l’azote excrété dans l’urine est principalement sous forme d’urée (Broderick, 2003; Marini et al., 2005).
1.2.2.2 Azote fécal
L’azote fécal est, proportionnellement, beaucoup plus stable que l’azote urinaire. Toutefois, l’azote des fèces peut s’élever lorsque la ration contient une forte teneur en amidon. Une importante quantité d’amidon dans l’alimentation échappe à la dégradation ruminale et à la digestion intestinale, stimulant la fermentation et la synthèse de protéines microbiennes dans le caecum, ce qui fait augmenter l’azote microbien excrété dans les fèces (Hassanat, 2009). Comme pour la détermination de l’excrétion urinaire, l’estimation de l’azote fécal demande une estimation du poids des fèces excrétées et la composition en azote de ces fèces. Le poids des fèces peut être obtenu par collecte totale ou estimé indirectement en utilisant un marqueur indigestible comme la fibre NDF indigestible (iNDF).
1.2.2.2.1 Détermination de la fibre indigestible iNDF pour estimer l’excrétion fécale
Des marqueurs internes, i.e. inhérents à la ration, peuvent être utilisés pour déterminer le volume de fèces excrété par jour, et par la suite l’excrétion fécale azotée. Pour vérifier si un composé possède les caractéristiques d’un marqueur interne idéal pour cette estimation, la récupération du composé après une incubation prolongée dans le rumen doit être effectué (Sampaio et al., 2011). Le marqueur doit également être récupérable à long terme dans les fèces (Sampaio et al., 2011). La iNDF est considéré comme un marqueur interne idéal (Van Soest, 1994), puisque sa digestibilité est égale à zéro pour beaucoup d'aliments (Krizsan et Huhtanen, 2013). La iNDF est un marqueur interne représentant en quelque sorte la quantité de matière sèche qui ne sera pas ni dégradé ni digéré, et ce même après une période d’incubation très longue (Krizsan et Huhtanen, 2013). Elle peut être utilisé comme facteur pour estimer la quantité de fèces excrétées, ce qui permettra d’estimer l’excrétion azotée fécale à partir du pourcentage d’azote déterminé par l’analyse du contenu en azote des fèces.
Afin de déterminer le iNDF des échantillons, on fait subir à l’aliment et les fèces une très longue dégradation ruminale. L’incubation d’aliments in situ ou in vitro peuvent être effectué pour
17 évaluer ce point. La méthode choisie dépend toutefois des objectifs de l’étude. L'étude de Varel et Kreikemeier (1995) effectue une comparaison des deux méthodes en déterminant la dégradation cinétique de la fibre NDF pour les mêmes temps d’incubation. La méthode in vitro suit la technique traditionnelle de Goering et Van Soest (1970), soit avec un inoculum de fluide ruminal (20 %) et une solution tampon. Les conclusions de Varel et Kreikemeier (1995) montrent que la méthode in vitro présente des temps de latences des bactéries plus longs et une dégradation plus lente de la NDF (P < 0,01). Ceci peut être expliqué par la quantité inférieure de microorganismes dans l'inoculum, comparativement à la quantité retrouvée dans le rumen. Pour Huhtanen et al. (1994), les récupérations fécales de la iNDF et iADF sont plus acceptables lors de l’incubation in situ de 288-h que la méthode in vitro dans du fluide ruminal à 96-h.
Le temps d’incubation, la grosseur des particules ainsi que la grosseur de pores des sachets à incuber sont des facteurs important lors de la détermination de la quantité de marqueur interne iNDF après l’incubation. La détermination de la quantité de fibre iNDF d’aliments suite à une incubation de 288-h in situ semble être un meilleur indicateur que d’autres temps d’incubation plus courts (Huhtanen et al., 2006; Krizsan et Huhtanen, 2013; Krizsan et al., 2015). Le NorFor (Nordic Feed evaluation system) recommande en 2007 une incubation in situ de 288-h, avec une grosseur de pores de 12 µm pour les sachets (Saatifil PES 12/6) et une grosseur de particules de 2-mm pour obtenir de meilleurs résultats. Ces recommandations ont ensuite été améliorées par Åkerlind et al. en 2011. Selon ces derniers, une grosseur de pores se situant dans un intervalle entre 10 et 15 µm est idéale.
Krizsan et Huhtanen (2013) présentent des résultats d’incubation d’aliments pour une période de 288 heures et une quantité de concentrés plus faible dans la ration (190 g/kg MS vs 625 g/kg MS) (Figure 1.3.). En effet, plus le temps d’incubation est long, plus la concentration finale en iNDF est stable, car la fibre digestible NDF est épuisée à son maximum. De plus, les facteurs extrinsèques comme la quantité de concentrés distribué peuvent affecter la digestibilité des parois par les microorganismes (Krizsan et Huhtanen, 2013). Une ration plus riche en concentrés diminue le pH du milieu ruminal, affectant les bactéries fibrolytiques et les protozoaires. Cela dit, une diminution de la digestion de la fibre NDF peut erroner la concentration finale en iNDF, puisque la fibre NDF ne sera pas totalement dégradée suite à la diminution de la flore
18
fibrolytique. Il est donc suggéré dans cet article d’avoir un temps d’incubation très long (288 heures) avec une quantité raisonnable de concentrés pour ne pas affecter la flore fibrolytique.
Figure 1.3. Effet de la variation du temps d’incubation (144. 216 et 288 h) sur la concentration en NDF indigestible (iNDF) pour tous les ingrédients incubés chez des vaches consommant une quantité faible (190 g/kg MS), modéré (421 g/kg MS) et élevé (625 g/kg MS) en concentrés. Chaque colonne représente la quantité réelle en iNDF de l’étude. Erreur-type = 1,2 g/kg MS.
Adapté de Krizsan et Huhtanen, 2013. La quantité de iNDF retrouvée après incubation dépend aussi de la grosseur de pores des sachets utilisés. Huhtanen et al. (1994) comparent des pores de 41-µm et 6-µm pour une incubation de fèces de 288-h in situ. Les sachets de 41-µm ont eu de faibles récupérations de fèces à la fin de l’incubation, étant donné que les pores sont plus gros. L’étude de Krizsan et al. (2015) compare des grosseurs de particules d’aliments de 0,8 mm et 2,0 mm avec des grosseurs de pores de sachets de 6, 11, 12 et 17 µm, (12 µm : Saatifil (PES 12/6), autres pores : SEFAR). Les particules de 0,8 mm sont moins récupérées à la fin du temps d'incubation que celles de 2-mm, peu importe la grosseur de pores des sachets. Ces propos permettent d’arriver à la conclusion que la taille des particules de 2-mm est mieux adaptée pour ce type d’expérience.
1.2.2.2.2 Estimation de l’azote fécale à partir de la fibre iNDF
En déterminant la fibre iNDF de chaque aliment de la ration et des fèces avec la méthode des sachets incubés, la quantité de fèces produite par jour peut être estimée. L’estimation de la quantité de fèces permet de calculer le nombre de grammes d’azote excrété dans les fèces suite à l’analyse du pourcentage d’azote avec la méthode de Kjeldahl. L’azote fécal (g/j) pourra ensuite être utilisé comme sortie de l’azote pour le calcul du bilan azoté. En connaissant l’ingestion de matière sèche, le pourcentage de iNDF des aliments (RTM et foin) et en supposant que l’iNDF
19 ingéré dans les aliments est la même dans les fèces, on peut déterminer la quantité de fèces produites par jour. Un exemple de calcul est présenté ci-dessous.
Exemple de calcul :
Pour une vache recevant une ration à base d’ensilage d’herbe et de tourteau de soya, le pourcentage de iNDF a été déterminé avec la méthode d’incubation de sachets in situ pour 288 heures.
RTM consommée = 18,89 kg MS/jour Foin consommé = 0,88 kg MS/jour
% iNDF de la RTM (calculée séparément pour chacun des aliments) = 8,90 % iNDF % iNDF du foin = 20,16 % iNDF
% iNDF fèces = 25,15 % iNDF % N total fèces (Kjeldahl) = 2,75 % N
1- Calcul de la consommation du nombre de kg iNDF/j de la RTM et du foin (base MS) :
Si la RTM contient 8,90 % de iNDF et que la vache consomme 18,89 kg MS/j de RTM, alors : 8,90 % iNDF
100 % iNDF =
1,68 kg MS j!!
18,89 kg MS j!!
Si le foin contient 20,16 % de iNDF et que la vache consomme 0,88 kg MS/j de foin, alors : 20,16 % iNDF
100 % iNDF =
0,18 kg MS j!!
0,88 kg MS j!!
Le total consommé kg iNDF/jour (RTM + foin) =
1,68 kg MS/j (RTM) + 0,18 kg MS/j (foin) = 1,86 kg iNDF/j (base MS)
2- Estimation de la production de fèces (kg/j) :
Si les fèces contiennent 25,15 % de iNDF et en supposant que la iNDF des aliments est la même retrouvée dans les fèces, alors :
25,15 % iNDF 100 % iNDF =
1,86 kg MS j!!
20
La vache a produit 7,40 kg fèces/j (base MS). 3- Calcul de la quantité d’azote excrété dans les fèces (g/j) :
Si la vache produit 7,40 kg fèces /j (base MS) et que l’azote totale des fèces est 2,75% avec la méthode de Kjeldahl, alors :
2,75 % N total 100 % N total =
0,203 kg N 7,40 kg fèces j!!
La vache excrète 203 g N/j dans ses fèces. Ce résultat est utilisé comme sortie d’azote fécal dans le calcul du bilan azoté.
1.2.3 Bilan net des tissus
Le bilan net d’un tissu estime la différence entre la sortie et l’entrée d’un nutriment dans le tissu étudié. Ce calcul est basé sur les différences véno-artérielles des nutriments multipliées par le débit plasmatique respectif pour chaque tissu (Lapierre et al., 2002). Ainsi, un bilan net négatif représente la quantité « utilisée » par le tissu, tandis qu’un bilan net positif est la quantité produite ou « relâchée » par le tissu en question.
Le bilan net hépatique, des tissus drainés par la veine porte et de la glande mammaire permet d’évaluer la quantité de nutriments azotés extraite ou émise par le foie, les tissus drainés par la veine porte ou la glande mammaire, respectivement, par unité de temps, habituellement exprimé en mmol/h (équation 7 et 8). Le bilan net splanchnique représente l’approvisionnement post-hépatique net du métabolite étudié (équation 9).
𝐻𝐸𝑃 = ( H ×dsp) – ( P ×dpp + ([A]×dpa)) (7)
𝑇𝐷𝑉𝑃 = P − A × 𝑑𝑝𝑝 (8)
𝑇𝑆𝑃 = H − A × 𝑑𝑝𝑠 (9)
21 Où HEP = Bilan net hépatique (mmol/h)
TDVP = Bilan net des tissus drainés par la veine porte (mmol/h) GM = Bilan net de la glande mammaire (mmol/h)
[H] = concentration hépatique du métabolite (mmol/L) [P] = concentration portale du métabolite (mmol/L) [A] = concentration artérielle du métabolite (mmol/L)
(A - V)(Phe+Tyr) = différence véno-artérielle de la Phe et Tyr (mmol/L)
dps = débit plasmatique splanchnique (L/h) dpp = débit plasmatique portal (L/h) dpa = débit plasmatique artériel (L/h) dpm = débit plasmatique mammaire (L/h)
Les bilans nets peuvent être calculés en fixant des cathéters chroniques permettant de prélever du sang en amont et en aval du tissu étudié. L’implantation de trois cathéters est nécessaire pour calculer HEP, TDVP et TSP, aux sites artériel (A), portal (VP) et sus-hépatiques (VSH). Ces cathéters sont implantés par chirurgie (Huntington, 1989). Par contre, comme la veine mammaire est facile d’accès et vu la difficulté d’y maintenir un cathéter permanent, les prélèvements mammaires sont faits par veni-puncture, en alternant le côté du prélèvement à chaque temps. Cette technique nous permet de mesurer la concentration en métabolites dans les vaisseaux ainsi que les débits sanguins et plasmatiques afférents et efférents du compartiment tissulaire ciblé.
1.2.3.1 Mesure des débits plasmatiques des tissus splanchniques et mammaire
Deux techniques peuvent être utilisées pour mesurer les débits plasmatiques du tissu splanchnique : 1) par dilution d’un marqueur et mesure de sa concentration (e.g. acide para-amino-hippurique (PAH)) et 2) par débitmétrie ultrasonique, impliquant l’implantation d’une sonde ultrasonique autour du vaisseau afférent ou efférent du tissu étudié. Une troisième méthode est possible pour le débit plasmatique de la glande mammaire, soit le principe de Fick.
1.2.3.1.1 Méthode de dosage par acide para aminohippurique (PAH)
La principale méthode de dilution utilisée pour mesurer les débits sanguins des TSP est la perfusion du PAH dans une ou 2 petites veines mésentériques, avec prélèvement sanguin en amont et en aval du site de perfusion. Plusieurs modes de déprotéinisation et techniques d’analyse de l’échantillon sanguin ont été testés, par exemple soit en milieu basique, acide ou par