IMPACT DE LA CONCENTRATION EN PEPTIDES D’UN
HYDROLYSAT DE CRABE DES NEIGES SUR LEUR SEPARATION
ET LEUR SELECTIVITÉ EN COURS D’ELECTRODYALYSE AVEC
MEMBRANE D’ULTRAFILTRATION (EDUF)
Mémoire
Victoire Yolande Koumfieg Noudou
Maîtrise en sciences et technologie des aliments
Maître ès sciences (M. Sc.)
Québec, Canada
IMPACT DE LA CONCENTRATION EN PEPTIDES D’UN
HYDROLYSAT DE CRABE DES NEIGES SUR LEUR SEPARATION
ET LEUR SELECTIVITÉ EN COURS D’ELECTRODYALYSE AVEC
MEMBRANE D’ULTRAFILTRATION (EDUF)
Mémoire
Victoire Yolande Koumfieg Noudou
Sous la direction de :
Jean Amiot, directeur de recherche Laurent Bazinet, codirecteur de recherche
iii
RÉSUMÉ
Les produits fonctionnels et nutraceutiques ont pris une grande importance en raison de leur valeur ajoutée. Leur production requiert l’isolation et la concentration des composés tels que les acides aminés et les peptides bioactifs des hydrolysats de protéines. A cette fin, l’EDUF (Électrodialyse combinée à l’ultrafiltration), une nouvelle technique de séparation, a été proposée. Les paramètres importants pour optimiser le procédé tels que la force du champ électrique, le type de membrane, le seuil de coupure, le pH, la configuration du module, le débit de la solution et la surface effective de la membrane ont déjà été étudiés. Cependant, le paramètre concentration de l’hydrolysat n’a encore jamais été étudié. Le projet consistait à évaluer l’impact de l’augmentation de la concentration d’un hydrolysat de crabe des neiges sur la sélectivité et le taux de séparation des peptides anioniques et cationiques, ainsi que sur leur activité antimicrobienne. Pour évaluer l’impact de la concentration de l’hydrolysat, quatre valeurs de concentration en protéines (0.5%, 1%, 2% et 4%) ont été étudiées et les autres paramètres (pH, conductivité, différence de potentiel) du système ont été constants. Les résultats ont montré que l’augmentation de la concentration a un effet sur le taux de séparation des peptides et que le plus haut taux de concentration peptidique a été observé à 4% pour le compartiment anionique à 291.9 µg/mL et pour le compartiment cationique à 431.87 µg/mL. Par contre, l’augmentation de la concentration n’a pas d’effet sur la sélectivité qui reste sans changement. Le taux de migration a augmenté avec l’augmentation de la concentration alors qu’en parallèle l’énergie relative consommée baissait. Le plus haut taux de migration a ainsi été observé à 4% (16.2 g/m2.h et 7.8 g/m2.h respectivement, pour les
compartiments cationique et anionique) avec une énergie relative consommée de 3.53 Wh/g. Les résultats ont aussi montré que l’augmentation de la concentration en peptides n’a eu aucun impact sur le colmatage et l’intégrité des membranes. Les différentes fractions (anionique et cationique) obtenues et l’hydrolysat initial testés et n’ont pas montré d’activité antimicrobienne contre Micrococcus luteus.
iv
ABSTRACT
The importance of functional and nutraceutical products has grown tremendously due to their added value. Their production requires the isolation and concentration of compounds, such as amino acids and bioactive peptides from protein hydrolysates. Therefore, a new separation technique EDUF (electrodialysis with ultrafiltration) was used. To optimize the process, important parameters such as electric field strength, membrane material and molecular weight cut-off, pH, ionic strength and flow rate of the solutions as well as cell configuration have already been studied, except for the initial peptide concentration in the feed solution. The objective of this study was to determine the impact of peptides concentration of snow crab by-product hydrolysate on selectivity and separation rate of anionic and cationic peptides, and on their antimicrobial activity. To assess the impact of peptides concentration, four values of protein concentrations (0.5%; 1%; 2% and 4%) were studied with other parameters (pH, conductivity, potential difference) of the system kept constant. The results showed that increasing the peptides concentration has an effect on separation rate of the peptides. The highest rate was observed at 4% with 291.9 mg/mL and 431.87 mg/mL peptide concentration, respectively for the anionic and cationic compartment. Other results also showed that increasing the initial concentration has no effect on selectivity. The migration rate increased linearly with increasing feed solution concentration while the relative energy consumption decreased with increasing feed solution concentration. The highest migration rates of 16.2 g/m2.h and 7.8 g/m2.h for the cationic and anionic compartments respectively were
observed at 4%, with relative energy consumption of 3.53 Wh/g. However, increasing the concentration had no effect on the fouling and membrane integrity. In terms of antimicrobial activity, different fractions (anionic and cationic) and the initial hydrolysate were tested and did not showed antimicrobial activity on Micrococcus luteus.
v
TABLE DES MATIERES
RÉSUMÉ ... iii
ABSTRACT ... iv
TABLE DES MATIERES ... v
LISTE DES TABLEAUX ... viii
LISTE DES FIGURES ... ix
AVANT PROPOS ... xii
Chapitre 1 : INTRODUCTION ... 1
Chapitre 2 : REVUE DE LITTERATURE ... 5
2.1. Production de crabe des neiges et sous-produits ... 5
2.1.1 Valorisation des résidus de crabe des neiges ... 6
2.1.2 Valorisation des coproduits de crabe des neiges ... 7
2.2. Peptides bioactifs ... 11
2.2.1 Peptides Anti cancer ... 13
2.2.1.1 Mode d’action ... 13
2.2.2 Peptides Antimicrobiens ... 14
2.2.2.1 Mode d’action des peptides antimicrobiens ... 16
2.3. Procédés de fractionnement des peptides bioactifs ... 20
2.4. Procédés EDUF et paramètres liés à l’efficacité du procédé ... 22
2.4.1 EDUF ... 22
2.4.2 Paramètres liés à l’efficacité des procédés électromembranaires. ... 25
HYPOTHÈSE ET OBJECTIFS ... 27
Chapitre 3 : Impact de la concentration en peptides anioniques et cationiques sur leur taux de migration et la sélectivité en cours d’électroseparation simultanée... 29
vi
3.1. Résumé ... 29
3.2. Abstract ... 30
3.3. Introduction ... 31
3.4. Materials and method ... 32
3.4.1 Materials and ED cell ... 32
3.4.1.1 Hydrolysate of snow crab by products ... 32
3.4.1.2 Chemicals ... 33
3.4.1.3 Membranes ... 33
3.4.1.4 Electrodialysis cell configuration ... 33
3.4.1.5 Protocol ... 34
3.4.2 Analytical methods ... 35
3.4.2.1 Peptide concentration ... 35
3.4.2.2 Peptide migration rate ... 35
3.4.2.3 Total amino acid Analysis ... 36
3.4.2.4 Relative energy consumption ... 36
3.4.2.5 In situ membrane resistance ... 36
3.4.2.6 Membrane electrical conductivity and thickness ... 37
3.4.2.7 Statistical Analysis ... 37
3.5. Results and discussion ... 38
3.5.1 Effect on peptide migration rate and selectivity ... 38
3.5.1.1 Peptide concentration ... 38
3.5.1.2 Amino acid analysis ... 41
3.5.2 Electrodialytic parameters: relative energy consumption ... 44
3.5.3 Membrane fouling and integrity ... 46
vii
3.5.3.2 Membrane electrical conductivity ... 49
3.6. Conclusion ... 51
3.7. Acknowledgements ... 51
Chapitre 4 : Détermination de l’activité antimicrobienne des différentes fractions peptidiques ... 53
4.1. Introduction ... 53
4.2. Matériel et méthodes ... 53
4.2.1 Matériel ... 53
4.2.2 Méthodes ... 54
4.2.2.1 Préparation des cultures bactériennes ... 54
4.2.2.2 Préparation de la microplaque ... 54
4.3. Résultats ... 55
Chapitre 5 : DISCUSSION GÉNÉRALE ... 58
Chapitre 6 : CONCLUSION GÉNÉRALE ... 61
viii
LISTE DES TABLEAUX
ix
LISTE DES FIGURES
Figure 1: Distribution du crabe des neiges
Figure 2: Proportion des différentes voies de valorisation des coproduits d’origine marine Figure 3: Différentes technologies de valorisation des ressources marines
Figure 4: Procédé d’obtention d’un hydrolysat de crabe des neiges Figure 5: Mode d’action des peptides anti cancer.
Figure 6: Mécanismes d’action de peptides antimicrobiens
Figure 7: Schéma illustrant le mécanisme de perméabilisation membranaire des peptides antimicrobien en hélice α
Figure 8: Schéma synoptique des différents procédés de fractionnement des peptides bioactifs
Figure 9 : Configuration de la séparation simultanée des peptides anioniques et cationiques par EDUF
Figure 10 : Configuration de la cellule d’électrodialyse avec membrane d’ultrafiltration Figure 11 : Évolution de la concentration en peptides en fonction du temps des fractions anioniques et cationiques
Figure 12 : Évolution du taux de migration en fonction de la concentration en protéine dans les fractions anioniques et cationiques
Figure 13 : Abondance (%) des différents acides aminés contenus dans l’hydrolysat initial et les fractions anioniques et cationiques
Figure 14 : Évolution de l’énergie relative de consommation en fonction de la concentration en protéines dans la solution d’alimentation après traitement EDUF Figure 15 : Évolution des résistances des membranes AEM, CEM, UFM1 et UFM2 en fonction du temps
Figure 16 : Conductivités des différentes membranes AEM, CEM, UFM1 et UFM2 avant et après traitement EDUF
Figure 17 : Épaisseur des différentes membranes AEM, CEM, UFM1 et UFM2 avant et après traitement EDUF
x
Figure 18 : Détermination de l’activité antimicrobienne des hydrolysats et différentes fraction en fonction du temps
xi
A mes parents, mes frères et sœurs, tante et à tous mes amis pour leur soutien infaillible.
xii
AVANT PROPOS
Les travaux de cette maîtrise portant sur l’impact de la concentration en peptides d’un hydrolysat de crabe des neiges sur la sélectivité et le taux de séparation des peptides acides et basiques en cours d’EDUF ainsi que sur leur activité antimicrobienne ont été réalisés dans le cadre d'un projet de recherche financé par le Fond québécois de la recherche sur la nature et les technologies (FQRNT).
Ce mémoire est divisé en quatre chapitres. Les chapitres 1 et 2 présentent respectivement l'introduction générale et la revue de littérature où sont présentés l’hydrolysat de crabe des neiges, les peptides bioactifs, les différents procédés utilisés pour l’extraction des peptides bioactifs et le procédé d'électrodialyse avec membrane d'ultrafiltration (EDUF). Le chapitre 3 a été rédigé sous forme d'article et décrit les travaux réalisés et les résultats obtenus. Il est rédigé en anglais et s'intitule «Impact of peptide concentration on their migration rate and selectivity during simultaneous electroseparation of anionic and cationic peptides ». Les chapitres 4,5 et 6 présentent respectivement la détermination de l’activité antimicrobienne, la discussion générale et la conclusion générale.
Madame Victoire Yolande NOUDOU est l'auteure principale de l’article inséré dans ce mémoire et de toutes les autres parties le constituant. Les Drs Jean Amiot et Laurent Bazinet, respectivement directeur et co-directeur ont supervisé ce travail de recherche. Leur soutien, leur contribution et leur ouverture d’esprit ont été d'une aide précieuse pour l'élaboration du travail, le traitement des données et la correction de l’article et du mémoire. Je les remercie aussi pour m'avoir fait confiance et m'avoir confié la réalisation de ce projet très intéressant. Puisqu'il s'agit d'un projet multidisciplinaire, les co-auteurs de l’article sont les Drs Laurent Bazinet et Lucie Beaulieu.
Je tiens à remercier les professionnels de recherche Jacinthe Thibodeau et Diane Gagnon pour leur aide technique et aussi toute l’équipe de recherche de Laurent Bazinet.
Chapitre 1
1
Chapitre 1 : INTRODUCTION
L’industrie des produits marins génère des milliers de tonnes de produits alimentaires, particulièrement celle du crabe des neiges qui est l’une des pêches les plus prospères du canada (Beaulieu et al., 2009). Cette production génère beaucoup de coproduits (déchets) qui, utilisés comme engrais ou rejetés directement dans l’environnement, représentent des risques pour la santé et la pollution. Cependant, ces coproduits renferment des substances méritant d’être valorisées en fonction des différentes sources naturelles et leurs constituants tels que les protéines. Ces coproduits représentent une source potentielle d’acides aminés essentiels et de peptides à activité biologiques. A ce sujet, une forte tendance existe pour la production des produits fonctionnels et nutraceutiquescontenant des peptides bioactifs à cause de leur impact sur la santé humaine et la prévention de certaines maladies associée à diverses activités biologiques. Des propriétés telles qu’anti cancer, antimicrobienne, anti hypertensive ou opioïde ont ainsi été démontrées. Par conséquent, la production et la caractérisation des propriétés des peptides bioactifs ont reçu un intérêt croissant ces dernières années (Bazinet et Firdaous, 2009) . Ils sont déjà utilisés dans plusieurs applications en industrie laitière, des jus, de la bière, du vin et des produits dérivés et aussi dans l’industrie pharmaceutique (Arzate, 2008).
Les industries alimentaires et bio-pharmaceutiques sont à la recherche de processus qui permettent la production de ces types de produits à partir de diverses sources naturelles, telles que soya, β-Lactoglobuline, crabe des neiges et d’autres produits marins. L’hydrolyse enzymatique est l’approche la plus utilisée pour libérer ces peptides de leur structure protéique. Compte tenu que la plupart des peptides fonctionnels sont alors présents dans des mélanges complexes contenant un grand nombre de fractions, ils doivent être séparés et purifiés (Ayoa Fernández, Francisco A. Riera, 2012). Les procédés de séparation utilisés pour l’obtention des peptides bioactifs sont en général appréciés pour leur faible consommation énergétique et leur bonne sélectivité (Garem et al., 1996). Les méthodes de séparation de peptides sont nombreuses mais ne s’appliquent pas toutes. Par exemple lachromatographie liquide ou d’échange d'ions, les technologies
2
de filtration sur gel et de précipitation sélective permettent une séparation efficace des peptides mais sont soit peu applicables à l’échelle industrielle ou soit très onéreuses (Bargeman et al., 2002). À l’inverse, les procédés baromembranaires (ultrafiltration, nano filtration, etc.) sont des méthodes simples et peu coûteuses qui souffrent toutefois d’un manque de sélectivité (Ayoa Fernández et Francisco A. Riera, 2012).
Pour pallier ces inconvénients, un nouveau procédé représentant une alternative prometteuse a été mis au point par Bazinet et al. (2005) . Ce procédé utilise un module électrodialytique avec membranes d’ultrafiltration (EDUF). L’EDUF permet ainsi la migration des molécules par rapport à leurs charges et leur poids moléculaires. Plusieurs applications ont déjà été réalisées sur le thé vert (Labbé et al., 2005), sur un hydrolysat trypsique de β Lactoglobuline (Poulin et al., 2006), sur l’alfalfa (Firdaous et al., 2009), et sur l’hydrolysat de crabe des neiges (Doyen et al., 2011). L’efficacité d’un tel procédé pour séparer des peptides d’un hydrolysat dépend de paramètres electrodialytiques tels que la force du champ électrique, le type de membrane, le seuil de coupure, le pH, la configuration du module, le débit de la solution, la surface effective de la membrane et la concentration de la solution d’hydrolysat qui sont tout aussi importants sur l’efficacité du procédé que sur la sélectivité et le taux de transport. Ces paramètres ont déjà été mis en évidence par de nombreux travaux qui ont été effectués sur le fractionnement des peptides par des procédés electromembranaires et membranaires (Lapointe et al., 2006 , Bargeman et al., 2002 ; Bargeman et al., 2002b ; Liu et al., 1997 ; Garem et al., 1996 ). En EDUF, le pH, la force du champ électrique, la configuration du module, le type de membranes et le seuil de coupure ont déjà été évalués par Poulin et al. (2007), Doyen et al. (2010), Shyam et al. (2014).
De nombreux travaux ont aussi mis en évidence les effets de la concentration de la solution d’hydrolysat de différentes types de solution d’alimentation dans les procédés electromembranaires (Garem et al., 1996 ; Van nunen, 1997 ; Bargeman et al., 2002; Ayoa Fernández, Francisco A. Riera, 2012). Par exemple, Bargeman et al. (2002) ont montré qu’en augmentant la concentration initiale d’hydrolysat de caséine αs2 de 2.5 fois,
cela entraine une augmentation de 2.1 fois le perméat avec le procédé d’électrofiltration. Van Nunen (1997) rapporte aussi une augmentation du flux de lipase associé à une
3
augmentation de la concentration de la solution d’alimentation. Il semble donc qu’une relation linéaire existe entre la concentration en hydrolysat et le taux de transport de peptide dans le perméat. Cependant d’autres travaux comme ceux d’Ayoa Fernández, Francisco A. Riera, (2012) ont montré une baisse de la sélectivité avec une augmentation de la concentration de la solution d’alimentation trypsique de β Lactoglobuline. Ces résultats ont montré qu’une augmentation de la concentration d’alimentation a entrainé une augmentation de la transmission des peptides anioniques alors que la transmission des ions chargés positivement a baissé.
Des travaux doivent donc être réalisés afin d’étudier l’impact de la concentration initiale en peptides d’un hydrolysat sur l’efficacité du procédé en EDUF. Un hydrolysat de crabe des neiges a été choisi car il a déjà fait l’objet de plusieurs études telles que celle de Suwal et al. (2014) et de Doyen et al. (2011 ; 2012) qui ont montré des activités antibactériennes et anticancéreuses dans l’hydrolysat de crabe des neiges.
Ce travail vise à évaluer l’impact de l’augmentation de la concentration en peptides d’un hydrolysat de crabe des neiges sur la sélectivité et le taux de séparation des peptides acides et basiques en cours d’EDUF ainsi que sur leur activité antimicrobienne. Ce travail fait partie d’un plus vaste projet qui vise à valoriser les coproduits résultant de la transformation du crabe des neiges.
Chapitre 2
5
Chapitre 2 : REVUE DE LITTERATURE
2.1. Production de crabe des neiges et sous-produits
Le crabe des neiges est, de loin, l’espèce de crabe la plus répandue sur la côte Est du Canada; il est pêché au Québec ainsi que dans les quatre provinces de l’Atlantique (Terre-neuve, Nouveau-Brunswick, Nouvelle-Ecosse, Île-du-Prince-Édouard) (Fig. 1). Le crabe des neiges (Chionoecetes opilio) constitue l’une des espèces les plus nobles parmi les ressources marines canadiennes et se classe parmi les produits haut de gamme, tant sur les marchés intérieurs qu’internationaux (MAPAQ, 2004). La pêche du crabe des neiges est l’une des plus lucratives dans l’est du Canada, les débarquements augmentant d’environ 25000 tonnes en 1990 à un peu plus de 93000 tonnes en 2000 (Aya Bouazza, 2009). En 2008, la valeur au débarquement pour l’ensemble de la région a atteint 356 millions de dollars, classant le crabe des neiges au deuxième rang derrière le homard (600 millions de dollars), et loin devant la crevette (258 millions de dollars).
De ce fait, l’industrie québécoise des produits marins génère des milliers de tonnes de produits alimentaires mais il en résulte une quantité considérable de résidus de transformation considérés souvent comme des déchets. Par exemple, l’exploitation de crabe des neiges génère d’importants volumes de produits commercialisables, soit 30% de la biomasse totale (Beaulieu et al, 2009). Cependant 30% de ce crustacé (corps, viscères, hépatopancréas, carapace, céphalothorax, l’hémolymphe ou liquide physiologique) sont ainsi considérés comme des résidus de transformation. Cela représente donc une perte pour les transformateurs qui, faute de solutions pour les valoriser, doivent soit payer pour enfouir ces déchets, soit les utiliser comme engrais ou en alimentation animale, ce qui implique un important problème environnemental et économique. De ce fait, des estimations récentes sur la pêche du crabe des neiges au Québec indiquent que les volumes globaux de transformation, d'environ 13 mille tonnes, génèrent près de 4 mille tonnes de résidus disponibles annuellement (MAPAQ, 2001).
6
Fig 1: Distribution du crabe des neiges (Chionoecetes opilio) (Ministère des pêches et des océans)
2.1.1 Valorisation des résidus de crabe des neiges
Appelés de plus en plus coproduits à cause de leurs propriétés remarquables (principes actifs, ingrédients fonctionnels, polymères, etc.), ces résidus peuvent être utilisés dans plusieurs domaines comme l’agroalimentaire, la santé ou l’environnement. Ces coproduits de crabe des neiges renferment des molécules valorisables notamment les protéines, acides aminés, lipides, minéraux, vitamines ainsi que des composés bioactifs (Kim et al, 2008) bénéfiques à la santé humaine. L’hépatopancréas et la carapace sont les principaux constituants des coproduits issus de la transformation du crabe des neiges. La composition chimique de l’hépatopancréas en fait une biomasse de choix pour une valorisation de ses protéines (7.9g/100g). Les coproduits de crabe des neiges ont récemment fait l’objet de plusieurs travaux de valorisation. A ce jour, diverses biomolécules à haute valeur ajoutée ont été identifiées telles que des enzymes
7
(collagénase), polysaccharides (chitine, chitosane), lipides (acides gras polyinsaturés, phospholipides), pigments, protéines, etc. (Aya Bouazza, 2009).
2.1.2 Valorisation des coproduits de crabe des neiges
Dans un contexte de sous-exploitation des ressources marines, la valorisation des biomasses de crustacés et poissons représente un enjeu de taille car elle doit intégrer le souci de la protection de l’environnement et du développement durable. Les nouvelles contraintes législatives et environnementales concernant la gestion de la ressource ont conduit notamment à considérer des voies de valorisation des résidus inutilisés lors des premières étapes de transformation. Afin d’augmenter leur rentabilité d’opération et de répondre aux exigences gouvernementales, les industries sont recherchent des voies de valorisation de leurs coproduits entiers, et ainsi développer et commercialiser de nouveaux produits sans produire d’effluents polluants (Aya Bouazza, 2009).
Selon le coproduit et procédé mis en œuvre pour le valoriser, une gamme très variée de produits dérivés peut être obtenue. Ces produits dérivés ont des volumes de production et des valeurs ajoutées très différentes et leurs applications sont larges. A partir d’un même type de coproduits, il est possible d’obtenir différents produits dérivés tels que farine, huile, hydrolysat, etc. (Dumay, 2006). Ces principales voies de valorisation des coproduits de la mer sont représentées à la Figure 2 :
8
Fig 2 : Proportions des différentes voies de valorisation des coproduits d’origine marine (Andrieux, 2004)
La valorisation de ces coproduits passe par diverses technologies (Fig. 3). La technologie la plus employée pour les coproduits de crabe des neiges est l’hydrolyse enzymatique. C’est une technique non agressive, sans utilisation de solvants et qui permet d’extraire les composés et de les fractionner ensuite en différentes fractions riches en biomolécules. La technique mise au point pour le crabe des neiges par Beaulieu et al. (2009), est décrite de la manière suivante :
L’hépatopancréas, le céphalothorax et les fluides biologiques du crabe des neiges sont broyés et ajoutés à de l’eau déminéralisée pour en faire une dilution 1:1; le volume final est chauffé à 40oC et 100g de protamex (enzyme commerciale) sont ajoutés pour
l’hydrolyse. Après 60 min d’hydrolyse à pH 8, la température est augmentée graduellement jusqu’à atteindre 85oC pour désactiver les protéases. Après hydrolyse, une
première décantation est effectuée à 3500g; le liquide issu de cette décantation est centrifugé avec une force centrifuge de 11000g afin de séparer les matières insolubles, les lipides et l’hydrolysat soluble. Ce dernier est ultrafiltré 2 fois (1kda) pour séparer les protéines et les peptides en fonction de leur poids moléculaire (50 et 1kda). Ensuite le
Proportions
Hydrolysat protéique (21%) Hachis congelés (23%) Aromes (1%)
Farine/Huile (52%)
Autres applications: gélatine, collagene (3%)
9
perméat est nano filtré puis traité dans un système d’osmose inverse. Les différentes fractions finales sont congelées à -20oC puis séchées (Fig. 4).
10
Fig. 4: Procédé d’obtention d’un hydrolysat de crabe des neiges (adapté de Beaulieu et al, 2009).
Coproduits decrabes des
neiges+ Eau Fraction Protamex Dilution (1:1) Hydrolyse enzymatique (40oC) Décantation (3500g) Fraction Centrifugation (11000g) Fraction Lipides Hydrolysat Ultrafiltration (1; 50kDa)
Nano filtration (>200Da) Osmose inverse (<200Da)
Congélation (-20oC)
Séchage
Eau
Hydrolysat decrabes des
11
2.2. Peptides bioactifs
Les peptides bioactifs sont définis comme des fragments de protéines spécifiques pouvant contenir généralement de 3 à 20 acides aminés , ayant un impact positif sur les fonctions de l’organisme et pouvant influer sur la santé car ils affectent de nombreux processus biologiques (Kitts et Weiler, 2003). En effet, les peptides sont des courts polymères d’acides aminés reliés par des liaisons peptidiques. L’intérêt de tels peptides est notamment relié au développement d’aliments fonctionnels capables de provoquer des effets physiologiques bénéfiques et aider à réduire le risque de maladies chroniques. Dans ce domaine, la plupart des travaux ont porté sur le lait et produits laitiers comme source de peptides bioactifs, mais l’intérêt d’autres sources de peptides continue de croitre. Diverses espèces de poissons (thon, saumon, etc.), des produits animaux (œufs, gélatine, etc.), les plantes (soja, etc.) et des animaux d’origine marines (crabe des neiges, etc.) ont été identifiés comme sources de peptides bioactifs (Rutherfurd-Markwick, Kay, 2012). Les peptides bioactifs provenant de diverses sources alimentaires ont montré diverses activités biologiques y compris anti hypertensive, antioxydante, anticancer et antimicrobienne comme le rapporte le tableau 1 ci-dessous. L’activité de ces peptides dépend de la composition et de la séquence d’acides aminés et de leur position spécifique dans la séquence.
12
Tableau 1: Protéines et peptides- Activité et sources
(Agriculture et agroalimentaire Canada, protéines et peptides bioactifs, essentiels fonctionnels et bénéfiques, août 2008)
Activité biologique Protéines et peptides (source) Hypotenseurs, peptides
inhibant l’ECA
Peptides de caséine et de lactosérum (lait de vache); ovalbumine (blanc d’œuf); peptides de muscles de poisson (bonite, saumon, sardine, thon); α-zéine (maïs), hydrolysats de protéines végétales (pois, pois chiche, soja, pomme de terre, graines de lin, lupin); peptides de porc et de poulet
Antimicrobien Lactoferrine et ses produits d’hydrolyse, lactoferricine (lait); β-lactoglobuline (lait); peptides de thionine (blé, orge, seigle et avoine); peptides de poisson (castor, saumon, poisson-chat et sole); avidine, ovalbumine, ovotransferrine, ovomucine, lysozyme (œuf)
Antioxydant Peptides de soja; peptides de protéines de pomme de terre hydrolysées; gélatine (peau de goberge de l’Alaska); hydrolysats de protéines de graines de lin
Anticancérigène α-lactalbumine, albumine sérique bovine (lait); peptides de lunasine (soja); ovomucine, lysozyme, cystatine et avidine (blanc d’œuf)
Antiobésité Protéines de soja, protéines et peptides de lactosérum, protéines et hydrolysats de pois
Santé cardiovasculaire (abaissement du cholestérol)
Protéines de soja, protéines de lupin
Immunomodulateur Oryzatensine (protéine de riz); immunoglobulines (lait et jaune d’œuf)
Séquestration des minéraux
13
Activité biologique Protéines et peptides (source) Opioïde
(régulation du système nerveux)
Gluten et gliadine (blé); β-casomorphines (lait)
Des peptides d’origine marine tels que ceux provenant du crabe des neiges ont été rapportés comme ayant des propriétés bioactives avec des degrés variables d’action tels que antimicrobien, anti cancer, etc. (Beaulieu et al, 2009).
2.2.1 Peptides Anti cancer
Les protéines, les peptides et les acides aminés ont été impliqués pour prévenir le développement de différents types de cancer. D’un point de vue structurel, la plupart des peptides anti cancer ont une conformation α-hélicoïdale ou en feuillet β, mais certaines structures étendues ont déjà été rapportées . Les mécanismes impliqués permettent soit l’inhibition de la protéase des cellules tumorales, l’atténuation de l’angiogenèse, l’arrêt du cycle cellulaire, l’induction de l’apoptose et l’immunostimulation.
2.2.1.1 Mode d’action
Les effets oncolytiques des peptides anti-cancer peuvent généralement se produire soit par des mécanismes membranolytiques ou non membranolytiques . Le mécanisme dépend des caractéristiques des peptides anti cancer ainsi que des caractéristiques de la membrane cible (Fig. 5). De ce fait, il existe trois modes d’action des peptides anti cancer:
1-Interaction avec l'angiogenèse : associés au développement des tumeurs, ils permettent de diminuer l'angiogenèse tumorale.
2- Cible intracellulaire : Les peptides anti cancer à l’intérieur de la cellule cancéreuse interagissent avec la mitochondrie (chargée négativement), ce qui engendre la lyse de la cellule et provoquera plusieurs composés stimulant l’apoptose
14
Fig 5: Mode d’action des peptides anti cancer incluant plusieurs phénomènes
2.2.2 Peptides Antimicrobiens
Les peptides antimicrobiens (PAM) sont des peptides de faible poids moléculaire (10kDa) à large spectre antimicrobien qui ont été identifiés dans une large variété de sources naturelles de microorganismes, d’animaux et de plantes. Ils présentent des effets inhibiteurs contre une large gamme d’agents pathogènes tels que des bactéries, des champignons et des virus . Les peptides antimicrobiens sont d’un grand intérêt pour leur application potentielle dans la conservation des aliments et à des fins thérapeutiques. Ils sont généralement chargés positivement et ont une séquence hydrophobe et hydrophile qui permet à la molécule d’être soluble dans les environnements aqueux et aussi entre les membranes riches en lipides. La majorité (80%) des peptides antimicrobiens cationiques sont des molécules importantes, entre autre pour l'immunité de tous les organismes vivants et en particulier pour la lutte contre l'invasion de pathogènes (Cyril Roblet, 2012). Les différentes caractéristiques structurales et la richesse remarquable en certains acides aminés sont la base de la classification actuelle des peptides antimicrobiens en quatre grands groupes de peptides antimicrobiens (Bulet et al., 2004) :
15
Les peptides cycliques riches en cystéines, à ponts disulfure ; Les peptides riches en acides aminés spécifiques ;
Les peptides contenant des acides aminés rares modifiés.
a) Les peptides cationiques linéaires formant une hélice α
Ils sont les plus étudiés du fait de leur structure simple qui facilite la synthèse et l’étude de leur mode d’action. Leur spectre d’activité est très large et s’étend sur les bactéries, les champignons, les protozoaires et certains sont hémolytiques ou cytotoxiques. Ces peptides sont caractérisés par leur taille (< 40 AA), leur caractère amphiphile marqué, leur charge, l’absence de résidus cystéine, leur structure tertiaire qui forme des nœuds ou articulations (Diamond et al.2009). En solution aqueuse, la plupart de ces peptides sont déstructurés, et c’est au contact de la membrane bactérienne, ou de milieux mimant les membranes, qu’ils prennent une conformation en hélice α amphipatique (Powers et al. 2003; Brogden 2005; Jenssen et al. 2006)
b) Les peptides cycliques riches en cystéines, à ponts disulfure
Ces peptides cycliques riches en cystéines représentent le 2ème grand groupe de peptides antimicrobiens et sont stabilisés par un ou plusieurs ponts disulfures intramoléculaires (Brogden 2005; Andres et al. 2007). Le nombre de ponts disulfures conditionne leur structure et leur activité. Ces ponts disulfures peuvent être établis entre des feuillets β, entres des structures mixtes α et β aussi appelées « open-ended », ou encore en épingle à cheveux « hairpin-like » (Bulet et al. 2004). Ces peptides sont généralement plus longs que les peptides en hélice α et peuvent ainsi adopter une grande variété de formes.
16
c) Les peptides riches en acides aminés spécifiques
Un troisième grand groupe rassemble des peptides linéaires dont les séquences primaires sont particulièrement dominées par un certain type d’acide aminé tels que l’arginine, le tryptophane, la phénylalanine, l’histidine, la glycine ou la proline et sont composés d’environ 44 résidus (Andres et al. 2007; Diamond et al. 2009). Contrairement aux peptides en hélice α décrits précédemment qui agissent par attaque de la membrane bactérienne, ces peptides agissent par inhibition de la synthèse des protéines.
d) Les peptides contenant des acides aminés rares modifiés
Ces peptides sont considérés comme non communs dans la mesure où ils sont composés d’acides aminés modifiés rares.
2.2.2.1 Mode d’action des peptides antimicrobiens
Chaque peptide antimicrobien possède un mode d’action qui lui est propre et dépendant de ses caractéristiques intrinsèques (charge, pI, hydrophobicité,...) mais il existe cependant des points communs permettant de mettre en avant certaines généralités. Le mode d'action des peptides antimicrobiens peut ainsi se diviser selon 3 étapes comprenant la fixation initiale (dépendante de la concentration du peptide et de sa capacité à s'auto structurer), l’intégration dans la membrane (dépendante de la conformation et de la capacité d'auto assemblage des peptides) puis l’aboutissement à la mort cellulaire (par un phénomène de pérméabilisation membranaire) (Daffre et al., 2008). La plupart des peptides antimicrobiens, semblent agir sur la membrane cytoplasmique des micro-organismes. Cette action directe sur la membrane entraîne la mort de la cellule par des phénomènes osmotiques rapides. Certains, cependant, agissent par inhibition de mécanismes intra cytoplasmiques tels que la synthèse d’ADN et ARN, la synthèse de protéines, des activités enzymatiques, ou encore par des perturbations dans
17
la formation des composants de la paroi (Jenssen et al., 2006). Leur spécificité d’action dépend de la nature de la bicouche lipidique des membranes biologiques (Diane D et al., 2010).
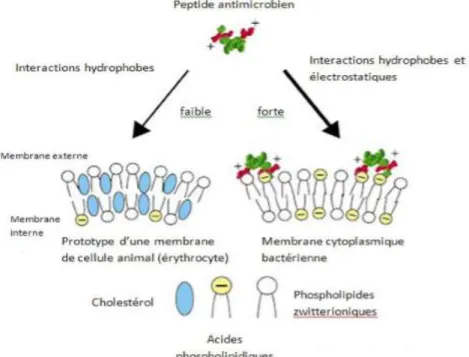
a) L’attraction
Le mécanisme d’action des peptides dépend en tout premier lieu de l’interaction du peptide avec la paroi bactérienne (Fig. 6). Cette attraction initiale se fait par l’intermédiaire de liaisons électrostatiques entre le peptide cationique et les phospholipides chargés négativement au niveau de la membrane externe de la bactérie à Gram négatif (Jenssen et al. 2006).
Fig 6: Mécanisme d’action (Zasloff, 2002)
b) Attachement, fixation à la surface de la bactérie
C’est l’étape d’attachement à la membrane externe pour les bactéries à Gram négatif ou au peptidoglycane pour les bactéries à Gram positif. Cette fixation se fait grâce aux groupements phosphates qui sont situés au niveau :
18 - du LPS pour les bactéries à Gram négatif
- des acides lipoteichoïques présents à la surface des bactéries à Gram positif.
L’importante proportion de lipides chargés négativement à la surface de la paroi des bactéries permet aux PAM de sélectionner les bactéries et non les cellules de l’hôte.
c) Interactions peptide membrane
Après l’étape de fixation, les peptides vont entraîner des perturbations et/ou une modification de la membrane externe ou plasmique ; cela aboutit à une modification de la perméabilité membranaire. Le ou les mécanismes par lesquels les peptides exercent leur action font l’objet de plusieurs hypothèses (Fig. 7):
- une privilégiant une action directement à la surface de la bactérie (3 modèles ont été proposés) : modèles de perméabilisation membranaire - une action intracellulaire provoquant la mort de la bactérie (un modèle décrit) - modèle de cible intracellulaire.
Fig. 7 : Schéma illustrant le mécanisme de perméabilisation membranaire des peptides antimicrobiens en hélice α : (A) modèle Barrel stave, (B) modèle Carpet-like et (C)
19
modèles de pores toroïdaux wormhole model. Les faces hydrophiles et hydrophobes des peptides (représentés par des cylindres) sont respectivement colorées en bleu et gris. Les vues du dessus des modèles barrel-stave et pores toroïdaux sont représentées dans des fenêtres (Toke, 2005).
d) Mécanismes de mort cellulaire
La mort de la bactérie est causée par de multiples défauts provoqués par les peptides au niveau de la membrane. La formation de pores entraîne ainsi la fuite des ions et des métabolites, puis la dépolarisation membranaire, l’arrêt de la synthèse du peptidoglycane, et finit par entraîner la mort de la bactérie (Yeaman et al. 2003). En plus des attaques membranaires, d’autres processus sont mis en jeu pour provoquer la mort de la bactérie.
En raison de la démonstration de leur impact sur la santé humaine, le marché des aliments et des produits nutraceutiques contenant des peptides bioactifs fonctionnels augmente très rapidement. Par conséquent, les industries alimentaires et biopharmaceutiques sont à la recherche de technologies permettant la production de ce type de produits à partir de ressources naturelles souvent destinées à être rejetées dans l’environnement. C’est le cas notamment de peptides du crabe des neiges qui inhibent certaines souches bactériennes gram négatives et gram positives (Beaulieu et al. 2009). Des analyses chromatographiques d’exclusion sériques ont permis de déterminer que le peptide antibactérien serait de nature anionique.
Considérant que la plupart des peptides fonctionnels sont présents dans des mélanges complexes de protéines hydrolysées, leur séparation et purification est nécessaire. De ce fait, le développement de nouvelles technologies permettant la recherche de nouveaux composés bioactifs à partir des sous-produits de l’industrie marine apportera plus de valeur à ce que nous considérons aujourd’hui comme un gaspillage et qui représente des défis économiques et environnementaux.
20
2.3. Procédés de fractionnement des peptides bioactifs
Les procédés les plus couramment utilisés pour le fractionnement et l’enrichissement des peptides comprennent les procédés baro membranaires (Ultrafiltration, nano filtration, microfiltration et osmose inverse) et les procédés chromatographiques. Ces procédés de fractionnement présentent de nombreux avantages et inconvénients (Fig. 8)
Fig 8 : Schéma synoptique des différents procédés de fractionnement
Les procédés chromatographiques regroupent la chromatographie d’échange d’ions (Chui et Etzel, 1997), la chromatographie d'adsorption, la chromatographie par filtration sur gel, la chromatographie d'exclusion de taille, la chromatographie d'affinité
PROCÉDÉS DE FRACTIONNEMENT PROCÉDÉS BAROMEMBRANAIRES (UF, NF, MF, OI) AVANTAGES
-Isolement des peptides bioactifs à partir d'une grande variété de
protéiques
-Peuvent etre opérés en continu -Consomment peu d'énergie -Facilement transposables à
l'échelle industrielle
INCONVENIENTS -Technologie peu sélective -Colmatage des membranes et
concentration de polarisation -Pas de capacité de fractionner
des peptides selon leur charge
PROCÉDÉS CHROMATOGRAPHIQUES
AVANTAGES -Séparation sélective -Séparation des molécules à forte
valeur ajoutée INCONVENIENTS
-Coût onéreux
-Utilisation à l'échelle de laboratoire -Faible volume traité par injection -Risques de trace de solvants dans le
21
sur colonne (Li-Chan et al, 1998), la chromatographie d'affinité sur membrane (Wolman et al, 2007). Elles sont utilisées à des fins de purification, pour l’enrichissement, et pour l’isolement de peptides. La lactoferrine, un peptide cationique antimicrobien, a été isolée ainsi (Ndiaye nafissatou, 2009). Les méthodes chromatographiques pour la séparation des peptides fournissent une bonne sélectivité. Elles ne sont cependant utilisés qu’à l’échelle laboratoire pour des fins analytiques car les coûts de production et les faibles rendements rendent impossible leurs utilisation à l’échelle industrielle (Fuda et al. 2004, Pouliot et al., 1998, Brisson et al, 2006, Lu et al., 2007). De façon courante, les peptides sont surtout séparés par chromatographie liquide à haute pression en phase inversée (RP-HPLC). Ce type de chromatographie utilise comme principe la séparation des molécules sur la base des interactions hydrophobes entre la phase stationnaire (matrice dans la colonne) et les molécules à fractionner (Ardô et Kristiansen, 2002).
Les techniques baro membranaires permettent la séparation d’un ou de plusieurs constituants sous l’effet de la pression telles que la microfiltration (MF), 1'ultrafiltration (UF), la nanofiltration (NF) ou l'osmose inverse (OI). Elles sont couramment utilisées pour le fractionnement des hydrolysats de protéines laitières dans le but d'améliorer leurs caractéristiques biologiques ou propriétés fonctionnelles (Pihlanto-Leppälä, Anne ; 2000 et Shahidi et Zhong, 2008). Ces procédés sont classés en fonction de la taille des pores des membranes et sont appropriés pour une utilisation à l’échelle industrielle en comparaison des techniques chromatographiques (Beermann et al, 2009 et Chabeaud et al, 2009). Mais ces procédures baromembranaires sont limitées car elles séparent seulement selon la taille des peptides sans tenir compte de leur charge et s’encrassent. Ces limitations ont poussé les scientifiques à chercher d’autres solutions pour isoler des peptides bioactifs en combinant donc la taille et la charge des peptides. Ainsi, d’autres technologies ont vu le jour dont le couplage des techniques baromembranaires et HPLC. Par exemple, une méthode UF et HPLC a été appliquée sur des échantillons d’hydrolysat de lait pour obtenir des petits peptides ayant une activité biologique (Doyen et al., 2011).
Des techniques d’électrofiltration ont ainsi été développées en utilisant comme force motrice le champ électrique et la pression (Lapointe et al, 2006). Ces procédés électromembranaires produisent le déplacement des molécules électriquement chargées
22
sous l’influence d’une différence de potentiel appliquée entre deux électrodes. Ainsi, la filtration électromembranaire (EMF) développée par Bargemen et al, (2002) a permis le fractionnement de peptides provenant d’hydrolysat de caséines αs2. De même, le contacteur membranaire électrophorétique (EMC) développé par Galier et Roux-de Balmann a permis de séparer l’α-lactalbumine du sérum albumine bovine (BSA). Liu et al (1996, 1997) ont proposé un système électrophorétique multicanaux en continu pour la séparation de protéines en mélange. Van Nunen (1997) a conçu un module pilote d’électrophorèse membranaire (MEM) pour la séparation de la lipase en mélange avec le lysozyme (Poulin et al, 2008) .
Cependant, tous ces procédés présentent des limites : les quantités de volumes traités sont faibles; la consommation énergétique est élevée; les restrictions à pouvoir traiter différents types de solution. Pour y remédier, l’équipe de Bazinet et al. (2005) de l’Université Laval, a développé un nouveau procédé capable de séparer les peptides sur la base de leur poids moléculaire et aussi de leur charge. L’électrodialyse avec membranes d’ultrafiltration (EDUF) permet de traiter différents types et volumes de solution. Ce procédé vise notamment à contourner le problème de faible sélectivité et de colmatage des membranes des procédés baromembranaires.
2.4. Procédés EDUF et paramètres liés à l’efficacité du procédé
2.4.1 EDUF
L’EDUF (électrodialyse avec membrane d’ultrafiltration) est un procédé membranaire qui combine l’utilisation d’un champ électrique, de membranes échangeuses d’ions et de membranes de filtration pour faire migrer des composés chargés électriquement d’une solution à une autre (Poulin et al., 2008) dans un module d’ED conventionnel ou alternatif. Ce procédé a montré une grande efficacité dans la concentration et la séparation sélective des peptides en fonction de leur poids moléculaire et aussi en fonction de leur charge. De ce fait, les peptides anioniques (chargés
23
négativement) migreront vers l’anode et les peptides cationiques (chargés positivement) migreront vers la cathode après être passés au travers d’une membrane d’ultrafiltration possédant une certaine limite de filtration selon la masse moléculaire. Ainsi, suivant qu’une ou deux membranes d’ultrafiltration sont utilisées, il sera possible de séparer les peptides positifs (Fig. 9b), négatifs (Fig. 9a) ou les deux (Fig. 9c), la séparation étant soit séparée ou simultanée. Pour réaliser la séparation, trois types de solutions circulent de façon indépendante dans les différents compartiments notamment la solution d'alimentation qui contient le mélange de molécules à séparer, la solution de récupération appelé perméat où les molécules actives sont recueillies et la solution d'électrolyte qui assure le rinçage des électrodes et fournit les ions requis pour le maintien du courant électrique.
24
Fig 9: Configuration de la séparation de peptides anioniques (a) et cationiques (b) et simultanée (c) (Poulin et al. 2006)
L’EDUF a ainsi été utilisée à plusieurs fins. Poulin et al. (2007) ont réalisé une séparation simultanée de peptides cationiques et anioniques issus d'un hydrolysat de β-lactoglobuline. Firdaous et al. (2009) ont séparé sélectivement un peptide hypotenseur (VW) à partir d'un hydrolysat de protéine de luzerne. Un hydrolysat de coproduits de crabe des neiges a été séparé par Doyen et al. (2011) et a montré une activité anti-cancérigène dans la fraction cationique et antimicrobienne dans la fraction anionique (Doyen et al., 2012). D’autres hydrolysats de protéines ont aussi été séparés par EDUF tels que les protéines de lin (Doyen et al, 2014) et de soya (Roblet et al. 2014). L’EDUF a aussi permis de concentrer les catéchines de thé vert (Labbé et al, 2005), l’enrichissement du jus de canneberge en anthocyanines (Rozoy et al, 2013) et les oligomères de chitosane (Aider, M., 2007), de même que la séparation de la lactoferrine du lactosérum (Ndiaye nafissatou, 2009), un peptide ayant des effets antimicrobiens, anti-inflammatoires et immunostimulateurs.
De ce fait, l’EDUF présente de nombreux avantages tels qu’une haute sélectivité du procédé, la pureté du produit, la réduction du colmatage et aussi aucune utilisation de solvant.
25
2.4.2 Paramètres liés à l’efficacité des procédés électromembranaires.
L’influence des paramètres opératoires tels la configuration du module, le débit de la solution, le pH de la solution, les membranes, le champ électrique et, la concentration de la solution d’alimentation sur l’efficacité de systèmes d’électroséparation ont été étudiés de nombreux travaux dont ceux de Bargeman et al. (2002) et liu et al. (1997).
a) Configuration du module
La configuration du module a démontré un effet sur l’efficacité du procédé. La migration peptidique dans une configuration alternative est supérieure à la configuration conventionnelle. Van Nunen (1997) et Bargeman et al. (2002), ont rapporté des facteurs d’augmentation du taux de séparation des protéines situés entre 1,2 et 2,0.
b) Débit de la solution
Les précédents travaux étudiés ont montré que le débit des solutions a un effet sur le rendement du procédé. Van Nunen (1997) rapporte que les variations du débit influencent le procédé d’électrophorèse membranaire. Poulin et al. (2007) ont observé que la vitesse de recirculation de la solution d’alimentation n’avait pas d’impact sur le rendement du procédé, mais qu’elle pouvait moduler la sélectivité du procédé.
c) pH de la solution
Le pH de la solution à séparer est un facteur clé de la séparation de peptides par ÉDMF (Électrodialyse avec membrane de filtration). En effet, celui-ci influence la charge des peptides : lorsque le pH est inférieur au point isoélectrique d'un peptide, celui-ci est chargé positivement, alors que s'il est supérieur, le peptide sera chargé négativement. Les auteurs rapportent que plus les valeurs de pH choisies s’éloignent du pI de la molécule migrante, plus la vitesse de migration de celle-ci augmente.
d) Membranes
Le matériau constituant les membranes a montré un effet sur la migration et la sélectivité peptidique. Il a été démontré dans les travaux de Doyen et al. (2011) que le matériau (PES) constituant les membranes avait un impact sur la sélectivité, et que les
26
peptides de masse moléculaire comprise entre 300 et 700Da représentaient la population ayant la plus abondamment migré. Bargeman et al. (2002) ont montré que la taille des pores des membranes influence la migration peptidique (plus le seuil de coupure est élevé, plus le taux de transport augmente).
e) Champ électrique
La force du champ électrique, force motrice des procédés électromembranaires, a montré un impact majeur sur la migration peptidique. Poulin et al. (2007) ont montré que l’élévation du champ électrique a aussi permis d’augmenter de façon importante la concentration de peptides récupérés. De même, Bargeman et al. (2002) ont montré qu’une augmentation du voltage de 20 à 40V entrainait une augmentation significative du taux de transport de la lysine.
f) Concentration de la solution d’alimentation
La concentration de la solution d’alimentation influence la migration peptidique. Certains travaux tels que ceux de Bargeman et al. (2002) ont constaté qu’en augmentant la concentration initiale d’hydrolysat de caséine αs2 de 2,5 fois, la récupération de peptides dans le perméat a été multipliée par un facteur 2,1. Galier et Balmann (2005) ont aussi démontré qu’en augmentant la concentration en protéine de la solution d’alimentation de 0.1 à 0.5 g/L, le taux de migration augmentait. D’autres travaux comme ceux d’Ayoa Fernández et Riera (2012) ont par contre montré une baisse de la sélectivité avec une augmentation de la concentration de la solution d’alimentation d’un hydrolysat trypsique de β-lactoglobuline.
Les différents paramètres des procédés d’EDUF sont importants pour la productivité et la sélectivité des peptides mais l’impact du paramètre concentration de la solution d’hydrolysat n’a pas encore été étudié sur l’efficacité du procédé EDUF par contre a été démontré dans d’autre procédé baromembranaire.
27
HYPOTHÈSE ET OBJECTIFS
L’hypothèse à la base de ce travail de recherche est la suivante :
« L’augmentation de la concentration en peptides d’un hydrolysat de crabe des neiges permet d’accroître la sélectivité et le taux de séparation des peptides acides et basiques en cours d’EDUF et d’en augmenter les propriétés antimicrobiennes.»
Pour vérifier l’hypothèse de recherche et atteindre le but du travail, les objectifs principaux suivants ont été définis :
1) Evaluer l’effet de l’augmentation de la concentration en peptides de l’hydrolysat de crabe des neiges sur la sélectivité et leur taux de séparation.
2) Caractériser l’effet de l’augmentation de la concentration en peptides de l’hydrolysat de crabe des neiges sur les paramètres électrodialytiques.
3) Evaluer le colmatage et l’intégrité des membranes après traitement d’EDUF.
Chapter 3
SIMULTANEOUS ELECTROSEPARATION OF
ANIONIC AND CATIONIC PEPTIDES:
IMPACT OF FEED PEPTIDE
CONCENTRATION ON MIGRATION RATE,
SELECTIVITY AND RELATIVE ENERGY
CONSUMPTION
Published in Journal of Membrane Science (2016) 53-59,
By:
Koumfieg Noudou, V. Y. ; Suwal, S. ; Amiot, J; Mikhaylin, S; Beaulieu, L; Bazinet, L.
Department of Food Science and, Institute of Nutrition and Functional Foods, Université Laval, Québec, QC, Canada G1V 0A6
29
Chapitre 3 :
Impact de la concentration en peptides anioniques et cationiques sur leur taux de migration et la sélectivité en coursd’électroseparation simultanée.
3.1. Résumé
Le présent travail visait à déterminer l’impact de la concentration initiale en peptide (0.5%,1%,2% et 4%) d’un hydrolysat de crabe des neiges sur la sélectivité, le taux de séparation des fractions anioniques et cationiques, ainsi que sur les paramètres électrodialytiques après traitement d’EDUF (électrodialyse avec membrane d’ultrafiltration). De cette étude, les résultats ont montré que l’augmentation de la concentration dans la solution d’alimentation a un effet sur le taux de séparation et sur la sélectivité totale et a affecté la sélectivité des acides aminés libres dans les deux compartiments de récupération RCA (Asp, Glu et His) et RCC (Arg principalement) et/ou des peptides contenant ces acides aminés. Le plus haut taux de migration a été observé à 4% (16.2 g/m2.h et 7.8 g/m2.h, respectivement, pour les compartiments
cationique et anionique). En outre, la consommation d’énergie relative a diminué avec l’augmentation de la concentration de la solution d’alimentation de 17.40 Wh/g (0.5%) à 3.53 Wh/g (4%). Les résultats ont aussi montré que l’intégrité des membranes et les propriétés physico-chimiques ne sont pas affectées dans l’intervalle de concentration testée. L’impact de la concentration en peptide dans la solution d’alimentation sur le taux de migration, la sélectivité et la consommation d’énergie relative n’avait auparavant jamais été démontré en EDUF.
30
3.2. Abstract
The present work aimed to determine the effect of initial peptide concentration (0.5, 1, 2 and 4 % (w/v)) in feed solution during electrodialysis with ultrafiltration membranes (EDUF) on migration rate and selectivity of both anionic and cationic peptides as well as electrodialytic parameters. The results showed that increasing the peptide concentration in the feed solution from 0.5% to 4% increased in a linear way the total separation rate and affected the selectivity of free amino acids in both recovery compartments RCA-
(Asp, Glu and His) and RCC+ (Arg mainly) and/or peptides containing these amino acids.
The highest migration rates observed at 4% were 16.2 g/m2.h and 7.8 g/m2.h for the
cationic and anionic compartments, respectively. Futhermore, the relative energy consumption decreased with increasing feed solution concentration from 17.40 Wh/g at 0.5% concentration to 3.53 Wh/g at 4% concentration. In addition, membrane integrity and physicochemical properties were not affected in the range of peptide concentration tested. To the best of our knowledge, it was the first time that the impact of feed peptide concentration on migration, selectivity and relative energy consumption is demonstrated in EDUF.
31
3.3. Introduction
The snow crab (Chionoecetes opilio) industry is one of Canada's most successful fisheries, with a landing volume of 98,065 metric tons in 2013 (DFO, 2014). However, it generates thousands of tons of byproducts . Eventually, the valorization of these byproducts, into value added protein-based products such as functional food and nutraceuticals, has economical as well as environmental importance. Indeed, the market for functional food and nutraceutical products containing bioactive peptides from natural sources is increasing very rapidly . Recent studies have demonstrated antibacterial and anticancer activities of peptides fractions from snow crab by product hydrolysate. The production of such bioactive peptides requires the development of an energetically, economically and environmental sound fractionation technique. The methods used most often are based on pressure-driven membrane filtration whose application is limited due to relatively lower selectivity and higher degree of membrane fouling . Furthermore, chromatographic techniques are long and expensive; they are mostly used for analytical purposes. Thus, other alternatives like electromembrane filtration (EMF), electro-ultrafiltration (EUF) and electro-electro-ultrafiltration-electrodialysis (EUF-ED) have been studied and are claimed to have better selectivity and no or reduced membrane fouling . However EMF and EUF have the disadvantage to use a specially designed filtration system with only one ultrafiltration membrane, which reduces its application on large scale, and also to use pressure which limits the peptides or molecules selectivity. To overcome these limitations, electrodialysis with membrane filtration (EDMF) was developed and patented by Bazinet et al. (2009). Indeed, in EDMF, peptides are separated according to their electrophoretic mobilities which are mostly related to their molecular weights (sizes) and charges. EDMF technique has already been used for the separation of various bioactive peptides from different food protein hydrolysates such as soybean, flaxseed, β-lactoglobulin, alfalfa, snow crab byproduct hydrolysate, etc.
Previous studies have demonstrated that several parameters affect EDMF efficiency such as: electric field strength; membrane material, effective surface area and molecular weight cut off (MWCO); solution pH, ionic strength and flow rate; and configuration of the module. Recently, Suwal et al. (2014) have shown that electrical
32
conductivity of feed and recovery solution must be maintained for a linear peptide migration during EDMF process. In addition, an increase in feed protein concentration from 0.01 to 0.05 (w/v) in an electrophoretic membrane contactor was previously found to increase proportionally the migration rate without impeding the final purity and yield . However, the effect of peptide concentration at much higher range in the feed solution of protein hydrolysate during EDMF has not been yet studied.
In this context, the objective of this study was to determine the impact of increasing the feed peptide concentration of snow crab by-products hydrolysate on peptide migration rate, selectivity (total amino acid composition of peptide fraction), electrodialytic parameters (migration rate, relative energy consumption) and in situ membrane resistance.
3.4. Materials and method
3.4.1 Materials and ED cell
3.4.1.1 Hydrolysate of snow crab by products
Snow crab by-products hydrolysate (SCBH) was obtained from Québec fisheries and aquaculture innovation center (Merinov, MAPAQ, Gaspé, Quebec, Canada) and produced as described previously . Snow crab by-products were enzymatically hydrolyzed by Protamex® (Novozymes, Bagsvaerd, Denmark; 1 g/kg of by-products) at pH 9 and then separated and purified by consecutives ultrafiltration and nanofiltration treatments. The snow crab by-products hydrolysate used in this work was the permeate of ultrafiltration (1kDa) and retentate of nanofiltration. The SCBH contained 72% of protein determined by LECO (LECO, St. Joseph, Michigan, USA).
33 3.4.1.2 Chemicals
Na2SO4 was obtained from MAT Laboratory (Quebec, QC, Canada). Solutions of
NaOH and HCl (1.0M) were obtained from Fisher scientific (Montreal, Qc, Canada) and KCl was purchased from ACP Inc. (Montreal, Qc, Canada).
3.4.1.3 Membranes
Polyether sulfone (PES) ultrafiltration membranes with MWCO of 100 kDa were purchased from Synder filtration (Vacaville, CA, USA). Neosepta CMX-SB cation exchange membrane (CEM) and Neosepta AMX-SB anion exchange membrane (AEM) were obtained from Tokuyama Soda Ltd. (Tokyo, Japon).
3.4.1.4 Electrodialysis cell configuration
The electrodialysis cell used in this experiment was a MP type cell manufactured by Electrocell Systems AB Company (Taby, Sweden) with an effective surface area of 100 cm2. The electrodialysis stack contained one anion-exchange membrane (AEM), one
cation-exchange membrane (CEM), and two ultrafiltration membranes. One UF membrane was placed near the cathode (UFM2) and the other one positioned near the anode (UFM1). The electrodialysis configuration shown in Fig.10 is the same as that used previously for simultaneous fractionation of anionic and cationic peptides from a tryptic digest of β-lactoglobulin. The EDUF configuration was divided into five compartments: two interconnected compartments containing electrode rinsing solution of Na2SO4 (20 g/L; 1.5L); two recovery compartments (RC): one for anionic peptides called
RCA- (between AEM and UFM1) and another for cationic peptides called RCC+ (between
UFM2 and CEM), both containing KCl solution (5g/L, 1.5L); a feed compartment (between UFM1 and UFM2) containing SCBH (1.5L) at variable peptide concentrations of 0.5, 1, 2 and 4 % (w/v). These solutions were circulated using four centrifugal pumps and the flow rates were controlled at 2 L/min in each compartment and 4 L/min in the compartments containing electrode rinsing solution. The power was supplied between a DSA anode and a stainless steel cathode by a variable 0-100 power supply.
34
Fig 10 : Configuration of the electrodialysis with ultrafiltration membrane cell. AEM: anion-exchange membrane, CEM: cation-exchange membrane, UFM: ultrafiltration membrane and V: voltmeter connected to a silver coated platinum electrode placed at the membrane
3.4.1.5 Protocol
Snow crab by-products hydrolysate (SCBH) was demineralised up to 52% by electrodialysis to reduce mineral salt content, using EUR-2C type cell (Eurodia, Rungis, France) and contained 79% of protein determined by LECO before the fractionation by EDUF. The electroseparations were carried out in batch process with a constant potential difference of 20 volts (4.8 V/cm) for a period of 4 hours. The ED system was equipped with cooling coils that maintained a constant temperature of 140C in each compartment.
The electrodialytic separation was carried out at four concentrations (0.5, 1, 2 and 4%) of SCBH. The pH of feed and permeate (RCA- and RCC+) solutions was adjusted to 6 at the
35
or KOH (1.0 M). Similarly, the electrical conductivities of feed and permeate solutions were monitored and maintained constant by the addition of NaCl (100 g/L) and KCl (100 g/L) respectively. Before each treatment, 10 mL samples of SCBH and permeate (RCA-
and RCC+) were collected in each compartment before the application of voltage and then
every 30 minutes after. Samples were frozen and kept at -30°C until analysed for protein concentration and amino acids. The electrical potential differences of each membrane and current intensity were recorded every 30 minutes during treatment. Three randomized repetitions were carried out for each condition of SCBH concentration and the membranes were changed after each block of repetitions. After each treatment, a cleaning in place (CIP) was performed according to the membrane manufacturer procedure. After cleaning, the cell was dismantled and the thickness and conductivity of each membrane were measured to evaluate membranes integrity used for EDUF treatment. The cell was then reassembled for the next treatment.
3.4.2 Analytical methods
3.4.2.1 Peptide concentration
The peptide concentrations in each solution samples were determined using BCATM
protein assay reagents (Pierce Biotechnology Inc., Rockford, IL, USA). Assays were conducted as recommended by the manufacturer. Analyses were performed on microplates with 25μL of sample mixed with 200µL of working reagents and then incubated at 37oC for 30 min. The microplates were cooled at room temperature for 5 min
and the absorbance of the samples was read at 562 nm with a microplate reader (Thermomax, Molecular Devices, Sunnyvale, CA, USA). The protein concentration was determined using BSA calibration curve in the range of 25 to 2000μg/mL.
3.4.2.2 Peptide migration rate
The migration rate (g of peptides/m2.h) was calculated at the end of the process with the
amount of peptide (g) migrated determined previously by BCA, effective surface area of ultrafiltration membrane (m2) and time (h) using equation 1.
36
Migration rate = ( )∗ ( ) ( ) (1) 3.4.2.3 Total amino acid Analysis
Total amino acid composition in the initial snow crab by-product hydrolysate (SCBH) and recovery fractions (RC) after EDUF treatment was determined in duplicate by the AccQ-Tag amino acid analysis method (waters, Mississauga, ON, Canada) as was described previously by Beaulieu et al. (2009). This procedure was used for the determination of amino acids resistant to acidic hydrolysis including taurine a derivative of cysteine. The amino acids were separated by RP-HPLC and quantified by fluorescence detection.
3.4.2.4 Relative energy consumption
The total energy consumption (ET) during EDUF process was determined by
integrating the multiplication of voltage and current intensity as a function of time (t) using equation 2.
E = U. I dt (2)
Where ET is the energy (Wh), I the current intensity (A) and U the voltage (V).
The relative energy consumption (ER) in Wh/g during EDUF treatment was calculated by
dividing the total energy consumed by the total amount of peptides (g) obtained at the end of the process using equation 3.
E = E
Amount of peptides (g) (3)