UNIVERSITE TOULOUSE III - PAUL SABATIER Sciences
THESE
Pour obtenir le grade de
DOCTEUR DE L’UNIVERSITE TOULOUSE III Discipline : Innovation Pharmacologique
Présentée et soutenue par : Christelle Coatrieux
le 08 octobre 2007
Monoamine oxydases et athérosclérose :
signalisation mitogène et études in vivo
Jury
Monsieur Luc Rochette Rapporteur
Professeur, Université de Bourgogne, Dijon
Monsieur Ramaroson Andriantsitohaina Rapporteur
Directeur de Recherche, INSERM, Angers
Monsieur Philippe Valet Président
Professeur, Université Paul Sabatier, Toulouse III
Madame Nathalie Augé Examinateur
Chargé de Recherche, INSERM
Monsieur Angelo Parini Directeur de Thèse
Professeur, Université Paul Sabatier, Toulouse III
Résumé
Les espèces réactives de l’oxygène (EROs) sont impliquées dans l’activation de nombreuses voies de signalisation cellulaires, conduisant à différentes réponses comme la prolifération. Les EROs, à cause du stress oxydant qu’elles génèrent, sont impliquées dans de nombreuses pathologies, notamment l’athérosclérose.
Les monoamine oxydases (MAOs) sont deux flavoenzymes responsables de la dégradation des catécholamines et des amines biogènes comme la sérotonine ; elles sont une source importante d’EROs. Il a été montré qu’elles peuvent être impliquées dans la prolifération cellulaire ou l’apoptose du fait du stress oxydant qu’elles génèrent.
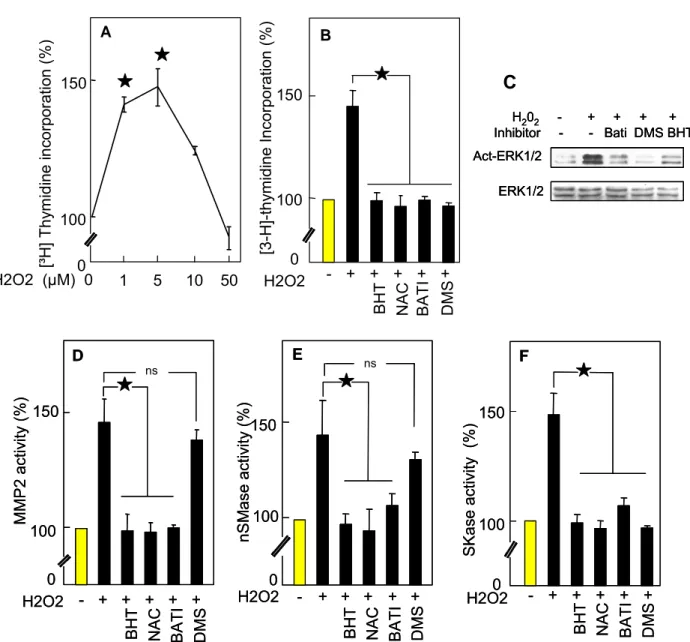
Ce travail de thèse a montré que la MAO-A, en dégradant son substrat (sérotonine ou tyramine), active une voie de signalisation mitogène particulière : la voie métalloprotéase-2/sphingolipides (MMPmétalloprotéase-2/sphingolipides), et contribue à la prolifération de cellules musculaire lisses vasculaires induite par ces monoamines. De plus, une étude complémentaire a confirmé l’importance des EROs comme stimulus mitogène (utilisation de peroxyde d’hydrogène exogène), et a décrit plus spécifiquement les étapes en amont de l’activation de MMP2, ainsi que l’activation par la MMP2 de la sphingomyélinase neutre (première enzyme de la cascade des sphingolipides).
Enfin, une étude a été menée in vivo sur un modèle de souris développant des plaques d’athérome (ApoE -/-), visant à étudier le rôle athéroprotecteur d’un inhibiteur de MAOs (IMAO), comparé à des piégeurs de carbonyle (ayant pour certains des propriétés IMAOs également). Cette étude montre un effet protecteur des piégeurs de carbonyles, indépendant de leurs propriétés IMAOs, et un faible effet de l’IMAO seul, dans la formation des lésions vasculaires primaires.
En conclusion, ce travail a montré une implication du stress oxydant, et particulièrement des MAOs dans la prolifération des cellules musculaires lisses vasculaires. Il a permis également de mieux décrire l’interaction entre MMP2 et la sphingomyélinase neutre ainsi que la voie de signalisation activée en amont de MMP2.
Enfin, bien que l’étude visant à montrer l’effet athéroprotecteur d’un IMAO sur lésion primaires n’ait pas montré d’efficacité aussi importante que celle notée pour des molécules (IMAOs ou non) piégeurs de carbonyles, ceci n’exclut pas un rôle des MAOs dans la formation des lésions avancées.
Abstract
Reactive oxygen species (ROS) are involved in the activation of many signaling pathways, leading to different responses, such as cell proliferation, inflammation, differentiation or apoptosis. The oxidative stress generated by ROS is involved in the initiation and evolution of many diseases including atherosclerosis.
Monoamine oxidases (MAOs) are two flavoenzymes that catalyze the oxidative deamination of catecholamines and biogenic amines, such as serotonin and tyramine. The degradation of biogenic amines by MAOs generates a large amount of ROS that may play a role in the biological properties of these agents like cell proliferation or apoptosis.
This study showed that ROS generated during the degradation of serotonin or tyramine by MAO-A, trigger the activation of a specific stress-induced mitogenic pathway, namely the metalloprotease2-neutral sphingomyelinase2 pathway (MMP2/nSMase2), which is involved in vascular smooth muscle cell proliferation. This ROS-induced MAO-A dependent signalling was mimicked by exogenous hydrogen peroxyde, which allowed to demonstrate that ROS-induced SMC proliferation requires the downstream activation of sphingosine kinase-1 (SK-1), a key enzyme in survival and proliferation signalling via the generation of sphingosine 1-phosphate (S1P). Furthermore, we report preliminary data on the mechanisms involved upstream the activation of MMP2 and of nSMase2 (which implicate the proprotein convertase and MT1-MMP, the physiological activator of MMP2).
Lastly, the protective effect of MAO inhibitors has been evaluated in vivo on an animal model for atherosclerosis, the apoE-/- mice. This study indicated that hydrazinic MAO inhibitors were very efficient in inhibiting the development of atherosclerotic lesions in apoE -/- mice, but this was due to the carbonyl scavenger properties of hydrazine and not to their IMAO effect, because non hydrazinic IMAO did not exhibited any protective effect. These data indicate that MAO-dependent oxidative stress is not involved in the formation of early atherosclerotic lesions, which doesn’t exclude an involvement in more advanced states, plaque rupture and remodelling.
In conclusion, this work allowed to demonstrate a role of MAO-dependent oxidative stress in SMC proliferation, via a new stress-induced signalling mechanism, the MMP2/nSMase2/SK-1 pathway, and suggests a role for ROS in the formation and the stability/fragility of fibrous cap in atherosclerosis.
Principales abréviations utilisées
AGE : Advanced Glycoxydation Endproduct
ALE : Advanced Lipoxydation Endproduct ApoE -/- : Knockout ApolipoprotéineE CE : Cellules Endothéliales
CML : Cellules Musculaires Lisses ERK : Extracellular-signal Regulated Kinase
ERO : Espèce Réactive de l’Oxygène FAD : Flavin Adenin Dinucleotid H2O2 : Peroxyde d’hydrogène HDL : High Density Lipoprotein 4-HNE : 4-Hydroxynonenal
5-HT : 5-hydroxytryptamine (sérotonine) IMAO : Inhibiteur de monoamine oxydase LDL: Low-Density Lipoprotein
LDLox: Low-Density Lipoprotein oxydées MAO: Monoamine oxydase
MAPK: Mitogen-Activated Protein Kinase MDA: Malondialdehyde
MMP: Matrix MetalloProtease MT-MMP: Membrane-type MetalloProtease
NAD(P)H oxydase : Nicotinamide adénine dinucléotide phosphate oxydase
NF-κB : Nuclear Factor -κB
PDGF : Platelet-derived Growth Factor SERT : Transporteur à la sérotonine Skase : Sphingosine kinase
S1P : Sphingosine 1-phosphate SM : Sphingomyéline
nSMase : Sphingomyélinase euter TIMP: Tissue inhibitor of MMP TNF alpha (ou TNFα):Tumor Necrosis Factor alpha
SOMMAIRE
I. Les Monoamine Oxydases : généralités ... 1
Isoformes ... 1
Structure... 2
Localisation... 2
Fonction des MAOs... 5
a. Réaction enzymatique catalysée ... 5
b. Rôle au niveau du système nerveux central ... 5
c. Rôle au niveau des organes périphériques ... 7
d. Nouveau rôle lié à la production d’EROs ... 7
Substrats et inhibiteurs... 8
a. Substrats... 9
b. Inhibiteurs ... 10
Pathologies associées... 11
a. Les maladies neurodégénératives et psychiatriques... 11
b. Le diabète... 12
II. Monoamine oxydases et stress oxydant ... 14
Apoptose... 14
Hypertrophie (cardiomyocytes)... 15
Prolifération ... 15
III. Stress oxydant et athérosclérose ... 16
Les maladies cardiovasculaires ... 16
Facteurs de risque... 16
Chronologie du processus atheromateux ... 16
Les espèces réactives de l’oxygène (EROs)... 19
a. Définition ... 19
b. Les différents dérivés réactifs de l’oxygène... 19
c. Les principales sources d’espèces réactives de l’oxygène ... 22
Espèces réactives de l’oxygène et athérosclérose ... 29
a. LES EROs dans l’athérosclérose ... 29
b. Sources d’EROs produites par les cellules vasculaires ... 31
c. Conséquences cellulaires du stress oxydant... 31
d. Principales signalisations intra-cellulaires activées par le stress oxydant... 32
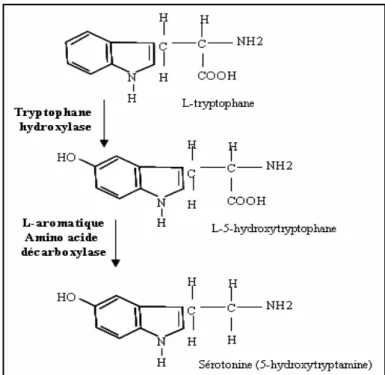
IV. La Sérotonine ... 35
Synthèse et dégradation ... 35
Stockage ... 37
Rôle ... 37
Les récepteurs à la sérotonine... 37
Sérotonine et athérosclérose ... 39
Signalisation cellulaire de la sérotonine dans les cellules vasculaires... 39
Objectif du travail... 41
Matériels et Méthodes... 43
Animaux : ... 43
Mesures d’espèces réactives de l’oxyène et paramètres d’oxydation : ... 44
a. Mesure de la production d’EROs intracellulaires ... 44
b. Dosage des hydroperoxydes (protéines carbonylées) ... 45
c. Dosage des TBARS (Thiobarbituric Acid Reactive Substances)... 45
Prolifération cellulaire... 46
a. Incorporation de thymidine tritiée... 46
b. Test au MTT (3-[4,5-diméthylthiazol-2-yl]-2,5-diphényltétrazolium bromure)... 46
c. Comptage cellulaire ... 46 Activités enzymatiques... 47 a. Activité MAO ... 47 b. Activité furine ... 47 c. Activité MMP14 et MMP2 ... 48 d. Activité nSMase... 49
e. Activité sphingosine kinase ... 49
Proteines ... 50
a. Dosage ... 50
b. Western Blot ... 50
c. Immunoprécipitation des protéines ... 51
RESULTATS EXPERIMENTAUX I. Rôle de la MAO-A et du stress oxydant dans la signalisation mitogène induite sur cellules musculaires lisses ... 52
I.1. Introduction ... 52
a. Les métalloprotéases... 52
b. MMP-2, MT1-MMP et athérosclérose... 54
c. La voie des sphingolipides... 55
d. Rôle des sphingolipides dans l’atherosclérose ... 57
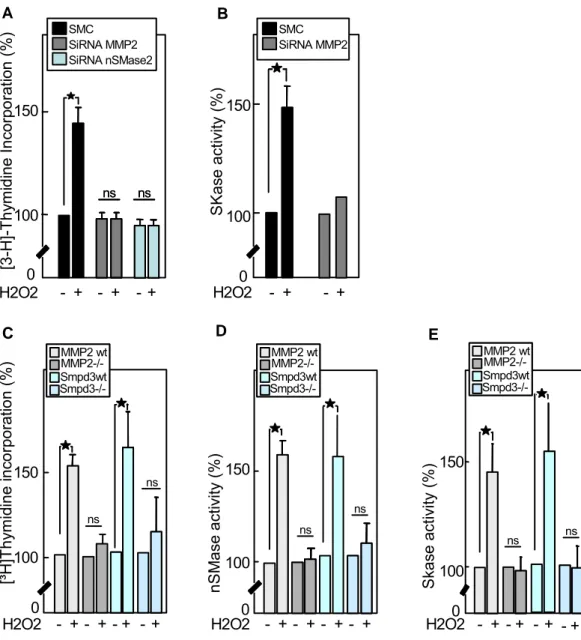
I.2. Résultats expérimentaux ... 58
I.3. Conclusion ... 113
II. Effet antiathérogène de deux classes d’inhibiteurs de monoamine oxydases sur la formation des lésions précoces... 114
II.1. Introduction ... 114
II. 2. Hypothèse de travail ... 114
II.3. Résultats ... 141
II.4. Conclusion ... 143
Conclusion générale et Perspectives ... 144
REFERENCES BIBLIOGRAPHIQUES ... 148
Revue Générale
1
I. Les Monoamine Oxydases : généralités
Les amines oxydases sont des enzymes largement distribuées chez les organismes vivants (bactéries, plantes, animaux) (Mondovi and Riccio 1984). Elles catalysent la déamination oxydative des amines (mono-, di- et polyamines), consommant de l’oxygène O2
et de l’eau, et produisant l’aldéhyde correspondant, du NH3 et du peroxyde d’hydrogène
(H2O2). Elles sont généralement classées en deux groupes i/les amines à FAD (monoamine et
polyamine oxydases, MAOs et PAOs) et ii/ les amines possédant un atome de cuivre dans leur site actif et un cofacteur organique (également appelées amine oxydases carbonyle dépendantes) comprenant les di-amine oxydases (DAOs), la lysyl-oxydase et les amine-oxydases sensibles au semicarbazide (SSAOs). Plus simplement elles sont appelées respectivement i/FAD-amine oxydases pour celles du premier groupe et ii/ amines oxydases à cuivre ou Cu-amine oxydases pour celles du deuxième.
Leur fonction dans le métabolisme des amines biogènes leur confère un rôle important lors des processus essentiels dans lesquels ces amines biogènes interviennent comme la prolifération (Vindis et al. 2000; Polgar et al. 2007), la différentiation cellulaire et l’apoptose (revue par Toninello et al. (Toninello et al. 2004)).
La monoamine oxydase (MAO) fut isolée pour la première fois en 1928 par Hare et nommée tyramine oxydase pour sa capacité à catalyser une déamination oxydative de la tyramine. Plus tard de nombreux substrats de la MAO, de type monoamines dont les catécholamines (dopamine, noradrénaline, adrénaline) et la sérotonine, furent mis en évidence d’où sa dénomination de monoamine oxydase.
Isoformes
Il existe deux isoformes de MAO : la MAO-A et la MAO-B, différenciées historiquement par la sélectivité de certains inhibiteurs à bloquer l’une ou l’autre des deux formes : la clorgyline bloquant la MAO-A (Johnson et al. 1968) et le déprényl étant spécifique de la MAO-B (Knoll and Magyar 1972; Knoll 1978). Il existe également une préférence de substrat, la MAO-A métabolisant plutôt la sérotonine, alors que la MAO-B a
Revue Générale
2
une préférence pour la β-phényléthylamine. La tyramine, l’adrénaline, la noradrénaline, et la dopamine sont métabolisées également par les deux isoenzymes (Glover et al. 1977).
Les deux isoformes de la MAO présentent des poids moléculaires légèrement différents : 60kDa pour la MAO-Aet 58 kDa pour la MAO-B chez l’homme (Cawthon and Breakefield 1979).
Au niveau génomique, les MAOs sont codées par deux gènes différents situés sur le chromosome X (Kochersperger et al. 1986). Leur organisation génomique est très similaire : 15 exons et 14 introns (Grimsby et al. 1991). De plus, le clonage des ADNc a montré chez l’homme une homologie de séquence en acides aminés de 70% entre les deux isoformes (Bach et al. 1988) et la comparaison des séquences de MAO-A ou de MAO-B interespèces a montré également une importante conservation de chacune des isoformes, avec une homologie de 87% entre les MAO-A humaine et bovine, 85% avec le rat (Powell et al. 1989; Kwan and Abell 1992) et de 88% entre les MAO-B humaine et bovine (Ito et al. 1988).
Structure
Les MAOs sont formées de deux sous unites liées par un pont dissulfure, associées à un groupement FAD (flavin adenine dinucléotide) jouant le rôle de cofacteur : les MAOs sont donc des enzymes appartenant à la famille des flavoprotéines. Par mutagenèse dirigée l’etude du site actif des MAOs a montré que certains acides aminés jouent un rôle clé dans l’activité enzymatique (Wu et al. 1993), ou la spécificité de substrat (Tsugeno and Ito 1997).
Des approches structurales (cristallographie) (figure 1) des MAOs ont été récemment réalisées et devraient permettre d’avancer dans la connaissance de leur site catalytique et de leurs sites de liaison aux inhibiteurs ou à leur substrat (Binda et al. 2003; De Colibus et al. 2005); cette nouvelle approche devrait permettre de modéliser de nouvelles molécules.
Localisation
Les MAOs sont des enzymes ubiquitaires très conservées chez les eucaryotes et situées, au niveau sub-cellulaire, sur la membrane mitochondriale externe. La localisation tissulaire des MAOs a essentiellement été étudiée au niveau du système nerveux central à
Revue Générale
3
cause de leur rôle dans le turn-over des catécholamines, de la dopamine et de la sérotonine, dont la demi-vie peut être altérée dans de nombreuses pathologies neurodégénérative (maladie de Parkinson, d’Alzheimer). La localisation des MAOs au sein des neurones ne correspond pas forcément à celle de leur substrat naturel : la MAO-A étant souvent présente au niveau des neurones catécholaminergiques et la MAO-B au niveau des neurones sérotoninergiques (Weyler et al. 1990).
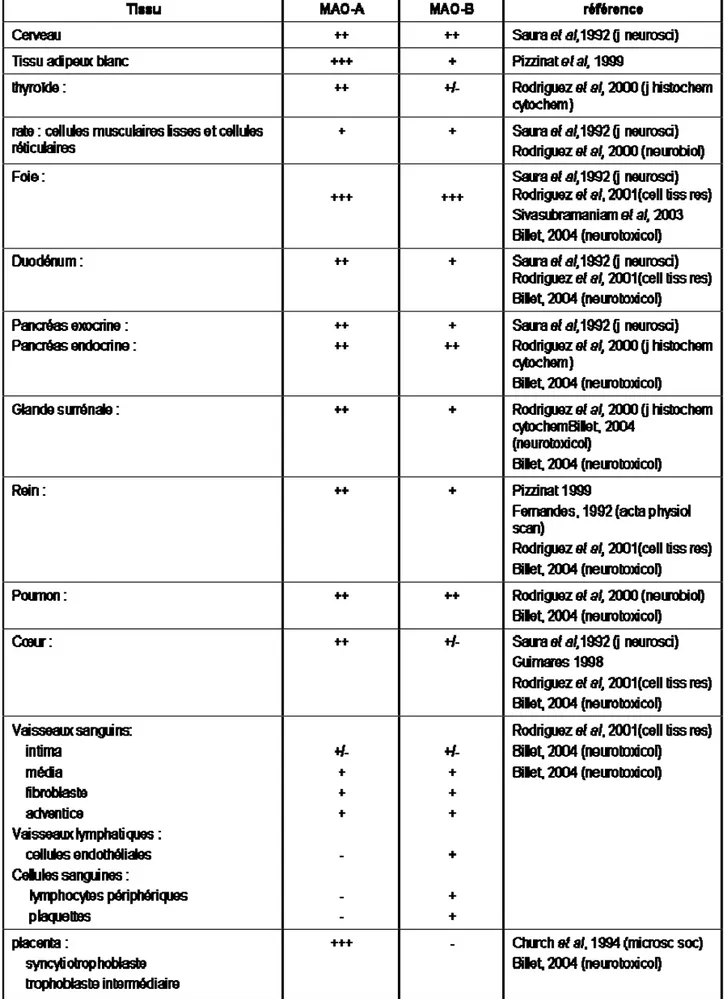
La cartographie de l’expression des MAOs dans les tissus périphériques humains, de souris et de rat a fait l’objet de nombreuses études, en fonction de l’age (Saura et al. 1994b; Saura et al. 1994a), du ratio MAO-A vs MAO-B (Sivasubramaniam et al. 2003) et du tissu (Saura et al. 1992; Rodriguez et al. 2000a; Rodriguez et al. 2000b; Billett 2004). Le tableau 1 est une liste non exhaustive de l’expression des MAO-A et –B dans différents tissus périphériques humains.
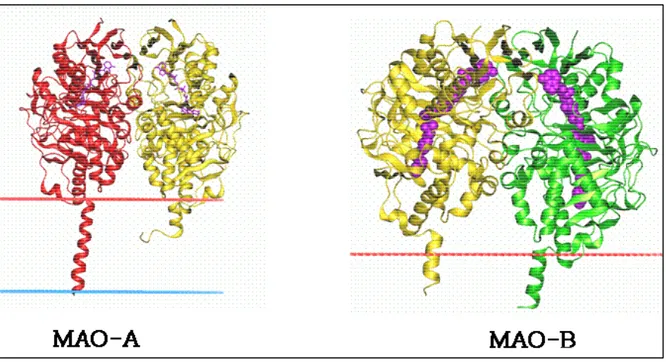
Figure 1. Structure cristallographique des monoamine oxydases humaines MAO-A : Elle cristallise sous-forme monomérique ; le co-facteur FAD est représenté en violet
MAO-B : Elle cristallise sous forme dimérique. Les deux monomères sont représentés en vert et en jaune ; le co-facteur FAD est représenté en violet
D’après http://opm.phar.umich.edu/images/proteins/1o5w.gif (MAO-A) et
http://opm.phar.umich.edu/phpthumb/phpThumb.php?src=../images/proteins/1ojd.gif&w=250&h=300
Revue Générale
4
Revue Générale
5 Fonction des MAOs
Les MAOs sont impliquées dans la déamination oxydative de monoamines (adrénaline, noradrénaline, dopamine, sérotonine, tryptamine, tyramine). Elles jouent donc un rôle primordial dans le maintien de l’homéostasie des monoamines et catécholamines en contrôlant leurs concentrations, notamment au niveau des vésicules synaptiques (système nerveux). Elles interviennent également dans la détoxification, notamment par le métabolisme des monoamines alimentaires (Ilett et al. 1980).
a. Réaction enzymatique catalysée
Les MAOs catalysent la déamination oxydative des amines primaires aliphatiques et aromatiques, ainsi que sur quelques amines secondaires et tertiaires, selon la réaction générale suivante :
RCH
2NH
2+ H
2O + O
2= RCHO + NH
3+ H
2O
2Cette réaction se déroule en trois temps : le substrat est tout d’abord oxydé, générant l’imine correspondante et le co-facteur FAD est réduit en hydroquinone (1). L’imine s’hydrolyse ensuite en aldéhyde, libérant de l’ammoniaque (2). Lors de la réoxydation du co-facteur FAD par l’oxygène, du peroxyde d’hydrogène est produit (3).
1) RCH2NH2 + E-FAD ⇒ RCH=NH + E-FADH2 2) RCH=NH + H2O ⇒ R-CHO + NH3
3) E-FADH2 + O2 ⇒ E-FAD + H2O2
L’aldéhyde produit lors de cette réaction est ensuite transformé en acide carboxylique ou en alcool, par un aldéhyde déshydrogénase ou une aldéhyde réductase.
b. Rôle au niveau du système nerveux central
Au niveau central, les MAOs participent au turnover et donc à l’inactivation des catécholamines et de la sérotonine, mais également à la détoxification de certains xénobiotiques.
Revue Générale
6
Ainsi, le 1-méthyl-4-phényl-1,2,3,6-tétrahydropyridine ou MPTP, un puissant neurotoxique provenant de drogues synthétiques (mépéridine), est métabolisé par la MAO-B en MPP+ ou 1-Methyl-4-phenylpyridinium, un métabolite capté spécifiquement par les neurones dopaminergiques et les détruisant, provoquant des symptômes ressemblant à ceux de la maladie de Parkinson.
Certaines maladies dues à un défaut dans la synthèse de monoamines (maladie de Parkinson, d’Alzheimer) sont soignées par des inhibiteurs de monoamine oxydases (IMAOs).
La maladie d’Alzheimer est semble-t-il associée à une augmentation de l’activité MAO-B (Saura et al. 1994b).
De plus, des études comportementales réalisées sur des animaux délétés pour la MAO-A ou la MMAO-AO-B ont permis de mieux comprendre l’importance de chaque isoforme au niveau central.
Les souris knock-out pour la MAO-A présentent une augmentation de la sérotonine et noradrénaline centrales (Cases et al. 1995); elles présentent une agressivité exagérée. Les animaux knock-out pour la MAO-B présentent une augmentation de β-PEA (Grimsby et al. 1997); elles ne présentent pas de comportement agressif particulier, à la différence de l’Homme où une diminution de la MAO-B plaquettaire semble associée à une augmentation de l’agressivité (Garpenstrand et al. 2002). Cependant ces souris sont plus sensibles au stress et ont une moins bonne capacité d’habituation aux activités locomotrices (Lee et al. 2004b).
Un double knock-out par croisement des deux lignées n’est pas possible du fait de la trop grande proximité des deux gènes, mais ce double knock-out a pu être isolé par mutation spontanée (Chen et al. 2004b). Il présente le même type de comportement agressif que le knock-out MAO-A.
Enfin, les MAOs, interviennent dans le développement et la maturation de certaines zones du cerveau (Nicotra et al. 2004) et, de par l’importante production d’espèces réactives de l’oxygène, elles interviennent dans les processus de vieillissement cérébral (Strolin Benedetti and Dostert 1989; Cadenas and Davies 2000), d’autant que de nombreuses études ont montré une augmentation de leur expression dans certaines régions du cerveau avec l’âge (Fowler et al. 1997; Mahy et al. 2000; Nicotra et al. 2004).
Revue Générale
7
c. Rôle au niveau des organes périphériques
Au niveau hépatique et intestinal, les MAOs participent à la détoxification des amines biogènes comme la tyramine (O'Carroll et al. 1983) (figure 2.) mais aussi de certains xénobiotiques comme le 1-méthyl-4phényl-1,2,3,6-tétrahydropyridine ou MPTP (Benedetti 2001).
Les MAOs rénales (Fernandes and Soares-da-Silva 1992; Saura et al. 1992) participent a la régulation de la concentration de monoamines produites. Ces monoamines (sérotonine, dopamine) jouent un rôle majeur dans la régulation des fonctions rénales (filtration, excrétion, réabsorption). Les MAOs, en régulant les concentrations de ces amines pourraient participer à la régulation de la fonction rénale (Fernandes and Soares-da-Silva 1994; Soares-da-Silva et al. 1996a).
Figure 2. Métabolisme de la tyramine alimentaire (Youdim and Weinstock 2004)
d. Nouveau rôle lié à la production d’EROs
Pancréas : Les MAOs pancréatiques pourraient participer à la libération d’insuline. En effet, une stimulation pharmacologique des récepteurs β2-adrénergiques (terbutaline) semble stimuler l’activité des MAOs pancréatiques, entraînant une modification de l‘état redox des îlots β pancréatiques par libération d’H2O2 (Panagiotidis et al. 1993c).
Revue Générale
8
Rein : Le rein est un organe ayant l’une des activités MAO les plus importantes (Fernandes and Soares-da-Silva 1990; Fernandes and Soares-da-Silva 1992; Saura et al. 1992; Pizzinat et al. 1998). Dans les cellules du tubule proximal les MAOs sont la principale voie de dégradation de la sérotonine et de la dopamine, qui participent à la régulation de la réabsorption du sodium (Hubbard and Henderson 1995; Soares-da-Silva et al. 1996b; Aperia 2000). De plus, le peroxyde d’hydrogène produit par les MAOs lors de la dégradation de la dopamine peut, en fonction de sa concentration (et de la concentration en substrat) être prolifératif (Vindis et al. 2000) ou proapoptotique (Bianchi et al. 2003). In vivo, le peroxyde d’hydrogène produit par les MAOs lors de phénomènes d’ischémie / reperfusion chez le rat est responsable de dommages tissulaires (Kunduzova et al. 2002a; Kunduzova et al. 2002b).
Tissus adipeux : Le tissu adipeux blanc et brun de rat, et les adipocytes humains expriment la MAO, notamment la MAO-A (Pizzinat et al. 1999c), susceptible de générer du peroxyde d’hydrogène lors du métabolisme de la tyramine (Raimondi et al. 2000). De plus, le transport de glucose (Marti et al. 1998) et la production d’AMPc (Raimondi et al. 2000) par les adipocytes soient augmentés par la tyramine en relation avec la production de peroxyde d’hydrogène par les MAOs. La lipolyse est également régulée négativement par les MAOs (Visentin et al. 2003). Ces résultats indiquent un rôle important des MAOs dans la balance stockage/lipolyse du tissu adipeux, favorisant plutôt le stockage.
De nombreux autres organes expriment également l’une ou l’autre isoforme de MAO. Ainsi le cœur est un organe exprimant fortement la MAO-A (Cao Danh et al. 1984; Sawyer et al. 2002). L’expression des MAOs augmente avec l’âge dans certains organes comme le coeur (Maurel et al. 2003) et pourrait contribuer au processus de vieillissement tissulaire par le stress oxydant qu’elles engendrent (Cadenas and Davies 2000).
Substrats et inhibiteurs
La spécificité de substrat et d’inhibiteur de chacune des deux isoformes de la MAO est résumée dans le tableau 2.
Revue Générale
9
a. Substrats
Il existe une spécificité de substrat chez les deux enzymes, la MAO-A métabolisant plutôt la sérotonine, la MAO-B ayant comme substrat préférentiel la β-phényléthylamine. Certains substrats sont communs, comme la dopamine et la tyramine qui sont métabolisées avec la même efficacité par les deux enzymes.
Tableau 2. Principaux substrats et inhibiteurs des MAOs (Vindis, 2001)
MAO-A MAO-A ET
MAO-B MAO-B
SUBSTRAT Sérotonine Dopamine
Adrénaline Noradrénaline Tyramine b-phenylethylamine Benzylamine Methyl-histamine MPTP INHIBITEURS
REVERSIBLES Moclobémide Toloxatone Befloxatone RO-41-1049 brofaromine
Milacémide RO-19-6327
INHIBITEURS
IRREVERSIBLES Clorgyline LY51641 Iproniazide Pargyline Phenelzine tranylcypromine
L-déprényl LY54761
Cependant, même si chaque isoforme a une affinité variable en fonction du substrat (chacune ayant son ou ses substrats de prédilection), à de fortes concentrations d’enzyme ou de substrat, elles métabolisent de manière moins spécifique un substrat avec lequel elles ont moins d’affinité.
Des xénobiotiques, dont l’exemple le plus connu est le MPTP, sont également susceptibles d’être dégradés par les MAOs (Trevor et al. 1987).
Parmi les substrats des MAOs, se trouvent certains dérivés méthylés de catécholamines ou de la sérotonine, produits respectivement par la catéchol-O-méthyltransferase (COMT) et la 5-hydroxyindole-O- catéchol-O-méthyltransferase (5-HIOMT).
Enfin, les MAOs partagent certains de leurs substrats avec d’autres enzymes, comme la benzylamine, principalement métabolisée par la SSAO (semicarbazide sensitive amine oxidase) ou la méthyl-histamine, généralement métabolisée par la DAO (diamine oxidase) ou la SSAO.
Revue Générale
10
Notons que parmi ces substrats, la sérotonine, un substrat plus spécifique de la MAO-A, présente des effets biologiques qui feront l’objet d’un chapitre particulier.
b. Inhibiteurs
Les inhibiteurs de MAO ont été développés pour soigner des maladies telles que la dépression. Les premiers IMAOs mis sur le marché étaient non spécifiques d’une forme de MAO et irréversibles (phénelzine, iproniazide, tranylcypromine). Leur utilisation a entraîné d’importants effets secondaires comme une hépatotoxicité, et des risques d’interaction médicamenteuse avec d’autres antidépresseurs de type tricycliques (inhibiteurs du transport de la sérotonine) ou des opiacés. De plus, du fait de leur liaison irréversible à l’enzyme, leur utilisation a entraîné des crises hypertensives baptisées « cheese-effect » car induites entre autre par une consommation de fromages, mais aussi de bière, de chocolat et plus généralement tous les aliments riches en tyramine.
L’industrie pharmaceutique a développé une large gamme d’IMAOs irréversibles ou réversibles, spécifiques de l’une ou l’autre des deux enzymes ou aspécifiques. Ces inhibiteurs appartiennent à plusieurs grandes familles :
Les inhibiteurs irréversibles sont reconnus par l’enzyme et convertis en intermédiaires réactifs qui réagissent avec le groupement FAD de la MAO, formant des adduits covalents stables, rendant l’enzyme inactive (Cesura and Pletscher 1992):
# Les dérivés de l’hydrazine (iproniazide, phenelzine)
# Les dérivés de la cyclopropylamine (tranylcypromine, LY51646, LY54761) # Les dérivés acétyléniques non sélectifs (pargyline), sélectifs de la MAO-A (clorgyline), ou de la MAO-B (L-déprényl, rasagiline).
Les inhibiteurs réversibles du fait de leur réversibilité, n’entraînent pas d’interactions médicamenteuses ou de contraintes alimentaires (Cesura and Pletscher 1992):
# Inhibiteurs à structure oxazolidinone (toloxatone, befloxatone) # Dérivés de la moclobémide
Revue Générale
11
# Inhibiteurs à groupement 2-aminoéthyl carboxamide (RO-41-1049 et RO-19-6327)
Pathologies associées
a. Les maladies neurodégénératives et psychiatriques
De nombreuses pathologies neurologiques sont dues à un déséquilibre dans la synthèse ou la dégradation des catécholamines et de la sérotonine.
Ainsi la sérotonine est augmentée dans certaines migraines et diminuée dans certains syndromes dépressifs et de nombreux désordres psychiatriques (certains symptômes de la maladie de Huntington, anxiété, instabilité d’humeur, impulsivité et agressivité, désordre obsessionnel compulsif, désordres bipolaires, boulimie, schizophrénie et suicide) (Bell et al. 2005). Du fait de son rôle particulier dans le sommeil, la baisse de sérotonine est également une cause d’insomnie chez les personnes dépressives (Wilson et al. 2000). Une famille de Hollandais, présentant chez ses sujets masculins une agressivité exagérée, possède une mutation du gène codant la MAO-A, et donc homozygote chez les hommes puisque situé sur le chromosome X (Brunner et al. 1993).
La maladie de Parkinson est une maladie neurodégénérative liée à une destruction des neurones dopaminergiques du ganglion basal du cerveau, impliquant une baisse de dopamine la plus connue et étudiée.
Des traitements à base d’inhibiteurs de transporteurs (inhibiteurs de ré-uptake) ou d’inhibiteurs de monoamine oxydases sont depuis longtemps utilisés pour diminuer les effets de ces maladies ; cependant de nombreux inhibiteurs de monoamine oxydases ont été retirés du marché notamment à cause du « cheese effect » ; actuellement les inhibiteurs utilisés ou en cour de développement sont souvent réversibles (moclobémide et brofaromine pour la MAO-A et lazabémide pour la MMAO-AO-B par exemple), ou spécifiques du cerveau et non des organes périphériques ce qui évite cet effet secondaire (cf. tableau 3)
Revue Générale
12
Tableau 3. Inhibiteurs réversibles et irréversibles des monoamine oxydases utilisés ou ayant été utilisés en médecine (D’après http://www.cnsspectrums.com/aspx/articledetail.aspx?articleid=400) Sélectivité Réversibilité Antidépresseur Iproniazide Phénelzine Isocarboxazide Tranylcypromide Nialamide Clirgyline Moclobémide Brofaromide A+B A+B A+B A+B A+B A A A Irréversible Irréversible Irréversible Irréversible Irréversible Irréversible Réversible Réversible En cour de développement Ladostigil M30 Befloxatone
A+B (sélectif du cerveau) A+B (sélectif du cerveau)
A Irréversible Irréversible Réversible Anti-Parkinsonien Sélégiline (déprényl) Rasagiline (azilect, agilect)
lazabémide B B B Irréversible Irréversible Réversible En cour de développement M30 ladostigil
A+B (sélectif du cerveau) A+B (sélectif du cerveau)
Irréversible Irréversible
b. Le diabète
Les MAOs et leurs substrats sont présents dans le pancréas exocrine (Lenzen et al. 1983) et endocrine. Dans les îlots bêta la MAO colocalise avec l’insuline dans les granules de sécrétion (Adeghate and Donath 1990; Panagiotidis et al. 1993b).
Les MAOs jouent un rôle dans la régulation de la glycémie, en particulier la sécrétion d’insuline, via la production de peroxyde d’hydrogène (Panagiotidis et al. 1993c). En effet, de nombreuses études montrent que l’inhibition des MAOs stimule la sécrétion d’insuline chez des lapins (Aleyassine and Gardiner 1975; Feldman and Chapman 1975). De même, une administration de L-DOPA (précurseur d’un des substrats des MAOs, la dopamine) diminue la sécrétion d’insuline sur des îlots pancréatiques de souris (Lundquist et al. 1991). Des souris normales mises a jeun une nuit, ont une activité MAO pancréatique augmentée de 35 à 70 %, associée à une diminution de glucose et d’insuline plasmatiques, bien que sur souris obèses, l’activité MAO n’est pas modifiée par le jeune (Panagiotidis et al. 1993a).
Revue Générale
13
L’activité MAO dans le pancréas est fortement réduite chez les diabétiques, et associée à une augmentation des taux tissulaires de noradrénaline, adrénaline et sérotonine (Adeghate et al. 2001). L’adrénaline augmente la sécrétion d’insuline pancréatique de sujets sains mais semble la bloquer, dans les pancréas de sujets diabétiques. Des constatations identiques ont été faites avec la noradrénaline (Lindskog and Ahren 1992), et la sérotonine (Coulie et al. 1998).
L’augmentation d’adrénaline, de noradrénaline et de sérotonine pancréatiques pourrait donc contribuer à la diminution de sécrétion d’insuline observée dans le diabète, bien qu’étant responsables d’une augmentation de cette sécrétion dans des pancréas de sujets sains.
Revue Générale
14
II. Monoamine oxydases et stress oxydant
L’impact des MAOs sur la signalisation cellulaire a longtemps été associé à leur rôle dans la régulation de la concentration en substrat, par exemple dans la maladie de Parkinson, où elles constituent une cible thérapeutique ; en effet cette maladie est caractérisée par une disparition des neurones dopaminergiques, entraînant un déficit en dopamine dans le système nerveux central. Les inhibiteurs de la MAO-B (qui dégrade la dopamine) par exemple le déprényl, ont été l’une des premières approches thérapeutiques développées pour augmenter la biodisponibilité de dopamine et ainsi ralentir l’évolution de cette maladie et restent encore actuellement l’un des traitements utilisés. D’autres travaux ont attribué un rôle aux métabolites (aldéhydes) produits lors de la dégradation de leur substrat, dans la maladie d’Alzheimer par exemple (Burke et al. 2001).
Il a récemment été envisagé un autre mode d’action des MAOs impliquant la production d’EROs lors de la dégradation de leur substrat. Via cette production d’EROs et le stress oxydant ainsi généré, les deux types de monoamine oxydases sont associés à une signalisation proapoptotique, hypertrophique ou mitogène selon le type cellulaire et la concentration de substrat en présence.
Apoptose
Le rôle des MAOs dans l’induction d’une cascade pro-apoptotique a d’abord été étudié dans le système nerveux central, dans le cadre de maladies neurodégénératives comme la maladie de Parkinson ; des travaux récents menés in vitro impliquent notamment les deux monoamine oxydases (MAO-A et MAO-B), attribuant ces effets à la production de métabolites aldéhydiques neurotoxiques, mais aussi à la libération d’EROS lors de la dégradation de la dopamine dans ce processus (Nagatsu and Sawada 2006; Naoi et al. 2006; Fitzgerald et al. 2007).
La cascade de signalisation apoptotique de la MAO a été décrite sur cellules tubulaires rénales HEK293 (MAO-B), et sur différents modèles cellulaires tels que PC12 : phéochromocytome (De Zutter and Davis 2001), M14 : mélanome (Malorni et al. 1998) et neuroblastome (Yi et al. 2006) (MAO-A). Deux effecteurs en amont de MAO-A ont été décrits (Bcl2 serait antiapoptotique et son augmentation bloquerait l’effet apoptotique de MAO-A (Yi et al. 2006)) ; P38MAP kinase semble au contraire favoriser l’action de MAO-A
Revue Générale
15
en augmentant l’expression de la flavoenzyme conduisant à l’apoptose de la cellule (De Zutter and Davis 2001).
L’apoptose induite par la MAO-A ou la MAO-B implique une modification du ratio Bax/Bcl2, une libération de cytochrome c, et une activation de la caspase3 (Bianchi et al. 2003; Ou et al. 2006). L’apoptose induite par les MAOs a également été décrite sur tissus rénaux et sur cardiomyocytes suite à une ischémie/reperfusion (Kunduzova et al. 2002a; Kunduzova et al. 2002b; Bianchi et al. 2005a), et dans ces deux cas, le phénomène de reperfusion est accompagné d’une augmentation de l’activité de l’enzyme, avec une augmentation de la libération de peroxyde d’hydrogène et mort cellulaire ou lésion de l’organe.
Les derniers travaux de l’équipe ont mis l’accent sur un rôle des espèces réactives de l’oxygène libérées par les MAOs dans les dommages cardiaques suite à une ischémie/reperfusion (Bianchi et al. 2005a) et dans l’apoptose de cardiomyocytes (Bianchi et al. 2005a; Krymskaya et al. 2005; Pchejetski et al. 2007).
Hypertrophie (cardiomyocytes)
Des cardiomyocytes mis en présence de sérotonine s’hypertrophient. Cette hypertrophie est due en partie au récepteur sérotoninergique 5HT2B mais également, à la production d’espèces réactives de l’oxygène engendrée par la MAO-A (Bianchi et al. 2005b). L’hypertrophie cardiaque observée est due à une phosphorylation de Erk1/2.
Prolifération
L’effet prolifératif des MAOs a été montré sur cellules rénales HEK293 (Vindis et al. 2000), et des études menées sur des cellules musculaires lisses pulmonaires ont montré que le transporteur à la sérotonine était nécessaire à la prolifération de ces cellules, suggérant un rôle en aval pour la MAO-A (Eddahibi et al. 1999; Eddahibi et al. 2000; Eddahibi et al. 2001; Lawrie et al. 2005; Morecroft et al. 2005).
Cet effet emprunte les voies classiques de la prolifération (phosphorylation et nucléarisation de Erk1/2 et activation nucléaire des promoteurs mitogènes comme GATA4).
Revue Générale
16
III. Stress oxydant et athérosclérose
Les maladies cardiovasculairesL’athérosclérose est l’une des principales causes d’apparition des maladies cardiovasculaires (infarctus du myocarde et coronaropathies, accident vasculaire cérébral…), qui sont la première cause de morbidité et de mortalité dans les pays industrialisés avec près de 180000 décès par an en France et 16,7 millions dans le monde (selon le « Rapport sur la santé dans le monde » de 2003 de l’OMS). La prévalence de ces maladies devrait croître dans les prochaines années en raison de l’adoption par des populations jusque-là épargnées de modes de vie occidentaux (ceux-ci étant associés à une augmentation des risques). La connaissance des facteurs de risque d’apparition de ces maladies, notamment de l’athérosclérose, et leur prévention est actuellement un enjeu de santé publique majeur.
Facteurs de risque
Divers facteurs de risque favorisent l’apparition et le développement des plaques d’athérome (Sanz et al. 2007)
♦ L’hypercholestérolémie et l’hypertriglycéridémie ♦ une pression artérielle élevée
♦ le diabète ♦ l’hérédité
♦ le tabagisme (le tabagisme a été montré comme facteur aggravant et accélérant le développement des plaques d’athérome au niveau coronarien, aortique et dans les artères des membres inférieurs).
♦ L’obésité et la sédentarité
♦ Le sexe (les hommes étant des sujets à risque par rapport aux femmes).
Chronologie du processus atheromateux
Il est possible d’établir la chronologie des principaux événements précoces de l’athérosclérose (Schachter 1997)
Revue Générale
17
Î Activation et augmentation de la perméabilité endothéliale Î Infiltration et rétention des lipoprotéines (LDLs)
Î Oxydation de ces LDLs Î Recrutement des monocytes
Î Migration des cellules musculaires lisses vers l’intima et prolifération
Î Activation et augmentation de la perméabilité endothéliale (Hadi et al. 2005)
Les cellules endothéliales activées participent activement à l’athérogénèse. Dans des conditions normales, l’endothélium (au repos), possède surtout des propriétés antithrombogéniques en s’opposant à l’activation plaquettaire (synthèse de protéoglycanes) et à la coagulation (thrombomoduline, protéine C et S) et en favorisant la fibrinolyse (activateurs du plasminogène). L’activation des cellules endothéliales peut être induite par des forces de cisaillement et ceci entraîne une augmentation de la perméabilité et la synthèse de molécules prothrombogènes (thromboplastine tissulaire et d’inhibiteurs de l’activateur du plasminogène).
Î Infiltration et rétention des lipoprotéines (Mertens and Holvoet 2001)
Lorsque les cellules endothéliales sont activées elles synthétisent de grandes quantités de protéoglycanes. Ceux-ci sont chargés négativement et ceci entraîne de nombreuses interactions avec d’autres molécules dont les LDLs. Ce système de contact retient les lipoprotéines dans la paroi vasculaire.
Î Oxydation des LDLs (Mertens and Holvoet 2001)
L’activation de l’endothélium induit un stress oxydatif qui altère de nombreuses fonctions de l’endothélium dont le tonus vasomoteur, en réduisant la biodisponibilité de monoxyde d’azote. Celle-ci peut résulter de l’augmentation de la dégradation du NO par les radicaux libres. Le radical libre le plus impliqué dans l’inactivation du NO est l’anion
Revue Générale
18
superoxyde (O2•-) qui semble être produit principalement par la NADH/NADPH oxydase
endothéliale. L’activité de cet enzyme est régulée par les forces mécaniques (ou forces de cisaillement), par les cytokines et des hormones ; tous ces stimuli entraînent une augmentation soutenue de l’activité de l’oxydase. Les radicaux libres tels que O2•- peuvent réagir avec le
NO pour former le peroxynitrite, agent qui catalyse l’oxydation des acides gras polyinsaturés, composants essentiels des phospholipides et des esters de cholestérol dans les particules LDL.
Î Recrutement des monocytes (Kraemer 2000; Bobryshev 2006)
L’activation des cellules endothéliales induit une expression d’intégrines ou protéines d’adhésion à la surface de l’endothélium, participant à la réaction inflammatoire. En effet, ces protéines se lient spécifiquement aux récepteurs des monocytes permettant ainsi leur adhésion puis leur pénétration dans l’intima artérielle. Les LDLs oxydées jouent également un rôle de chimioattractant sur les monocytes. Une fois dans l’intima, ils se différencient en macrophages. Ceux-ci internalisent et métabolisent différents composants dont les LDLs modifiées, et deviennent spumeux.
Î Migration et prolifération des cellules musculaires lisses dans l’intima (Kraemer 2000; Willis et al. 2004; Bochaton-Piallat and Gabbiani 2005)
Sous l’impulsion de signaux chimioattractants (dont les LDLs oxydées, différents facteurs de croissance-PDGF, bFGF, TGFβ…-, et d’autres signaux chimioattractants- composants de la matrice…), les cellules musculaires lisses migrent vers l’intima. Les cellules musculaires lisses synthétisent une chape fibreuse riche en collagène, pouvant se calcifier avec le temps. La nature de la chape conditionne la stabilité de la plaque.
Ce phénomène s’auto-entretient ensuite, les macrophages et les cellules musculaires lisses, comme les cellules endothéliales pouvant oxyder des LDLs. Par la suite, certaines cellules entrent en apoptose, sous l’effet de cytokines proinflammatoires (Littlewood and Bennett 2003; Lee and Hirani 2006), de LDLs fortement oxydées (Salvayre et al. 2002). Tous les types cellulaires sont concernés par l’apoptose, contribuant à l’augmentation de volume du core lipidique acellulaire.
Revue Générale
19 Les espèces réactives de l’oxygène (EROs)
a. Définition
Les espèces réactives de l’oxygène sont une famille d’entités chimiques regroupant les dérivés non radicalaires (ne possédant pas d’électron célibataire) et les radicaux libres oxygénés (espèces chimiques possédant un électron célibataire - non apparié). On peut distinguer les radicaux primaires, qui ont un rôle physiologique particulier et les radicaux secondaires, issus de la réaction des radicaux primaires avec des entités biochimiques cellulaires (lipides, protéines, glucides…) (Favier 2003; Gardès-Albert M 2003).
b. Les différents dérivés réactifs de l’oxygène
1. Dérivés primaires de l’oxygène
♦ Les dérivés primaires non radicalaires
Ils ne possèdent pas d’électrons non appariés mais sont des précurseurs des radicaux libres et sont aussi réactifs que ceux-ci.
¾ Le peroxyde d’hydrogène H2O2.
Ce n'est pas un radical libre à proprement parler mais une molécule car tous ses électrons périphériques sont appariés. Cependant, il peut générer des radicaux hydroxyle ·OH en présence de cations métalliques tels que Fe2+ (réaction de Fenton), ou Cu+.
H2O2+ Fe2+ → ·OH + Fe3+ + OH- (réaction de Fenton)
Il se forme par dismutation de l’anion super oxyde O2.- sous l’action d’une enzyme : la
superoxyde dismutase (SOD).
SOD
Le peroxyde d’hydrogène, bien que moins réactif que certains autres EROs, n’en est pas moins un agent de signalisation efficace de par son effet prolongé, au radical hydroxyle à l’effet éphémère et à la demi-vie courte. De plus, en réagissant avec l’anion superoxyde, il fournit l’hydroxyle (réaction de Haber-Weiss)
Revue Générale
20 ¾ L’oxygène singulet 1O
2 .
C’est une molécule mise en état d’excitation par activation photochimique de l’oxygène :
O2 1O2
hυ
ou par réaction du peroxyde d'hydrogène avec l'acide hypochlorique HOCl : H2O2+ HOCl H2O + H+ + Cl-+1O2
¾ L’acide hypochlorique HOCl.
Essentiellement produit par les myeloperoxydases leucocytaires à partir de peroxyde d’hydrogène et d’ion chlorure :
H2O2+ H+ + Cl- H2O + HOCl
¾ Le peroxynitrite ONOO- .
Il est produit par réaction du monoxyde d’azote avec un anion superoxyde NO. + O2.- ONOO-
♦ Les radicaux libres oxygénés
Ils possèdent un électron libre non apparié et sont extrêmement réactifs.
¾ Le radical hydroxyle .OH (le plus réactif des radicaux libres oxygénés).
Le radical hydroxyle est particulièrement délétère vis-à-vis des matériaux biologiques. Il peut se former par réaction du peroxyde d’hydrogène avec un ion ferreux (réaction de Fenton)
Revue Générale
21
ou par réaction du peroxyde d’hydrogène avec l’anion superoxyde (réaction de Haber-Weiss) H2O2+ O2.- .OH + OH- + O2
ou sous l’effet de radiations ionisantes (rayons X ou gamma).
De par sa demi-vie courte (inférieure à la microseconde), et à la faible distance qu’il peut parcourir (moins de dix nanomètres), il diffuse peu et agit directement sur le site de production.
¾ L’anion superoxyde O2.-.
Il peut se former par réaction de l’oxygène avec un électron (généralement cet électron provient d’une fuite au niveau de la chaîne respiratoire mitochondriale, plus précisément l’accepteur terminal : la cytochrome oxydase du complexe IV de la chaîne de transport électronique de la membrane interne mitochondriale). Ainsi l’oxygène n’est réduit que partiellement : 2% de l’oxygène subit une réduction mono électronique au niveau de l’ubiquinone.
O2 + e - O2.-
La NADPH oxydase est également une source importante d’anion super oxyde. NADPH + 2O2 NADP + + H+ + 2 O2.
-NADPH oxydase
Le radical superoxyde est moins réactif que l’hydroxyle, mais sa durée de vie est longue (Gardès-Albert M 2003) et peut diffuser loin de son lieu de production. Ce radical a peu de cibles privilégiées (les superoxyde dismutases, le cytochrome c, l’ascorbate), il réagit avec le peroxyde d’hydrogène pour fournir l’hydroxyle.
¾
Le radical perhydroxyle HO2 .Revue Générale
22 ¾ Le monoxyde d’azote ou oxyde nitrique NO. .
C’est un agent vasodilatateur (Moncada and Higgs 1993; Cosentino F 2002). Il est synthétisé par les NO synthases (NOS) selon la réaction :
L- Arginine + O2 L-Citrulline + NO.
NOS
2. Dérivés secondaires de l’oxygène
Ces radicaux se forment par réaction des radicaux primaires ci-dessus avec certains composés biochimiques de la cellule.
¾
Le radical peroxyle RO2 .C’est un radical très réactif avec la plupart des molécules, notamment impliqué dans la propagation de l’oxydation des acides gras poly insaturés des membranes cellulaires.
¾ Le radical alkoxyle RO.
c. Les principales sources d’espèces réactives de l’oxygène
1. Sources exogènes d’espèces réactives de l'oxygène
Elles sont surtout d’origine physique et chimique (ex radiations X ou gamma, UVA,
radiolyse de l’eau, réactions photochimiques ...).
2. Sources endogènes d’EROs
♦ Sources endogènes d’EROs enzymatiques La chaîne respiratoire mitochondriale
La chaîne respiratoire mitochondriale est constituée d’un ensemble de transporteurs d’électrons mobiles ou membranaires. Au niveau de la chaîne respiratoire a lieu une réduction contrôlée de l’oxygène en eau. Cependant ce système peut laisser fuir quelques électrons qui vont réduire partiellement l’oxygène. 2 % de l'oxygène subit une réduction mono électronique
COO ° O COOH O ° O
Revue Générale
23
(addition d'un seul électron) conduisant à la formation du radical superoxyde O2.- (au niveau
de l’ubiquinone ou co-enzyme Q) dont elles sont le principal site de production. O2+ 1 e-→ O2
.-Cette réaction entraîne une accumulation de peroxyde d’hydrogène qui peut réagir avec les ions ferreux de la mitochondrie (réaction de Fenton) et produire des ions hydroxyles OH. . Le rôle du stress oxydant généré par la mitochondrie a été largement documenté dans de nombreuses pathologies, dont l’athérosclérose (Nelson et al. 2004; Ballinger 2005).
Les complexes enzymatiques du réticulum endoplasmique (cytochromes P450)
Les enzymes de la famille cytochrome p450 (CYPs) sont des monooxygénases non spécifiques, exprimées principalement dans le réticulum endoplasmique appartenant à des systèmes multi enzymatiques, incluant la NADPH-cytochrome P450 réductase et le cytochrome b5 contenant les coenzymes FAD/FMN. Cette superfamille catalyse des réactions
d’oxydation de leur substrat (oxydation, péroxydation, et/ou réduction par O2 de manière
dépendante de NADPH) selon la réaction suivante :
RH + O2 + H+ + NADPH ROH + H2O + NADP+
La réaction consomme une molécule d’oxygène, de 2 protons, et de 2 électrons. Dans cette réaction RH est un substrat lipophile. .
Lors de la réaction, une molécule d’oxygène doit être « activée » : elle est scindée en deux ; 1. - un atome d'oxygène est introduit dans le substrat :
RH→ROH (ω-hydroxylation) 2. - l'autre atome est réduit par 2 électrons pour donner de l'eau :
1/2O2 + 2 e- + 2 H+→ H2O (β-oxydation)
Parmi les substrats de cette réaction, on compte des substances endogènes comme le cholestérol, les stéroïdes, l’acide arachidonique (qu’ils transforment en eicosanoïdes), et des xénobiotiques. Les CYPs produisent des ions superoxyde O2− et du peroxyde d’hydrogène
Revue Générale
24
o Soit si l’oxygène est réduit au lieu d’être ajouté au substrat lors de l’étape de ω-hydroxylation, ceci en fonction du substrat métabolisé.
o Soit l’un des électrons peut s’échapper des flavines de l’enzyme NADPH:P450 réductase.
Les CYPs sont des sources importantes de ROS contribuant au développement de maladies cardiovasculaires, comme l’hypertension ou les dysfonctions endothéliales (facteurs de risque de l’athérosclérose) (Fleming 2001; Ramos and Moorthy 2005).
Le peroxysome
Le peroxysome est un organite intracellulaire bordé d’une membrane effectuant des réactions de péroxydation lipidique : β-oxydation des acides gras à très longues chaînes (saturés et insaturés). Il réalise également des réactions générant du peroxyde d’hydrogène dans la cellule : des enzymes oxydantes sont présentes dans cet organite : la D-amino-acide-oxydase, l’urate-D-amino-acide-oxydase, et glycolate oxydase.
Réactions catalysées par ces enzymes D-aminoacide oxydase
D-aminoacid + H2O+ O2 → 2−oxo aminoacid + NH3 + H2O2
Urate oxydase
Acide urique + O2 → allantoïne + H2O2
Glycolate oxydase
Glycolate + O2 → glyoxylate + H2O2
Bien qu’elles représentent des sources potentielles d’EROs, à ce jour aucune étude n’a montré l’implication de ces enzymes dans la pathologie athéromateuse. En effet le péroxysome est avant tout un organite de détoxification contre les EROs (dans cet organite est localisée la catalase, une enzyme chargée de dismuter le peroxyde d’hydrogène en eau + O2).
Revue Générale
25 La xanthine oxydoréductase
La xanthine oxydoréductase est la principale enzyme de la dégradation des bases puriques. Elle a pour coenzyme un dérivé du GTP, avec un noyau ptérine et un atome de Molybdène. Sa structure comporte encore deux FAD et plusieurs centres Fer-Soufre (molybdoflavoenzyme). Sa localisation subcellulaire est encore discutée : elle est présente dans le cytoplasme (Jarasch et al. 1981), mais aurait également été détectée dans les péroxysomes (Angermuller et al. 1987; Dikov et al. 1988) . Enfin les travaux les plus récents montrent sa présence sur la membrane cellulaire externe (Rouquette et al. 1998; Frederiks WM 1999). L'enzyme comporte une forme réduite (xanthine déshydrogénase - XDH) catalysant la déshydrogénation avec le NAD+ comme coenzyme. Elle peut être convertie par oxydation en un dimère (xanthine oxydase) fonctionnant avec l'oxygène et produisant des peroxydes. In vivo, la forme réduite prédomine dans le foie et la forme oxydée dans les vaisseaux (Berry and Hare 2004).
La xanthine oxydase (XO) est une source importante de radicaux libres. Elle transforme l’hypoxanthine en xantine puis en acide urique, produisant au cours de chacune de ces deux réactions un anion superoxyde. La xanthine déshydrogénase produit quant à elle une molécule de peroxyde d’hydrogène par molécule d’hypoxanthine hydrolysée.
Xanthine oxydase
Hypoxanthine + H2O+ O2 → xanthine + O2.- → Acide urique
Xanthine déshydrogénase
Hypoxanthine + H2O+ NAD+ → xanthine + (NADH, H+)
Xanthine + H2O + O2 → Acide urique + H2O2
Au niveau vasculaire, la xanthine oxydase fournit 25% des ions superoxyde O2·-
(Guzik et al. 2006) et est fortement impliquée dans les maladies cardiovasculaires (Madamanchi et al. 2005)
Revue Générale
26 La NADPH oxydase et les NOX
> La NADPH oxydase phagocytaire et la myéloperoxydase des polynucléaires La NADPH oxydase est un complexe enzymatique multi protéique, appartenant aux phagocytes (polynucléaires neutrophiles et éosinophiles, monocytes et macrophages) et aux lymphocytes B. Elle catalyse le transfert d'électrons de son substrat le NADPH à l'accepteur final l'oxygène entraînant la production d'anions superoxyde et ses dérivés de réduction : le peroxyde d'hydrogène, le radical hydroxyle et l'oxygène singulet. Ces composés oxydants sont capables de tuer les micro-organismes préalablement endocytés.
NADPH + 2O2 NADP+ + H+ +O2
.-Les neutrophiles posssèdent également une myéloperoxydase qui catalyse la réaction du peroxyde d’hydrogène produit à partir de l’anion superoxyde avec des ions chlorure pour produire l’ion hypochloride OCl− et participe à la lutte contre les agents pathogènes
H2O2 + C l- HOCl+ OH
-HOCl OCl- + H+
La NADPH phagocytaire semble impliquée dans l’oxydation des LDLs, et de différentes cibles et dans la mort cellulaire des macrophages (apoptose) induite par la captation d’oxystérols (Leonarduzzi et al. 2006). Des effets similaires ont été décrits pour la myéloperoxydase (Madamanchi et al. 2006). Il semble que la NADPH oxydase fournisse plus de 60% des ions superoxyde O2·-(Guzik et al. 2006). La NADPH oxydase jouerai un rôle actif
dans l’athérosclérose (Ushio-Fukai and Alexander 2004). > Les NOX
La NADPH oxydase phagocytaire est longtemp restée la seule enzyme décrite spécialisée dans la génération d’ions superoxyde, dans le but de défendre l’organisme contre une invasion de microorganismes. Ces 5 dernières années, de nouveaux membres de la famille de la NADPH oxydase phagocytaire, les NOX (NADPH oxydase), comprenant sept homologues, ont été découverts. Elles sont exprimées dans de nombreux tissus dont le système vasculaire. A ce niveau, l’un de leurs rôles physiologiques serait d’assurer un tonus vasculaire. Les NOX pourraient également jouer un rôle dans la régulation de la prolifération cellulaire. Elles jouent également un rôle dans la physiopathologie de l‘athérosclérose via la production d’EROs (Cai et al. 2003; Ushio-Fukai and Alexander 2004).
Revue Générale
27 Les NO synthases
Elles catalysent la réaction suivante :
L- Arginine + O2 L-Citrulline + NO.
NOS
Cette réaction dépend de nombreux co-facteurs : NADPH, FAD, FMN, BH4
(tetrahydrobioptérine) et fer.
Il existe quatre isoformes de NOS : eNOS (endothélial NOS) décrite pour la première fois dans des cellules endothéliales, nNOS (neural NOS) découverte dans les neurones, toutes les deux dépendantes du calcium et constitutivement actives, et iNOS (inductible NOS) indépendante du calcium (Sessa 1994) ; la quatrième NOS est une NOS mitochondriale découverte récemment (Boveris et al. 2002), et localisée dans la membrane mitochondriale interne. Ces quatre isoformes sont largement distribuées dans l’organisme (Nathan and Xie 1994; Boveris et al. 2002), et parfois co-exprimées dans un même type cellulaire.
> eNOS et nNOS
Elles nécessitent une augmentation du calcium/Calmoduline intracellulaire (Abu-Soud and Stuehr 1993). Le taux basal de NO. synthétisé est relativement faible, mais peut être augmenté suite à une stimulation par des agonistes, comme l’acétylcholine (Bredt and Snyder 1994; Harrison 1997; Tsutsui 2004). Dans les cellules vasculaires la eNOS produit du NO. provoquant une vasodilatation. Au niveau du système nerveux central et périphérique où elle est exprimée, la nNOS joue un rôle dans la réponse neuronale.
> iNOS
iNOS fonctionne indépendamment des concentrations intra-cellulaire en calcium/calmoduline. Son expression est stimulée par des cytokines pro-inflamatoires comme le TNF alpha, les interleukines et la présence d’agents pathogènes. Contrairement aux deux autres NOS, iNOS produit des quantités de NO. très importantes (Tsutsui 2004).
eNOS et iNOS sont impliquées dans l’athérosclérose, bien que la balance entre le bénéfice apporté par la production de NO par eNOS (la déficience de cette enzyme étant associée à un développement des lésions athéromateuses) et les facteurs de risque de développement
Revue Générale
28
comme le diabète engendrés par un excès de iNOS soient encore imparfaitement connus (Cook 2006).
> mtNOS
L’activité de mtNOS est régie par le potentiel de membrane (Korshunov et al. 1997; Kato and Giulivi 2006; Valdez et al. 2006). Une diminution de ce potentiel, provoque un effondrement de la production mitochondriale de NO, alors qu’une hyperpolarisation membranaire potentialise cette production. D’autres signaux, comme par exemple le choc septique, stimulent également cette enzyme (Boveris et al. 2002). A ce jour, cette enzyme n’a pas été impliquée dans l’athérosclérose.
Les cyclooxygénases et lipooxygénases (Vila 2004)
L'activation des phospholipases peut induire une libération d'acide arachidonique qui est métabolisé en prostaglandines et leucotriènes. Cette activité implique un transfert d'électrons qui pourrait initier la formation d'espèces réactives de l’oxygène, par la cyclo-oxygénase et la lipoxygénase.
Les monoamine oxydases
Comme cela a été évoqué lors du chapitre consacré à ces enzymes, lors de l’hydrolyse de leur substrat (amines biogènes), les monoamine oxydases, situées sur la membrane mitochondriale externe, libèrent de façon équimolaire du peroxyde d’hydrogène. L’implication des MAOs et de la dégradation de leurs substrats dans l’athérogénèse n’a jamais été étudiée. Cependant, elles peuvent induire une prolifération (Vindis et al. 2000; Lawrie et al. 2005; Morecroft et al. 2005) ou une apoptose (Bianchi et al. 2003; Bianchi et al. 2005a) cellulaires selon le type cellulaire et la concentration en substrat.
♦ Sources endogènes d’EROs non enzymatiques
L'accumulation d'équivalents réducteurs tels que le NADPH et le NADH (Valdez et al. 2000), le NADPH, les quinones (Boveris et al. 1976; Cadenas et al. 1980) et les
Revue Générale
29
flavoprotéines qui peuvent réagir entre eux ou avec l'oxygène, pourrait induire la formation d'EROs.
L’auto-oxydation des catécholamines
L’apparition de radicaux superoxydes O2°- peut résulter de l'auto-oxydation (oxydation par
l'oxygène) de composés tels que des catécholamines, en particulier la dopamine (Graham et al. 1978; Klegeris et al. 1995). En effet, les catécholamines possèdent une structure dihydroquinone QH2, facilement oxydable, notamment en présence d’ions métalliques tels que le fer Fe2+ ou le cuivre Cu2+.
Chaîne d’initiation : QH2 + OH- QH- + H20 QH- + 02 QH· + 02·- QH- + 02·- + 2H + QH·+ H202 Chaîne de propagation : QH·+ 02 Q + 02·- + H + QH·+ QH· Q + QH2 Chaîne de terminaison : 02·- + 02·- + 2H + H202 + 02
Les produits de cette auto-oxydation (semiquinones, quinones et anion superoxyde O2°-) sont généralement toxiques pour les cellules (Tanaka et al. 1991; Ben-Shachar et al.
1995; Spencer et al. 1998; Stokes et al. 1999).
L’acide urique produit lors de la dégradation des bases puriques par la xanthine déshydrogénase ou la xanthine oxydase est un puissant antioxydant, mais l’enzyme produit en même temps du peroxyde d’hydrogène ou des ions superoxydes selon qu’elle soit sous forme réduite ou oxydée dimérique (xanthine oxydase). De plus, des études montrent que dans le cas de l’athérosclérose, l’acide urique est un facteur aggravant puisque il cause des dommages au niveau de l’endothélium, diminue la biodisponibilité de l’oxyde nitrique (dont nous avons vu précédemment le rôle protecteur) (Culleton et al. 1999; Hamed and Nabeshima 2005).
Espèces réactives de l’oxygène et athérosclérose
a. LES EROs dans l’athérosclérose
Les espèces réactives de l’oxygène jouent un rôle primordial dans l’athérosclérose. Ces espèces réactives de l’oxygène participent à la génération de lipoprotéines oxydées (LDL
Revue Générale
30
ox) qui, selon leur niveau d’oxydation seront mitogènes ou pro-apoptotiques pour les cellules vasculaires (CML et CE) et induisent la génération de cytokines (Puddu et al. 2005).
Le peroxyde d’hydrogène H2O2 joue un rôle important dans le stress oxydant, non
seulement car il est à l’origine d’autres EROs (HOCl, .OH) mais aussi car il agit directement sur les cellules : il peut, selon sa concentration être toxique ou prolifératif (Herbert et al. 1996; Singh et al. 1998; Irani 2000).
Le rôle du radical hydroxyle .OH dans les différentes pathologies cardiovasculaires (athérosclérose, hypertension) a été également largement documenté(Touyz 2003; Bergamini et al. 2004). L’anion superoxyde O2.-est aussi un facteur majeur dans le développement de
l’athérosclérose (White et al. 1994) et de l’hypertension (Nakazono et al. 1991).
Le monoxyde d’azote NO. (provenant essentiellement de eNOS, au niveau des cellules endothéliales) régule le développement des maladies cardiovasculaires (dont l’athérosclérose) (Naseem 2005). Il agit notamment en régulant l’apoptose des différents types cellulaires impliqués dans la formation de la plaque, plus particulièrement les macrophages, et en inhibant la prolifération des cellules musculaires lisses vasculaires. Son rôle est plutôt protecteur car une déficience en eNOS est associée à une augmentation des lésions. Cette molécule semble avoir un rôle ambivalent puisque le diabète, qui est un facteur de risque de l’athérosclérose et des maladies cardiovasculaires, est associé à une surexpression de iNOS et une surproduction de NO. (Cook 2006). La balance entre le bénéfice et le risque lié à cet ERO reste à élucider.
Les cellules vasculaires génèrent également des quantités importantes d’espèces réactives de l’oxygène : ainsi, les CML produisent du peroxyde d’hydrogène sous l’effet de facteurs de croissance (PDGF (Sundaresan et al. 1995)) ou de ligands de certains récepteurs à sept domaines trans-membranaires comme la thrombine (Patterson et al. 1999). Cette production est nécessaire afin d’observer la prolifération des CMLs ; Un effet mitogène direct des CMLs est induit par le peroxyde d’hydrogène (Rao and Berk 1992; Rao et al. 1993). Les EROs semblent également indispensables à la survie des CMLs, puisque une surexpression de la catalase bloque la prolifération et favorise l’apoptose de ces cellules (Tsai et al. 1996; Brown et al. 1999). Enfin, des concentrations exogènes élevées d’EROs provoquent la mort cellulaire par apoptose des CMLs (Li et al. 1997a; Li et al. 1997b). Certains suppresseurs de tumeurs, comme p53, qui joue un rôle important dans la régulation du cycle cellulaire, produisent des EROs nécessaires à leur signalisation : une surexpression de p53 est
Revue Générale
31
mitogène et pro-apoptotique, et génère des EROs intra-cellulaires. Cette production est indispensable à l’effet de p53, puisque lorsqu’elle est supprimée, l’effet pro-apoptotique de p53 est diminué (Speir et al. 1994).
La survie et la mort des cellules endothéliales est également influencée par les EROs : la mort des cellules endothéliales est un évènement important dans la formation de la plaque d’athérome et cet évènement a été largement étudié ; les EROs extra-cellulaires et les molécules modifiées par oxydation (par exemple LDLox) et les EROs intra-cellulaires générés notamment par la NO synthase et la NADPH oxydase sont très toxiques pour les cellules endothéliales (Li et al. 1999; Ray and Shah 2005).
La survie des cellules endothéliales est un phénomène moins étudié ; pourtant il semble que les EROs (notamment produites par la NADPH oxydase) jouent également un rôle dans ce phénomène lors de stimulations pro-apoptotiques des cellules endothéliales (Deshpande et al. 2000).
b. Sources d’EROs produites par les cellules vasculaires
Les cellules vasculaires possèdent de nombreuses enzymes susceptibles de générer des EROs (cyclooxygénases et lipoxygénases, enzymes de la chaîne mitochondriale, cytochrome p450, xanthine oxydase) évoquées précédemment. Cependant la NADPH oxydase non phagocytaire (NOX), exprimée tant dans les CMLs que dans les cellules endothéliales, semble jouer un rôle majeur, comme nous l’avons détaillé dans le chapitre consacré à cette enzyme. La NO synthase est également un producteur d’EROs.
c. Conséquences cellulaires du stress oxydant
Les conséquences biologiques du stress oxydant sont extrêmement variables selon la dose et le type cellulaire (macrophages, cellules endothéliales, cellules musculaires lisses, fibroblastes). De faibles stress augmentent l’activation de signaux mitogènes et la prolifération cellulaire (Natarajan et al. 1995; Madamanchi et al. 2001; Moon et al. 2001; Shen et al. 2001) ainsi que l'expression de protéines d'adhésion (Rojas et al. 2006), des stress moyens (mais physiologiques) faciliteront les dommages à l’ADN, aux mitochondries et l'apoptose (Escargueil-Blanc et al. 1997; Steinberg 1997; Kockx and Herman 1998; Ballinger et al. 2000) alors que de forts stress provoqueront une nécrose, la balance entre apoptose et
Revue Générale
32
nécrose variant d’un type cellulaire à l’autre (Lizard et al. 1999; Burlacu et al. 2001) et des stress extrêmes désorganiseront la membrane cellulaire, entraînant des lyses immédiates.
d. Principales signalisations intra-cellulaires activées par le stress oxydant
¾ Apoptose
La mort cellulaire programmée ou apoptose est un phénomène normal, tout au long de la vie d’un organisme, avec un pic au moment de l’organogenèse. Ce phénomène est très finement régulé, mais des régulations peuvent parfois se produire, entraînant des pathologies diverses. Au niveau cardiovasculaire, l’apoptose serait une étape initiatrice de la formation de la plaque d’athérome, et dans les étapes les plus tardives, comme la fragilisation de plaques puis leur rupture (Harmon and Allan 1997; Dimmeler and Zeiher 2000; Patel et al. 2000; Salvayre et al. 2002). L’apoptose touche tous les types cellulaires impliqués dans la formation de la plaque : les cellules endothéliales, les cellules musculaires lisses et les macrophages.
¾ Survie
Les bénéfices cellulaires des EROs sont essentiellement retrouvés dans les cellules musculaires lisses où ils sont antiapoptotiques ; en effet, l’angiotensine II et le PDGF deux facteurs de croissance antiapoptotiques et promitotiques nécessitent une production d’EROs pour protéger les CMLs de l’apoptose notamment par l’activation de la NADPH oxydase (Sundaresan et al. 1995; Zafari et al. 1998; Ushio-Fukai and Alexander 2004). Un traitement par des antioxydants a même un effet apoptotique (Tsai et al. 1996; Brown et al. 1999). Les EROs jouent également un rôle important dans la balance apoptose/survie des macrophages (Baran et al. 2004) ; un phénomène original a même pu être démontré : de faibles concentrations de LDL oxydées induiraient l’expression de la MnSOD, protégeant par la suite les macrophages de la cytotoxicité induite par des concentrations supérieures en LDL oxydées (Shatrov and Brune 2003).