© Virginie Aspirot-Buron, 2019
Évaluation des capacités cardiorespiratoires et
physiques d'enfants en traitement de chimiothérapie
pour une leucémie lymphoblastique aiguë
Mémoire
Virginie Aspirot-Buron
Maîtrise en kinésiologie - avec mémoire
Maître ès sciences (M. Sc.)
Évaluation des capacités cardiorespiratoires et
physiques d’enfants en traitement de chimiothérapie
pour une leucémie lymphoblastique aiguë
Mémoire
Virginie Aspirot-Buron
Sous la direction de :
Philippe Corbeil, directeur de recherche
Charles Sebiyo Batcho, codirecteur recherche
ii
Résumé
La leucémie est un cancer qui touche les cellules souches du sang. Il existe plusieurs types de leucémies, toutefois nous nous sommes intéressés à la leucémie lymphoblastique aiguë (LLA) pédiatrique. L’anomalie se trouve au niveau des cellules souches lymphoïdes, et se développe de manière soudaine, en quelques jours ou quelques semaines. De nombreuses conséquences néfastes sont connues au niveau cardiorespiratoire, musculaire, de l'énergie et de l’activité physique d’enfants en fin de chimiothérapie. L’objectif premier de l’étude était de mesurer les capacités cardiorespiratoires et musculaires réelles d’enfants atteints d’une LLA à trois temps de la chimiothérapie : l’induction (T1), la consolidation 2 (T2) et l’entretien (T3). Un deuxième objectif était de tester la faisabilité d’une épreuve d’effort maximal cardiorespiratoire pendant ou après l’induction. Le protocole de l’étude comprenait une épreuve d’effort physique sur ergocycle pour évaluer la consommation maximale d’oxygène (𝑉̇O2max), un questionnaire sur la qualité de vie et un sur l’activité physique. La force musculaire était évaluée par un audit des dossiers (N=16) de physiothérapie d’anciens patients et des participants à l’étude. Une patiente a complété le test 𝑉̇O2max aux T1 et T2, et s’est améliorée de 54,5% entre les deux tests, mais restait nettement sous les valeurs normales. Pour l’ensemble des données de force musculaire : force de préhension, moment de force des extenseurs du genou et des fléchisseurs dorsaux de la cheville, les valeurs étaient inférieures à celles d’enfants sains, et avaient diminuées entre l’induction et la consolidation 2.
Les résultats de ce mémoire démontrent que certains enfants atteints d’une LLA présentent un déconditionnement cardiorespiratoire et musculaire dès l’induction. Elles démontrent également la faisabilité d’un exercice cardiorespiratoire soutenu après la phase d’induction. Ces données importantes serviront aux professionnels de la santé dans la mise en place d’interventions en activité physique adaptée aux capacités d’enfants atteints d’une LLA.
iii
Abstract
Leukemia is a blood cancer and can be expressed in many forms, but the main focus of this thesis will be on acute lymphoblastic leukemia (ALL) in the pediatric population. The anomaly develops in the lymphoid stem cells and the disease develops rapidly, within a few days to a few weeks. Leukemia and chemotherapy have been shown to have many deleterious on the children cardiorespiratory and muscular status, energy level and engagement in physical activity mainly reported for children in the last phase of chemotherapy. The first aim of our work was to collect data on their cardiorespiratory and muscular status during three phases of the chemotherapy: induction (T1), consolidation 2 (T2) and maintenance (T3). The second aim was to test the feasibility of maximal oxygen consumption test (𝑉̇O2max) during or post induction.
The protocol comprised a 𝑉̇O2max test on ergocycle, a quality of life and physical activity questionnaires. Data on muscular strength was collected through auditing the physical therapy files (n=16) of past and current patients. One participant completed the T1 and T2 𝑉̇O2max testing and showed a 54.5% increase from T1 to T2. Despite this improvement, her score at T2 was still poor compared to her expected value. Data collected on muscular strength were: grip strength, moments of force of the knee extensors and the ankle dorsiflexors. They all showed lower values than expected compared to normative value at T1 and a decline from T1 to T2.
The results outlined in this thesis show that children with ALL may present with decreased cardiorespiratory and muscular fitness with an onset as early as induction chemotherapy. Nonetheless, the results showed that high intensity cardiorespiratory exercise was feasible post induction. The data are of importance as they will help health care professionals build physical activity interventions adapted to the physical capacities of children with ALL.
iv
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des tableaux ... vi
Liste des figures ... vii
Liste des abréviations ... viii
Dédicaces ... ix Épigraphe ... x Remerciements ... xi Avant-propos ... xii Introduction générale ... 1 Chapitre 1 : La leucémie ... 4 1.1 Incidence et pronostic ... 4
1.2 Signes, symptômes et diagnostic de la leucémie ... 5
1.2.1 Signes et symptômes de la leucémie ... 5
1.2.2 Signes et symptômes du SNC atteint lors d’une leucémie chez l’enfant ... 6
1.2.3 Diagnostic de la leucémie ... 7
1.3 Les types de LLA pédiatriques ... 7
1.4 Traitement de la leucémie ... 8
Protocole de l’institut Dana Farber (Dana Farber Cancer Institute, DFCI) ... 13
1.5 Développements physiologiques à l’adolescence chez les enfants en santé ... 15
1.6 Effets de la chimiothérapie sur les capacités cardiorespiratoires et musculaires ... 17
1.6.1 Chimiothérapie, médicaments cardiotoxiques et effet sur les capacités cardiorespiratoires ... 17
1.6.2 L’effet de la LLA et la chimiothérapie sur les capacités musculaires à courts et longs termes ... 21
1.7 Activité physique et effet de l’entraînement chez les enfants atteints de la LLA pendant la chimiothérapie ... 23
1.7.1 Activité physique chez les patients atteints de la LLA ou d’un cancer hématologique pendant la chimiothérapie ... 23
1.7.2 Effet d’un programme d’entraînement pour les enfants atteints de la LLA pendant la chimiothérapie ... 25
1.8 Évaluation des capacités cardiorespiratoire chez la population pédiatrique ... 27
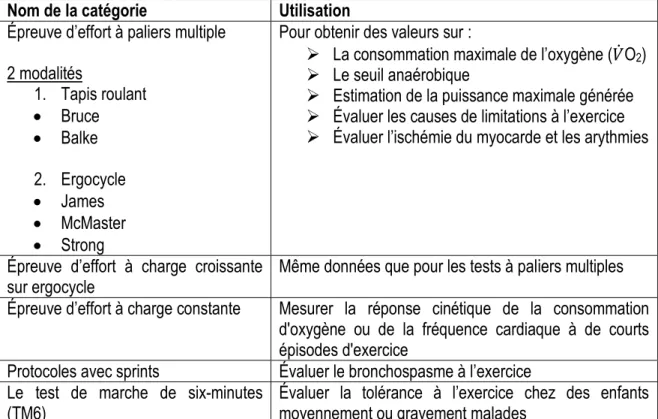
1.8.1 Protocoles à paliers multiples sur tapis roulant ... 28
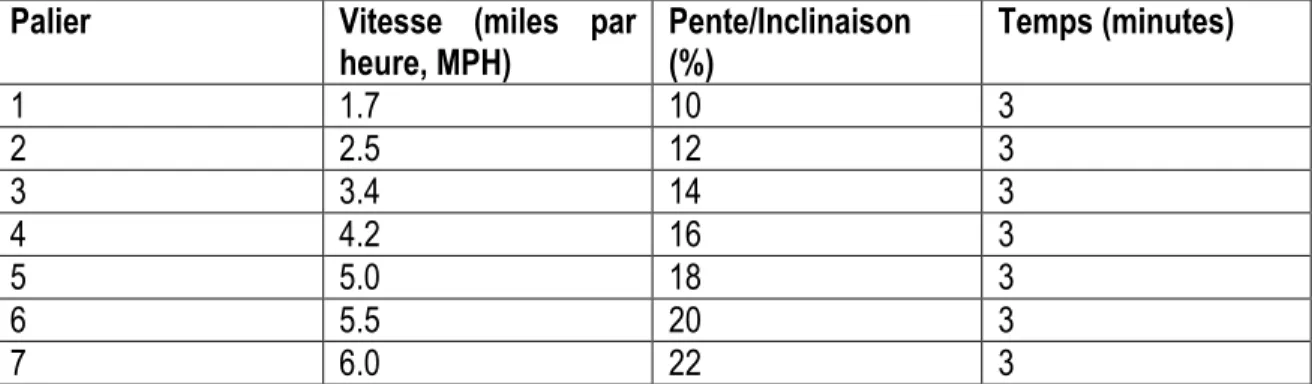
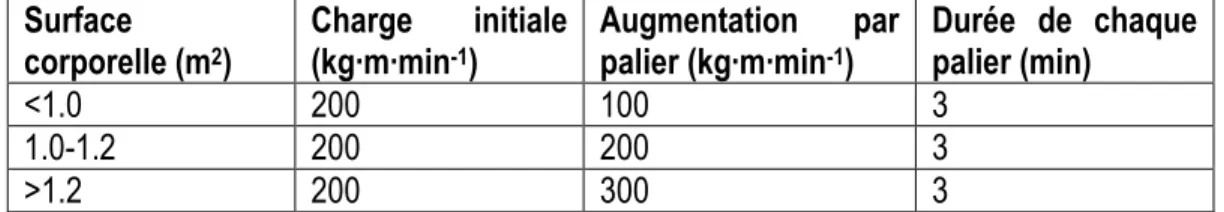
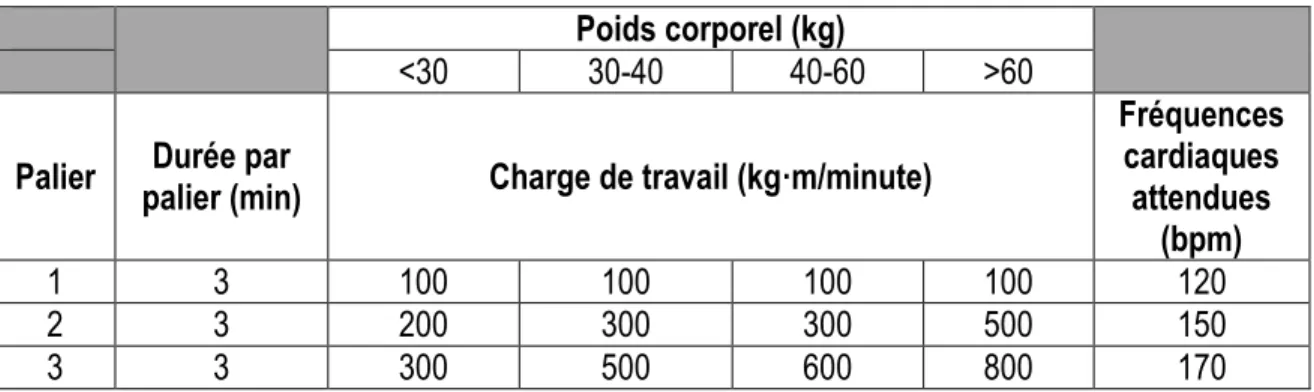
1.8.2 Protocoles à paliers multiples sur ergocycle ... 30
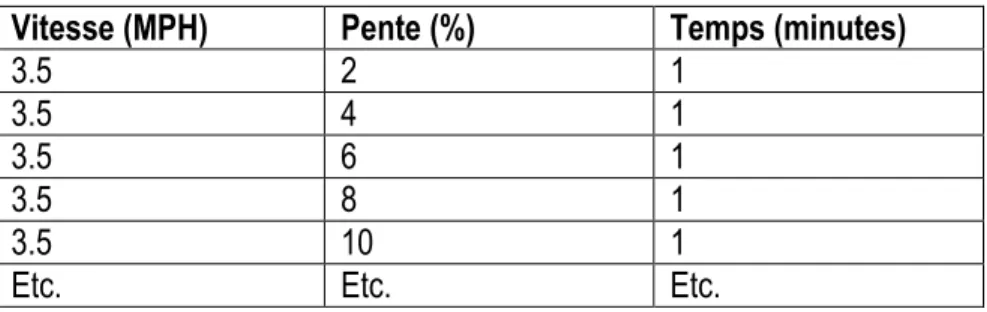
1.8.3 Épreuve d’effort à charge croissante sur ergocycle ... 32
1.8.4 Épreuve d’effort à charge constante ... 33
1.8.5. Épreuve d’effort en sprints ... 34
1.8.6 Le test de marche de six-minutes (TM6) ... 34
1.8.7 Épreuve d’effort pharmacologique ... 36
1.8.8 Spirométrie ... 36
1.8.9 Mesure de sécurité et contre-indications ... 36
v
Chapitre 2: Cardiorespiratory and Physical Fitness Testing of a Child with Low-Risk Acute Lymphoblastic
Leukemia during the Early Phases of Chemotherapy: A Case Study ... 41
2.1 Résumé ... 41
2.2 Abstract ... 41
Chapitre 3 : Analyse des capacités musculaires d’enfants atteints de la LLA ... 58
3.1 Introduction ... 58
3.2 Méthodologie ... 58
Sélection des dossiers pour l’audit ... 58
Analyse des données ... 59
3.3 Résultats ... 60 3.4 Discussion ... 71 3.5 Conclusion ... 73 Discussion générale... 74 Conclusion générale ... 82 Bibliographie ... 83
vi
Liste des tableaux
Chapitre 1
Tableau 1 : Signes et symptômes associés à la leucémie, la leucémie pédiatrique et la LLA Tableau 2 : Classification du niveau de risque d’une LLA selon le Children’s Oncology Group Tableau 3 : Médicaments de la chimiothérapie multi-agents et leur méthode d’administration Tableau 4 : Agents de la chimiothérapie utilisés par phase selon le DFCI-16-001, tous niveaux de risque confondus.
Tableau 5 : Les cinq catégories de tests d’effort recommandés pour tester les capacités cardiorespiratoires chez les enfants selon le AHA
Tableau 6 : Protocole de Bruce sur tapis roulant Tableau 7 : Protocole de Balke sur tapis roulant Tableau 8 : Protocole de James sur ergocycle Tableau 9 : Protocole de McMaster
Tableau 10 : Protocole de Strong Tableau 11 : Protocole de Godfrey
Tableau 12 : Conditions présentant un risque élevé lors de la réalisation d’une épreuve d’effort selon AHA et l’ACSM
Chapitre 2
Table 1: Anthropometric characteristics of the participant post induction and during consolidation 2 Table 2: Physiological parameters of the V ̇O2max test for the participant post induction and during consolidation 2
Table 3: Grip strength and lower limb moment of force for the participant during induction and during consolidation 2
vii
Liste des figures
Chapitre 2
Figure 1: Physiological parameters of the participant during the cardiorespiratory tests at T1 and T2. A: minute ventilation (l/min); B: heart rate (bpm); C: oxygen consumption (ml/min); M1: last 30s of warm up; M2: last 30s of stage 1; M3: last 30s of T1 and same time period at T2; M4: last 30s of test (before cool-down)
Figure 2: Comparison of the participant’s moment of force for the knee extensors and the ankle dorsiflexors from T1 to T2 and with normal values.
Chapitre 3
Figure 1 : Coefficients de corrélation de Pearson (A, C) et Spearman (B, D) entre la variation de la force de préhension de la main gauche en fonction de l’âge au diagnostic (A, B) et en fonction du délai entre les prises de mesures T1 et T2 (C, D)
Figure 2 : Coefficients de corrélation de Pearson (A, C) et Spearman (B, D) entre la variation de la force de préhension de la main droite en fonction de l’âge au diagnostic (A, B) et en fonction du délai entre les prises de mesures T1 et T2 (C, D)
Figure 3 : Coefficients de corrélation de Pearson (A, C) et Spearman (B, D)entre la variation du moment de force des extenseurs du genou gauche en fonction de l’âge au diagnostic (A, B) et en fonction du délai entre les prises de mesures T1 et T2 (C, D)
Figure 4 : Coefficients de corrélation de Pearson (A, C) et Spearman (B, D) entre la variation du moment de force des extenseurs du genou droit en fonction de l’âge au diagnostic (A, B) et en fonction du délai entre les prises de mesures T1 et T2 (C, D)
Figure 5 : Coefficients de corrélation de Pearson (A, C) et Spearman (B, D) entre la variation du moment de force des fléchisseurs dorsaux de la cheville gauche en fonction de l’âge au diagnostic (A, B) et en fonction du délai entre les prises de mesures T1 et T2 (C, D)
Figure 6 : Coefficients de corrélation de Pearson (A, C) et Spearman (B, D) entre la variation du moment de force des fléchisseurs dorsaux de la cheville droite en fonction de l’âge au diagnostic (A, B) et en fonction du délai entre les prises de mesures T1 et T2 (C, D)
Figure 7 : Effet relatif du traitement (chimiothérapie) sur la force de préhension de la main droite (A, B) et de la main gauche (C, D) entre l’induction et la consolidation 2, et distribution des données de la force de préhension (B, D) des participants évalués à l’induction et à la consolidation 2.
Figure 8 : Effet relatif du traitement (chimiothérapie) sur le moment de force des extenseurs du genou droit (A, B) et du genou gauche (C, D) entre l’induction et la consolidation 2, et distribution des données du moment de force des extenseurs du genou(B, D) des participants évalués à l’induction et à la consolidation 2.
Figure 9 : Effet relatif du traitement (chimiothérapie) sur le moment de force des fléchisseurs dorsaux de la cheville droite (A, B) et de la cheville gauche (C, D) entre l’induction et la consolidation 2, et distribution des données du moment de force des fléchisseurs dorsaux (B, D) des participants évalués à l’induction et à la consolidation 2.
viii
Liste des abréviations
LLA : Leucémie lymphoblastique aiguë
𝑉̇O2max: Consommation maximale d’oxygène, maximal oxygen consumption ALL : Acute lymphoblastic leukemia
ADN : Acide désoxyribonucléique SNC : Système nerveux central LMA : Leucémie myéloïde aiguë
COG : Children’s Oncology Group
GB: Globules blancs IV: Intraveineuse IM : Intramusculaire IT : Intrathécale LCR: Liquide céphalorachidien RTC : radiothérapie crânienne DFCI : Dana Farber Cancer Institute DEX : Dexrazoxane
NHANES: The National Health and Nutritional Examination Survey IMC: Indice de masse corporelle
AVQ : Activités de la vie quotidienne CPM : Counts per minute
RM : Répétition maximale
AHA : American Heart Association TM6 : Test de marche de six minutes MPH : Miles par heure
RPM : Révolutions par minute
ACSM : American College of Sports Medicine CMES: Centre mère-enfant Soleil
CHU: Centre hospitalier universitaire UL: Université Laval
RTE : relative treatment effet
ix
Dédicaces
À tous ces enfants qui mènent cet immense combat, non sans peur, mais avec force et résilience. Aux familles. À tous ceux qui soignent, aiment, accompagnent et soutiennent. À tous ceux qui croient aux projets de petites, moyennes et grandes envergures pour améliorer la qualité de ces enfants.
x
Épigraphe
“Out of the night that covers me, Black as the pit from pole to pole,
I thank whatever gods may be For my unconquerable soul. In the fell clutch of circumstance I have not winced nor cried aloud. Under the bludgeonings of chance My head is bloody, but unbowed. Beyond this place of wrath and tears
Looms but the Horror of the shade, And yet the menace of the years Finds, and shall find me, unafraid.
It matters not how strait the gate, How charged with punishments the scroll,
I am the master of my fate: I am the captain of my soul”
xi
Remerciements
Je commencerai en remerciant mon directeur Philippe Corbeil d’avoir accepté de prendre sous sa supervision une étudiante avec un projet différent de son champ d’expertise et bien des défis entourant sa mise en place. Merci d’avoir ensuite proposé d’aller se chercher un allié ayant des connaissances dans le milieu clinique soit Charles S. Batcho. Merci, Charles, d’avoir accepté de me prendre en co-supervision. Je poursuivrai maintenant mes remerciements en vous témoignant conjointement toute la gratitude que je ressens face à votre encadrement. Énumérer tout ce que j’ai appris à votre contact serait trop long, mais je tiens à mentionner que vous avez eu le don de m’expliquer et de me transmettre tant de nouvelles connaissances quant au milieu de la recherche tout au long de mon parcours à la maîtrise. J’ai apprécié votre guidance, mais également d’avoir l’opportunité d’apprendre par moi-même et d’accomplir de nouvelles tâches. Je vous remercie également d’avoir su me ramener sur terre lorsque j’avais des idées plus grandes que nature dues à mon grand enthousiasme, mais d’avoir gardé le cap lorsque les obstacles et les imprévus obscurcissaient ma vue de la ligne d’arrivée. Il y a eu des embûches, des déceptions, mais surtout de beaux moments, des moments forts en émotions. J’ai maintenant pour mon dire qu’on n’arrête pas un train en marche et que bien des choses sont possibles à qui veut les entreprendre détermination, acharnement et l’aide des bonnes personnes. Philippe et Charles, merci pour tout. Je tiens maintenant à remercier le Dr Marc-André Dugas de nous avoir accordé cette première rencontre en 2016 afin de commencer ce qui serait une incontournable collaboration avec le Centre mère-enfant Soleil du CHU de Québec. Je remercie le Dr Bruno Michon pour son implication dans la mise en place du projet et lors des suivis avec les patients. Je remercie grandement la Dre Isabelle Marc, sans qui la collecte de données et ce projet n’auraient pu être possibles ainsi que toute son implication dans des dossiers parallèles. Je remercie Michèle Bisson d’avoir su mettre notre participante à l’aise lors des tests et de toutes ses disponibilités pour répondre à mes diverses questions. Je remercie maintenant Josée Martel et Gabrielle Côté pour leur contribution inestimable en tout ce qui a trait à la collecte de données musculaires reliées au projet, cette dernière n'aurait pas pu exister sans vous. Je remercie tout particulièrement Josée Martel de son accueil et de son ouverture à participer au projet dans les tout débuts, de ses conseils et de son support continu. Je remercie Émilie Martineau pour son aide inestimable dans le recrutement et les suivis des participants de l’étude, pour la générosité de son temps afin de m’aider à comprendre les dossiers patients et répondre à mes interminables questions. Je remercie également Jean Leblond, pour son aide inestimable dans la réalisation des analyses statistiques. Merci pour votre temps, votre patience et vos explications claires sur des notions qui ne sont pas faciles. Une énorme merci à vous pour tout ce que vous avez fait afin que ce projet puisse se concrétiser.
Je termine en remerciant ma famille et mon conjoint Mathieu pour leur support indéfectible. Merci pour vos encouragements, votre empathie, votre compréhension et votre amour. Merci aussi à mes amis qui m’ont encouragée pendant mon parcours à la maîtrise, ce fut apprécié.
xii
Avant-propos
Cardiorespiratory and Physical Fitness Testing of a Child with Low-Risk Acute Lymphoblastic Leukemia during the Early Phases of Chemotherapy: A Case Study
Virginie Aspirot-Buron, Charles S. Batcho, Bruno Michon, Marc-André Dugas, Isabelle Marc, Josée Martel, Michèle Bisson, Philippe Corbeil
Cet article a été soumis à la revue Leukemia Research
Tous les auteurs ont donné leur approbation pour ce manuscrit. Virginie Aspirot-Buron, Josée Martel et Michèle Bisson ont préparé et participé à la collecte de données. L’article du chapitre 2 a été principalement rédigé par Virginie Aspirot-Buron sous la supervision de Philippe Corbeil et Charles S. Batcho.
1
Introduction générale
La leucémie, un cancer des cellules souches de la moelle osseuse et du sang, est le cancer pédiatrique le plus prévalent chez les enfants de zéro à 14 ans au Canada. En effet, près du tiers (32%) des 905 nouveaux cas de cancer à chaque année entre 2009 et 2013 étaient des leucémies, et environ 80% de ces nouveaux cas étaient une leucémie lymphoblastique aiguë (LLA). La LLA, avec une moyenne annuelle de 292 nouveaux cas, est donc le cancer avec la plus grande incidence chez les moins de 15 ans. La leucémie se développe principalement chez les jeunes enfants, les garçons étant plus touchés que les filles avec un taux d’incidence de 18% plus élevé (1).
Ce mémoire se concentre sur la LLA pédiatrique. À cet effet, les prochaines sections porteront principalement sur ce type de leucémie. Les enfants ayant la LLA ainsi que les survivants à moyen et long terme peuvent être aux prises avec différents problèmes de santé, reliés notamment à la maladie et aux traitements qu’ils subissent. En effet, une classe de médicaments, les anthracyclines, utilisée dans la chimiothérapie multi-agents a été démontrée comme cardiotoxique (2). Cela veut dire que certains patients et survivants, à la suite de leur exposition aux anthracyclines, ont développé des problèmes cardiaques dus à une atteinte de leurs cardiomyocytes, les cellules musculaires du cœur (3). Il a également été démontré chez des survivants à long terme de la LLA pédiatrique qu’ils avaient une faible capacité cardiorespiratoire (efficacité du cœur et des poumons à soutenir un effort physique), c’est-à-dire, plus faible que celle d’adultes n’ayant pas eu la maladie (4, 5). D’autres études se sont intéressées aux capacités musculaires d’enfants durant leur traitement et ont remarqué que les enfants atteints de la LLA avaient moins de force musculaire que des enfants sains, particulièrement au niveau des membres inférieurs, les membres supérieurs étant moins affectés (6, 7). Il a également été démontré que les enfants atteints de la LLA font moins d’activité physique que les enfants sains pendant leur traitement de chimiothérapie (8, 9). De plus, certains sont sujets à des changements négatifs au niveau de leur composition corporelle, c’est-à-dire d’une prise de poids en masse grasse parfois accompagnée d’une perte de masse musculaire (masse maigre) (10). Ces enfants seraient également plus à risque de subir une fracture, dû à une perte de densité minérale osseuse (11). Il est important de mentionner que pour certains, ces changements
2
physiques néfastes perdureront bien au-delà de la fin de leur traitement de chimiothérapie et de leur rémission.
Au vu de cette problématique complexe touchant les enfants atteints de la LLA en traitement et les survivants de la LLA pédiatrique, il a fallu faire un choix quant à notre population d’étude entre ces deux groupes distincts. La chimiothérapie étant difficile à supporter et venant avec une panoplie d’effets secondaires incommodants tels que de la fatigue, des nausées, des douleurs musculaires, certains professionnels de la santé et parents ont peur que ces enfants se surmènent en ajoutant de l’activité physique aux traitements (9). D’autre part, des études ont démontré que les enfants en dernière phase de la chimiothérapie pouvaient prendre part à des séances d’entraînement cardiovasculaire et musculaire sans effets négatifs sur leur état de santé et sans altérer leur réponse à la chimiothérapie (12, 13). Toutefois, à ce jour, il y a peu de données sur les capacités cardiorespiratoires et musculaires d’enfants atteints de la LLA pendant les premières phases de traitement de chimiothérapie. Plus d’information sur les capacités physiques des enfants malades durant les phases de traitement pourrait aiguiller, notamment, les professionnels de la santé spécialistes de l’activité physique dans la mise en place de plans d’interventions adaptés. Cela permettrait de rassurer le personnel traitant en démontrant la faisabilité d’insérer des périodes d’activité physique aux moments opportuns durant les traitements de chimiothérapie. Finalement, ces plans d’interventions en activité physique pourraient pallier en partie au déconditionnement physique qui affecte ces enfants durant et après leur chimiothérapie tout en favorisant l’activité physique comme levier pour réduire les impacts associés à un mode de vie sédentaire.
Les travaux de recherche présentés dans ce mémoire portent sur l’évaluation des capacités cardiorespiratoires et musculaires d’enfants en traitement de chimiothérapie pour une LLA. Un premier objectif de ces travaux était d’obtenir des données sur les capacités cardiorespiratoires et musculaires maximales de ces enfants lors des premières phases de la chimiothérapie (qui sont décrites à la section « Traitement de la leucémie »). Un second objectif était de tester la faisabilité d’une épreuve d’effort maximal lors des premières phases de la chimiothérapie, ce qui n’avait pas été fait à ce jour, ainsi que de vérifier l’acceptabilité d’un tel test auprès des enfants et de leur famille.
3
Ce mémoire se divise en trois chapitres. Le premier chapitre est une revue de littérature présentant plus d’informations sur la leucémie, particulièrement la LLA, son traitement et les conséquences connus sur l’état des capacités cardiorespiratoires et musculaires des enfants en traitement et des survivants. Le chapitre deux présente un manuscrit issu des résultats des travaux de recherche sur les capacités cardiorespiratoires, et qui a été soumis pour publication dans un journal scientifique. Le chapitre trois présente les résultats d’une collecte de données au niveau des capacités musculaires. Finalement, une discussion générale présente les principaux constats des travaux effectués, des limitations, recommandations et suggestions d’améliorations notamment par rapport à la méthodologie employée, ainsi que des perspectives pour des travaux futurs.
4
Chapitre 1 : La leucémie
1.1 Incidence et pronostic
Les cellules souches se reproduisent et se différencient pour créer des cellules aux fonctions distinctes. Les cellules souches sanguines peuvent se différencier en deux autres types de cellules souches. Le premier type étant les cellules souches myéloïdes qui donneront des cellules matures appelées globules rouges, plaquettes, granulocytes ou monocytes. Le second type est les cellules souches lymphoïdes qui donneront des cellules matures appelées lymphocytes. Les granulocytes, monocytes et lymphocytes sont des sous-types de globules blancs et ces derniers servent à combattre les infections. Le cancer s’attaquant à des cellules souches myéloïdes se nomme une leucémie myéloïde alors que celui s’attaquant aux cellules souches lymphoïdes se nomme une leucémie lymphoïde ou lymphoblastique (14).
Les leucémies lymphoblastiques chroniques et les leucémies myéloïdes chroniques sont plus rarement diagnostiquées chez les jeunes enfants. Les leucémies sont classées par type soient lymphoïde ou myéloïde, aiguë ou chronique, mais sont également classées par niveaux de risque. Ces derniers seront décrits dans la section «La leucémie lymphoblastique aiguë pédiatrique ».
La leucémie apparaît lorsqu’il y a une mutation génétique de l’acide désoxyribonucléique (ADN) d’une cellule souche de la moelle osseuse; ce processus s’appelle une «mutation acquise». Ces cellules anormales dans leur développement et/ou leur fonctionnement sont dites «blastes ou blastes leucémiques». Les blastes prolifèrent rapidement et envahissent les cellules sanguines saines, car ces cellules anormales survivent mieux que les cellules normales et les empêchent de faire leur travail adéquatement. Les blastes leucémiques débutent dans la moelle osseuse puis infiltrent le système sanguin. Ces cellules anormales peuvent également infiltrer le système nerveux central (SNC) et les nœuds lymphoïdes (15). Le système nerveux central comprend l’encéphale et la moelle épinière. L’encéphale contrôle la plupart des fonctions du corps, dont la perception, les mouvements, les sensations, les pensées, la parole et la mémoire. La moelle épinière se rattache à l’encéphale au niveau du tronc cérébral et est protégée par les vertèbres qui forment la colonne vertébrale. Les
5
nerfs émergent de la moelle épinière pour innerver les deux côtés du corps. La moelle épinière fait circuler les signaux nerveux, leur permettant d’aller et venir entre l’encéphale et les nerfs du reste du corps (16).
Il existe non seulement une différence au niveau des types de cancers, lymphoïde ou myéloïde, mais aussi au niveau du développement de la maladie. Une leucémie dite aiguë se développe de façon soudaine et rapide, en quelques jours à quelques semaines, alors que celle de type chronique se développe plus lentement sur des mois voire des années. Cela donne donc quatre types de leucémies les plus fréquentes, soit la leucémie lymphoblastique ou myéloïde, aiguë ou chronique (14).
Au Canada, entre 2009 et 2013, chez les enfants de 0-14 ans, il y eut au total 1445 diagnostics de leucémies, dont 1130 LLA et 180 leucémies myéloïdes aiguës (LMA). Pour la même période, 145 enfants atteints d’une leucémie en sont décédés, dont 59 atteints d’une LLA et 57 d’une LMA. Entre 1992 et 2010, le taux d’incidence a augmenté en moyenne de 0.6% annuellement pour tous les types de leucémies (1, 17).
Le pronostic d’enfants atteints d’une leucémie s’améliore de façon constante. Entre 1992 et 2010, le taux de mortalité a diminué de 3.5% en moyenne annuellement (1). Entre 2000 et 2004, le taux de survie de 5 ans après le diagnostic pour les enfants atteints de LLA était de 91%, toutefois les 9% de décès enregistrés n’excluent pas les causes de décès reliés à d’autres facteurs que la maladie (18). 1.2 Signes, symptômes et diagnostic de la leucémie
1.2.1 Signes et symptômes de la leucémie
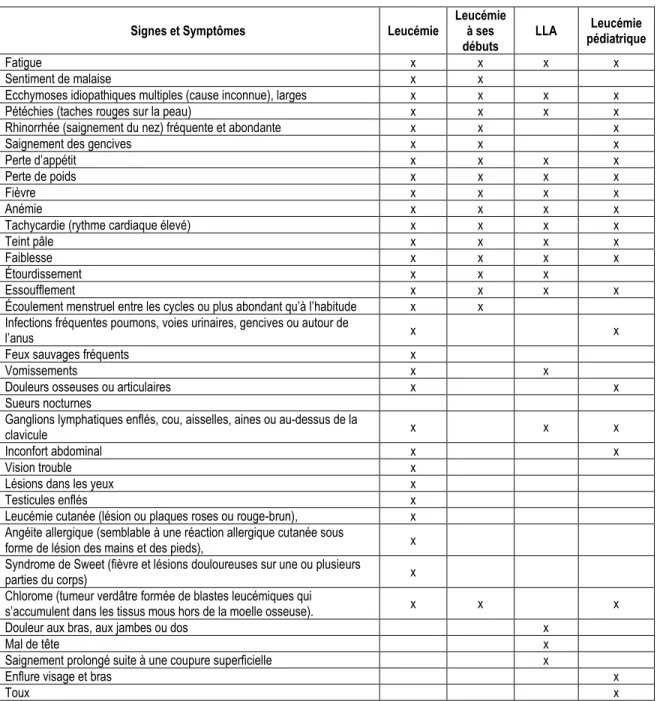
Une multitude de symptômes peuvent indiquer qu’une personne est atteinte d’une leucémie (tableau 1) (19-21).
6
Tableau 1 : Signes et symptômes associés à la leucémie, la leucémie pédiatrique et la LLA
Signes et Symptômes Leucémie Leucémie à ses
débuts
LLA pédiatrique Leucémie
Fatigue x x x x
Sentiment de malaise x x
Ecchymoses idiopathiques multiples (cause inconnue), larges x x x x Pétéchies (taches rouges sur la peau) x x x x Rhinorrhée (saignement du nez) fréquente et abondante x x x
Saignement des gencives x x x
Perte d’appétit x x x x
Perte de poids x x x x
Fièvre x x x x
Anémie x x x x
Tachycardie (rythme cardiaque élevé) x x x x
Teint pâle x x x x
Faiblesse x x x x
Étourdissement x x x
Essoufflement x x x x
Écoulement menstruel entre les cycles ou plus abondant qu’à l’habitude x x Infections fréquentes poumons, voies urinaires, gencives ou autour de
l’anus x x
Feux sauvages fréquents x
Vomissements x x
Douleurs osseuses ou articulaires x x Sueurs nocturnes
Ganglions lymphatiques enflés, cou, aisselles, aines ou au-dessus de la
clavicule x x x
Inconfort abdominal x x
Vision trouble x
Lésions dans les yeux x
Testicules enflés x
Leucémie cutanée (lésion ou plaques roses ou rouge-brun), x Angéite allergique (semblable à une réaction allergique cutanée sous
forme de lésion des mains et des pieds), x Syndrome de Sweet (fièvre et lésions douloureuses sur une ou plusieurs
parties du corps) x
Chlorome (tumeur verdâtre formée de blastes leucémiques qui
s’accumulent dans les tissus mous hors de la moelle osseuse). x x x Douleur aux bras, aux jambes ou dos x
Mal de tête x
Saignement prolongé suite à une coupure superficielle x
Enflure visage et bras x
Toux x
1.2.2 Signes et symptômes du SNC atteint lors d’une leucémie chez l’enfant
Les principaux signes et symptômes suivants surviennent lorsque des blastes leucémiques ont infiltré le SNC : maux de tête, vomissement particulièrement en matinée, faiblesse musculaire au niveau du visage et des yeux, vision trouble, convulsions (chez l’enfant non épileptique), problème d’équilibre et diminution des résultats scolaires (19).
7
1.2.3 Diagnostic de la leucémie
Au Canada, il existe diverses méthodes pour diagnostiquer la leucémie pédiatrique. Les plus courantes sont : un bilan des antécédents médicaux complété par un bilan physique, l’évaluation d’une formule sanguine complète, l’évaluation de facteurs de saignement et de coagulation sanguine, ponction (prélèvement) et de la moelle osseuse, ponction lombaire (pour déterminer si le SNC est affecté). Il y a également la cytochimie (identifier les structures tissulaires et les composants des cellules du sang ou de la moelle osseuse), immunophénotypage (l’étude des protéines exprimées par une cellule) et les études cytogénétiques et moléculaires également l’étude de l’ADN, au microscope pour confirmer le diagnostic, identifier le type et le sous-type de leucémie, planifier le traitement et établir un pronostic (22-27).
Les types et sous-types de leucémies sont importants, car ils influencent le traitement donné à l’enfant, mais également son pronostic. Ces tests permettent également d’évaluer le niveau de risque de la leucémie de l’enfant, ce qui sera présenté plus en détail dans la section « Niveau de risque de la LLA et pronostic ». Certaines méthodes telles que les formules sanguines, les ponctions lombaires et de moelle osseuse sont effectuées à plusieurs reprises au courant des traitements pour faire un suivi de l’état de l’enfant ainsi que pour déterminer s’il répond favorablement à la chimiothérapie. 1.3 Les types de LLA pédiatriques
Il existe trois types de globules blancs prédominants, soit : les lymphocytes B produisant des anticorps pour combattre des infections, les lymphocytes T qui viennent supporter les lymphocytes B dans la production d’anticorps pour combattre les infections, entre autres fonctions, et les cellules tueuses naturelles qui s’attaquent aux cellules infectées par un virus et aux cellules issues d’une tumeur. Une LLA peut donc être de type précurseur B, qui se divisent en trois sous-types soient : pro-B, pré-B précoce ou B commune. Le «pré» indique le type de cellules matures que les cellules leucémiques seraient devenues. Le type de leucémie le plus commun est la LLA pré B (28).
La LLA se classifie également par son niveau de risque selon les standards établis par différentes institutions ou groupes. Le niveau de risque aide le médecin à estimer le pronostic et à construire le
8
plan de traitement de l’enfant. Les niveaux de risque établis par la National Cancer Institute/Rome et ceux du Children’s Oncology Group (COG) sont souvent utilisés.
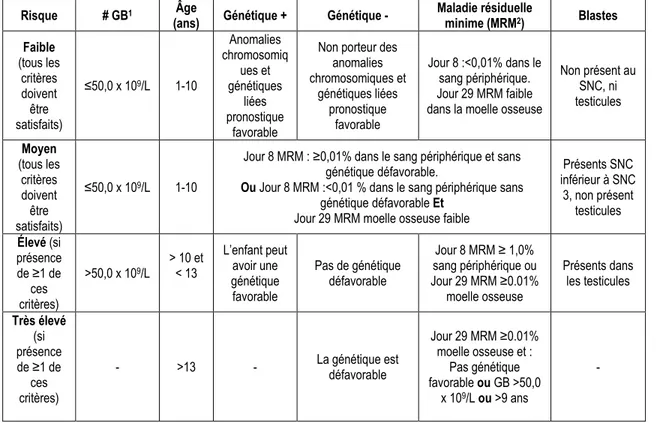
Le National Cancer Institue/Rome a établi deux niveaux de risque soit standard ou élevé selon l’âge et le nombre de globules blancs (GB) présents lors d’un prélèvement sanguin(29). En effet, le nombre de GB et l’âge au diagnostic ont été identifiés comme des facteurs fiables pour estimer le pronostic de l’enfant(30). Le COG classe la LLA en 4 catégories de risque : faible, moyen, élevé, très élevé. Ce groupe classe les LLA de façon plus détaillée (tableau 2) (29).
Tableau 2 : Classification du niveau de risque d’une LLA selon le Children’s Oncology Group
1 : Globule blanc 2 : Maladie résiduelle minime
1.4 Traitement de la leucémie
Au Canada, la LLA se traite principalement par la chimiothérapie multi-agents, ce qui veut dire que plusieurs médicaments sont combinés (tableau 3)(30, 31). Le but de la chimiothérapie est de venir détruire toutes les cellules cancéreuses pour atteindre la rémission et aussi pour empêcher une
Risque # GB1 Âge
(ans) Génétique + Génétique - Maladie résiduelle minime (MRM2) Blastes Faible (tous les critères doivent être satisfaits) ≤50,0 x 109/L 1-10 Anomalies chromosomiq ues et génétiques liées pronostique favorable
Non porteur des anomalies chromosomiques et génétiques liées pronostique favorable Jour 8 :<0,01% dans le sang périphérique. Jour 29 MRM faible dans la moelle osseuse
Non présent au SNC, ni testicules Moyen (tous les critères doivent être satisfaits) ≤50,0 x 109/L 1-10
Jour 8 MRM : ≥0,01% dans le sang périphérique et sans génétique défavorable.
Ou Jour 8 MRM :<0,01 % dans le sang périphérique sans
génétique défavorable Et Jour 29 MRM moelle osseuse faible
Présents SNC inférieur à SNC 3, non présent testicules Élevé (si présence de ≥1 de ces critères) >50,0 x 109/L > 10 et < 13 L’enfant peut avoir une génétique favorable Pas de génétique défavorable Jour 8 MRM ≥ 1,0% sang périphérique ou Jour 29 MRM ≥0.01% moelle osseuse Présents dans les testicules Très élevé (si présence de ≥1 de ces critères)
- >13 - La génétique est défavorable
Jour 29 MRM ≥0.01% moelle osseuse et : Pas génétique favorable ou GB >50,0 x 109/L ou >9 ans -
9
récurrence de la maladie à long terme(30). La chimiothérapie multi-agents se compose de trois à cinq phases, tout dépendamment du protocole utilisé par le centre hospitalier traitant. Il a plusieurs façons d’administrer les agents chimiothérapeutiques, soit par voie intraveineuse (IV), cette méthode est celle utilisée le plus fréquemment. Pour ce faire, un cathéter est posé pour la durée des traitements et celui-ci a généralement une ouverture directe au niveau de la veine cave supérieure. Il y a aussi la voie intramusculaire (IM) généralement au niveau de la cuisse. Il y a également la voie intrathécale (IT), qui consiste en une ponction infiltration lombaire dans la colonne vertébrale pour traiter une leucémie ayant atteint le liquide céphalorachidien (LCR) et finalement la voie orale (32). Il existe aussi des cas où la radiothérapie et la greffe de moelle osseuse sont nécessaires. Ces traitements seront discutés dans les sections subséquentes selon les informations fournies par le site de la Société canadienne du cancer (32).
La première phase est la chimiothérapie d’induction qui a pour but de détruire le plus de blastes leucémiques possible pour atteindre la rémission complète. Cette phase intensive est d’une durée d’environ 4 semaines à 6 semaines. C’est généralement durant cette phase que les patients recevront les plus fortes doses de médicaments toxiques pour tuer les cellules leucémiques. Les agents chimiothérapeutiques les plus fréquemment combinés à cette phase sont : la vincristine, un corticostéroïde (prednisone or dexaméthasone) et L-aspariganase (aspariganase, asparaginase Erwinia ou pegaspargase)(30). Tout dépendamment du protocole, il se peut que certains enfants reçoivent également des anthracyclines (daunorubicine ou doxorubicine), des médicaments très puissants, reliés à certains effets néfastes qui seront discutés dans les sections à venir. Statistiquement, 95-98% des enfants atteindront la rémission après cette phase (30, 31). La rémission est atteinte lorsque moins de 5% des cellules de la moelle osseuse sont leucémiques et que la production des globules blancs, rouges et plaquettes présentent des valeurs normales(30).
10
La deuxième phase est la chimiothérapie de consolidation dont le but est de tuer les cellules leucémiques qui pourraient rester chez les enfants, même si celles-ci ne sont pas détectables dans le sang ni dans la moelle osseuse afin de consolider la rémission acquise en induction(30). Cette phase empêche aussi que des blastes leucémiques infiltrent le SNC et/ou les testicules. La consolidation dure entre 4 et 6 semaines, d’autres médicaments anti-cancer peuvent s’ajouter au traitement, tels que le mercaptopurine et le cyclophosphamide. La posologie des médicaments administrés diffère selon le niveau de risque de la leucémie de l’enfant, ainsi que sa réponse à l’induction(31).
La troisième phase est la chimiothérapie d’entretien intermédiaire ou provisoire qui a pour but de continuer à détruire les blastes leucémiques restants dans la moelle osseuse et le sang de l’enfant. Cette phase s’étend sur une période de six à huit semaines pendant laquelle seront utilisés les mêmes agents chimiothérapeutiques qu’aux phases précédentes(30, 31).
La quatrième phase est la chimiothérapie d’intensification différée ou tardive qui dure huit semaines et est divisée en blocs. Durant cette période, l’enfant recevra une intensification différée, ressemblant à l’induction et à une autre chimiothérapie d’entretien provisoire, avant de passer à la dernière étape du traitement. Le but de cette phase est de s’assurer que la leucémie ne réapparaisse pas en éradiquant les cellules résistantes à la chimiothérapie. Les médicaments utilisés sont les mêmes qu’aux phases précédentes, auxquels peut venir s’ajouter la thioguanine(30, 31).
La dernière phase du traitement se nomme la chimiothérapie d’entretien et dure en moyenne 2 ans(30). Cette phase peut aller jusqu’à trois ans chez les garçons(31), car ces derniers peuvent avoir des cellules leucémiques au niveau des testicules. Le but de cette phase est de maintenir l’enfant en
11
rémission et de s’assurer de tuer les cellules leucémiques cachées, c’est-à-dire de possibles cellules cancéreuses restantes dans le sang et la moelle osseuse qui ne seraient pas détectées lors d’analyses au microscope. Cette dernière phase est cruciale au maintien du rétablissement et elle se composera d’une chimiothérapie orale, donc des comprimés que l’enfant devra prendre à la maison sur une base quotidienne, en plus de visites à l’hôpital pour recevoir des traitements intraveineux ou par ponction lombaire dans le liquide céphalorachidien. Ces visites programmées de façon régulière à intervalles de semaines ou mois permettront aussi de prendre des formules sanguines complètes pour analyses et d’assurer que les doses des médicaments anticancéreux sont appropriées. Il est important que la chimiothérapie tue les cellules leucémiques cachées, mais aussi que le niveau de globules blancs soit adéquat pour éviter que l’enfant soit à haut risque d’infections. Rappelons que le rôle des globules blancs sains est de combattre les infections.
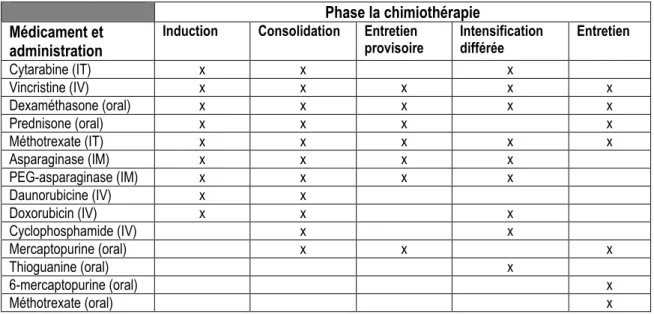
Tableau 3 : Médicaments de la chimiothérapie multi-agent et leur méthode d’administration Phase la chimiothérapie
Médicament et administration
Induction Consolidation Entretien
provisoire Intensification différée Entretien
Cytarabine (IT) x x x Vincristine (IV) x x x x x Dexaméthasone (oral) x x x x x Prednisone (oral) x x x x Méthotrexate (IT) x x x x x Asparaginase (IM) x x x x PEG-asparaginase (IM) x x x x Daunorubicine (IV) x x Doxorubicin (IV) x x x Cyclophosphamide (IV) x x Mercaptopurine (oral) x x x Thioguanine (oral) x 6-mercaptopurine (oral) x Méthotrexate (oral) x
Si le système nerveux central et/ou les testicules ont été atteints, d’autres traitements tels que la radiothérapie et la greffe de cellules souches ou de moelle osseuse peuvent être utilisés de pair avec la chimiothérapie. La radiothérapie sert à traiter ou prévenir les cellules leucémiques au cerveau, la moelle osseuse et/ou aux testicules, car la chimiothérapie n’est pas efficace à ces endroits. Cette méthode est aussi employée pour préparer l’enfant à recevoir une greffe de cellules souches, celle-ci
12
se nomme irradiation corporelle totale, car la radiothérapie sera effectuée sur tout le corps de l’enfant (31). Le fonctionnement de la radiothérapie utilise des rayons X ou gamma de haute énergie afin de tuer ou endommager les cellules leucémiques, donc diminuer leur développement et leur multiplication, en sachant que les cellules saines se rétablissent mieux d’un tel traitement. La dose totale de radiation est séparée en fractions qui sont administrées sur une période de quelques semaines. La radiation cesse très rapidement après le traitement, l’enfant n’est donc pas radioactif et peut être en contact avec d’autres personnes. La radiothérapie crânienne (RTC) est utilisée lorsqu’une ponction lombaire révèle que des blastes ont infiltré le liquide céphalorachidien, liquide qui entoure le cerveau et la moelle osseuse. La RTC peut aussi être employée chez les enfants atteints d’une LLA de type précurseur B qui réagissent lentement à la chimiothérapie d’induction et ceux atteints d’une LLA de type pré-T avec un nombre de globules blancs élevé (33). Les jeunes garçons peuvent subir de l’irradiation aux testicules pendant la phase de consolidation s’il y a présence des cellules cancéreuses après la chimiothérapie d’induction.
Un autre type de traitement employé pour traiter la LLA pédiatrique est la greffe de cellules souches, on dira une greffe de moelle osseuse lorsque les cellules sont prises au niveau de la moelle osseuse et une greffe de cellules souches hématopoïétiques lorsque les cellules viennent du sang périphérique. Plusieurs enfants peuvent subir des greffes, notamment ceux avec une LLA à risque élevé ou très élevé, ceux dont la chimiothérapie ne répond pas aussi bien que prévu et ceux à risque de rechute (34).
À ce jour, la maladie résiduelle minime (MRM) dans le cas d'une LLA peut être évaluée après la chimiothérapie d’induction avec des techniques de cytochimie très précises afin d’identifier les patients qui présentent encore de blastes leucémiques. La MRM est également un indicatif des patients à risque de rechute lorsqu’il y en a présence suite à la réponse maximale au traitement et/ou à la fin des traitements. C’est présentement la technique la plus fiable pour prédire un pronostic(30).
13
La MRM est également un critère de classification du risque de la maladie, c’est-à-dire que le niveau de risque initial au début de la chimiothérapie peut être modifié en fonction de la présence de MRM selon des prélèvements pris au courant de la chimiothérapie d’induction, et à d’autres moments dans le traitement. La présence de MRM est également un indicateur pronostique, l’absence de cette dernière indique une réponse favorable au traitement (35, 36).
Les différentes modalités de traitement de la leucémie comportent des effets secondaires. La radiothérapie, par exemple, peut entraîner ces effets secondaires à court terme : fatigue extrême après et pendant les traitements, syndrome de somnolence (somnolence excessive), perte de cheveux et poils, nausées ou vomissements, maux de tête, œdème cérébral, diarrhée, sécheresse et/ou douleur buccale/gorge et réactions cutanées. Il y a également quelques effets secondaires à long terme : leuco encéphalopathie (perte de la myéline, couche protectrice des nerfs au niveau du cerveau) maux d’oreille ou troubles de l’ouïe, changements neurologiques et/ou des taux d’hormones, troubles de la glande thyroïde et troubles de l’appareil reproducteur chez les garçons (37). La leuco encéphalopathie peut également survenir après une chimiothérapie à forte dose. Notez toutefois que ce sont les effets reliés à la chimiothérapie au niveau des capacités cardiorespiratoires et physiques qui seront l’accent de ce mémoire et donc étudiés de façon plus exhaustive dans les sections à venir.
Protocole de l’institut Dana Farber (Dana Farber Cancer Institute, DFCI)
Cette section présente le protocole de chimiothérapie utilisé par Le Centre mère-enfant Soleil du CHU de Québec-Université Laval, soit celui de l’institut Dana Farber, communément appelé le protocole de Boston. Depuis le consortium de 2016 qui a mené au protocole DFCI -16-001, il y maintenant trois niveaux de risque d’une LLA et ce dernier est identifié en fonction de différents critères au moment du diagnostic (voir Annexe A pour la liste des références ayant mené à la nouvelle classification du risque, non publié à ce jour).
14
Ce protocole comporte les trois phases principales de la chimiothérapie, soit l’induction, la consolidation et l’entretien, des phases supplémentaires sont ajoutées selon le niveau de risque. Les doses et les différents médicaments de la chimiothérapie multi-agents varient également selon le niveau de risque (tableau 4).
Le risque faible comporte six phases soit : l’induction 1A (quatre semaines), l’induction 1B (3 semaines), la consolidation 1A (3 semaines), le traitement du système nerveux central (3 semaines), la consolidation 2 (27 semaines) et la continuation (même phase que l’entretien, 72 semaines).
Pour le niveau de risque inter-élevé, une phase d’induction 1B- partie 2 (3 semaines) s’ajoute après l’induction 1B s’il y a présence de maladie résiduelle élevée ou inconnue.
Pour le niveau de risque très élevé, en plus de l’induction 1B- partie 2, il s’ajoute une consolidation 1B (4 semaines) et une consolidation 1C (3 semaines) après la consolidation 1A.
15
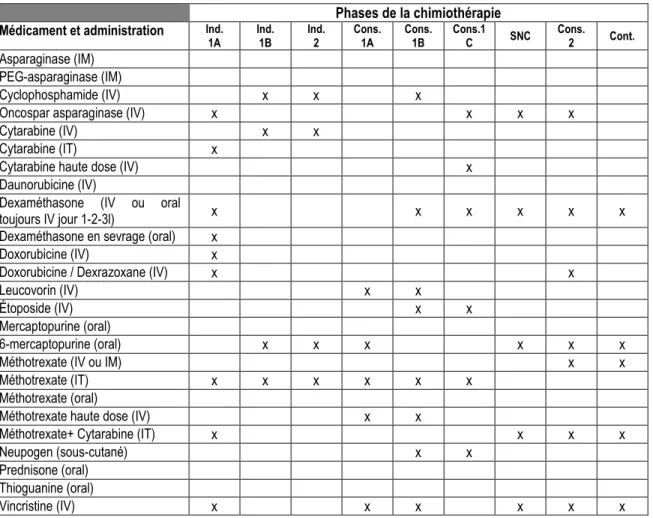
Tableau 4 : Agents de la chimiothérapie utilisés par phase selon le DFCI-16-001, tous niveaux de risque confondus.
Phases de la chimiothérapie
Médicament et administration Ind.
1A Ind. 1B Ind. 2 Cons. 1A Cons. 1B Cons.1 C SNC Cons. 2 Cont.
Asparaginase (IM) PEG-asparaginase (IM)
Cyclophosphamide (IV) x x x
Oncospar asparaginase (IV) x x x x Cytarabine (IV) x x
Cytarabine (IT) x
Cytarabine haute dose (IV) x Daunorubicine (IV)
Dexaméthasone (IV ou oral
toujours IV jour 1-2-3l) x x x x x x Dexaméthasone en sevrage (oral) x
Doxorubicine (IV) x
Doxorubicine / Dexrazoxane (IV) x x
Leucovorin (IV) x x
Étoposide (IV) x x
Mercaptopurine (oral)
6-mercaptopurine (oral) x x x x x x
Méthotrexate (IV ou IM) x x
Méthotrexate (IT) x x x x x x Méthotrexate (oral)
Méthotrexate haute dose (IV) x x
Méthotrexate+ Cytarabine (IT) x x x x Neupogen (sous-cutané) x x
Prednisone (oral) Thioguanine (oral)
Vincristine (IV) x x x x x x
Notes : Ind. = Induction; Cons. = Consolidation; SNC = Système nerveux central; Cont. = Continuation.
1.5 Développements physiologiques à l’adolescence chez les enfants en santé
L’adolescence et la puberté sont associées à des années de croissance accélérée caractérisée par des changements physiologiques et anatomiques notamment au niveau de la masse et de la force musculaire, de la taille des poumons et du volume du cœur. Au niveau musculaire, les hormones de croissance associées à la puberté accéléreront le développement de la masse musculaire de pair avec le développement du système nerveux qui lui contribuera à une meilleure efficacité de recrutement des fibres musculaires pour augmenter la force musculaire. C’est donc à ce moment qu’il devient possible et efficace de commencer un entraînement en force musculaire (38). Également au début de l’adolescence, les poumons connaissent leur période de croissance la plus rapide. Pour les filles, cette période de maturation et de croissance rapide commence autour de
16
treize ans, soit environ un an peu plus tôt que les garçons (39). Le volume du cœur connaîtra également une croissance rapide lors de l’adolescence, probablement en réponse à la forte demande imposée pendant la poussée de croissance (40).
La capacité cardiorespiratoire est évaluée par la consommation maximale d’oxygène (𝑉̇O2max) lors d’un exercice et est généralement exprimée en ml/kg/min ou en ml/ min. Cette dernière peut être testée de plusieurs manières en fournissant un effort maximal ou soutenu avec ou sans mesure d’échange gazeux en simultané. Plusieurs tests seront décrits plus exhaustivement dans la section « Évaluation de la capacité cardiorespiratoire chez la population pédiatrique ». De pair avec le développement physiologique qui s’accélère lors de la puberté, la 𝑉̇O2max atteindra son sommet vers la fin de l’adolescence période à laquelle le corps aura une grande capacité d’adaptation à l’entraînement musculaire et cardiovasculaire, contrairement à l’enfance (41).
À l’adolescence, un grand potentiel d’adaptation est présent et supporté par les hormones de croissance, autant au niveau des muscles, des poumons, du cœur, des organes et des os. Toutefois, l’activité physique joue un grand rôle au niveau de la performance sportive, car le corps s’adapte à l’intensité des stimuli qu’il reçoit. L’entraînement musculaire, par exemple, engendrera le développement de nouvelles fibres musculaires au niveau des membres supérieurs et inférieurs et améliora le recrutement de ces dernières lors d’un effort, par une efficience augmentée du lien unissant les muscles au système nerveux central (38). Ces changements bénéfiques se produisent également au niveau du muscle cardiaque, le myocarde. En effet, l’entraînement physique améliore l’efficacité du cœur lors d’un exercice intense et/ou prolongé. Un muscle cardiaque plus fort est en mesure de fournir aux muscles squelettiques une plus grande quantité de sang oxygéné à chaque battement tout en nécessitant moins de battements à la minute (42). Au niveau des cellules musculaires, celles-ci seront également plus efficaces à utiliser l’oxygène pour générer de l’énergie, exprimée ici en contractions musculaires et en force musculaire (43).
17
Bien que le potentiel d’amélioration de la condition physique soit optimal lors de l’adolescence, l’activité physique joue un rôle prépondérant dans son développement. Les prochaines sections expliqueront comment les capacités cardiorespiratoires, l’intégrité du myocarde, la force et la masse musculaire des membres supérieurs et le niveau d’activité d’enfant et d’adolescent en traitement de chimiothérapie sont affectés par la maladie et la chimiothérapie. Soit des répercussions qui peuvent perdurer jusqu’à l’âge adulte.
1.6 Effets de la chimiothérapie sur les capacités cardiorespiratoires et musculaires 1.6.1 Chimiothérapie, médicaments cardiotoxiques et effet sur les capacités cardiorespiratoires Depuis plusieurs décennies, certains médicaments de la chimiothérapie, les anthracyclines, ont été identifiés comme cardiotoxiques, c’est-à-dire qu’ils affecteraient l’intégrité du myocarde. Les anthracyclines sont une classe de médicaments très puissants administrés généralement en induction, et durant les autres phases aux enfants ayant une LLA plus agressive (tableau 4), et ont été identifiés comme cardiotoxiques. Il y a deux types de cardiotoxicité, le type I est relié à la mort des cardiomyocytes (cellules cardiaques) suite à nécrose ou l’apoptose (autodestruction des cellules), alors que le type II est relié à une dysfonction des cardiomyocytes. Le type I est donc irréversible tandis que le type II est réversible. Cette cardiotoxicité peut se manifester pendant le traitement (forme aiguë) ou plusieurs années après la fin de la chimiothérapie (forme chronique retardée). La doxorubicine est un médicament de la classe des anthracyclines utilisé pour traiter différents cancers avec ou sans tumeur dû à son efficacité. En effet, la doxorubicine est employée pour son efficacité à tuer les cellules cancéreuses qui prolifèrent rapidement en attaquant leur ADN. Toutefois, la métabolisation de ce médicament au niveau des cardiomyocytes cause la génération de radicaux libres et une cascade de réactions cellulaires qui peuvent mener à l’apoptose, donc la mort de ces cellules. Les anthracyclines, administrés pendant la chimiothérapie pour traiter la LLA peuvent donc causer de la cardiotoxicité de type I (2). Il est important de comprendre que les anthracyclines sont un des médicaments de la chimiothérapie qui ont permis de faire augmenter le taux de survie de façon significative ce qui explique leur utilisation en dépit des effets néfastes qu’elles peuvent entraîner.
18
Des études se sont penchées sur l’effet du dosage cumulatif reçu pendant les traitements de chimiothérapie et de radiothérapie avec le développement de problèmes au niveau cardiaque et sur la force musculaire. Selon l’étude d’Akyay et coll. (44), des patients nouvellement diagnostiqués et des survivants à court terme (moins de cinq ans après l’exposition à la chimiothérapie et/ou la radiothérapie) âgés entre quatre à dix-sept ans pourraient présenter une diminution de leur force de préhension ainsi qu’effectuer un temps plus long au test chronométré du lever de chaise. Leurs tests sanguins pour les niveaux de créatine phosphokinase, de myoglobine, de troponine cardiaque et d’électrolytes reliés à la rhabdomyolyse pourraient montrer des valeurs différentes par rapport à des enfants sains, sans toutefois être en dessous ou en dessus des valeurs normales. Notez que la présence de myoglobine dans le sang est un indicateur de la rhabdomyolyse, qui se définit comme une destruction des fibres musculaires [3]. La présence de troponine dans le sang est également une indication d’un problème au niveau du myocarde (muscle cardiaque), tels que l’infarctus du myocarde ou une myocardite [4]. Dans de cette étude, sans préciser les valeurs, les chercheurs ont constaté que la dose cumulative d’anthracyclines et de 6-mercaptopurine avait tendance à augmenter le niveau de troponine cardiaque chez les survivants, et à diminuer les performances aux tests de force chez les enfants nouvellement diagnostiqués comparés à des enfants sains. L’administration de radiothérapie n’a pas eu d’effet significatif sur ni l’un ou l’autre des deux groupes. La dose cumulative d’anthracyclines varie en fonction de plusieurs facteurs, notamment le niveau de risque de la maladie et peut influencer le risque de développer des complications au niveau du myocarde. Cela a été observé par Rathe et coll. en 2010 (3) qui ont réalisé une étude longitudinale en suivant des patients âgés de zéro à quinze ans dès leur diagnostic puis sur une période médiane de 8,2 ans et ayant été traité avec une dose cumulative médiane de 250 mg/m2. Ils ont remarqué que les participants pouvaient présenter un amincissement significatif de l’épaisseur du septum diastolique et de l’épaisseur de la paroi postérieure du ventricule gauche diastolique, une dilation du diamètre ventriculaire gauche pendant la diastole, et une diminution significative de la masse du ventricule gauche. Ils ont également constaté une diminution de la fraction d’éjection qui tend à s’accroître avec les années pour devenir plus significative. Ils mentionnent également que les participants de leur étude avaient été traités avec des doses relativement basses, ce qui ne leur a pas permis d’établir statistiquement un lien entre la dose cumulative d’anthracyclines reçues et les changements dans l’intégrité du myocarde.
19
Ces études démontrent que des marqueurs biologiques d’atteintes du myocarde peuvent être décelés par des tests sanguins dès l’induction chez certains enfants. Toutefois, il semblerait que cette atteinte prenne de l’ampleur avec le temps. Bien qu’aucun des participants n’ait eu de maladie du cœur selon les critères diagnostics, il ne faudrait pas négliger l’effet à long terme de l’exposition répétée à de petites doses d’anthracyclines. Il est important de mentionner que des analyses statistiques unies et multi- variées de Rathe et coll. (3) ont démontré un effet temps. En effet, plus de changements dans l’intégrité du myocarde étaient décelés à l’échocardiogramme avec les suivis les plus éloignés dans le temps du diagnostic. Selon leurs données, la dilatation du ventricule gauche commençait deux ans après les traitements, mais devenait évidente après cinq ans et progressait tout au long des années de suivi avec une tendance à la stabilisation après 15 ans de suivi. La diminution de la fraction d’éjection était également affectée par le temps et tendait à diminuer entre les mesures de suivi (3). Donc, les adultes ayant eu une LLA à l’enfance devraient être suivis en cardiologie tout au long de leur vie pour surveiller les impacts à long terme de la chimiothérapie sur leur santé cardiaque (3, 44).
Depuis quelques décennies, la dexrazoxane (DEX) a été identifiée pour ses propriétés de cardioprotecteur contre les effets néfastes des anthracyclines, notamment chez les enfants atteints d’une LLA à haut risque. Des études récentes ont démontré que son utilisation pouvait diminuer l’atteinte au myocarde tout en n’affectant pas de façon significative l’activité cytotoxique des anthracyclines sur les cellules cancéreuses. En effet, ces études ont montré que certains enfants atteints d’une LLA à haut risque ou d’un lymphome lymphoblastique traités avec de la doxorubicine plus de la DEX avaient moins d’incidences d’atteintes au niveau de la masse du ventricule gauche, du diamètre du ventricule gauche à la fin de la diastole et de la systole, ainsi que de la fraction d’éjection. Les études mentionnaient toutefois l’importance d’une étroite collaboration entre les hémato-oncologues et les cardiologues dans les suivis des patients traités avec des anthracyclines. À ce jour, il n’y a pas de statistiques accessibles au niveau de l’utilisation de la DEX chez les enfants atteints de la LLA. Les effets et l’efficacité à long terme de la DEX sont toujours à l'étude ainsi que son interaction avec la doxorubicine (45, 46).
20
En plus des risques de cardiotoxicité, la chimiothérapie multi-agents a plusieurs conséquences néfastes à long terme sur les capacités cardiorespiratoires d’enfants qui la reçoivent. Plusieurs études concernant les capacités cardiorespiratoires se sont intéressées aux survivants de la LLA pédiatrique, particulièrement chez des adultes ayant terminé leurs traitements plusieurs années. Ces études ont remarqué que des survivants à long terme avaient une faible capacité cardiorespiratoire comparée à celle d’adultes n’ayant pas eu la maladie. De plus, les survivants peuvent également présenter un surpoids et un très bas niveau d’activité physique. En effet, en 2010 l’équipe de Järvelä et coll. (4) a démontré chez une cohorte de survivants ayant été diagnostiqués depuis un temps médian de 15,9 ans une 𝑉̇O2peak de 14% moins par rapport à leur groupe contrôle. De plus, plusieurs survivants de la LLA pédiatrique avaient une 𝑉̇O2peak sous les valeurs normales, ils avaient une force musculaire des membres inférieurs significativement moindres que les adultes de leur groupe contrôle, et certains présentaient un surpoids. Notez que la moitié des survivants en surpoids avait reçu de la radiation crânienne qui est connue comme un facteur de risque pour une prise de masse grasse menant au surpoids. D’autre part, 33,2 % des survivants avaient un très faible niveau d’activité physique hebdomadaire, soit <5 MET h/semaine. Les survivants avaient été traités avec des doses d’anthracyclines allant de 120 à 370 mg/m2. Bien que les chercheurs n’aient pas identifié de façon certaine le lien entre les anthracyclines (cardiotoxiques), la vincristine et le cyclophosphamide, ces résultats et les informations connues sur les anthracyclines supportent l’effet néfaste des traitements sur la condition physique des survivants. Des résultats similaires ont été obtenus par Tonorezos et coll. (5) qui s’est également penchée sur l’évaluation des capacités cardiorespiratoires de survivants d’une LLA pédiatrique. Ils ont recruté 115 adultes âgés de dix-huit à trente-huit ans, dont plus de 65% avaient terminé leur chimiothérapie depuis quinze ans et plus, pour leur faire passer une épreuve d’effort maximale sur tapis avec un protocole à paliers multiples et mesures d’échanges gazeux. Ils ont comparé les résultats de leurs participants à ceux de 570 participants provenant d’un sondage national sur la santé et la nutrition (The National Health and
Nutritional Examination Survey, NHANES). Le 𝑉̇O2max des survivants de la LLA était significativement plus bas de 8,9 ml/kg/min comparé à ceux de la cohorte NHANES, et ce en considérant les ajustements pour l’âge, le genre, l’ethnicité, le statut tabagique et la masse grasse. Les survivants n’ayant pas été traités avec des anthracyclines et/ou de la radiothérapie crânienne avaient également un 𝑉̇O2max significativement moins élevé que les participants NHANES. Les survivants ayant été traités avec de la radiothérapie crânienne avaient un 𝑉̇O2max significativement
21
moindre que ceux qui n’y avaient pas été exposés. Finalement, près du deux tiers des survivants avaient été classés comme ayant une capacité cardiorespiratoire faible comparée à 26,3% pour la cohorte NHANES et 70,3% des femmes et 14,0% des hommes avaient une valeur maximale en MET classée comme faible.
Ces études démontrent que les survivants de LLA pédiatrique ont une faible capacité cardiorespiratoire ce qui concorde avec les effets néfastes connus des anthracyclines. Néanmoins, les auteurs proposent de poursuivre l’investigation chez les survivants à long terme avec un grand éventail de doses cumulatives d’anthracyclines et/ou de radiothérapie crânienne. Ils mettent également de l’avant que plus d’efforts devraient être déployés pour faire la promotion de l’activité physique chez cette population, car une faible capacité cardiorespiratoire est un élément prédicateur du risque de maladies cardiovasculaires, maladies chroniques, de limitations fonctionnelles et de mortalité. Il est à noter que ces études sont relativement récentes et que l’intérêt à documenter les effets néfastes de la chimiothérapie multi-agents et la radiothérapie pour traiter les enfants atteints de LLA est grandissant. Il serait d’intérêt d’investiguer plus en profondeur les capacités cardiorespiratoires de ces enfants, et ce, dès le début des traitements afin d’identifier des moments clés pour des interventions en activité physique.
1.6.2 L’effet de la LLA et la chimiothérapie sur les capacités musculaires à courts et longs termes Les mécanismes précis causant les effets néfastes constatés de la LLA et son traitement sur les capacités musculaires sont encore à préciser. Toutefois, des études ont constaté que les enfants en traitement de chimiothérapie pour une LLA pouvaient présenter des faiblesses rapidement après le début des traitements. En effet, l’étude de Ness et coll. (7) a comparé les résultats de tests musculaires de 109 enfants âgés entre quatre et dix-huit qui étaient entre le 7ème et le 10ème jour de la chimiothérapie d’induction pour une LLA de type B ou T à des normes et chartes pour des enfants appariés pour l’âge et le poids. Ils ont observé que les enfants atteints de LLA avaient une amplitude de mouvement diminuée au niveau de la flexion plantaire passive, une distance parcourue plus courte que les valeurs normales au test de marche de six minutes, une diminution au niveau de l’extension active du genou et une densité minérale osseuse plus faible que la normale. Sans
22
atteindre le niveau statistiquement significatif, ils ont également noté un indice de masse corporelle (IMC) plus élevé que la moyenne et une force de préhension plus faible que la moyenne estimée. Cette faiblesse musculaire a également été observée chez des enfants en fin de traitement, soit en chimiothérapie de continuation. En 2011, Muratt et coll. (6), suite à des tests de force isocinétique (vitesse constante) et concentrique (contraction musculaire où la longueur du muscle diminue) sur Biodex, ont observé une diminution de la force musculaire des membres inférieurs et supérieurs chez les enfants atteints de la LLA par rapport à leur groupe contrôle. En effet, les enfants atteints de la LLA présentaient une diminution significative du moment de force des extenseurs du genou, du travail mécanique total et maximal lors d’une répétition de l’extension du genou, et une diminution du travail mécanique total des extenseurs du coude, bilatéralement. Ils avaient aussi un plus grand débalancement musculaire du ratio quadriceps (extenseurs) et ischio-jambiers (fléchisseurs).
Ces résultats montrent que la perte au niveau des capacités musculaires peut être présente dès le début des traitements voire au moment où l’enfant est atteint de la maladie, donc avant le diagnostic d’une LLA. Il serait également possible que les membres supérieurs soient affectés plus tardivement comme le montre les résultats de la force de préhension qui n’étaient pas significativement affectée lors d’étude de Ness et coll. en induction versus une diminution significative de l’extension du coude chez les participants en continuation de l’étude de Muratt et coll. Une possible explication de cette faiblesse pourrait provenir de diminution de participation à d’activités physiques et des activités de la vie quotidienne (AVQ), qui seront discutées plus en détail dans les sections ultérieures. Des chercheurs ont également pointé du doigt certains médicaments de la chimiothérapie multi-agents comme agents causant de l’atrophie musculaire et des neuropathies (47), ce qui contribuerait à la perte de force musculaire. Tout comme les auteurs des études sur les capacités cardiorespiratoires, les auteurs de ces études sur l’état de capacités musculaires d’enfants atteints d’une LLA en traitement de chimiothérapie mettent de l’avant l’importance d’interventions en activité physique pour pallier en partie à leur déconditionnement.