MÉLANIE DIONNE
DISTRIBUTION ET SÉLECTION DE L’HABITAT
CHEZ LES MÉGALOPES ET LES JUVÉNILES DU
CRABE DES NEIGES, CHIONOECETES OPILIO, DANS
UN CONTEXTE DE CHANGEMENT CLIMATIQUE
Mémoire présenté
à la Faculté des études supérieures de l'Université Laval
pour l’obtention
du grade de maître ès sciences (M. Sc.)
Département de biologie
FACULTÉ DES SCIENCES ET GÉNIE UNIVERSITÉ LAVAL
QUÉBEC NOVEMBRE 2002
Résumé
Les premiers stades benthiques du crabe des neiges semblent être très sténothermes et pourraient être particulièrement vulnérables aux changements climatiques et ainsi influencer T abondance des populations adultes. Dans le cadre de cette étude, nous décrivons la distribution des juvéniles dans le golfe du Saint-Laurent et évaluons leurs préférences d’habitat en termes de température et de substrat à l’aide d’expériences en milieu contrôlé. En milieu naturel, les juvéniles de stades I à IV sont concentrés au-dessus et en dessous du cœur de la couche intermédiaire froide entre 0 et 1,9°C, alors qu’à partir du stade VI, les juvéniles sont retrouvés presqu’exclusivement dans les eaux peu profondes <27 m. Les préférences thermiques observées en laboratoire passent de froide (0-1,5°C) à plus chaude (1-4,5°C) entre les stades III et V. La vase (<0,5 mm) est généralement le substrat préféré. Nos résultats suggèrent que les premiers stades juvéniles sont très sténothermes et pourraient représenter une période critique dans le cycle vital du crabe des neiges.
Méianie Dionne Edwin Bourget
Avant-Propos
Je tiens à remercier tout spécialement mes deux directeurs de projet, Edwin Bourget et Bernard Sainte-Marie, pour leur support, leur confiance et pour m’avoir transmis et partagé leur passion pour la science.
Merci à Denis Gilbert pour l’aide au niveau de la physique et de la modélisation effectuée sur une partie des données. Je remercie également Christian Turcotte, Bernard Chénard et Jérôme Gagnon pour leur aide incontournable en laboratoire. Merci également à Louise Lapointe et Gaétan Daigle pour leurs précieux conseils au niveau statistique.
J’aimerais remercier tout spécialement mes parents pour leurs encouragements et leur support incontesté dans ce projet comme dans tous les autres que j’ai entrepris. Merci également à Philippe Archambault et les membres du laboratoire pour leur support moral constant.
Finalement, merci au Ministère des Pêches et des Océans, au FCAR et au GIROQ pour leur support financier.
« L'émotion est le moteur de l'effort nécessaire pour comprendre et la compréhension est
source d’enthousiasmes encore plus passionnés encore. »
iv
Table des matières
Page
RÉSUMÉ... i
AVANT-PROPOS... ii
TABLE DES MATIÈRES... iv
LISTE DES TABLEAUX... v
LISTE DES FIGURES... vii
INTRODUCTION GÉNÉRALE... 1
CHAPITRE 1. DISTRIBUTION AND HABITAT SELECTION OF JUVENILE SNOW CRABS, CHIONOECETES OPILIO, FROM A CLIMATE CHANGE PERSPECTIVE Abstract... 9 Introduction... 10 Methods... 13 Results... 21 Discussion... 31 CONCLUSION GÉNÉRALE... 36
LISTE DES OUVRAGES CITÉS... 40
ANNEXE A : Sélection de l’habitat chez les mégalopes du crabe des neiges, Chionoecetes opilio... 48
ANNEXE B : Granulométrie du sédiment dans la baie Sainte-Marguerite... 58
V
Liste des tableaux
Page
Table 1 Results from the one-way ANOVAs comparing the mean abundance of juvénile snow crabs (ind./1000m’2) in different temperature/depth strata. Data were logio(x+l) transformed for the analysis. The surface (SI) and the very deep layers (D3) were excluded from the analyses for cohort I to instar VI inclusively to meet assumptions of homoscedasticity. Significant p values are in bold. First and second highest abundance within each instar group are shown in dark and pale grey respectively. SI: > 1°C, < 18 m deep; S2: 0-l°C, 18-27 m; I: < 0°C, 27-85 m; Dl: 0-l°C, 85-105 m; D2: 1-2°C, 105-120 m; D3: > 2°C, > 120 m... 22
Table 2 Results from the two-factor ANOVAs comparing the abundance of juvénile snow crabs in different température (cold, medium, warm) and substratum (mud, sand, gravel) sections. Replicate is a random factor. Température and substratum are fixed factors. Significant p values are in bold. Transformations are written beside each analysis... 27
Table 3. Results from the two-factor ANOVAs comparing the abundance of instar V juvénile snow crabs in different température (cold, medium, warm) and substratum (mud, sand, gravel) sections. Replicate is a random factor. Température and substratum are fixed factors. Significant p values are in bold. Transformations are written beside each analysis. Modified gradient I: températures between 1.5 and 4.5°C; Modified gradient II: températures between 3 and 5.5°C... 29
Tableau 4. Résultats de l’ANOVA à 2 facteurs comparant l’abondance des mégalopes à différentes températures (froide: 0-1 °C, moyenne : 1-1.5°C, chaude : 1.5-2.5°C) et sur trois types de substrat (vase: <0,5 mm; sable: 1-2 mm; gravier: 2-16 mm) à l’intérieur d’un même aquarium. Réplicat est un facteur aléatoire. Température et substrat sont des facteurs fixes. Les valeurs significatives de p sont en gras...53
Tableau 5. Granulométrie associée à chaque échantillon pris en mai 2001 dans la baie Sainte-Marguerite, Québec, à l’aide d’une benne Shippek 0.04m2. La granulométrie est exprimée en pourcentage de vase (< 0,5 mm), sable (1-2 mm) et gravier (2-16 mm) pour chaque station d’échantillonnage... 60
vii
Liste des figures
Page
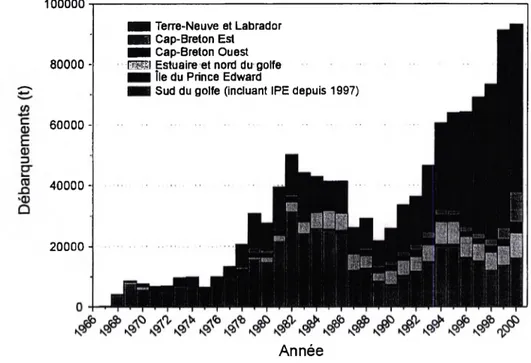
Figure 1 Débarquements atlantiques canadiens du crabe des neiges (R. Dufour, MPO, Région de Québec)... 5
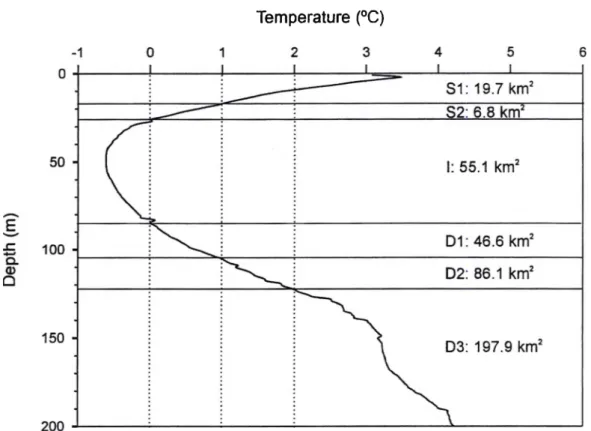
Figure 2 Mean température profile, based on 50 profiles, as a function of depth in Baie Sainte- Marguerite in the month of May 2001. The profile is divided in 6 strata in which 5 to 10 trawl samples were taken: SI: >1°C, <18m deep; S2: 0-l°C, 18-27m; I: <0°C, 27- 85m; Dl: 0-l°C, 85-105m; D2: 1-2°C, 105-120m; D3: >2°C, >120m... 14
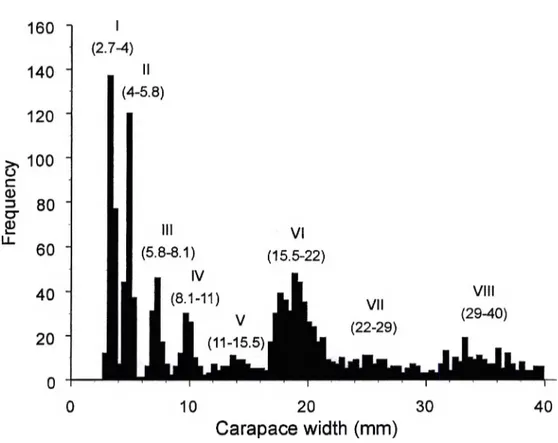
Figure 3 Size frequency distribution of juvénile snow crabs, Chionoecetes opilio, collected by beam trawl in Baie Sainte-Marguerite in May 2001. Roman numerals above the modes indicate instars. Numbers in parenthèses represent the carapace width range in millimétrés corresponding to each instar ... 15
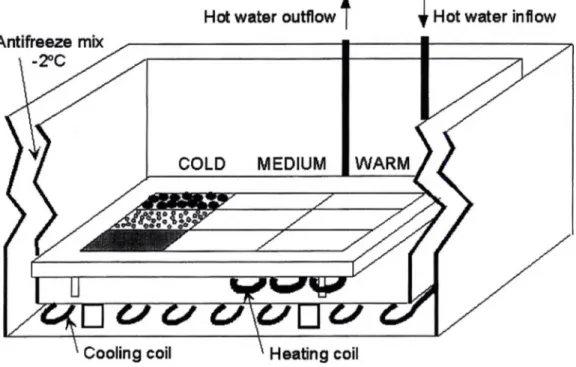
Figure 4 Diagram of the experimental bain-marie tank used in the laboratory experiments, creating a horizontal thermal gradient System. Each aquarium (50 x 30 x 20 cm) was inserted individually in a cold water tank (60 x 60 x 60 cm) (see description in the text... 17
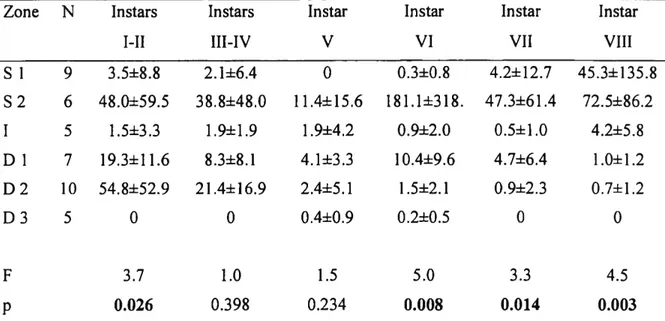
Figure 5 Cumulative frequency distributions of température (a) and depth (b) (f(t)) and of abundance of juvénile snow crabs (g(t)) from the May 2001 trawl survey in Baie Sainte-Marguerite, based on 45 trawl samples. Cohort I: instars I and II; Cohort II: instars III and IV ... 24
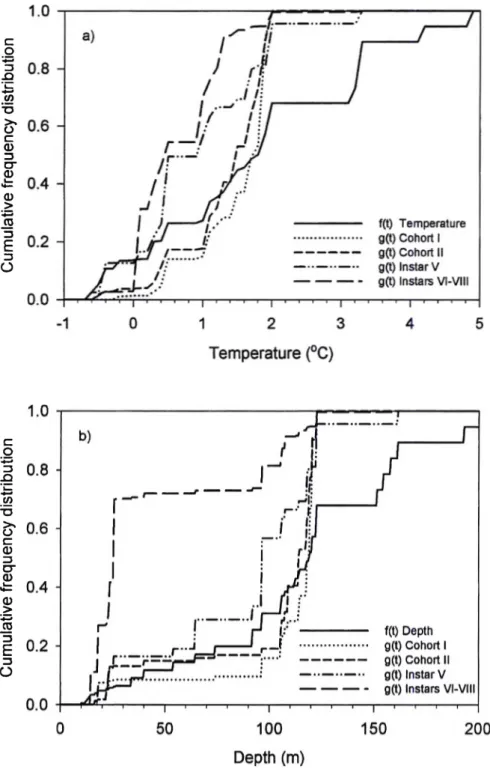
Figure 6 Cumulative frequency distributions of depth (f(t)) and of abundance of juvénile snow crabs (g(t)) from the 1989 to 2000 spring trawl surveys in Baie Sainte-Marguerite, based on 138 trawl samples. Cohort I: instars I and II; Cohort II: instars III and IV... ...25
viii
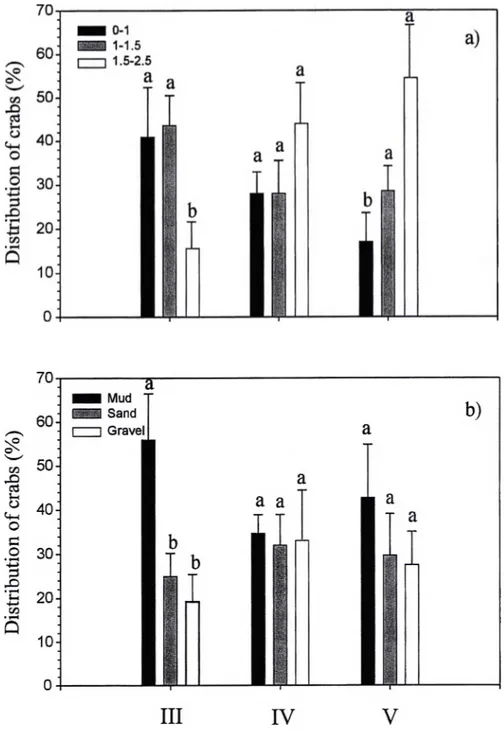
Figure 7 Distribution (%) of juvénile snow crabs among different température ranges (a) and different types of substratum (b) in a controlled laboratory choice experiment. Roman numerals indicate instars. Bars having dissimilar letters above them differ significantly from each other...28
Figure 8 Distribution (%) of instar V juvénile snow crabs among different température ranges in a controlled laboratory choice experiment: thermal gradient between (a) 0 and 2.5°C, (b) 1.5 and 4.5°C and (c) 3.0 and 5.5°C. Bars having dissimilar letters above them differ significantly from each other...30
Figure 9 Taux de survie moyen par semaine, estimé en pourcentage des densités initiales de larves par bassin. Les différentes étapes du développement sont indiquées en haut du graphique. Még. = mégalope... 52
Figure 10 Abondance des mégalopes sur différents types de substrat (a) et dans différentes zones de température (b) durant les expériences de préférence d’habitat en laboratoire. Les barres ayant des lettres différentes sont significativement différentes l’une de l’autre selon les tests de Ls Means... 54
Fig. 11 Diminution de la concentration en oxygène dans un aquarium à gradient thermique à eau stagnante lors d’une expérience de laboratoire sur les préférences de température et de substrat chez les juvéniles du crabe des neiges. L’aquarium contenait 25 crabes de stade V...61
Introduction générale
L’abondance d’une population adulte représente le résultat de plusieurs processus de sélection au cours d’un cycle de vie. Les premiers stades benthiques constituent souvent une étape critique chez les invertébrés marins benthiques chez qui le taux de mortalité est élevé, parfois même plus élevé que le taux de mortalité durant la phase larvaire (Gosselin et Qian 1997, Hunt et Scheibling 1997). Cette période de développement pourrait donc représenter le maillon le plus faible du cycle vital chez plusieurs invertébrés marins benthiques. Il est donc essentiel de bien comprendre les processus régulateurs intervenant lors de cette étape critique. Certaines caractéristiques de l’habitat, telles la température de l’eau (Brown et al. 1992, Sulkin
et al. 1996, Frederich et al. 2000b, Rosenkranz et al. 2001) et le type de substrat (Boudreau et al. 1990, Feldman et al. 1997, Gebauer et al. 1998, Linnane et al. 2000) sont connues pour
influencer la déposition, la distribution, la croissance et la survie de plusieurs crustacés décapodes. Des perturbations importantes et brusques de ces caractéristiques environnementales sont susceptibles d’influencer davantage les premiers stades benthiques puisqu’ils sont souvent moins mobiles que les adultes.
Le crabe des neiges, Chionoecetes opilio (O. Fabricius, 1788), est un décapode de la famille des Majidae et de la sous-famille des Oregoniinae (Hickman et al. 1995) habitant les
eaux froides et profondes dans le nord-ouest de l’Atlantique et le nord du Pacifique, dont la mer de Béring, la mer d’Okhotsk et la mer du Japon (Slizkin 1982). Plus près de nous, le crabe des neiges est présent dans l’estuaire et le golfe du Saint-Laurent, dans la baie des Chaleurs ainsi qu’autour de l’île du Cap-Breton et de Terre-Neuve (Squires 1990). Dans le nord-ouest de l’Atlantique, les adultes se distribuent principalement entre 60 et 200 m de profondeur (Watson 1969). Le crabe des neiges est considéré comme une espèce d’affinité arctique- boréale puisqu’il est associé aux eaux très froides mais est absent du nord de l’Arctique (Slizkin 1982).
2
La distribution spatiale du crabe des neiges diffère en fonction de la taille des individus (Coulombe et al. 1985). En effet, il semble y avoir une augmentation de la taille et une diminution de l’effectif des juvéniles avec la profondeur dans le sud-ouest du golfe du Saint- Laurent. Les juvéniles et les immatures habiteraient les profondeurs au-dessus de 90 m alors que les adultes se concentreraient plus en profondeur. La distribution du crabe des neiges serait également reliée à la température et au type de substrat (Coulombe et al. 1985, Brêthes et al. 1987, Robichaud et al. 1989, Comeau et al. 1998). Les températures préférentielles ducrabe des neiges adulte se situent entre -1°C et 5°C et le taux de mortalité augmente à partir de 12°C (Hardy et al. 1994) pour atteindre une température létale à 18°C (Foyle et al. 1989). En laboratoire, Foyle et al. (1989) ont démontré que les adultes ont un coût métabolique positif entre 1°C et 7°C , alors qu’il est légèrement négatif à des températures plus basses ou plus élevées. Quant au substrat préférentiel, le crabe des neiges adulte serait plus abondant sur les substrats vaseux et gravelo-vaseux que sur d’autres types de fonds (Coulombe et al. 1985,
Brêthes et al. 1987, Comeau et al. 1998). Selon certains auteurs, la température et le type de
substrat auraient un effet plus important que la profondeur sur la distribution de cette espèce (Coulombe et al. 1985, Brêthes et al. 1987, Robichaud et al. 1989, Comeau et al. 1998).
Cycle de vie du crabe des neiges
La reproduction du crabe des neiges a lieu dans les eaux de profondeur faible à intermédiaire à la fin de l’hiver et au printemps (Lovrich et al. 1995, Comeau et al. 1998). La
fécondation est interne et l’incubation dure de 24 à 27 mois dans le golfe du Saint-Laurent (Sainte-Marie 1993, Moriyasu et Lanteigne 1998). La durée d’incubation semble varier en fonction de la température, une température plus chaude favorisant un développement embryonnaire plus court (Kon 1980). Dans le golfe du Saint-Laurent, l’éclosion des œufs a lieu d’avril à juin (Lanteigne 1985, Sainte-Marie 1993, Starr et al. 1994, Conan et al. 1996) et
la femelle peut libérer de 10 000 à 30 000 larves (Sainte-Marie 1993). Les débris phytoplanctoniques provenant de l’explosion printanière de phytoplancton semblent être le signal déclencheur de l’éclosion. En effet, l’abondance maximale des larves survient 2 à 3 semaines après cette explosion, coïncidant avec une abondance élevée du microzooplancton, la nourriture présumée des larves (Starr et al. 1994).
3 Les larves passent du stade prézoé aux stades zoé I et II pour ensuite se métamorphoser en mégalopes, le stade pelago-benthique, entre la fin août et la fin octobre (Robichaud et al. 1989, Lovrich et al. 1995, Comeau et al. 1998). Le développement planctonique dépend de la
température et dure de 3 à 5 mois à des températures de surface entre 8°C et 12°C (Lanteigne 1985, Lovrich et al. 1995, Comeau et al. 1998). La déposition des mégalopes chez le crabe des
neiges reste encore un phénomène peu connu. Par contre, chez d’autres espèces de crabes, les mégalopes feraient un choix actif de leur environnement avant la déposition finale (Lipcius et
al. 1990), ce qui suggère l’existence d’habitats préférentiels favorisant la survie. Suite à la
déposition, les mégalopes du crabe des neiges se métamorphosent et entament une série de mues en tant que juvéniles, à intervalles de 6 mois pour les juvéniles des stades I à V et à intervalles de 1 an pour les stades successifs ultérieurs (Sainte-Marie et al. 1995, Alunno- Bruscia et Sainte-Marie 1998, Comeau et al. 1998). La période juvénile s’étend du stade I au stade VIII inclusivement. Les mégalopes et les premiers juvéniles semblent être les plus sensibles aux conditions du milieu, particulièrement face à la température et au type de substrat (Lanteigne 1985). Cette période pourrait représenter le maillon le plus faible du cycle vital du crabe des neiges et le plus dépendant des conditions environnementales. En effet, ces jeunes crabes sont peu mobiles et seraient victimes des fluctuations environnementales, contrairement aux crabes immatures et adultes capables de se déplacer efficacement (Sainte- Marie et Gilbert 1998). La majorité des femelles effectuent une mue terminale et atteignent la maturité sexuelle à l’âge de 5,5 à 7,5 ans (stades IX à XI) à une taille variant entre 47 et 68 mm de largeur de carapace (Alunno-Bruscia et Sainte-Marie 1998, Comeau et al. 1998). Les
mâles passent par 3 stades de développement distincts, entrecoupés par 2 mues critiques et atteignent une taille finale entre 40 et 162 mm de largeur de carapace après 4 à 12 ans (Sainte- Marie et al. 1995). L’espérance de vie des crabes, après la mue terminale, est généralement de
5 à 6 ans et les femelles ne peuvent mener à terme que 2 à 3 portées durant une vie (Sainte- Marie 1993, Moriyasu et Lanteigne 1998, Comeau et al. 1999).
Historique des pêcheries et explosion démographique
Dans le golfe du Saint-Laurent, la pêche au crabe des neiges a commencé au début des années 1960 (Elner et Beninger 1995, Comeau et al. 1998) et est maintenant devenue l’une
4 des pêches commerciales les plus importantes au Canada. Les débarquements ont atteint 95 000 tonnes en 2001 pour une valeur excédant 390 millions de dollars canadiens (É. Koulouris, MPO, Région de Québec, comm. pers.). Au Canada, une taille minimale légale de 95 mm de largeur de carapace (stade XII chez le mâle, atteint environ 8,7 ans après la déposition) est en vigueur depuis 1973 (Elner et Beninger 1995). Cette taille minimale légale excède la taille maximale des femelles adultes et celles-ci sont donc épargnées par la pêche commerciale.
Depuis le début de la pêche au crabe des neiges, les débarquements ont augmenté et fluctué de façon relativement synchrone entre les différentes zones de pêche sur une période d’environ 8-10 ans (Conan et al. 1996, Sainte-Marie et al. 1996, Sainte-Marie 1997). Depuis
1994, une hausse marquée des débarquements et des prises par unité d’effort a été observée, particulièrement dans les régions de Terre-Neuve, du Labrador et de la côte ouest du Cap Breton (Fig. 1). Cette hausse s’explique tout d’abord par l’augmentation de l’effort de pêche avec le temps, mais plusieurs indices montrent qu’il y a également eu une forte croissance de la biomasse commerciale depuis 1994. Ce phénomène est survenu environ 9 ans après un refroidissement des eaux côtières (Gilbert et Pettigrew 1997, Sainte-Marie et Gilbert 1998). En fait, ce n’est qu’une partie de la colonne d’eau qui s’est refroidie. En effet, la colonne d’eau des eaux côtières du nord-ouest de l’Atlantique, dont le golfe du Saint-Laurent, est constituée de 3 couches principales durant les périodes estivale et automnale : une couche de surface chaude (jusqu’à 18°C) et peu salée, une couche intermédiaire froide (CIF : température minimale entre -1 et 2°C) et une couche salée et tiède (jusqu’à 6°C) profonde. Une forte corrélation inverse (r = -0,88) existe entre la température minimale et l’épaisseur de la CIF (Sainte-Marie et Gilbert 1998). Depuis 1985, dans le golfe du Saint-Laurent, l’épaisseur de la CIF au seuil de 1°C a augmenté de plusieurs dizaines de mètres alors que la température minimale au cœur de la CIF a diminué d’environ 1°C. Ces conditions résultent en une augmentation de la surface de fond baignée par des eaux froides, ce qui pourrait favoriser la survie du crabe des neiges, tout particulièrement des mégalopes et des premiers stades juvéniles qui pourraient être plus vulnérables aux conditions du milieu. Dans une telle situation, le phénomène d’expansion d’aire habitable se traduirait en une survie accrue des jeunes stades benthiques et en une augmentation marquée des débarquements 9 ans plus tard,
5
100000
■■ Terre-Neuve et Labrador ■H Cap-Breton Est ■■ Cap-Breton Ouest ■—I Estuaire et nord du golfe
île du Prince Edward
Sud du golfe (incluant IPE depuis 1997)
20000 -î 60000
40000 80000
-Année
6 période nécessaire pour qu’un crabe atteigne la taille minimale légale. Cette hausse des débarquements serait plus marquée dans les régions à pentes douces comme Terre-Neuve et le Labrador et plus faible dans les régions à pentes abruptes comme le nord-est du Golfe (Sainte- Marie et Gilbert 1998). C’est d’ailleurs ce que l’on observe depuis 1994. L’explosion des populations du crabe des neiges pourrait donc être due, en partie du moins, à l’impact de ce changement environnemental.
Préférence d’habitat des premiers stades benthiques
Jusqu’à maintenant, très peu d’études ont été effectuées sur les mégalopes et les jeunes stades juvéniles du crabe des neiges. Leur distribution fine ainsi que leurs préférences thermiques et édaphiques sont des aspects très mal connus. En ce qui concerne la température, il semblerait que les juvéniles plus âgés préfèrent des températures < 3°C (Brêthes et al.
1987), mais on ne connaît pas les préférences plus spécifiques. Lovrich et al. (1995) suggèrent que les premiers stades benthiques seraient plus abondants au cœur de la couche intermédiaire froide du golfe du Saint-Laurent. Cependant, les relations précises avec la température et le type de substrat n’ont pas été évaluées. En laboratoire, les premiers stades benthiques auraient un meilleur potentiel de croissance et de survie à 0°C et à 1,5°C qu’à -1,5°C et 3°C, ce qui démontre la sténothermie de ces juvéniles (Gravel 2002). Quant au substrat, les juvéniles de 45 à 65 mm de largeur de carapace (environ 5 à 7 ans après la déposition sur le substrat) auraient une préférence pour le substrat gravelo-vaseux (Coulombe et al. 1985). Brêthes et al. (1987) et Robichaud et al. (1989) ont par contre constaté une préférence pour les substrats
homogènes vaseux dans le sud-est et le sud-ouest du golfe du Saint-Laurent respectivement. Toutefois, ces observations ont été effectuées à l’aide de chaluts munis de filets de 12 et 25 mm de maillage respectivement, pouvant laisser passer les premiers stades juvéniles.
La présente étude vise donc à éclaircir cette problématique et à mieux connaître la distribution et les préférences d’habitat des premiers stades benthiques du crabe des neiges. Pour ce faire, 3 hypothèses ont été testées : 1) la distribution spatiale des premiers stades juvéniles est hétérogène en milieu naturel; 2) dans une situation présentant une combinaison de plusieurs températures, les mégalopes et les juvéniles se distribuent dans la région où la
7 température est la plus froide; 3) dans une situation présentant une combinaison de plusieurs types de substrats, les mégalopes et les juvéniles se distribuent sur le substrat le plus fin. Nous avons vérifié la distribution des juvéniles du crabe des neiges en milieu naturel à l’aide d’un échantillonnage aléatoire stratifié en fonction de la température en mai 2001 dans la baie Sainte-Marguerite, Québec, Canada. Les préférences thermiques et édaphiques des mégalopes et des juvéniles ont été vérifiées en milieu contrôlé à l’aide d’un montage d’aquariums à gradient thermique offrant différents types de substrat. La section concernant les préférences d’habitat des mégalopes a été insérée en tant qu’Annexe A puisque ces expériences ont été effectuées à l’aide d’un petit nombre d’individus seulement et représentent des résultats préliminaires.
Chapitre 1
Distribution and habitat sélection of early benthic stage
snow crabs, Chionoecetes opilio^ from a climate change
9
Abstract
Early benthic stages of snow crab are presumed to be very stenotherm and therefore, they would be quite sensitive to climate change and influence subséquent adult population abundance. We determined the distribution pattern of juvéniles in the Gulf of St. Lawrence, Québec, Canada and their température and substratum preferences through controlled laboratory experiments. Field sampling was carried out with a beam trawl equipped with température probes and a video caméra. Laboratory experiments were conducted in aquaria with a température gradient and a choice of three sédiments (mud, sand and gravel). Field and laboratory data indicate that early benthic stages hâve sharp size-dependent distribution and habitat preferences. In the field, juvéniles from instars I to IV are scarce in the core of the cold intermediate layer (CIL), distributing above and below where température is between 0 and 2°C. Older juvéniles, from instars VI to VIII, are concentrated above the CIL in the surface layers <27 m. Température preference in the laboratory shifted from a cold (0.0-1.5°C) to a warmer température preference (1.0-4.5°C) between the third and the fifth juvénile instar. Juvéniles preferred mud in general. Oxygen may also be an important regulatory factor. Our results suggest that early benthic stages would be the first component of the population affected by climate changes.
10
Introduction
High juvénile mortality is a widespread phenomenon among benthic marine invertebrates and variability in juvénile survivorship can affect population size significantly (Gosselin and Qian 1997, Hunt and Scheibling 1997). Juvéniles and adults are often spatially segregated and different processes may regulate their survival (Gosselin and Qian 1997). Abiotic habitat characteristics such as water température (Brown et al. 1992, Frederich et al.
2000b, Rosenkranz et al. 2001) and substratum (Boudreau et al. 1990, Linnane et al. 2000) are
known to affect seulement, distribution, growth and survival of many benthic crustacean decapods. Sudden changes in those environmental conditions are likely to affect juvéniles first, as they are usually less mobile than adults.
The circalittoral habitat of the Gulf of St. Lawrence and of the Labrador, Newfoundland and Scotian Shelves experienced a large change in the late 1980s, when cod
(Gadus morhua) populations collapsed (e.g. Myers et al. 1996) while northern shrimp (Pandalus borealis) and snow crab (Chionoecetes opilio) populations boomed (e.g. Sainte- Marie 1997, Lilly et al. 2000). This ecosystem shift followed a period of rapid cooling of the shelves in the Northwest Atlantic that started around the mid 1980s (Drinkwater 1996). Two classes of hypothèses hâve been proposed to explain the increase in biomass of large crustacean decapods. First, the surge has been attributed to indirect or direct climate effects, i.e. extension of the availability of suitable habitat and/or greater survival of early juvéniles in colder water. The second alternative or complementary hypothesis is that the collapse of cod (and of ground fish in general) relaxed a top-down control (Tremblay 1997, Lilly et al. 2000).
Testing of these hypothèses is important for understanding marine ecosystem functioning, for gaining perspective into past climate-related events, and for predicting future events that might arise from global climate changes (e.g. Frank et al. 1990). However, essential information on relationships between température and juvénile crustaceans is missing or is incomplète.
The snow crab, C. opilio, inhabits cold shelf or slope bottoms of the Northwest Atlantic and North Pacifie (Slizkin 1982) and supports one of Canada’s most important and
lucrative marine fisheries. Snow crab is also considered to be the most cold-restricted marine invertebrate resources of Canada (Foyle et al. 1989) and therefore, it may represent a unique model for assessing and predicting the impacts of climate change on marine fishery resources. Recruitment to snow crab populations in eastern Canada occurs annually from August to October, when megalopae settle on the bottom and métamorphosé to instar I (Lovrich et al. 1995). Intermoult periods last about 6 months for instars I to V, and 1 year for later instars. Snow crab remains juvénile (sexually immature) until instar VIII inclusively (Sainte-Marie et
al. 1995).
The juvénile period appears to be the most stenothermic of ail snow crab life history phases, but only fragmentary data are available to substantiate this claim. Slizkin (1982) suggested that juvéniles prefer températures <0°C in the southeastern Bering Sea, while Brêthes et al. (1987) reported occurrences of juvéniles at températures <3°C in the northwest Gulf of St. Lawrence. These two studies, however, considered ail juvénile instars together and the distribution of the earliest instars was not examined. Some authors suggested that instar I crabs concentrate in the core of the cold intermediate layer (CIL) in the northwest Gulf of St. Lawrence (Lovrich et al. 1995). If early juvéniles are indeed more stenotherm than older ones
and adults, they would be more vulnérable to climate changes than older individuals and could represent the weakest link of the snow crab life cycle.
Although substratum quality may affect snow crab distribution, little is known about its spécifie influence in early life stages. Early juvéniles hâve been reported to prefer homogeneous mud substrata (Brêthes et al. 1987, Robichaud et al. 1989) or to be indifferent to sédiment type (Conan et al. 1996). If snow crabs settle or survive only on spécifie substrata,
then persistence of populations could also dépend on the spatial coincidence of adéquate substratum and suitable température, as proposed by Rosenkranz et al. (2001) for the Tanner
crab Chionoecetes bairdi in Bristol Bay, Alaska.
To better understand the distribution and habitat preferences of juvénile snow crabs, three hypothèses were tested. It was predicted that (i) spatial distribution of young juvéniles will be heterogeneous on the bottom of Baie Sainte-Marguerite. Two models likely to explain
12 this distribution pattern, température and substratum type, were then tested in the laboratory. It was predicted that (ii) in a controlled température choice environment, juvénile crabs would demonstrate a spécifie preference for the coldest water available and (iii) in a controlled substratum choice environment, juvénile crabs would make an active choice for the finest substratum.
13
Methods
Field distribution
The spatial distribution of snow crabs was studied in Baie Sainte-Marguerite (approximately 50°06’N, 66°35’W), in the northwest Gulf of Saint Lawrence, Québec, Canada, in the first three weeks of May 2001. For a site description, see Sainte-Marie and Hazel (1992). Five to 10 randomly allocated samples were taken in each of 6 discrète temperature-depth strata, determined from CTD profiles (SBE-19, Seabird Electronics) before sampling (Fig. 2). Snow crabs were sampled with a 3 m wide beam trawl fitted with heavy tickler chains to dislodge buried animais. Tows lasted approximately 5 min at 2.5 knots, and tow distance was determined from GPS readings for calculation of swept area and crab density. The 25 mm net was divided by rigid hoops into two equal sections lined with 5 or 15 mm mesh. Only crabs collected in the 5 mm net section were considered because our focus was on instars I to VIII (2.7-40 mm carapace width). Trawl content was sorted on board on a 2 mm sieve. Carapace width (CW) of crabs was measured with a vernier calliper to the nearest 0.1 mm. The resulting size frequency histogram is shown in Fig. 3.
Two Vemco probes were attached to the upper frame of the beam trawl to record température and depth. A Sony Handycam video caméra with a wide angle objective (VCL- 0637H, x0.6) was fixed to the upper frame of the trawl between two halogen lights (20 W, 12 V). This allowed us to visually evaluate the type of substratum associated with each sample and its homogeneity over the towed distance. Also, a sample of the sédiment was taken afiter each trawlset with a 0.04 m2 Shippek grab and frozen for subséquent analysis. In the laboratory, sédiment samples were thawed, dried and separated into fractions using 63 pm to 32 mm sieves (phi = 4.0 to -5.0) at 1 phi intervals. Each fraction was then weighed and expressed as a percentage of the total weight of the sample (for a detailed description of the method, see Annex B).
14
Température (°C)
Figure 2 Mean température profile, based on 50 profiles, as a function of depth in Baie Sainte- Marguerite in May 2001. The profile is divided into 6 strata in which 5 to 10 trawl samples weretaken: SI: >1°C, <18m deep; S2: 0-l°C, 18-27m; I: <0°C, 27-85m; Dl: 0-l°C, 85-105m; D2: 1-2°C, 105-120m; D3: >2°C, >120m. Estimated bottom area associated with each stratum is shown.
15
Figure 3 Size frequency distribution of juvénile snow crabs, Chionoecetes opilio, collected by beam trawl in Baie Sainte-Marguerite in May 2001. Roman numerals above the modes indicate instars. Numbers in parenthèses represent the carapace width range in millimétrés corresponding to each instar.
16
Laboratory experiments
Juvénile crabs were collected with a beam trawl in Baie aux Outardes (approximately 48°58’N, 68°35W) on the north shore of the St. Lawrence Estuary during August 2001. On board, CW of each crab was measured with a vernier calliper and only crabs <15.5 mm (instar V or less) were selected. At this time of the year, instars I and II were not présent or scarce and therefore, could not be tested. Juvénile crabs were transferred to the Maurice Lamontagne Institute where they were maintained in darkness in a tank with circulating seawater at 2°C and 28%o salinity. They were fed twice weekly with thawed shrimp, Pandalus borealis.
Habitat preference experiments were conducted in aquaria containing 20 L of seawater, resulting in a water column of 15 cm. Each aquarium was inserted into a larger insulated tank containing 91 L of non-toxic antifreeze mix regulated by a Johnson Control A-Y-D350 cooler System (Fig. 4). A heating coil was installed on the bottom of each aquarium, at one randomly chosen side, and a Haake DC30 digital apparatus circulated warm freshwater through it. By varying the température of the cooling and heating coils, it was possible to generate different température gradients. A sédiment grid installed over the heating coil was separated along its length into 3 température zones, each subdivided into 3 longitudinal sections with an area of 7 x 14 cm, in which mud (<0.5 mm), sand (1-2 mm) or gravel (2-16 mm) was randomly deposited. A 4 cm wide border around the grid, also filled with those sédiments, was provided to avoid wall interaction and to ensure independence of the data. Température probes (Dallas DS 1820 ± 0.2°C) were placed at the junction between température zones to record température every 5 minutes. Seawater in each aquarium was oxygenated to saturation and allowed to rest for 1 h before the start of an experiment to allow formation of a steady thermal gradient. Mobile probes were used to confirm that water température was uniform across the width of the aquarium. Three identical experimental tanks were used simultaneously and ail experiments were carried out in darkness.
Preliminary experiments lasting 25 h indicated that instar III crabs required 6-7 h to reach equilibrium in their distribution. In another preliminary experiment, oxygen déplétion over time was measured every hour for 25 h with an oxymeter (Orion 1230 Multimeter ±
17
Figure 4 Diagram of the experimental bain-marie tank used in the laboratory experiments, creating a horizontal thermal gradient System. Each aquarium (50 x 30 x 20 cm) was inserted individually in a cold water tank (60 cm3) (see description in the text).
18 at the beginning of the experiment, dropped to 88% after 8 h and to 69% after 22 h (see Annex C). Anomalous crab behaviours such as slower movements and overturning, presumably due to oxygen déplétion, were observed after 24 hours (see also Das and Stickle 1994). Finally, to evaluate if juvénile crabs are gregarious on a small spatial scale, experiments with instars II and V were conducted on mud only at constant 2°C and in three replicates, following the standard method (see below).
In the main experiments, cold, medium and warm zones ranged 0-1, 1-1.5 and 1.5- 2.5°C. We were unable to generate subzero températures. Separate experiments were conducted for each of instars III, IV and V. Each experiment was conducted in darkness with 25 individuals distributed uniformly over the sédiment grid at the beginning of the experiment. Based on the results of the preliminary experiments, the number of crabs in each sédiment section was noted on the 8Ü1 hour, a time at which distribution was stable and oxygen concentration in seawater was high enough not to influence the behaviour of the crabs. Three replicates were carried out with instars III and IV, and 8 with instar V. Crabs were used only once. After each replicate, the aquarium was emptied, the sédiment grid was extracted and ail components were thoroughly rinsed with seawater. Two additional experiments with modified thermal gradients were conducted to better résolve the température preference of instar V crabs. In the first one, the three zones ranged 1.5-2.0, 2.0 to 3.0 and 3.0-4.5°C. In the second one, the températures were 3.0-3.5, 3.5-4.5 and 4.5 to 5.5°C. Both experiments were replicated 3 times.
Statistical analysis
Homogeneity in the distribution of juvénile snow crabs among temperature-depth strata in the field was tested using a one-factor analysis of variance. Instars I and II, and instars III and IV, were combined for analyses because they belong respectively to cohorts I (âge 0+) and II (âge 1+) during the May sampling period (Sainte-Marie et al. 1995). Larger instars were
analysed separately since they each represent a distinct cohort. To meet the assumption of homoscedasticity, the surface (SI) and deepest (D3) layers were excluded from the analyses on instars I to VI, as abundance in these strata was very low or null.
19 To illustrate the fïeld distribution of juvéniles in relation to the availability of a habitat variable, a modelling analysis developed by Perry and Smith (1994) was used. This analysis provides a perspective on juvénile occupation of the bottom different than density patterns because it takes into account the bottom surface area associated with each temperature-depth stratum (see Fig. 2). This analysis compares the cumulative distribution function (CDF) of the density of each cohort to the sampled CDF of a particular habitat variable. The test statistic represents the maximum absolute différence between both CDF curves, which is then compared to a pseudo-population of similarly computed test statistics obtained by Monte- Carlo simulations, under the null hypothesis of no association between juvénile abundance and the habitat variable. This nonparametric test has no prior assumptions on the statistical distribution of either variable. Historical snow crab distribution data in Baie Sainte- Marguerite, available for late April to late May of 1989 to 2000, were also compared to that of year 2001. These data were collected following the same method described above except that the net had a 15 mm mesh (Sainte-Marie et al. 1996). We used depth and température as
habitat variables for the 2001 analyses, but only depth was available for the 1989-2000 analysis.
To détermine température and substratum preferences of juvéniles in the laboratory, a two-factor analysis of variance was used for each instar. To evaluate the degree of gregariousness of juvénile snow crabs, a nearest-neighbour analysis was performed following the method in Clark and Evans (1954). The distance between two crabs in different grid sections was approximated by the distance separating the centres of their respective grid sections. The distance between two crabs in the same grid section was taken to be 0. This method tests the déviation of the observed distribution from a perfect random distribution with a statistic R that varies from 0 to 2 (R = 0: perfectly clumped; R = 1: randomly dispersed; R = 2: uniformly dispersed).
LS Means tests were carried out for post-hoc comparisons using the sequential Bonferroni test (Rice 1989). Data were logio(x+l) transformed when assumptions of homoscedasticity and normality were not met. Homogeneity of variances was tested using Cochran’s test and normality of data was evaluated by examining plots of the residuals.
20 ANOVA and post-hoc comparisons were conducted using the SAS software (SAS/STAT version 8.2, copyright ©1999 SAS Institute Inc., USA).
21
Results
Field distribution
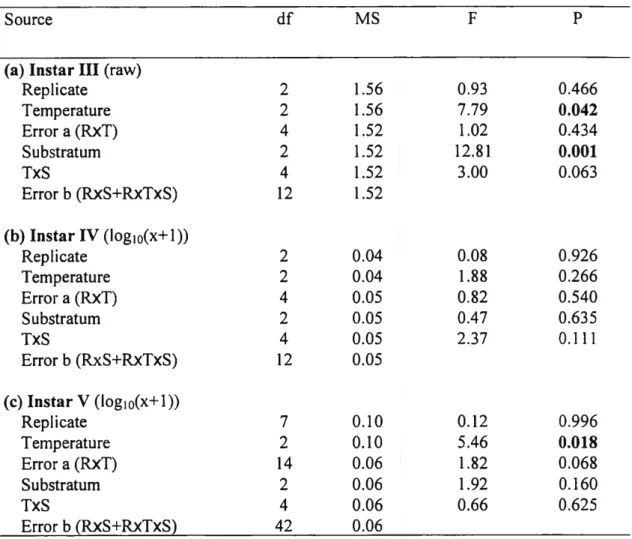
Density of juvéniles was not uniform among or within temperature-depth strata (Table 1). The highest or second-highest densities were always recorded in the narrow S2 stratum. In contrast, density was always very low or null in the I stratum (representing the core of the CIL) and in the deepest stratum D3. A high variance in the density of juvéniles was observed, suggesting the existence of mesoscale aggregations within strata and making statistical détection of any distribution pattern diffïcult at the current scale of sampling. The first cohort (instars I and II) was signifïcantly less abundant in the core of the CIL (I stratum) than in the S2, DI and D2 strata and it was absent from the deepest stratum (Table 1). The second cohort (instars III and IV) followed the same distribution pattern, but no significant différences in density were observed among strata. Instars V and VI spread out more uniformly in the deep strata and they were the only juvéniles to occur in the deepest stratum. Density was signifïcantly different among strata only for instar VI which occurred at greater densities in the S2 than in the I and D2 strata. Older juvéniles belonging to instars VII and VIII were scarce in the D2 stratum, absent from the D3 stratum and were concentrated in the two surface strata. Instar VII had a signifïcantly higher density in the S2 stratum than in the SI, D2 and D3 strata. Instar VIII occurred at a signifïcantly higher density in the S2 stratum than in the SI, Dl, D2 and D3 strata.
In the cumulative distribution function (CDF) analysis relative to température, CDFs of cohorts I and II departed moderately from the température CDF (p = 0.088 and p = 0.149, respectively), as more than 95% of those juvéniles concentrated between 0.3 and 1.9°C which represented approximately 45% of the available température (Fig. 5a). However, instar V was distributed in proportion to the available habitat showing no association with a particular température (p = 0.400). The CDF of instars VI to VIII was moderately different from that of the température CDF (p = 0.130) with about 90% of ail individuals associated with températures between 0 and 1.3°C. Overall, juvéniles never occurred on bottoms warmer than 3.3°C.
22
Table 1. Results from the one-way ANOVAs comparing the mean abundance of juvénile snow crabs (ind./1000m2) in different temperature/depth strata. Data were logio(x+l) transformed for the analysis. The surface (SI) and the very deep layers (D3) were excluded from the analyses for cohort I to instar VI inclusively to meet assumptions of homoscedasticity. Significant p values are in bold. First and second highest abundance within each instar group are shown in dark and pale grey respectively. SI: >1°C, <18m deep; S2: O-1°C, 18-27m; I: <0°C, 27-85m; Dl: O-1°C, 85-105m; D2: 1-2°C, 105-120m; D3: >2°C, >120m. Zone N Instars I-II Instars III-IV Instar V Instar VI Instar VII Instar VIII S 1 9 3.5±8.8 2.1±6.4 0 0.3±0.8 4.2±12.7 45.3±135.8 S2 6 48.0±59.5 38.8±48.0 11.4±15.6 181.1±318. 47.3±61.4 72.5±86.2 I 5 1.5±3.3 1.9±1.9 1.9±4.2 0.9±2.0 0.5±1.0 4.2±5.8 D 1 7 19.3±11.6 8.3±8.1 4.1±3.3 10.4±9.6 4.7±6.4 1.0±1.2 D2 10 54.8±52.9 21.4±16.9 2.4±5.1 1.5±2.1 0.9±2.3 0.7±1.2 D3 5 0 0 0.4±0.9 0.2±0.5 0 0 F 3.7 1.0 1.5 5.0 3.3 4.5 P 0.026 0.398 0.234 0.008 0.014 0.003
23 In the cumulative distribution fonction (CDF) analysis relative to depth, there was a clear shift of distribution from deep to shallow bottoms with increasing juvénile âge. In 2001, CDFs of cohorts I and II were moderately different from the depth CDF (p = 0.101 and p = 0.176 respectively), with more than 85% of the individuals concentrated between 95 and 120 m which represented <30% of the available depths (Fig. 5b). The distribution of Instar V crabs was not different than that of the available depths (p = 0.453). The CDF of instars VI to VIII differed from the depth CDF (p = 0.051) with approximately 70% of individuals concentrated above 26 m (6% of the available bottom) and the remaining population occurred mainly between 95 and 120 m (62% of the available bottom). Overall, juvéniles were never encountered deeper than 160 m.
Analysis of the 1989-2000 data revealed a similar, although less contrasted, depth distribution pattern of juvéniles (Fig. 6). The CDF of cohort I was not different from the depth CDF (p = 0.795), but numbers were very small due to poor trawl efficiency for these crab sizes. CDFs of cohort II and instar V differed from the depth CDF (p = 0.042 and p = 0.057 respectively) and about 65% of the individuals were collected between 100 and 125 m. The CDF of instars VI to VIII was significantly different from that of the depth (p < 0.001). Approximately 70% of the older juvéniles were distributed between 10 and 85 m, which represents 25% of the available bottom area. Overall, juvéniles were never encountered deeper than 175 m over the period 1989-2000.
Ail sédiment samples had a high content of mud (<63 pm; 11 to 74%) or sand (63 pm- 2 mm; 25 to 98%, see Annex C for more details). Gravel (> 2 mm) was either not présent or accounted for a maximum of 12% of the total sédiment weight. Given that sédiment grain size was rather uniform across the sampled area of Baie Sainte-Marguerite, no relationship between crab density and sédiment type could be established.
24 C u m u la ti v e fr e q u e n c y d is tr ib u ti o n C u m u la ti v e fr e q u e n c y d is tr ib u tio n
Figure 5 Cumulative frequency distributions of température (a) and depth (b) (f(t)) and of abundance of juvénile snow crabs (g(t)) from the May 2001 trawl survey in Baie Sainte- Marguerite, based on 45 trawl samples. Cohort I: instars I and II; Cohort II: instars III and IV.
25 C u m u la ti v e fr e q u e n c y d is tr ib u ti o n
Figure 6 Cumulative frequency distributions of depth (f(t)) and of abundance of juvénile snow crabs (g(t)) from the 1989 to 2000 spring trawl surveys in Baie Sainte-Marguerite, based on
26
Laboratory experiments
No gregarious behaviour was observed on the small spatial scale of our experiments. The distribution of juvéniles was either uniform for instar II (R = 1.26-1.46, p < 0.05) or random for Instar V (R = 1.14 to 1.25, p > 0.05).
Température and substratum preferences varied among instars. When placed in a température gradient of 0-2.5°C, Instar III selected températures of 0-1.5°C (Table 2, Fig. 7a) and concentrating on mud (Fig. 7b). Instar IV crabs had no température or substratum preference. Instar V selected températures of 1-2.5°C but no spécifie substratum was preferred. In the experimental range of 1.5-4.5°C, instar V showed no température preference, but selected mud more than other sédiments (Table 3, Fig. 8b). However, in the experimental range of 3 to 5.5°C, a preference for températures of 3-4.5°C was observed but no spécifie substratum choice was noted (Table 3, Fig. 8c). On mud, the majority of juvénile snow crabs buried and only their eyes and rostrum emerged.
Tl
Table 2. Results from the two-factor ANOVAs comparing the abundance of juvénile snow crabs in different température (cold, medium, warm) and substratum (mud, sand, gravel) sections. Replicate is a random factor. Température and substratum are fixed factors. Significant p values are in bold. Transformations are written beside each analysis.
Source df MS F P
(a) Instar III (raw)
Replicate 2 1.56 0.93 0.466 Température 2 1.56 7.79 0.042 Error a (RxT) 4 1.52 1.02 0.434 Substratum 2 1.52 12.81 0.001 TxS 4 1.52 3.00 0.063 Error b (RxS+RxTxS) 12 1.52 (b) Instar IV (log)0(x+l)) Replicate 2 0.04 0.08 0.926 Température 2 0.04 1.88 0.266 Error a (RxT) 4 0.05 0.82 0.540 Substratum 2 0.05 0.47 0.635 TxS 4 0.05 2.37 0.111 Error b (RxS+RxTxS) 12 0.05 (c) Instar V (iogio(x+1 )) Replicate 7 0.10 0.12 0.996 Température 2 0.10 5.46 0.018 Error a (RxT) 14 0.06 1.82 0.068 Substratum 2 0.06 1.92 0.160 TxS 4 0.06 0.66 0.625 Error b (RxS+RxTxS) 42 0.06
28
Figure 7 Distribution (%) of juvénile snow crabs among different température ranges (a) and different types of substratum (b) in a controlled laboratory choice experiment. Roman numerals indicate instars. Bars having dissimilar letters above them differ significantly from each other.
29
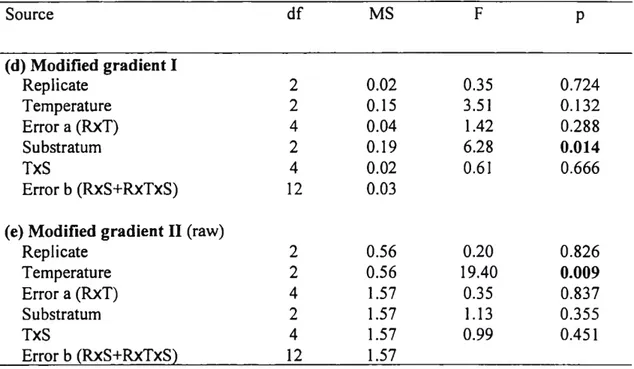
Table 3. Results from the two-factor ANOVAs comparing the abundance of instar V juvénile snow crabs in different température (cold, medium, warm) and substratum (mud, sand, gravel) sections. Replicate is a random factor. Température and substratum are fixed factors. Significant p values are in bold. Transformations are written beside each analysis. Modified gradient I: températures between 1.5 and 4.5°C; Modified gradient II: températures between 3 and 5.5°C.
Source df MS F P (d) Modified gradient I Replicate 2 0.02 0.35 0.724 Température 2 0.15 3.51 0.132 Error a (RxT) 4 0.04 1.42 0.288 Substratum 2 0.19 6.28 0.014 TxS 4 0.02 0.61 0.666 Error b (RxS+RxTxS) 12 0.03
(e) Modified gradient II (raw)
Replicate 2 0.56 0.20 0.826 Température 2 0.56 19.40 0.009 Error a (RxT) 4 1.57 0.35 0.837 Substratum 2 1.57 1.13 0.355 TxS 4 1.57 0.99 0.451 Error b (RxS+RxTxS) 12 1.57
30
Figure 8 Distribution (%) of instar V juvénile snow crabs among different température ranges in a controlled laboratory choice experiment: thermal gradient between (a) 0 and 2.5°C, (b) 1.5 and 4.5°C and (c) 3.0 and 5.5°C. Bars having dissimilar letters above them differ significantly from each other.
31
Discussion
Distribution patterns of juvénile snow crabs in the field, as well as température and substratum preferences under controlled laboratory conditions were examined. Juvénile snow crabs showed heterogeneous and ontogeny-dependent distribution patterns among the temperature-depth strata in the field. Laboratory experiments revealed spécifie température and substratum preferences which also depended on ontogeny. Below, we first discuss the principal abiotic factors which can govern juvénile distribution, then we consider the likeiy causes of the différences in distribution and habitat preferences among juvénile instars.
Abiotic factors influencing juvénile distribution
The spatial distribution of juvénile snow crabs may be the resuit of sélective settlement and of subséquent habitat-specific mortaiity and movement, as demonstrated for several species (Eggleston and Armstrong 1995, Dittel et al. 1996). The greater density of the first
cohort of juvénile snow crab in the depth strata immediately above and below the core of the CIL is probably determined by differential settlement and mortaiity. Indeed, early juvéniles appear to be behaviourally and physiologically constrained to a sedentary habit: they are poorly mobile, remain in hiding most of the time (Lovrich et al. 1995, the présent study) and
enzymes likeiy involved in the oxidation of lactate are not expressed in snow crab leg muscle until instar VI (Angers et al. 1994).
Température emerges as the most important of the two tested abiotic factors affecting spatial distribution of juvénile snow crab. Although megalopae settled preferentially on mud in the température range of 0-2.5°C (Annex A), and juvénile stages also usually exhibited a preference for mud in the current study, the bimodal density pattern of cohort I and II cannot be explained by substratum because sandy-mud occurred throughout the study area. This bimodal pattern is also inconsistent with a spécifie depth, light or salinity requirement. However, based on the annual variability of water column properties in the northwest Gulf of St. Lawrence (Petrie et al. 1996), the three strata most densely populated by the first two
32 period of several months (S2) the 0-1.5°C température range preferred by the smallest instar (III) in the laboratory experiments. Brêthes et al. (1987) also suggested that température was
more important than substratum and depth for determining juvénile abundance patterns. The association of early juvéniles with such a narrow range of températures may be energetically advantageous. Indeed, Gravel (2002) showed that instars II to VI hâve a greater scope for growth and survive better at 0°C and 1.5°C than at -1.2°C and 3°C.
Contrary to our initial hypothesis and to the interprétations of Slizkin (1982) and Lovrich et al. (1995), early juvénile snow crab avoided the core of the CIL and did not associate with the coldest water available. Our study is the first to evaluate early juvénile distribution of snow crabs in very cold water and to test habitat preferences in the laboratory. Previous studies were conducted in the field and they either did not assess bottom température specifically (Slizkin 1982, Lovrich et al. 1995) or were conducted in warmer climatological periods when subzero températures were non-existent (Brêthes et al. 1987). Some authors hâve suggested that température <0°C is energetically disadvantageous for reptant decapod crustaceans, including unspecified Chionoecetes species, because they hâve a reduced ability to regulate [Mg2+] in the haemolymph (Frederich et al. 2000b). This component acts as an
anaesthetic at températures <0°C and it could reduce the scope of activity of crabs, increase their vulnerability to prédation, and ultimately explain why they hâve not been successful at colonizing the coldest polar and sub polar régions (Frederich et al. 2001). Since survival of juvénile snow crabs seems to be reduced at very cold and at warm températures, then sélection
should hâve favoured individuals that become established on suitable grounds.
In the laboratory, ail instars except the fourth had a preference for mud but only within their preferred température range, further suggesting that température is the primary factor influencing distribution and that substratum might play a secondary rôle in the smaller scale distribution. The observed burrowing behaviour in mud might serve to avoid predators or to offer protection against other environmental risks as suggested by Stevens et al. (1994). This
type of behaviour was also observed for juvénile snow crabs in the field (Conan et al. 1996) and for other species of crabs (Richards 1992, Zhou & Shirley 1998).
33 Although we did not specifically consider oxygen in this study, one of our preliminary experiments suggests that it is also a very important factor regulating distribution of early juvénile snow crab. Oxygen saturation decreases with depth in the northern Gulf of St. Lawrence and the 69% oxygen saturation threshold which induced anomalous behaviour in instar V in the laboratory is usually reached at about 120 m of depth (D. Gilbert unpubl. data). This is precisely the depth at which there occurred an almost knife-edge réduction in juvénile density in Baie Sainte-Marguerite, both in 2001 and in the 1989-2000 record. Interestingly, juvénile blue crab (Callinectes sapidus) mortality over one month reaches 50% at 69% oxygen saturation (Das & Stickle 1993). Blue crab megalopae are much more tolérant of hypoxia than early juvéniles, but when exposed to hypoxie conditions they delay metamorphosis and may actively search for more oxygenated habitat (Tankersley & Wieber 2000). Moreover, tolérance to hypoxia increases with size in blue crab (Das & Stickle 1993) as in many other taxa (Diaz & Rosenberg 1995). If this is true for snow crabs as well, then this feature and the greater tolérance of large snow crabs to warmer température (Foyle et al. 1989) could explain why large males can be distributed to much greater depths than juvéniles (Coulombe et al. 1985;
LovrichetaZ. 1995).
Changes in distribution with ontogeny
The shift in juvénile distribution towards shallower depths with growing âge was observed between 1989 and 2000, confirming that year 2001 is not an exceptional year. However, historical trends were not as pronounced as those observed in 2001. This could be due to the pooling of many years having different temperature-depth profiles (Gilbert and Pettigrew 1997). Moreover, trawl sampling during each of those earlier years was done with a larger mesh (15 mm) and with less intensity than in the 2001 sampling.
The shift in juvénile distribution with âge from deep to shallow waters could be explained by two non-exclusive processes. The first is a migration of older juvéniles towards shallow and seasonally warmer waters. This is supported by the warmer température preference observed for instar V in the laboratory. A warmer température could increase their growth and favour long-term survival, as previously observed for other species of crabs
34 (Brown et al. 1992, Hartnoll and Bryant 2001). This hypothesis is also supported by the
spreading of instars V and VI in the deep strata and their increase in density in the DI layer, just above one of the high younger instars density patch. This migration could also occur mainly in late summer when température of the core of the CIL is warming and when no <0°C température barrier is présent. Migration towards deeper strata, which are also warm, would not be advantageous in terms of oxygen requirement, as mentioned above. Prédation might also influence the migration of juvéniles. Reaching a certain size, juvénile crabs might be more vulnérable to predators and finding a refuge might be essential for their survival (Hines
et al. 1987). Cod, for example, is one important predator of snow crabs and it inhabits depths between 90 to 400 m (Castonguay et al. 1999). However, this prédation pressure may hâve a weak importance, as abundance of cod remained very low since the late 1980s (Castonguay et
al. 1999). Migration might also be advantageous in terms of spatial ségrégation to decrease
density-dependent processes like cannibalism. In the laboratory, instar V crabs cannibalise younger crabs, which may affect their behaviour, delay their moult schedule and decrease survival (Sainte-Marie and Lafrance in press). Cannibalism also exists between large adult males (>90 mm CW) and old juvéniles, increasing progressively on crabs from 16 mm CW, to reach a maximum pressure on crabs of 30 mm CW (Dutil et al. 1997). Those large males are mainly found at depths below 80 m (Lovrich et al. 1995), where old juvéniles are low in abundance. Also, instars V to VII crabs are known to be the most frequently consumed prey by conspecifics in the wild (Lovrich and Sainte-Marie 1997).
A second process might consist of a higher mortality rate in the deep compared to the surface layers. Prédation, as mentioned above, could be an important cause. Those two hypothèses are not necessarily exclusive. Final distribution might be the resuit of migration and also of differential mortality on individuals staying in the risky zones. Dahlgren and Eggleston (2000) suggest that mobile animais respond to changes in growth rate (g) and mortality risk (p) in a way that maximises net benefits. Their optimality model predicts that mobile animais will tend to minimize p/g and that both terms are important when it cornes to choosing an optimal habitat.
35 In summary, température seems to play a central rôle in the distribution of juvénile snow crabs and in their habitat sélection. Our experiments support the hypothesis that juvénile snow crabs make an active choice of température and substratum, two major benthic habitat components. Oxygen may also influence juvénile distribution, but further studies need to be conducted on this aspect. These habitat preferences and the field distribution change during ontogeny and processes underlying this shift need to be studied in more detail. The specificity and the restricted habitat préférence of juvénile snow crabs in general, and particularly of very young juvéniles, may represent a potential population bottleneck, as the availability of their optimal habitat can be limiting. We predict that young juvéniles would be the first population component to be affected in a climate change perspective.
Acknowledgments. Support for this research was provided by the Department of Fisheries and Océans Strategie Science Fund, the Climate Change Action Fund (CCAF) of Natural Resources Canada, the Groupe Interuniversitaire de Recherches Océanographiques du Québec (GIROQ), the Département de Biologie, Université Laval and a scholarship from the Fonds pour la Formation de Chercheurs et l’Aide à la Recherche (FCAR). Spécial thanks to Louise Lapointe (GIROQ) and Gaétan Daigle (Département de mathématiques et statistiques) for their statistical help. We also thank Christian Turcotte, Bernard Chénard, Jean-Pierre Allard, Richard Larocque and Isabelle Bérubé (Fisheries and Océans Canada) for their help in the field and in the laboratory.
36
Conclusion générale
Notre étude a permis de décrire la distribution de tous les stades juvéniles du crabe des neiges en milieu naturel, une première de façon aussi détaillée. Elle a également permis de mettre en lumière les préférences d’habitat des premiers stades juvéniles en milieu contrôlé en termes de température et de type de substrat et ainsi d’estimer l’importance qu’ont ces facteurs dans la sélection de l’habitat de ces organismes.
La densité des juvéniles diffère d’une strate de température à l’autre dans le golfe du Saint-Laurent mais la majorité des juvéniles se retrouvent à des températures entre 0 et 1,9°C. Aucun juvénile n’a été retrouvé à des températures plus chaudes que 3,3°C, ce qui vient appuyer les conclusions de Brêthes et al. (1987) selon lesquelles 3°C représente la limite supérieure de distribution des juvéniles du crabe des neiges. La rareté de tous les stades juvéniles dans les eaux très froides (<0°C) est par contre un élément d’information nouveau. En effet, ces observations contredisent les conclusions de Slizkin (1982) et de Lovrich et al. (1995) qui prédisaient une abondance maximale au centre de la couche intermédiaire froide à des températures <0°C. Toutefois, ces conclusions proviennent d’interpolations puisque personne n’a effectué d’échantillonnage détaillé dans cette couche auparavant. Des températures <0°C semblent désavantageuses au niveau énergétique pour les juvéniles du crabe des neiges. Selon Gravel (2002), les juvéniles de stades II à VI du crabe des neiges auraient une meilleure croissance à 0°C et 1.5°C plutôt qu’à -1.5°C et 3°C. Également, certains crustacés décapodes, dont certaines espèces du genre Chionoecetes, auraient une capacité réduite à réguler le taux de magnésium dans leur hémolymphe, un élément qui agirait comme anesthésiant, particulièrement à des températures <0°C. Ces organismes seraient désavantagés en eau très froide par un ralentissement des activités motrices, ce qui limiterait leur tolérance et la colonisation des habitats très froids (Frederich et al. 2000a, Frederich et Pôrtner 2000, Frederich et al. 2000b, Frederich et al. 2001).
En plus d’être spécifique en fonction de la température, la distribution des juvéniles en milieu naturel change avec l’ontogénie. Les juvéniles des stades I à IV ont une distribution bimodale au-dessus et en dessous du cœur de la couche intermédiaire froide (CIF) avec très
37 peu d’individus au centre de la CIF. À partir du stade VI, la distribution devient unimodale et
les juvéniles se concentrent en eaux peu profondes seulement, au dessus de la CIF, à des profondeurs <27 m. Ce changement ontogénique a également été observé, bien qu’avec une intensité moindre, lors des années 1989 à 2000, suggérant que ce mécanisme est récurrent sur une longue échelle temporelle. Par contre, la distribution des juvéniles en milieu naturel ne semble pas influencée par le type de substrat. Toutefois, notre site d’étude ne comportait qu’une très faible diversité de types de substrat et il a donc été impossible de bien évaluer le lien entre l’abondance des juvéniles et le type de substrat en milieu naturel.
En laboratoire, les juvéniles ont également démontré des préférences d’habitat spécifiques et dépendantes de l’ontogénie. Les juvéniles de stade III sont très sténothermes et préfèrent des températures froides entre 0 et 1,5°C alors que les juvéniles de stade V semblent plus eurythermes et préfèrent des températures plus chaudes entre 1,0 et 4,5°C. Les juvéniles de stade IV ne démontrent aucune préférence pour les températures vérifiées et pourraient représenter un stade de transition. Les juvéniles des stades III et V démontrent également une préférence pour les substrats vaseux mais seulement lorsqu’ils se trouvent à des températures préférentielles. La température semble donc être la variable la plus susceptible d’influencer la distribution des juvéniles. Le substrat pourrait exercer une influence plus locale par la suite.
Ces changements ontogéniques ainsi que la concentration des juvéniles plus âgés en eaux peu profondes pourraient s’expliquer par deux processus non-exclusifs. D’abord, ces changements de distributions pourraient être expliqués par une migration des juvéniles, à partir des stades V et VI, vers les eaux peu profondes et plus chaudes durant la période estivale. Une température plus chaude pourrait accélérer la croissance et améliorer la survie à long terme, tel qu’observé chez d’autres espèces (Brown et al. 1992, Hartnoll et Bryant 2001). Plusieurs éléments supportent cette hypothèse : (i) une préférence pour les températures plus chaudes est observée chez les juvéniles de stade V en laboratoire; (ii) en milieu naturel, les juvéniles de stades V et VI semblent se disperser de façon plus uniforme dans les strates de profondeurs, ce qui peut également suggérer un certain mouvement ; et (iii) les enzymes reliées à l’activité musculaire aérobique ne sont exprimées qu’à partir du stade VI, ce qui pourrait permettre un déplacement plus efficace chez les juvéniles plus âgés (Angers et al.
38 1994). La migration des juvéniles vers les strates profondes entre 120 et 200 m, où la température est également plus chaude, serait probablement désavantageuse puisque la concentration en oxygène est <70% de saturation, plutôt que de 100% dans les 30 premiers mètres de profondeur (Gilbert et al. 1997). En laboratoire, les crabes étaient affectés négativement par le manque d’oxygène autour de 69% de saturation, un taux retrouvé à environ 120 m en milieu naturel. La prédation pourrait également exercer une influence importante sur la distribution des juvéniles. À une certaine taille, les juvéniles pourraient subir un taux de prédation plus élevé, particulièrement dans les eaux profondes, les forçant à trouver un refuge spatial. La morue, un prédateur du crabe des neiges se concentrant entre 90 et 400 m depuis les dernières années (Castonguay et al. 1999), consomme particulièrement les crabes
juvéniles >12 mm (stade V et plus ; K. Briand, MPO, Région de Québec, comm. pers.). Par contre, cette pression de prédation pourrait être atténuée depuis la dernière décennie puisque l’abondance de la morue est restée très basse (Castonguay et al. 1999). La migration des juvéniles plus âgés pourrait finalement être avantageuse afin de minimiser les processus dépendants de la densité comme le cannibalisme. Chez le crabe des neiges, le cannibalisme est un phénomène important, autant entre les juvéniles eux-mêmes (Sainte-Marie et Lafrance sous presse) qu’entre les adultes et les juvéniles (Dutil et al. 1997). En effet, les mâles adultes
>90 mm de largeur de carapace, retrouvés principalement à des profondeurs >80 m, exerceraient une pression de prédation croissante chez les crabes juvéniles de 16 à 30 mm de largeur de carapace (Lovrich et al. 1995).
Une seconde hypothèse pourrait consister en une mortalité différentielle d’une strate de température à l’autre, étant plus élevée en profondeur qu’en surface. La mortalité par la prédation, tel que mentionné plus haut, pourrait en être une cause. En fait, la migration et la mortalité différentielle ne sont pas des hypothèses nécessairement exclusives. La distribution finale des juvéniles pourrait être le résultat d’une migration et également d’une mortalité différentielle exercée sur les individus toujours présents dans les zones à risque. Selon certains auteurs, les animaux mobiles tendent à la fois à maximiser leur taux de croissance (g) et à minimiser le risque de mortalité (p) afin de maximiser leurs bénéfices nets et atteindre une valeur p/g la plus faible possible (Dahlgren et Eggleston 2000). Les deux termes seraient importants lors de la sélection d’un habitat.
39 Cette étude a donc permis de décrire en détail la distribution des juvéniles du crabe des neiges en milieu naturel, particulièrement celle des premiers stades benthiques. Elle a également permis de démontrer l’importance de la température et, en second lieu, celle du substrat dans la sélection de l’habitat chez les juvéniles du crabe des neiges. Il serait intéressant de poursuivre la recherche afin d’avoir une meilleure compréhension des mécanismes impliqués dans les changements ontogéniques observés, tant au niveau de la distribution des juvéniles en milieu naturel qu’au niveau des préférences de température. Ces différences ontogéniques pourraient être la conséquence d’un changement physiologique important se produisant autour des stades IV et V. Des recherches futures devraient également porter sur le rôle de l’oxygène dans la distribution et la sélection de l’habitat chez les juvéniles du crabe des neiges. Finalement, il serait intéressant d’évaluer si les mégalopes du crabe des neiges se déposent préférentiellement sur le même type d’habitat que les juvéniles et ainsi faire suite aux travaux déjà entamés dans cette étude. L’habitat des plus jeunes stades juvéniles peut donc être décrit comme étant un sédiment de boue baigné par une eau entre 0 et 1,9°C de saturation en oxygène >69%. Les premiers stades benthiques se sont révélés très sténothermes et pourraient représenter une période critique dans le cycle vital du crabe des neiges, particulièrement dans un contexte de changement climatique. En effet, un changement de température de quelques dixièmes de degrés pourrait faire changer une situation optimale en situation sub-optimale et ainsi affecter la croissance et d’autres paramètres essentiels à la survie à long terme. Les premiers stades benthiques pourraient donc être extrêmement vulnérables aux changements climatiques et influencer l’abondance des populations adultes de façon importante.