Caractérisation de l’activité de glucurono-conjugaison
des enzymes UDP-glucuronosyltransférases de souris
(Ugt2b) envers des substrats endogènes (androgènes)
et exogènes (bisphénol A).
Mémoire
Sarah Caron
Maîtrise en sciences pharmaceutiques
Maître ès sciences (M.Sc.)
Québec, Canada
© Sarah Caron, 2016
Résumé
La souris est un modèle animal souvent utilisé lors d’études du métabolisme et de la toxicité de molécules, c’est pourquoi nous avons voulu identifier les principaux tissus et enzymes impliquées au niveau de la glucuronidation chez cet animal. Le foie et le rein des souris mâles, ainsi que le foie des souris femelles ont démontré une forte activité de conjugaison des androgènes, tout comme le foie, la vésicule biliaire et les tissus du système digestif pour le BPA. Les Ugt2b1 et 2b5 sont les principales enzymes responsables de la conjugaison des androgènes, tandis que ce sont les Ugt2b1 et Ugt2b34 pour le BPA. La représentativité des mécanismes chez la souris par rapport à l’homme comme modèle dans le contexte de la glucuronidation des androgènes et du BPA sera discuté à la lumière de ces expériences tout au long de ce mémoire.
Abstract
Mice are frequently used as a model in studies of metabolism and molecules toxicities. Therefore, we wanted to identify the tissues and enzymes involved in the glucuronidation process in this animal. The liver and kidney in the case of males and liver only in females were the tissues with the highest conjugation activity for androgens and the liver, gallblader and intestinal tissues for BPA. Ugt2b1 and 2b5 were the principal enzymes responsible for the conjugation of androgens, whereas Ugt2b1 and 2b34 were involved in the conjugation of BPA. The transposition of glucuronidation mecanisms from mice to human will be discussed in the light of these results throughout the text.
Table des matières
Résumé ... III
!
Abstract ... V
!
Table des matières ... VII
!
Liste des tableaux ... IX
!
Liste des figures ... XI
!
Liste des abréviations et des sigles ... XIII
!
Remerciements ... XV
!
Avant-propos ... XVII!
Chapitre 1 ... 1!
Introduction ... 1!
1!
Métabolisme ... 1!
1.1!
Phase I ... 3!
1.2!
Phase II ... 4!
1.3!
Phase III ... 5!
2!
Glucuronidation ... 6!
2.1
!
Rôles, effets et distribution tissulaire ... 8!
2.2
!
Réaction de glucuronidation ... 10!
2.3
!
Structure des UGT et localisation cellulaire ... 11!
2.4
!
Les familles d’enzymes ... 12!
2.4.1
!
UGT1A ... 13!
2.4.2
!
UGT2 ... 16!
2.4.2.1
!
UGT2A ... 17!
2.4.2.2
!
UGT2B ... 17!
2.4.3
!
UGT2B15 ... 20!
2.4.3.1
!
Distribution tissulaire et spécificité enzymatique ... 20!
2.4.3.2
!
Polymorphismes ... 21!
3
!
Hormones stéroïdiennes ... 22!
3.1
!
Classification ... 22!
3.2
!
Minéralocorticoïdes et glucocorticorticoïdes ... 23!
3.3
!
Androgènes ... 24!
3.3.1
!
Fonctions des androgènes ... 25!
3.3.2
!
Stéroïdogenèse ... 26!
3.3.2.1
!
Tissus classiques ... 26!
3.3.2.1.1
!
Synthèse au niveau des glandes surrénales ... 27!
3.3.2.1.2
!
Synthèse au niveau des gonades ... 28!
3.3.2.2
!
Tissus périphériques ... 29!
3.3.2.3
!
Régulation de la stéroïdogenèse ... 30!
3.3.3
!
Récepteur aux androgènes ... 30!
3.3.4
!
Maladies associées aux androgènes ... 31!
3.3.5
!
Métabolisme des androgènes ... 32!
3.3.5.1
!
UGT2B15, 2B17 et la prostate ... 32!
3.3.5.3
!
UGT2B15 et traitement du cancer de la prostate ... 35!
4
!
Bisphénol A ... 36!
4.1
!
Perturbateurs endocriniens ... 36!
4.2
!
Formation, synthèse et utilisation ... 38!
4.3
!
Mesure chez l’humain ... 40!
4.4
!
Modes d’action ... 42!
4.4.1
!
Récepteur aux œstrogènes ... 43!
4.4.2
!
Récepteur aux androgènes ... 43!
4.4.3
!
Récepteur à l’hormone thyroïdienne ... 43!
4.4.4
!
Récepteur aux glucocorticoïdes ... 44!
4.5
!
Effets rapportés ... 44!
4.5.1
!
Développement ... 45!
4.5.2
!
Diabète ... 46!
4.5.3
!
Obésité ... 46!
4.5.4
!
Effets chez les femelles ... 47!
4.5.5
!
Effets chez les mâles ... 48!
4.5.5.1
!
Prostate ... 48!
4.6
!
Métabolisme ... 49!
5
!
Modèles animaux ... 50!
5.1
!
Étude de la glucuronidation ... 50!
5.1.1
!
Comparaison entre le singe, la souris et l’homme ... 50!
5.1.2
!
Singe ... 52!
5.1.3
!
Souris ... 53!
5.1.3.1
!
Ugt murines ... 53!
5.1.3.2
!
Distribution tissulaire des UGT2 chez la souris ... 54!
5.1.3.3
!
Physiologie des androgènes ... 55!
5.1.3.3.1
!
Glucuronidation des androgènes ... 56!
5.1.4
!
Le BPA : élimination et pharmacocinétique ... 57!
Chapitre 2 ... 59
!
Hypothèses et objectifs du projet ... 59
!
Chapitre 3 ... 61
!
Androgen glucuronidation in mice: when, where and how. ... 61
!
Résumé ... 61
!
Chapitre 4 ... 95
!
The gallbaldder, an unexpected contributor for Bisphenol A glucuronidation in mice: a reaction catalyzed by the UDP-glucuronosyltransferase (Ugt2b)1 and Ugt2b34 enzymes. ... 95
!
Résumé ... 95
!
Chapitre 5 ... 131
!
Discussion ... 131
!
1.
!
Conclusions et analyses critiques ... 131!
1.1 Analyses critiques ... 133
!
2.
!
Analyses complémentaires ... 135!
3.
!
Perspectives et applications pratiques ... 138!
Liste des tableaux
Liste des figures
Figure 1 : Les trois phases du métabolisme, de leurs enzymes et de leurs impacts. ... 2
!
Figure 2 : Principales enzymes impliquées dans les phase I et II de la détoxification des composés endogènes et exogènes chez l’humain. ... 4
!
Figure 3 : Représentation des différents transporteurs du métabolisme ainsi que leurs substrats respectifs. .... 6
!
Figure 4: Réaction de glucuronidation catalysée par les UGT. ... 8
!
Figure 5 : Répartition consensuelle de l’expression hépatique relative des UGT. ... 9
!
Figure 6 : Représentation de l’importance relative des UGT dans le métabolisme des drogues. ... 9
!
Figure 7 : Plan de la réaction de glucuronidation.. ... 11
!
Figure 8 : Domaines fonctionnels de la séquence primaire d’une enzyme UGT et position membranaire. ... 12
!
Figure 9 : Arbre phylogénétique des protéines d’UGT. ... 13
!
Figure 10 : Arbre phylogénétique des deux sous-familles principales d’UGT ainsi que leur organisation chromosomique. ... 14
!
Figure 11 : Différences structurelles des isoformes courts et longs en fonction de l’épissage alternatif du gène UGT1 avec la présence du nouvel exon 5b. ... 15
!
Figure 12 : Représentation schématique du locus de l’UGT2 humain. ... 17
!
Figure 13 : Spécificité de l’UGT2B7, 2B15 et 2B17 pour la DHT, l’ADT et le 3!-diol. ... 19
!
Figure 14 : Structure du noyau des stéroïdes. ... 22
!
Figure 15 : Coupe transversale et vue microscopique de la glande surrénale. ... 23
!
Figure 16 : Voie de synthèse de l’aldostérone et du cortisol à partir du cholestérol dans les zones gloméruleuses et fasciculées de la surrénale. ... 24
!
Figure 17 : Schéma comparatif des mécanismes de l’endocrinologie. ... 26
!
Figure 18 : Représentation schématique des voies de stéroïdogenèse de la glande surrénale et intracrines. 27
!
Figure 19 : Régulation de la stéroïdogenèse par l’axe hypothalamo-hypophysaire. ... 30!
Figure 20 : Organisation structurelle générale des récepteurs nucléaires. ... 31
!
Figure 21 : Structure de la molécule de BPA, du DES et de l’estradiol. ... 38
!
Figure 22 : Consommation mondiale de BPA en 2013. ... 40
!
Figure 23 : Concentrations d’androgène-G déterminées dans le plasma de 20 hommes, 4 singes, chien, boeuf, porc rat et souris adultes mâles. ... 51
!
Figure 24 : Niveau du métabolisme par la glucuronidation de différents substrats (n = 12) chez différentes espèces par rapport à l’homme. ... 52
!
Figure 25 : Représentation schématique de la famille Ugt2 murine. ... 54
!
Figure 26 : Distribution tissulaire des enzymes murines Ugt2b dans différents tissus de souris mâle et femelle. ... 55
!
Figure 27 : Représentation de la voie de synthèse des stéroïdes à partir du cholestérol dans les tissus endocrinien. ... 56
!
Figure 28 : Comparaison des différences de glucuronidation des androgènes chez l’homme par rapport à la souris. ... 57
!
Liste des abréviations et des sigles
3!-diol Androstane-3!,17"-diol4-dione Androsténédione ABC ATP-binding cassette ACTH Adrénocortocotropique
ADT Androstérone
ADTh Thérapie de privation d’androgène AR Récepteur à l'androgène
ARE Élément de réponse au récepteur aux androgènes
BPA Bisphénol A
COMT Catéchol-O-méthyltransférase
CYP Cytochrome P450
DHEA Déhydroépiandrostérone DHT Dihydrotestostérone ER Récepteur aux œstrogènes FSH Hormone folliculo-stimulante
GPR30 Récepteur membranaire couplé à a protéine G GR Récepteur aux glucocorticoïdes
GST Glutathione-S-transférase IMC Indice de masse corporelle LH Homone lutéinisante NAT N-acétyltransférase
PBPK Pharmaco- / toxicocinétique basée sur la physiobiologie Pc Poids corporel
Pca Cancer de la prostate
PPAR Récepteur activé par les proliférateurs de peroxysomes PSA Antigène prostatique spécifique
RE Réticulum endoplasmique RN Récepteur nucléaire SLC Solute Carrier SULT Sulfotransférase
TDI Dose quotidienne tolérable
TR Récepteur à l'hormone thyroïdienne
Remerciements
Je dois tout d’abord commencer par remercier mon directeur de recherche le Docteur Olivier Barbier pour son soutien et sa patience tout au long de ma maîtrise. J’ai acquis une formation de qualité grâce à son excellence en science ainsi que son dévouement pour ses étudiants. Ce n’est donc pas seulement un diplôme que j’obtiens avec la réalisation de cette maîtrise, mais aussi des connaissances de la méthodologie scientifique que je n’aurais pu acquérir sans l’aide d’Olivier. Mon co-directeur, le Docteur Alain Bélanger, a eu un rôle important durant ma maîtrise par le bagage de connaissances et de matériels dont il est l’auteur. Je me dois aussi de remercier la Docteure Thérèse Di Paolo pour son soutien et son aide qui m’ont permis de terminer mon mémoire malgré les nombreux obstacles rencontrés.
Je tiens aussi à dire un gros merci aux professionnels de recherche de l’équipe Barbier, Mélanie Verreault et Jocelyn Trottier, qui m’ont formée d’abord durant mon stage et m’ont aidée tout au long de ma maîtrise autant en matière d’expériences de laboratoire, de discussion sur mon projet ou en m’aidant dans des expériences. Ils sont tous les deux patients, à leur façon, et ont pris le temps de m’expliquer des concepts, de me les répéter et de répondre à mes questions jusqu’à ce qu’ils étaient certains que j’avais bien compris. Ils sont des outils indispensables au laboratoire et j’ai été heureuse de vous côtoyer pendant un peu plus de 2 ans. Je voudrais aussi remercier Patrick Caron pour sa participation au dosage de mes nombreux essais enzymatiques.
Les étudiants de l’équipe ont permis de rendre les heures passées au laboratoire plus agréables et je tiens à les remercier d’avoir enduré mes humeurs. Je pense ici à Valérie, Louis, Anna, Cyril, mais aussi à Martin et Laurent, aux stagiaires Laurence, Anne-Sophie et Zoé et à Marine qui est comme dans l’équipe. Val, je suis contente de t’avoir eu comme collègue, qui aurait cru que l’on ferait notre maîtrise ensemble lorsque l’on s’est croisée à notre premier cours du bacc? Martin, un merci tout spécial pour le rôle que tu as jouer à la toute fin, merci pour tes conseils et ton soutien. J’ai aussi eu la chance de rencontrer plusieurs autres étudiants et techniciens extraordinaires des différentes équipes de l’étage (Équipe CG, FD, SG, plateforme de séquençage). Il y en a trop pour tous les nommer et j’aurais peur d’en oublier parmi toutes ses personnes,
mais j’ai une mention spéciale à donner à Karine, Simon, Frédéric et Amélie de l’équipe de Durocher. Je dois aussi mentionner Marianne Roberge pour son soutien. Sachez que ça l’a été un plaisir de travailler, discuter ou dîner avec chacun de vous et j’espère que nous allons nous revoir un jour dans le monde de la science.
Je dois maintenant remercier LA personne qui a été la plus présente tout au long de ma maîtrise et même durant mon baccalauréat et qui m’a soutenue et endurée depuis le début (ou presque). Gaby, une chance que je t’ai, merci de ton aide, de ta patience et de tes encouragements. Merci pour toutes les fois où tu m’as écoutée me plaindre pour me répondre avec des encouragements et me calmer. J’ai une chance incroyable de t’avoir et j’ai hâte d’enfin commencer ce nouveau chapitre de nos vies avec toi.
Gaby n’a pas été le seul à avoir à endurer mes humeurs durant mes études, alors je dois remercier sincèrement ma famille. Mes parents qui m’ont permis de me rendre là en m’encourageant depuis le début et en me soutenant dans les moments les plus difficiles. Merci à vous et à mes grands-parents, Pierrette et Claude, de m’avoir donné le bagage nécessaire pour accomplir mes études et de m’avoir inculqué l’envie d’apprendre et de comprendre de nouvelles choses. Pierrette, tu es une femme hors du commun et je crois que je suis encore plus fière de t’avoir comme grand-mère que toi tu l’es d’être la mienne.
Finalement, je veux remercier les gars et ma gang de filles. Merci les gars, Mathieu, Jeff, Doom, Oli Riverin et Dan. Merci de m’avoir fait passer du temps agréable et de m’avoir changé les idées tout au long de mes études. Tout particulièrement, je dois remercier mon ami Olivier Desjardins pour ses conseils et son soutien, on verra ce que la suite nous apportera. Les filles, Chri, Jo et S-J, vous m’avez soutenue durant les moments difficiles et de m’avez permis de tenir le coup malgré les difficultés. Je vous connais depuis si longtemps, 20 ans pour certaines et au moins 15 ans pour les autres, merci d’avoir été là pour moi. J’espère avoir plus de temps maintenant pour vous voir, faire des soupers, faire la fête et voir m’amuser avec le petit Alexis. Donc un gros merci à vous les filles, Chri, Jo et S-J, vous êtes incroyables et je vous adore.
Avant-propos
Ce mémoire est divisé en quatre sections principales, il y a tout d’abord l’introduction générale, qui contient des informations sur l’ensemble des aspects de mon projet de maîtrise. Ensuite, la deuxième section est composée des hypothèses et objectifs de mon projet. La troisième section contient les deux manuscrits provenant des travaux que j’ai effectués et la dernière section, étant la discussion ainsi que la conclusion générale, fait la synthèse et l’analyse de l’ensemble des résultats obtenus dans le cadre des travaux des manuscrits. Finalement, ce mémoire se termine par la liste des références de l’introduction et de la discussion générale.
Ainsi, le premier manuscrit scientifique se trouve dans le troisième chapitre, il est écrit en anglais et sera soumis au courant de l’année 2015 dans « Biochemical Journal ». Ce manuscrit porte sur l’activité des enzymes Ugt2b de souris pour des substrats endogènes (androgènes). Les résultats sont issus du clonage et de la caractérisation enzymatique de sept Ugt2b de souris. En premier lieu, Olivier Larouche, un ancien étudiant à la maîtrise du laboratoire du docteur Alain Bélanger, a travaillé au clonage et à la caractérisation enzymatique de cinq Ugt2b (Ugt2b1, 2b5, 2b34, 2b35 et 2b36) et c’est Laurent Grosse, un ancien étudiant au doctorat du docteur Barbier qui s’est chargé des enzymes Ugt2b restantes (Ugt2b37 et Ugt2b38). Les dosages sur HPLC-MS/MS ont été effectués par les professionnels de recherche Patrick Caron et Jocelyn Trottier. Pour ma part, j’ai contribué aux essais enzymatiques de caractérisation de l’activité des enzymes pour les différents substrats ainsi que pour les cinétiques enzymatiques qui ont permis d’établir les paramètres pharmacocinétiques des réactions. Les analyses des réactions enzymatiques ont été faites par moi-même ainsi que M. Larouche et Grosse pour nos expériences respectives. Laurent Grosse et Olivier Larouche sont co-premier auteurs de cet article, mais pour ma contribution importante dans la partie manipulation des expériences du manuscrit je suis en seconde position dans la liste des auteurs.
Puis, le quatrième chapitre contient un deuxième manuscrit en anglais qui sera aussi soumis au courant de l’année 2015, mais cette fois-ci dans le journal « Drug Metabolism and Disposition ». En ce qui concerne ce manuscrit portant sur l’analyse de l’activité des Ugt2b pour le Bisphénol A, j’ai effectué les essais ainsi que les
cinétiques enzymatiques à partir des enzymes Ugt2b précédemment clonées par Olivier Larouche et Laurent Grosse. Jocelyn Trottier et Partick Caron ont effectué les dosages en HPLC-MS/MS et j’ai effectué les analyses des expériences, c’est pourquoi je suis l’auteure principale.
Les deux manuscrits débutent par leur résumé et sont ensuite divisés en plusieurs sections telles l’introduction, le matériel et méthodes, les résultats, la discussion, la bibliographie, les remerciements, la légende des figures, les tableaux et finalement les figures.
Chapitre 1
Introduction
1 Métabolisme
L’organisme est exposé à une grande variété de composés toxiques, généralement hydrophobes, d’origine exogène (xénobiotique) ou endogène (endobiotique) qu’il doit éliminer. Il est donc important de bien comprendre les mécanismes du métabolisme qui permet le maintien du bon fonctionnement de l’organisme. En règle générale, lorsqu’une substance exogène comme un polluant ou une drogue pénètre dans le corps, elle est d’abord absorbée pour ensuite y être distribuée, puis métabolisée et finir excrétée. Ces processus déterminent la pharmacocinétique des substances, c’est-à-dire la biodisponibilité et la quantité de drogue qui sera retrouvée dans les tissus. Puisque la majorité de ces substances pénétrant dans l’organisme passent par la voie orale et que l’absorption est faite dans le tractus gastro-intestinal, les enzymes du foie et de l’intestin ont un impact tôt dans le processus d’absorption et ce avant même que les substances aient atteint la circulation systémique [1]. Effectivement, en plus du foie qui est reconnu comme le principal organe responsable de la détoxification de l’organisme et de l’intestin, bien d’autres tissus comme les reins, les poumons, la peau et la muqueuse nasale jouent un rôle dans ce processus [2]. Les enzymes du métabolisme convertissent donc les substances toxiques (xéno- et endobiotiques) en métabolites (actifs, inactifs ou avec une activité altérée) dans le but de diminuer leur concentration systémique. Ce processus est connu comme l’effet du premier passage (« first-pass effect ») [1].
Afin de saisir les mécanismes de ce métabolisme, il faut aussi connaître le fonctionnement des membranes cellulaires qui sont en fait des barrières hydrophobes perméables contrôlant l’accès à l’environnement interne des cellules. Les molécules polaires, et donc hydrophiles, ne peuvent ainsi pas diffuser à travers ces membranes et le passage à travers la membrane est effectué par le biais de protéines de transport qui sélectionnent spécifiquement leurs substrats. C’est pourquoi, suite au métabolisme des molécules par les enzymes du métabolisme (phase I et II), les protéines de transport transmembranaires
(phase III) sont nécessaires puisqu’elles permettent le passage des molécules vers l’extérieur de la cellule. En effet, à la suite de leur transformation par les enzymes de phase I et II, il est possible que les molécules soient devenues trop hydrophiles pour ressortir de la cellule passivement. Ensemble, les enzymes du métabolisme et les protéines de transport permettent donc la terminaison de l’effet des molécules ainsi que l’élimination de celles-ci par la bile et l’urine [3]. Dans ce mémoire, l’utilisation de la classification en phase de Williams des enzymes du métabolisme est préférée, bien qu’elle soit moins adaptée aux connaissances actuelles, pour faciliter la compréhension des différentes classes d’enzymes [4].
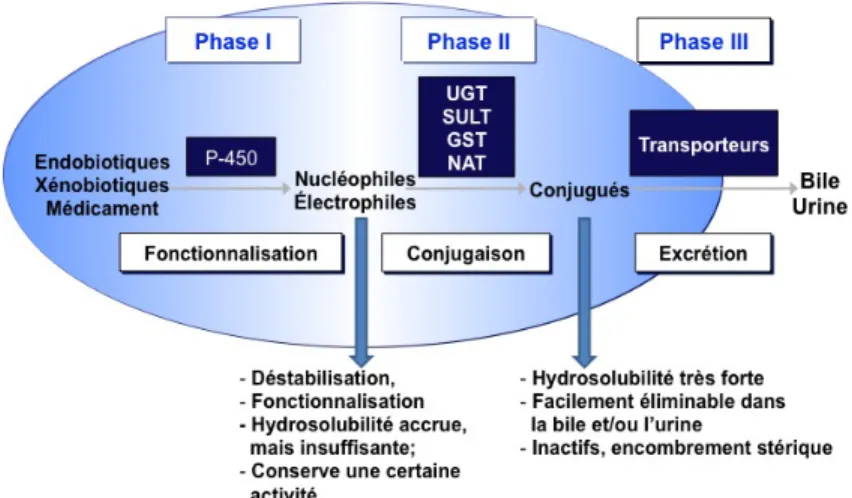
Figure 1 : Les trois phases du métabolisme, de leurs enzymes et de leurs impacts.
Ainsi, les enzymes du métabolisme sont séparées en phases et interviennent d’une manière différente dans le processus de biotransformation des molécules exogènes (médicaments, drogues, polluants environnementaux, etc.) tout comme des molécules endogènes (hormones, acides biliaires, acides gras, etc.) (figure 1). Tout d’abord, l’appellation enzyme de phase I et enzyme de phase II ne désigne pas nécessairement un ordre dans la réaction puisqu’il est possible pour les molécules d’être excrétées après la transformation par les enzymes de phase I, tout comme il n’est pas obligatoire pour les molécules d’être préalablement transformées par les enzymes de phase I pour être prises en charge par les enzymes de phase II [1]. Donc, les enzymes de la phase I procèdent généralement en modifiant un groupement fonctionnel du
substrat par des réactions de fonctionnalisation comme l’oxydation, la réduction ou l’hydrolyse, ce qui augmente le caractère hydrophile des molécules [2]. Les principales enzymes de ce groupe sont les cytochromes P450 (CYP). Les enzymes de phase II, quant à elles, procèdent à la conjugaison des molécules (figure 2). Finalement, la phase III consiste au transport transmembranaire des molécules dans le but de les exporter à l’extérieur de la cellule vers la bile ou l’urine.
1.1 Phase I
Les enzymes de phase I sont responsables du métabolisme de plus de 75% des composés exogènes [1, 5, 6] et ce sont principalement les CYP (cytochrome P450) qui en sont responsables [1, 6-8]. En plus des CYP, ce groupe est composé de diverses enzymes comme des amines oxydases, des peroxydases et des déshydrogénases (figure 2) [5, 9]. Ces enzymes facilitent l’élimination de molécules telles que certaines drogues, des polluants, des produits chimiques, des acides gras, des acides biliaires, des dérivés de la vitamine D3, des stéroïdes, etc. [10] en exposant ou ajoutant un des groupements fonctionnels (-OH, -NH2,
-SH, -COOH) [1, 6, 11].
Les CYP sont un sujet d’étude majeure depuis près de 60 ans [12] et sont les principales enzymes étudiées parmi les enzymes de phase I en raison de leur diversité et de leur implication dans la biotransformation d’une multitude de substrats. Ces enzymes sont fonctionnellement versatiles et font partie de la famille d’enzymes catalytiques la plus diversifiée en biochimie [11], qui est en effet composée de plus de 15 000 gènes connus dans le règne animal [13]. Les CYP agissent en ajoutant un groupement fonctionnel réactif sur un composé hydrophobe à l’aide de réaction d’oxydation, de réduction ou d’hydrolyse [1, 7, 8].
Figure 2 : Principales enzymes impliquées dans les phase I et II de la détoxification des composés endogènes et exogènes chez l’humain [5].
Le pourcentage de la contribution de chaque enzyme de phase I et II dans le métabolisme des drogues est estimé par la taille relative de chaque section de la charte correspondante. ADH, alcool déshydrogénase; ALDH, aldéhyde déshydrogénase; CYP, cytochrome P450; DPD, dihydropyrimidine déshydrogénase; NQO1, NADPH:quinone oxidoréductase ou DT diaphorase; COMT, catéchol O-méthyltransférase; GST, glutathione S-transférase; HMT, histamine méthyltransférase; NAT, N-acétyltransférase; ST, sulfotransférases; TPMT, thiopurine méthyltransférase; UGT, uridine diphosphate glucuronosyltransférases.
1.2 Phase II
Les enzymes du métabolisme de phase II jouent un rôle important pour permettre une diminution de l’activité et favoriser l’élimination de molécules endogènes et exogènes [9] en affectant généralement les propriétés chimiques du substrat par la conjugaison d’un groupement accepteur comme les carboxyl (-COOH), hydroxyl (-OH), amines (primaire, secondaire) ou thiol (-SH) avec un groupement qui est spécifique à la classe de l’enzyme. Ces classes d’enzymes sont les sulfotransférases (SULT), les N-acétyltransférases (NAT), les glutathione-S-transférases (GST), les catéchol-O-méthyltransférases (COMT) [5, 8] et, celles qui seront traitées davantage dans ce mémoire, les uridine diphosphate glucuronosyltransférases (UGT) (figure 2). La conjugaison par les enzymes de phase II est donc respectivement faite avec l’ajout d’un sulfate, d’un acétyle, d’un glutathion, d’un méthyle ou d’un glucuronide. En ce qui concerne les réactions de phase II, il faut savoir
que ces conjugaison n’ont pas toutes les mêmes rôles physiologiques. Dans le cas de la glucurono-conjugaison (« glucuronidation »), l’ajout du groupement va créer un encombrement stérique de la structure du substrat, ce qui va généralement le rendre biologiquement moins actif [4] puisque la capacité du substrat à se lier à des facteurs de transcription est affectée [14, 15]. Cette réaction, étant au centre de mes travaux de recherche, sera détaillée plus spécifiquement à la section suivante. D’abord, la glucuronidation et la sulfatation ont pour but de faciliter l’élimination des molécules en augmentant leur hydrophilicité. La glucuronidation est considérée comme la voie majeure d’élimination de plusieurs composés notamment parce qu’elle est généralement irréversible (détaillée à la section 2.1) et concerne beaucoup plus de métabolites que la sulfatation [16] comme c’est le cas au niveau de certaines hormones stéroïdiennes qui sont inactivées par la sulfatation et réactivées par la désulfatation [17]. Ensuite, les réactions d’acétylation et de méthylation n’affectent pas la polarité du substrat et vont souvent nécessiter une seconde réaction de conjugaison [1, 8]. Finalement, la conjugaison à un gluthation joue plutôt un rôle au niveau du potentiel oxydo-réductif des membranes qu’une vraie conjugaison [5, 18]. Dans le cas de polymorphismes ou d’activités réduites des enzymes du métabolisme, cela peut mener à des effets toxiques de molécules endogènes ou de médicaments [9, 19] ainsi qu’être en lien avec le développement de plusieurs types de cancer [8, 9].
1.3 Phase III
Finalement, la phase III du métabolisme des drogues est composée de protéines de transport qui sont nécessaires à l’excrétion des molécules qui, après leur conjugaison par les enzymes de phase II, ont acquis un caractère trop hydrophile pour permettre leur diffusion passive à travers la double couche lipidique de la membrane [20, 21]. Ces protéines de transport facilitant le passage vers l’extérieur de la cellule sont des protéines transmembranaires qui peuvent être divisées en deux familles, les transporteurs ABC (« ATP-binding cassette ») et les SLC (« Solute Carrier ») (figure 3) [8]. La première étant la plus grosse famille de protéines membranaires [22], ceux-ci utilisent l’énergie de l’hydrolyse de l’ATP afin de permettre le transport unidirectionnel de molécules hydrophiles à travers la membrane [8]. La famille des SLC, quant à elle, inclut plus de 300 gènes de transporteurs différents [8, 23, 24] qui permettent le transport d’une variété de solutés à
travers la membrane grâce à divers mécanismes couplés à l’énergie [25]. Ces transporteurs jouent un rôle crucial notamment dans l’absorption intestinale, l’excrétion biliaire et rénale et dans la pénétration au niveau des tissus et des cellules d’une variété de drogues (figure 3) [8, 26].
Figure 3 : Représentation des différents transporteurs du métabolisme ainsi que leurs substrats respectifs [26].
Ainsi, ces phases du métabolisme des drogues permettent ensemble l’élimination des xénobiotiques et l’équilibre cellulaire des substances endogènes par différents processus de biotransformation. Toutefois, dans la prochaine section ainsi que pour le reste du mémoire, je me concentrerai principalement sur le métabolisme par la glucuronidation puisque cela a été la principale réaction étudiée au cours de ce projet de maîtrise.
2 Glucuronidation
Les 19 enzymes UDP-glucuronosyltransférase (UGT) qui catalysent la réaction de glucuronidation chez l’homme font donc partie des enzymes de phase II [27]. Ce sont celles, parmi les enzymes de
conjugaison, qui ont le plus grand impact sur le métabolisme, autant au niveau de la détoxification que de l’excrétion dans l’urine et la bile [28]. La glucuronidation est d’ailleurs responsable de la conjugaison d’environ 35% des molécules exogènes auxquelles l’organisme est exposé (figure 2) [5, 29] et le nombre de molécules prises en charge par les UGT est presque infini [30].
Parmi les molécules structurellement très variées [30] métabolisées par les UGT, on retrouve des xénobiotiques, comme de nombreuses drogues [19, 29], des polluants environnementaux ou des carcinogènes [31] ainsi que des de nombreuses molécules endogènes comme les hormones (stéroïdiennes, thyroïdiennes, minéralocorticoïdes et glucocorticoïdes), les constituants de la bile (bilirubine, acides biliaires), les rétinoïdes (qui sont des dérivés de la vitamine A) et les dérives des acides gras [16, 31]. Mis à part le foie, les tissus les plus importants pour leur capacité de glucuronidation sont les reins ainsi que les tissus du tractus gastro-intestinal (estomac, intestin) [2, 6, 31-33]. De plus certaines enzymes UGT sont aussi exprimées à différents niveaux dans une variété de tissus comme les poumons, la peau, les ovaires, les testicules, les glandes mammaires, la prostate, etc. [2, 31]
La glucuronidation existe dans une certaine mesure chez toutes les espèces de mammifères, quoiqu’il y ait des différences au niveau des substrats conjugués et des niveaux d’activité des enzymes entre les espèces. Cet aspect sera développé à la section 5 de ce chapitre.
2.1 Rôles, effets et distribution tissulaire
Les UGT ont donc un rôle essentiel dans la terminaison d’effets biologiques et l’élimination d’une myriade de molécules xéno- et endobiotiques [31] en catalysant leur conjugaison à un groupement glucuronosyl hautement polaire [28, 30] qui provient du cofacteur, l’acide uridine 5’-disphophoglucuronide (UDPGA) (figure 4) [34]. La fixation du groupement glucuronide à l’aglycone augmente non seulement l’hydrophilicité [34], mais modifie aussi sa conformation ce qui peut perturber son activité biologique, s’il en possède une, comme cela a déjà été mentionné précédemment.
Figure 4: Réaction de glucuronidation catalysée par les UGT.
La réaction enzymatique implique deux molécules : un co-facteur, l’acide UDP-glucuronique (UDPGA) et un substrat, comme par exemple, la dihydrotestostérone (DHT), adapté de [35].
Le foie est le tissu exprimant la plus grande variété et quantité d’enzymes UGT conséquemment, mis à part les UGT1A5, 1A7, 1A8, 1A10 et 2A1, on retrouve tous les UGT1 et UGT2 dans ce tissu (figure 5) [31, 36]. En effet, les UGT1A7, 1A8 et 1A10 sont uniquement retrouvées au niveau du tractus gastro-intestinal [19, 29, 32]. De plus, en ne tenant pas compte de la variabilité interindividuelle, les UGT2B sont généralement plus abondants que les UGT1A [31]. Parmi les UGT2B, les UGT2B7, 2B15 et 2B17 sont notamment très
importants pour le métabolisme hépatique des drogues et des androgènes [19]. Au niveau du rein, exprimant moins d’isoformes par rapport au foie, on retrouve quand même les UGT1A6, 1A9 et 2B7 [32].
Figure 5 : Répartition consensuelle de l’expression hépatique relative des UGT [31].
Les enzymes les plus importantes pour le métabolisme des drogues semblent être les UGT1A1, 1A3, 1A4, 1A6, 1A9, 2B7 et 2B15 (figure 6) [6, 19], la spécificité de celles-ci sera décrite plus en détail dans les prochains paragraphes.
Toutefois, la glucuronidation peut être renversée par l’action d’une enzyme fortement exprimée au niveau intestinal par la flore bactérienne, la "-glucuronidase, qui est capable de scinder le lien unissant la molécule au groupement glucuronide [27]. Ceci permet donc la réabsorption de la molécule au niveau de l’épithélium intestinal [34], une étape importante du cycle entérohépatique [27, 31, 36]. Certains composés absorbés par la voie digestive et inactivés par la glucuronidation au niveau du foie seront sécrétés dans l’intestin par la voie biliaire et ensuite excrétés dans les fèces. Or, la déconjugaison par la "-glucuronidase permet la réabsorption de ces composés [27, 34, 36]. Lorsqu’il est question de polluants ou de médicaments ayant des effets indésirables à trop haute dose, cette étape peut avoir des conséquences importantes.
Dans de rares circonstances, il est possible que la conjugaison ait plutôt un rôle d’activation, comme c’est d’ailleurs le cas pour la morphine, qui à la suite de la conjugaison la molécule acquiert une activité plus importante que le substrat parent [37]. En effet, l’UGT2B7 peut former la morphine-3- ainsi que la morphine-6-glucuronide [38], cette dernière a une activité analgésique beaucoup plus importante que la morphine non-conjuguée [39-41] et qui peut en plus traverser la barrière hématoencéphalique [40].
2.2 Réaction de glucuronidation
La glucuronidation consiste en une attaque nucléophile d’un hétéroatome (O, N, S) de l’aglycone sur le carbone C1 de l’acide !–D-glucuronique [6]. La réaction conduit, selon un mécanisme de substitution nucléophile de type SN2, à la formation d’un "-D-glucuronide avec inversion de configuration ainsi qu’à la libération de l’UDP (figure 7) [34].
Figure 7 : Plan de la réaction de glucuronidation [31].
2.3 Structure des UGT et localisation cellulaire
Au niveau cellulaire, les UGT sont des glycoprotéines transmembranaires du réticulum endoplasmique (RE) et leur site actif fait face à la lumière de celui-ci [42]. Les UGT sont synthétisées comme des précurseurs d’environ 530 acides aminés répartis en deux parties, les domaines carboxyle-terminal (C-terminal) et amine-terminal (N-(C-terminal) [31, 37]. Le domaine C-terminal, qui est hautement conservé, permet l’ancrage à la face interne du RE [21] et est responsable de la liaison au cofacteur UDPGA (figure 8) [31]. Le domaine N-terminal est, quant à lui, moins conservé, confère la spécificité de substrat des enzymes et contient un peptide signal qui permet la liaison de la chaîne polypeptidique au RE [37, 42] (figure 8). Ce peptide signal sera ensuite clivé lors de l’insertion de l’enzyme à la membrane du RE [31].
Des isoformes des UGT1A plus courts ont été découverts, ceux-ci ne possèdent pas exactement la même portion du domaine C-terminal [43] et seront détaillés à la section 2.4.1.
Figure 8 : Domaines fonctionnels de la séquence primaire d’une enzyme UGT et position membranaire [44].
2.4 Les familles d’enzymes
Les UGT sont classées en 4 familles principales, les UGT1, UGT2, UGT3 et UGT8 (figure 9) [36, 45]. Dans le contexte de ce mémoire, je me concentrerai sur la description des familles des UGT1 et UGT2 puisque ce sont actuellement les mieux documentées et les plus pertinentes pour les travaux de ce projet de maîtrise [46]. Les sous-familles de ces dernières, c’est-à-dire les UGT1A, UGT2A et UGT2B, sont celles qui seront plus particulièrement traitées en raison de leur importance en terme du métabolisme des xéno- et endobiotiques [19, 30, 31, 36, 47]. En effet, les UGT3 et les UGT8 ne fonctionnent pas de la même façon que les autres enzymes de la famille [46] puisqu’elles n’utilisent pas le cofacteur UDPGA comme donneur de sucre [48]. Le donneur de sucre de l’UGT3 est encore inconnu et l’UGT8 utilise plutôt l’UDP galactose [45].
Figure 9 : Arbre phylogénétique des protéines d’UGT [31].
Jusqu’à maintenant, 117 gènes de la famille des UGT ont été identifiés chez les mammifères [45], dont 19 sont des protéines fonctionnelles avec une activité enzymatique, chez l’Homme parmi les UGT1 et UGT2 [49]. L’homologie entre les différentes familles est d’au moins 41% tandis qu’entre les enzymes d’une même famille l’homologie est supérieure à 59% [50].
2.4.1 UGT1A
Les enzymes de la sous-famille des UGT1A proviennent d’un locus complexe situé sur le chromosome 2q37 (figure 10) [30]. Le locus des UGT1A est composé de 13 premiers exons différents qui subissent un épissage alternatif avec les exons 2 à 5 [30]. Ceci résulte en 13 transcrits dont 9 donneront des protéines fonctionnelles (UGT1A1, 1A3, 1A4, 1A5, 1A6, 1A7, 1A8, 1A9 ET 1A10) et 4 des pseudogènes (UGT1A2p, UGT1A11p, UGT1A12p et UGT1A13p) puisque leur exon 1 contient des mutations non-sens, provoquant l’arrêt de la traduction [27, 30].
Figure 10 : Arbre phylogénétique des deux sous-familles principales d’UGT ainsi que leur organisation chromosomique [30].
Toutefois, il y a quelques années, un deuxième exon 5 (exon 5b) a été identifié en amont de l’exon 5 classique (figure 11) [30, 43, 51]. Cela double donc le nombre d’isoformes encodés par le mécanisme d’épissage alternatif et produit les isoformes d’UGT1A (i2) [52] qui sont plus courts (45 kDa par rapport à 55 kDa) que les UGT1A déjà décrites (i1) (figure 11). Ces nouvelles protéines ne possèdent pas d’activité de transférase, et malgré l’absence de leur domaine transmembranaire sont quand même situées au niveau du RE [51-53]. De plus, les données actuelles indiquent qu’elles sont exprimées conjointement aux isoformes classiques et montrent une activité de répression sur la glucuronidation en interagissant avec celles-ci par la formation des complexes enzymatiques inactifs (i1-i2) [54]. Toutefois, la nature de cette interaction reste encore à être élucidée [54].
Figure 11 : Différences structurelles des isoformes courts et longs en fonction de l’épissage alternatif du gène UGT1 avec la présence du nouvel exon 5b [43].
Représentation schématique des différents domaines composant l’isoforme active des UGT1A_i1 (à droite) comparativement à son modulateur négatif l’UGT1A_i2 (à gauche).
Les UGT1A sont responsables du métabolisme d’environ 55% des drogues connues éliminées via la glucuronidation [27]. Ces dernières sont considérées comme les constituants de la première ligne de défense pour protéger l’organisme contre plusieurs substances synthétiques et polluantes pénétrant par cette voie [29]. Les UGT1A catalysent la glucuronidation d’une vaste gamme de molécules endogènes et exogènes comme la bilirubine, le sérotonine, les analgésiques, les androgènes, les œstrogènes, des drogues anti-cancer (irinotécan et flavopiridol), des agents carcinogènes comme les hydrocarbones aromatiques polycycliques ainsi que le 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanol (NNAL) qui proviennent du tabac [30]. Aussi, les UGT1A peuvent être divisés en deux groupes en fonction de leur similarité de séquences et de fonctions, tout
d’abord les enzymes catalysant le métabolisme de la bilirubine et des substrats semblables dont font partie les UGT1A1, 1A3, 1A4 et 1A5, et celles associées aux phénols comprenant les UGT1A6-1A10 [2, 30, 31, 45].
L’activité de conjugaison de la bilirubine de l’UGT1A1 est essentielle pour protéger l’organisme contre les effets neurotoxiques de ce métabolite de l’hème. Des mutations entraînant une réduction de l’activité de cette enzyme sont associées à l’hyperbilirubinémie [31, 55]. Les symptômes résultants d’une déficience de l’UGT1A1 dépendent du niveau auquel l’enzyme fonctionne. Plus il y a une accumulation de bilirubine, en raison de l’inefficacité de l’UGT1A1, plus les symptômes sont importants. L’hyperbilirubinémie peut donc être asymptomatique, comme c’est le cas des personnes atteintes du syndrome de Gilbert, avoir des effets toxiques sévères chez les patients atteints du syndrome de Criggler-Najjar de type II ou, chez les type I, résulter en une accumulation de bilirubine fatale. C’est la seule enzyme UGT dont les variations génétiques sont sans équivoque liées directement à une maladie puisqu’elle est extrêmement importante au niveau du métabolisme de la bilirubine [31, 55].
2.4.2 UGT2
La famille des UGT2 se divise en sous-familles des UGT2A et UGT2B (figure 9) [30]. Contrairement à la sous-famille des UGT1A, les membres de la famille UGT2 possèdent chacun six exons qui leur sont propres, à l’exception des UGT2A1 et 2A2 (figure 12) [30, 55]. Ainsi, comme pour les UGT1A,les UGT2A1 et 2A2 sont issues d’un épissage alternatif et sont donc codées par un premier exon spécifique ainsi que cinq exons communs (2 à 6) qui proviennent du même locus situé au 4q13.3 [56]. De son côté, l’UGT2A3 est situé au même locus que les UGT2B, soit le chromosome 4q13.2 et ne possèdent aucun de ses 6 exons en commun avec les autres UGT2 [55].
Figure 12 : Représentation schématique du locus de l’UGT2 humain [45].
Chacun des gènes UGT2B consiste en 6 exons et sont représentés par un rectangle (pas à l’échelle), sauf pour les UGT2A1 et 2A2 qui représentent 7 exons. Le « P » représente les pseudogènes.
2.4.2.1 UGT2A
Les UGT2A ont longtemps été associées uniquement à l’épithélium olfactif (poumons, trachée, larynx) [57] où leur expression a d’abord été détectée. Depuis, on les a détectées dans d’autres tissus comme l’intestin, le pancréas et les reins [58] et, en ce qui concerne l’UGT2A3, dans le foie, le colon et le tissu adipeux [56]. Les UGT2A ne sont plus uniquement confinées à leur rôle dans la détoxification de molécules odorantes comme les métabolites procarcinogènes du tabac, les hydrocarbures aromatiques polycycliques (UGT2A1 et 2A2) [58, 59] puisqu’on sait maintenant que les trois UGT2A ont, à différents niveaux, la capacité de conjuguer les acides biliaires [56, 60]. D’autant plus qu’une activité de conjugaison pour d’autres substrats inattendus, tels que des métabolites androgéniques (testostérones, épi-testostérone, androstérone et étiocholanolone) a été rapportée pour les UGT2A1 et 2A2 [61-64]. L’UGT2A3 n’a cependant démontré aucune activité à plus de 80 substrats [56], outre son activité de conjugaison des acides biliaires [60].
2.4.2.2 UGT2B
Jusqu’à ce jour, sept protéines fonctionnelles UGT2B ont été identifiées chez l’homme (UGT2B4, 2B7, 2B10, 2B11, 2B15, 2B17 et 2B28) ainsi que cinq pseudogènes (UGT2B24P, 2B25P, 2B26P, 2B27P, 2B29P) [45]. De plus, des travaux du laboratoire du Dr Guillemette ont permis tout récemment de mettre en évidence des nouveaux isoformes de l’UGT2B4 et de l’UGT2B7 par l’épissage alternatif de l’exon qui étaient jusqu’alors encore inconnus [65-67].
Les UGT2B catalysent la glucurono-conjugaison de divers substrats, notamment des hormones stéroïdiennes, des acides biliaires, des acides carboxyliques, des phénols et de divers carcinogènes. Toutefois, les données actuelles suggèrent que les UGT2B4, 2B10, 2B17 et 2B28 ont un rôle mineur ou limité dans le métabolisme des drogues (figure 6) [19, 49]. L’UGT2B4, fortement exprimé au niveau du foie (figure 5) [31], a été principalement étudiée dans le cadre du métabolisme hépatique et extra-hépatique des acides biliaires ainsi que la conjugaison des acides gras [65]. Tout comme l’UGT2B4, les UGT2B10 et UGT2B11 conjuguent les acides gras et plus spécifiquement les métabolites eicosanoïdes [68]. Les UGT2B10 et 2B11 ont d’ailleurs été détectées au niveau du foie tandis que seulement l’UGT2B11 est retrouvée à la glande mammaire et à la vessie [69]. Il a été rapporté que l’enzyme UGT2B28, présente au foie, à la glande mammaire et au tissu adipeux [69], peut conjuguer faiblement l’estradiol, l’androstane-3!,17"-diol (3!-diol), l’androstérone (ADT) et la testostérone, quoiqu’à une capacité bien moins élevée que pour les UGT2B7, 2B15 et 2B17 [70]. Malheureusement, très peu d’informations sont actuellement disponibles sur le rôle de cette enzyme dans le métabolisme des drogues [2, 19, 69].
Les UGT2B sont reconnus pour leur capacité de conjugaison des androgènes, plus particulièrement les UGT2B7, 2B15 et 2B17 qui ont une très forte activité de conjugaison d’hormones stéroïdiennes [16, 19], ainsi qu’une variété de molécules endogènes et exogènes comme des médicaments [19, 31]. L’UGT2B7 a aussi la capacité de conjuguer des dérivés œstrogéniques, des acides gras et des rétinoïdes, mais aussi des composés exogènes comme la morphine et différents anti-inflammatoires non-stéroïdiens (AINS) [30]. Bien qu’elle soit absente de la prostate, elle peut conjuguer dans d’autres tissus le 3!-diol en position 3-hydroxy (figure 13) [50], quoiqu’à un niveau moins élevé que l’UGT2B17. Les UGT2B15 et 2B17 possèdent une activité particulièrement forte pour l’hormone active, la dihydrotestostérone (DHT) [71] et malgré leur très grande homologie de séquences (96%), ces deux enzymes illustrent quelques différences au niveau de la spécificité de substrat, du niveau d’activité et de la tissu-distribution [16, 27]. En effet, elles sont exprimées conjointement dans plusieurs tissus, notamment le foie, les reins, le tractus gastro-intestinal et les poumons, mais seule l’UGT2B15 est retrouvée au niveau du tissu adipeux, tandis que l’UGT2B17 est la seule aux glandes surrénales [50]. Ces enzymes sont plus spécifiquement associées aux tissus androgéno-sensibles, on
les retrouve donc aussi au niveau de la peau, de la glande mammaire, de la prostate, des testicules et de l’utérus [50, 71]. De plus, l’UGT2B15 conjugue en position 17-hydroxy les androgènes 5!-réduits alors que l’UGT2B17, de son côté, conjugue autant en position 3- que 17-hydroxy (figure 13) [50]. Les niveaux de conjugaison de la DHT et du 3!-diol pour l’UGT2B15 sont forts et modérés respectivement et l’UGT2B17, quant à elle, conjugue le 3!-diol et la testostérone à des niveaux semblables aux UGT2B7 et 2B15 mais a une capacité nettement plus importante pour la conjugaison de l’ADT [50].
2.4.3 UGT2B15
L’UGT2B15 est l’enzyme centrale pour le métabolisme des androgènes chez l’homme, ainsi que dans la réalisation de ce projet de maîtrise. Je consacrerai donc une section plus importante pour cette enzyme afin de fournir des informations nécessaires sur celle-ci.
2.4.3.1 Distribution tissulaire et spécificité enzymatique
L’enzyme UGT2B15 est exprimée dans une grande variété de tissus ce qui nous laisse croire qu’elle a une implication majeure en ce qui concerne la réaction de glucuronidation chez l’homme [72]. En plus d’être exprimée au niveau du foie, on la retrouve aux reins, à la peau, l’œsophage, aux testicules, à la prostate, aux ovaires, à la glande mammaire et à l’utérus [16]. De plus, comme il a déjà été mentionné, parmi les trois enzymes conjuguant les androgènes, l’UGT2B15 est la seule enzyme exprimée au niveau du tissu adipeux [73]. On suppose que sa présence dans ce tissu influence l’inactivation et l’élimination extra-hépatique de drogues [74]. En effet, une étude a démontré que le niveau métabolique de clairance intrinsèque d’un métabolite spécifique à l’UGT2B15, l’oxazepam était plus élevé chez des individus obèses par rapport à des individus contrôles non-obèses [74]. Qui plus est, l’effet de l’UGT2B15 au niveau du tissu adipeux a été observé dans le laboratoire du Dr Tchernof. Ils ont observé une quantité supérieure de 3!-diol sous forme conjugué chez des patients obèses par rapport aux patients contrôles [73].
En plus de la conjugaison des androgènes 5!-réduit comme le 3!-diol et la DHT en position 17-hydroxy (figure 13) [75], l’enzyme a aussi la capacité, quoiqu’à une affinité limitée, de conjuguer certains œstrogènes (catécholestrogène, 4-hydroxyestrone et 2-hydroxyestrone) [71, 76]. En plus de son rôle majeur dans la glucuronidation des androgènes, l’UGT2B15 est un acteur important dans le métabolisme de composés phénoliques, de coumarins, de flavonoïdes et de drogues [72]. Parmi ces molécules on retrouve donc des benzodiazépines, tels l’oxazepam (énantiomère S) [74] et le lorazepam [77], le 4-OH-tamoxifen [78], des anti-inflammatoires non stéroïdiens (AINS) comme l’acide salicylique [79], le 5-OH-Rofecoxib (AINS) [80] et le sipoglitazar [19, 81]. Le criblage des différentes UGT humaines a aussi révélé la contribution majeure de l’enzyme UGT2B15 dans le foie humain pour la conversion du BPA en dérivé glucuronide (BPA-G), un perturbateur endocrinien qui sera traité en détail plus loin dans ce mémoire [82].
2.4.3.2 Polymorphismes
Jusqu’à ce jour, six variants alléliques, ayant des substitutions d’acides aminés, de l’UGT2B15 ont été identifiés chez des populations caucasiennes, afro-américaines, hispaniques et orientales (tableau 1) [83]. Le polymorphisme UGT2B15*2 ou UGT2B15 D85Y, où un acide aspartique (D) est remplacé par une tyrosine (Y), est celui qui nous intéresse le plus dans le contexte de ce mémoire pour son rôle au niveau de la détoxification ainsi que son lien avec le cancer de la prostate (PCa) qui sera expliqué dans le paragraphe suivant. D’autant plus que ce variant est retrouvé dans une proportion de la population égale à la forme l’UGT2B15*1 D85 [72].
Tableau 1 : Caractérisation des allèles d’UGT2B15 [83].
Bien que les deux variants D85 et Y85 possèdent la même spécificité de substrats, ils diffèrent significativement par leur habilité à conjuguer efficacement le 3!-diol et la DHT, pour lesquels le variant Y85 est deux fois plus actif que le variant D85[72]. C’est toutefois l’inverse qui est observé en ce qui concerne la réaction de conjugaison de médicaments, comme l’oxazepam et du lorazepam, qui est réduite pour le variant Y85 [19, 84, 85], ce qui a aussi été observé in vivo [84, 86]. Certaines études ont d’ailleurs fait une association entre les porteurs du variant Y85 chez qui il y aurait une accumulation de masse adipeuse plus élevée [87], puisque la DHT, hormone inhibant la différenciation adipocytaire, est éliminée plus rapidement chez les porteurs de ce variant [88].
Même s’il a d’abord été cru que ce polymorphisme avait peu d’importance au niveau clinique [89], on sait maintenant que ce n’est pas le cas, puisqu’une activité réduite de l’enzyme UGT2B15 est un facteur de
risque du PCa [90]. Par conséquent, les porteurs du variant D85 seraient plus susceptible de développer un PCa que les porteurs du variant Y85 [90]. En effet, les variants D85 et Y85 font l’objet de plusieurs études en lien avec le PCa puisqu’ils influencent l’activité androgénique sur les cellules prostatiques, cet aspect sera traité à la section 3.3.5.2.
3 Hormones stéroïdiennes
Malgré la diversité de structures chimiques, toutes les hormones partagent des caractéristiques importantes dans leur mode d’action. En effet, la majorité de ces hormones sont présentes à de faibles concentrations dans la circulation qui les transporte jusqu’aux tissus cibles où elles interagissent avec des récepteurs avec une forte affinité pour remplir leurs fonctions [91]. Ces hormones sont essentielles à l’organisme et régulent une multitude de processus physiologiques [92, 93]. Étant donné la nature des travaux de ce projet de maîtrise, je me pencherai particulièrement sur les androgènes faisant partie des hormones sexuelles avec les œstrogènes. Il est toutefois nécessaire de débuter par un survol du système endocrinien en général. Les hormones sexuelles font donc partie de la famille des hormones stéroïdiennes (stéroïdes), tout comme les glucocorticoïdes et les minéralocorticoïdes.
Figure 14 : Structure du noyau des stéroïdes.
3.1 Classification
Le noyau des stéroïdes, appelé cyclopentano-perhydrophénantrène, est constitué de trois cyclohexanes (6 C), formant le squelette phénanthrène, et d’un cyclopentane (5 C) (figure 14). Les stéroïdes sont classifiés en fonction de leur nombre de carbones (C); on retrouve les pregnanes (21 C), comme la pregnénolone, les glucorticoïdes et les minéralocorticoïdes, les androstanes (19 C) et les estranes (18 C)
[94-97]. Des réarrangements mineurs dans la structure ou conformation du noyau permettent aux stéroïdes de se lier spécifiquement à des récepteurs et d’influencer diverses voies signalétiques [22]. Le cholestérol, précurseur à la synthèse des stéroïdes et les acides biliaires, est aussi membre de la famille des stéroïdes [22, 98]. Finalement, les corticostéroïdes sont des molécules synthétiques ou des hormones naturellement produites qui peuvent servir de médicaments comme le dexamethasone, un corticostéroïde utilisé dans le traitement de l’inflammation asthmatique [99, 100].
Figure 15 : Coupe transversale et vue microscopique de la glande surrénale [101].
3.2 Minéralocorticoïdes et glucocorticorticoïdes
La glande surrénale est l’organe permettant la synthèse des glucocorticoïdes et des minéralocorticoïdes [102] ainsi que de certains précurseurs aux hormones sexuelles, comme la déhydroépiandrostérone (DHEA), la DHEA-sulfate (-S) et l’androsténédione (4-Dione) [92, 103]. La synthèse des glucocorticoïdes et des minéralocorticoïdes se fait au niveau de la zone fasciculée et de la zone glomérulée respectivement (figure 16) [91, 95, 104].
Les glucocorticoïdes, dont le principal est le cortisol [100, 102, 105], sont utiles dans le métabolisme normal des cellules (métabolisme du glucose, mobilisation des réserves énergétiques et de la gestion du stress) [105]. Ils servent à s’assurer que l’organisme ait un apport énergétique suffisant en augmentant la vitesse du catabolisme des protéines et l’élimination des acides aminés pour les envoyer au foie. Ces acides
aminés peuvent ensuite servir à construire des protéines ou à la néoglucogenèse dans le foie. Les glucocorticoïdes aident à combattre les stress en favorisant une augmentation du glucose circulant et fournissent donc de l’énergie pour combattre des situations de stress (environnement hostile, stress émotifs, blessures, infections) et ce sont aussi des composés anti-inflammatoires [100].
L’aldostérone fait partie des minéralocorticoïdes qui ont quant à eux un rôle dans la balance électrolytique [95, 100, 102, 105]. Ils influencent la rétention d’eau dans l’organisme puisqu’ils agissent sur la rétention et la réabsorption du sodium ainsi que l’excrétion du potassium par les tubules rénaux [105]. Ainsi, l’aldostérone joue un rôle régulateur majeur du volume intravasculaire et de la pression sanguine [95, 100, 104, 105].
Figure 16 : Voie de synthèse de l’aldostérone et du cortisol à partir du cholestérol dans les zones gloméruleuses et fasciculées de la surrénale [95].
3.3 Androgènes
Il faut remonter aux années 30 et plus précisément en 1935, pour trouver les premières descriptions chimiques et physiologiques d’un androgène, la testostérone, par le chercheur néerlandais Ernst Laqueur [106]. D’autres hormones androgéniques ont depuis été caractérisées comme par exemple la DHT, la 4-dione
et la DHEA [107]. Bien qu’on mesure une concentration 10 fois plus élevé de testostérone dans le sang par rapport à la DHT [50], l’action de la DHT est très importante puisque cette hormone à une affinité pour le récepteur aux androgènes (AR) plus élevé que la testostérone [50, 107].
3.3.1 Fonctions des androgènes
Ce sont ces hormones qui, chez les vertébrés, permettent le développement des caractères sexuels mâles durant l’embryogenèse, grâce à la sécrétion de testostérone par les cellules de Leydig [107]. La maturation à la puberté ainsi que le maintien des fonctions reproductives, de la spermatogenèse et le comportement sexuel durant la vie adulte sont aussi issus de l'action de ces hormones [108-110]. La présence des androgènes est donc essentielle pour la formation des organes génitaux mâles internes et externes [110]. De plus, les androgènes ont un rôle dans plusieurs fonctions non-reproductives des tissus, tels que les os et les muscles squelettiques, chez l’homme comme la femme [108]. Ces hormones sont donc importantes notamment pour le développement osseux normal, l’apparition d’une tonalité plus grave de la voix, d’une pilosité plus forte ainsi que du développement de la masse musculaire [109, 111]. Aussi, lorsque des niveaux faibles de testostérone (hypogonadisme) sont observés chez un individu, il y présence de libido et érection faible, d’une quantité faible de spermatozoïdes et un développement de la poitrine. De plus, des dérèglements au niveau d’une sécrétion d’androgènes plus élevée sont associés au développement de l’hyperplasie bégnine de la prostate (BPH) ainsi qu’au cancer de la prostate [111, 112].
Figure 17 : Schéma comparatif des mécanismes de l’endocrinologie [113].
3.3.2 Stéroïdogenèse
Il existe deux types de stéroïdogenèse, celle des tissus endocriniens comme les gonades et la surrénale (tissu classique) et celle dans les tissus périphériques ou intracrines (prostate, peau, tissu adipeux, glande mammaire, etc.) (figure 17) [114]. C’est à partir du cholestérol que les tissus endocriniens produisent des hormones actives en grande quantité qui vont ensuite être déversées dans la circulation sanguine pour exercer des fonctions physiologiques dans tout le corps [113]. La synthèse de stéroïdes intracrines par les tissus périphériques n’utilise pas le cholestérol, mais plutôt les précurseurs provenant des tissus endocriniens, comme le DHEA pour synthétiser les hormones actives en petite quantité, en fonction des besoins locaux ainsi que des enzymes présentes [113]. Ainsi, très peu de ces hormones synthétisées à ce niveau sont retrouvées dans la circulation puisqu’elles sont utilisées et métabolisées localement [103, 113-115]. Les mécanismes d’inactivation des androgènes, principalement la glucuronidation sont décrits à la section 3.3.5.
3.3.2.1 Tissus classiques
Plusieurs organes sont capables de synthétiser les stéroïdes actifs à partir de précurseurs, tels les surrénales, les gonades, le cerveau, le placenta et le tissu adipeux. Toutefois, certains d’entre eux sont spécialisés dans la production de stéroïdes à partir du cholestérol [22, 116], c’est le cas des testicules, des
ovaires et des glandes surrénales, ces dernières étant essentielles à la survie de l’individu sont considérées comme étant le tissu le plus important dans la stéroïdogenèse [116]. Plusieurs enzymes sont impliquées dans la synthèse de ces hormones, les principales étant des cytochromes P450, des hydroxystéroïdes déshydrogénases (3" et 17"-HSD) et des stéroïdes réductases (figure 18) [92].
Figure 18 : Représentation schématique des voies de stéroïdogenèse de la glande surrénale et intracrines [117].
3.3.2.1.1 Synthèse au niveau des glandes surrénales
Le cholestérol est nécessaire à la synthèse des stéroïdes et peut provenir de deux sources, la première voie consiste à la synthèse à partir de molécules d’acétate, c’est cependant la seconde qui est favorisée, où le cholestérol de source alimentaire est fourni par les lipoprotéines de faible densité plasmatiques [92, 95]. Le cholestérol libre est insoluble dans le cytosol c’est donc la protéine régulatrice de la stéroïdogenèse aiguë (StAR) qui permet d’internaliser le cholestérol à la mitochondrie [92, 97]. L’expression de cette protéine étant spécifique aux glandes surrénales et aux gonades [92, 97], il semble que cette réaction soit essentielle pour la capacité de la synthèse de stéroïdes de novo de la cellule. Le rôle de StAR est d’autant plus important qu’elle est une étape limitante et permet une régulation de l’import du cholestérol à deux niveaux. Premièrement son expression transcriptionnelle détermine la capacité nette de la cellule à effectuer
la stéroïdogenèse (chronique). Et deuxièmement, afin de répondre rapidement à une stimulation, par exemple à l’hormone lutéinisante (LH), la cellule modifie la disponibilité du cholestérol envers StAR (aigu) [92].
La synthèse même des stéroïdes peut ensuite débuter par le clivage du cholestérol en prégnénolone par le cytochrome P450scc (side-chain clivage; clivage de la chaîne latérale ou CYP11A1) [95, 97, 103, 118], cette étape est aussi considérée comme une étape limitante de la stéroïdogenèse [95].
Il est intéressant de noter que le destin de la prégnénolone est directement lié à l’endroit où se déroule la synthèse à l’intérieur de la glande surrénale (figure 15 et 16), en effet la prégnénolone formée peut donner à la fois des minéralocorticoïdes, des glucocorticoïdes ou des précurseurs d’androgènes (DHEA et 4-dione). Ainsi, au niveau de la zone glomérulée, ce seront des minéralocorticoïdes qui seront formés par la prise en charge de la 3"-hydroxystéroïde déshydrogénase (3"-HSD) /Δ5 !Δ4 isomérase de type 2 (HSD3B2) (figure 16 et 18) [95, 117]. De plus, les cellules de cette zone n’ont aucune activité oxydative de la CYP17 c’est pourquoi ce sont des minéralocorticoÏdes qui y sont produits [97]. L’activité de la CYP17 est toutefois possible dans la zone fasciculée (figures 15 et 16), ce qui mène à la formation de glucocorticoïdes puisque cette enzyme catalyse la 17"-hydroxylation de la prégnénolone [97]. Finalement, la troisième zone, la zone réticulée (figure 15), est le site de l’action oxydative 17-20 lyase de la CYP17 via un second site actif, ce qui en fait, grâce à la présence du cytochrome b5, le siège de la synthèse du précurseur d’androgène et d’œstrogène, le DHEA (figure 18) [97, 118]. Le DHEA peut ensuite être sulfaté par la SULT2A1 qui permet au DHEA-S de rejoindre la circulation et de constituer une réserve de précurseurs androgéniques à des fins de transformations dans les tissus périphériques (figure 18) [97]. Bien que la zone réticulée soit caractérisée par une faible expression de la 3"-HSD de type 2, ce qui favorise la conversion de la prégnénolone en DHEA et DHEA-S une faible quantité est quand même convertie en 4-dione [97]. Ainsi, les glandes surrénales sécrètent trois précurseurs androgéniques, le DHEA, le DHEA-S et le 4-dione, qui seront transformés en hormones actives dans les tissus cibles des androgènes.
3.3.2.1.2 Synthèse au niveau des gonades
La formation de novo de la testostérone est entraînée par la sécrétion de l’hormone lutéinisante (LH) au niveau des cellules de Leydig [111, 115], tandis que seulement une petite quantité est produite par les
surrénales, le foie et les ovaires [111]. Ainsi, c’est avec la même succession d’étapes décrites à la section précédente qu’il y a formation de DHEA à partir du cholestérol, quoique la SULT2A1 est absente des cellules de Leydig il n’y a donc pas de formation de DHEA-S [97]. La 3"-HSD de type 2 permet ensuite la formation de 4-dione, qui est transformée en testostérone par la 17"-HSD de type 3 [97, 103], cette enzyme est majoritairement trouvée aux testicules [103]. Bien que la DHT soit l’androgène le plus actif, elle est faiblement synthétisée aux gonades et préférentiellement retrouvée dans les tissus où son rôle est essentiel, comme les épididymes et la prostate. Sa formation résulte de l’action de l’enzyme 5α-réductase. De plus, une faible quantité d’œstrogènes est aussi sécrété au niveau des testicules grâce à l’aromatase CYP19 qui transforme la testostérone en estradiol (figure 18) [117].
3.3.2.2 Tissus périphériques
Les androgènes produits au niveau des testicules compte pour seulement 50-60% de la testostérone au niveau de la prostate [119], le reste est donc produit directement dans les tissus périphériques à partir des précurseurs d’androgènes, c’est ce qui est appelé l’intracrinologie [117].Ainsi, bien que les glandes surrénales et les gonades ont longtemps été réputées comme étant les seuls tissus pouvant synthétiser de novo des hormones actives à partir du cholestérol, on sait maintenant que des tissus périphériques peuvent synthétiser les hormones actives qui leur sont nécessaires localement, à partir de précurseurs (comme le DHEA-S)[103], comme le tissu adipeux, l’endomètre, le sein, la peau et la prostate [97]. Ainsi, la majorité des tissus possèdent la batterie enzymatique nécessaire à l’intracrinologie, à des niveaux variables ce qui détermine donc la quantité de stéroïdes produite spécifiquement par ceux-ci [117].
3.3.2.3 Régulation de la stéroïdogenèse
La formation d’hormones stéroïdiennes est fortement régulée par l’axe hypotalamo-hypophysaire et régulent donc la stéroïdogenèse au niveau des glandes surrénales et des gonades (figure 19). En effet, l’hormone de libération des gonadotropines hypophysaires (GnRH) par l’hypothalamus qui induit la sécrétion des hormones lutéinisante (LH), folliculo-stimulante (FSH) et adrénocortocotropique (ACTH) par l’hypophyse antérieure [110]. La LH à son tour stimule la stéroïdogenèse au niveau des testicules [115], la FSH a une influence la gamétogénèse [110]. Ensuite, l’ACTH a un rôle
important dans la stéroïdogenèse puisqu’elle permet la libération du cholestérol des LDL à la mitochondrie [92]. Cette hormone favorise aussi la formation de stéroïdes en augmentant la translocation du cholestérol dans la membrane interne mitochondriale vers la P450scc mais aussi en augmentant l’expression de la protéine StAR. L’ACTH augmente aussi à long terme l’expression d’enzyme de la stéroïdogenèse en augmentant l’expression de la protéine StAR.
Finalement, les androgènes ont un rôle de rétro-inhibition au niveau de leur molécule stimulatrice (figure 19) [115].
Figure 19 : Régulation de la stéroïdogenèse par l’axe hypothalamo-hypophysaire [115].
3.3.3 Récepteur aux androgènes
Le gène du AR est situé sur le locus q12 du chromosome X [120, 121]. Ce récepteur est un récepteur stéroïdien qui fait partie de la superfamille des récepteurs nucléaires (RN). Les récepteurs nucléaires régulent et coordonnent une multitude de procédées en intégrant les signaux internes et externes et permettent donc le
![Figure 2 : Principales enzymes impliquées dans les phase I et II de la détoxification des composés endogènes et exogènes chez l’humain [5]](https://thumb-eu.123doks.com/thumbv2/123doknet/6488141.173283/22.918.127.757.122.444/figure-principales-enzymes-impliquées-détoxification-composés-endogènes-exogènes.webp)
![Figure 3 : Représentation des différents transporteurs du métabolisme ainsi que leurs substrats respectifs [26]](https://thumb-eu.123doks.com/thumbv2/123doknet/6488141.173283/24.918.161.730.217.597/figure-représentation-transporteurs-métabolisme-substrats-respectifs.webp)

![Figure 5 : Répartition consensuelle de l’expression hépatique relative des UGT [31].](https://thumb-eu.123doks.com/thumbv2/123doknet/6488141.173283/27.918.318.642.212.562/figure-répartition-consensuelle-l-expression-hépatique-relative-ugt.webp)
![Figure 7 : Plan de la réaction de glucuronidation [31].](https://thumb-eu.123doks.com/thumbv2/123doknet/6488141.173283/29.918.225.667.108.524/figure-plan-réaction-glucuronidation.webp)
![Figure 8 : Domaines fonctionnels de la séquence primaire d’une enzyme UGT et position membranaire [44]](https://thumb-eu.123doks.com/thumbv2/123doknet/6488141.173283/30.918.114.765.122.591/figure-domaines-fonctionnels-séquence-primaire-enzyme-position-membranaire.webp)
![Figure 10 : Arbre phylogénétique des deux sous-familles principales d’UGT ainsi que leur organisation chromosomique [30]](https://thumb-eu.123doks.com/thumbv2/123doknet/6488141.173283/32.918.107.752.112.457/figure-arbre-phylogénétique-familles-principales-ugt-organisation-chromosomique.webp)
![Figure 11 : Différences structurelles des isoformes courts et longs en fonction de l’épissage alternatif du gène UGT1 avec la présence du nouvel exon 5b [43]](https://thumb-eu.123doks.com/thumbv2/123doknet/6488141.173283/33.918.174.769.131.505/figure-différences-structurelles-isoformes-fonction-épissage-alternatif-présence.webp)
![Figure 13 : Spécificité de l’UGT2B7, 2B15 et 2B17 pour la DHT, l’ADT et le 3! -diol [71]](https://thumb-eu.123doks.com/thumbv2/123doknet/6488141.173283/37.918.198.712.356.967/figure-spécificité-ugt-b-b-dht-adt-diol.webp)