© Myriam Drouin, 2019
Monofluoroalcène comme isostère de la liaison
peptidique : synthèse, caractérisation et application
Thèse
Myriam Drouin
Doctorat en chimie
Philosophiæ doctor (Ph. D.)
iii
Résumé
Les propriétés uniques apportées par l’introduction d’un atome de fluor dans un composé bioactif ont favorisé son utilisation en chimie médicinale. Le nombre et la diversité des groupements fluorés maintenant présents en témoignent. Parmi ceux-ci, le monofluoroalcène présente des caractéristiques intéressantes, dont celle d’être un isostère non hydrolysable de la liaison peptidique. Cette thèse portera sur le motif monofluoroalcène et sera divisée en trois axes principaux, soit sa synthèse, sa caractérisation et son utilisation potentielle comme sonde fluorée.
Tout d’abord, l’alkylation allylique catalysée au palladium de 3,3-difluoropropènes a été développée, en utilisant le diméthylmalonate et ses dérivés comme nucléophiles. Une large gamme de monofluoroalcènes a été obtenue dans de bons rendements. Une variante asymétrique de la réaction a également été examinée. Cependant, elle présente des limites importantes, et uniquement les substrats cycliques réagissent de manière énantiosélective. Les produits obtenus peuvent ensuite subir différentes transformations, comme une monodécarboxylation en deux étapes donnant le mime de la liaison peptidique lié à un acide β-aminé. Afin d’obtenir des dérivés d’acides α-aminés, la synthèse du motif par une réaction de substitution nucléophile bimoléculaire avec réarrangement allylique à partir d’acides aminés a aussi été brièvement explorée.
L’influence sur l’hydrophobie de l’incorporation du monofluoroalcène dans de courts peptides a ensuite été évaluée. L’indice d’hydrophobie, un paramètre déterminé en utilisant la chromatographie liquide haute performance en phase inverse, a été calculé pour différents peptides fluorés et naturels. Il a été possible de conclure que la présence du motif dans le squelette d’un peptide augmentait sa lipophilie et de quantifier cette valeur.
Finalement, l’incorporation du monofluoroalcène comme isostère de la liaison peptidique dans de larges peptides a été effectuée, afin d’obtenir une étiquette-19F située dans le squelette
pour l’étude d’événements biologiques par résonance magnétique nucléaire. Le motif a été incorporé dans deux peptides, la PGLa et (KIGAKI)3, qui ont été analysés par des techniques
iv
Abstract
The unique properties associated with the incorporation of fluorine into bioactive compounds have led to its important use in medicinal chemistry. Nowadays, various fluorinated functional groups are employed. Among them, the monofluoroalkene shows interesting properties. This thesis will present the study of the monofluoroalkene as a peptide bond isostere and will focus on its synthesis, characterization and use as a fluorinated probe.
The palladium catalyzed allylic alkylation of 3,3-difluoropropenes using dimethylmalonate and its derivatives was developed. Various monofluoroalkenes were obtained in good yields. An asymmetric variant of the transformation was then investigated, but the transformation was limited to six-membered cycles. Some derivatization of the monofluoroalkenes obtained could be performed, such as a two steps monodecarboxylation procedure to access a peptide bond mimic followed by a β-amino acid. To access α-amino acid derivatives, a bimolecular nucleophilic substitution with allylic rearrangement starting from natural amino acids was briefly investigated.
The influence on the hydrophobicity of the incorporation of a monofluoroalkene into the backbone of short peptides was then evaluated. The hydrophobicity index, a parameter that can be determined by using reverse-phase high performance liquid chromatography, was used to quantify the lipophilicity of fluorinated and natural peptides. In every case, the presence of the monofluoroalkene enhanced the hydrophobicity of the compounds.
Finally, the monofluoroalkene was incorporated into the backbone of larger peptides to access a new 19F-label for the study of biological events by nuclear magnetic resonance. The
motif was integrated into the sequence of two peptides, PGLa and (KIGAKI)3, and the
v
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... x
Liste des figures ... xii
Liste des schémas ... xv
Liste des abréviations ... xviii
Remerciements ... xxii
Introduction ... 1
Chapitre 1 Synthèse de monofluoroalcènes par addition allylique de diméthylmalonate catalysée au palladium à des 3,3-difluoropropènes ... 24
1.1. Introduction ... 25 1.1.1. Antécédents ... 25 1.1.2. Objectifs ... 32 1.1.3. Tsuji-Trost ... 33 1.2. Résultats et discussion ... 36 1.2.1. Variante achirale ... 36
1.2.1.1. Synthèse des substrats ... 36
1.2.1.2. Optimisation ... 40 1.2.1.3. Étendue de la réaction ... 42 1.2.1.3.1. Substrats ... 42 1.2.1.3.2. Nucléophiles ... 50 1.2.2. Variante asymétrique... 52 1.2.2.1. Essais préliminaires ... 52
1.2.2.2. Synthèse des substrats ... 53
1.2.2.3. Optimisation ... 57
1.2.2.4. Étude des substrats ... 62
1.2.2.4.1. Isomérie ... 62
1.2.2.4.2. Substitution de l’alcène ... 64
vi
1.2.2.5. Étude des nucléophiles ... 68
1.2.3. Transformations subséquentes ... 69 1.2.3.1. Hydrogénation ... 70 1.2.3.2. Alkylation ... 71 1.2.3.3. Réduction ... 72 1.2.3.4. Déalkoxylation/hydrolyse ... 74 1.3. Conclusion... 75 1.4. Partie expérimentale ... 77 1.4.1. Commentaires généraux ... 77 1.4.2. Synthèse ... 78
1.4.2.1. Synthèse des 3,3-difluoropropènes ... 78
1.4.2.1.1. Oléfination des α-difluorocétones ... 78
1.4.2.1.2. Alcènes monosubstitués ... 89
1.4.2.2. Synthèse des nucléophiles ... 93
1.4.2.3. Synthèse des monofluoroalcènes ... 94
1.4.2.3.1. À partir des alcènes disubstitués60 ... 94
1.4.2.3.2. À partir des alcènes monosubstitués60 ... 103
1.4.2.3.3. À partir des alcènes trisubstitués61... 105
1.4.2.4. Transformations synthétiques des monofluoroalcènes60,61 ... 114
1.4.2.4.1. Réduction ... 114
1.4.2.4.2. Alkylation ... 115
1.4.2.4.3. Réduction ... 117
1.4.2.4.4. Monodécarboxylation ... 119
Chapitre 2 Évaluation du caractère hydrophobe induit par la présence du monofluoroalcène dans de courts peptides ... 121 2.1. Introduction ... 122 2.1.1. Mesure de l’hydrophobie ... 122 2.1.2. Modulation de l’hydrophobie ... 125 2.2. Objectifs ... 130 2.3. Méthodologie ... 134
2.3.1. Synthèse peptidique sur support solide ... 134
2.3.2. Indice d’hydrophobie par RP-HPLC ... 138
vii
2.4.1. Synthèse de l’isostère de dipeptide comportant un monofluoroalcène ... 143
2.4.2. Synthèse de l’isostère de dipeptide comportant un alcène ... 147
2.4.3. Synthèse peptidique sur support solide ... 149
2.4.3.1. Peptides déprotégés ... 149
2.4.3.2. Peptides protégés ... 151
2.4.4. Indices d’hydrophobie ... 152
2.4.4.1. Série déprotégée ... 152
2.4.4.2. Série protégée ... 156
2.4.4.3. Analyses dans le méthanol ... 158
2.5. Conclusion... 161 2.6. Partie expérimentale ... 162 2.6.1. Commentaires généraux ... 162 2.6.2. Synthèse ... 164 2.6.2.1. Synthèse en solution ... 164 2.6.2.1.1. Dipeptide ... 164
2.6.2.1.2. Isostère de dipeptide comportant un monofluoroalcène ... 167
2.6.2.1.3. Isostère de dipeptide comportant un alcène... 173
2.6.2.2. Synthèse peptidique sur support solide ... 179
2.6.2.2.1. Peptides non fluorés déprotégés ... 179
2.6.2.2.2. Peptides fluorés déprotégés ... 182
2.6.2.2.3. Peptides non fluorés protégés ... 186
2.6.2.2.4. Peptides fluorés et comportant l’alcène protégés ... 190
2.6.3. RP-HPLC ... 195
2.6.3.1. Comparaison méthanol et acétonitrile ... 195
Chapitre 3 Études biophysiques de peptides comportant un monofluoroalcène comme isostère de liaison peptidique ... 197
3.1. Introduction ... 198
3.2. Objectifs ... 207
3.3. Méthodologie ... 209
3.3.1. Synthèse peptidique sur support solide ... 209
3.3.2. Dichroïsme circulaire ... 211
3.3.3. Dichroïsme circulaire orienté ... 213
viii
3.3.5. Clivage de vésicules ... 217
3.4. Résultats et discussion ... 218
3.4.1. Synthèse du monofluoroalcène comme isostère de la liaison peptidique ... 219
3.4.2. PGLa ... 220 3.4.2.1. Synthèse ... 221 3.4.2.2. Analyses biophysiques ... 224 3.4.3. (KIGAKI)3 ... 229 3.4.3.1. Synthèse ... 229 3.4.3.2. Analyses biophysiques ... 230 3.5. Conclusion... 234 3.6. Partie expérimentale ... 236 3.6.1. Commentaires généraux ... 236 3.6.2. Synthèse ... 237
3.6.2.1. Synthèse de l’isostère de dipeptide comportant un monofluoroalcène ... 237
3.6.2.2. Synthèse peptidique sur support solide ... 239
3.6.2.2.1. PGLaF6,7, (KIGAKI)3F2,3 et (KIGAKI)3F8,9 ... 239
3.6.2.2.2. PGLaF10,11 ... 240
3.6.3. Dichroïsme circulaire ... 240
3.6.3.1. PGLa et ses dérivés ... 241
3.6.3.2. (KIGAKI)3 et ses dérivés... 241
3.6.3.2.1. Études dans H2O ... 241
3.6.3.2.2. Études en présence de lipides ... 242
3.6.4. Dichroïsme circulaire orienté ... 242
3.6.5. RMN ... 243
3.6.5.1. Préparation des échantillons ... 243
3.6.5.2. Mesures ... 243
3.6.6. Clivage de vésicules ... 244
3.6.6.1. Préparation des vésicules... 244
3.6.6.2. Mesures ... 245
Chapitre 4 Vers la synthèse d’isostères de dipeptides comportant un monofluoroalcène à partir d’acides aminés ... 246
4.1. Introduction ... 247
ix
4.2.2. Réaction de déoxofluoration ... 250
4.2.2.1. Introduction ... 250
4.2.2.2. Optimisation ... 254
4.2.2.3. Chimie en flux continu ... 263
4.2.3. Catalyse ... 268
4.2.3.1. Introduction ... 268
4.2.3.2. Réactivité d’un sel d’alkoxyméthyltrifluoroborate de potassium... 271
4.2.3.3. Réactivité des acides arylboroniques... 274
4.2.4. Substitution nucléophile bimoléculaire avec réarrangement allylique ... 277
4.2.4.1. Introduction – Organolithiens ... 277
4.2.4.2. Introduction – Chlorure de diméthylaluminium ... 279
4.2.4.3. Résultats ... 281
4.2.4.3.1. À partir du 3,3-difluoropropène protégé ... 281
4.2.4.3.2. À partir du 3,3-difluoropropène déprotégé ... 284
4.2.5. Métathèse croisée ... 287 4.2.5.1. Introduction ... 287 4.2.5.2. Résultats ... 291 4.3. Conclusion... 294 4.4. Partie expérimentale ... 296 4.4.1. Informations générales ... 296 4.4.2. Synthèse ... 297 Conclusions et perspectives ... 309 Bibliographie ... 316
x
Liste des tableaux
Tableau I.1. Propriétés des atomes d’hydrogène, de fluor et de chlore. ... 3
Tableau I.2. Propriétés spectroscopiques des atomes d'hydrogène et de fluor. ... 4
Tableau I.3. Exemples de réactifs de fluoration.24c,k ... 12
Tableau 1.1. Comparaison des méthodes de synthèse de monofluoroalcènes développées par le groupe du Pr Paquin. ... 31
Tableau 1.2. Optimisation de l’addition de diméthylmalonate catalysée au palladium à 1.5. ... 41
Tableau 1.3. Étendue de l’addition de diméthylmalonate à des 3,3-difluoropropènes. ... 43
Tableau 1.4. Optimisation de l’addition de diméthylmalonate catalysée au palladium à 1.15. ... 48
Tableau 1.5. Étendue de l’addition de nucléophiles à 1.5. ... 50
Tableau 1.6. Optimisation des ligands pour la catalyse asymétrique.a,b ... 58
Tableau 1.7. Optimisation de l’addition de diméthylmalonate catalysée au palladium à E-1.11... 60
Tableau 1.8. Deuxième optimisation des ligands pour la catalyse asymétrique.a,b ... 62
Tableau 1.9. Influence de la géométrie de l’alcène. ... 63
Tableau 1.10. Influence de la géométrie de l’alcène. ... 65
Tableau 1.11. Étendue de l’addition énantiosélective de diméthylmalonate.a,b ... 67
Tableau 1.12. Nucléophiles pouvant être utilisés pour la catalyse asymétrique. ... 68
Tableau 2.1. Paramètres variés pour l’étude de φ0. ... 134
Tableau 2.2. Rendements des peptides déprotégés. ... 150
Tableau 2.3. Rendements des peptides protégés. ... 151
Tableau 2.4. Temps de rétention, k’ et log(k’) de GVG-aa.a... 153
Tableau 2.5. Indices d’hydrophobie des peptides déprotégés.a,b ... 154
Tableau 2.6. Indices d’hydrophobie des peptides protégés.a ... 157
Tableau 2.7. Indices d’hydrophobie dans l’acétonitrile et le méthanol à pH = 7.a ... 160
Tableau 2.8. Temps de rétention dans le méthanol et dans l’acétonitrile. ... 195
Tableau 3.1. Distances pouvant être mesurées par R2 ou REDOR par RMN à l’état solide.a... 201
Tableau 3.2. Transitions électroniques et signaux importants en CD. ... 212
Tableau 3.3. MIC de mutants de la PGLa.a ... 220
Tableau 3.4. Synergie entre la PGLa et la Magainin I observée par clivage de vésicules.a,b ... 229
Tableau 3.5. Clivage de vésicules par (KIGAKI)3 et ses dérivés fluorés.a,b ... 234
xi
Tableau 4.2. Déoxofluoration suivant les conditions du groupe de Takei. ... 254
Tableau 4.3. Optimisation de la déoxofluoration en présence de Me-DAST... 259
Tableau 4.4. Optimisation de la déoxofluoration en présence de Deoxo-Fluor (50 % dans THF). 260 Tableau 4.5. Optimisation de la déoxofluoration en présence de Deoxo-Fluor (50% dans toluène). ... 261
Tableau 4.6. Optimisation de la déoxofluoration en chimie en flux continu. ... 266
Tableau 4.7. Optimisation de l’addition d’acide phénylboronique à 4.17. ... 275
Tableau 4.8. Optimisation de l’addition d’acide 4-méthoxyphénylboronique. ... 276
Tableau 4.9. Optimisation de l’addition de chlorure de diméthylaluminium à 4.1a. ... 282
Tableau 4.10. Optimisation de l’addition de chlorure de diméthylaluminium au 3,3-difluoropropène déprotégé. ... 286
xii
Liste des figures
Figure I.1. Exemple de composé comportant un 18F. ... 4
Figure I.2. Composés naturels organofluorés. ... 5
Figure I.3. Force des ponts hydrogène C-F---H-O.16 ... 7
Figure I.4. Exemples de composés fluorés présents dans différents domaines. ... 8
Figure I.5. Fludrocortisone. ... 9
Figure I.6. Exemples de médicaments fluorés les plus vendus. ... 10
Figure I.7. Amélioration de la stabilité métabolique. ... 11
Figure I.8. Monofluoroalcène : synthon26a et chimie médicinale27b. ... 13
Figure I.9. Exemples d’isostères de liaisons peptidiques. ... 14
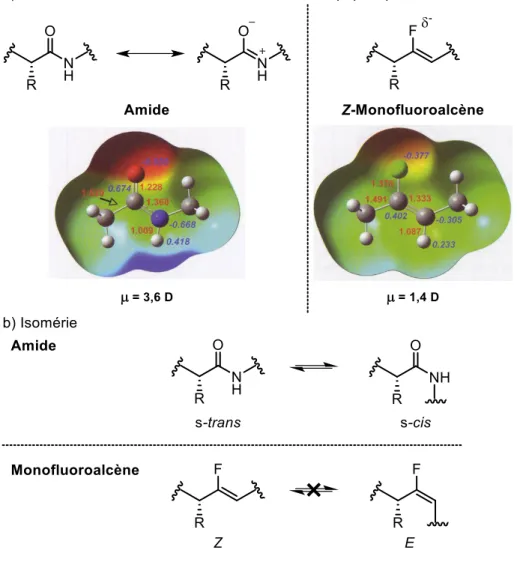
Figure I.10. Comparaison de l’amide et du monofluoroalcène. Les cartes de densité électronique sont tirées de la réf. 32. ... 15
Figure I.11. Exemples de peptides comportant un monofluoroalcène. ... 16
Figure I.12. Catégories de monofluoroalcènes. ... 17
Figure I.13. Voies de synthèse principales de monofluoroalcènes. ... 18
Figure I.14. Objectifs de la thèse. ... 19
Figure I.15. Thalidomide. ... 21
Figure I.16. Hydrophobie induite par la présence d’un monofluoroalcène dans le squelette de courts peptides. ... ... 22
Figure I.17. Incorporation d’un monofluoroalcène dans la PGLa et (KIGAKI)3 et études biophysiques. ... 23
Figure 1.1. Acides β3-aminés. ... 33
Figure 1.2. Substrats à l’étude. ... 39
Figure 1.3. Substrats d’intérêt qui n’ont pas pu être obtenus. ... 39
Figure 1.4. Isostère pouvant être obtenu à la suite d’une déalkoxylation/hydrolyse... 45
Figure 1.5. Projections de Newman. ... 47
Figure 1.6. Produit de double addition obtenu en présence de cyanoacétate de méthyle. ... 51
Figure 1.7. Nucléophiles incompatibles à la transformation. ... 52
Figure 1.8. Substrats à l’étude pour la catalyse asymétrique. ... 54
Figure 1.9. Isostères de β3 -homoalanine et de β3-homophénylalanine. ... 54
Figure 1.10. Angles dans le complexe métallique.90 ... 61
xiii
Figure 1.12. Composé pour l’obtention de cristaux. ... 73
Figure 2.1. Peptidomimétiques... 126
Figure 2.2. Exemples d’acides aminés monofluoré, difluoré et trifluoré. ... 126
Figure 2.3. Hydrophobie polaire. ... 127
Figure 2.4. Comparaison du log D7,07 de la Leu-enképhaline et de tyrosines perfluorées. ... 129
Figure 2.5. Hydrophobie de la Leu-enképhaline contenant un monofluoroalcène. ... 129
Figure 2.6. Exemple d’indices d’hydrophobie obtenus par RP-HPLC. ... 130
Figure 2.7. Monofluoroalcène à l’étude et motifs de comparaison. ... 131
Figure 2.8. Librairie de peptides à l’étude... 133
Figure 2.9. Résines utilisées. ... 135
Figure 2.10. Agents de couplage et bases utilisés. ... 137
Figure 2.11. Régression linéaire. ... 140
Figure 2.12. Effet du groupe voisin. ... 142
Figure 2.13. β-fluorolactame. ... 146
Figure 2.14. Régression linéaire pour le peptide GVG-aa à pH = 2. ... 153
Figure 2.15. Indices d’hydrophobie des peptides déprotégés... 155
Figure 2.16. Principe de paire d’ions. ... 155
Figure 2.17. Profil d’ionisation des peptides déprotégés à pH = 2 et 7. ... 156
Figure 2.18. Indices d’hydrophobie des peptides protégés. ... 158
Figure 2.19. Dichroïsme circulaire de quatre tripeptides.a,b ... 159
Figure 2.20. Corrélation entre les indices d’hydrophobie dans l’acétonitrile et dans le méthanol.. 196
Figure 3.1. Image tirée de réf. 173 : principaux mécanismes d’action des peptides antimicrobiens actifs au niveau de la membrane. ... 199
Figure 3.2. Exemples d’acides aminés pouvant être utilisés pour des études RMN 19F à l’état solide. ... 202
Figure 3.3. Image tirée de réf. 194 : réalignement de la PGLa fluorée en fonction du ratio P/L. ... 203
Figure 3.4. Images tirées de réf. 196 (a) et 197 (b) : état-I de la PGLa. ... 204
Figure 3.5. Image tirée de réf. 199 : études de distance entre deux résidus monofluorés de la PGLa. ... 205
Figure 3.6. Image tirée de réf. 201 : mobilité de (KIGAKI)3. ... 206
Figure 3.7. Monofluoroalcène à l’étude. ... 207
Figure 3.8. Dérivés fluorés de PGLa à l’étude. ... 208
Figure 3.9. Dérivés fluorés de (KIGAKI)3 à l’étude. ... 209
xiv
Figure 3.11. Lumière polarisée circulairement et elliptiquement... 211
Figure 3.12. Transitions électroniques. ... 212
Figure 3.13. Image tirée de réf. 212 : spectres obtenus par OCD. ... 214
Figure 3.14. Anisotropie de déplacement chimique du spectre de poudre et orientation pour le fluorobenzène. ... 215
Figure 3.15. Exemple schématique de spectre CPMG obtenu. ... 216
Figure 3.16. Clivage de vésicules. ... 217
Figure 3.17. Profils HPLC de PGLaF6,7 et PGLaF10,11. ... 222
Figure 3.18. Dichroïsme circulaire de la PGLa et de ses dérivés fluorés. ... 225
Figure 3.19. Dichroïsme circulaire orienté de la PGLa et de ses dérivés fluorés. ... 226
Figure 3.20. Dichroïsme circulaire orienté normalisé de la PGLa et de ses dérivés fluorés. ... 227
Figure 3.21. RMN 19F à l’état solide de la PGLa et de ses dérivés fluorés dans des échantillons orientés dans des bicouches lipidiques de DMPC/PG (3:1). ... 228
Figure 3.22. Profils HPLC de (KIGAKI)3F2,3 et (KIGAKI)3F8,9. ... 230
Figure 3.23. Dichroïsme circulaire de (KIGAKI)3 et de ses dérivés fluorés dans H2O. ... 231
Figure 3.24. Dichroïsme circulaire de (KIGAKI)3 et de ses dérivés fluorés dans des vésicules de DMPC/PG (4:1). ... 232
Figure 3.25. RMN 19F à l’état solide de (KIGAKI)3 et de ses dérivés fluorés dans des échantillons orientés dans des bicouches lipidiques de DMPC à 308 K. ... 233
Figure 4.1. Sous-produit de la réaction de déoxofluoration. ... 256
Figure 4.2. Fonctionnement de la chimie en flux continu. ... 263
Figure 4.3. Dérivé fluoré de sphingosine. ... 289
Figure 4.4. Chélation du carbonyle sur le centre métallique. ... 294
xv
Liste des schémas
Schéma I.1. Synthèse de monofluoroalcènes à partir de 3,3-difluoropropènes. ... 20
Schéma I.2. Synthèse de monofluoroalcènes par addition de diméthylmalonate et de ses dérivés à des 3,3-difluoropropènes. ... 20
Schéma I.3. Synthèse de monofluoroalcènes à partir de dérivés d’acides aminés. ... 22
Schéma 1.1. Monofluoroalcène ciblé et méthode de synthèse. ... 25
Schéma 1.2. Formation d’un complexe π-allyle à partir d’un fluorure allylique.47... 26
Schéma 1.3. Synthèse de monofluoroalcènes par le groupe de Fujii. ... 27
Schéma 1.4. Synthèse de β-aminofluoroalcènes développée par le groupe Paquin. ... 28
Schéma 1.5. Synthèse de monofluoroalcènes par catalyse au platine. ... 28
Schéma 1.6. Utilisation d’organolithiens, d’amidures de lithium et de thiolates de lithium pour la synthèse de monofluoroalcènes. ... 29
Schéma 1.7. Addition de diméthylmalonate à un 3-chloro-3-fluoropropène. ... 31
Schéma 1.8. Objectifs pour la synthèse de monofluoroalcènes par addition allylique de diméthylmalonate et de ses dérivés catalysée au palladium. ... 32
Schéma 1.9. Mécanisme proposé pour l’addition de diméthylmalonate au 3,3-difluoropropène 1.5. ... 34
Schéma 1.10. Énantiosélectivité selon l’échange des énantiofaces du complexe. ... 35
Schéma 1.11. Voies de synthèse des substrats. ... 37
Schéma 1.12. Optimisation de l’addition de diméthylmalonate à Z-1.11. ... 44
Schéma 1.13. Sélectivité pour les alcènes Z. ... 46
Schéma 1.14. Attaque en C3 et réarrangement. ... 47
Schéma 1.15. Optimisation sur l’alcool protégé par un benzyle. ... 49
Schéma 1.16. Essais préliminaires pour la catalyse asymétrique. ... 53
Schéma 1.17. Synthèse infructueuse du substrat azoté. ... 56
Schéma 1.18. Synthèse infructueuse de substrats acycliques... 57
Schéma 1.19. Complexes π-allyles et isomérisation. ... 64
Schéma 1.20. Hydrogénation du monofluoroalcène. ... 70
Schéma 1.21. Réaction test pour l’hydrogénolyse du lien C-F. ... 71
Schéma 1.22. Alkylation en alpha du diester. ... 72
Schéma 1.23. Réduction du diester en diol. ... 72
xvi
Schéma 1.25. Résumé de l’addition allylique catalysée au palladium de diméthylmalonate et de ses
dérivés à des 3,3-difluoropropènes. ... 75
Schéma 2.1. Synthèse de l’auxiliaire chiral. ... 144
Schéma 2.2. Synthèse du monofluoroalcène 2.13. ... 145
Schéma 2.3. Modification des groupements protecteurs de 2.13. ... 146
Schéma 2.4. Synthèse de l’isostère de dipeptide comportant un alcène... 148
Schéma 2.5. Modifications des groupements protecteurs de 2.21. ... 149
Schéma 3.1. Protection de l’isostère de dipeptide par un Fmoc. ... 219
Schéma 3.2. Synthèse de la PGLaF6,7. ... 221
Schéma 3.3. Synthèse de la PGLaF10,11. ... 223
Schéma 4.1. Analyse rétrosynthétique pour la synthèse d’isostères de dipeptides comportant un monofluoroalcène. ... 248
Schéma 4.2. Voie de synthèse du 3,3-difluoropropène dérivé de la L-phénylalanine. ... 250
Schéma 4.3. Déoxofluoration d’alcool et de cétone. ... 251
Schéma 4.4. Mécanisme proposé pour la déoxofluoration d’une cétone. ... 253
Schéma 4.5. Déoxofluoration de l’énone dérivée de la phénylalanine par le groupe de Takei. ... 254
Schéma 4.6. Déoxofluoration en présence de XtalFluor-E. ... 255
Schéma 4.7. Optimisation de la déoxofluoration en présence de Fluolead. ... 256
Schéma 4.8. Intermédiaire de la déoxofluoration... 257
Schéma 4.9. Déoxofluoration de l’énone et de l’ynone. ... 258
Schéma 4.10. Déoxofluoration d’une ynone par le groupe de O’Hagan. ... 258
Schéma 4.11. Conditions optimisées de la réaction de déoxofluoration. ... 262
Schéma 4.12. Déoxofluoration d’une cétone en chimie en flux continu par le groupe de Seeberger. ... 264
Schéma 4.13. Déoxofluoration d’une cétone en chimie en flux continu par le groupe de Ley. ... 265
Schéma 4.14. Meilleures conditions pour la déoxofluoration en chimie en flux continu. ... 267
Schéma 4.15. Synthèse d’un monofluoroalcène par amination allylique catalysée au palladium. . 268
Schéma 4.16. Voie de synthèse envisagée pour la formation du monofluoroalcène par catalyse au palladium. ... 269
Schéma 4.17. Substrats modèles. ... 269
Schéma 4.18. Essai préliminaire pour la création d’un lien C-C. ... 270
Schéma 4.19. Mécanisme proposé. ... 271
Schéma 4.20. Sel de trifluoroborate de potassium et réactions subséquentes. ... 272
xvii
Schéma 4.22. Addition du sel de trifluoroborate de potassium sur le substrat cyclique. ... 273
Schéma 4.23. Addition du sel de trifluoroborate de potassium sur le substrat acyclique. ... 274
Schéma 4.24. Formation de l’organotrifluoroborate pour la transmétallation. ... 277
Schéma 4.25. Addition de butyllithium pour former un monofluoroalcène. ... 278
Schéma 4.26. Addition de l’anion du 1,3-dithiane pour former le monofluoroalcène. ... 278
Schéma 4.27. Meilleures conditions de l’addition de l’anion du 1,3-dithiane. ... 279
Schéma 4.28. SN2’ à l’aide de triméthylaluminium. ... 280
Schéma 4.29. Synthèse de monofluoroalcène en présence de Me2AlCl. ... 280
Schéma 4.30. Voie de synthèse de monofluoroalcènes à partir d’acides aminés en utilisant la méthodologie de Taguchi. ... 281
Schéma 4.31. Essai préliminaire de l’addition de cyanure. ... 283
Schéma 4.32. Addition du chlorure de diméthylaluminium au sel de HCl. ... 284
Schéma 4.33. Lavage acido-basique. ... 285
Schéma 4.34. Catalyseurs de la famille Grubbs utilisés en métathèse. ... 288
Schéma 4.35. Développement de la métathèse croisée par le groupe de Gouverneur. ... 289
Schéma 4.36. Homocouplage développé par le groupe de O’Hagan. ... 289
Schéma 4.37. Développement de métathèse croisée par le groupe de Bouzbouz. ... 290
Schéma 4.38. Synthèse du 3,3-difluoropropène disubstitué. ... 290
Schéma 4.39. Essais préliminaires pour la métathèse croisée. ... 291
Schéma C.1. Développement de la synthèse de monofluoroalcènes à l’aide de chlorure de diméthylaluminium. ... 314
Schéma C.2. Développement de la synthèse de monofluoroalcènes comprenant deux résidus différents de la glycine. ... 315
xviii
Liste des abréviations
ΔH enthalpie de réaction α polarisabilité δ déplacement chimique μw micro-ondes φ0 indice d’hydrophobie γ ratio gyromagnétique σI effet inductif σR effet de résonance
[]cat. catalyseur (quantité catalytique)
[α] pouvoir rotatoire
Ψ[(E)-CH=CH] alcène comme remplacement de l’amide
Ψ[(Z)-CF=CH] monofluoroalcène comme remplacement de l’amide
Ac acétyle
Ala (A) alanine
ANTS sel de disodium de l’acide 8-aminonaphtalène-1,3,6-trisulfonique
aq. aqueux Ar aryle Arg (R) arginine B0 champ magnétique BINAP 2,2’-bis(diphénylphosphino)-1,1’-binaphtalène Boc tert-butoxycarbonyle Bn benzyle Bpg bicyclopent-[1.1.1]-1-ylglycine BSA bis(triméthylsilyl)acétamide nBu n-butyle tBu tert-butyle C3-TunePhos 1,13-bis(diphénylphosphino)-7,8-dihydro-6H-dibenzo[f,h][1,5]dioxonine Cbz carboxybenzyle
CD circular dichroism (dichroïsme circulaire)
CDI carbonyldiimidazole
6-Cl-HOBt 6-chloro-1-hydroxybenzotriazole
CPMG Carr-Purcell-Meiboom-Gill
CSA chemical shift anisotropy (anistropie de déplacement chimique)
Cy cyclohexyle
DAST N,N-diéthyl-1,1,1-trifluoro- λ4-sulfanamine
xix dba dibenzylidèneacétone DCE dichloroéthane DCM dichlorométhane Dde bis-N-[1-(4,4-diméthyl-2,6-dioxocyclohexylidène)éthyl] DDQ 2,3-dichloro-5,6-dicyano-1,4-benzoquinone
Deoxo-Fluor® N,N-bis(2-méthoxyéthyl)-1,1,1-tifluoro-λ4-sulfanamine
DIBAL-H hydrure de diisobutylaluminium
DIC N,N’-diisopropylcarbodiimide DIFLUORPHOS 5,5’-bis(diphénylphosphino)-2,2,2’,2’-tétrafluoro-4,4’-bi-1,3-benzodioxole DM 3,5-diméthylphényle DMA diméthylacétamide DMAP 4-diméthylaminopyridine DMF diméthylformamide DMPC (1,2-dimyristoyl-sn-glycéro-3-phosphocholine) DMPG (1,2-dimyristoyl-sn-glycéro-3-phospho-(1'-rac-glycérol))
DOPr récepteur opïode delta
dppe 1,2-bis(diphénylphosphino)éthane dppf 1,1’-bis(diphénylphosphino)ferrocène dppp 1,3-bis(diphénylphosphino)propane DPX bromure de p-xylène-bis-pyridinium DTBM 3,5-di-tert-butyl-4-méthoxyphényle E1 élimination d’ordre 1 E2 élimination d’ordre 2
EC50 concentration efficace médiane
EDC.HCl hydrochlorure de N-éthyl-N’-(3-diméthylaminopropyl)carbodiimide
ELSD evaporative light scattering detector (détecteur évaporatif à diffusion de lumière)
équiv. équivalent
esd estimate of the standard deviation (erreur standard sur l’estimé)
ESI electrospray ionization (ionisation par électronébuliseur)
Et éthyle
Fluolead trifluorure de 4-tert-butyl-2,6-diméthylphénylsulfure
Fmoc fluorénylméthoxycarbonyle
Gly (G) glycine
GP groupe partant
HBTU hexafluorophosphate de
2-(1H-benzotriazol-1-yl)-1,1,3,3-tétraméthylaminium
HCTU hexafluorophosphate de 2-(6-chloro-1-H-benzotriazole-1-yl)-1,1,3,3-tétraméthylaminium
xx
HRMS-ESI high resolution mass spectrometry with electrospray ionization (spectrométrie de masse haute résolution avec ionisation par électronébuliseur)
I intensité
Ile (I) isoleucine
IR infrarouge
JOSIPHOS 1-[1-(dicyclohexylphosphino)éthyl]-2-(diphénylphosphino)ferrocène
k’ facteur de capacité
L ligand
LC-MS chromatographie liquide couplée à un spectromètre de masse
LUMO lowest unoccupied molecular orbital (orbitale inoccupée la plus basse en énergie)
Lys (K) lysine
Me méthyle
Me-DAST N,N-diméthyl-1,1,1-trifluoro-λ4-sulfanamine
MeO-BIPHEP 2,2'-bis(diphénylphosphino)-6,6'-diméthoxy-1,1'-biphényle
Met (M) méthionine
MIC concentration inhibitrice minimale
Ms mésyle
MS molecular sieves (tamis moléculaire)
MTBE méthyl tert-butyl éther
Mtt 4-méthyltrityle
Nal naphtylalanine
NFSI N-fluorobenzènesulfonimide
ns nombre de scans
Nu nucléophile
OCD oriented circular dichroism (dichroïsme circulaire orienté) Oxyma pure éthyl cyano(hydroxyimino)acétate
P/L ratio peptide/lipide
PG protecting group (groupe protecteur)
Ph phényle Phe (F) phénylalanine Phg phénylglycine Phth phtalimide Piv pivaloyle PMB para-méthoxybenzyle PMP para-méthoxyphényle POPC 1-palmitoyl-2-oléoyl-glycéro-3-phosphocholine POPE 1-palmitoyl-2-oléoyl-sn-glycéro-3-phosphoéthanolamine POPG 1-palmitoyl-2-oléoyl-sn-glycéro-3-phospho-(1'-rac-glycérol) iPr isopropyle
xxi
rac racémique
Rf rapport frontal
RMN résonance magnétique nucléaire
RP-HPLC reverse-phase high performance liquid chromatography (chromatographie liquide haute performance en phase inverse)
sat. saturé
SEGPHOS 5,5′-bis(diphénylphosphino)-4,4′-bi-1,3-benzodioxole
Selectfluor® bis(tétrafluoroborate) de
N-chlorométhyl-N’-fluorotriéthylènediammonium
Ser (S) sérine
SF synergy factor (facteur de synergie)
SN2 substitution nucléophile bimoléculaire
SN2’ substitution nucléophile bimoléculaire avec réarrangement allylique
Su succinimide
SYNPHOS 6,6’-bis(diphénylphosphino)-2,2’,3,3’-tétrahydro-5,5’-bi-1,4-benzodioxine
T° température
T1 temps de relaxation longitudinal (spin-réseau)
T2 temps de relaxation spin-spin (transversal)
t0 temps mort
tr temps de rétention
t. a. température ambiante
TBDPS tert-butyldiphénylsilyle
TEP tomographie par émission de positrons
TES triéthylsilyle
TOF time-of-flight (temps de vol)
TFA acide trifluoroacétique
TFE 2,2,2-trifluoroéthanol
THF tétrahydrofurane
TIS triisopropylsilane
Tyr (Y) tyrosine
Val (V) valine
Xaa ou AA acide aminé
XtalFluor-E tétrafluoroborate de (diéthylamino)difluorosulfonium XtalFluor-M tétrafluoroborate de difluoro(morpholino)sulfonium
xxii
Remerciements
Lorsque j’ai débuté ma maîtrise dans le groupe de Jean-François Paquin, je n’étais pas encore certaine de ce que je voulais faire comme emploi et si je voulais poursuivre avec un doctorat. Il y avait l’engagement que cela représente, mais je me demandais surtout si j’avais les capacités pour en faire un. Et voilà que j’écris les remerciements de ma thèse, et il y a beaucoup de personnes sans qui cela n’aurait pas été possible.
Tout d’abord, je voudrais remercier mon directeur de recherche, Jean-François, d’avoir eu confiance en moi et de m’avoir donné l’opportunité d’effectuer mon doctorat dans son groupe. J’ai vraiment apprécié le fait de travailler avec toi au cours des cinq dernières années. Tu as toujours été disponible pour les questions que j’avais sur mon projet, mais aussi pour écouter de nouvelles suggestions ou m’aider à comprendre les résultats moins cohérents qui étaient parfois obtenus. Tu m’as aussi donné la chance de présenter mes travaux dans plusieurs congrès internationaux et de rédiger mes premiers articles scientifiques, et cela m’a permis de m’épanouir sur le plan professionnel. Merci aussi pour tous les BBQ et piscine l’été, ainsi que les vins et fromages pour les soirées de Noël, c’était bien de pouvoir se parler aussi en dehors du laboratoire.
Cela m’amène à remercier Anne S. Ulrich, qui m’a accueillie dans son laboratoire pour un stage de six mois, alors que je n’avais aucune expérience dans le domaine de la biophysique. Cela m’a permis d’élargir mes connaissances scientifiques. Plus particulièrement, merci à Parvesh et Stephan, qui m’ont supervisée lorsque j’étais au Karlsruhe Institute of Technology et ont eu la patience de m’expliquer les différentes techniques.
Dans le domaine universitaire, je voudrais aussi remercier le groupe de Denis Giguère, qui m’a prêté l’équipement nécessaire pour effectuer les analyses en RP-HPLC pour mon projet sur l’hydrophobie. Le groupe de Normand Voyer m’a aussi aidée pour le projet sur l’hydrophobie, en me donnant tout le matériel pour effectuer la synthèse peptidique sur
xxiii
support solide. Un merci particulier à François Otis pour son aide et les réponses à toutes mes questions dans ce domaine.
Lors de mon premier stage, j’ai eu le plaisir d’avoir Pier Alexandre comme superviseur. Premièrement, merci papa PA de m’avoir tout appris dans le laboratoire à ce moment-là, surtout que je ne travaillais même pas sur ton projet. Je pense que je vais toujours me rappeler cet après-midi où je t’avais aidé à ramasser le déversement du cryostat et qu’on avait fini la journée au pub U. J’ai vraiment passé un bel été grâce à toi, et je suis super contente qu’on soit toujours en contact. Lors de mon deuxième stage, j’ai été sous la supervision de Jean-Denys, et c’est à ce moment que j’ai commencé à travailler sur les monofluoroalcènes. Tout d’abord, merci pour toutes tes connaissances sur le domaine! Au départ, je ne savais pas à quoi m’attendre en t’ayant comme superviseur, et ensuite comme collègue pendant mes études graduées. Nous sommes tellement différents de caractère. Finalement, j’ai adoré travailler avec toi. OMG, avec quelle autre personne est-ce que je pourrais chanter Confessions nocturnes dans le laboratoire? Et qui me dirait que la seule note que j’ai, c’est le my-grec? Je sais que je suis tannante et que je te pose encore 1000 questions même si tu es rendu à l’autre bout du continent, alors merci pour ta patience.
Je voudrais aussi remercier les différents stagiaires qui ont travaillé sur mon projet. Tout d’abord Audrey, qui a réussi à garder le moral tout un été alors que le projet ne fonctionnait pas du tout. J’étais tellement stressée quand tu es arrivée au laboratoire 30 minutes après que j’aie commencé ma maîtrise, merci d’avoir été indulgente par rapport à ça. Ça me fait bizarre de te remercier ici comme stagiaire, on s’entend que notre relation a beaucoup évolué depuis cet été-là. Le fait d’avoir ma hotte et mon bureau à côté de toi a vraiment fait que j’ai passé de meilleures journées au laboratoire. Surtout quand tu lâches des petits bruits, ça me fait toujours rire tes bulles au cerveau! Et bon, je ne pense pas que j’ai besoin de te remercier pour les 1000 moments qu’on a passés ensemble en dehors de l’université, que ce soit pendant le FEQ, chez toi, au bar, à Montréal… Tout ce que j’espère, c’est qu’on va continuer comme ça même si nous ne sommes plus voisines de travail! Ensuite il y a eu Marie, qui est débarquée directement d’Allemagne. Je sais que c’était difficile pour toi, entre la langue que tu ne comprenais pas et faire de la chimie organique, mais je suis vraiment contente de t’avoir
xxiv
connue davantage quand j’habitais à Karlsruhe. Merci de m’avoir hébergée et de m’avoir fait aimer ton pays! L’été suivant, j’ai pu travailler avec Sébastien. Pour vrai, tu es une des personnes les plus gentilles que je connaisse. C’était vraiment plaisant de t’avoir comme collègue et d’avoir pu te former, tu étais tout le temps super intéressé. Finalement, j’ai pu travailler avec José sur le projet sur l’hydrophobie au cours de la dernière année de mon doctorat. Que dire sur toi et ton jetlag (je ne pensais pas que c’était possible d’oublier un produit pendant cinq mois et demi sur la rampe à vide)! Non, pour vrai, tu étais excellent dans le laboratoire, je suis sûre que ton doctorat va se passer super bien. Et il y a deux trucs parfaits pour décrire notre relation : Kraken et poulet portugais! Tu m’as tellement fait rire, j’espère qu’on pourra se revoir dans les prochaines années, malgré la distance.
Je voudrais maintenant remercier tous les collègues que j’ai eus au sein du groupe Paquin, passés comme présents. Il y a tout de même certaines personnes que je voudrais souligner plus particulièrement. Elsou, ma maîtrise n’aurait pas été la même sans toi! J’ai tellement passé de bons moments avec toi, autant à l’université qu’en dehors. Et tu dégages tellement une belle joie de vivre, c’est difficile de ne pas être heureuse en te côtoyant, même dans les journées les plus difficiles. Je pense qu’un des seuls regrets que j’ai eu durant ma thèse, c’est d’être partie sept mois alors que tu finissais (et que tu repartes direct en France). Je m’ennuie de toi, mais je sais qu’on va garder contact! Mathilde, ça a pris du temps avant qu’on se parle davantage, mais je suis contente que ce soit finalement arrivé. Je pense que je vais toujours me rappeler des cours de trampoline, c’était tellement drôle. Justine, on a bien changé entre le moment de notre stage d’été où nous étions allées aux États-Unis et maintenant, mais j’en garde de beaux souvenirs. Tu as quand même réussi à me faire jouer la seule partie de LOL de ma vie! Majdou, je suis vraiment contente que tu sois venue faire ton post-doc dans le groupe, et que tu restes finalement à Québec pour aller chez OmégaChem. Je voulais te remercier pour les fois que tu m’as aidée dans le laboratoire, mais aussi dans ma vie personnelle. Ce n’est pas pour rien que je t’appelle maman Majdou. Sérieux, j’ai tellement des bons souvenirs avec toi, que ce soit la première soirée électro ou la vodka Skittles (je ne prendrai plus jamais un cadeau de fête que tu as préparé ahah). Mélissa, je suis vraiment contente que nous soyons allées en Floride ensemble. Je vais m’ennuyer de tes bruits de baleine échouée et de ton rire. Enfin quelqu’un qui rit aussi mal que moi! Les nouvelles
xxv
maîtrises, Marie, Raphaël, Camille et Xavier, j’espère que vous continuerez à faire du groupe Paquin un endroit où faire ses études est agréable, autant dans le laboratoire qu’en dehors! Et Marius, même si tu es rendu chez les Leclerc, je suis contente que tu sois venu faire ton deuxième post-doc avec nous. Malgré tes allures de monsieur pas gentil, en fait tu es un gros nounours avec un club de golf. J’espère que tu es prêt à remettre la soirée pirate prochainement!
Je voudrais aussi remercier mes deux meilleures amies. Laurie, même si tu es rendue à Longueuil, je suis contente qu’on se voit le plus souvent possible. Ça me fait toujours du bien de rire avec toi, et de t’entendre m’encourager quand je suis dans une moins bonne journée. Sophie, même si tu ne comprends rien de ce que je fais, tu as toujours été fière de moi et me l’a montré. Tu es ma moitié artistique, j’ai besoin de toi dans ma vie pour avoir mon équilibre. Pour vrai, je ne sais pas ce que je ferais sans toi.
Finalement, je voudrais remercier ma famille. Mes parents, qui ont toujours cru en moi et m’ont encouragée à poursuivre mes études tout en m’aidant autant qu’ils le pouvaient. Vous m’avez écouté chialer sur ma chimie même si vous ne compreniez pas, vous essayez de lire mes articles… Pour vrai, votre présence a vraiment été importante pour moi et je ne serais pas la femme que je suis devenue aujourd’hui sans vous. Merci pour tout, je ne vous le dirai jamais assez. Merci à mes frères, sans qui je ne serais pas aussi heureuse. Alex, Lo, Frank et Nico, vous êtes débiles, mais ça me fait du bien d’être avec vous. Je sais que je suis votre sœur préférée! Que ce soit pour une nuit de voile, un souper, un shotgun dans les toilettes… on passe toujours de beaux moments. Je vais toujours pouvoir compter sur vous, et je ne pense pas que j’y serais arrivée dans les cinq dernières années si je n’avais pas eu votre soutien. Et merci aussi à mes belles-sœurs : Justine, Florence et Marie-Michelle. Ça fait du bien de se tenir avec des filles pendant les soupers de famille!
Voilà le tour des remerciements que je voulais dire. Merci de m’avoir aidée à devenir qui je suis aujourd’hui et de m’avoir soutenue pour que je puisse accomplir mes objectifs et finir mon doctorat.
1
2
Le fluor
Découverte
Au 19e siècle, plusieurs scientifiques se sont intéressés à l’isolation du fluor diatomique (F 2),
mais sans succès.1 C’est finalement en 1886 que la première synthèse du fluor diatomique
sous forme gazeuse a été effectuée par le chercheur français Henry Moissan.2 Un procédé
d’électrolyse de bifluorure de potassium (KHF2) a permis l’isolation du gaz. Moissan obtint
le prix Nobel de chimie de 1906 pour l’isolation et les études réalisées sur le F2, en plus de
la mise au point du four à arc électrique.
Propriétés
L’atome de fluor est le 13e élément le plus abondant dans la croûte terrestre. Dans la nature,
cet élément se retrouve essentiellement dans des minéraux sous forme anionique de fluorure (F-). Les deux sources principales sont le fluorspar (CaF
2) et la cryolite (Na3AlF6).1 De plus,
le fluorure est présent dans la fluoroapatite [Ca5(PO4)3F], un des composés inorganiques
formant l’émail des dents. Le fluorure a une abondance relative de 0,027 % en masse dans la croûte terrestre. En comparaison, le chlorure est présent à 0,19 % et le bromure à 6 x 10-4 %.1
Toutefois, uniquement 1,4 mg/L de fluorure se retrouve dans l’eau de mer, comme sa source principale, le fluorspar, est peu soluble. Cette faible solubilité explique que l’atome de fluor soit relativement abondant dans la lithosphère, mais pratiquement absent de la biosphère.
1 Kirsch, P. Introduction. Dans Modern Fluoroorganic Chemistry, 2e Éd. : Wiley-VCH, Weinheim, Allemagne,
2013, p. 1-24.
3
Les propriétés de l’atome de fluor en font un élément unique, qui est souvent comparé à l’hydrogène ou aux autres halogènes (Tableau I.1).1 C’est l’élément le plus électronégatif du
tableau périodique, avec une électronégativité de 3,98 selon l’échelle de Pauling. De ce fait, l’atome de fluor est relativement petit, avec un rayon de van der Waals de 1,47 Å, ce qui le rapproche de l’atome d’hydrogène (1,20 Å). Ces deux propriétés rendent la déformation du nuage électronique de l’atome de fluor difficile, ce qui lui confère une faible polarisabilité (α), soit de 0,557 x 10-24 cm-3. Cela le diffère de l’halogène le suivant dans le tableau
périodique, l’atome de chlore, qui a une polarisabilité de 2,18 x 10-24 cm-3.
Tableau I.1. Propriétés des atomes d’hydrogène, de fluor et de chlore.
Propriétés H F Cl
Électronégativité (échelle de Pauling) 2,20 3,98 3,16
Rayon de van der Waals (Å) 1,20 1,47 1,75
Polarisabilité (x 10-24 cm-3) 0,667 0,557 2,18
L’atome de fluor, qui se retrouve sous la forme de l’isotope stable 19F avec une abondance
naturelle de 100 %, est intéressant d’un point de vue spectroscopique (Tableau I.2).3,4 Comme
il a un spin de ½, tout comme 1H et 13C, donc un spin non nul, 19F peut être utilisé en
résonance magnétique nucléaire (RMN). Son ratio gyromagnétique (γ) est de 40,03 MHz/T, ce qui représente 0,94 fois celui de l’hydrogène. Cela lui confère une bonne sensibilité, soit de 83 % par rapport à 1H, ainsi que la possibilité de faire des études de longues distances
intermoléculaires. Finalement, la RMN 19F est un outil précis, comme sa fenêtre spectrale
d’analyse est large (environ 350 ppm). Ainsi, de faibles variations de l’environnement chimique d’un composé seront identifiables par un changement du déplacement chimique.
3 Dolbier, W. R. General Introduction. Dans Guide to Fluorine NMR for Organic Chemists, 2e Éd. : Wiley,
Hoboken, NJ, 2016, p. 1-8.
4
Tableau I.2. Propriétés spectroscopiques des atomes d'hydrogène et de fluor.
Propriétés H F
Spin 1/2 1/2
Abondance naturelle (%) 99,985 100
Ratio gyromagnétique (MHz/T) 42,58 40,03
Sensibilité (%) 100 83,3
Un radioisotope de l’atome de fluor, le 18F, peut être obtenu par synthèse. Avec son temps de
demi-vie de 109,8 minutes, il est utilisé dans le domaine médical en tomographie par émission de positrons (TEP).5 Par exemple, I.1 est un composé radiopharmaceutique utilisé
pour étudier le métabolisme du glucose (Figure I.1).6 Dans ce cas, le groupement hydroxyle
en position 2 du glucose a été remplacé par un atome de 18F.
Figure I.1. Exemple de composé comportant un 18F.
5 Preshlock, S.; Tredwell, M.; Gouverneur, V. Chem. Rev. 2016, 116, 719. 6 Ametamey, S. M.; Honer, M.; Schubiger, P. A. Chem. Rev. 2008, 108, 1501.
5
Chimie organofluorée
Composés naturels
Certains organismes vivants, tels que les plantes ou les micro-organismes, ont la capacité de transformer le fluorure inorganique en métabolites organofluorés. Pour ce faire, l’enzyme fluorinase serait responsable de la création du lien C-F. Toutefois, seulement 18 produits organofluorés, pour la plupart toxiques, sont retrouvés dans la nature (Figure I.2).7
Figure I.2. Composés naturels organofluorés.
Le plus abondant est l’acide fluoroacétique, présent principalement sous forme de fluoroacétate. Il est à la base de la synthèse des autres métabolites organofluorés. Par exemple, le métabolisme in vivo du fluoroacétate produit le (2R,3R)-2-fluorocitrate, qui est
7 (a) Harper, D. B.; O’Hagan, D. Nat. Prod. Rep. 1994, 11, 123; (b) Heng, H.; O’Hagan, D.; Schaffrath, C. Nat.
6
hautement toxique. Dans le règne végétal, il est possible de retrouver l’acide ω-fluorooléique. À partir de cet acide gras, sept autres acides gras ω-fluorés peuvent être métabolisés, avec un nombre variable de carbones et d’insaturations sur la chaine acyle. Le dernier métabolite obtenu à partir des plantes est la fluoroacétone. Toutefois, les analyses de ce composé volatil sont ambigües et certains pensent qu’il s’agirait plutôt du fluoro-acétaldéhyde. Deux métabolites fluorés, la nucléocidine et la 4-fluorothréonine, sont retrouvés dans la nature à la suite de leur biosynthèse par des micro-organismes. Finalement, cinq analogues fluorés de la 5-fluorouracile ont pu être isolés d’une éponge marine, la Phakellia fusca.8
Propriétés
La liaison entre un atome de carbone et un atome de fluor est à la base de la chimie organofluorée.9,10 Le lien simple C-F est court, soit de 1,40 Å, comparativement à 1,09 Å
pour le lien C-H et 1,43 Å pour le lien C-O. C’est le lien simple le plus fort avec le carbone, avec une force de 105 kcal/mol. Comparativement, le lien C-H est de 98 kcal/mol et le lien C-O est de 84 kcal/mol. Ces deux propriétés découlent de la petite taille et de l’importante électronégativité du fluor, qui rendent le lien C-F relativement inerte. D’un point de vue stérique, le remplacement d’un lien C-H par un lien C-F ne perturbera pas trop une molécule. Cependant, la nouvelle liaison créée est fortement polarisée vers l’atome de fluor, avec un moment dipolaire de 1,41 D, ce qui entraine une modification importante du caractère électrostatique. En effet, le lien C-H est plutôt polarisé vers le carbone et présente un moment dipolaire de 0,40 D. Une caractéristique importante des composés organofluorés est l’impact de la présence de plusieurs atomes de fluor sur le même carbone. La liaison C-F sera de plus en plus forte en augmentant le nombre d’atomes de fluor : CH3F (107 kcal/mol) < CH2F2
(109,6 kcal/mol) < CF3H (114,6 kcal/mol) < CF4 (116 kcal/mol).9 L’ajout d’atomes de fluor
a aussi un effet important sur le pKa. Par exemple, dans le cas de l’acide acétique,
8 Xu, X.-H.; Yao, G.-M.; Li, Y.-M.; Lu, J.-H.; Lin, C. J.; Wang, X.; Kong, C. H. J. Nat. Prod. 2003, 66, 285. 9 O’Hagan, D. Chem. Soc. Rev. 2008, 37, 308.
7
l’augmentation du nombre de fluor favorise l’acidité du composé : CH3CO2H (pKa = 4,76) <
CH2FCO2H (pKa = 2,59) < CHF2CO2H (pKa = 1,34) < CF3CO2H (pKa = 0,52).11,12 Le
caractère hydrophobe d’une molécule sera aussi influencé par la présence d’un ou plusieurs atomes de fluor. Par exemple, l’éthane a un log P de 1,81, alors que le 1,1-difluoroéthane a un log P de 0,75. La présence des atomes de fluor augmente donc l’hydrophilie du composé, ce qui est souvent le cas pour la fluoration de groupements alkyles. Toutefois, la fluoration peut aussi augmenter l’hydrophobie, par exemple dans le cas de la fluoration aromatique.12
Finalement, le fluor d’une liaison C-F peut être un accepteur faible de liaisons hydrogène.13,14,15 La liaison hydrogène entre le fluorométhane et l’eau, ainsi qu’entre le
fluoroéthylène et l’eau, a été étudiée (Figure I.3).16 Alors que les deux motifs engendrent une
distance similaire de 1,9 Å entre le fluor et l’hydrogène, le lien C(sp3)-F permet un pont H
plus fort que le lien C(sp2)-F.
Figure I.3. Force des ponts hydrogène C-F---H-O.16
11 Schlosser, M. Angew. Chem. Int. Ed. 1998, 110, 1496.
12 Purser, S.; Moore, P. R.; Swallow, S.; Gouverneur, V. Chem. Soc. Rev. 2008, 37, 320. 13 Plenio, H. Chem. Rev. 1997, 97, 3363.
14 Champagne, P. A.; Desroches, J.; Paquin, J.-F. Synthesis 2015, 47, 306. 15 Dalvit, C.; Vulpetti, A. Chem. Eur. J. 2016, 22, 7592.
8
Intérêts des composés organofluorés
Des molécules organofluorées sont retrouvées dans plusieurs domaines, tels que les matériaux,17 l’agrochimie18 et le pharmaceutique19 (Figure I.4). En 2006, 30 à 40 % des
produits agrochimiques sur le marché contenaient un atome de fluor, alors que cette proportion était de 20 % dans le domaine pharmaceutique.20 En 2016, le nombre de
médicaments contenant au moins un atome de fluor sur le marché ou en phase de développement s’élevait à 25 %.21 D’ailleurs, la moitié des dix médicaments les plus vendus
en 2005 étaient fluorés,20 tout comme 12 des 34 médicaments approuvés par la « US Food
and Drug Administration » en 2014.21
Figure I.4. Exemples de composés fluorés présents dans différents domaines.
17 (a) Berger, R.; Resnati, G.; Metrangolo, P.; Weber, E.; Hulliger, J. Chem. Soc. Rev. 2011, 40, 3496; (b)
Cardone, A.; Martinelli, C.; Losurdo, M.; Dilonardo, E.; Bruno, G.; Scavia, G.; Destri, S.; Cosma, P.; Salamandra, L.; Reale, A.; Di Carlo, A.; Aguirre, A.; Milián-Medina, B.; Farinola, G. M. J. Mater. Chem. A
2013, 1, 715; (c) Milad, R.; Shi, J.; Aguirre, A.; Cardone, A.; Milián-Medina, B.; Abderraba, M.; Gierschner,
J. J. Mater. Chem. C 2016, 4, 6900; (d) Ameduri, B. Chem. Eur. J. 2018, 24, 18830; (e) Ragni, R.; Punzi, A.; Babudri, F.; Farinola, G. M. Eur. J. Org. Chem. 2018, 3500.
18 (a) Jeschke, P. ChemBioChem 2004, 5, 570; (b) Jeschke, P. Pest. Manag. Sci. 2010, 66, 10; (c) Fujiwara, T.;
O’Hagan, D. J. Fluorine Chem. 2010, 167, 16.
19 (a) Isanbor, C.; O’Hagan, D. J. Fluorine Chem. 2006, 127, 303; (b) Bégué, J.-P.; Bonnet-Delpon, D. J.
Fluorine Chem. 2006, 127, 992; (c) Kirk, K. L. J. Fluorine Chem. 2006, 127, 1013; (d) Hagmann, W. K. J. Med. Chem. 2008, 51, 4359; (e) O’Hagan, D. J. Fluorine Chem. 2010, 131, 1071; (f) Wang, J.; Sánchez-Roselló,
M.; Aceñas, J. L.; del Pozo, C.; Sorochinsky, A. E.; Fustero, S.; Soloshonok, V. A.; Liu, H. Chem. Rev. 2014,
114, 2432; (g) Gillis, E. P.; Eastman, K. J.; Hill, M. D.; Donnelly, D. J.; Meanwell, N. A. J. Med. Chem. 2015, 58, 8315; (h) Zhou, Y.; Wang, J.; Gu, Z.; Wang, S.; Zhu, W.; Aceñas, J. L.; Soloshonok, V. A.; Izawa, K.; Liu,
H. Chem. Rev. 2016, 116, 422.
20 Thayer, A. M. Chem. Eng. News 2006, 84, 15. 21 Richardson, P. Expert. Opin. Drug Dis. 2016, 11, 983.
9
Pour ce qui est des matériaux, la présence d’un fluor aromatique peut favoriser les interactions électrostatiques, et ainsi permettre d’obtenir de meilleurs candidats, par exemple pour les cristaux liquides.17
Le premier composé commercial bioactif incorporant un fluor, la fludrocortisone, a été synthétisé en 1954. Le remplacement d’un lien C-H par un lien C-F permettait une augmentation de son activité anti-inflammatoire (Figure I.5).22 Par la suite, l’intérêt pour la
synthèse de médicaments fluorés a augmenté, en vue d’obtenir des molécules organofluorées incorporant un ou plusieurs atomes de fluor aromatiques ou aliphatiques, et sous forme de différents motifs : -F, -CF3, -CF2H, -OCF3, etc. (Figure I.6).19e
Figure I.5. Fludrocortisone.
Plusieurs aspects physicochimiques sont influencés par l’incorporation d’un ou plusieurs atomes de fluor dans un composé et peuvent améliorer ses propriétés pharmacocinétiques.12,23 Par exemple, la biodisponibilité ou les affinités de liaison avec le
site actif ciblé peuvent être favorisées par le remplacement d’un lien C-H par un lien C-F dans une molécule bioactive. Tout d’abord, il peut y avoir une perturbation du pKa.12 Comme
le fluor est très électronégatif, sa présence a une influence sur l’acidité ou la basicité des groupements fonctionnels voisins, donc sur leur réactivité ou leur état d’ionisation. Ensuite, l’incorporation d’un atome de fluor entraînera une variation de la lipophilie, qui a une
22 Fried, J.; Sabo, E. F. J. Am. Chem. Soc. 1954, 76, 1455.
23 (a) O’Hagan, D.; Rzepa., H. S. Chem. Commun. 1997, 647; (b) Smart, B. E. J. Fluorine Chem. 2001, 109, 3;
(c) Böhm, H.-J.; Banner, D.; Bendels, S.; Kansy, M.; Kuhn, B.; Müller, K.; Obst-Sander, U.; Stahl, M.
ChemBioChem 2004, 5, 637; (d) Müller, K.; Faeh, C.; Diederich, F. Science 2007, 317, 1881; (e) Huchet, Q.
A.; Kuhn, B.; Wagner, B.; Kratochwil, N. A.; Fischer, H.; Kansy, M.; Zimmerli, D.; Carreira, E. M.; Müller, K. J. Med. Chem. 2015, 58, 9041.
10
importance pour la biodisponibilité d’un médicament et sa capacité à franchir les membranes cellulaires.12 Les deux propriétés mentionnées ci-dessus auront un impact direct sur la
solubilité d’une molécule bioactive dans les conditions biologiques.
Figure I.6. Exemples de médicaments fluorés les plus vendus.
La présence d’un lien C-F peut aussi modifier la conformation,23e la propension à faire des
liaisons hydrogène et les interactions électrostatiques d’un composé. Cela a un impact direct sur les interactions avec la cible, par exemple les interactions protéines-ligands.23c,d
Finalement, l’incorporation d’un atome de fluor peut être effectuée pour améliorer la stabilité métabolique d’un médicament, que ce soit en empêchant le métabolisme oxydatif, le métabolisme hydrolytique ou l’épimérisation (Figure I.7).12
11
Figure I.7. Amélioration de la stabilité métabolique.
Synthèse
L’émergence de composés organofluorés d’intérêt a été favorisée par le développement de nouvelles méthodes de synthèse au cours des dernières années.24 Alors que le premier
composé organofluoré, le fluorure de benzoyle, a été obtenu en 1863, la première moitié du 20e siècle a plutôt été marquée par la synthèse de chlorofluorocarbones, servant entre autres
de réfrigérants.1 L’acide fluorhydrique était alors utilisé comme principal agent de fluoration,
mais sa corrosivité importante a rendu le développement de la chimie du fluor plus compliqué. Dans les années 1950-1960, la synthèse de composés pharmaceutiques fluorés a débuté, mais elle a pris son ampleur après le protocole de Montréal de 1987. En effet, les compagnies produisant des composés organofluorés travaillaient surtout sur la synthèse de chlorofluorocarbones. Or, le protocole de Montréal visait à enrayer ces molécules, vu leur impact sur la destruction de la couche d’ozone. Certaines entreprises ont alors concentré leurs efforts sur le développement de nouveaux réfrigérants ayant un impact environnemental
24 Revues de la littérature sélectionnées sur la synthèse de composés organofluorés : (a) Wilkinson, J. A. Chem.
Rev. 1992, 92, 505; (b) Shimizu, M.; Hiyama, T. Angew. Chem. Int. Ed. 2005, 44, 214; (c) Furuya, T.; Kuttruff,
C. A.; Ritter, T. Curr. Opin. Drug. Disc. 2008, 11, 863; (d) Ma, J.-A.; Cahard, D. Chem. Rev. 2008, 108, PR1; (e) Lectard, S.; Hamashima, Y.; Sodeoka, M. Adv. Synth. Catal. 2010, 352, 2708; (f) Valero, G.; Companyó, X.; Rios, R. Chem. Eur. J. 2011, 17, 2018; (g) Furuya, T.; Kamlet, A. S.; Ritter, T. Nature 2011, 473, 410; (h) Liang, T.; Neumann, C. N.; Ritter, T. Angew. Chem. Int. Ed. 2013, 52, 8214; (i) Ma, J.-A.; Li, S. Org. Chem.
Front. 2014, 1, 712; (j) Champagne, P. A.; Desroches, J.; Hamel, J.-D.; Vandamme, M.; Paquin, J.-F. Chem. Rev. 2015, 115, 9073; (k) Chatalova-Sazepin, C.; Hemelaere, R.; Paquin, J.-F.; Sammis, G. M. Synthesis 2015, 47, 2554; (l) Campbell, M. G.; Ritter, T. Chem. Rev. 2015, 115, 612; (m) Yang, X.; Wu, T.; Phipps, R. J.; Toste,
12
moins négatif, mais une grande partie a décidé de réorienter leur secteur d’activité, par exemple dans le développement d’outils organofluorés pour le domaine pharmaceutique.
Différents réactifs ont été élaborés pour la création d’un lien C-F dans des conditions plus douces que celles utilisant l’acide fluorhydrique. Ils permettent d’effectuer des réactions de fluoration nucléophile, comme la SN2 ou la déoxofluoration, de fluoration électrophile ou de
fluoration radicalaire (Tableau I.3).21,25
Tableau I.3. Exemples de réactifs de fluoration.24c,k
Fluoration nucléophile Fluoration électrophile Fluoration radicalaire SN2 Déoxofluoration NaF KF CsF DAST NFSI XeF2 (nBu) 4NF (TBAF) (Me)4NF (TMAF) Deoxo-Fluor ® Selectfluor® NFSI Selectfluor®
13
Motif d’intérêt : le monofluoroalcène
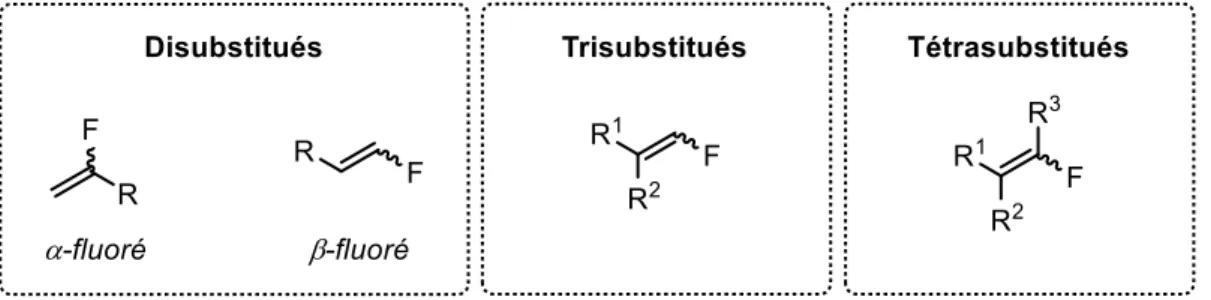
Parmi les différents motifs fluorés, le monofluoroalcène montre des caractéristiques intéressantes. Les monofluoroalcènes peuvent être utilisés comme synthons en synthèse organique,26 en plus de présenter une importance en chimie médicinale (Figure I.8).27
Figure I.8. Monofluoroalcène : synthon26a et chimie médicinale27b.
26 Exemples sélectionnés de monofluoroalcènes comme synthons : (a) Koh, M. J.; Nguyen, T. T.; Zhang, H.;
Schrock, R. R.; Hoveyda, A. H. Nature (London) 2016, 531, 459; (b) Nguyen, T. T.; Koh, M. J.; Shen, X.; Romiti, F.; Schrock, R. R.; Hoveyda, A. H. Science (Washington, D. C.) 2016, 352, 569; (c) Rousée, K.; Schneider, C.; Bouillon, J.-P.; Levacher, V.; Hoarau, C.; Couve-Bonnaire, S.; Pannecoucke, X. Org. Biomol.
Chem. 2016, 14, 353.
27 Exemples sélectionnés de l’utilisation du monofluoroalcène en chimie médicinale : (a) Sciotti, R. J.;
Pliushchev, M.; Wiedeman, P. E.; Balli, D.; Flamm, R.; Nilius, A. M.; Marsh, K.; Stolarik, D.; Jolly, R.; Ulrich, R.; Djuric, S. W. Bioorg. Med. Chem. Lett. 2002, 12, 2121; (b) Asahina, Y.; Iwase, K.; Iinuma, F.; Hosaka, M.; Shizaki, T. J. Med. Chem. 2005, 48, 3194; (c) Huleatt, P. B.; Khoo, M. L.; Chua, Y. Y.; Tan, T. W.; Liew, R. S.; Balogh, B.; Deme, R.; Gölöncsér, F.; Magyar, K.; Sheela, D. P.; Ho, H. K.; Sperlágh, B.; Mátyus, P.; Chai, C. L. L. J. Med. Chem. 2015, 58, 1400; (d) Cheng, J.; Giguère, P. M.; Onajole, O. K.; Lv, W.; Gaisin, A.; Gunosewoyo, H.; Schmerberg, C. M.; Pogorelov, V. M.; Rodriguiz, R. M.; Vistoli, G.; Wetsel, W. C.; Roth, B. L.; Kozikowski, A. P. J. Med. Chem. 2015, 58, 1992; (e) Hohlfeld, K.; Wegner, J. K.; Kesteleyn, B.; Linclau, B.; Unge, J. J. Med. Chem. 2015, 58, 4029.
14
Le monofluoroalcène peut être utilisé comme mime de l’énol.28 Il peut aussi mimer un amide,
ce qui en fait un isostère non hydrolysable de la liaison peptidique (Figure I.9).29,30,31
Figure I.9. Exemples d’isostères de liaisons peptidiques.
Le monofluoroalcène reproduit bien les différentes caractéristiques de l’amide (Figure I.10). D’un point de vue géométrique, les deux motifs se ressemblent. L’amide contient un lien C-N ayant un caractère de double liaison par résonance et qui a une longueur de 1,368 Å, ainsi qu’un lien double C=O de 1,228 Å. Pour sa part, le monofluoroalcène contient une liaison double C=C de 1,333 Å et un lien simple C-F de 1,376 Å.29,32 D’un point de vue électronique,
l’oxygène de l’amide attire les électrons jusqu’à porter une charge négative dans la forme limite de résonance, ce qui donne un moment dipolaire (μ) de 3,6 D pointant vers l’oxygène. Pour le monofluoroalcène, le fluor possède une charge partielle négative, avec un moment dipolaire de 1,4 D pointant vers le fluor.30 De plus, lorsqu’un amide est remplacé par un
monofluoroalcène dans une séquence peptidique, il est important de pouvoir conserver la
28 Choi, W. J.; Chung, H.-J.; Chandra, G.; Alexander, V.; Zhao, L. X.; Lee, H. W.; Nayak, A.; Majik, M. S.;
Kim, H. O.; Kim, J.-H.; Lee, Y. B.; Ahn, C. H.; Lee, S. K.; Jeong, L. S. J. Med. Chem. 2012, 55, 4521.
29 Études théoriques du monofluoroalcène comme isostère de liaison peptidique : (a) Abraham, R. J.; Ellison,
S. L. R.; Schonholzer, P.; Thomas, W. A. Tetrahedron 1986, 42, 2101; (b) Urban, J. J.; Tillman, B. G.; Cronin, W. A. J. Phys. Chem. A 2006, 110, 11120; (c) McKinney, B. E.; Urban, J. J. J. Phys Chem. A 2010, 114, 1123.
30 Choudhary, A.; Raines, R. T. ChemBioChem 2011, 12, 1801.
31 Revues de la littérature sur le monofluoroalcène comme isostère de liaison peptidique : (a) Taguchi, T.; Yanai,
H. Fluorinated Moieties for Replacement of Amide and Peptide Bonds. Dans Fluorine in Medicinal Chemistry
and Chemical Biology, Éd. Ojima, I. : Blackwell Publishing Inc., 2009, 257-290; (b) Drouin, M.; Paquin, J.-F. Beilstein J. Org. Chem. 2017, 13, 2637.
32 Taguchi, T.; Yanai, H. Introduction: Basic Aspects of Fluorine in Chemistry and Biology. Dans Fluorine in
15
structure secondaire, donc la capacité de donner des liaisons hydrogène, comme avec le N-H de l’amide, et d’en accepter, comme avec le C=O de l’amide. Le monofluoroalcène est un accepteur faible de liaisons hydrogène, ce qui laisse présumer que sa présence n’entraînera pas trop de perturbations.29a
Figure I.10. Comparaison de l’amide et du monofluoroalcène. Les cartes de densité électronique sont tirées de la réf. 32.
16
Dans la nature, les liaisons peptidiques se retrouvent dans un équilibre entre la forme s-trans, qui est majoritaire,33 et la forme s-cis.34 Le seul exemple où l’isomère s-cis est favorisé est la
proline.35 Avec le monofluoroalcène, il est possible de venir mimer sélectivement, et sans
équilibre, l’une des deux formes. Finalement, le remplacement d’une liaison peptidique par un monofluoroalcène peut améliorer la stabilité métabolique d’un peptide, comme il n’est pas sensible au métabolisme hydrolytique.32
Différents mutants peptidiques comportant un monofluoroalcène dans leur séquence ont été synthétisés et leur activité biologique a pu être étudiée et comparée aux peptides naturels comportant l’amide ou encore un autre isostère de liaison peptidique (Figure I.11).31
Figure I.11. Exemples de peptides comportant un monofluoroalcène.
Par exemple, le groupe de Altman s’est intéressé à la modification de la Leu-enképhaline, un pentapeptide reconnu pour ses propriétés analgésiques.36 L’isostère de dipeptide
Try-Ψ[(Z)-CF=CH]-Gly a été synthétisé et incorporé dans la séquence. L’activité agoniste du peptide fluoré a été mesurée à l’aide de la concentration efficace médiane (EC50) sur le récepteur
opioïde DOPr. Même si le peptide fluoré présentait une activité intéressante (5 ± 2 nM), elle
33 Ramachandra, G. N.; Sasisekharan, V. Adv. Protein Chem. 1968, 23, 283.
34 Joseph, A. P.; Srinivasan, N.; de Brevern, A. G. Amino Acids 2012, 43, 1369.
35 Ramachandra, G. N.; Mitra, A. K. J. Mol. Biol. 1976, 107, 85.