ﺎﻨﺘﻤﻠﻋ ﺎﻣ ﻻﺇ ﺎﻨﻟ ﻢﻠﻋ ﻻ ﻚﻧﺎﺤﺒﺳ
ﺍ ﻢﻴﻠﻌﻟﺍ ﺖﻧﺃ ﻚﻧﺇ
ﻢﻴﻜﳊ
ﺔﻳﻵﺍ :ﺓﺮﻘﺒﻟﺍ ﺓﺭﻮﺳ
31
DOYENS HONORAIRES :
1962 – 1969 : Professeur Abdelmalek FARAJ 1969 – 1974 : Professeur Abdellatif BERBICH
1974 – 1981 : Professeur Bachir LAZRAK 1981 – 1989 : Professeur Taieb CHKILI 1989 – 1997 : Professeur Mohamed Tahar ALAOUI 1997 – 2003 : Professeur Abdelmajid BELMAHI 2003 – 2013 : Professeur Najia HAJJAJ – HASSOUNI
ADMINISTRATION : Doyen
Professeur Mohamed ADNAOUI
Vice Doyen chargé des Affaires Académiques et estudiantines Professeur Brahim LEKEHAL
Vice Doyen chargé de la Recherche et de la Coopération Professeur Taoufiq DAKKA
Vice Doyen chargé des Affaires Spécifiques à la Pharmacie UNIVERSITE MOHAMMED V
1-
ENSEIGNANTS-CHERCHEURS MEDECINS ET PHARMACIENS
PROFESSEURS :Décembre 1984
Pr. MAAOUNI Abdelaziz Médecine Interne - Clinique Royale Pr. MAAZOUZI Ahmed Wajdi Anesthésie-Réanimation
Pr. SETTAF Abdellatif pathologie Chirurgicale
Novembre et Décembre 1985
Pr. BENSAID Younes Pathologie Chirurgicale
Janvier, Février et Décembre 1987
Pr. LACHKAR Hassan Médecine Interne
Pr. YAHYAOUI Mohamed Neurologie
Décembre 1989
Pr. ADNAOUI Mohamed Médecine Interne - Doyen de la FMPR Pr. OUAZZANI Taïbi Mohamed Réda Neurologie
Janvier et Novembre 1990
Pr. HACHIM Mohammed* Médecine Interne
Pr. KHARBACH Aîcha Gynécologie-Obstétrique
Pr. TAZI Saoud Anas Anesthésie-Réanimation
Février Avril Juillet et Décembre 1991
Pr. AZZOUZI Abderrahim Anesthésie-Réanimation - Doyen de la FMPO
Pr. BAYAHIA Rabéa Néphrologie
Pr. BELKOUCHI Abdelkader Chirurgie Générale Pr. BENCHEKROUN Belabbes Abdellatif Chirurgie Générale
Pr. BENSOUDA Yahia Pharmacie Galénique
Pr. BERRAHO Amina Ophtalmologie
Pr. BEZZAD Rachid Gynécologie-ObstétriqueMéd Chef Maternité des Orangers
Pr. CHERRAH Yahia Pharmacologie
Pr. CHOKAIRI Omar Histologie-Embryologie
Pr. KHATTAB Mohamed Pédiatrie
Pr. SOULAYMANI Rachida Pharmacologie - Dir. du Centre National PV Rabat Pr. TAOUFIK Jamal Chimie Thérapeutique V.D à la pharmacie+Dir du CEDOC+Directeur du Médicament
Décembre 1992
Pr. AHALLAT Mohamed Chirurgie Générale - Doyen de FMPT
Pr. BENSOUDA Adil Anesthésie-Réanimation
Pr. CHAHED OUAZZANI Laaziza Gastro-Entérologie
Pr. CHRAIBI Chafiq Gynécologie-Obstétrique
Pr. EL OUAHABI Abdessamad Neurochirurgie
Pr. FELLAT Rokaya Cardiologie
Pr. GHAFIR Driss* Médecine Interne
Pr. TAGHY Ahmed Chirurgie Générale
Pr. ZOUHDI Mimoun Microbiologie
Mars 1994
Pr. BENJAAFAR Noureddine Radiothérapie
Pr. BEN RAIS Nozha Biophysique
Pr. CAOUI Malika Biophysique
Pr. CHRAIBI Abdelmjid Endocrinologie et Maladies Métaboliques Doyen de la FMPA
Pr. EL AMRANI Sabah Gynécologie-Obstétrique
Pr. EL BARDOUNI Ahmed Traumato-Orthopédie
Pr. EL HASSANI My Rachid Radiologie
Pr. ERROUGANI Abdelkader Chirurgie Générale - Directeur CHIS -Rabat
Pr. ESSAKALI Malika Immunologie
Pr. ETTAYEBI Fouad Chirurgie Pédiatrique
Pr. HASSAM Badredine Dermatologie
Pr. IFRINE Lahssan Chirurgie Générale
Pr. MAHFOUD Mustapha Traumatologie-Orthopédie
Pr. RHRAB Brahim Gynécologie-Obstétrique
Pr. SENOUCI Karima Dermatologie
Mars 1994
Pr. ABBAR Mohamed* Urologie - Directeur Hôpital My Ismail Meknès Pr. ABDELHAK M’barek Chirurgie Pédiatrique
Pr. BENTAHILA Abdelali Pédiatrie
Pr. BENYAHIA Mohammed Ali Gynécologie-Obstétrique Pr. BERRADA Mohamed Saleh Traumatologie-Orthopédie Pr. CHERKAOUI Lalla Ouafae Ophtalmologie
Pr. LAKHDAR Amina Gynécologie-Obstétrique
Pr. MOUANE Nezha Pédiatrie
Mars 1995
Pr. ABOUQUAL Redouane Réanimation Médicale
Pr. AMRAOUI Mohamed Chirurgie Générale
Pr. BAIDADA Abdelaziz Gynécologie-Obstétrique
Pr. BARGACH Samir Gynécologie-Obstétrique
Pr. DRISSI KAMILI Med Nordine* Anesthésie-Réanimation
Pr. ZBIR EL Mehdi* Cardiologie - Directeur Hôp. Mil.d’Instruction Med V Rabat
Novembre 1997
Pr. ALAMI Mohamed Hassan Gynécologie-Obstétrique
Pr. BEN SLIMANE Lounis Urologie
Pr. BIROUK Nazha Neurologie
Pr. ERREIMI Naima Pédiatrie
Pr. FELLAT Nadia Cardiologie
Pr. KADDOURI Noureddine Chirurgie Pédiatrique
Pr. KOUTANI Abdellatif Urologie
Pr. LAHLOU Mohamed Khalid Chirurgie Générale
Pr. MAHRAOUI CHAFIQ Pédiatrie
Pr. TAOUFIQ Jallal Psychiatrie - Directeur Hôp. Arrazi Salé Pr. YOUSFI MALKI Mounia Gynécologie-Obstétrique
Novembre 1998
Pr. BENOMAR ALI Neurologie - Doyen de la FMP Abulcassis
Pr. BOUGTAB Abdesslam Chirurgie Générale
Pr. ER RIHANI Hassan Oncologie Médicale
Pr. BENKIRANE Majid* Hématologie
Janvier 2000
Pr. ABID Ahmed* Pneumo-Phtisiologie
Pr. AIT OUMAR Hassan Pédiatrie
Pr. BENJELLOUN Dakhama Badr.Sououd Pédiatrie
Pr. BOURKADI Jamal-Eddine Pneumo-Phtisiologie - Directeur Hôp. My Youssef Pr. CHARIF CHEFCHAOUNI Al Montacer Chirurgie Générale
Pr. ECHARRAB El Mahjoub Chirurgie Générale Pr. EL FTOUH Mustapha Pneumo-Phtisiologie Pr. EL MOSTARCHID Brahim* Neurochirurgie
Pr. MAHMOUDI Abdelkrim* Anesthésie-Réanimation
Pr. TACHINANTE Rajae Anesthésie-Réanimation
Pr. TAZI MEZALEK Zoubida Médecine Interne
Novembre 2000
Pr. AIDI Saadia Neurologie
Pr. AJANA Fatima Zohra Gastro-Entérologie
Pr. BENAMR Said Chirurgie Générale
Pr. CHERTI Mohammed Cardiologie
Pr. ECH-CHERIF EL KETTANI Selma Anesthésie-Réanimation
Pr. EL HASSANI Amine Pédiatrie - Directeur Hôp. Chekikh Zaied
Pr. EL KHADER Khalid Urologie
Pr. EL MAGHRAOUI Abdellah* Rhumatologie
Pr. GHARBI Mohamed El Hassan Endocrinologie et Maladies Métaboliques Pr. MDAGHRI ALAOUI Asmae Pédiatrie
Pr. ROUIMI Abdelhadi* Neurologie
Décembre 2000
Pr. ZOHAIR ABDELAH* ORL
Décembre 2001
Pr. BALKHI Hicham* Anesthésie-Réanimation
Pr. BENAMAR Loubna Néphrologie
Pr. BENAMOR Jouda Pneumo-Phtisiologie
Pr. BENELBARHDADI Imane Gastro-Entérologie
Pr. BENNANI Rajae Cardiologie
Pr. BENOUACHANE Thami Pédiatrie
Pr. BEZZA Ahmed* Rhumatologie
Pr. BOUCHIKHI IDRISSI Med Larbi Anatomie
Pr. BOUMDIN El Hassane* Radiologie
Pr. CHAT Latifa Radiologie
Pr. DAALI Mustapha* Chirurgie Générale
Pr. DRISSI Sidi Mourad* Radiologie
Pr. EL HIJRI Ahmed Anesthésie-Réanimation
Pr. EL MAAQILI Moulay Rachid Neuro-Chirurgie Pr. EL MADHI Tarik Chirurgie-Pédiatrique
Pr. EL OUNANI Mohamed Chirurgie Générale
Pr. ETTAIR Said Pédiatrie - Directeur. Hôp.d’Enfants Rabat
Pr. GAZZAZ Miloudi* Neuro-Chirurgie
Pr. HRORA Abdelmalek Chirurgie Générale
Pr. KABBAJ Saad Anesthésie-Réanimation
Pr. KABIRI EL Hassane* Chirurgie Thoracique Pr. LAMRANI Moulay Omar Traumatologie-Orthopédie Pr. LEKEHAL Brahim Chirurgie Vasculaire Périphérique Pr. MAHASSIN Fattouma* Médecine Interne
Pr. MEDARHRI Jalil Chirurgie Générale
Pr. MIKDAME Mohammed* Hématologie Clinique
Pr. MOHSINE Raouf Chirurgie Générale
Pr. NOUINI Yassine Urologie - Directeur Hôpital Ibn Sina
Pr. SABBAH Farid Chirurgie Générale
Pr. SEFIANI Yasser Chirurgie Vasculaire Périphérique Pr. TAOUFIQ BENCHEKROUN Soumia Pédiatrie
Décembre 2002
Pr. AL BOUZIDI Abderrahmane* Anatomie Pathologique
Pr. AMEUR Ahmed * Urologie
Pr. JAAFAR Abdeloihab* Traumatologie-Orthopédie
Pr. KRIOUILE Yamina Pédiatrie
Pr. MABROUK Hfid* Traumatologie-Orthopédie
Pr. MOUSSAOUI RAHALI Driss* Gynécologie-Obstétrique Pr. OUJILAL Abdelilah Oto-Rhino-Laryngologie Pr. RACHID Khalid * Traumatologie-Orthopédie
Pr. RAISS Mohamed Chirurgie Générale
Pr. RGUIBI IDRISSI Sidi Mustapha* Pneumo-phtisiologie
Pr. RHOU Hakima Néphrologie
Pr. SIAH Samir * Anesthésie-Réanimation
Pr. THIMOU Amal Pédiatrie
Pr. ZENTAR Aziz* Chirurgie Générale
Janvier 2004
Pr. ABDELLAH El Hassan Ophtalmologie
Pr. AMRANI Mariam Anatomie Pathologique
Pr. BENBOUZID Mohammed Anas Oto-Rhino-Laryngologie
Pr. BENKIRANE Ahmed* Gastro-Entérologie
Pr. BOUGHALEM Mohamed* Anesthésie-Réanimation
Pr. BOULAADAS Malik Stomatologie et Chirurgie Maxillo-Faciale
Pr. BOURAZZA Ahmed* Neurologie
Pr. CHAGAR Belkacem* Traumatologie-Orthopédie
Pr. CHERRADI Nadia Anatomie Pathologique
Pr. EL FENNI Jamal* Radiologie
Pr. EL HANCHI ZAKI Gynécologie-Obstétrique
Pr. EL KHORASSANI Mohamed Pédiatrie Pr. EL YOUNASSI Badreddine* Cardiologie
Pr. HACHI Hafid Chirurgie Générale
Pr. JABOUIRIK Fatima Pédiatrie
Pr. KHARMAZ Mohamed Traumatologie-Orthopédie
Pr. MOUGHIL Said Chirurgie Cardio-Vasculaire
Pr. OUBAAZ Abdelbarre* Ophtalmologie
Pr. TARIB Abdelilah* Pharmacie Clinique
Pr. TIJAMI Fouad Chirurgie Générale
Pr. ZARZUR Jamila Cardiologie
Janvier 2005
Pr. ABBASSI Abdellah Chirurgie Réparatrice et Plastique Pr. AL KANDRY Sif Eddine* Chirurgie Générale
Pr. ALLALI Fadoua Rhumatologie
Pr. AMAZOUZI Abdellah Ophtalmologie
Pr. AZIZ Noureddine* Radiologie
Pr. BAHIRI Rachid Rhumatologie - Directeur. Hôp. Al Ayachi Salé
Pr. BARKAT Amina Pédiatrie
Pr. BENYASS Aatif Cardiologie
Pr. DOUDOUH Abderrahim* Biophysique Pr. EL HAMZAOUI Sakina* Microbiologie
Pr. HAJJI Leila Cardiologie (mise en disponibilité)
Pr. HESSISSEN Leila Pédiatrie
Pr. LAAROUSSI Mohamed Chirurgie Cardio-Vasculaire
Pr. LYAGOUBI Mohammed Parasitologie
Pr. RAGALA Abdelhak Gynécologie-Obstétrique
Pr. SBIHI Souad Histo-Embryologie-Cytogénétique
Pr. ZERAIDI Najia Gynécologie-Obstétrique
Avril 2006
Pr. ACHEMLAL Lahsen* Rhumatologie
Pr. AKJOUJ Said* Radiologie
Pr. BELMEKKI Abdelkader* Hématologie
Pr. BENCHEIKH Razika O.R.L
Pr. BIYI Abdelhamid* Biophysique
Pr. BOUHAFS Mohamed El Amine Chirurgie Pédiatrique Pr. BOULAHYA Abdellatif* Chirurgie Cardio-Vasculaire Pr. CHENGUETI ANSARI Anas Gynécologie-Obstétrique
Pr. DOGHMI Nawal Cardiologie
Pr. FELLAT Ibtissam Cardiologie
Pr. FAROUDY Mamoun Anesthésie-Réanimation
Pr. HARMOUCHE Hicham Médecine Interne
Pr. HANAFI Sidi Mohamed* Anesthésie-Réanimation Pr. IDRISS LAHLOU Amine* Microbiologie
Pr. JROUNDI Laila Radiologie
Pr. KARMOUNI Tariq Urologie
Pr. KILI Amina Pédiatrie
Pr. KISRA Hassan Psychiatrie
Pr. KISRA Mounir Chirurgie Pédiatrique
Pr. LAATIRIS Abdelkader* Pharmacie Galénique Pr. LMIMOUNI Badreddine* Parasitologie
Pr. MANSOURI Hamid* Radiothérapie
Pr. OUANASS Abderrazzak Psychiatrie
Pr. SAFI Soumaya* Endocrinologie
Pr. SEKKAT Fatima Zahra Psychiatrie
Pr. SOUALHI Mouna Pneumo-Phtisiologie
Pr. TELLAL Saida* Biochimie
Pr. EHIRCHIOU Abdelkader* Chirurgie Générale
Pr. EL BEKKALI Youssef * Chirurgie Cardio-Vasculaire
Pr. ELABSI Mohamed Chirurgie Générale
Pr. EL MOUSSAOUI Rachid Anesthésie-Réanimation
Pr. EL OMARI Fatima Psychiatrie
Pr. GHARIB Noureddine Chirurgie Plastique et Réparatrice
Pr. HADADI Khalid* Radiothérapie
Pr. ICHOU Mohamed* Oncologie Médicale
Pr. ISMAILI Nadia Dermatologie
Pr. KEBDANI Tayeb Radiothérapie
Pr. LALAOUI SALIM Jaafar* Anesthésie-Réanimation
Pr. LOUZI Lhoussain* Microbiologie
Pr. MADANI Naoufel Réanimation Médicale
Pr. MAHI Mohamed* Radiologie
Pr. MARC Karima Pneumo-Phtisiologie
Pr. MASRAR Azlarab Hématologie Biologique
Pr. MRANI Saad* Virologie
Pr. OUZZIF Ez zohra* Biochimie-Chimie
Pr. RABHI Monsef* Médecine Interne
Pr. RADOUANE Bouchaib* Radiologie
Pr. SEFFAR Myriame Microbiologie
Pr. SEKHSOKH Yessine* Microbiologie
Pr. SIFAT Hassan* Radiothérapie
Pr. TABERKANET Mustafa* Chirurgie Vasculaire Périphérique
Pr. TACHFOUTI Samira Ophtalmologie
Pr. TAJDINE Mohammed Tariq* Chirurgie Générale
Pr. TANANE Mansour* Traumatologie-Orthopédie
Pr. TLIGUI Houssain Parasitologie
Pr. TOUATI Zakia Cardiologie
Décembre 2008
Pr TAHIRI My El Hassan* Chirurgie Générale
Mars 2009
Pr. ABOUZAHIR Ali* Médecine Interne
Pr. AGDR Aomar* Pédiatre
Pr. AIT ALI Abdelmounaim* Chirurgie Générale Pr. AIT BENHADDOU El hachmia Neurologie
Pr. AKHADDAR Ali* Neuro-Chirurgie
Pr. ALLALI Nazik Radiologie
Pr. AMINE Bouchra Rhumatologie
Pr. ARKHA Yassir Neuro-Chirurgie - Directeur Hôp.des Spécialités Pr. BELYAMANI Lahcen* Anesthésie-Réanimation
Pr. BJIJOU Younes Anatomie
Pr. BOUHSAIN Sanae* Biochimie-Chimie
Pr. BOUI Mohammed* Dermatologie
Pr. BOUNAIM Ahmed* Chirurgie Générale
Pr. BOUSSOUGA Mostapha* Traumatologie-Orthopédie Pr. CHTATA Hassan Toufik* Chirurgie Vasculaire Périphérique
Pr. DOGHMI Kamal* Hématologie Clinique Pr. EL MALKI Hadj Omar Chirurgie Générale Pr. EL OUENNASS Mostapha* Microbiologie
Pr. ENNIBI Khalid* Médecine Interne
Pr. FATHI Khalid Gynécologie-Obstétrique
Pr. HASSIKOU Hasna * Rhumatologie
Pr. KABBAJ Nawal Gastro-Entérologie
Pr. KABIRI Meryem Pédiatrie
Pr. KARBOUBI Lamya Pédiatrie
Pr. LAMSAOURI Jamal* Chimie Thérapeutique
Pr. MARMADE Lahcen Chirurgie Cardio-Vasculaire
Pr. MESKINI Toufik Pédiatrie
Pr. MESSAOUDI Nezha * Hématologie Biologique
Pr. MSSROURI Rahal Chirurgie Générale
Pr. NASSAR Ittimade Radiologie
Pr. OUKERRAJ Latifa Cardiologie
Pr. RHORFI Ismail Abderrahmani * Pneumo-Phtisiologie
Octobre 2010
Pr. ALILOU Mustapha Anesthésie-Réanimation
Pr. AMEZIANE Taoufiq* Médecine Interne
Pr. BELAGUID Abdelaziz Physiologie
Pr. CHADLI Mariama* Microbiologie
Pr. CHEMSI Mohamed* Médecine Aéronautique
Pr. DAMI Abdellah* Biochimie-Chimie
Pr. DARBI Abdellatif* Radiologie
Pr. DENDANE Mohammed Anouar Chirurgie Pédiatrique
Pr. EL HAFIDI Naima Pédiatrie
Pr. EL KHARRAS Abdennasser* Radiologie
Pr. EL MAZOUZ Samir Chirurgie Plastique et Réparatrice
Pr. EL SAYEGH Hachem Urologie
Pr. ERRABIH Ikram Gastro-Entérologie
Pr. LAMALMI Najat Anatomie Pathologique
Pr. MOSADIK Ahlam Anesthésie-Réanimation
Pr. JAHID Ahmed Anatomie Pathologique
Pr. MEHSSANI Jamal* Psychiatrie
Pr. RAISSOUNI Maha* Cardiologie
*Enseignants Militaires
Février 2013
Pr. AHID Samir Pharmacologie-Chimie
Pr. AIT EL CADI Mina Toxicologie
Pr. AMRANI HANCHI Laila Gastro-Entérologie
Pr. AMOUR Mourad Anesthésie-Réanimation
Pr. AWAB Almahdi Anesthésie-Réanimation
Pr. BELAYACHI Jihane Réanimation Médicale
Pr. BELKHADIR Zakaria Houssain Anesthésie-Réanimation
Pr. BENCHEKROUN Laila Biochimie-Chimie
Pr. BENKIRANE Souad Hématologie Biologique
Pr. BENNANA Ahmed* Informatique Pharmaceutique
Pr. BENSGHIR Mustapha* Anesthésie-Réanimation Pr. BENYAHIA Mohammed* Néphrologie
Pr. BOUATIA Mustapha Chimie Analytique et Bromatologie Pr. BOUABID Ahmed Salim* Traumatologie-Orthopédie
Pr. BOUTARBOUCH Mahjouba Anatomie
Pr. CHAIB Ali* Cardiologie
Pr. DENDANE Tarek Réanimation Médicale
Pr. DINI Nouzha* Pédiatrie
Pr. ECH-CHERIF EL KETTANI Mohamed Ali Anesthésie-Réanimation Pr. ECH-CHERIF EL KETTANI Najwa Radiologie
Pr. ELFATEMI Nizare Neuro-Chirurgie
Pr. EL GUERROUJ Hasnae Médecine Nucléaire
Pr. EL HARTI Jaouad Chimie Thérapeutique
Pr. EL JOUDI Rachid* Toxicologie
Pr. EL KABABRI Maria Pédiatrie
Pr. EL KHANNOUSSI Basma Anatomie Pathologie
Pr. EL KHLOUFI Samir Anatomie
Pr. EL KORAICHI Alae Anesthésie-Réanimation
Pr. EN-NOUALI Hassane* Radiologie
Pr. ERRGUIG Laila Physiologie
Pr. FIKRI Meryim Radiologie
Pr. GHFIR Imade Médecine Nucléaire
Pr. IMANE Zineb Pédiatrie
Pr. IRAQI Hind Endocrinologie et Maladies Métaboliques
Pr. KABBAJ Hakima Microbiologie
Pr. KADIRI Mohamed* Psychiatrie
Pr. LATIB Rachida Radiologie
Pr. MAAMAR Mouna Fatima Zahra Médecine Interne
Pr. MEDDAH Bouchra Pharmacologie
Pr. MELHAOUI Adyl Neuro-Chirurgie
Pr. MRABTI Hind Oncologie Médicale
Pr. OUBEJJA Houda Chirurgie Pédiatrique
Pr. OUKABLI Mohamed* Anatomie Pathologique
Pr. RAHALI Younes Pharmacie Galénique
Pr. RATBI Ilham Génétique
Pr. RAHMANI Mounia Neurologie
Pr. REDA Karim* Ophtalmologie
Pr. REGRAGUI Wafa Neurologie
Pr. RKAIN Hanan Physiologie
Pr. ROSTOM Samira Rhumatologie
Pr. ROUAS Lamiaa Anatomie Pathologique
Pr. ROUIBAA Fedoua* Gastro-Entérologie
Pr. SALIHOUN Mouna Gastro-Entérologie
Pr. SAYAH Rochde Chirurgie Cardio-Vasculaire
Pr. SEDDIK Hassan* Gastro-Entérologie
Pr. ZERHOUNI Hicham Chirurgie Pédiatrique
Pr. ZINE Ali* Traumatologie-Orthopédie
Avril 2013
Pr. EL KHATIB Mohamed Karim* Stomatologie et Chirurgie Maxillo-Faciale
MAI 2013
Pr. BOUSLIMAN Yassir Toxicologie
MARS 2014
Pr. ACHIR Abdellah Chirurgie Thoracique Pr. BENCHAKROUN Mohammed * Traumatologie-Orthopédie Pr. BOUCHIKH Mohammed Chirurgie Thoracique
Pr. EL KABBAJ Driss * Néphrologie
Pr. EL MACHTANI IDRISSI Samira * Biochimie-Chimie
Pr. HARDIZI Houyam Histologie-Embryologie-Cytogénétique
Pr. HASSANI Amale * Pédiatrie
Pr. HERRAK Laila Pneumologie
PROFESSEURS AGREGES : DECEMBRE 2014
Pr. ABILKASSEM Rachid* Pédiatrie
Pr. AIT BOUGHIMA Fadila Médecine Légale Pr. BEKKALI Hicham * Anesthésie-Réanimation Pr. BENAZZOU Salma Chirurgie Maxillo-Faciale Pr. BOUABDELLAH Mounya Biochimie-Chimie Pr. BOUCHRIK Mourad* Parasitologie Pr. DERRAJI Soufiane* Pharmacie Clinique Pr. DOBLALI Taoufik* Microbiologie Pr. EL AYOUBI EL IDRISSI Ali Anatomie
Pr. EL GHADBANE Abdedaim Hatim* Anesthésie-Réanimation Pr. EL MARJANY Mohammed* Radiothérapie
Pr. FEJJAL Nawfal Chirurgie Réparatrice et Plastique
Pr. JAHIDI Mohamed* O.R.L
Pr. LAKHAL Zouhair* Cardiologie
Pr. OUDGHIRI Nezha Anesthésie-Réanimation Pr. RAMI Mohamed Chirurgie Pédiatrique
Pr. SABIR Maria Psychiatrie
Pr. SBAI IDRISSI Karim* Médecine Préventive, Santé Publique et Hyg.
AOUT 2015
Pr. MEZIANE Meryem Dermatologie
Pr. TAHRI Latifa Rhumatologie
JANVIER 2016
Pr. BENKABBOU Amine Chirurgie Générale
Pr. EL ASRI Fouad* Ophtalmologie
Pr. ERRAMI Noureddine* O.R.L
Pr. NITASSI Sophia O.R.L
JUIN 2017
Pr. ABI Rachid* Microbiologie
Pr. ASFALOU Ilyasse* Cardiologie
Pr. BOUAYTI El Arbi* Médecine Préventive, Santé Publique et Hyg.
Pr. BOUTAYEB Saber Oncologie Médicale
Pr. EL GHISSASSI Ibrahim Oncologie Médicale
Pr. OURAINI Saloua* O.R.L
Pr. RAZINE Rachid Médecine Préventive, Santé Publique et Hyg. Pr. ZRARA Abdelhamid* Immunologie
2- ENSEIGNANTS – CHERCHEURS SCIENTIFIQUES
PROFESSEURS / PRs. HABILITES
Pr. ABOUDRAR Saadia Physiologie
Pr. ALAMI OUHABI Naima Biochimie-Chimie
Pr. ALAOUI Katim Pharmacologie
Pr. ALAOUI SLIMANI Lalla Naïma Histologie-Embryologie
Pr. ANSAR M’hammed Chimie Organique et Pharmacie Chimique
Pr. BARKIYOU Malika Histologie Embryologie
Pr. BOUHOUCHE Ahmed Génétique Humaine
Pr. BOUKLOUZE Abdelaziz Applications Pharmaceutiques Pr. CHAHED OUAZZANI Lalla Chadia Biochimie-Chimie
Pr. DAKKA Taoufiq Physiologie
Pr. FAOUZI Moulay El Abbes Pharmacologie
Pr. IBRAHIMI Azeddine Biologie Moléculaire/Biotechnologie Pr. KHANFRI Jamal Eddine Biologie
Pr. OULAD BOUYAHYA IDRISSI Med Chimie Organique Pr. REDHA Ahlam Chimie
Pr. TOUATI Driss Pharmacognosie Pr. ZAHIDI Ahmed Pharmacologie
Mise à jour le 10/10/2018 Khaled Abdellah
Après avoir rendu grâce à ALLAH le
Tout Puissant,
Le Miséricordieux, ainsi qu’à son prophète
Mohamed, paix et salut sur lui.
À MES CHERS PARENTS
AYT KASSOU AICHA ET BAHMA ZAID
Tous les mots du monde ne sauraient exprime
l’immense amour que je vous porte, ni la profonde gratitude
que je vous témoigne pour tous vos efforts, et vos sacrifices
que vous n’avez jamais cessé de consentir pour
mon instruction et mon bien-être.
C’est à travers vos encouragements que j’ai opté pour cette noble
profession, Je vous dédie ce travail et je vous remercie
pour tout ce que vous avez fait pour moi.
Puisse Dieu vous préserver et vous procurer sante, bonheur
et longue vie et faire en sorte que jamais je ne vous déçoive.
À
MES CHERS ET ADORABLE SOEUR S ET FRERES :
Latifa, Ikrame, Rida, Zakaria
Nous avons partagé les meilleurs et les plus agréables
moments, votre amour, énergie, joie et sourire ont été
pour moi le meilleur encouragement que je puisse avoir.
En témoignage de mon affection fraternelle, de ma profonde
tendresse et reconnaissance, J’espère que ma thèse
sera pour vous une source de fierté, je vous souhaite
À
MA FAMILLE PROCHE ET LOINTAINE
Merci pour vos encouragements et vos motivations,
Je vous dédie ce travail en témoignage de mon amour,
mon attachement, mon respect le plus profond
et mon affection la plus sincère.
À
MON MAITRE ET PRESIDENT DE THESE
Monsieur DAMI ABDELLAH
Professeur de biochimie
Malgré vos multiples obligations, vous avez accepté
de présider cette thèse.
Nous vous en sommes profondément reconnaissants
et nous vous remercions pour le grand honneur que vous nous faites.
Votre compétence, votre dynamisme, ainsi que vos qualités humaines
et Professionnelles exemplaires ont toujours suscité notre admiration.
Pour nous c’est un grand honneur de vous voir siégé
dans notre jury de thèse.
À
MON MAITRE ET RAPPORTEUR DE
THESE Monsieur le professeure
MASRAR AZLARAB
Chef de service d’hématologie biologie
Nous sommes Très Honoré De Vous avoir comme encadrant de notre
thèse, nous vous remercions pour la gentillesse et la spontanéité avec
lesquelles vous avez bien voulu diriger ce travail, nous avons
eu le grand plaisir de travailler sous votre direction, et trouvé
auprès de vous le conseiller et le guide qui nous a reçu en toute
À
MON MAITRE ET JUGE DE THESE
MADAME BENKIRANE SOUAD
Professeur d’hématologie biologique
Vous avez accepté de siéger parmi
Le jury de notre thèse.
Ce geste dénote non seulement de votre gentillesse
Mais surtout de votre souci du devoir
Envers vos étudiants.
Veuillez accepter Madame,
Notre profonde reconnaissance
Et
nos remerciements les plus sincères.
Soyez assuré que c’est une fierté pour nous de vous compté
Parmi les membres de notre jury.
À
MON MAITRE ET JUGE DE THESE
MADAME NAZIH MOUNA
Professeur d’hématologie biologique
Durant nos années d’études nous avons eu la chance
de vous avoir comme enseignante.
Nous avons ainsi pu apprécier la clarté et la précision
de l’enseignement que vous nous avez dispensé.
Avec tout le respect que nous vous devons, veuillez trouver ici,
L’expression de notre profond respect et nos vifs remerciements.
À
MON MAITRE ET JUGE DE THESE
MONSIEUR JEAIDI ANASS
Professeur d’hématologie biologique
Nous vous remercions monsieur le professeur pour avoir accepté
de juger ce travail, c’est un grand honneur pour nous.
Avec tout le respect que nous vous devons, veuillez trouver ici,
L’expression de notre profond respect et nos
vifs remerciements.
Soyez assuré que c’est une fierté pour nous de vous compté
Parmi les membres de notre jury.
À
MES AMIS DE la 29EME PROMOTION
J’aurais toujours à l’esprit le souvenir des agréables années
qu’on a mené ensembles, avec les inoubliables moments de joie et de
tristesse qu’on savait adroitement éluder en s’épaulant mutuellement.
Veuillez trouver dans ce travail l’expression de mon respect
le plus profond et mon affection la plus sincère.
Je vous souhaite, un avenir brillant, plein de succès,
de bonheur et de prospérité.
À
TOUTES LES PERSONNES QUI ONT PARTICIPÉ
DE PRES OU DE LOIN
À
L’ÉLABORATION DE CE TRAVAIL
ET À TOUS CEUX QUE J’AI
LISTE DES ABREVIATIONS
ABC : ATP-binding cassette ADH : Hormone antidiurétique ADN : Acide Désoxyribonucléique
Afssaps : l’Agence française de sécurité sanitaire des produits de santé ALA : Acide aminolevulinique
ALAD : Acide aminolévulinique Déshydratase ALAS : Acide aminolevulinique synthase AMM : Autorisation de mise sur le marché ANT : Adenine nucléotide translocator APS : Antipaludéens de Synthèse
ARNm : Acide Ribonucléique Messager BMP : Bone morphogenetic protein BR : La Bilirubine
BV : La biliverdine
CH (CPH) : Coproporphyrie Héréditaire CO : monoxyde de carbone
CPOX : Coproporphyrinogen oxidase CYP : Cytochrome P450
D cyt b(CYBRD1) : Cytochrome duodénal b EPO : Erythropoïétine
EPO : L’éosinophile peroxydase FECH : La ferrochélatase
FLVCR : récepteur félin virus leucémique fPC : familiale porphyrie cutané
FPN1 : Ferroportin-1
FPS : Facteur de Protection Solaire [(SPF) en anglais] G6PD : glucose-6-phosphate déshydrogénase
GMPc : Guanosine monophosphate cyclique GTP : Guanosine triphosphate
Hb A : Hémoglobine A
HCP : Heme carrier protein (protéine porteuse d’hème) HDL : High density lipoprotein
HFE : gène High Fe
HIF-1 : Hypoxia Inducible Factors HMB : Hydroxyméthylbilane.
HMBS : Hydroxyméthylbilane synthase HO : hème oxygénase
Hp : Haptoglobine
HSCT : Hematopoietic stem cell transplantation Hx : Hèmopexine
IDO : Indoleamine2 ,3-dioxygenase Ig : Immunoglobuline
IR : ischémie-reperfusion
IRC : insuffisance rénale chronique IRE : Iron responsive element IRP : Iron responsive Protein LDL : Low density lipoprotein LPO : La lactoperoxydase L-Trp : L- tryptophane MFRN1 : Mitoferrin-1 MPO : La myéloperoxydase
PHE : Porphyrie Hépatoérythrocytaire PKA : La protéine kinase A
PLP : Pyridoxal phosphate
PPDLX (PPELX, XLDPP, XLPP) : Protoporphyrie dominante liée à l’X. PPE : Protoporphyrie Erythropoïétique
PPIX : Protoporphyrine IX
PPIX-Zn : Protoporphyrine IX lié au zinc PPOX : Protoporphyrinogène-Oxydase PPS : produit de protection solaire PV : Porphyrie Variegata
SNP : single-nucleotide polymorphism sPC : sporadique porphyrie cutané TDO : Tryptophane 2,3-dioxygenase TfR : Récepteur à la transferrine TFRC1 : transferrin receptor-1 TLR4 : Toll Like Receptor 4 TPO : La peroxydase thyroïdienne UPg : Uroporphyrinogène
UPn : Uroporphyrine
UROD : Uroporphyrinogène Décarboxylase UROS : Uroporphyrinogène III Synthase UTR : Untranslated Transcribed Region VHC : Virus de l'Hépatite C
VIH : Virus de l'Immunodéficience Humaine
LISTE DES FIGURES
Figure 1: Hème, fluorescence des porphyrines et hémoprotéines ...5 Figure 2 : la toxicité de l’hème libre. ... 10 Figure 3 : Les mécanismes de protection contre l’hème libre. ... 12 Figure 4: la synthèse d’Hème chez les eucaryotes, ... 16 Figure 5: Régulation hépatique de la biosynthèse de l’hème et hémoprotéines . ... 18 Figure 6 : Régulation érythropoïétique de la biosynthèse de l’hème ... 19 Figure 7: mode d’action du système IRE-IRP. ... 21 Figure 8 : les principaux transporteurs d’hème et ses précurseurs. ... 23 Figure 9 :la voie de dégradation de l’hème dans les cellules de mammifères ... 26 Figure 10: cycle redox biliverdine/bilirubine. ... 28 Figure 11 : La voie de biosynthèse de l’hème et les aspects de sa régulation dans les
hépatocytes et la moelle osseuse. ... 29
Figure 12 : la structure de la peau. ... 35 Figure 13 : structure des porphyrines ... 37 Figure 14 : La voie de biosynthèse de l'hème, ainsi que les porphyries respectifs et des
substrats toxiques associés accumulés dans chaque maladie. ... 38
Figure 15 : Manifestations cliniques des porphyries cutanées tardives ... 47 Figure 16: Fragilité cutanée, microkystes, modification de la pigmentation et lésions
vésiculo-bulleuses (ampoules) des mains au cours d’une PV ... 61
Figure 17: étapes de décarboxylation de coproporphyrinogène III ... 64 Figure 18 : Arbre décisionnel. Explorations biologiques des porphyries cutanées, ... 67 Figure 19 : régulation de la biosynthèse de l’hème au niveau érythrocytaire ... 70 Figure 20: Aspect génétique de la PPE, ... 71 Figure 21 : les Manifestations cliniques de la protoporphyrie érythropoïétique PPE ... 74 Figure 22: Physiopathologie du syndrome photo-algique aigue observé dans la
protoporphyrie érythropoıétique ... 82
Figure 23: La voie de biosynthèse de l'hème à partir de hydroxyméthylbilan ... 87 Figure 24 : manifestation clinique de porphyrie érythropoïétique congénitale ……….. ... 90 Figure 25 : inclusions pourpre-violet en forme d'aiguille dans les globules rouges……. ... 91
LISTE DES TABLEAUX
Tableau 1: classification des porphyries ... 41
Tableau 2 : multifactorielle étiologies des PCT ... 51
Tableau 3 : les anomalies biochimiques majeures dans les
urines/selles/plasma/globules rouge durant la maladie biochimiquement active, ... 54 Tableau 4 : Médicaments induisant des pseudo-porphyries les plus souvent
incriminés. ... 55 Tableau 5 : Les effets du fer sur la PCT et les porphyries érythropoïétiques ... 84
SOMMAIRE
Introduction ... 1 La première partie: Le métabolisme de l'hème ... 3
1 L’hème ... 4 1.1 La définition ...4 1.2 Les types ...4 1.3 Les rôles ...6 1.4 La toxicité ...9 1.5 Contrôle de l’hème libre circulant ... 11 1.6 La biosynthèse de l’hème... 14 1.6.1 Les étapes de biosynthèse ... 14 1.6.2 La régulation de la biosynthèse ... 17 1.6.3 Les transporteurs de l’hème et précurseurs ... 22 1.6.4 La dégradation de l’hème ... 24 1.6.5 Le rôle antioxydant indirect de HO-1 ... 27 1.6.6 Rôle des produits de dégradation de l’hème ... 27
3.2 La définition des porphyries ... 37 3.3 La Classification des porphyries ... 39 3.4 Les porphyries cutanées ... 42 3.4.1 Généralités ... 42 3.4.2 La physiopathologie ... 42 3.5 Les porphyries bulleuses ... 44 3.5.1 Porphyries cutanées tardives ... 44 3.5.1.1 Généralités ... 44 3.5.1.2 La pathogénèse ... 45 3.5.1.3 La clinique ... 46 3.5.1.4 Les Facteurs de risque ... 48 3.5.1.5 Le diagnostic ... 52 3.5.1.6 Le diagnostic différentiel ... 52 3.5.1.7 Prévention et traitement ... 56 3.5.2 La porphyrie variegata(PV) ... 58 3.5.2.1 Généralités ... 58 3.5.2.2 La pathogénèse ... 59 3.5.2.3 La clinique ... 59 3.5.2.4 L’histopathologie ... 61 3.5.2.5 Les facteurs déclenchant ... 61 3.5.2.6 Le diagnostic ... 62 3.5.2.7 Le diagnostic différentiel ... 62 3.5.2.8 Prévention et traitement ... 62
3.5.3 Coproporphyrie héréditaire CPH ... 64 3.5.3.1 Généralités ... 64 3.5.3.2 La clinique ... 65 3.5.3.3 L’hardéroporphyrie ... 65 3.5.3.4 Le diagnostic ... 65 3.5.3.5 Le diagnostic différentiel ... 66 3.5.3.6 Prévention et traitement ... 66 3.6 Les porphyries photoalgiques : Porphyries aiguës douloureuses photosensibles ... 67 3.6.1 La protoporphyrie érythropoïétique PPE ... 68 3.6.1.1 Généralités ... 68 3.6.1.2 La pathogénèse ... 68 3.6.1.3 Le mode de transmission de la PPE ... 71 3.6.1.4 La clinique ... 73 3.6.1.5 L’histopathologie ... 75 3.6.1.6 Le diagnostic ... 76 3.6.1.7 Le diagnostic différentiel ... 76 3.6.1.8 Prévention et traitement ... 77
3.7 Porphyries récessives rares ... 83 3.7.1 La porphyrie érythropoïétique congénitale PEC ... 83 3.7.1.1 Généralités ... 83 3.7.1.2 La physiopathologie ... 85 3.7.1.3 La génétique ... 88 3.7.1.4 La clinique ... 88 3.7.1.5 L’histopathologie ... 91 3.7.1.6 Le diagnostic ... 92 3.7.1.7 Le diagnostic différentiel ... 92 3.7.1.8 Prévention et traitement ... 93 3.7.2 La porphyrie hépato-érythropoïétique PHE ... 93
La troisième partie: La photo-protection ... 95
4 Les mesures de photo-protection ... 96 4.1 La photoprotection naturelle ... 96 4.2 La photoprotection artificielle ... 97 4.2.1 La photoprotection externe ... 97 4.2.1.1 La photoprotection vestimentaire ... 97 4.2.1.2 Les produits de protection solaire (PPS) ... 97 4.2.2 La photoprotection active interne ... 98 5 Conseils simples avant de s’exposer au soleil ... 99
Conclusion ... 100 Résumés ... 102 Références ... 106
2
Les porphyries sont des maladies (anomalies) métabolique héréditaires ou acquises rares, ce sont des maladies liées chacune à une atteinte spécifique d’une des enzymes de la biosynthèse de l’hème. Ce déficit enzymatique entraîne l'accumulation et l'excrétion accrue des porphyrines et/ou de leurs précurseurs : ALA et PBG. Selon le lieu d’accumulation on les classe en deux catégories : les porphyries hépatiques (accumulation dans le foie) et les porphyries érythropoïétiques (accumulation dans la moelle osseuse).
La plupart du temps, la maladie ne présente aucun symptômes, jusqu’au moment où un facteur, tant exogène qu’endogène, les déclenche. S’ils existent ils sont généralement neuro-viscéraux aigus, des lésions cutanées ou leurs combinaison, ces symptômes sont la conséquence d’accumulation des précurseurs ou de porphyrines photosensibles dans les tissus, qui en excès passent à travers le sang vers la peau où ils deviennent photosensibles et s’éliminent dans l’urines ou les selles.
Le diagnostic de ces porphyries est difficile vu la symptomatologie qui se ressemble entre elles et avec d’autre maladies, le diagnostic de certitude repose sur le dosage des porphyrines dans les milieux biologiques spécifiques ainsi que le dosage de l’activité enzymatique spécifiquement déficitaire pour chaque type de porphyries et aussi la biologie moléculaire. Il est nécessaire pour les praticiens comme les odonto-stomatologues, les hépatologues, et les dermatologues d’avoir quelques notions de base permettant de révéler ces maladies, vu la fragilité cutanée existante chez les patients.
Le diagnostic et le traitement des porphyries nécessitent une étroite concertation multidisciplinaire, pour optimiser la prise en charge des patients et leurs familles.
Dans ce travail on s’intéresse dans la première partie au métabolisme de l’hème en abordant sa voie de biosynthèse et de dégradation, puis dans la deuxième partie aux porphyries à symptomatologie cutanées due aux porphyrines accumulées dans la peau, la rendant fragile et sensible à la lumière et ce en rapportant les aspects physiopathologiques, cliniques, diagnostiques, et thérapeutiques de chaque porphyrie. Dans la troisième partie on souligne les mesures de photo-protections adoptées.
La première partie :
4
1 L’hème :
1.1 La définition :
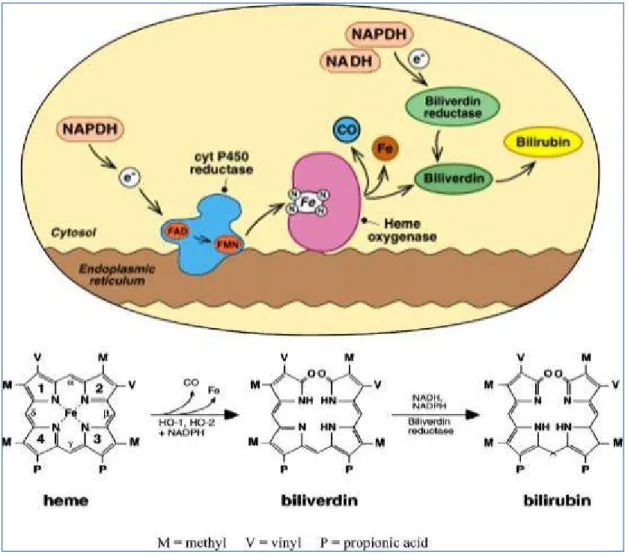
L’hème est une molécule plane de protoporphyrine (IX) complexée à un atome de fer (figure 1, A) ce fer peut faire six liaisons, quatre liaisons covalentes de coordination avec les azotes des cycles pyrroles, les deux autre peuvent être occupées par des acides aminés spécifiques des protéines, ou par des gaz comme l’oxygène, oxyde nitrique, monoxyde de carbone CO (3) , l’hème est une molécule qui se lie aux plusieurs protéines en tant que cofacteur ou groupe prosthétique pour former des hémoprotéines, comme l'hémoglobine, la myoglobine et les cytochromes. La protoporphyrine IX est une porphyrine avec quatre atomes d'azote contenant l'atome de fer (II) sous forme de chélate, ce fer peut se lier de manière réversible à l'oxygène ou conduire des électrons par conversion entre le fer ferreux et le fer ferrique (4), bien que ces deux formes de fer soient les plus communs au sein de la structure de l'hème, les états d'oxydation de l'hème-Fe peuvent varier de Fe 2+ à Fe 5+ (5). L’Hème est une molécule cofacteur et de signalisation essentielle requise pour la quasi-totalité de la vie aérobie, cependant l'excès d’hème est cytotoxique (6).
1.2 Les types :
Il existe trois types d’hème biologiquement actif importants qui différent par des modifications chimiques (7) :
-l’hème b est le type d’hème le plus commun chez les mammifères, l’hémoglobine et la myoglobine sont des exemples de protéines qui contiennent de l’hème b ; l’hème b n’a pas de liaison covalente avec l’apoprotéine, étant coordonné à celle-ci par son cation ferreux.
-l’hème a diffère de l’hème b en ce que sa chaine latérale méthyle en position 8 est oxydée en aldéhyde et que sa chaine latérale vinyle en position 3 est remplacée par un terpénoïde (17-hydroxyethylfarnesyl). Comme l’hème b, l’hème a n’est pas lié par covalence avec l’apoprotéine, un exemple de protéine contenant de l’hème a est le cytochrome c oxydase. -l’hème c diffère de l’hème b en ce que les deux chaines latérales vinyle sont remplacées par des groupements sulfhydrile, l’hème c peut se lier aux protéines par deux liaisons Thio-éther covalentes. Le cytochrome c et le complexe bc1 sont des exemples de protéines qui contiennent de l’hème c.
6
1.3 Les rôles :
L’hème constitue le groupe prosthétique de très nombreuses hémoprotéines impliquées dans le processus de transport, de liaison et de métabolisme de l’oxygène (hémoglobine, myoglobine, oxydases, catalases), et de transfert des électrons (cytochromes) (fig1 C). Il est également le groupe prosthétique de protéines comme la guanylate-cyclase, les NO-synthases, les hydroxylases ou cyclo oxygénases qui synthétisent des molécules de signalisation comme le GMPc, le monoxyde d’azote(NO), les hormones stéroïdes, et les prostaglandines. L’hème contrôle également, outre sa propre synthèse et sa dégradation, l’expression de nombreuses protéines comme la globine, et il régule la prolifération de nombreux types cellulaires(9). -Transport et le stockage des molécules diatomiques gazeuses tels que l'oxygène (O 2), l'oxyde-nitrique (NO) et de monoxyde de carbone (CO).
-transport de l’oxygène :
L’hémoglobine est la principale protéine des érythrocytes (ou hématies) des vertébrés assurant le transport de l’oxygène (O2) du poumon vers les tissus et le retour du gaz carbonique (CO2) des tissus vers le poumon, une molécule d’hémoglobine est formée de deux types de chaines, identiques deux à deux, chacune liées à un groupement prosthétique : la protoporphyrine IX (l’hème). L’hémoglobine A (Hb A) la forme majoritaire circulante dans le sang des adultes est constituée de deux chaînes de type alpha (α) et deux chaines béta (β)(10), la chaîne (α) comporte 141 résidus d’acides aminés et la chaine (β) 146 résidus, les chaines réalisent des liaisons de coordination métallique avec l’atome de fer fixé dans la molécule d’hème par deux résidus histidines, L’un de ses résidus histidine (His distale) lie directement le fer sous forme Fe2+,l’autre (His proximale) le lie par l’intermédiaire de la molécule d’O2 quand l’hémoglobine est oxygénée (dite alors oxyhémoglobine), l’oxygène ou plutôt la molécule de dioxygène(O2), est liée aux atomes de fer des quatre groupements héminiques portés par les chaines de globines, ainsi une molécule d’Hb peut lier 4 molécules d’O2(11). La myoglobine : La myoglobine est une molécule extrêmement compacte dont 70% de la chaine est repliée en hélice α. à l’intérieure de sa chaine polypeptidique elle renferme un hème avec un atome de fer central (12), c’est une protéine spécifique des muscles du squelette et du myocarde qui intervient dans leur oxygénation. Elle a une très forte affinité pour l’oxygène à 37 °C supérieure à celle de l’hémoglobine, permettant un transfert aisé d’oxygène de l’hémoglobine à la myoglobine et ainsi une fourniture d’oxygène au système mitochondrial au cours du travail musculaire (la contraction).
-respiration cellulaire : les cytochromes constituants les complexes (III et IV) de la chaine respiratoire contiennent plusieurs types d’hème (hème b, c1, a, a3) en tant que support d’oxydo-réduction (13) .
-Activation post-traductionnelle des anticorps : Dans la circulation sanguine de tous les individus sains, on trouve des anticorps circulants mono-réactifs qui sont capables de devenir poly-réactifs. L’acquisition de cette poly-réactivité survient de manière post-traductionnelle, après exposition des anticorps à des molécules de bas poids moléculaire tel que l’hème : L’exposition à l’hème d’Ig humaines de donneurs sains augmentait drastiquement la capacité de ces Ig à lier différents antigènes du soi ou exogènes (bactéries et virus) (14) .
- cytochromes P450 : sont un groupe d’enzymes contenant l’hème, des hémoprotéines incluses dans la couche lipidique du réticulum endoplasmique des hépatocytes et entérocytes(15), présentent aussi dans les reins, et les poumons, Ce sont des enzymes qui catalysent des réactions d’oxydation nécessitant de l’oxygène et du NADPH, les cytochromesP450 de mammifères ont trois fonctions principales (16) :
- l’anabolisme de certaines substances endogènes (stéroïdes).
- le métabolisme des xéno-biotiques dont les médicaments, les polluants et les carcinogènes chimiques, donc ils ont un rôle dans la détoxification de l’organisme. - l’oxydation de composés endogènes dont les acides gras et les acides rétinoïques. - La peroxydase : une enzyme, trouvée principalement dans les plantes mais également dans les leucocytes et le lait, qui catalyse la déshydrogénation (oxydation) de diverses substances en présence de peroxyde d'hydrogène (qui agit comme un accepteur d'hydrogène, au cours de conversion en eau), Les peroxydases hème de mammifères, y compris la lactoperoxydase (LPO), la myéloperoxydase (MPO), l'éosinophile peroxydase (EPO) et la peroxydase thyroïdienne (TPO)(17) , contiennent une fraction d'hème lié de manière covalente à la protéine, Dans l'organisme, les peroxydases décomposent notamment les composés peroxydes
8
-cytochrome duodénal b (Dcyt b ou CYBRD1): hémoprotéine a activité Ferri-réductase (19), c’est une oxydoréductase ascorbate dépendant impliquée dans la réduction du fer alimentaire de la forme ferrique à la forme ferreux au niveau de la bordure en brosse des entérocytes duodénaux(20) .
-oxyde nitrique synthase NOS : utilise pareillement l’hème comme groupement prosthétique et le NADPH comme cofacteur, NOS catalyse l'oxydation d’acide aminé simple, la L-arginine, en L-citrulline et oxyde nitrique (NO), une molécule de signalisation importante dans le système cardiovasculaire, immunitaire et nerveux. En se liant à l'hème de La guanyl cyclase elle active l'enzyme qui convertit le GTP en GMP cyclique, dernière molécule de signalisation conduisant à divers effets physiologiques(21).
-indoleamine2 ,3-dioxygenase (IDO) et tryptophane 2,3-dioxygenase(TDO) : IDO et TDO sont des enzymes héminiques solubles qui catalysent la conversion de la L-Trp en N-formylkynurénine première étape du métabolisme de la L-Trp par la voie de la kynurénine, elles sont reconnues comme des dioxygénases, le tryptophane est impliqué dans le maintien d'une forte réponse immunitaire, pour cela les cellules tumorales qui catabolisent le tryptophane génèrent un environnement immunosuppresseur locale (21).
-l’hème est une molécule régulatrice :
- entre dans le processus de maturation des micro-ARN (miARN) : qui sont des régulateurs traductionnels capables d’extinction de l’expression d’un gène, des études ont fourni des preuves biochimiques directes qui disent que l’hème ferrique serve d'activateur pour la maturation des miARN(22).
- un inducteur d’hème oxygénase qui le catabolise.
- un inhibiteur de sa propre synthèse par répression de l’ALAS1.
- Inhibition des canaux Ca-dépendent : une classe de canaux ioniques, les canaux Slo1 BK à grande conductance dépendant du calcium, possèdent un motif de séquence de liaison à l'hème conservé, les hèmes oxydés et réduits se lient à la protéine du canal hSlo1 et inhibent profondément les courants K + transmembranaires en diminuant la fréquence d'ouverture du canal(23).
1.4 La toxicité :
Dans le cas physiologique l’hème est issu essentiellement d’hémoglobines catabolisées dans le système réticulo-histiocytaire après lyse des hématies vieillies (en moyenne après 120 jours) dans la rate, le foie et la moelle osseuse. Les macrophages du foie en particulier, vont libérer de l’hémoglobine qui va perdre ses molécules d’hème subissant des oxydations qui les transforment en bilirubine dont une partie sera conjuguée (glucurono-conjugaison) pour une élimination biliaire (10). Dans le sang, circule de la bilirubine conjuguée et de la bilirubine non conjuguée liée à l’albumine ; il n’existe donc quasiment pas de bilirubine libre. En cas d’hémolyse importante, on retrouvera un ictère mixte dit hémolytique (excès de bilirubine). Lorsque les capacités d’élimination de l’hème se trouvent dépassées comme dans le cas de paludisme, la drépanocytose, la thalassémie, l’ischémie-reperfusion, où la libération des molécules d'Hb dans la circulation sanguine est en grande quantité cause l'oxydation du fer ferreux (Fe2+) de l’hème en fer ferrique (Fe3+) en présence d'espèces réactives de l'oxygène (ERO), selon la réaction de Fenton l’Hb oxydée : la méthémoglobine (HbFe3+) est hautement réactive, instable et relâche rapidement ses groupements hème dans la circulation. L’hème se trouve en grande quantité ce qui génère des effets toxiques(24, 25)(fig.2) , vu que c’est une molécule hautement cytotoxique, insoluble et ne peut ainsi pas circuler librement dans l’organisme, elle se lie de façon inappropriée à diverses biomolécules, peut modifier leur structure et leur fonction(6).Cette toxicité peut se manifester par des réactions d’oxydations provoquant d’importants désordres vasculaires médiès par la formation des espèces réactives de l’oxygène (ROS) tel que le peroxyde d' hydrogène (H2O2) , les hydroxyles (HO·) et les hydroperoxyles (HOO·)(26), Ces réactions d’oxydations concernent principalement les lipides et les lipoprotéines des composants membranaires occasionnant la lyse et la mort cellulaire par cytotoxicité. L’Hème b peut être libéré des hémoprotéines auxquelles il se lie de façon non covalente, cet hème qui n'est pas lié aux poches des hémoprotéines, peut agir
10
L'hème provoque des dommages oxydatifs cellulaires en favorisant la formation de ROS, la peroxydation des lipides, les dommages causés à l'ADN et aux protéines. De plus, l'hème est une source de fer, par conséquent la surcharge en hème conduit à une accumulation intracellulaire de fer, avec génération ultérieure de ROS. C’est un agent hémolytique, car il intercale la membrane des globules rouges, favorisant ainsi la rupture cellulaire et amplifiant davantage le processus hémolytique. Il favorise l'inflammation par ses propriétés pro-inflammatoires en stimulant l'activation des cellules pro-inflammatoires (leucocytes et granulocytes) et la production de cytokines qui peuvent être impliquées dans l'induction de l’apoptose. Enfin, l'hème provoque un dysfonctionnement endothélial par plusieurs mécanismes: augmentation de l'expression des molécules d'adhésion et de l'activation endothéliale, promotion du recrutement de cellules inflammatoires et de l'agrégation plaquettaire, entraînant une consommation oxydative d'oxyde nitrique (NO) et une vasoconstriction, avec oxydation de lipoprotéines de basse densité (LDL)(27).
1.5 Contrôle de l’hème libre circulant : (28) (24)
Dans des conditions pathologiques d’hémolyse l’hémoglobine (Hb) libérée des cellules peut être liée à l’haptoglobine (Hp) circulante, qui est une glycoprotéine de la phase aigüe, synthétisée dans le foie, cette liaison de (Hp) à (Hb) est l’une des plus fortes interactions protéine-protéine survenant dans le plasma, elle empêche l’oxydation d’Hb et la libération de l’hème, le complexe Hb-Hp se lie aux récepteurs CD163 (hemoglobin scavenger receptor) exprimées dans les macrophages et les hépatocytes conduisant à une endocytose et la dégradation du complexe Hb-Hp, où les molécules d’hème d’Hb sont dégradées par l’hème oxygénase alors que l’Hp et le fragment protéique de Hb sont dégradés dans les lysosomes(29) , l’Haptoglobine est épuisable (pas de processus de recyclage), lorsque l’Hb est
12
L’Hémopexine (Hx) est une β1-glycoprotéine plasmatique de 60 KDa, et une protéine positive de la phase aiguë qui lie l'hème libre circulant avec la plus forte affinité hémique de toute protéine connue (30), elle joue un double rôle par le transport d’hème vers le foie pour sa dégradation et l'inhibition de la toxicité résultant de l’oxydation de l'hème(31). L’Hx a plusieurs rôles mais le plus connu est de lier l'Hème libre, de le maintenir dans un état soluble et monomérique afin de réduire sa réactivité. Le complexe hème-Hx est reconnu par les récepteurs CD91 des macrophages (6), par lesquels les deux molécules sont internalisées, conduisant au catabolisme intracellulaire d’hème, alors que l’Hx est sécrétée dans la circulation, la liaison du complexe hème-Hx au récepteur CD91 induit la transcription d'ARNm codant pour l'HO-1 et la ferritine.
L’albumine est la protéine la plus abondante du plasma, synthétisée par le foie, cette protéine plasmatique d’un poids moléculaire de 66 kDa représente environ 50 % des protéines plasmatiques, son turnover permanent occupe 10 % de la synthèse protéique totale hépatique, elle possède des propriétés anti-oxydantes(32). L’albumine a un rôle crucial dans le nettoyage de l’hème, en fournissant une protection contre les dommages oxydatifs de l'hème libre, et contribue à l'homéostasie du fer en recyclant le fer hémique. En fait pendant les premières secondes après l'apparition de l'hème dans le plasma, plus de 80% de ce puissant oxydant se lie aux lipoprotéines de haute densité (HDL) et lipoprotéines de basse densité (LDL), seuls les 20% restants se lient à l’albumine et à l'hémopexine. Ce premier effet cinétique est dû au taux de liaison de l'hème plus rapide pour HDL et LDL, suivie par un transfert plus lent de l’hème vers l’albumine et l’hémopexine, qu’ont une plus grande affinité pour l’hème, la formation du complexe albumine-hème constitue un événement protecteur qui empêche la formation de HDL et LDL oxydés, qui sont les composants plasmatiques les plus oxydants intolérants.
14
1.6 La biosynthèse de l’hème :
1.6.1 Les étapes de biosynthèse :
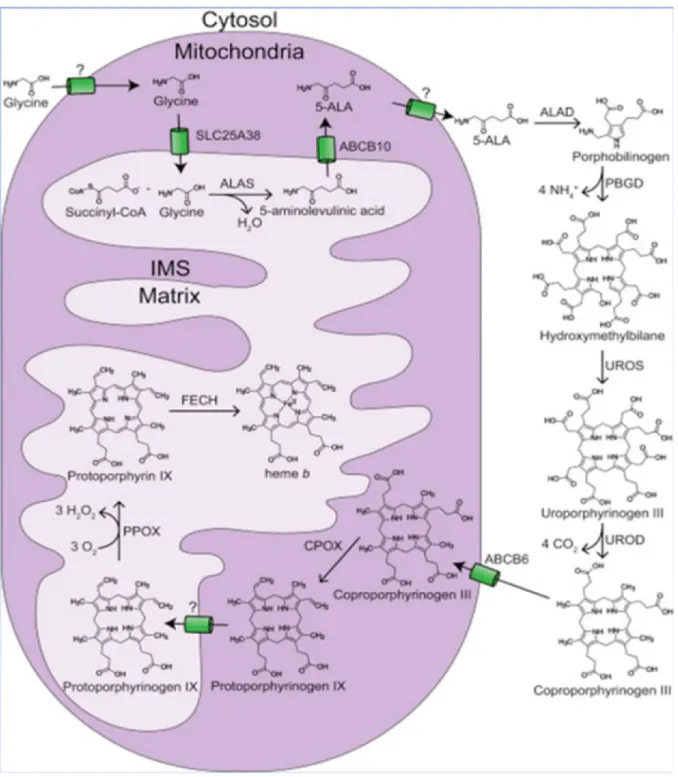
Les eucaryotes synthétisent l’hème via la voie hautement conservée de shemin (6) (fig4), huit enzymes participent successivement à cette biosynthèse à partir de la glycine et succinyl-COA, cette voie métabolique est initialement mitochondriale puis présente trois étapes cytoplasmiques avant de réintégrer la mitochondrie pour former l’hème (8). La synthèse de l'hème est omniprésente dans tout le corps(34), quantitativement la plus grande part (80%) est produite dans les cellules érythropoïétiques au niveau de la moelle osseuse pour la synthèse d’hémoglobine et 15% dans les cellules parenchymateuses du foie pour la synthèse des cytochromes et des hémoprotéines.
Cette voie de biosynthèse se déroule en huit étapes :(35) dans la mitochondrie :
Etape 1 : condensation de la glycine, acide aminé dérivé du cycle d’acide citrique dans la mitochondrie et de succinyl-COA pour former le dioxyde de carbone, le Coenzyme A et l’acide 5-aminolévulinique (5-ALA), le précurseur commun de tous les tétra-pyrroles biologiques (36) cette réaction se déroule dans la matrice mitochondriale et est catalysée par ALA-synthase (ALAS).
dans le cytoplasme : l’ALA synthétisé dans la mitochondrie est ensuite transporté à travers les deux membranes mitochondriales (interne et externe) vers le cytoplasme.
Etape 2 : dans le cytoplasme deux molécules d’ALA sont condensées pour former le mono-pyrrole porphobilinogène (PBG), la réaction est catalysée par la porphobilinogène synthase (PBGS).
Etape 3 : quatre molécules de PBG sont reliées par l’hydroxyméthylbilane synthase (HMBS) également appelée porphobilinogène désaminase, pour former l’hydroxyméthylbilane tetrapyrole (HMB).
Etape 4 : l’HMB est converti (cyclisée), en uroporphyrinogène III par l’uroporphinogène synthase (UROS, également connu sous le nom isomérase uroporphyrinogène III et hydroxyméthylbilane hydrolase ), une fraction de l'hydroxyméthylbilane échappe à l'action d’UROS subissant une conversion non enzymatique donnant l'isomère uroporphyrinogène I (37).
Etape 5 : décarboxylation de l’uroporphyrinogène III par l’uroporphyrinogène III décarboxylase (UROD) pour former la coproporphyrinogène III.
Dans la mitochondrie :
Etape 6 : la coproporphyrinogène III pénètre l’espace inter-mitochondriale(6), où elle est oxydée puis décarboxylée par la coproporphyrinogène oxydase (CPOX) pour former la protoporphyrinogène IX puis transportée vers la matrice mitochondriale . Etape 7 : la protoporphyrinogène IX est oxydée en protoporphyrine IX par la
protoporphyrinogène oxydase (PPOX).
Etape 8 : le fer ferreux Fe²+ est inséré sur la protoporphyrine IX par la ferrochelatase(FECH) pour former l’hème.
L’hème une fois synthétisé doit être incorporé dans des hémoprotéines pour éviter sa toxicité, il peut induire la transcription et l’expression de plusieurs apoprotéines servant à la synthèse des hémoprotéines tel que l’Hémoglobine, la myoglobine, la neuroglobine, pour les cellules érythroïdes, musculaires, et neuronales, respectivement.
16
Figure 4: la synthèse d’Hème chez les eucaryotes, (ALAS = 5- aminolevulinic acid (5-ALA) synthase; ALAD = 5-ALA dehydratase; PBGD = porphobilinogen deaminase; UROS =
uroporphyrinogen synthase; UROD = uroporphyrinogen decarboxylase; CPOX = coproporphyrinogen oxidase; PPOX = protoporphyrinogen oxidase; FECH = ferrochelatase(6)).
1.6.2 La régulation de la biosynthèse :
La première étape de la biosynthèse d’hème est limitant, catalysée par l’enzyme homodimérique mitochondriale ALAS dépendant du cofacteur pyridoxal-5'-phosphate (PLP) (24, 26), l’ALAS possède deux iso-enzymes codées par deux gènes ALAS1 dont l’expression est ubiquitaire nommé aussi (ALAS-NE) et ALAS2 a expression érythroïde spécifique nommé aussi (ALAS-E), ces gènes ont été cartographiés sur le chromosome X (Xp11.21) pour ALAS2 (27), et le chromosome3 (3p21.1) pour ALAS1 (28). Les deux produits de gènes ALAS humains partagent une identité de 74% au niveau des acides aminés(24).
La régulation de la production d’hème diffère entre les deux tissus érythroïdes et hépatiques essentiellement par la différence du taux de synthèse d’ALA(8), contrôlée aussi par le passage nécessaire du fer depuis le TfR (récepteur à la transferrine) vers la mitochondrie(19), au niveau hépatique il y a plusieurs cibles régulatrices d’activités ALAS1(38) : 1) répression transcriptionnelle via un élément sensible à l'hème en se liant à un CP-motif (constituer de résidus cystéine et proline, 2) déstabilisation post-transcriptionnelle de l'ARNm d'ALAS1 favorisant ainsi sa dégradation, 3) inhibition post-traductionnelle via un motif régulateur de l'hème, 4) inhibition directe de l'activité de l'enzyme et 5) la dégradation de la protéine ALAS1 via l'induction de la protéase Lon peptidase 1 à médiation hémique, donc l’hème régule négativement l’expression ALAS1 au niveau hépatique alors qu’il régule positivement la dégradation de son ARNm, augmente la dégradation de l'enzyme mitochondriale mature (39), et active également la transcription du gène des chaines de globine.
18
Figure 5: Régulation hépatique de la biosynthèse de l’hème et hémoprotéines(8) ;
(L’ALA synthase 1 est l’enzyme limitant régulateur sur lequel s’exerce un rétrocontrôle inhibiteur par le produit final. Trois mécanismes d’induction d’ALAS1 responsable de crises aiguës de porphyrie ont été identifiées : (1) dérépression de l’ALAS1 par induction du catabolisme de l’hème
par l’hème oxygénase 1 en situation pro-inflammatoire ; (2) dérépression de l’ALAS1 par des médicaments ou hormones porphyrinogéniques entrainant l’induction d’un des hémoprotéines des
familles de cytochromes P450 ; (3) activation de l’ALAS1 par le jeûne médié par une induction du peroxisome proliferator-activated receptor 1 alpha (PGC-1a). CO : monoxyde de carbone ; NO :
L’expression d’ALAS2 au niveau érythroïde est essentiel pour la formation de l'hémoglobine, et est fortement induite au cours de l’étape ultérieure de la différenciation érythroïde en réponse à l’érythropoïétine (EPO) (8),dans ces cellules l’ALAS2 n’est transcrite que pendant la période où la synthèse d’hème est active, son expression génique est déterminée par la trans activation du facteur nucléaire GATA1, de la boîte CACC et des sites de liaison à NF-E2 dans les zones promotrices(fig. 6 A).
20
A ce niveau, la biosynthèse de l’hème est limité par la biodisponibilité intracellulaire du fer (fig. 6 B) et n’est pas inhibée par le produit final : l’hème (40). le fer est acquis par l’intermédiaire d’une endocytose mèdiée par le récepteur à la transferrine(Tf-R) , une fois intériorisé lié à la transferrine, le fer Fe3+ est réduit à Fe²+ libéré dans le cytosol puis pénètre la mitochondrie par l’intermédiaire de la protéine membranaire mitochondriale « MFRN1 ». Le fer agit principalement au niveau de la première étape de la synthèse de l’hème en stabilisant les ARNm de l’ALA synthase 2 et au niveau de la dernière étape de cette synthèse en tant que substrat de la ferrochélatase.
Les niveaux de fer cellulaire régulent l’activité de liaison IRE-IRP (iron responsive element– iron responsive Protein) (20) (fig7) qui à son tour régule l’activité de traduction des ARNm d’ALAS2 régulant ainsi l’expression ALAS2 au niveau post-transcriptionnelle, les IRP sont des protéines de liaison d’ARN qui se lient aux éléments sensibles au fer : IRE que sont des séquences spécifiques dans la région UTR 5’ non traduite de l’ARNm de l’ALAS2. Dans les conditions de carence en fer (fig.7A), la traduction d’ARNm ALAS2 est inhibée par liaison de l’IRP à l’IRE inhibant la fixation du ribosome sur l’ARNm, en revanche les IRP se détachent de l’IRE dans les conditions de suffisance en fer, par formation d’un complexe avec l’IRP et l’IRE reste libre (fig.7B) ce qui entraine une augmentation de traduction d’ARNm de l’ALAS2. Les taux élevés de fer provoquent une régulation positive sur la traduction de l’ARNm de l’ALA synthase et régulation négative sur la synthèse du récepteur à la transferrine (= feed back négatif).
Figure 7: mode d’action du système IRE-IRP.
La ferrochélatase (FECH) est la deuxième enzyme limitante de la vitesse de cette voie, son expression est induite au cours de la différentiation érytroïde. L’enzyme FECH humaine est une protéine homodimérique de 86 kDa, associée à la membrane interne de la mitochondrie. Elle est codée par un unique gène nucléaire de 45 kb contenant 11 exons, localisée sur le chromosome 18q21.31 (41). le promoteur du gène FECH contient des séquences cis-régulatrices spécifiques du tissu érythroïde et d’autres fixant le facteur transcriptionnelle HIF-1, conférant un haut niveau d’expression lors de la différenciation érythroïde et en réponse à l’hypoxie, la FECH présente d’ailleurs un cluster fer–soufre [2Fe–2S] essentiel pour l’activité enzymatique, modulée par la quantité de fer et dont le rôle est important dans la régulation de la synthèse d’hème(19). Des études ont suggéré que la fraxatine protéine mitochondriale évolutionnaire conservée en 210 acides, qui a un rôle important dans le métabolisme du fer, joue un rôle important dans cette étape finale , car elle a une affinité de liaison élevée pour la
22
1.6.3 Les transporteurs de l’hème et précurseurs :
Être lipophile, l’hème s’associe facilement avec les membranes des cellules et des organelles; cependant, la présence de chaînes latérales carboxylate anioniques, sont responsables de sa liaison à des protéines porteuses, comme l'albumine et hémopexine (HPX), qui limitent sa diffusion transmembranaire (43), ce qui indique la nécessité de transporteurs spécifiques (fig. 8), Au cours des quinze dernières années un certain nombres de transporteurs de l’hème ont été identifiés y compris :
Membre mitochondriale de la famille ATP-binding cassette*ABC* : (6, 7, 35) - Abcb6 : contrôle la translocation des précurseurs d’hème entre la mitochondrie
et le cytosol, il est responsable du transport de la coproporphyrinogène III. - ABCG2 : exporte l’hème vers le milieu extérieur, hors de la cellule. - Abcc5 ou MRP-5.
- ABCB10 : exportation de l’ALA mitochondriale vers le cytosol.
ANT : adenine nucléotide translocator = contrôle la translocation d’hème entre la mitochondrie et le cytosol.
HRG 1 : avec une expression dans les endosomes et les lysosomes, il est nécessaire pour le recyclage d’hème par les macrophages, il transporte l’hème exogène du phagolysosome au cytosol durant l’érythropoïèse.
HCP1 : protéine porteuse d’hème, exprimée dans la membrane plasmique, contrôle l’importation de l’hème extracellulaire.
SLC25A38, un transporteur de la membrane interne (MI) mitochondrial de l’ALA. SLC36A1 : transporteurs d’ALA, abondamment exprimés dans les cellules
érythroïdes.
TMEM14C : protéine de la membrane mitochondriale interne, impliquée dans l'importation de protoporphyrinogène IX dans la matrice mitochondriale.