MEMOIRE DE FIN D’ETUDE
pour l’obtention du
DIPLOME NATIONAL DE SPECIALITE
EN CARDIOLOGIE
Facteurs prédictifs d’extériorisation de Dispositifs
Electroniques Cardiaques Implantables :
Expérience de l’unité de Rythmologie du CHU de
Rabat entre 2009 et 2019
Dr. Hajar CHOUAIB
Sous la direction du Pr. I.FELLAT
2
3
A notre Maitre Mme le professeur I.Fellat,
Je vous remercie de m’avoir confié ce travail et d’avoir veillé à sa réalisation
comme mémoire de fin de spécialité. J’espère avoir mérité votre confiance.
Veuillez accepter l’expression de mes sentiments les plus respectueux de
reconnaissance et de gratitude.
A tous nos Maîtres,
Nous saluons votre engagement dans la formation de différentes générations de
jeunes cardiologues. Vous nous avez guidés tout au long de notre formation avec
bienveillance et compréhension. La flexibilité et la disponibilité ont été les
qualités les plus marquantes au cours de ces années.
Veuillez croire en notre profond respect et notre très haute considération, et
accepter ici, chers maîtres, l’expression de notre gratitude et notre profonde
reconnaissance.
4
5
ABRÉVIATIONS
……….7PREMIÈRE PARTIE : INTRODUCTION
...………..8DEUXIÈME PARTIE : RAPPELS THÉORIQUES
...……….…101-
Historique
...112-
Composition des DECI
………..133-
Interactions entre l’hôte et le dispositif implantable
...174-
Définitions
...185-
Causes possibles d’extériorisation
...204.1
-
L’Infection... ....204.2
-
Causes locales...264.3
-
Causes générales...286-
Prise en charge des extériorisations
……….………295.1
-
Extraction………295.2
-
Antibiothérapie ……….315.3- Réimplantation ……….32
TROISIÈME PARTIE: ÉXPERIENCE DE RABAT
………...……….351-
OBJECTIFS DE L’ÉTUDE
...362-
MATÉRIEL ET MÉTHODES
...372.1
-
Critères d’inclusion... ....372.2
-
Critères d’exclusion...372.3
-
Définitions utilisées dans notre étude...372.4- Variables étudiées... ...38
2.5- Recueil des données...39
6
3-
RÉSULTATS
...403.1
-
Caractéristiques des patients... ....413.2- Données concernant la primo-implantation...42
3.3- Données concernant les infections documentées...44
3.4- Données concernant les extractions………...46
3.5- Données concernant les réimplantations...48
3.6- Résultats après réimplantations...50
4-
DISCUSSION
...514.1- Analyse statistique………...51
4.2- L’Infection………52
4.3- Facteurs généraux………..54
4.4- Facteurs liés à la procédure...55
4.5- Facteurs locaux………56 4.6- Techniques de réimplantation... ..57 4.7- Prévention...60
CONCLUSION
………..61BIBLIOGRAPHIE
……….63RESUME
……….………..697
ABRÉVIATIONS
AAP : Antiagrégation plaquettaire
BAV : Bloc auriculo-ventriculaire
OD : Oreillette droite
VD : Ventricule droit
VG : Ventricule gauche
FEVG : Fraction d’éjection ventriculaire gauche
PM : Pacemaker
DAI : Défibrillateur automatique implantable
DECI : Dispositif électronique cardiaque implantable
ETT : Echocardiographie transthoracique
8
9 De plus en plus de dispositifs électroniques cardiaques implantables (DECI) sont implantés en raison de l’allongement de l’espérance de vie tant chez les sujets sains que chez ceux atteints de cardiopathies (1) et de l’extension des indications de pose de pacemaker ou de défibrillateur. En effet, dès le début du 21e siècle, les indications d’implantation de DECI se
sont élargies aussi bien en prévention primaire que secondaire, avec des prothèses de plus en plus complexes (essor de la resynchronisation bi-ventriculaire et de la défibrillation en prophylaxie primaire).
Les stimulateurs cardiaques et les défibrillateurs automatiques implantables comprennent des sondes, qui, connectées au boitier, permettent de délivrer au patient les thérapies nécessaires (stimulation, défibrillation et/ou resynchronisation).
L’extériorisation de DECI, bien que relativement peu fréquente, constitue la complication la plus redoutable que les rythmologues, chirurgiens cardiovasculaires, voire chirurgiens plastiques sont amenés à gérer de façon occasionnelle dans leur pratique.
Toute extériorisation est synonyme de contamination du matériel et d’infection subséquente, de ce fait, il y a un consensus général que ces dispositifs doivent être retirés et réimplantés secondairement après réévaluation de leur indication, avec antibiothérapie associée, selon des recommandations bien établies. (2)
L’extériorisation imminente sans signes d’infection peut être gérée de façon conservatrice avec capsulectomie et repositionnement local sous-fascial ou sous-pectoral, des procédures plus complexes ont été décrites mais ne sont pas réalisées en routine. Lorsque l’infection est avérée ou lorsqu’il y a récidive d’extériorisation après repositionnement initial, le patient doit être référé pour extraction/remplacement du boitier et des sondes.
Il existe peu d’études abordant ce sujet, et ces études comportent généralement un faible nombre de patients.
Le but de notre étude est de rapporter et d’analyser l’expérience du CHU IBN SINA en matière d’extériorisation de DECI entre 2009 et 2019. Elle décrit 18 patients référés vers un seul centre sur une période de 10 ans avec extériorisation ou extériorisation imminente de leur DECI.
10
11
1 Historique
Le bénéfice clinique des dispositifs implantables cardiaques a été prouvé depuis longtemps par plusieurs études. Des millions de DECI ont été implantés à travers le monde et la qualité de vie de ces patients a été drastiquement améliorée.
Les premières stimulations par des électrodes trans-thoraciques étaient réalisés par Zoll au début des années cinquante (Zoll, 1952), puis arrive la stimulation endocardique percutanée en 1959 (Furman & Schwedel, 1959). La stimulation permanente par électrodes épicardiques a été décrite la première fois en 1960 (Chardack 1960). Depuis, les pacemakers et les techniques d’implantation ont rapidement évolué ; Les générateurs sont plus fiables et plus compacts, contenant des composants micro-électroniques, pouvant être contrôlés automatiquement et à distance, permettant ainsi plus d’options de programmation et de monitorage et une durée de vie plus longue des pacemakers (Kusomoto & Goldschlager, 1996; Trohman, et al, 2004). Les sondes sont plus fines et plus résistantes et de ce fait durent aussi longtemps. (3) Les dernières recommandations européennes publiées en 2013 confirment les indications classiques de stimulation.
Depuis plus de 15 ans, la resynchronisation ventriculaire gauche a prouvé son bénéfice en réduisant la morbi-mortalité chez les patients présentant une insuffisance cardiaque avec bloc de branche sous traitement médical optimal, et les recommandations ont intégré cette indication en 2005. (4,5)
De façon similaire, le bénéfice des défibrillateurs automatiques implantables, en prévention primaire et secondaire, a été prouvé par des essais randomisés dès les années 90 (AVID (6), MADIT (7)).
L’implantation correcte d’un DECI est capitale pour son fonctionnement optimal. La réalisation d’une implantation dans un environnement électrophysiologique est aussi sure et efficace que dans un bloc opératoire (Garcia-Bolao & Alegria, 1999). Ceci requiert un centre avec une équipe qualifiée de cardiologues, d’infirmiers et de techniciens. La formation continue de cette équipe et le suivi des complications sont primordiaux. L’expérience des cardiologues et des chirurgiens et le volume des pacemakers implantés dans un centre, joue un rôle dans la réduction des complications des implantations, de ce fait, les
12 recommandations décourage ces procédures dans les centres à faible volume d’implantation.
Malgré ces précautions, certaines complications précoces peuvent survenir au cours des 6 premières semaines après l’implantation. Leur incidence peut atteindre 7%, moins de 5% de ces complications nécessitent une réintervention (Kiviniemi et al., 1999; Klug et al., 2003). La mortalité peropératoire est très rare.
13
2 Composition des DECI :
2.1. PM ou CRT-P :
Ces dispositifs ont pour principale fonction d’envoyer des impulsions électriques lorsque la fréquence cardiaque est trop lente. Ils sont constitués d’un boîtier étanche relié à une ou plusieurs sonde(s) qui comportent une ou plusieurs électrode(s) à leur extrémité.
Boitier :
Le boitier se compose d’une coque en titane contenant un générateur d’impulsions programmable (microcircuit avec un logiciel) avec une batterie au lithium et d’un connecteur.
Son diamètre moyen est d’environ 4 cm avec 5 mm d'épaisseur, 25 à 28 grammes de poids. Sa taille a été considérablement réduite ces dernières années, et reste principalement limitée par celle de la batterie. Celle-ci est en lithium avec une durée de vie de 5 à plus de 10 ans. Elle n’est pas rechargeable et le stimulateur est donc remplacé avant l’épuisement de sa batterie lors d’une opération généralement très simple.
Le générateur est habituellement placé en sous-cutané dans la fosse sous-clavière gauche. Rarement, il peut être placé dans la région clavière droite, sur la ligne axillaire, en sous-mammaire ou profondément sous le muscle grand pectoral.
Sonde(s) :
Le boitier est relié au cœur par l’intermédiaire d’une ou plusieurs sondes souples et fines. Ces sondes sont des conducteurs électriques. Le conducteur interne est en alliage comprenant titane, iridium, carbone ; l’isolant est en silicone, polyuréthane ou un mélange des deux.
Les électrodes sont le plus souvent bipolaires reconnaissables sur les radiographies sous forme de deux pièces métalliques situées sur la portion intracardiaque de la sonde constituant 2 pôles séparés d’une distance maximale de 20 mm l’un de l’autre, le pôle proximal constituant l’anode (pôle positif) d’aspect variable, parfois en forme de bague de faible épaisseur et le pôle distal (à l’extrémité de la sonde) formant la cathode (pôle négatif). Plus rarement la sonde est unipolaire avec une électrode métallique à l’extrémité de la sonde constituant la cathode, le boîtier faisant alors fonction d’anode.
14 Le nombre de sonde dépend de la nature et des troubles motivant l’implantation. Une sonde est presque toujours implantée à l’apex ou sur le septum du ventricule droit, une 2e est fréquemment connectée à l’oreillette droite (excepté si le patient est en arythmie), une 3e est plus rarement introduite dans le réseau veineux coronaire pour piloter le ventricule gauche en le synchronisant avec le ventricule droit.
Les sondes sont placées par voie endocavitaire percutanée via la veine sous-clavière ou plus rarement la veine céphalique ou la veine jugulaire, sauf en cas d’approche chirurgicale épicardique ou les sondes sont accrochées directement sur l’épicarde après sternotomie ou mini-thoracotomie.
Les sondes sont branchées d’une part sur le générateur dans un bloc de connexion via une broche de connexion (terminal connector pin). D’autre part, la fixation des sondes à la paroi du cœur peut être réalisée de manière passive ou active :
Passive par ancrage aux trabécules cardiaques par un système de barbillons, de dents, hélices, ailettes ou structures coniques entourant l’extrémité distale de la sonde avec installation d’une fibrose en six à douze semaines, elle est radio-transparente.
Active par vissage hélicoïdal pénétrant le myocarde, elle est alors radio-opaque et bien reconnaissable en radiographie standard.
Il existe depuis peu des pacemakers à chambre unique sans sonde appelés leadless cardiac pacemakers (LCP), largués et fixés dans le ventricule droit par voie veineuse fémorale. Ils sont radio-opaques et ont une forme de cylindre de quelques centimètres de long.
2.2. DAI ou CRT-D :
Ces dispositifs permettent d’appliquer une thérapie électrique correspondant soit à une stimulation rapide soit à un choc électrique ce qui nécessite une quantité d’énergie nettement plus importante qu’en cas de simple stimulation. Ils s’enclenchent en cas de détection d’une arythmie ventriculaire importante souvent potentiellement létale.
Les défibrillateurs peuvent être associés à une simple possibilité de stimulation ventriculaire droite via le coil ou à une possibilité de stimulation bicamérale ou même à une resynchronisation biventriculaire.
15
Boitier :
Ils sont constitués d’un boîtier plus large que celui des pacemakers. Les trois composants de base du DAI logés dans le boîtier sont : 1) le générateur d’impulsion, qui contient les circuits électroniques ;
2) le condensateur, permettant l’accumulation et la décharge d’une quantité définie d’énergie servant à la défibrillation
3) et la batterie.
Sonde(s) :
Le générateur est connecté à une sonde de défibrillation placée dans le ventricule droit (VD) qui possède un système de pacing/sensing (pour la stimulation/détection ventriculaire droite) et un système de défibrillation (appelé «coil») sur la même sonde. Les coils ont la caractéristique de pouvoir accumuler une charge électrique importante puis délivrer un choc de défibrillation biphasique au travers du myocarde. Les coils et le boîtier servent de pôles pour la défibrillation.
On distingue :
des sondes simple coil : un coil distal au niveau du VD,
et des sondes double-coil : un coil distal dans le VD et un coil proximal au niveau de la veine cave supérieure, incorporés dans la même sonde. Elles ont l’avantage de permettre la programmation de plusieurs vecteurs de défibrillation (utile si le seuil de défibrillation est très élevé pour une configuration donnée).
Comme pour les sondes de stimulation, la fixation des sondes à l’endocarde peut être : active (à vis)
ou passive (à barbillons). Les DAI peuvent être :
monochambre (une sonde dans le VD),
double-chambre (une sonde dans le VD et une sonde de stimulation/détection dans l’OD)
triple-chambre (la troisième sonde de stimulation étant située dans une veine tributaire du sinus coronaire au contact du ventricule gauche) dans le cadre d’un traitement de resynchronisation cardiaque.
16 Depuis peu existent des défibrillateurs sous-cutanés sans sonde endocavitaire qui ne nécessitent dès lors pas d’abord veineux mais qui ne permettent pas non plus de stimulation, si nécessaire.
La sonde utilisée pour la défibrillation est tunnelisée au niveau sous-cutané entre la loge du boîtier au niveau axillaire et une petite incision réalisée au niveau de l’appendice xyphoïd e. Elle est ensuite tunnelisée à partir de ce niveau, verticalement en parasternal gauche.
Lorsqu’une sonde de défibrillateur placée classiquement par voie veineuse est défectueuse, on peut implanter ce nouveau type de dispositif à sonde sous-cutanée tout en laissant l’ancienne sonde endocavitaire dysfonctionnelle en place mais débranchée.
Tout comme les pacemakers sans sonde, ces défibrillateurs sous-cutanés permettent de s’affranchir du maillon le plus faible des DECI que constitue la sonde endocavitaire, réduisant ainsi le risque infectieux.
17
2 Interactions entre l’hôte et la sonde
Le système de stimulation inclus une ou plusieurs sondes connectées à un boitier implanté dans une loge sous la clavicule, typiquement sous-cutanée, localisée juste au dessus de l’aponévrose du muscle grand pectoral. Bien que la taille des pacemakers et des défibrillateurs ait diminué significativement, des complications liées à une implantation superficielle peuvent survenir, dont l’extériorisation de matériel.
Les risques d’extériorisation de pacemaker sont principalement liés à la réponse de l’hôte au corps étranger que constituent la sonde et le boitier.
Le boîtier est formé d’une coque en titane, un métal très bien toléré par le corps humain. Après l’intervention, le processus de cicatrisation commence au niveau de la loge mais également le long des sondes avec des réactions inflammatoires et des phénomènes de thrombose, qui se transforment à la longue et s’organisent en fibrose, préférentiellement dans les zones ou la sonde entre en contact avec l’endothélium vasculaire ou l’endocarde (8). Les zones d’adhésion les plus fréquentes sont le site d’entrée veineux, la veine cave supérieure, et enfin l’interface entre l’électrode et l’endocarde. La sonde peut être engainée d’une couche de fibrine dès le cinquième jour qui suit l’implantation(9).
Les facteurs prédictifs de formation de tissu fibreux et cicatriciel ne sont pas clairement identifiés, mais il semble que les patients les plus jeunes développent ces réponses plus fréquemment et de façon plus intense.
Les réactions inflammatoires sévères de causes diverses (infectieuse, allergique, hématome post-opératoire…) entrainent des exsudats dans la loge, une destruction tissulaire avec un aspect macroscopique grumeleux et friable des tissus nécrosés aboutissant à la déhiscence de cicatrice et l’exposition du matériel.
18
3 Définitions
Des définitions précises des termes utilisés sont indispensables pour guider le diagnostic et pour une prise en charge adaptée, elles ont été proposées par les différentes sociétés savantes américaine, britannique et européenne : (2,10,11,12)
Erosion isolée de loge : boitier et/ou sonde(s) exposé(e)(s) à travers la peau, avec ou sans signes locaux d’infection.
Infection de loge isolée : érythème localisé, œdème, douleur, sensibilité, chaleur ou écoulement avec hémocultures négatives.
Bactériémie: hémocultures positive avec ou sans symptômes et signes d’infection systémique.
Infection de loge avec bactériémie : signes d’infection locale et hémocultures positives. Infection de sonde: végétation au niveau de la sonde et hémocultures positives.
Infection de loge avec endocardite valvulaire/sur sonde : signes locaux et hémocultures positive et végétation(s) sur valve(s) ou sonde(s).
Endocardite sur DCI sans infection de loge : hémocultures positives et végétation(s) sur valve(s) ou sonde(s).
Bactériémie occulte avec infection de DCI probable : absence de source alternative d’infection, résolution après extraction du DCI.
Situations ou l’infection de DCI est incertaine : extériorisation imminente, endocardite isolée sur valve gauche chez un patient porteur de DCI.
Infection de cicatrice d’incision superficielle : concerne uniquement la peau et le tissu sous-cutané au niveau de l’incision, et pas les tissus mous profonds (ex, fascia et/ou muscle) de l’incision.
Le retrait de sonde est un terme général qui comprend le retrait de toute sonde associée à un dispositif électronique cardiaque implantable, quelle qu’en soit la technique, alors que l’extraction et l’explantation ont une définition plus spécifique. (12)
Explantation de sonde : retrait de sonde implantée il y a moins d’un an, effectué via la veine d’implantation, nécessitant uniquement une traction mécanique et les outils d’implantation typiques.
Extraction de sonde : une extraction de sonde est une procédure plus complexe, qui répond à un ou plusieurs des critères suivants :
19 o La sonde est retirée avec l’assistance d’outils spécialisés (gaines télescopiques,
laser) indépendamment de sa durée d’implantation.
o La sonde est retirée via un autre accès veineux que la veine d’implantation. o La sonde ciblée a été implantée depuis plus d’un an.
Cela dit, cette distinction entre explantation et extraction est en réalité très théorique et en pratique, le terme d’extraction est le plus souvent utilisé pour définir le retrait des sondes sans tenir compte de leur ancienneté.
20
4 Causes possibles d’extériorisation :
4.1 L’infection
L’érosion cutanée causée par le boitier du DECI est habituellement le résultat de l’infection de loge.
L’infection de suture ou de loge de DECI n’est pas rare durant le premier mois et l’incidence est estimée à 1% (del Rio et al., 2003 ; Klug et al., 2007).
Les principaux facteurs de risque décrits sont la réintervention, le diabète, l’âge avancé, les corticoïdes, un opérateur inexpérimenté, et l’insuffisance rénale.
L’antibioprophylaxie avant l’implantation a un effet protecteur.
Dans le cas d’une infection très précoce, une contamination per-opératoire par la flore cutanée (staphylococcus aureus) est la principale source d’infection (Kearney et al., 1994 ; Da Costa et al., 1998). L’infection survenant au-delà d’un mois provient souvent de la sonde (et non de la loge).
Le diagnostic comprend des hémocultures positives (80 % des cas) et l’ETO objectivant des végétations sur les sondes.
Le succès du traitement de l’infection de DECI requiert l’ablation de tout le matériel et l’administration d’antibiotiques.
L’érosion cutanée au site d’implantation et d’autres signes locaux d’infection sont fréquents. Le Staphylococcus epidermidis ou d’autres bactéries gram négatives sont les germes les plus retrouvés.
4.1.1 Épidémiologie
Malgré l’antibioprophylaxie au moment d’une primo-implantation de la sonde ou du changement de boitier (13), les taux d’infections lies aux DECI sont en augmentation, comme l’affirment plusieurs registres nord-américains (14). Ils révèlent un nombre inquiétant d’infections de DECI. Outre l’augmentation du nombre d’implantations, cette ascension s’explique aussi par des facteurs lies à la fois à l’hôte, aux procédures et au matériel implanté (15).
La durée de vie de la population augmente, avec comme corollaire une augmentation du temps d’exposition au risque d’infection chez les patients porteurs de matériel. De plus, les comorbidités sont croissantes chez les patients implantes.
21 Les réinterventions deviennent de plus en plus fréquentes (défaillance de sonde, fin de vie de la batterie), et le taux d’infection est plus important lors du changement de boitier que lors de la primo-implantation (16).
La resynchronisation cardiaque et la pose de défibrillateurs se sont développées. Or le nombre de sondes favorise à lui seul la survenue d’une infection (17). De même, l’implantation d’une sonde de défibrillation présente un risque plus élevé d’infection (18) que pour une sonde de pacemaker. L’origine de ce risque d’infection est certes en partie liée au type de patients qui reçoivent ce matériel, mais il est probable que certaines propriétés physiques liées aux sondes rentrent aussi en ligne de compte (15).
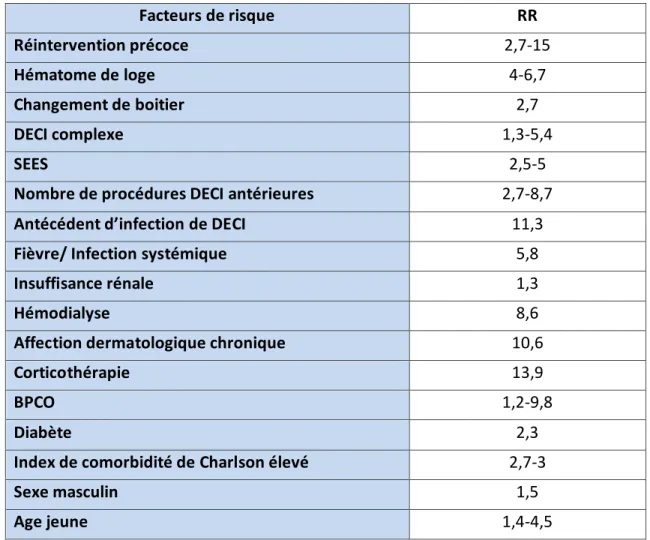
Des études ont identifié des facteurs de risques spécifiques de l’infection de DECI (19-26), parmi lesquels on retrouve l’insuffisance rénale, les complications au site d’implantation (incluant l’hématome de loge), le nombre de sondes, la présence de fièvre dans les 24 heures qui précédent l‘implantation, l’utilisation d’une sonde de stimulation temporaire et une réintervention précoce.
La majorité des infections de DECI sont causées par Staphylococcus aureus ou par des staphylococci coagulase négative; ces deux groupes, et plus particulièrement les staphylococci coagulase négative, sont résistants à l’oxacilline. D’autres bactéries ou des champignons sont plus rarement impliqués (27).
L’intervalle entre la primo-implantation ou le changement de boitier et l’infection est extrêmement variable, de quelques semaines à plusieurs années (27,28).
4.1.2 Diagnostic
Il est parfois difficile de porter le diagnostic d’endocardite infectieuse sur DECI. La présentation clinique varie en fonction de la virulence de l’organisme infectant et de la localisation de la partie du matériel infectée.
Il y a schématiquement trois tableaux cliniques : signes locaux évidents (précoce le plus souvent) ; tableau septique sévère, avec hémocultures positives et végétation en ETT/ETO (tardif) ; et enfin symptômes pulmonaires fébriles, souvent traités comme des épisodes d’infections bronchiques, de diagnostic plus difficile (15).
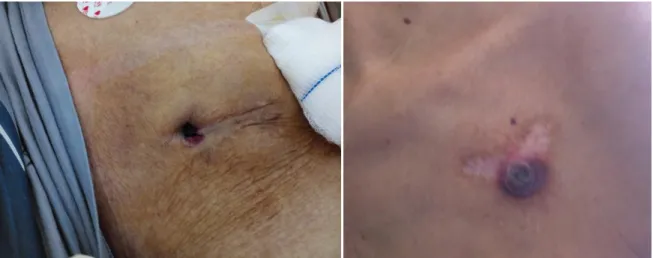
La présentation clinique avec des signes locaux évidents comprend une douleur localisée, un érythème, une érosion ou une ulcération de la peau et des tissus mous, avec parfois fistulisation de la poche vers la peau, permettant l’évacuation d’un abcès. Cet aspect
22 clinique est illustré dans la figure 1. Il peut être difficile de faire la différence entre des changements postopératoires précoces, comme un hématome de loge ou une inflammation de la cicatrice. Une ponction de la poche à visée diagnostique doit être évitée, puisqu’elle augmente le risque d’infection.
FIGURE 1 : Erosion de la peau en regard du boitier de pacemaker, avec orifice chez deux de nos patients.
La deuxième présentation clinique est celle d’une endocardite du cœur droit, avec fièvre et frissons, parfois sepsis sévère ou choc septique, où les hémocultures sont positives et l’ETT/ETO sans équivoque sur la présence de végétations sur la ou les sondes. Le diagnostic est alors assez simple.
Enfin, le dernier tableau clinique est celui d’un patient âgé, porteur de DECI, présentant des pneumopathies à répétition. La présentation clinique est souvent rendue difficile du fait de traitements antibiotiques probabilistes décapitant l’infection sans la guérir, et négativant les hémocultures. Le prélèvement d’hémocultures est essentiel, même si le patient est apyrétique ou n’a pas de signes d’infection systémique. Une échographie transoesophagienne est indispensable, d’autant plus en cas de bactériémie, et surtout s’il s’agit d’un staphylocoque (29). En effet, l’ETO est plus sensible et spécifique afin de diagnostiquer des végétations sur sonde. La présence de végétations sur sonde est en faveur, mais n’est pas pathognomonique d’une endocardite liée au DECI. En effet, des thrombus sur les sondes sont retrouvés lors d’examen échocardiographique systématique chez 5 à 10 % des porteurs de DECI, sans infection (30).
La confirmation diagnostique est appuyée par des données peropératoires, telle que la visualisation d’un abcès, d’un épaississement sous-cutané et des changements
23 inflammatoires. Des prélèvements profonds dans la poche et la mise en culture des sondes une fois leur extraction effectuée sont impératifs et permettent parfois d’isoler la bactérie incriminée afin d’obtenir son profil de résistance.
4.1.3 Prise en charge
Il n’y a pas de données d’études prospectives randomisées pour guider la prise en charge des infections de dispositifs. Les recommandations concernant l’extraction du dispositif, la voie et la durée d’administration des antibiotiques, ainsi que le timing de la réimplantation sont principalement basées sur des données observationnelles.
Les infections liées aux sondes qui ne sont pas traitées ont un taux de mortalité particulièrement élevé, allant de 31 à 66 %, un taux deux à trois fois plus élevé que celui retrouvé chez les patients traités avec une extraction complète du DECI et une antibiothérapie (27,32-38).
Dans une étude rétrospective monocentrique récente (45), incluant tout les cas consécutifs d’infections liées au DECI entre 1991 et 2008 (416 patients), les complications liées à l’extraction du matériel intracardiaque et endovasculaire étaient associées à une augmentation de la mortalité à 30 jours (RR 4,33) et à un an (RR 3,77). Cependant, lorsque l’on comparait un groupe traité par antibiothérapie initiale et extraction différée ou non réalisée, et un groupe avec extraction immédiate, on remarquait que le 2ème groupe avait
une mortalité à un an trois fois moins importante (RR 0,35). En analyse multivariée, l’antibiothérapie sans extraction était associée à une augmentation significative de la mortalité à 30 jours (RR 6,97).
Ces données, bien que rétrospectives, confortent le consensus selon lequel il faut retirer tout le matériel intracardiaque dans tous les cas d’endocardite sur DECI confirmé, le retrait doit être considéré même quand l’infection n’est que suspectée.
Le retrait de toutes les sondes ainsi que le boitier est indiqué en cas d’infection, que l’infection concerne une sonde, plusieurs, ou seulement le boitier. Il est recommandé de ne pas retirer le boitier sans les sondes.
Cependant, chaque cas doit bénéficier d’une évaluation individuelle, basée sur les comorbidités du patient et le risque de l’extraction. Il existe de rares situations, chez des patients avec un pronostic global très sombre ou une espérance de vie limitée, ou un traitement antibiotique au long court est préféré à l’extraction (12,39).
24 Certains auteurs recommandent une extraction chirurgicale, lorsque la taille de la végétation excède 2 cm (31). Cependant, la taille au-dessus de laquelle l’extraction percutanée de sondes présente un plus haut risque que l’extraction chirurgicale reste sujette à discussion. La dernière mise à jour des recommandations sur l’endocardite infectieuse suggère une discussion au cas par cas pour les infections de DECI avec végétations dont la taille excède 2 cm en attendant des données plus robustes(3).
4.1.4 Antibiothérapie
La durée de la couverture antibiotique après extraction repose sur un consensus d’expert (2).
Chez les patients ayant des hémocultures négatives, la durée recommandée est de 7 a 10 jours chez les patients avec une érosion cutanée sans infection de poche et de 10 a 14 jours en cas d’infection de poche associée au DECI.
Chez les patients avec bactériémie, signes d’infection systémique, ou antibiothérapie préalable ayant pu décapiter l’infection, une ETO doit être réalisée. Dans ces cas, au moins deux semaines d’antibiothérapie sont recommandées. Si la bactérie incriminée est un
Staphylococcus aureus, l’antibiothérapie doit être administrée au moins 14 jours (deux à
quatre semaines) après l’extraction du dispositif, et à partir de la date de la négativation des hémocultures. Dans les cas compliqués d’endocardite valvulaire, d’emboles septiques ou d’ostéomyélite, un traitement de 4 à 6 semaines est recommande (29).
Un algorithme de prise en charge diagnostique et thérapeutique des infections de DCI est représenté sur la figure 2.
25 Figure 2 : Algorithme de prise en charge d’une infection de DECI suspectée.
*L’antibiothérapie doit être administrée au moins 4-6 semaines dans l’endocardite (4 semaines pour les valves natives, 6 semaines pour les prothèses ou l’endocardite valvulaire à staphylocoque). S’il existe une végétation sur sonde en l’absence de végétation valvulaire, 4 semaines d’antibiothérapie visant le staphylocoque aureus et 2 semaines pour les autres pathogènes sont recommandées.
Habituellement du coté controlatéral ; un DAI sous-cutané peut être considéré.
**Les recommandations 2010 de l’AHA sur les infections de DECI distinguent l’infection de loge de l’érosion(10).
4.1.5 Réimplantation
Apres l’extraction du DECI, si l’indication d’implantation de stimulateur cardiaque ou de défibrillateur est toujours retenue, il faut dans la mesure du possible implanter un nouveau dispositif sur un autre site que le précédent, généralement en prépectoral controlatéral, avec une sonde endocardique. Bien que le délai avant réimplantation soit mal défini, la réimplantation doit être différée jusqu’à ce que les hémocultures soient négatives et jusqu’à ce que les signes locaux et généraux d’infection disparaissent.
26
4.2 Facteurs locaux favorisant l’extériorisation :
- Hématome de loge :
L’Hématome au niveau de la loge est la complication la plus fréquente après l’implantation (5% des cas) et peut conduire à une hospitalisation prolongée et à fortiori dans certains cas à un échec de cicatrisation voire une nécrose cutanée et aboutir à une réimplantation (1-2%) (Kiviniemi et al., 1999 ; Wiegand et al., 2004).
Les facteurs de risque incluent l’usage de fortes doses d’héparine de bas poids moléculaire, de l’association aspirine-clopidogrel, et d’opérateur inexpérimenté.
L’aspirine seule et l’anticoagulation orale seule telle la warfarine avec un INR<2 n’augmentent pas le risque d’hématome.
L’électrocoagulation ou une reprise exploratrice de la loge est utile pour minimiser le saignement et le risque d’un large hématome. L’usage sélectif d’hémostatiques topiques telle la thrombine topique est réservé aux patients à haut risque. Parfois la mise en place d’un drain est nécessaire et suffisante. L’évacuation d’un hématome est réalisée dans moins de 0,5% avec un risque majeur d’infection ; les indications potentielles incluent le saignement persistant, la douleur réfractaire aux analgésiques, l’échec de cicatrisation et la nécrose cutanée.
- Erosion cutanée mécanique :
L’hyperpression exercée sur la peau en regard de la loge, que ce soit par des forces s’exerçant de l’extérieur de façon chronique (Bretelles, ceinture de sécurité, bandoulière de sac…) ou de l’intérieur par le boitier lui-même s’il est volumineux ou si la poche est très petite, peut aboutir à une érosion cutanée dite mécanique.
D’autres facteurs prédisposants peuvent être présents, par exemple, l’extrême fragilité cutanée des patients âgés, une graisse sous-cutanée précaire, l’usage chronique de corticoïdes, et l’utilisation de désinfectants abrasifs (Kiviniemi et al., 1999).
L’érosion cutanée doit être recherchée et détectée avant l’extériorisation. C’est une complication rarement précoce avec une incidence estimée à 1%.
- Changement de boitier :
Un grand nombre de données cliniques révèlent un risque élevé de complications associées au changement de boitier, en particulier lorsqu’elles sont recherchées systématiquement ou
27 lors de suivi prolongé pendant plusieurs mois. Les complications péri-procédurales directes sont retrouvées dans 1 à 2% des cas, mais le taux de l’ensemble des complications à court terme est plus élevé (approximativement 4% ; variant de 0.6% à 8.2%) (40-42).
Les complications majeures incluent l’infection (0%–5.2%), et l’hématome nécessitant une évacuation (0%–1.6%) (40-42).
Le taux de complications mineures varie de 2.3% à 7.4%, et incluent les infections traitables par antibiotiques, l’hématome, la douleur, et des problèmes de cicatrice.
Il est important de noter que le changement de boitier est associé à 2,2 fois plus de risque de complications liées à la loge en comparaison avec la primo-implantation ; et le risque augmente encore plus avec les changements ultérieurs, allant de 1,5% pour un premier changement à 8,1% pour le quatrième boitier implanté (43).
Ces données soulignent l’importance de minimiser ces risques en déployant tous les efforts pour réduire le nombre de changement de boitier par patient.
Cet objectif peut être accompli par le choix de générateur avec une longévité de batterie supérieure, des seuils optimaux durant l’implantation, éviter les sondes inutiles, et l’usage de stratégies de programmation qui réduisent la consommation et minimiser les stimulations et les thérapies de DAI inutiles (44).
Le changement de boitier ne doit pas être une décision automatique mais réfléchie et discutée avec le patient, en particulier pour le défibrillateur chez le patient âgé chez qui le risque opératoire et procédural même lié à l’âge et aux comorbidités contrebalance le bénéfice de la prévention de mort subite (45).
28
4.3 Facteurs généraux :
Le patient, le rythmologue et le DECI influencent le risque de complications.
Les complications périprocédurales sont associées aux comorbidités du patient tels l’angor crescendo, l’insuffisance cardiaque, la fibrillation atriale, les valvulopathies, l’insuffisance respiratoire, l’insuffisance rénale, l’atteinte cérébrovasculaire, une infection de DECI antérieure, les néoplasies, la fièvre et des pathologies dermatologiques, l’usage d’antiarrhythmiques, d’anticoagulants ou d’antiagrégants plaquettaires, ou de corticoïdes (46).
Les facteurs liés aux procédures qui augmentent le risque de complications incluent les reprises pour déplacement, le changement de boitier, l’hématome, l’absence d’antibioprophylaxie, la stimulation temporaire, faible volume d’implantation (<60-70 / par an), un grand nombre de sondes, les défibrillateurs en comparaison avec les pacemakers, et la resynchronisation biventriculaire (40,41,46).
29
5 Prise en charge des extériorisations
L’extériorisation de n’importe quelle partie du DECI indique une contamination de l’ensemble du système, une extraction de l’ensemble du matériel doit alors être réalisée (12).
5.1 Extraction du matériel :
Préparation du patient
La préparation spécifique d’un patient avant extraction de pacemaker ou de défibrillateur a fait l’objet de recommandations de l’EHRA (European Heart Rythm Association) (47).
Le patient doit être préparé afin de limiter le délai d’intervention en cas de complications. Le champ opératoire est large, permettant un drainage péricardique ou une sternotomie immédiate, l’implantation de stimulateur ou de défibrillateur controlatéral et enfin un accès bilatéral au Scarpa. Le patient est équipé de deux voies veineuses périphériques de bon calibre et parfois d’un cathéter artériel en cas de procédure à risque. L’intervention idéalement se déroule sous anesthésie générale, sous ventilation mécanique, au bloc opératoire de chirurgie cardiaque ou au moins thoracique. Sont présents un opérateur principal, un assistant, un anesthésiste, une infirmière formée en extraction et en implantation de DECI, une infirmière sachant manipuler un appareil de radioscopie. Un chirurgien cardiaque est sur site, prévenu de l’intervention, capable d’intervenir en urgence en cas d’avulsion myocardique ou vasculaire, car le pronostic de ces complications est directement lié au délai d’intervention.
Sont disponibles des outils d’extraction, des outils d’implantation, du matériel de ponction et de drainage péricardique, de drainage thoracique, un défibrillateur externe, du matériel de radioscopie adapté (amplificateur de brillance ou capteur plan).
Voies d’abord
Les sondes sont typiquement extraites par voie haute, via la veine d’implantation.
Cependant, parfois, par exemple lorsque l’extrémité libre de la sonde ne peut pas être atteinte par voie haute, une voie d’abord basse via la veine fémorale est nécessaire. De plus, certaines équipes utilisent des approches hybrides, ou via des voies veineuses alternatives. Ainsi, Bongiorni et coll. ont rapporté le succès d’une approche via la veine fémorale et la veine jugulaire interne pour des sondes flottantes et des sondes avec des adhésions denses
30 dans la veine cave supérieure (Maytin et al., 2010). Fischer et coll. ont également décrit une technique hybride par voie haute et basse, la voie basse permettant de stabiliser la sonde en amont du point de contact avec l’endocarde, diminuant les risques d’avulsion cardiaque provoqués par la traction par voie haute (Fischer et al., 2009).
Approche « step by step »
Une approche étape par étape, prédéfinie, est appropriée pour aboutir à l’extraction du matériel cible dans la plus grande partie des cas en utilisant un minimum d’outils.
Dans un premier temps, une incision est réalisée, permettant un accès au site d’implantation, et si possible parallèle au plan des sondes. Il faut inciser en reprenant la première cicatrice d’intervention (en cas de changement préalable) de façon à aborder les sondes à leur point d’entrée dans la veine. Cet abord permet de repérer les olives de fixation de ces sondes ou les sutures directes sur la veine, olives ou point de fixation qu’il faut retirer. Secondairement, les sondes sont désolidarisées du PM ou du DAI, puis sectionnées le plus distal possible (le plus proche possible de leur connecteur). En cas d’infection, une incision elliptique, afin d’exciser les tissus cicatriciels, est réalisée, ainsi que des prélèvements profonds. Le boitier est retiré et les sondes ciblées sont disséquées jusqu’à leur site d’entrée veineux. La dissection autour du site d’entrée veineux est essentielle pour permettre le passage des outils d’extraction, mais peut se compliquer d’hémorragie.
Ensuite, un guide est introduit dans la sonde. Une astuce assez simple est de commencer par repousser la sonde dans la veine. Si cela est possible, cela veut dire que la sonde n’est pas adhérente à l’endoveine. Une fois le guide en place, il faut dévisser la sonde à laquelle on applique une traction douce souvent suffisante en cas d’implantation récente (< 1 an en pratique). Si la sonde ne peut être repoussée et si l’implantation est ancienne, il faut introduire un guide afin de mesurer la longueur de la sonde. Secondairement, ce guide est remplacé par un extracteur qui va permettre d’appliquer une traction sur l’ensemble du corps de la sonde. Si cette tentative échoue à nouveau, des gaines télescopiques ou un extracteur laser sont utilisés.
Si la sonde se rompt lors de cette procédure, une approche trans-fémorale vient compléter la procédure d’extraction.
31
Résultats de l’extraction
Les taux de succès pour les extractions de sondes sont variables. Cette variabilité dans les résultats tient compte de l’hétérogénéité des populations et de la disparité dans la définition du succès.
Les grandes séries de patients dans les centres les plus expérimentés rapportent de très hauts taux de succès complet (95 a 99 %) et un faible taux de complications majeures (2 à 3 %) même si des complications sont observées, telles que la tamponnade, la lacération vasculaire, l’insuffisance tricuspide traumatique, et le décès (48-50). Ce faible taux de complications s’explique par l’expérience de ces centres puisqu’il est parfaitement prouvé que la probabilité de complications décroit avec l’expérience de l’opérateur et le volume d’extraction (51). Les conclusions de ces études ne sont donc pas généralisables à toutes les situations d’extraction et à tous les centres.
La plupart des complications est traumatique, liée aux sondes elles-mêmes. Ce sont les déchirures vasculaires, les perforations cardiaques, l’embolisation de thrombus ou de végétations à partir de la sonde et les insuffisances tricuspides. Lorsqu’elle est réalisée par des opérateurs expérimentés, l’extraction reste grevée d’un taux de mortalité de 1 %, avec un taux de complication majeure de 2 à 3 %.
Les facteurs de risque de complications lors d’une extraction de sondes sont notamment l’âge jeune, le sexe féminin, les calcifications autour de la sonde à la radiographie de thorax et l’extraction de sondes multiples (50).
5.2 Antibiothérapie
32
5.3 Réimplantation
5.3.1 Site
Autant que possible, le nouveau boitier doit être implanté à site différent de celui du système explanté, si celui-ci était infecté. La position endocardique controlatérale est la plus fréquemment utilisée. La position abdominale avec une sonde endocardique tunnelisée ou une sonde épicardique est une alternative exceptionnellement utilisée (patient dépendant d’une stimulation et dispositif infecté).
5.3.2 Temps
Le délai optimal avant réimplantation reste sujet à discussion. Chez les patients avec une infection de sonde, ce délai doit être le plus long possible, en prenant en compte le risque encouru par le patient durant le temps passé sans dispositif de stimulation. Cependant, chez les patients avec une infection de la poche du DECI sans signes d’infection systémique et sans endocardite sur sonde, le nouveau dispositif peut être implante à un site différent du premier des que les signes d’infection locaux ont disparu.
La réimplantation précoce est généralement réservée aux patients dépendant de leur pacemaker, sans échappement, même sous isoprénaline.
5.3.3 Gestion avant la réimplantation
- Pacemaker :
Patients pacemaker-dépendants :
o Isoprénaline IVSE, afin d’accélérer le rythme d’échappement sous-jacent.
o Sonde d’entrainement électrosystolique temporaire. La stimulation temporaire est laissée en place jusqu’à ce que les hémocultures soient négatives et que l’infection endocardique soit contrôlée, ce qui nécessite généralement deux semaines d’antibiothérapie parentérale. Un stimulateur cardiaque permanent peut alors être implanté, et le traitement par antibiotiques poursuivi.
o Implantation d’un système de stimulation épicardique (boitier intra-abdominal) immédiat, avec le concours d’un chirurgien cardiaque.
o Implantation temporaire d’une sonde endocardique à vis par voie haute reliée à un PM conventionnel positionné en pré-cutané.
33 Certains patients qui ne sont pas dépendants de leur stimulateur peuvent être surveillés sous télémétrie sans stimulateur temporaire jusqu’à l’implantation d’un nouveau dispositif.
- Défibrillateur
Les différentes options sont les suivantes :
o Surveillance sous télémétrie permanente jusqu’a ce que les conditions soient réunies pour la réimplantation en cas d’implantation en prévention secondaire ou en cas d’indication d’implantation en prévention primaire chez un patient ayant déjà présenté des arythmies depuis l’implantation du DAI.
o Réimplantation immédiate épicardique. o Défibrillateur automatique portatif (LifeVest).
o Réimplantion à distance en cas d’indication initiale d’implantation en prévention primaire chez un patient n’ayant pas présenté d’arythmie ventriculaire depuis la primo-implantation
5.3.4 Non-réimplantation
Il est intéressant de noter que 30 à 50 % des patients ayant subi une extraction de DECI ne sont pas réimplantés (28). Il s’agit de patients non dépendants du système de stimulation, chez qui l’indication d’implantation initiale est soit revue à la baisse, soit dont le bénéfice du système de stimulation est dépassé par le risque attendu d’infection de ce système.
Première situation, l’indication d’implantation est revue à la baisse, au regard des données Holter du stimulateur retiré, ou grâce aux données de la surveillance télémétrique permanente qui suit l’extraction.
Deuxième situation, le bénéfice clinique net est défavorable. Sans que l’indication d’implantation initiale soit remise en cause, le bénéfice clinique net ne justifie pas la réimplantation. De telles décisions sont prises au cas par cas après évaluation du bénéfice escompté de l’implantation, et du risque immédiat et futur de la réimplantation.
Enfin, chez certains patients, implantés d’un défibrillateur en prévention primaire, qui n’ont pas bénéficié de thérapie appropriée au cours de leur temps d’implantation, il n’est pas déraisonnable d’envisager la non-réimplantation, si la réimplantation comporte un risque particulièrement élevé.
34 Le but du travail qui suit est donc d’étudier la prévalence des facteurs prédictifs d’extériorisation de DECI et leur prise en charge dans le CHU de Rabat entre 2009 et 2019 et de comparer ces résultats aux données de la littérature.
35
36
1 OBJECTIFS DE L’ÉTUDE
Il s’agit d’une étude rétrospective, observationnelle et monocentrique, incluant tous les patients ayant bénéficié d’une extraction de pacemaker ou de défibrillateur pour extériorisation de matériel de cause infectieuse ou non infectieuse, dans l’unité de rythmologie, au CHU de Rabat, entre janvier 2009 et Décembre 2019 inclus.
Cette étude a pour but de déterminer la prévalence des patients qui présente une extériorisation de pacemaker, indépendamment du temps de la dernière implantation, de relever la fréquence des facteurs de risque d’extériorisation décrits dans la littérature et d’identifier d’autres facteurs associés.
37
2 MATÉRIEL ET MÉTHODES
Cette étude était conduite au Département de rythmologie du CHU de Rabat.
Les registres d’archive ont été revus, et les patients référés pour évaluation de problèmes liés à leur pacemaker sur une période s’étendant de 2009 à 2019 ont été identifiés.
Le motif d’admission variait de simples modifications cutanées locales à l’extériorisation avec ou sans signes cliniques d’infection du boitier ou des sondes.
Les données concernant l’âge des patients, l’histoire médicale, l’histoire du dispositif, le motif de consultation, les données de l’examen clinique, les résultats biologiques et microbiologiques, les traitements reçus, le timing et type d’interventions, et les résultats en terme de récidive ont été recueillies et analysées.
2.1 Critères d’inclusion
Sondes implantées par voie endovasculaire exclusivement, dans le ventricule droit, l’oreillette droite ou dans le sinus coronaire.
Sondes de pacemaker ou de défibrillateur, reliées à un boitier pectoral. Extraction percutanée ou chirurgicale.
Absence de durée minimale requise entre l’implantation et le retrait.
2.2 Critères d’exclusion
Absence de modifications cutanées au site d’implantation.
2.3 Définitions utilisées dans notre étude
- Extériorisation : érosion cutanée exposant le matériel (boitier ou sonde) au milieu extérieur.
- Menace d’extériorisation : Modifications cutanées locales au site d’implantation présageant l’extériorisation sans interruption cutanée.
- L'infection est suspectée et recherchée dans les deux cas, devant toute érosion cutanée ou menace d'extériorisation de matériel.
38
2.4 Variables étudiées
2.4.1 Caractéristiques liées au patient
Age lors de la primo-implantation, sexe, poids.
Comorbidités type diabète, HTA, habitudes toxiques, cardiopathie sous-jacente, FEVG, stade NYHA lors de l’hospitalisation pour primo-implantation, FA, insuffisance respiratoire, créatininémie et fonction hépatique lors de l’hospitalisation pour primo-implantation
Traitement en cours tel la prise d’antiagrégants plaquettaires, d’anticoagulants oraux (INR le jour de la primo-implantation) ou de corticoïdes,
2.4.2 Caractéristiques liées à la primo-implantation
Indication d’implantation, classe et niveau de preuve de l’indication. Type de matériel (stimulation, resynchronisation ou défibrillation). Site d’implantation en précisant le type d’incision et le niveau de la loge.
Conditions d’implantation : fièvre 24h avant implantation, bilan inflammatoire, le recours et la durée de SEES temporaire, antibioprophylaxie (type, délai d’administration par rapport au geste).
Antécédents de reprise ou de changement de boitier et leur délai par rapport à l’extériorisation.
Facteurs locaux type traumatisme local, brûlure, hyperpression cutanée, nécrose ou hématome.
2.4.3 Caractéristiques liées à l’extraction
Indication d’extraction, classe et niveau de preuve de l’indication. Technique utilisée. Type de matériel et nombre de sondes extraites. Stimulo-dépendance et recours à une SEES ou sonde épicardique. Succès ou échec d’extraction. Nécessité d’une extraction chirurgicale. Ancienneté de l’implantation.
2.4.4 Données sur les Endocardites infectieuses confirmées liées
au DECI
En cas d’endocardite infectieuse liée au dispositif cardiaque implantable confirmée, présence ou non de végétations en ETT, en ETO, hémocultures, culture per-opératoire,
39 bactérie incriminée, antibiogramme, nombre d’antibiotiques utilisés et durée de l’antibiothérapie.
2.4.5 Caractéristiques liées à la réimplantation
Caractère simultané ou différé de la réimplantation, délai de réimplantation en jours si différée, type de réimplantation (endocardique ou épicardique, homolatérale ou controlatérale, type d’incision, niveau de la loge).
En cas de non-réimplantation, cause (indication non retenue après réévaluation, du fait d’un bénéfice clinique revu a la baisse, ou lorsque le bénéfice clinique n’est pas remis en cause, risque considéré comme trop important).
2.4.6 Résultats après la réimplantation
Succès avec absence de récidive, récidive d’EI, ré-extériorisation.
2.5 Recueil des données
Nous avons colligé rétrospectivement les données pour chaque patient à partir des dossiers (compte-rendu d’hospitalisation et de consultation). Pour prendre en considération l’ensemble des extractions/réimplantations sur la période définie, nous avons consulté les registres d’implantation et d’extraction de stimulateurs et de défibrillateurs entre 2009 et 2019 ou étaient inscrites les données procédurales.
2.6 Analyse statistique
Pour l’analyse des facteurs prédictifs d’extériorisation potentiels dans notre série, les mesures des tendances centrales - moyenne, médiane ou mode – sont calculées à l’aide du test du Chi carré, la méthode exacte de Fisher à intervalle unilatéral et les Odds Ratio exacts, et sont comparés aux résultats rapportés dans la littérature.
40
3 RÉSULTATS
Entre janvier 2009 et décembre 2019, 1363 procédures d’implantation de DECI ont été recensées dans notre institution (Centre Hospitalo-universitaire IBN SINA de Rabat, Département de Cardiologie).
41
3.1 Caractéristiques des patients
Les caractéristiques des patients sont présentées dans le tableau 1 :
Caractéristiques Cas (n=18) Témoins (n=18)
Age Médiane=55 ans [17-83] Médiane=71,5 ans [56-88]
Sexe (H/F) 12H/6F 11H/7F
Poids - -
Classe NYHA 8(44%)I/6(33%)II/2(11%)III/2(11%)IV 4(22%)I/4(22%)II/7(38%)III/3(16%)IV
Diabète 7 (38%) 4 (22%)
HTA 12 (66%) 11 (61%)
Tabagisme Ancien 4 / actif 3(16%) 5 (27%)/2 (11%)
Dyslipidémie 5 (27%) 2 (11%) FA 3 (16%) 2 (11%) Cardiopathie Ischémique 4 (22%) 2 (11%) CMD non ischémique 1 (5%) 1 (5%) CMH 1 (5%) 0 Valvulaire 2 (11%) 1 (5%) Rythmique 1 (5%) 0 Cœur sain 9 (50%) 14 (77%) FEVG >50% 14 (77%) 17 40-50% 1 (5%) 0 (94%) <40% 3 (16%) 1 (5%) Antiagrégants plaquettaires
Simple 2 (11%)/Double 2 (11%) Simple 3 (16%)/Double 1 (5%)
Anticoagulant 4 (22%) 3 (16%)
Corticoïdes 0 0
Insuffisance rénale (cl<60ml/min)
2 (11%) 3 (16%)
Insuffisance respiratoire 0 2 (11%) (PID/BPCO)
Insuffisance hépatique 0 1 (5%) (Cytolyse/VHC+)
42
3.2 Données concernant la primo-implantation
Les données concernant les procédures de primo-implantation sont présentées dans le tableau 2. Notre unité de rythmologie collige des patients implantés initialement dans d’autres services à travers le royaume, de ce fait, Ces données de primo-implantation n’ont pas pu être relevées chez 4 patients :
Un patient porteur de PM initialement implanté au CHU de Casablanca,
Un patient porteur de DAI infecté un mois après implantation dans une clinique privée de Rabat,
Un troisième patient porteur de CRT implanté également dans une clinique privée, Et le patient le plus jeune de la série implanté d’un PM double chambre pour BAV
congénital au service de cardiologie A à Rabat.
Primo-implantation Cas (n=14) Témoins (n=18)
Fièvre 24h avant implantation 1 (7%) 0
CRP/Procalcitonine positive 2 (14%) 3 (16%)
SEES 4 (28%) 4 (22%)
Antibioprophylaxie Tous (100%) Tous (100%)
Type d’incision Deltopectorale 100% Deltopectorale 100%
Loge Sous-cutanée 100% Sous-cutanée 100%
Réinterventions
Reprise 3 0
Changement de boitier 1 0
Une notion de fièvre au cours de la primo-implantation a été retrouvée chez un seul patient parmi les cas avec lymphangite, sans élévation des marqueurs biologiques d’inflammation. La CRP était modérément élevée chez 2 patients dans notre série de cas lors de la primo-implantation dans des contextes de décompensation acido-cétosique chez un diabétique non contrôlé et post-opératoire de remplacement valvulaire aortique chez une autre
43 patiente, les deux étaient porteurs d’une SEES. Parmi les témoins, la CRP était modérément élevée chez 3 patients porteurs de SEES dont un dans un contexte de post-IDM inférieur. Parmi les indications de reprises dans notre série, on note :
une reprise un mois après primo-implantation pour déplacement de sonde ventriculaire, une reprise laborieuse pour défaut de capture 9 ans après primo-implantation pour un
BAV congénital,
deux reprises chez un même patient la première pour repositionnement de la sonde ventriculaire à 1 mois de la primo-implantation, et la deuxième 1 mois après le repositionnement pour hémostase.
Un seul patient de notre série de cas a bénéficié de deux changements de boitier à 8 ans de la primo-implantation avec atrialisation, puis 7 ans après avec changement de la sonde ventriculaire droite.
44
3.3 Données concernant les infections documentées
Les données concernant les infections de matériel de stimulation ou de défibrillation sont présentées dans le tableau 3 :
Infections documentées/Extériorisations N=13/18 (72%)
Infection isolée de loge 5 (27%)
EI sur sonde 8 (44%)
EI valvulaire 0
Infection systémique avec sepsis 1(5%)
Hémocultures positives 3(16%)
Culture matériel positive 4(22%)
Prélèvement de pus positif 2(11%)
Végétations ETT/ETO 8(44%)
Germe isolé 8(44%)
Antibiothérapie 18(100%)
Nombre d’ATB utilisés (moy) 2,75
Durée ATB 4-6 semaines
Les données concernant les infections documentées sont présentées dans le tableau 4 :
Germes E.I. sur sonde documentées
Staphylococcus epidermidis - Staphylococcus aureus 4 Staphylococcus hominis 1 Enterococcus - Streptococcus bovis/intermedius/oralis - Streptococcus sobrinus 1 Klebsiella oxytoca/pneumoniae - Serratia - Pseudomonas aeruginosa 1 Pseudomonas putida 1 Proteus - Enterobacter cloaque/durans - Acinetobacter baumanni -
45 Dans notre série, 72% des cas d’extériorisations présentent des signes d’infection associés : 27% d’infections isolées de loge, une anomalie évocatrice d’endocardite infectieuse sur sonde visualisée en ETT/ETO dans 44% des cas (végétation mobile ou engainante le long de la sonde), par contre aucun cas d’endocardite valvulaire n’a été relevé.
Le germe a été isolé sur culture de matériel dans 22% des cas, sur prélèvement de pus dans 11% des cas, et les hémocultures étaient positives dans 16% des cas. Le staphylocoque aureus est le principal germe retrouvé dans notre série, sensible à la méticilline dans 3 cas sur 4.
L’infection peut être classée selon son délai d’apparition après primo-implantation. L’infection est dite « précoce » lorsque le délai entre l’implantation et le diagnostic et la reprise est de moins d’un mois, et « tardive » si ce délai se situe entre 1 mois et 1 an. Enfin, elle est dite « retardée » si ce délai dépasse 1 an.
Dans notre série, une infection précoce était retrouvée dans 5,5% des cas (1/18), tardive dans 27%(5/18), et retardée dans 66 % des cas (12/18). Le délai moyen d’extériorisation était de 34 mois avec des extrêmes de 1 mois et 15 ans (Tableau 5).
Délai d’apparition de l’infection après implantation
Cas (n=18)
Précoce (<1mois) 1/18 (5,5%)
Tardive (1mois-1an) 5/18 (27%)
Retardée (>1an) 12/18 (66%)
Une antibiothérapie probabiliste est démarrée de façon systématique chez tous les cas d’extériorisation de notre série, après prélèvements bactériologiques. Cette antibiothérapie vise principalement le staphylocoque avec une association de vancomycine et de gentamycine, adaptée secondairement aux résultats de l’antibiogramme. En l’absence de signes infectieux et si les prélèvements bactériologiques sont négatifs, l’antibiothérapie est arrêtée au bout de 2 semaines ; Autrement, elle est poursuivie 4 à 6 semaines.
46
3.4 Résultats concernant les procédures d’extraction
Le tableau 6 détaille les caractéristiques du matériel extrait :
Caractéristiques des procédures Cas (n=18)
Type de matériel
PM 15 (83%)
(2 Monochambre/ 13 Double chambre)
DAI 1 (5,5%)
monochambre
CRT 2 (11%)
(1 CRT-D/ 1 CRT-P) Nombre de sondes extraites
1 6
2 9
3 1
Site de la sonde extraite
OD 14
VD (PM) 11
VD (DAI) 2
VG 1
Age des sondes
<1 an 6
1 an-3 ans 6
>3 ans 4
Stimulodépendance 8
Stimulation alternative
SEES temporaire fémorale 5
Sondes épicardiques 2
Sonde ventriculaire laissée en place, boitier externe
4
Extraction chirurgicale 2
Les pacemakers constituent le principal type de matériel extrait dans 83% des cas, contre 5,5% de DAI et 11% de CRT ; avec un total de 32 sondes extraites (27 sondes par voie percutanée, et 5 sondes par voie chirurgicale).
47 Le recours à l’extraction chirurgicale était inévitable chez deux patients de notre série en raison de l’ancienneté des sondes datant de 15 ans et de 12 ans. Ces patients ont été envoyés directement à la chirurgie, sans tentative préalable d’extraction percutanée.
Dans notre série, un cas d’infection de cicatrice a été traité initialement de façon conservatrice sans extraction de matériel avec ouverture de la coque de la loge PM, nettoyage et résection de la peau infectée, toilette à la bétadine et injection de 750 mg de ciprofloxacine. L’évolution s’est faite 2 mois plus tard vers une extériorisation avec infection isolée de la loge sans bactériémie et sans germe isolé, ayant motivé une extraction-réimplantation différée avec évolution favorable.
Chez 2 patients stimulo-dépendants de notre série, la sonde ventriculaire a été laissée en place, avec externalisation du boitier.
Le taux de succès procédural complet (retrait de toutes les sondes ciblées, dans leur intégralité, sans complication majeure lors de la procédure) était de 100 % dans notre série. Parmi les causes d’échec possibles, on peut citer la rupture ou le blocage de la sonde lors du passage dans le défilé costo-claviculaire, les adhérences myocardiques, les adhérences veineuses ou la rupture de l’électrode distale dans le myocarde. Aucune de ces complications n’a été décrite dans notre série.
On n’a recensé aucun décès per procédural. Les complications majeures per procédure pouvant conduire au décès ont lieu le plus souvent après l’extraction d’une sonde ventriculaire, par avulsion ou plaie cardiaque ou vasculaire :
La déchirure de la veine cave supérieure étendue ou non aux parois de l’oreillette droite nécessite une sternotomie en urgence, réalisée sur place par les chirurgiens cardiaques.
La tamponnade par plaie du ventricule droit, survenant pendant les manœuvres de traction sur la sonde, souligne la fibrose et les adhérences qu’il peut exister, et nécessite également l’intervention du chirurgien en urgence.
Dans notre série, aucune complication mineure n’a été retrouvée. Il peut s’agir entre autres de plaie vasculaire près du site d’entrée veineux nécessitant une réparation par un chirurgien, de la migration de fragment de sonde dans la circulation artérielle pulmonaire,