HAL Id: tel-01591198
https://tel.archives-ouvertes.fr/tel-01591198
Submitted on 21 Sep 2017HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Relation ” communauté-ressource ” : cas des
communautés marines d’invertébrés benthiques qui
exploitent les débris grossiers dérivés de plantes
terrestres
Sandrine Fanfard
To cite this version:
Sandrine Fanfard. Relation ” communauté-ressource ” : cas des communautés marines d’invertébrés benthiques qui exploitent les débris grossiers dérivés de plantes terrestres. Ecologie, Environnement. Université Pierre et Marie Curie - Paris VI, 2016. Français. �NNT : 2016PA066678�. �tel-01591198�
Propriété intellectuelle et propriété des données
Ce travail est le fruit d’une collaboration impliquant mes deux directeurs de thèse et moi-même. Mes directeurs ont fourni l’idée générale qui guide la recherche, les ressources requises pour supporter et conduire cette recherche. Le partage des droits de propriété intellectuelle relatifs aux travaux réalisés dans le cadre de cette collaboration repose sur des ententes spécifiques intervenues entre les différents participants.
En ce qui concerne le support et la conduite des travaux présentés dans les chapitres 2 et 3 du manuscrit, il convient de préciser que les données mises à ma disposition sont issues du projet Deflam : “De la forêt à la Mer : Transfert et recyclage du bois mort sur la marge continentale méditerranéenne’’. Ce projet est financé par le programme national « Écosphère Continentale et Côtière » de l’INSU dans le cadre de l’action thématique « Dynamique et Réactivité des Interfaces Littorales ». Le projet Deflam, dans lequel est impliqué le Professeur Jean-Marc Guarini, est dirigé par le Docteur François Charles. Il est évident, pour moi, que la valorisation des résultats sous la forme de publications ne sera envisageable qu’avec l’accord de toutes les personnes impliquées dans le programme ayant participé aux expériences décrites dans le manuscrit.
Résumé
Dérivants ou submergés, les débris grossiers dérivés de plantes terrestres fournissent de l'énergie et des nutriments pour les écosystèmes marins. En considérant cette matière organique allochtone, l’objectif de ma thèse est de décrire le processus d'assemblage d’une communauté autour d’une ressource trophique et de considérer en retour l’effet de la diversité et de la composition observée au sein de cette communauté sur la dynamique d’exploitation de la ressource. Pour ce faire, j'ai combiné des expériences in situ et la modélisation avec l'intention de parvenir à une description cohérente et quantitative du lien écogéochimique entre la biodiversité et le fonctionnement des écosystèmes. En utilisant de la litière de feuilles et du bois mort, cette approche a permis: (i) de montrer l'importance des interactions biotiques dès le début du processus d'assemblage de la communauté, (ii) de faire le lien explicite entre la consommation des ressources et la dynamique de populations des consommateurs, et (iii) de tester comment la transformation des ressources est affectée par la diversité observée au sein des communautés.
Mots clés: Ecologie des communautés, Colonisation, Expérimentation, Prédation, Model
stochastique, Débris grossiers de bois, Dynamique de décomposition, Tarets, Mer Méditerranée.
Abstract
Either adrift or submerged, coarse debris derived from terrestrial plants provide energy and nutrients for marine ecosystems. By considering this allochtonous organic material, the goals of my PhD were to describe the assembly process of macrobenthic communities around food sources and to consider the feedback effect of the observed communities on the geochemical fate of the resource. To do so, I combined in situ experiments and modelling with the intention to build a consistent, quantitative description of the ecogeochemical link between biodiversity and ecosystem functioning. Using leaf litter and dead wood, this approach allowed: (i) to show the importance of biotic interactions from the beginning of the community assembly process, (ii) to make the explicit connection between the resource consumption and the population dynamics of the consumers, and (iii) and to test how resource processing is affected by the specific diversity of
6
Remerciements
Comment commencer ? Par qui ? Par quoi ? 3 années de doctorat, un peu plus de 4 ans passés à Banyuls… Bien plus qu’un diplôme, qu’un travail, j’en retiendrai l’expérience de vie, les rencontres, les collègues, les amis !
Trois années de doctorat supposent en effet des échanges scientifiques, une acquisition de compétences et de connaissances qui nous préparent à notre métier futur, de chercheur, de chargé d’études, nous permettant de développer notre ouverture d’esprit, de la créativité, de la persévérance et beaucoup d’adaptabilité face aux difficultés. Quand on commence le doctorat, on est motivé(e), passionné(e), concentré(e) et volontaire. La dureté de la tache n’est pas un secret, on signe pour cette part également, en espérant pouvoir faire du projet qu’on nous confie un travail de qualité, valorisé et discuté en fin de course par la production d’un manuscrit tel que celui-ci et lors de la soutenance de thèse.
C’est donc par cette étape finale que je commencerai, en remerciant les membres de mon jury, rapporteurs, examinateur et président, pour leur évaluation de mon travail et pour l’obtention de mon diplôme de doctorat. Je remercie donc Frédéric Olivier et Tarik Meziane pour leurs critiques objectives et très instructives de ce manuscrit, Laurent Chauvaud pour son regard extérieur et sa réflexion sur le sujet, et enfin, Eric Thiebaut pour avoir accepté de présider ce jury, ainsi que pour son rôle capital dans le processus final de soumission et défense du présent projet doctoral. Je vous remercie donc tous les quatre pour votre participation à mon jury de thèse, et notamment pour la discussion finale de soutenance qui m’a permis d’exprimer et de défendre l’entièreté de ma réflexion sur ce travail de 3 ans.
Je souhaite également adresser une pensée particulière pour le service informatique de l’Observatoire de Banyuls, qui a permis la retransmission en directe de ma soutenance à Banyuls en visioconférence à partir de l’UPMC, et ce, malgré une demande de dernière minute et des difficultés techniques. Merci donc à Michel G. et Fabien C. pour votre disponibilité et réactivité face à cette situation, et d’avoir permis à ceux qui m’ont soutenu à Banyuls d’assister à cette étape finale.
8
marins, Paulo B. Ce trio m’aura appris tant de choses, entre partager une passion commune que je n’effleurais qu’à peine à mon arrivée, jusqu’à un soutien et un enseignement technique dans le long travail de détermination des mignonettes petites bestioles qui ont bien voulu coloniser mes expériences in situ. Et voilà qu’entre les histoires passionnantes de Jean-Michel, les blagues et nuitées tardives de Paulo, et l’amitié de Céline jusqu’au bout du bout, je peux leur dire un grand merci, car ils ont fortement contribué à l’amélioration de mes compétences dans ce domaine. Seulement cette thèse ne consistait pas uniquement en de la taxonomie des macroinvertébrés benthiques marins, malgré l’aspect chronophage de la tache qui aura pris bien plus de la moitié de mon temps effectif de thèse. Ce sujet englobait des analyses moléculaires, dont les aspects scientifiques complémentaires n’ont pu être qu’effleurés dans ce manuscrit. Grace à ce volet, j’ai eu tout de même la chance de travailler avec Gilles V., le sourire du 3ème étage, et accessoirement ingénieur d’étude spécialisé dans les analyses biogéochimiques de la matière organique... Gilles, merci pour ces conversations qui auront enrichi ma réflexion du sujet, posé les limites des techniques abordées, et surtout merci pour ton enseignement technique lors des analyses de mes échantillons. Ce fut toujours un plaisir d’échanger avec toi, ressortant systématiquement reboostée et la tête pleine d’une réflexion neuve et de nouvelles pistes à creuser !
Enfin, avant l’analyse taxonomique ou moléculaire de mes échantillons, une étape non moins négligeable est celle du terrain, de la mise en place à l’échantillonnage des expériences in situ, et des tentatives expérimentales de laboratoires. L’étape en mer a nécessité l’investissement des marins et plongeurs de la station, à la fois pour accéder au site de pose (SOLA en baie de Banyuls sur mer), pour la sécurité et l’assistance de surface, la mise en place des cages en plongée et les échantillonnages complémentaires. J’ai pu également compter sur l’assistance technique de l’atelier pour la confection des dispositifs expérimentaux (les miens et ceux de ma stagiaire de master 2 qui n’aurait pu réussir sans leur concours). Je remercie donc les marins, Arnaud, Christophe, Jean-Luc, Eric et Germain, les plongeurs, Jean-Claude et Bruno, et à l’atelier Yannick, René et Serge pour leur soutien technique, leur amitié et surtout les bons moments partagés au fil de ces 4 années à l’observatoire.
Pour les expériences de laboratoire, n’ayant malheureusement pas abouti, je tiens tout particulièrement à remercier Lionel F., un ami cher, passionné et talentueux qui, au delà de son aide pratique et le partage de ses connaissances en aquariologie, a été un véritable exemple de persévérance, d’acharnement au travail, de rigueur et de succès en terminant sa thèse de façon exemplaire par une soutenance bluffante et les félicitations de son jury ! Merci mon Yo pour ces moments partagés, au boulot comme en dehors !
Après la science, la thèse est également une aventure humaine, qui amène du bon et du mauvais, mais surtout qui nous ouvre les yeux sur les personnes qui nous entourent. Face à cette tache ardue, où l’on est plus ou moins guidé(e), on « doit » y arriver, coute que coute ! Mais comment ? Pour ma part, j’y suis arrivée certe, mais pas seule !
Quand on débute on se fait des connaissances, avec qui on échange « science », puis des blagues de boulot, et enfin des histoires de vie, du quotidien… ces mêmes personnes deviennent des amis, des confidents, des piliers, des armes au jour le jour ! Ce sont leurs sourires le matin, les bonjours, les au revoirs, des coups de gueule aux fous rires autour d’un café… Des Personnes d’exception… Tout d’abord les banyulencs, amis doctorants ou salariés… Merci aux gamers et plus proches amis, Mareike V., Marine B., Hugo B., Hugo L. et Océane, Marc K. et Mathieu R., Tatiana S. et Rémy V., Mariana P. et Matthias G., et les non gamers, mais non des moindre, Elsa S. et Brian, Margot D. et Szandra B. et vos petites familles, Lyvia L., Nathalie G., Valérie D., Lionel F. et Olivier P., Belèn Q. et Renata A., pour nos soirées détente, nos pauses café toujours bienfaitrices, nos discussions engagées et tous ces fous rires ! Vous êtes le meilleur de ces quatre années à Banyuls, j’ai muri scienfifiquement et humainement à vos cotés, par nos échanges, vos critiques, notre amitié et notre solidarité à toute épreuve ! Vous étiez là, pendant le travail quotidien, les conférences, les journées des doctorants, à écouter, critiquer, questionner mon travail, à dédramatiser certaines épreuves ou aider à en surmonter d’autres… Un grand merci mes amis, mes piliers ! Je n’oublierai pas « de remercier les chinchilas, dictateurs éclairés, chérifs et renégats, les cat-sitters en chefs, et admirateurs de ses majestées les chats, d’avoir effectué le déplacement et navigué avec leurs gros doigts » le long de ce parcours doctoral. Chinch les Mamas !!!
Et avant de clôturer ces remerciements, une pensée particulière pour une amie spéciale, Carinne R. J’étais là il y a quelques années pour le début de ta thèse, à travailler sur tes échantillons, tout en découvrant ce qui devenait une passion, un métier, un objectif à concrétiser... L’écologie marine dans ses belles lignes je l’ai découverte avec toi, et voilà qu’en cette fin de doctorat, c’est toi qui a répondu présente pour m’aider. Carinne, un grand merci pour tes relectures, pour ton soutien, et pour m’avoir redonné la confiance en moi nécessaire pour finaliser cette étape !
Enfin, je souhaiterais remercier mes parents et mon frère pour avoir répondu présents, nuit et jour, et qui m’ont soutenue durant ce parcours de 3 ans et bien plus ! Un merci tout particulier pour ma mère et mon frère, pour vos encouragements quotidiens, votre présence malgré la distance, et Maman pour avoir été là en personne à ma soutenance de thèse. Enfin, un dernier mot pour ma famille de cœur, Marlyne, Camille, Marithée et Yvon, toujours indéfectiblement à mes cotés.
Un grand merci à vous tous, ayant contribué de près ou de loin, du début ou à la fin, scientifiquement ou humainement, à cette réussite !!! Elle est aussi la vôtre !
12
EFFET DE LA DIVERSITÉ DE LA COMMUNAUTÉ SUR LA RESSOURCE 100 CHAPITRE III : DIVERSITÉ SPÉCIFIQUE DES COMMUNAUTÉS DE TEREDINIDAE
ET CONSOMMATION DU BOIS, UNE APPROCHE THÉORIQUE 102
INTRODUCTION 104
MATERIEL ET METHODES 106
Expérience in situ de colonisation des bois ... 106
Le modèle individu centré ... 106
RESULTATS 108 Résultats de l’expérience in situ ... 108
Le modèle ... 108
L’expérimentation virtuelle ... 110
DISCUSSION 110 CONCLUSION 116 REFERENCES BIBLIOGRAPHIQUES 116 DISCUSSION GÉNÉRALE ET PERSPECTIVES 120 Rappels des objectifs et des principaux résultats ... 122
Le mécanisme d’assemblage de la communauté ... 124
Rôle de la ressource dans le mécanisme d’assemblage ... 126
Exploitation de la ressource par une diversité d’organismes spécialisés ... 128
Choix de l’approche, combinant expérimentation in situ et modélisation mathématique ... 132
CONCLUSION ET PERSPECTIVES 134 REFERENCES BIBLIOGRAPHIQUES 136 ANNEXES 150 IDENTITE DE LA RESSOURCE ET MISE EN PLACE DE LA COMMUNAUTE ECOLOGIQUE 152 Annexe 1 : Mécanisme d’assemblage d’une communauté autour d’une ressource « habitat » ... 154
Annexe 2 : Caractérisation moléculaire des ressources détritiques : feuilles de Vigne et de Hêtre ... 164
DIVERSITE SPECIFIQUE ET DEMOGRAPHIQUE DES CONSOMMATEURS PRIMAIRES : EFFET SUR LA DYNAMIQUE DE DEGRADATION DE LA RESSOURCE TROPHIQUE 168 Annexe 3 : Diversité des consommateurs primaires et Dynamique de dégradation de la ressource ... 170
TIRES A PART DES CHAPITRES 1 ET 2 :ARTICLES PUBLIES 176 Annexe 4 : « First Record of Harmothoe mariannae Barnich & Fiege, 2009 (Polychaeta : Polynoidae) in the Mediterranean Sea, France » ... 178
14
TOTAL 4 DISPOSITIFS ONT ETE IMMERGES A 1 M DE PROFONDEUR, PUIS ECHANTILLONNES AU HASARD APRES 97,146,208 ET 402 JOURS D’EXPERIMENTATION. ... 79FIGURE II.2 : DIMINUTION DE LA MASSE DES TASSEAUX DE PIN (PINUS SYLVESTRIS) (RONDS NOIRS), ATTAQUES PAR LES POPULATIONS DE TEREDINIDAE (CARRES BLANCS) AU COURS DE L’EXPERIENCE IN
SITU (A).LES COURBES REPRESENTENT L’AJUSTEMENT DU MODELE AUX DONNEES EXPERIMENTALES (B). ... 83
FIGURE III.1:NOMBRE DE GALERIES DES TEREDINIDAE OBSERVE POUR CHACUNE DES 5 PIECES DE BOIS, REPARTI PAR CLASSES DE TAILLES (DIAMETRE EN MM), ET EN FONCTION DU POURCENTAGE DE RECOUVREMENT TOTAL QU’ELLES OCCUPENT SUR LA SURFACE DU BOIS. ... 105
FIGURE III.2:RECOUVREMENT DE LA SURFACE INITIALEMENT DISPONIBLE EN FONCTION DU NOMBRE DE TENTATIVES D’INSTALLATIONS D’UN NOUVEL INDIVIDU.LE DIAMETRE DES GALERIES ETANT SOIT DE 3MM (A) ; 5MM (B) OU 10MM (C) ; NOMBRE D’ECHANTILLONS : K = 5 ; TAILLE DE CHAQUE ECHANTILLON : N =30. ... 107
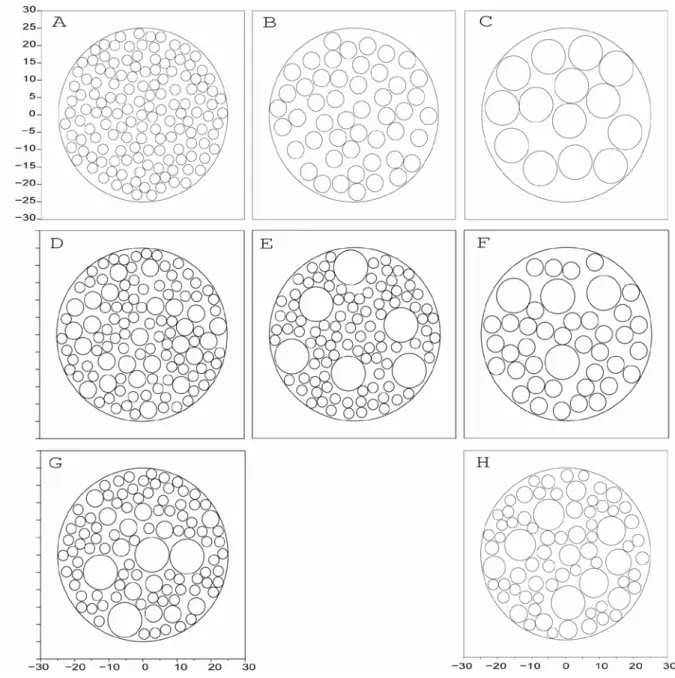
FIGURE III.3:SORTIES GRAPHIQUES DES SIMULATIONS :A,B ET C POUR UN TYPE DE CERCLE AVEC UN DIAMETRE FIXE RESPECTIVEMENT DE 3,5 ET 10MM ;D,E ET F, POUR UNE COMBINAISON DE DEUX TYPES DE CERCLES AVEC UN DIAMETRE FIXE RESPECTIVEMENT DE 3 ET 5MM,3 ET 10MM, ET 5 ET 10MM ;G POUR UNE COMBINAISON DE TROIS TYPES DE CERCLES AVEC DES DIAMETRES DE 3,5 ET 10MM ;H POUR DES CERCLES AVEC UNE GAMME DE DIAMETRES DE 3 A 10MM. ... 111
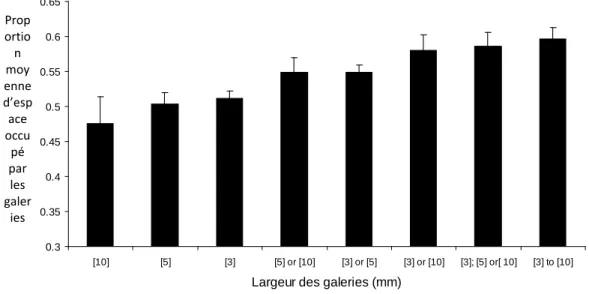
FIGURE III.4 : PROPORTION MOYENNE D’ESPACE OCCUPE EN FIN DE SIMULATIONS POUR DIFFERENTS DIAMETRES DE GALERIES : UN DIAMETRE FIXE, UNE COMBINAISON DE DEUX OU TROIS DIAMETRES FIXES, ET UN DIAMETRE ALEATOIRE.LES NOMBRES ENTRE CROCHETS CORRESPONDENT AU DIAMETRE DES GALERIES.TAILLE DES ECHANTILLONS : N =100 ;NOMBRE DE TENTATIVES D’INSTALLATION = 75000... 113
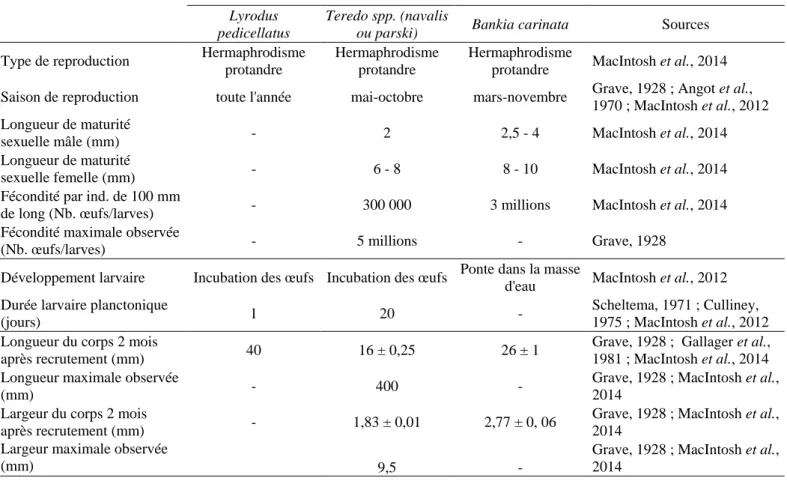
TABLE III.3 :TRAITS D’HISTOIRE DE VIE DES TROIS TAXONS LES PLUS ABONDANTS EN MEDITERRANNEE,
LYRODUS PEDICELLATUS,TEREDO SPP. ET BANKIA CARINATA. ... 115
FIGURE AI.1:PROTOCOLE EXPERIMENTAL ET ECHANTILLONNAGE.LE DISPOSITIF EXPERIMENTAL PRINCIPAL (D1) COMPORTAIT 3 UNITES DE 5 MICROCOSMES :3 EXPERIMENTAUX CONTENANT DES FEUILLES DE HETRE (E1 A E3),1 EXPERIMENTAL CONTENANT DES MORCEAUX DE PAPIER PLASTIFIE (E0), ET 1 TEMOIN (C).DEUX MICROCOSMES ADDITIONNELS (DIC_M1/2 ET M2/3) ONT ETE MIS EN PLACE A DEUX TEMPS INTERMEDIAIRES, DECALES A 36 ET 86 JOURS D’EXPERIENCE, ET ONT ETE ECHANTILLONNES A LA PERIODE SUIVANTE. ... 155
FIGURE AI.2:DIVERSITE TAXONOMIQUE DES ASSEMBLAGES EXPERIMENTAUX.SONT REPRESENTEES POUR CHAQUE DUREE D’EXPERIENCE,36,86 ET 133 JOURS (RESPECTIVEMENT M1,M2 ET M3),(A) LES ABONDANCES RELATIVES POUR CHACUN DES 5 PHYLUMS, LA RICHESSE SPECIFIQUE (S) ET L’EFFECTIF TOTAL (N) OBSERVES DANS CHAQUE MICROCOSME EXPERIMENTAL (C1, C2 ET C3), ET (B) LES ABONDANCES ABSOLUE ET RELATIVE MOYENNES DES PRINCIPAUX PHYLUMS. ... 155
FIGURE AI.3 : VARIABILITE SPATIO-TEMPORELLE DES ASSEMBLAGES EXPERIMENTAUX. ANALYSE FACTORIELLE DE CORRESPONDANCE (AFC) REALISEE SUR LE TABLEAU DE CONTINGENCE DES TAXONS IDENTIFIES ET QUANTIFIES A CHAQUE PERIODE DE PRELEVEMENT, 36, 86 ET 133 JOURS D’EXPERIMENTATION (M1,M2 ET M3) ET POUR CHAQUE REPLICA (C1,C2 ET C3).LES RONDS GRIS REPRESENTENT LES TAXONS, ET LES TRIANGLES NOIRS SONT LA PROJECTION DES CAGES EXPERIMENTALES PLACEES EN FONCTION DE LEURS ASSEMBLAGES (SCALING DE TYPE 2). ... 157
FIGURE AI.4 : VARIABILITE TEMPORELLE DES PRINCIPAUX PHYLUMS IDENTIFIES. ABONDANCE TOTALE MOYENNE DES 5 PHYLUMS PRINCIPAUX RELEVEE DANS LES MICROCOSMES EXPERIMENTAUX POUR CHAQUE PERIODE D’ECHANTILLONNAGE, A 36,86 ET 133 JOURS D’EXPERIMENTATION (M1,M2 ET M3).L’ECART TYPE A LA MOYENNE EST REPRESENTE PAR UNE BARRE VERTICALE ET MONTRE LA VARIABILITE INTER MICROCOSMES OBSERVEE POUR CHAQUE TEMPS. ... 157
FIGURE AI.5 : VARIABILITE SPATIO-TEMPORELLE DES GENRES LES PLUS ABONDANTS AU SEIN DES ASSEMBLAGES EXPERIMENTAUX. ANALYSE FACTORIELLE DE CORRESPONDANCE REALISEE SUR LE TABLEAU DE CONTINGENCE DES GENRES LES PLUS ABONDANTS AUX TROIS TEMPS,36,86 ET 133 JOURS (M1, M2 ET M3) ET POUR CHAQUE REPLICA (C1, C2 ET C3). LES CERCLES GRIS REPRESENTENT LES TAXONS IDENTIFIES ET LES TRIANGLES NOIRS, LES MICROCOSMES POSITIONNES EN FONCTION DE LEUR ASSEMBLAGE (SCALING DE TYPE 2). ... 158
FIGURE AI.6:VARIABILITE TEMPORELLE DU RATIO VAGILE / SESSILE.LE RATIO MOYEN VAGILE/SESSILE CORRESPOND A LA DIVISION DE L’ABONDANCE DES ESPECES DE CONSOMMATEURS PRIMAIRES POTENTIELS VAGILES SUR CELLE DES SESSILES (IND/IND) POUR CHAQUE MICROCOSME EXPERIMENTAL. CETTE VALEUR MOYENNE EST CARACTERISEE POUR CHAQUE DUREE EXPERIMENTALE (36,86 ET 133 JOURS) ET PAR UN ECART TYPE A LA MOYENNE (BARRE VERTICALE). ... 159
FIGURE AII.1CARACTERISATION DU CONTENU MOLECULAIRE DES FEUILLES DE VIGNE (VITIS VINIFERA) ET DE HETRE (FAGUS SYLVATICA).LA MASSE CONTENUE DANS 1 MG DE FEUILLES DE CHACUNE (A) DES TROIS CLASSES MOLECULAIRES, LIPIDES, PROTIDES ET GLUCIDES, ET (B) DES QUATRE FAMILLES D’ACIDES GRAS, BRANCHES, MONOINSATURES, POLYINSATURES ET SATURES, ONT ETE MESUREES POUR LES DEUX ESPECES FOLIAIRES. ... 164
FIGURE AIII.1:VARIATION TEMPORELLE DE LA MASSE SECHE DE FEUILLES DE VIGNE (A), DE L’ABONDANCE MOYENNE DES CONSOMMATEURS PRIMAIRES (B) ET DE LEUR MASSE TOTALE MOYENNE (C) DANS LES MICROCOSMES EXPERIMENTAUX.LES VALEURS MOYENNES (CROIX NOIRES) ET LEURS ECARTS TYPES (BARRES HORIZONTALES) SONT CALCULES A PARTIR DES DONNEES DES MICROCOSMES EXPERIMENTAUX. ... 171
FIGURE AIII.2 :PROJECTIONS DES DEUX PREMIERS PLANS DE L’ANALYSE EN COMPOSANTES PRINCIPALES (ACP) REALISEE SUR 4 DESCRIPTEURS DE LA VARIABILITE SPATIOTEMPORELLE (FLECHES ROUGES) OBSERVEES DANS LES MICROCOSMES EXPERIMENTAUX (TRIANGLES NOIRS). CES QUATRE DESCRIPTEURS SONT LA DUREE DE L’EXPERIENCE (TPS), LA MASSE SECHE DE FEUILLES DE VIGNE (FVMS), L’ABONDANCE TOTALE (CPRAB.) ET LA MASSE SECHE TOTALE (CPRMS.) DES 3 CONSOMMATEURS PRIMAIRES IDENTIFIES,CAPITELLA SPP.,GAMMAROPSIS MACULATA ET ERICTHONIUS PUNCTATUS... 172
FIGURE AIII.3: DYNAMIQUE DE DEGRADATION DE LA RESSOURCE, LES FEUILLES DE VIGNE, ESTIMEE A PARTIR DES ABONDANCES DES CONSOMMATEURS PRIMAIRES (CAPITELLA SPP., G. MACULATA ET E.
PUNCTATUS), PRECEDEMMENT SIMULEES PAR LE MODELE DE DYNAMIQUE DE COMMUNAUTE DEVELOPPE DANS LE CHAPITRE 1 (FANFARD ET AL.,2016).LA DEGRADATION DE LA RESSOURCE PREND EN COMPTE LA CONSOMMATION DIRECTE PAR LES 3 TAXONS (A), LIMITEE PAR LA QUANTITE DE RESSOURCE DISPONIBLE A LA CONSOMMATION (B), ET PAR LA COMPETITION INTERSPECIFIQUE LIMITANT LE NOMBRE D’INDIVIDUS CAPABLES DE CONSOMMER (C) A CHAQUE PAS DE TEMPS.AINSI, SONT REPRESENTEES LA MASSE MOYENNE DE FEUILLES NON CONSOMMEES (COURBE NOIRE), LES ECARTS TYPES (COURBES GRISES), AINSI QUE LES VALEURS EXPERIMENTALES (TRIANGLES NOIRS). 173
Introduction générale
I
NTRODUCTION
38
MÉCANISME DE MISE EN PLACE D’UNE COMMUNAUTÉ
M
ÉCANISME
DE
M
ISE
EN
P
LACE
D’UNE
C
OMMUNAUTÉ
La stratégie pour décrire et quantifier la dynamique d’une communauté et celle de la ressource qu’elle exploite est de considérer un assemblage naturel d’espèces qui s’organise autour de cette ressource. Les macrodétritus dérivés de plantes terrestres que l’on trouve en mer et les invertébrés capables d’utiliser et transformer ce matériel d’origine allochtone constituent un sous-système qui peut permettre de suivre la dynamique de la ressource et d’observer le processus d’assemblage d’un nombre réduit d’espèces autour de cette ressource.
Dans cette première partie du manuscrit, nous cherchons à observer le processus de mise en place et de structuration d’une communauté expérimentale de macro invertébrés benthiques en milieu naturel, en réponse à l’utilisation d’une ressource introduite. Une première expérience in situ a ainsi été menée, mettant en jeu une ressource allochtone distincte, sélective et identifiable : des feuilles de vigne, Vitis vinifera.
L’expérience in situ permet d’identifier et caractériser la diversité, la dynamique spatio-temporelle et la structuration fonctionnelle de la communauté colonisatrice. L’analyse des résultats permet d’émettre des hypothèses sur les processus biotiques impliqués dans le mécanisme global d’assemblage. Dans un second temps, nous utilisons la modélisation mathématique afin de simuler la dynamique de communauté observée, sur la seule base des processus identifiés expérimentalement et des traits écologiques des espèces.
La confrontation entre dynamiques simulées et observées nous permet de vérifier la robustesse de nos hypothèses et de hiérarchiser les processus simulés entre eux.
40
C
HAPITRE
I
C
OMBINED
IN SITU
E
XPERIMENTATION
AND
M
ODELLING
A
PPROACHES
TO
D
ISENTANGLE
P
ROCESSES
IN
THE
E
ARLIEST
S
TAGE
OF
C
OMMUNITY
A
SSEMBLY
CHAPITRE I -
Combined in situ experimentation and
modelling approaches to disentangle processes involved in
the earliest stage of community assembly
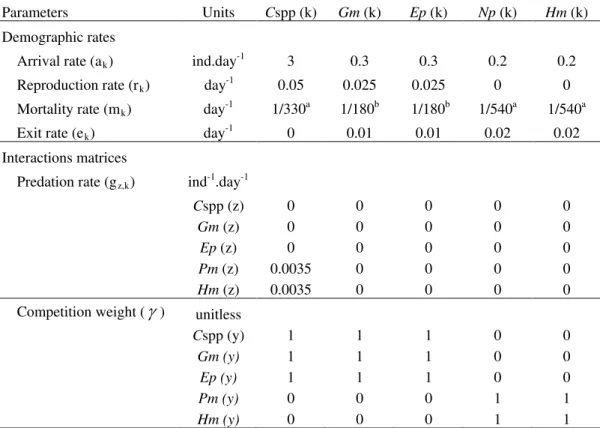
Table I.1. Parameters (ak, rk, mk, gz,k, ek and gy,k) used in the colonization model (equation 1, Figure I.2) representing the dynamics of the 5 interactive taxa identified in the study: Cspp, Capitella spp.; Gm, Gammaropsis maculata; Ep, Erichthonius punctatus; Np, Nereiphylla paretti; Hm, Harmothoe mariannae. k, y and z indicate the species. Mortality rates are determined from values found in the literature for similar ecosystems (see references below) and other values are based on order of magnitude. Despite the presence of 5 different identified taxa, the model can simplify to a 2 prey-1 predator system, by grouping 2 pairs: Gammaropsis maculata and Erichthonius punctatus, and Nereiphylla paretti and Harmothoe mariannae.
Parameters Units Cspp (k) Gm (k) Ep (k) Np (k) Hm (k) Demographic rates
Arrival rate (ak) ind.day-1 3 0.3 0.3 0.2 0.2
Reproduction rate (rk) day-1 0.05 0.025 0.025 0 0 Mortality rate (mk) day-1 1/330a 1/180b 1/180b 1/540a 1/540a
Exit rate (ek) day-1 0 0.01 0.01 0.02 0.02
Interactions matrices
Predation rate (gz,k) ind-1.day-1
Cspp (z) 0 0 0 0 0
Gm (z) 0 0 0 0 0
Ep (z) 0 0 0 0 0
Pm (z) 0.0035 0 0 0 0
Hm (z) 0.0035 0 0 0 0
Competition weight ( ) unitless
Cspp (y) 1 1 1 0 0
Gm (y) 1 1 1 0 0
Ep (y) 1 1 1 0 0
Pm (y) 0 0 0 1 1
Hm (y) 0 0 0 1 1
a Giangrande 1997, b Bellan-Santini et al. 1998.
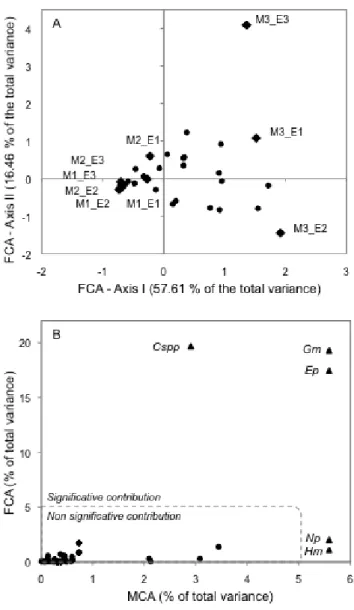
Figure I.2. A) Projection plan of the two first axes of the Factorial Correspondence Analysis
(FCA) performed on the contingency table of the taxa abundances in experimental microcosms. Taxa are depicted by dots and microcosms by diamonds. Axis I, representing 57.61% of the overall variance, accounted for temporal changes in taxa composition, separating M1 and M2 from M3. Axis II, representing 16.46% of the overall variance, accounted for the variability between microcosms, mainly separating C1, C2 and C3 of M3. B) taxa contributions to the total variances
72
EXPLOITATION DE LA RESSOURCE
E
XPLOITATION
DE
LA
R
ESSOURCE
Dans le chapitre précédent, nous avons tenté d’observer le mécanisme de mise en place et de structuration de communautés d’invertébrés benthiques autour d’une ressource allochtone détritique.
Lors de cette expérience basée sur la feuille de vigne comme ressource trophique, nous avons identifié une forte structuration des espèces durant le processus d’assemblage de la communauté. La dynamique temporelle de cette dernière correspond aux dynamiques interactives de populations des espèces qui la composent, essentiellement organisées en réseau trophique. Le contrôle des prédateurs sur les populations de consommateurs primaires s’est avéré être le processus le plus structurant. Il affecte à la fois la diversité des espèces, leurs abondances, et leurs dynamiques au cours du temps.
Mais au-delà de cette pression de prédation, il est évident que la dynamique de population des espèces prédatrices est également dépendante de celle de leurs proies potentielles, elle-même conditionnée par la présence d’une ressource consommable. Nous avons donc démontré l’importance de cette structuration trophique de la communauté dès la phase précoce de colonisation, néanmoins, sans pouvoir caractériser ou quantifier le lien trophique entre cette communauté en cours d’assemblage et sa ressource primaire.
Dans ce chapitre, nous nous focalisons sur l’effet de la communauté sur la dynamique de sa ressource. Nous essayons de comprendre comment la communauté, via les consommateurs primaires, impacte la dynamique de sa ressource. Ainsi, en conservant notre approche méthodologique entre expérimentation in situ et modélisation mathématique, nous espérons caractériser et quantifier l’effet des consommateurs primaires sur la dynamique de leur ressource.
Lors de cette nouvelle expérience in situ, nous utilisons le bois comme ressource allochtone, plus aisément standardisable et quantifiable au cours du temps. L’objectif est de décrire et de quantifier, à partir de pièces de bois normalisées, la dégradation du bois mort en mer et de relier ce processus à la dynamique de colonisation de cette ressource par des xylophages marins.
74
C
HAPITRE
II
D
YNAMIQUE
DE
D
ÉGRADATION
DU
B
OIS
M
ORT
EN
M
ER
CHAPITRE II -
Dynamique de dégradation du bois
mort en mer
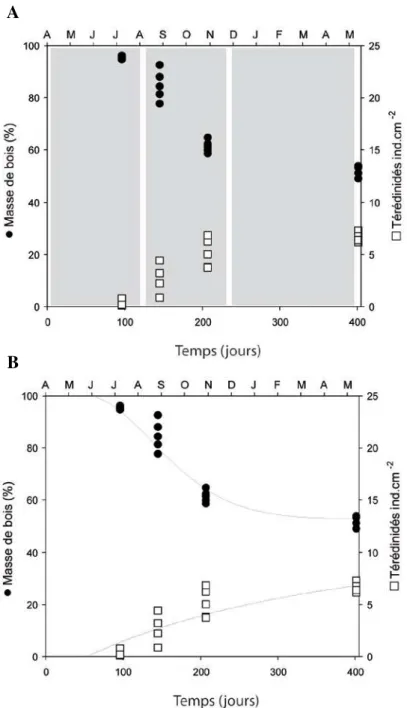
Figure II.2 : Diminution de la masse des tasseaux de pin (Pinus sylvestris) (ronds noirs), attaqués
par les populations de Teredinidae (carrés blancs) au cours de l’expérience in situ (A). Les courbes représentent l’ajustement du modèle aux données expérimentales (B).
A
Table II.1 : Valeurs optimales des paramètres et taux du modèle, estimés mathématiquement et
illustrés par les simulations de la Figure II.2B.
Constantes Unités Valeurs
Temps de latence jours 53
, taux d’arrivée des Teredinidae individus.jour-1 7.67
Tc, nombre critique de Teredinidae individus 2180
k, taux de consommation ind-1.jour-1 0.000018
100
EFFET DE LA DIVERSITÉ DE LA COMMUNAUTÉ SUR LA RESSOURCE
E
FFET
DE LA
D
IVERSITÉ
DE LA
C
OMMUNAUTÉ
SUR LA
R
ESSOURCE
Dans le chapitre 2, nous avons pu caractériser et quantifier l’effet des consommateurs primaires sur leur ressource. Ce lien a été illustré à la fois à partir du processus de consommation du bois par les Teredinidae, impactant directement la dynamique de dégradation de leur ressource, mais également par une rétroaction du bois sur la dynamique de ses consommateurs.
D’une part, le processus de consommation du bois par les Teredinidae influence directement la vitesse de dégradation de cette ressource. Par ce processus densité-dépendant, la dynamique de population des consommateurs primaires influence directement celle de la ressource. D’autre part, la quantité de bois disponible (surface et volume) limite la dynamique de population des Teredinidae, et ainsi sa propre consommation.
Les Teredinidae, famille d’espèces sessiles, utilisent donc le bois comme une ressource trophique mais aussi « habitat ». Dans ces deux types d’appropriation de la ressource, ces invertébrés benthiques sont en compétition pour (i) la quantité de surface disponible pour leur établissement et leur croissance de population, et (ii) pour la quantité de nourriture disponible pour leur développement et croissance individuels. Cette compétition intra et interspécifique n’a pu être explicitement exprimée et quantifiée.
Dans le chapitre 3, nous souhaitons faire ce lien explicite entre la diversité des consommateurs primaires et son impact sur la dynamique de dégradation de la ressource. L’identité des espèces et la composition de l’assemblage doivent être connues afin d’expliquer la variabilité observée dans l’exploitation de la ressource. Nous allons donc tester théoriquement le potentiel d’utilisation du bois par différents assemblages de Teredinidae, caractérisés par la taille des galeries qu’ils y forent.
102
C
HAPITRE
III
D
IVERSITÉ
S
PÉCIFIQUE
DES
C
OMMUNAUTÉS
DE
T
EREDINIDAE
ET
C
ONSOMMATION
DU
B
OIS
: A
PPROCHE
T
HÉORIQUE
CHAPITRE III : Diversité spécifique des communautés
de Teredinidae et consommation du bois, une approche
théorique
0.3 0.35 0.4 0.45 0.5 0.55 0.6 0 50000 100000 150000 200000 250000 300000 Tentatives d'installation C ons om m at ion de l a r es s our c e C 0.3 0.35 0.4 0.45 0.5 0.55 0.6 0 50000 100000 150000 200000 250000 300000 Tentatives d'installation C ons om m at ion de l a r es s our c e B 0.3 0.35 0.4 0.45 0.5 0.55 0.6 0 50000 100000 150000 200000 250000 300000 Tentatives d'installation C ons om m at ion de l a r es s our c e A
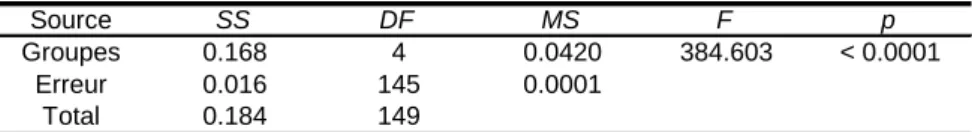
Table III.1 : Test d’analyse de variance (ANOVA) et post hoc. Couverture de la surface
disponible avec l’augmentation des tentatives d’installation. Diamètre des galeries : 3mm (haut) ; 5mm (milieu) ; 10mm (bas) ; nombre d’échantillons : k = 5 ; taille des échantillons : n = 30.
Analyse de variance lorsque la largeur de la galerie est de 3 mm
Source SS DF MS F p
Groupes 0.168 4 0.0420 384.603 < 0.0001 Erreur 0.016 145 0.0001
Total 0.184 149 Test de Tukey
Classement et regroupements des groupes non significativement différents. Groupes Moyenne Comparaisons
1500 0.429 A
15000 0.493 B
75000 0.515 C
150000 0.515 C
300000 0.518 C
Analyse de variance lorsque la largeur de la galerie est de 5 mm
Source SS DF MS F p
Groupes 0.074 4 0.0185 51.336 < 0.0001 Erreur 0.052 145 0.0004
Total 0.126 149 Test de Tukey
Classement et regroupements des groupes non significativement différents. Groupes Moyenne Comparaisons
1500 0.449 A
15000 0.493 B
75000 0.504 B C
150000 0.505 B C
300000 0.510 C
Analyse de variance lorsque la largeur de la galerie est de 10 mm
Source SS DF MS F p
Groupes 0.047 4 0.012 10.188 < 0.0001
Erreur 0.166 145 0.001
Figure III.3 : Sorties graphiques des simulations : A, B et C pour un type de cercle avec un
Figure III.4 : Proportion moyenne d’espace occupé en fin de simulations pour différents
diamètres de galeries : un diamètre fixe, une combinaison de deux ou trois diamètres fixes, et un diamètre aléatoire. Les nombres entre crochets correspondent au diamètre des galeries. Taille des échantillons : n = 100 ; Nombre de tentatives d’installation = 75000.
Table III.2 : Analyse de la variance ANOVA et tests post-hoc realisés sur les résultats de
simulation du modèle. Diminution de la ressource pour des combinaisons de galeries de diamètres différents. Nombre d’échantillons : k = 5 ; Taille des échantillons : n = 30.
0.3 0.35 0.4 0.45 0.5 0.55 0.6 0.65 [10] [5] [3] [5] or [10] [3] or [5] [3] or [10] [3]; [5] or[ 10] [3] to [10]
Largeur des galeries (mm)
C ons om m at ion de l a r es s our c e
Analyse de variance, taux de recouvrement en fonction de la composition de l'assemblage de galeries
Source SS DF MS F p
Groupes 1.322 7 0.1889 422.775 < 0.0001
Erreur 0.354 792 0.0004
Total 1.676 799
Test de Tukey, différences entre les groupes.
Classement et regroupements des groupes non significativement différents. Groupes Moyenne [10] 0.476 A [5] 0.503 B [3] 0.512 B [5] or [10] 0.548 C Comparaisons Prop ortio n moy enne d’esp ace occu pé par les galer ies
Table III.3 : Traits d’histoire de vie des trois taxons les plus abondants en Méditerrannée, Lyrodus pedicellatus, Teredo spp. et Bankia carinata.
Lyrodus pedicellatus
Teredo spp. (navalis
ou parski) Bankia carinata Sources
Type de reproduction Hermaphrodisme protandre
Hermaphrodisme protandre
Hermaphrodisme
protandre MacIntosh et al., 2014 Saison de reproduction toute l'année mai-octobre mars-novembre Grave, 1928 ; Angot et al.,
1970 ; MacIntosh et al., 2012 Longueur de maturité
sexuelle mâle (mm) - 2 2,5 - 4 MacIntosh et al., 2014
Longueur de maturité
sexuelle femelle (mm) - 6 - 8 8 - 10 MacIntosh et al., 2014
Fécondité par ind. de 100 mm
de long (Nb. œufs/larves) - 300 000 3 millions MacIntosh et al., 2014
Fécondité maximale observée
(Nb. œufs/larves) - 5 millions - Grave, 1928
Développement larvaire Incubation des œufs Incubation des œufs Ponte dans la masse
d'eau MacIntosh et al., 2012 Durée larvaire planctonique
(jours) 1 20 -
Scheltema, 1971 ; Culliney, 1975 ; MacIntosh et al., 2012 Longueur du corps 2 mois
après recrutement (mm) 40 16 ± 0,25 26 ± 1
Grave, 1928 ; Gallager et al., 1981 ; MacIntosh et al., 2014 Longueur maximale observée
(mm) - 400 -
Grave, 1928 ; MacIntosh et al., 2014
Largeur du corps 2 mois
après recrutement (mm) - 1,83 ± 0,01 2,77 ± 0, 06
Grave, 1928 ; MacIntosh et al., 2014
Largeur maximale observée
(mm) 9,5 -
Grave, 1928 ; MacIntosh et al., 2014
120
Discussion générale et perspectives
D
ISCUSSION
G
ÉNÉRALE
150
152
Identité de la ressource et mise en place de la communauté écologique
I
DENTITÉ DE LA
R
ESSOURCE
ET
M
ISE EN
P
LACE DE LA
C
OMMUNAUTÉ
É
COLOGIQUE
Anx 1 : Mécanisme d’assemblage d’une communauté autour
d’une ressource « habitat »
Anx 2 : Caractérisation moléculaire des ressources détritiques :
feuilles de Vigne et de Hêtre
154
Annexe 1 : Mécanisme d’assemblage d’une communauté autour
d’une ressource « habitat »
Dans le but de vérifier les propriétés d’assemblage de la communauté écologique identifiées dans le Chapitre 1, nous avons mis en place une nouvelle expérience in situ, sur la même base protocolaire que la précédente. Elle a pour but d’observer la dynamique temporelle d’assemblage d’une communauté de macrofaune benthique et celle de la ressource introduite dans les microcosmes. Dans cette expérience, la ressource allochtone unique est constituée de feuilles de Hêtre, Fagus sylvatica. Notre objectif est de (i) confirmer l’importance des interactions biotiques dans le processus de structuration trophique de la communauté (e.g prédation), (ii) identifier un lien potentiel entre l’identité de la ressource et la diversité - dynamique des consommateurs primaires à la base du réseau trophique, et (iii) vérifier l’importance des mécanismes de succession dans la dynamique d’assemblage.
Protocole et échantillonnage
En début d’expérience, chaque microcosme contenait 4g de masse sèche de feuilles de hêtre, Fagus sylvatica, préalablement déshydratées et pesées. Puis, chaque unité a été échantillonnée respectivement à 36, 86 et 133 jours d’expérience (Figure AI.1). La colonisation des microcosmes par des invertébrés benthiques était limitée par une taille de maille de 3 mm pour les microcosmes expérimentaux, et de 200 μm pour les microcosmes témoins. Des microcosmes expérimentaux ont été placés à des temps intermédiaires afin d’identifier les potentiels processus de succession des espèces dans leur séquence de colonisation des cages.
Dès les microcosmes échantillonnés, la macrofaune a été triée vivante dans un premier temps, pour permettre un sous-échantillonnage d’individus pour des analyses isitopiques ultérieures. Tout invertébré présent a été compté et identifié jusqu’au niveau spécifique dans la majorité des cas, puis conservé dans de l’éthanol à 70%.
Les feuilles de Hêtre ont été triées et libérées de toute macrofaune. Des sous-échantillons de feuilles ont été prélevés et congelés à -80°C en conditions stériles pour des analyses isotopiques et moléculaires ultérieures (Annexe 2).
Variabilité spatiotemporelle des assemblages expérimentaux
La diversité totale recensée au sein des microcosmes est de 346 taxons identifiés, soit 10758 individus comptabilisés. Sept phylums ont été recensés dont des Arthropodes, Mollusques, Annélides, Chordés, et quelques Echinodermes (0,6% de l’abondance totale). Les Arthropodes dominent l’abondance totale, particulièrement représentés par l’espèce Gammaropsis maculata correspondant à 70 % des effectifs totaux (Figure AI.2a).
156
La richesse spécifique des assemblages expérimentaux augmente avec la durée d’expérience, avec 34, 68 et 75 taxons identifiés en moyenne par microcosme, respectivement à 36, 86 et 133 jours d’expérience (Figure AI.2a). L’abondance de chaque taxon augmente également avec la durée de l’expérience, à l’exception des arthropodes dont elle diminue significativement entre 86 et 133 jours (Figure AI.2b). Ce dernier phylum reste dominant dans la majorité des microcosmes.Cependant, cette diminution d’abondance (absolue et relative), cause une légère inversion de dominance en fin d’expérience, avec des assemblages composés en moyenne de 35% d’arthropodes contre 37% d’annélides.
Statistiquement, l’assemblage total ne montre pas de variation temporelle en début d’expérience (M1 et M2, Axe CA1, Figure AI.3). L’opposition des assemblages échantillonnés à 36 (M1) et 86 (M2) aux assemblages observés à 133 jours (M3) d’expérimentation (Axe CA1 de l’AFC, Figure AI.3), correspond à l’inversion de dominance des annélides sur les arthropodes en fin d’expérience (seulement 30% de la variabilité totale). On observe également une augmentation de la variabilité inter réplicats au cours du temps, de M1-M2 vers M3 (axe CA2, 19% de la variabilité totale). Cependant cette variabilité spatio-temporelle reste faiblement structurante pour l’assemblage, car ne représente que 49 % de la variabilité totale.
Diversité fonctionnelle des assemblages
Au sein de cette variabilité temporelle des assemblages on observe deux dynamiques distinctes : (i) celle des Mollusques, Annélides et Chordés, qui augmentent en abondance au cours du temps, et (ii) celle des Arthropodes et Echinodermes qui augmentent jusqu’à 86 jours d’expérience, puis diminuent en fin d’expérience (Figure AI.4).
En considérant la richesse spécifique totale identifiée lors de cette expérience in situ, seulement 21% (74 taxons) des taxons concerne près de 50% des effectifs totaux (5180 individus). Ces 74 taxons, identifiés pour la plupart au niveau spécifique, concernent 24 genres taxonomiques (Table AI.1), les plus abondants et caractéristiques des dynamiques temporelles globales observées au niveau des 5 principaux phylums (Figure AI.4).
Ainsi, une AFC a été réalisée sur les assemblages des microcosmes expérimentaux, réduits à ces 24 genres les plus abondants (Figure AI.5). Elle montre plus fortement cette variabilité temporelle qui oppose les assemblages M1/M2 aux M3 (58% de la variance expliquée sur l’axe CA1). La variabilité expliquée par l’axe CA2 reste essentiellement spatiale en distinguant la variation inter réplicas des assemblages à chaque temps. La dynamique temporelle de ces 24 genres taxonomiques traduit essentiellement une opposition fonctionnelle entre les dynamiques des taxons vagiles et sessiles (Table AI.2). Au sein des taxons vagiles nous distinguons les « prédateurs » des potentiels « consommateurs primaires ». L’abondance des prédateurs augmente au cours du temps, passant de 17 à 54 individus par microcosme en moyenne, alors que le ratio des consommateurs primaires vagiles sur sessiles diminue avec le temps. L’abondance des taxons sessiles augmente graduellement durant l’expérience, alors que celle des taxons vagiles (hors prédateurs) diminue drastiquement en fin d’expérience.
160
Références bibliographiquesCamisa, F. (2015). Amphipod assemblages of Posidonia oceanica meadows: space, time and metacommunity structure.
1Howeth, J. G., & Leibold, M. A. (2010). Species dispersal rates alter diversity and ecosystem stability in pond metacommunities. Ecology, 91(9), 2727-2741.
2Howeth, J. G., & Leibold, M. A. (2010). Prey dispersal rate affects prey species composition and trait diversity in response to multiple predators in metacommunities. Journal of Animal Ecology, 79(5), 1000-1011.
Morton, R. D., & Law, R. (1997). Regional species pools and the assembly of local ecological communities. Journal of Theoretical Biology, 187(3), 321-331.
Ricklefs, R. E. (2008). Disintegration of the ecological community. The American Naturalist, 172(6), 741-750.
Taylor, R. B. (1997). Seasonal variation in assemblages of mobile epifauna inhabiting three subtidal brown seaweeds in northeastern New Zealand. Hydrobiologia, 361(1-3), 25-35.
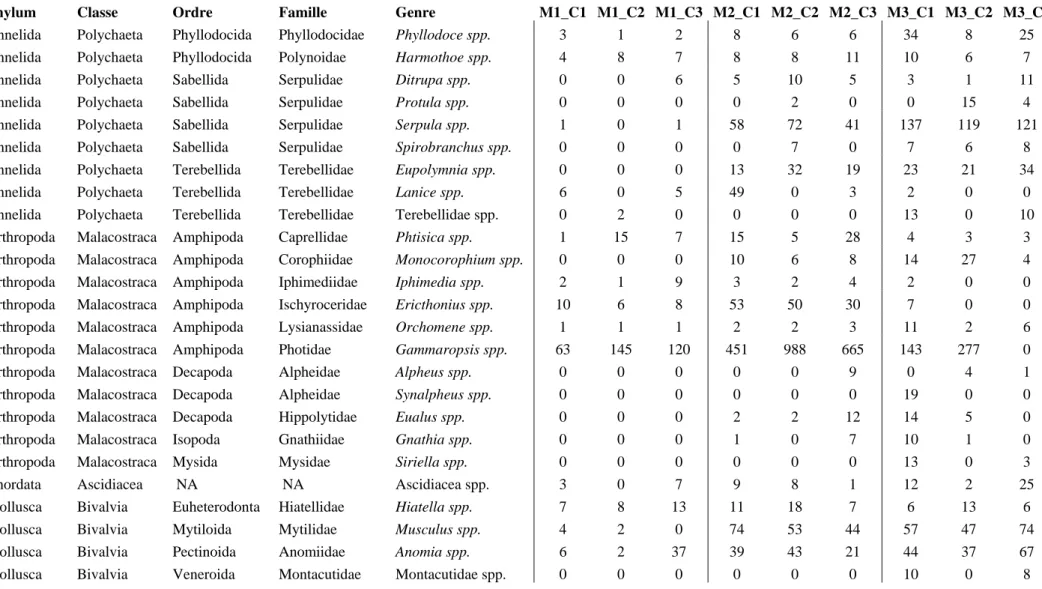
Table AI.1 : Tableau de contingence des 24 genres les plus abondants identifiés au sein des assemblages des microcosmes expérimentaux (ind/microcosme).
Phylum Classe Ordre Famille Genre M1_C1 M1_C2 M1_C3 M2_C1 M2_C2 M2_C3 M3_C1 M3_C2 M3_C3
Annelida Polychaeta Phyllodocida Phyllodocidae Phyllodoce spp. 3 1 2 8 6 6 34 8 25
Annelida Polychaeta Phyllodocida Polynoidae Harmothoe spp. 4 8 7 8 8 11 10 6 7
Annelida Polychaeta Sabellida Serpulidae Ditrupa spp. 0 0 6 5 10 5 3 1 11
Annelida Polychaeta Sabellida Serpulidae Protula spp. 0 0 0 0 2 0 0 15 4
Annelida Polychaeta Sabellida Serpulidae Serpula spp. 1 0 1 58 72 41 137 119 121
Annelida Polychaeta Sabellida Serpulidae Spirobranchus spp. 0 0 0 0 7 0 7 6 8
Annelida Polychaeta Terebellida Terebellidae Eupolymnia spp. 0 0 0 13 32 19 23 21 34
Annelida Polychaeta Terebellida Terebellidae Lanice spp. 6 0 5 49 0 3 2 0 0
Annelida Polychaeta Terebellida Terebellidae Terebellidae spp. 0 2 0 0 0 0 13 0 10
Arthropoda Malacostraca Amphipoda Caprellidae Phtisica spp. 1 15 7 15 5 28 4 3 3
Arthropoda Malacostraca Amphipoda Corophiidae Monocorophium spp. 0 0 0 10 6 8 14 27 4
Arthropoda Malacostraca Amphipoda Iphimediidae Iphimedia spp. 2 1 9 3 2 4 2 0 0
Arthropoda Malacostraca Amphipoda Ischyroceridae Ericthonius spp. 10 6 8 53 50 30 7 0 0
Arthropoda Malacostraca Amphipoda Lysianassidae Orchomene spp. 1 1 1 2 2 3 11 2 6
Arthropoda Malacostraca Amphipoda Photidae Gammaropsis spp. 63 145 120 451 988 665 143 277 0
Arthropoda Malacostraca Decapoda Alpheidae Alpheus spp. 0 0 0 0 0 9 0 4 1
Arthropoda Malacostraca Decapoda Alpheidae Synalpheus spp. 0 0 0 0 0 0 19 0 0
Arthropoda Malacostraca Decapoda Hippolytidae Eualus spp. 0 0 0 2 2 12 14 5 0
Arthropoda Malacostraca Isopoda Gnathiidae Gnathia spp. 0 0 0 1 0 7 10 1 0
Arthropoda Malacostraca Mysida Mysidae Siriella spp. 0 0 0 0 0 0 13 0 3
Chordata Ascidiacea NA NA Ascidiacea spp. 3 0 7 9 8 1 12 2 25
Mollusca Bivalvia Euheterodonta Hiatellidae Hiatella spp. 7 8 13 11 18 7 6 13 6
Mollusca Bivalvia Mytiloida Mytilidae Musculus spp. 4 2 0 74 53 44 57 47 74
Mollusca Bivalvia Pectinoida Anomiidae Anomia spp. 6 2 37 39 43 21 44 37 67
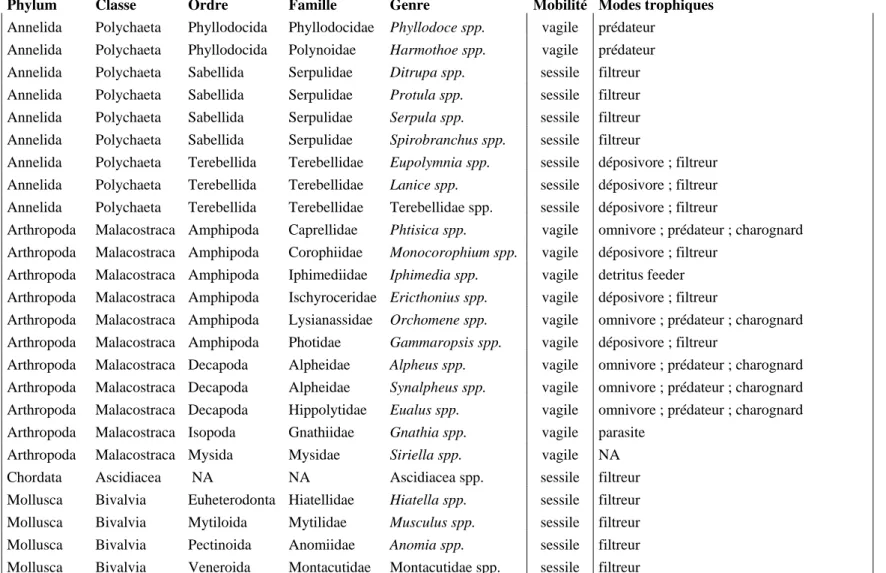
Table AI.2 : Traits écologiques des 24 genres les plus abondants identifiés au sein des assemblages des microcosmes expérimentaux. Phylum Classe Ordre Famille Genre Mobilité Modes trophiques
Annelida Polychaeta Phyllodocida Phyllodocidae Phyllodoce spp. vagile prédateur Annelida Polychaeta Phyllodocida Polynoidae Harmothoe spp. vagile prédateur Annelida Polychaeta Sabellida Serpulidae Ditrupa spp. sessile filtreur Annelida Polychaeta Sabellida Serpulidae Protula spp. sessile filtreur Annelida Polychaeta Sabellida Serpulidae Serpula spp. sessile filtreur Annelida Polychaeta Sabellida Serpulidae Spirobranchus spp. sessile filtreur
Annelida Polychaeta Terebellida Terebellidae Eupolymnia spp. sessile déposivore ; filtreur Annelida Polychaeta Terebellida Terebellidae Lanice spp. sessile déposivore ; filtreur Annelida Polychaeta Terebellida Terebellidae Terebellidae spp. sessile déposivore ; filtreur
Arthropoda Malacostraca Amphipoda Caprellidae Phtisica spp. vagile omnivore ; prédateur ; charognard Arthropoda Malacostraca Amphipoda Corophiidae Monocorophium spp. vagile déposivore ; filtreur
Arthropoda Malacostraca Amphipoda Iphimediidae Iphimedia spp. vagile detritus feeder Arthropoda Malacostraca Amphipoda Ischyroceridae Ericthonius spp. vagile déposivore ; filtreur
Arthropoda Malacostraca Amphipoda Lysianassidae Orchomene spp. vagile omnivore ; prédateur ; charognard Arthropoda Malacostraca Amphipoda Photidae Gammaropsis spp. vagile déposivore ; filtreur
Observations expérimentales. Lors des expériences in situ, les feuilles de vigne et de hêtre se comportent différemment. D’une part, la feuille de vigne se déstructure dès le premier mois d’expérience. Les membranes externes des feuilles se séparent, et seul le parenchyme des feuilles est dégradé ou consommé par les macroinvertébrés benthiques (Chapitre 1 et Annexe 3). D’autre part, la feuille de hêtre conserve l’intégrité de sa structure anatomique. Les différents feuillets restent solidaires jusqu’en fin d’expérience, et les feuilles ne présentent aucune trace d’attaques ou de consommation par les macroinvertébrés benthiques. Les feuilles de hêtre servent essentiellement de substrat pour les espèces sessiles et d’habitat pour la communauté d’invertébrés benthiques qui colonise les microcosmes (Annexe 1).
A partir de ces observations, nous cherchons à comprendre si la composition moléculaire de ces deux espèces foliaires permet d’expliquer les différentes dynamiques de dégradation observées, ou le type d’appropriation par la communauté de macroinvertébrés qui les colonise (ressource trophique ou substrat).
Analyses moléculaires. Les feuilles de vigne et de hêtre utilisées pour les dosages suivants proviennent des mêmes lots de feuilles utilisés dans les expériences in situ présentées dans le Chapitre 1 et l’Annexe 1. Ces feuilles proviennent d’arbres non traités chimiquement. Elles ont été préalablement séchées puis broyées. La caractérisation de la composition moléculaire globale des feuilles de vigne et de hêtre a été réalisée par dosage colorimétrique selon les méthodes de Barnes et Blachlstock (1973) pour les lipides, de Bradford (1976) pour les protides, et de Dubois (1956) pour les glucides. La quantification des pigments a été effectuée par spectrofuorimètrie (Spectrofluorimètre Lambda 25, UV/VIS, Perkin Elmer). Le contenu en acides gras totaux a été déterminé par chromatographie en phase gazeuse – spectrométrie de masse (GC-MS Saturn 2100T, Varian).
Résultats. Le contenu moléculaire global des feuilles de vigne et de hêtre (lipides, protides et glucides) ne diffère pas significativement entre les deux espèces d’arbre (Test de Student, p-value = 0,97) (Figure AII.1 A).
Cependant, ces deux ressources ne possèdent pas les mêmes quantités d’acides gras par unité de masse. Les feuilles de hêtre sont particulièrement riches en acides gras saturés par rapport aux feuilles de vigne (Figure AII.1 B).
166
structurelle jusqu’en fin d’expérience. Ainsi, les feuilles de hêtre peuvent résider plus longtemps dans le milieu marin en résistant plus efficacement aux attaques de potentiels consommateurs. Il serait intéressant de suivre la teneur en acides gras, et plus particulièrement en ester de waxes au cours de la dégradation temporelle des feuilles dans l’eau de mer. On pourrait ainsi faire le lien biogéochimique entre la composition moléculaire des feuilles et la fonction qu’elles assurent dans l’écosystème marin.La faible cohésion tissulaire de la feuille de vigne permet certainement sa disponibilité en tant que ressource trophique pour les macroinvertébrés benthiques détritivores. Alors que la résistance de la feuille de hêtre, non moins intéressante au niveau nutritionnel, est suffisamment résistante pour accueillir des organismes sessiles et limiter sa consommation. Les fonctions de ces deux ressources affectent l’assemblage de la communauté qui se structure autour d’elles. Il est donc essentiel de considérer les propriétés moléculaires et structurelles des ressources afin de caractériser le lien et leur impact sur les communautés écologiques.
Références bibliographiques
Barnes, H., & Blackstock, J. (1973). Estimation of lipids in marine animals and tissues: detailed investigation of the sulphophosphovanilun method for ‘total’lipids. Journal of Experimental Marine Biology and Ecology, 12(1), 103-118.
Batovska, D. I., Todorova, I. T., & Popov, S. S. (2009). Seasonal variations in the leaf surface composition of field grown grapevine plants. J. Serb. Chem. Soc, 74(11), 1229-1240.
Bradford, M. M. (1976). A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical biochemistry, 72(1-2), 248-254.
Chabrol, E., & Charonnat, R. (1937). Une nouvelle reaction pour l’etude des lipides l’oleidemie. Presse méd, 45, 1713.
Dubois, M., Gilles, K. A., Hamilton, J. K., Rebers, P. A. T., & Smith, F. (1956). Colorimetric method for determination of sugars and related substances. Analytical chemistry, 28(3), 350-356.
Drevon, B., & Schmit, J. M. (1964). La reaction sulfophosphovanillique dans l’ét. ude des lipides seriques. Bull. Trav. Soc. Pharm. Lyon, 8, 173-178.
168
Diversité spécifique et démographique des consommateurs primaires : effet sur la dynamique de dégradation de la ressource trophique