UNIVERSITE MOHAMMED V DE RABAT
FACULTE DE MEDECINE ET DE PHARMACIECentre d’Etudes Doctorales : « Sciences de la Vie et de la Santé » Formation Doctorale : « Biologie Médicale, Pathologie Humaine et
Expérimentale, Et Environnement » &
UNIVERSITE SUTAN MOULAY SLIMANE
FACULTÉ DES SCIENCES ET TECHNIQUESEquipe d'Oncologie Expérimentale et de Substances Naturelles, Immuno-pharmacologie Cellulaire et Moléculaire,
THESE DE DOCTORAT
Présentée pour l’obtention du
DOCTORAT EN SCIENCES
Par
:M
lle. Najat BOUCHMAA
Activité anti-tumorale in vitro de nouvelles molécules de
Pyridazin-3 (2H)-one orchestrant le stress oxydatif dans
le cancer du sein : Etude cellulaire, biochimique et
moléculaire.
Année : 2019 N° De Thèse 15/18 CSVS
Thèse soutenue publiquement le 22 Avril 2019 devant les Membres du jury :
Pr. Jamal TAOUFIK, FMPR Université Mohammed V, Rabat Président Pr. Azzedine IBRAHIMI, FMPR Université Mohammed V, Rabat Rapporteur Pr. Youssef BAKRI, FSR Université Mohammed V, Rabat Rapporteur Pr. Mustapha ENNAJI, FST Université Hassan II, Mohamadia Rapporteur Pr. Mohamed NHIRI, FST Université Abdelmalek Saadi, Tanger Examinateur Pr. Abdelmajid ZYAD, FST Université Sultan My Slimane, Béni Mellal Directeur de thèse
2
,نيدلاو
عورأ ىلإ
يمأ
ضبن
يبلق
و
يبأ
يتايحرون
…
3
REMERCIEMENT
Dans un premier temps, mes remerciements vont aux membres de Jury les professeurs, Jamal TAOUFIK, Azzedine IBRAHIMI, Youssef BAKRI, Mustapha ENNAJI et Mohamed NHIRI, de m‟avoir donné l‟honneur de juger cette thèse. Veuillez accepter, chers maitres, l‟assurance de mon estime et mon profond respect.
Je remercie tout naturellement mes directeurs de thèse les professeurs, M‟hammed ANSAR et Abdelmajid ZYAD ; En premier, j‟exprime sincèrement ma profonde gratitude, au Pr. ZYAD, à qui je ne pourrai jamais assez lui remercier de m‟avoir accueillie dans son équipe de recherche pour un stage d‟un mois qui s‟est étalé par la suite carrément à une thèse. J‟ai beaucoup apprécié travailler à ses côtés pendant ces 4 années sur le sujet qui me passionne le plus. Je lui remercie pour son encadrement très proche et sa sympathie. Sa rigueur, ses encouragements, ses précieux conseils et surtout la confiance qu‟il m‟a accordée m‟ont conduit à affiner mon engouement pour la recherche et acquérir la maturité d‟un vrai chercheur. Ensuite j'adresse toute ma reconnaissance au Pr. ANSAR, pour ces molécules d‟or qui m‟a procuré. Je lui remercie pour sa bienveillance à mon égard, sa disponibilité, ses conseils, et pour sa patience à finir ce travail. Je tiens aussi à le remercier sur sa confiance, ses encouragements tout au long de ces années en respectant toujours mes choix font que je me suis toujours sentie à l‟aise.
Je tiens à remercier également tous les membres de l‟Equipe d‟Oncologie Expérimentale : Pr. Hassan Ait Mouse, Dr. Mounir Tilaoui, pour leur aide. Un grand merci au Dr. Abdessalam El Jaâfari, Dr. Souad Krich et Dr. Inès Louiefoudi pour leur bienveillane à mon égard. Merci à mes collègues : Abdellatif, Lamiae, Sanae et Abderazzak pour leur leur sympathie. Merci, particulièrement à Abderazzak, avec qui me partage le labo quelques weekends et quelques vacances, je lui remercie pour sa fratérnité, sa générosité, et surtout sa bonne humeur.
Merci aux membres du laboratoire de Chimie thérapeutique, mes collègues Walid Gùerrab, Youness Zaoui et Youness Boukharssa pour leur gentillesse.
J‟adresse mes vifs remerciements à Monsieur le Directeur du CEDoc SVS le professeur Jamal TAOUFIK qui m‟a fait l‟honneur de présider le jury de cette thèse doctorale. Merci pour votre soutien et enthousiasme permanent à aider les doctorants.
Un grand merci au professeur My. Abess FAOUZI pour son acceuil et ses précieusses conseils durant mes premières années de thèse. Je remercie spécialement mon cher collègue Ilias pour les moments qu‟on a partagés dans le laboratoire de Pharmacologie, je n‟oublierai pas son soutien moral dans des moments de doute.
Un grand merci au directeur du laboratoire MedBiotech, Pr. Azzedine IBRAHIMI, pour sa générosité et sa gentillese. Merci aux membres Abdelmalek et Houssna pour leur sympatie et disponibilité aux moments de mes manipulations dans leur laboratoire.
4
Un merci spécial à Abha pour sa disponibilité et sa sympathie au cours de mes manipulations au plateau technique, merci aussi pour les discussions qu‟on a partagés en fin de cette thèse.
Merci à ma copine du centre de recherche, Hafssa, pour les bons moments qu‟on a partagés ensemble pendant mon séjour à Beni Mellal. J‟espère sincèrement qu‟on gardera contact.
Papa et maman, je suis le fruit de votre amour, cette thèse est le fruit de toutes vos peines, vos encoucargements, vos efforts et de tous vos sacrifices, c‟est le fruit de mon amour envers vous. Si je suis là aujourd‟hui c‟est grâce à vous. Rien au monde ne sera suffisant pour vous remercier. Que dieu vous garde, je vous aime !
Je remerci tendrement mes chères sœurs (Souad, Hassania, Khadija, Fatima-Ezzahra, et Nabila) et mon frère Mohamed, qui étaient toujours présents, continuent de l‟être et je sais qu‟ils le seront pour faire mon bonheur.
Un merci chaleureux à mes anges, mes neuveux et mes nièces, pour leur amour profond. J‟aimerais encore profondément remercier, mes beaux frères, spécialement Hassan (mon frère non biologique), pour leur soutien fraternel durant ces longues années de thèse.
J‟exprime ma profonde gratitude à mes chères amies : Orsula, Imane (El Malmi), Ghizlane et Amina. En particulier les docteurs :Imane (Arous), Fouzia, Mariam, Zineb2 qui m‟ont toujours encouragé à finir ce travail par des gestes d'amitié dont je suis très reconnaissante.
Enfin, ces derniers mots sont pour toi, Reda. Tout ce que je pourrais écrire n‟est rien à côté de la joie qu‟on partage. Toute mon affection et ma profonde gratitude pour ton soutien moral tout au long de ces années. Tu m‟as soutenue sur tous les plans tout le long de cette aventure et tu as, par conséquent, tombé amoureux des cellules tumorales (Error !). Ta présence à mes côtés est un cadeau précieux, que la vie continue à m‟offrir cette chance…
5
Liste de publications
Najat Bouchmaa, Reda Ben mrid, Youness Boukharsa, Youssef Bouargalne, Mohamed Nhiri, Abderrazak Idir, Jamal Taoufik, M‟hammed Ansar and Abdelmajid Zyad (2019). Reactive Oxygen Species-Mediated Apoptosis And Cytotoxicity Of Newly Synthesized Pyridazin-3-Ones In P815 (murin mastocytoma) cell line. Accepted in: Drug Chemistry.
Reda Ben Mrid, Najat Bouchmaa, Youssef Bouargalne, Khalid Karrouchi, Imad Kabach, Miloud El Karbane, Abderrazak Idir, Abdelmajid Zyad and Mohamed Nhiri (2019). Phytochemical Characterization, Antioxidant and In Vitro Cytotoxic Activity Evaluation of Juniperus oxycedrus Subsp. oxycedrus Needles and Berries. Molecules 2019, 24, 502. (Equal contribution).
Najat Bouchmaa, Reda Ben Mrid, Youness Boukharsa, Nhiri Mohamed, Hassan Ait Mouse, Jamal Taoufik, M‟hammed Anssar and Abdelmajid Zyad (2018). Cytotoxicity Of Newly Pyridazin-3(2H)-One Derivatives Orchestrating Oxidative Stress In Human Triple Negative Breast Cancer (MDA-MB-468). Arch Pharm Chem Life Sci. 2018;1–11.
Najat Bouchmaa, Mounir Tilaoui, Youness Boukharsa, Abdessalam Jaâfari, Hassan Aît Mouse, My. Ali Oukerrou, Jamal Taoufik, M‟hammed Ansar and Abdelmajid Zyad (2017). In Vitro Antitumor Activity of Newly Synthesized Pyridazin-3(2H)-One Derivatives via Apoptosis Induction. Pharmaceutical Chemistry Journal, 51(10), 893-901.
Moulay Ali Oukerrou, Mounir Tilaoui, Hassan Ait Mouse, Najat Bouchmaa, Abdelmajid Zyad (2017). Differential Cytotoxic Activity of Essential Oil of Lippia citriodorafrom Different Regions in Morocco. Chemistry & biodiversity, 14(7), e1600497.
Maria Miguel, Najat Bouchmaa, Smail Aazza, Farah Gaamoussi and Badiaâ Lyoussi (2014). Antioxidant, Anti-Inflammatory And anti-Acetylcholinesterase Activities Of Eleven Extracts Of Moroccan Plants. Fresenius Environmenta Fresenius Environmental Bulletin, 23(6).
Patent
M‟hammed Ansar, Abdelmajid Zyad, Najat Bouchmaa, Youness Boukharsa,
Youness Zaoui, Azeddine Ibrahimi et Jamal Taoufik. Evaluation du potential anticancéreux des dérivées des 5-arylundéne-6-méthyl-pyridazin-3(2H)-ones.
6
Liste de Communications
Communications Orales
Najat Bouchmaa, Youness Boukharsa, Mounir Tilaoui, Hassan Ait Mouse, Jamal Taoufik, M‟hammed Anssar
& Abdelmajid Zyad. Newly synthesized Pyridazines-3-ones derivatives induced apoptosis towards triple negative breast cancer cells (MDA-MB-468). 3eme workshop international: Chimie Moléculaire, Plantes et Hémisynthèse, May 12. 2017, Faculty of sciences and Technology Beni Mellal, Morocco.
Najat Bouchmaa, Youness Boukharsa, Hassan Ait Mouse, Jamal Taoufik, Abdelmajid Zyad & M‟hammed
Anssar. Newly synthesized Pyridazines-3-ones derivatives induced apoptosis towards MDA-MB-231 (triple negative breast cancer cells) and MCF-7(human breast adenocarcinoma cell line). 2ème édition du congrès international des sciences pharmaceutiques (CISPHARM 2017) du 17 au 19 à Faculté des Sciences et Techniques Beni Mellal, Maroc.
Najat Bouchmaa, Youness Boukharsa, Hassan Aît Mouse, Jamal Taoufik, Abdelmajid Zyad & M‟hammed
Anssar. Activité Anti-tumorale de nouvelles series synthétisées de pyridazinones: Synthèse, cytoxicité et mécanisme moléculaire. 1ere edition du congrs international des sciences pharmaceutiques (CISPHARM 2017) du 17 au 19 à Faculté des Sciences et Techniques Beni Mellal, Maroc.
Najat Bouchmaa, Youness Boukharsa, Hassan Aît Mouse, Jamal Taoufik, Abdelmajid Zyad & M‟hammed
Ansar. La 4éme édition des journées internationales jeunes chercheurs (JIJC4) sous le thème « chimie thérapeutique : compétences plurielles, organisée à El Jadida du 19 au 20 Novembre 2015.
Najat Bouchmaa, Youness Boukharsa, Hassan Aît Mouse, Jamal Taoufik, Abdelmajid Zyad & M‟hammed
Anssar Activité antitumorale de nouvelles séries synthétisées de pyridazinones : Synthèse, Cytoxicité et Mécanisme moléculaire. Congres international « biotechnologie au service de la société », les 22-24 Octobre 2015 à la FST de Fès, Maroc.
Najat Bouchmaa, Youness Boukharsa, Mounir Tilaoui, Hassan Aît Mouse, Jamal Taoufik, M‟hammed Anssar
& Abdelmajid Zyad. Activité antitumorale de nouvelles séries synthétisées de pyridazinones : Synthèse, Cytoxicité et Mécanisme moléculaire. Congres international « biotechnologie au service de la société », les Octobre 2015 à la FST de Fès, Maroc.
Posters
Najat Bouchmaa, Youness Boukharsa, Reda Ben Mrid, Mohamed Nhiri, Jamal Taoufik, M‟hammed Anssar &
Abdelmajid Zyad. Newly derivatives pyridazinones exhibit programmed cell death via orchestrating oxidative stress-mediated cytotoxicity by regulation genes expression apoptosis pathway in human triple negative breast cancer (MDA-MB-468). The First International Conference on Biotechnology, December 18-19, 2017, Poly-disciplinary Faculty in Beni-Mellal, Morocco
Najat Bouchmaa, Youness Boukharsa, Reda Ben Mrid, Mohamed Nhiri, Jamal Taoufik, M‟hammed Anssar &
Abdelmajid Zyad. Newly synthesized Pyridazines-3-ones derivatives induced apoptosis towards triple negative breast cancer cells (MDA-MB-468). The 2nd Edition of the international Congress Cancer in Beni Mellal (ICCBM‟) Caner Diseases: Clinical Studies, Scientific & Therapeutic Advances held at Faculty of Sciences and Technology-Beni Mellal-Morocco.
Najat Bouchmaa, Youness Boukharsa, Mounir Tilaoui, Jamal Taoufik, M‟hammed Anssar & Abdelmajid Zyad.
In vitro antitumor activity and synergistic effect of newly synthesized molecules of pyridazinones against breast cancer cell lines. The 2nd Edition of the international Congress Cancer in Beni Mellal (ICCBM‟) Caner Diseases: Clinical Studies, Scientific & Therapeutic Advances held at Faculty of Sciences and Technology-Beni Mellal-Morocco.
Najat Bouchmaa, Youness Boukharsa, Jamal Taoufik, Abdelmajid Zyad & M‟hammed Anssar. In vitro
antitumor activity and synergistic effect of newly synthesized molecules of pyridazinones against breast cancer cell lines. Les 5emes journées scientifiques du Cedoc SVS 21 et 22 Mars 2014.
7
SOMMAIRE
LISTE DES FIGURES ... 10
LISTE DES Tableaux ... 12
LISTE D’ABRÉVIATIONS ... 13
RÉSUMÉ ... 15
ABSTRACT ... 16
صخلم ... 17
PREMIERE PARTIE: INTRODUCTION GENERALE 1. Généralités sur le CANCER DU SEIN ... 19
1.1. Epidémiologie du Cancer du sein chez la femme ... 21
1.1.1. A travers le monde ... 21
1.1.2. Epidémiologie Nationale ... 23
1.2. Types du cancer de sein (Aspects cliniques du cancer du sein) ... 24
1.3. Aspects moléculaires ... 25
1.3.1. Tumeurs luminales ... 25
1.3.2. Tumeurs basales ... 26
1.3.3. Triple négative (HR-/HER2-) ... 26
1.3.4. Le sous-type Her2 ... 26
2. Mécanismes moléculaires ... 27
2.1. Sur le plan génétique ... 27
2.2. Sur le plan protéomique ... 28
2.2.1. ROS et cancer ... 28
2.2.2. Stress oxydatif dans une cellule tumorale ... 30
2.2.3. L‟état pro-oxydant chez les cellules cancéreuses mammaires ... 31
2.2.4. Systèmes antioxydants ... 31
3. Traitement et enjeux ... 33
4. Famille des Pyridazinones ... 34
OBJECTIFS DE LA THESE ... 37
DEUXIEME PARTIE : MATERIEL ET METHODES 1. Réactifs et produits chimiques ... 42
2. Molécules utilisées ... 42
3. Culture cellulaire et conditions de traitement ... 43
3.1. Lignées cellulaires ... 43
3.2. Culture cellulaire et condition de traitement ... 43
8
4. Etude de l‟activité cytotoxique par le test MTT (Methyl Tetrazolium Test) ... 44
4.1. Test de la Cytotoxicité sur les lignées tumorales mammaires humaines MCF-7 et MDA-MB-468 ... 44
4.2. Etude de la cytotoxicité contre les cellules normales : Les cellules mononucléées du sang périphérique (PBMCs) ... 45
5. Etude de Combinaison des Pyridazinones en thérapie combinatoire ... 46
6. Test de la formation Clonogénique ... 47
7. Migration cellulaire ... 47
8. Etude de la mort cellulaire programmée par Apoptose ... 48
8.1. Extraction de l‟ADN génomique (ADNg) ... 48
8.2. Eude de l‟apoptose via la fragmentation d‟ADN ... 48
8.3. Test de marquage des caspases à l‟Annexin V ... 48
9. Analyses moléculaires ... 49
9.1. Extraction des ARN ... 49
9.2. Synthèse de l‟ADN complémentaire (ADNc) (RT-PCR) ... 49
9.3. Amplification par PCR ... 49
10. Détermination du contenu en Hydrogène Peroxyde (H2O2) ... 51
11. Détermination du contenu en Malondialdéhyde (MDA) (Peroxydation lipidique) . 51 12. Tests d'activité enzymatique... 51
12.1. Préparations des extraits enzymatiques ... 51
12.2. Détermination des activités enzymatiques Oxydantes et Anti-oxydantes ... 52
12.3. Détermination de la teneur en protéines ... 53
13. Analyses statistiques ... 53
TROISIEME PARTIE : RESULTATS ET DISCUSSION Chapitre 1: Les dérivés Pyridazinones : Des candidats potentiels pour la chimiothérapie contre le cancer du sein 1. Introduction ... 56
2. Résultats ... 57
2.1. Effet antitumoral in vitro des Pyridazinones sur les lignées tumorales mammaires MCF-7 et MDA-MB-468 ... 57
2.2. Etude de la Cytotoxicité des dérivés Pyridazinones contre les cellules normales du sang périphériques (PBMCs) ... 61
2.3. Étude de la formation de colonies ... 63
2.4. Étude de l‟apoptose ... 65
2.4.1. Étude de l‟apoptose via la dégradation d‟ADN ... 65
2.4.2. Étude de l‟apoptose par Annexin streptavidin V ... 67
2.5. Étude préliminaire sur l‟utilisation des molécules de Pyridazinones en thérapie combinatoire ... 70
2.5.1. Étude de la synergie avec des molécules conventionnelles ... 70
2.5.2. Étude de la synergie avec certaines molécules naturelles (Les acides Phénoliques) ... 74
9
3. Discussion ... 77
4. Conclusion et perspectives ... 85
Chapitre 2: Dérivés Pyridazinones et réponse tumorale : Analyses moléculaires 1. Introduction ... 88 2. Résultats et Discussion ... 89 2.1. Les Pro-apoptotiques ... 89 2.2. Les anti-apoptotiques ... 93 3. Discussion ... 97 4. Conclusion et perspectives ... 106
Chapitre 3: Les systèmes de réponse au stress dépendant du glutathion et de la thiorédoxine médié l’activité antitumorale in vitro des dérivés des Pyridazin-3-ones 1. Introduction ... 109
2. Résultats ... 111
2.1. Teneur en peroxyde d'hydrogène (H2O2) ... 111
2.2. Peroxydation lipidique (MDA) ... 112
2.3. Activités enzymatiques antioxydantes ... 113
3. Discussion ... 119 4. Conclusion et perspectives ... 124 REFERENCES BIBLIOGRAPHIQUES ... 125 References Bibliographiques ... 126 ANNEXES ... 137 PUBLICATIONS ... 148
10
LISTE DES FIGURES
Figure 1. Estimation de l'incidence du cancer le plus courant chez la femme dans le monde en 2018.. ... 22 Figure 2. Estimation de la mortalité au cancer du sein dans le monde en 2018. Le nombre de
pays représentés dans chaque groupe de classement est inclus dans la légende (GLOBOCAN, 2018). ... 23
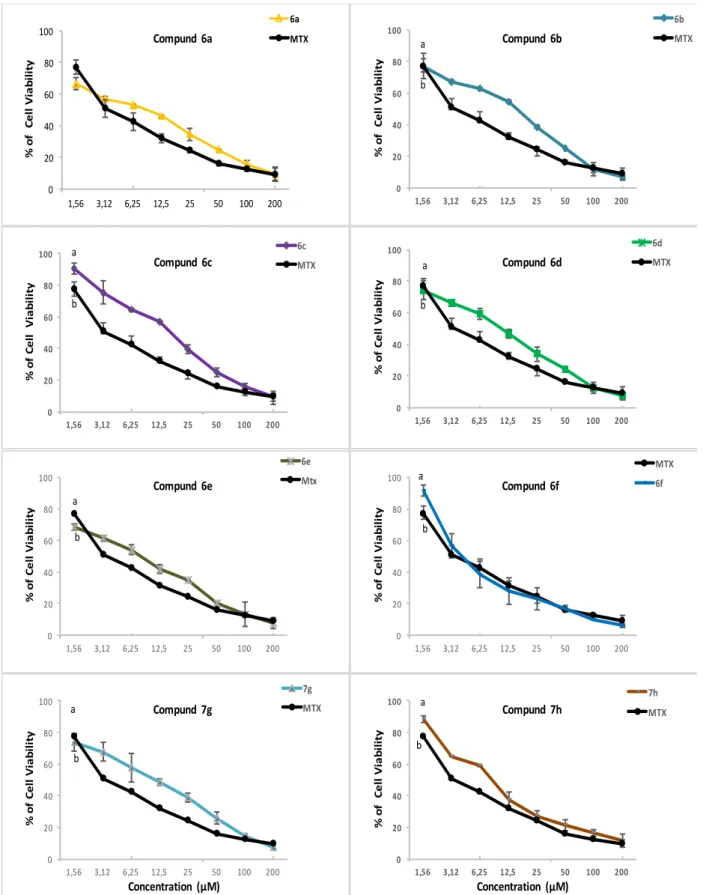
Figure 3. Deux mécanismes possibles de la cancérogenèse.. ... 28 Figure 4. Étude de la Cytotoxicité contre de la lignée tumorale mammaire MDA-MB-468
après traitement par les dérivés de Pyridazinones 6a, 6b, 6c, 6d, 6e, 6f, 7g et 7h pendant 48 heures de traitement. ... 58 Figure 5. Cytotoxicité contre de la lignée cellulaire tumorale mammaire MCF-7 après
traitement avec les dérivés de Pyridazinones 6a, 6b, 6c, 6d, 6e, 6f, 7g et 7h après 48 heures de traitement. ... 60 Figure 6. Effet des dérivés de Pyridazin-3(2H)-ones sur la viabilité des cellules mononucléées
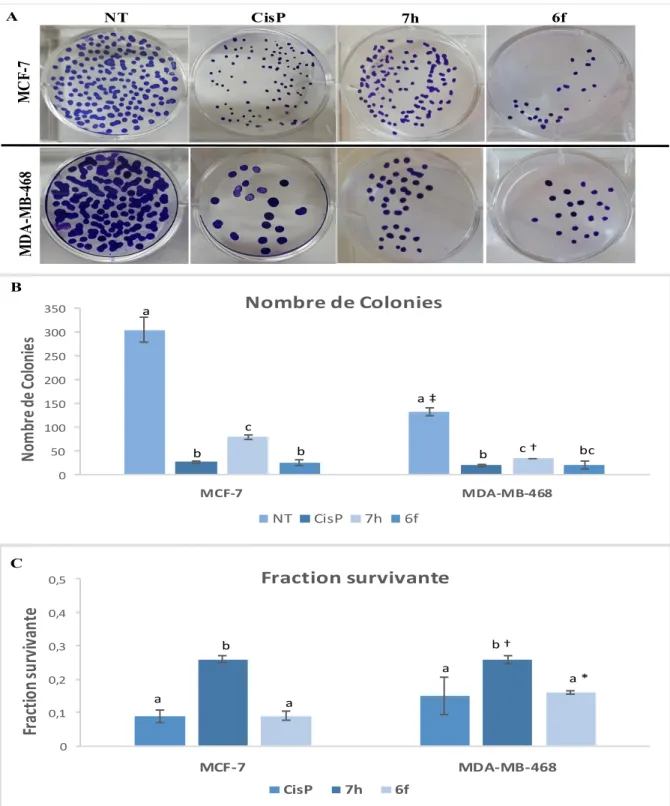
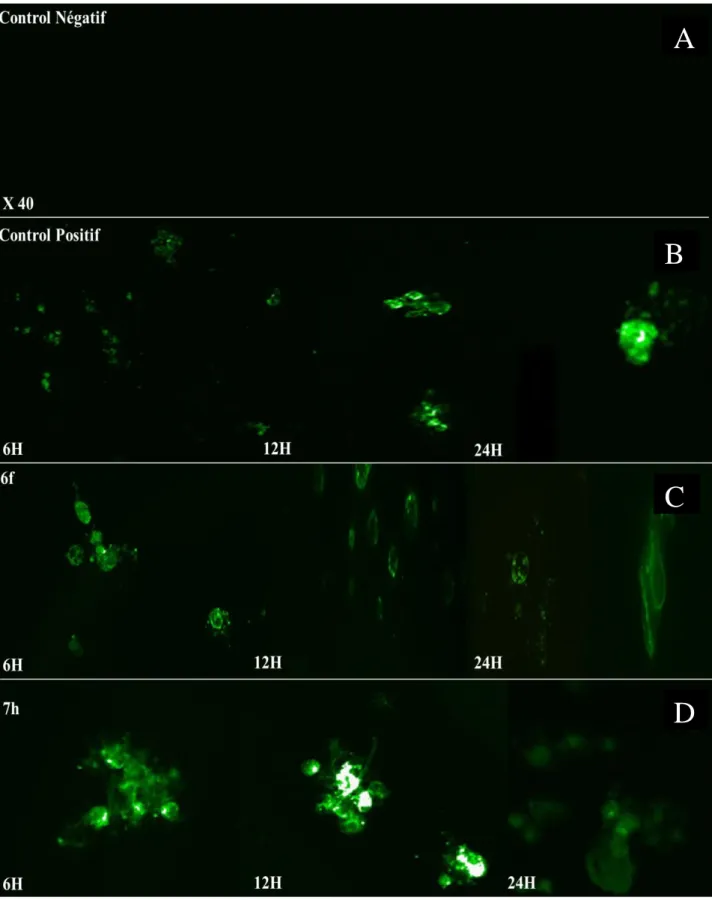
du sang périphérique (PBMCs) traitées par les molécules 6a, 6d, 6e, 6f, 7g et 7h pendant 48 heures. ... 62 Figure 7. Test de la formation clonogénique réalisée sur des cellules tumorales MDA-MB-468 et MCF-7.. ... 64 Figure 8. Étude de la Fragmentation d‟ADN sur la lignée MDA-MB-468 traitées par les
Pyridazinones (6f ou 7h). ... 66 Figure 9. Étude de la Fragmentation d‟ADN sur la lignée MCF-7 traitées par les
Pyridazinones (6f ou 7h). ... 67 Figure 10. Étude de l‟apoptose via le test d‟Annexin V sur la lignée MCF-7 traitée par les
molécules 6f ou 7h. ... 69 Figure 11. Expression du gène p53 modulé par le traitement aux molécules de Pyridazinones
6h ou 7h, dans les lignées MDA-MB-468 (A) et MCF-7 (B). ... 89 Figure 12. Expression du gène caspase-3 modulé par le traitement aux molécules de
Pyridazinones 6h ou 7h, dans les lignées MDA-MB-468 (A) et MCF-7 (B). ... 90 Figure 13. Expression du gène Gadd-153 modulé par le traitement aux molécules de
11
Figure 14. Expression du gène Fas-L modulé par le traitement aux molécules de Pyridazinones 6h ou 7h, dans les lignées MDA-MB-468 (A) et MCF-7 (B). ... 93 Figure 15. Expression du gène Bcl-XL modulé par le traitement aux molécules de
Pyridazinones 6h ou 7h, dans les lignées MDA-MB-468 (A) et MCF-7 (B).. ... 94 Figure 16. Expression du gène survivin modulé par le traitement aux molécules de
Pyridazinones 6h ou 7h, dans les lignées MDA-MB-468 (A) et MCF-7 (B). ... 95 Figure 17. Expression du gène C-Jun modulé par le traitement aux molécules de
Pyridazinones 6h ou 7h, dans les lignées MDA-MB-468 (A) et MCF-7 (B). ... 96 Figure 18. Expression du gène K-Ras modulé par le traitement aux molécules de
Pyridazinones 6h ou 7h, dans les lignées MDA-MB-468 (A) et MCF-7 (B).. ... 97 Figure 19. Concentration de peroxyde d'hydrogène (H2O2) dans les deux lignées tumorales
(MDA-MB-468 et MCF-7) après traitement par des dérivés de pyridazin-3(2H) -one 6f ou 7h, NT (contrôle négatif) et MTX (contrôle positif). ... 112 Figure 20. Activité de la peroxydation lipidique exprimée en concentration en
malondialdéhyde (MDA) dans les deux lignées tumorales (MDA-MB-468 et MCF-7) après traitement par des dérivés de pyridazin-3 (2H) -one 6f ou 7h, NT (contrôle négatif) et MTX (contrôle positif).. ... 113 Figure 21. Activités de la superoxyde dismutase (SOD) dans les cellules des deux lignées
tumorales (MDA-MB-468 et MCF-7) après traitement par des dérivés de pyridazin-3 (2H)-one 6f ou 7h, NT (contrôle négatif) et MTX (contrôle positif).. ... 114 Figure 22. Activités de la gluthation peroxydase (GPx) dans les cellules des deux lignées
tumorales (MDA-MB-468 et MCF-7) après traitement par des dérivés de pyridazin-3 (2H) -one 6f ou 7h, NT (contrôle négatif) et MTX (contrôle positif).. ... 115 Figure 23. Activités de la glutathion S-transférase (GST) dans les cellules des deux lignées
tumorales (MDA-MB-468 et MCF-7) après traitement par des dérivés de pyridazin-3 (2H) -one 6f ou 7h, NT (contrôle négatif) et MTX (contrôle positif).. ... 116 Figure 24. Activités de la glutathion réductase (GR) dans les cellules des deux lignées
tumorales (MDA-MB-468 et MCF-7) après traitement par des dérivés de pyridazin-3 (2H) -one 6f ou 7h, NT (contrôle négatif) et MTX (contrôle positif).. ... 117 Figure 25. Activités de la thioredoxine réductase (TrxR) dans les cellules des deux lignées
tumorales (MDA-MB-468 et MCF-7) après traitement par des dérivés de pyridazin-3 (2H) -one 6f ou 7h, NT (contrôle négatif) et MTX (contrôle positif).. ... 118
12
Figure 26. Activités de l‟Isocitrate dehydrogenase (ICDH) dans les cellules des deux lignées tumorales (MDA-MB-468 et MCF-7) après traitement par des dérivés de pyridazin-3 (2H) -one 6f ou 7h, NT (contrôle négatif) et MTX (contrôle positif) ... 99
LISTE DES TABLEAUX
Tableau 1. Amorces utilisées ... 50 Tableau 2. Concentration inhibitrice 50 (IC50) en µM, des dérivés de pyridazin-3(2H) - testés contre la lignée tumorale mammaire humaine MDA-MB-468. ... 59 Tableau 3. Concentration inhibitrice 50 (IC50) en µM, des dérivés de pyridazin-3 (2H) - testés contre la lignée tumorale mammaire humaine MCF-7. ... 59 Tableau 4. Analyse de l'indice de combinaison du co-traitement de la lignée tumorale MCF-7 par la molécule 6f (IC30) combinée à des concentrations variables des drogues conventionnelles (Méthotrexate, Cisplatine ou Paclitaxel). ... 71 Tableau 5. Analyse de l'indice de combinaison du co-traitement de la lignée tumorale
MDA-MB-468 par la molécule 6f (IC30) combinée à des concentrations variables des drogues conventionnelles (Méthotrexate, Cisplatine ou Paclitaxel). ... 72 Tableau 6. Analyse de l'indice de combinaison du co-traitement de la lignée tumorale MCF-7 par la molécule 7h (IC30) combinée à des concentrations variables des drogues conventionnelles (Méthotrexate, Cisplatine ou Paclitaxel). ... 73 Tableau 7. Analyse de l'indice de combinaison du co-traitement de la lignée tumorale
MDA-MB-468 par la molécule 7h (IC30) combinée à des concentrations variables des drogues conventionnelles (Méthotrexate, Cisplatine ou Paclitaxel). ... 73 Tableau 8. Analyse de l'indice de combinaison du co-traitement de la lignée tumorale MCF-7 par la molécule 6f (IC30) combinée à des concentrations variables des Acides Phénoliques (A. Vannilique, Acide Synapique ou Acide Syringique). ... 75 Tableau 9. Analyse de l'indice de combinaison du co-traitement de la lignée tumorale
MDA-MB-468 par la molécule 6f (IC30) combinée à des concentrations variables des Acides Phénoliques (A. Vannilique, Acide Synapique ou Acide Syringique). ... 75 Tableau 10. Analyse de l'indice de combinaison du co-traitement de la lignée tumorale
MCF-7 par la molécule MCF-7h (IC30) combinée à des concentrations variables des Acides Phénoliques (A. Vannilique, Acide Synapique ou Acide Syringique). ... 76 Tableau 11. Analyse de l'indice de combinaison du co-traitement de la lignée tumorale MDA-MB-468 par la molécule 7h (IC30) combinée à des des concentrations variables des Acides Phénoliques (A. Vannilique, Acide Synapique ou Acide Syringique). ... 77
13
LISTE D’ABRÉVIATIONS
A. Syn: Acide Synapique A. Syr: Acide Syringique A.Van: Acide Vannilique Addit.: Additivité
ADNg: ADN génomique Akt: rotein kinase B (PKB) Antag.: Antagonisme AP-1: Activator protein 1 Bax: Bcl-2–associated X
Bcl-XL: B-cell lymphoma-extra large Bcl2: B-cell lymphoma 2
BRCA1: Breast cancer protein 1 BSA: Bovine Serum Albumin
Caspase-3: Cysteine-dependent aspartate-directed proteases CAT: Catalase
CHOP: C/EBP homologous protein CisP: Cisplatine
DMSO: Dimethyl sulfoxide
ER-negative: Estrogen-receptor-negative ER-Positive: Estrogen-receptor-positive Fas-L: Fas ligand
Gadd-153: Growth arrest and DNA damage-inducible protein GPx: Gluthation peroxydase GR: Glutathion reductase GSH: Glutathione GSSG: Glutathione disulfide GST: Glutathion S-transférase H2O2: Peroxyde d'hydrogène
14 IAP: Inhibiteur de la protéine d‟apoptose
IC: Indice of combinaison IC30: 30% Inhibitory Concentration value
IC50: 50% Inhibitory Concentration value ICDH: Isocitre dehydrogenase
K-Ras: -Ki-ras2 Kirsten rat sarcoma viral oncogene homolog MAPK: Mitogen-activated protein kinase
MDA: Malondialdehyde
MMP: Matrix metalloproteinases
mTOR: Mammalian target of rapamycin
MTT: Methylthiazolyldiphenyl-tetrazolium bromide MTX: Methotrexate
NF-κB: Nuclear Factor-Kappa B p53: Tumor protein 53
Pacli: Paclitaxel
PBMCs: Peripheral blood mononuclear cell PBS: Phosphate buffer solution
PCR: Polymerase chain reaction,
PTEN: Phosphatase and tensin homolog ROS: Reactive Oxygen Species
SD: Standard deviation SOD: Superoxyde dismutase SVF: Serum vœu fatal Syn.: Synergie
15
RÉSUMÉ
Le cancer du sein chez la femme est un problème de santé mondiale d‟une grande ampleur causant des conséquences humaines et économiques redoutables partagées entre les femmes et leurs familles. Notre étude consiste dans un premier temps à étudier une série de 20 nouveaux dérivés de pyridazin-3-ones en tant que candidats antitumoraux contre deux types de cancer mammaires : un triple négatif (TNBC) (MDA-MB-468) et un type luminale (MCF-7). Ces dérivés ont montré une cytotoxicité significative importante, dose-dépendante, sans aucun effet sur les cellules normales (PBMCs). En plus de leur effet séléctif, ils ont montré une cytotoxicité spéctaculaire sur la lignée TNBC. Également, les dérivés 6f et 7h ont montrés un effet synergique significatif, avec des molécules conventionnelles ou des acides phénoliques et une réduction visible de la formation de colonies tumorales. Il est à souligner que ces molécules ont manifestés un effet apoptotique.
Notre étude consiste dans un deuxième temps, en un travail de caractérisation moléculaire afin de comprendre le mécanisme moléculaire impliqué dans la mort cellulaire. Nous avons conduit une analyse par PCR semi-quantitative, en se focalisant sur l‟étude de l‟expression des gènes cibles impliquées en apoptose. Ce travail identifiant une surexpression des gènes pro-apoptotiques et une sous-expression des gènes anti-apoptotiques, avec une réponse différentielle chez les deux lignées.
Dans la 3ème approche, notre travail consiste à évaluer les mécanismes biochimiques impliqués dans le pouvoir antitumoral in vitro observé. Nous nous intéressons à une approche basée sur l'induction de la cytotoxicité via l'orchestration du stress oxydatif. Les activités spécifiques des enzymes antioxydantes clés du métabolisme, telleque la GPx, la TrxR, semblent être liées au pouvoir antitumorale observé.
Par conséquent, nous avons conclu que les pyridazinones peuvent améliorer l'efficacité thérapeutique du traitement actuel du TNBC via l'inhibition de GR et de TrxR. Ces résultats pourraient suggérer la TrxR comme une cible thérapeutique pour l‟amélioration de l'efficacité thérapeutique des anticancéreux actuels ou pour la conception de nouveaux anticancéreux, à base de pyridazinones.
Mots-clés : TNBC; Cancer du sein ER-positif; Activité anti-tumorale in vitro; PBMCs; Synergie ; Apoptose; Stress oxydatif ; Systèmes antioxydant (GPx et TrxR).
16
ABSTRACT
Breast cancer in women is a major global health problem with devastating human and economic consequences shared between women and their families. Our study first consists to study a series of 20 new pyridazin-3-one derivatives as antitumour candidates against two types of human breast cancer: The triple negative (TNBC) (MDA-MB-468) and the luminal type (MCF-7). These derivatives showed significant, dose-dependent cytotoxicity with no effect on normal cells (PBMCs). In addition to their selective effect, pyridazionoes derivatives demonstrated specular cytotoxicity on the TNBC cell line. Also, the 6f and 7h derivatives showed a significant synergistic effect, with conventional molecules and phenolic acids with a visible reduction in tumor colony formation. It should be noted that these molecules have shown an apoptotic effect.
Our study consists in a second step, to analyse the molecular characterization in order to understand the molecular mechanism involved in cell death. We conducted a semi-quantitative PCR analysis, focusing on the study of the expression of target genes involved in apoptosis. This work identified an up-regulation of pro-apoptotic genes expression and a down-regulation of anti-apoptotic genes expresion, with a differential response in both tumor lines.
In the third approach, our study consists to evaluate the biochemical mechanisms involved in the observed in vitro antitumour power. We are interested in an approach based on the cytotoxicity induction via oxidative stress orchestration. The specific activities of the key antioxidant enzymes of metabolism, such as GR and TrxR, appear to be related to the observed antitumor effect.
Therefore, we concluded that pyridazinones may improve the therapeutic effectiveness of the current TNBC treatment through the inhibition of GR and TrxR. These results could suggest TrxR as a therapeutic target for improving the therapeutic efficacy of the current anticancer drugs or for the design of new pyridazinone-based anticancer drugs.
Keywords: TNBC; ER-positive breast cancer; in vitro anti-tumour activity; PBMCS; Synergy; Apoptosis; Oxidative stress; GPx and TrxR antioxidant systems.
17
صخلم
خٝدبصزقإٗ خّٞبسّإ تقا٘ػ تجسر شٞجم ٌدح دار خَٞىبػ خٞحص خينشٍ ءبسْىا ٙذى ٛذثىا ُبطشس ذؼٝ
خَٞخٗ
ءبسْيى
ح٘طخم .ِٕشسلأٗ
خساسذث بَْق ،ٚىٗأ
02
خئٝضخ
حذٝذخ
ٍِ
ُْ٘ٝصاذٝشٞجىا دبقزشٍ
(
pyridazinones
،)
دبضَم خحششٍ
ِٞػّ٘ ذض
ٛذثىا ًاسٗلأ
ٜثلاثىا :خّٞبطشسىا
( ٜجيسىا
MDA-MB-468
عْ٘ىاٗ )
(
luminal
)
(
MCF-7
.)
ذقٗ
دبئٝضدىا غَٞخ دشٖظأ
،
بٕسبجزخا ٌر ٜزىا
عشدث
حذَزؼٍ
،
خَٞس ٚيػ
خٞؼٞجطىا بٝلاخىا ٚيػ شٞثأر ٛأ ُٗد خٍبٕ خٝ٘يخ
(
PBMCs
)
.
ٚىإ خفبضلإبث
بٖزٞىبؼف ،خٞئبقزّلاا دشٖظأ خيٕزٍ خٝ٘يخ خَٞس دبقزشَىا ٓزّٕ ٍِ خّٞبطشسىا بٝلاخيى خجسْىبث
ع٘
ٜجيسىا ٜثلاثىا
َم .
ب
ذْٕشث
ٍِ لام
ىا
ِٞزئٝضد
6f
ٗ
7h
ٚيػ
ٙذٍ
ٖقفا٘ر
َ
ٜطبشْىا ب
شٞجنىا
ذزَىا خٝٗدلأا غٍ
ا
ضبَحلأاٗ خىٗ
خٞؼٞجطىا خٞىْ٘ٞفىا
ٚىإ خفبضلابث
د٘خٗ
ضبفخّا
حضاٗ
ؼزسٍ ءبْث ٜف
داشَ
ًس٘ىا
ٜف
ٍِ ِٞػْ٘ىا لام
خّٞبطشسىا بٝلاخىا
خسٗسذَىا
حسبشلإا سذدرٗ .
ٚىإ
ُأ
ىا
دبئٝضد
حس٘مزَىا
ذق
دشٖظأ
شٞثأر
ٜف هبؼفىا بٕ
.حٍشجَىا ٛ٘يخىا دَ٘ىا
ذَزؼرٗ
خيحشَىا
خّٞبثىا
بْزساسد ٜف
،
ٌٖف فذٖث خئٝضدىا صئبصخىا خساسد ٚيػ
خٞئٝضدىا خٞىٟا
خيخذزَىا
.بٝلاخىا دٍ٘ ٜف
ءاشخإث بَْق
وٞيحر
ها
PCR
ىا
فصْ
ىا
َٜن
،
دبْٞدىا شٞجؼر خساسد ٚيػ ضٞمشزىا غٍ
زسَىا
خفذٖ
خيخذزَىاٗ
ٜف
حٍشجَىا ٛ٘يخىا دَ٘ىا
.
خساسذىا ٓزٕ ذْٞث
بًطشفٍ اًشٞجؼر
ٜف
دبْٞدىا
ىا
حضفحَ
ٛ٘يخىا دَ٘يى
حٍشجَىا
(
pro-apoptotic
)
ذٝذحر غٍ
ٗ
حجم
ٌٞظْر
دبْٞدىا
يى حدبضَىا
حٍشجَىا دَ٘
ى
( بٝلاخي
anti-apoptotic
)
،
خْٝبجزٍ خثبدزسا غٍ
ا ِٞزّٞبطشسىا ِٞزىلاسىا ٍِ لام ٜف
ِٞزسٗسذَى
.
ٜف ٚيدزر خثىبثىا خيحشَىا
ىا خٞئبَٞٞم٘ٞجىا دبٞىٟا ٌٞٞقر
خيخذـزَ
ٜف
حسذقىا
ًس٘يى حدبضَىا
ٜف خظ٘حيَىاٗ
خٝشجخَىا ةسبدزىا
(
in vitro
.)
بث بٍْبَزٕا بْٞىٗأ لىر هلاخ ٍِ
ٚيػ ٌئبقىا ٜخلاؼىا حْٖى
خَٞسىا ساذحا
ػ خٝ٘يخىا
ٗ .ٛذسمأزىا دبٖخلإا قٝشط ِ
ذؼر
خطشّلاا
خصبخىا
ى
حذسملأى حدبضَىا دبَٝضّلأ
خَنحزَىاٗ
ٜف
خٞيَػ
لاا
ةلاقزس
،
ك
GR
ٗ
TrxR
،
.ٛذثىا ُبطشس ذض ُْ٘ٝصاذٝشٞجيى خَٞسىا حسذقىبث خطجرشٍ
ٍْٔٗ
،
بْصيخ
ُْ٘ٝصاذٝشٞجىا دبقزشٍ ُأ ٚىإ
صضؼٝ ُأ ِنَٝ
خٞخلاؼىا خٞىبؼفىا
ُبطشسى ٜىبحىا جلاؼيى
ٛذثىا
ٜجيسىا ٜثلاثىا
(
TNBC
)
قٝشط ِػ
حجم
GR
ٗ
TrxR
.
حششر حئبزْىا ٓزٕ
TrxR
ٜخلاػ فذٖم
خٞخلاؼىا خٞىبؼفىا ِٞسحزى
خٞىبحىا خٝٗدلأى
حدبضٍ حذٝذخ خٝٗدأ ٌَٞصزى ٗأ ُبطشسيى حدبضَىا
ُبطشسى
ٛذثىا
ٚيػ خَئبقىاٗ
دبقزشٍ
ُْ٘ٝصاذٝشٞجىا
.
تيسيئرلا ثبملكلا
ٛذثىا ُبطشس ؛ٜجيسىا ٜثلاثىا ٛذثىا ُبطشس :
ER-positif
ٍ طبشّ ؛
ًس٘ىا دبض
؛
( خٞؼٞجطىا بٝلاخىا
PBMCs
)
؛
دبٖخإ ؛حٍشجَىا بٝلاخىا دٍ٘ ؛قفا٘زىا
؛ٛذسمأر
حذسملأا دادبضٍ خَظّأ
(
Glutathione
)
ٗ
(
Thioredoxin
)
.
18
19
1. Généralités sur le CANCER DU SEIN
Depuis qu‟il est connu sous le nom de ‟carcinos‟ dans les prêtres d‟Esculape et Hippocrate (460-377 av. J.-C.), le cancer est considéré comme une maladie aussi affreuse que bien souvent fatale malgré les traitements : c‟est une prolifération anarchique, tumorale ou ulcérante s‟étendant inexorablement (Rouesse et al., 2013).
Depuis la plus haute Antiquité, la première description du cancer du sein ayant été faite par Hippocrate sous le terme de « carcinoma ». Précisément, l'histoire connue du cancer du sein remonte au moins à 1600 av. J. -C dans les décrits Egyptiens du papyrus Edwin Smith où il a décrit pour la première fois des cas de pathologies pouvant s‟apparenter à des cancers du sein (Baize et al., 2008).
La survenue d'un cancer du sein est connue donc, depuis longtemps (Jemal et al., 2011 ; Clarke et al., 2006), cette maladie affecte les femmes de toutes les races et nationalités. Parmi les différents cancers humains, chez la femme, le carcinome mammaire est la tumeur maligne non cutanée la plus répandue à l'échelle mondiale et la principale cause de décès par carcinome chez les femmes. Le cancer du sein qui est la principale cause de mortalité dans les pays en développement et les pays développés (Globocan Estimation, 2018) semble être un enjeu majeur de la santé publique mondiale. L'incidence de ce fardeau est en augmentation constante (Globocan Estimation, 2018), ce qui entraîne une augmentation des coûts économiques lourds sur les femmes et leurs familles.
Grace à l‟avancée technologiques telles que le séquençage de nouvelle génération et les puces d'expression génétique, les scientifiques découvrent maintenant une pléthore de mutations de gènes et altérations au sein des cancers du sein. Cette avancée a mis en évidence la grande hétérogénéité des cancers du sein. De ce fait, il est maintenant entendu que le cancer du sein n‟est pas une maladie unique mais plutôt de nombreuses différentes maladies, chacune avec ses propres caractéristiques cliniques, morphologiques et moléculaires.
A ce jour, de nombreux facteurs de risque de cancer du sein ont été identifiés (IARC, 2014). Cependant, l‟étiologie du cancer du sein reste complexe et multifactorielle. Les facteurs de risque du développement du cancer du sein sont avant tout l‟âge, le sexe, l‟existence d‟une anomalie génétique prédisposant au cancer, les facteurs environnementaux et les facteurs de risque hormonaux (œstrogènes endogènes et exogènes, les antécédents menstruels, les premières règles), la ménopause tardive et la fin de la grossesse.
20
L‟âge est le principal facteur de risque de cancer du sein. Le cancer du sein augmente avec l‟âge, il touche très rarement les femmes de moins de 30 ans tandis que le risque après 50 ans est multiplié par 5 par rapport à la population générale. De plus, l‟incidence du cancer du sein est liée au sexe. Les hommes peuvent eux aussi être atteints par un cancer du sein, mais cela est infiniment plus rare, puisqu‟ils représentent seulement 1% des cas de cancer du sein (Globocan Estimation, 2018). Il est à noter que des facteurs hormonaux sont clairement liés au risque de cancer du sein. Le risque de survenue d‟un cancer du sein est plus élevé lorsque la durée et le niveau d‟exposition aux œstrogènes sont importants (Key et al., 2013). En effet, les traitements hormonaux de la ménopause sont considérés comme étant des agents cancérogènes, le risque de cancer du sein apparait dès les cinq premières années de prise et augmente avec la durée d‟utilisation (Cogliano et al., 2011 ; IARC, 2012).
A ce jour, les études épidémiologiques ont établi, le rôle tumorigène des œstrogènes au niveau mammaire. Les données de la littérature montrent, de longue date, que des menstruations précoces et/ou la survenue tardive de la ménopause (Collaborative Group on Hormonal Factors in Breast Cancer, 2012), l‟âge tardif de la première grossesse (après 35 ans) ou l‟absence de grossesse (Russo et al., 2005), l‟augmentation du nombre de cycles menstruels et les cycles menstruels courts favorisent une longue exposition de l‟épithélium mammaire aux hormones ovariennes, notamment les œstrogènes et augmentent le risque du cancer du sein (Colditz et al., 2004).
Différents facteurs génétiques peuvent jouer un rôle dans le risque de développer un cancer du sein. Les antécédents familiaux de cancer du sein au premier degré augmentent le risque de cancer (Collaborative Group on Hormonal Factors in Breast Cancer, 2001). De nombreuses mutations peuvent également entrainer une réelle prédisposition au cancer du sein à savoir celles les plus connues, les mutations des gènes BRCA1 et BRCA2 qui génèrent un risque très élevé de cancer du sein (Mavaddat et al., 2010).
Les antécédents personnels de cancer du sein sont un facteur de risque majeur. Les femmes qui ont eu un cancer du sein ont un risque 3 à 4 fois plus élevé de développer un nouveau cancer (INC, 2017). Ainsi qu‟une densité mammaire élevée engendre un risque de cancer du sein (Antoni et al., 2013). Quant aux facteurs environnementaux liés au mode de vie, nous pouvons citer l‟exposition aux radiations ionisantes (Martin et Weber, 2000), des facteurs alimentaires tels que la consommation d‟alcool, les régimes alimentaires riches en graisses, la prise de poids après la ménopause (Sieri et al., 2014 ; McDonnell et al., 2014 ; Shah et al.,
21
2014). Il est à noter que la pratique d‟une activité physique, entraine une diminution du risque de cancer (WCRF et AICR, 2010).
Plusieurs études suggèrent que les aspects du mode de vie ou de l‟environnement sont des déterminants du risque de cancer du sein. De plus, il semble donc exister une forte corrélation positive entre les facteurs de risque environnementaux ou génétiques, l‟exposition aux œstrogènes et le cancer du sein.
1.1. Epidémiologie du cancer du sein chez la femme
1.1.1. A travers le monde
Chez la femme, le cancer du sein est la malignité la plus courante. Selon l'Organisation Mondiale de la Santé (OMS), il s'agit du cancer le plus courant chez les femmes à la fois dans les pays développés et les moins développés (Global Health Estimation, OMS 2018). En effet, c‟est le cancer le plus fréquemment diagnostiqué dans la vaste la majorité des pays (154 sur 185) et il est également la principale cause de décès par cancer dans plus de 100 pays, suivi des cancers colorectaux et du poumon (Global Health Estimations, OMS 2018) (Figure 1, Figure 2). Dans le monde entier, en 2018, il y a environ 2,1 millions de femmes nouvellement diagnostiquées par cancer du sein, représentant près de 1 cas de cancer sur 4 chez les femmes (24,2% de tous les cancers).
22
Figure 1. Estimation de l'incidence du cancer le plus courant chez la femme dans le monde en 2018. Le nombre de pays représentés dans chaque groupe de classement est inclus
dans la légende (GLOBOCAN, 2018*).
Malgré que les taux d‟incidence soient les plus élevés en Australie / Nouvelle-Zélande, Europe du Nord, d‟Europe occidentale, les Pays-Bas et la France, Europe du Sud et Amérique du Nord. Alors que dans les 5 régions africaines, le risque cumulé de décès chez les femmes en 2018 est globalement comparables aux risques observés chez les femmes en Amérique du Nord et dans les pays d'Europe aux revenus les plus élevés. Donc, en termes de mortalité, les taux de cancer du sein montrent moins de variabilité.
Globalement, chaque année, plus de deux millions de cas de cancer du sein sont diagnostiqués, mais un pourcentage élevé est caractérisé par le cancer du sein triple négatif (TNBC), qui est connu pour ê1tre le sous-type complexe et agressif du cancer du sein.
23
Figure 2. Estimation de la mortalité au cancer du sein dans le monde en 2018. Le nombre
de pays représentés dans chaque groupe de classement est inclus dans la légende (GLOBOCAN, 2018*).
Le cancer du sein se classe comme la cinquième cause de décès par cancer en général (626,679 morts) et alors qu'il est la cause la plus fréquente de décès par cancer chez les femmes dans les régions les moins développées (324.000 de décès, 14,3% du total de nombre de décès chez la femme), il est maintenant la deuxième cause de décès par cancer dans les régions les plus développées (198.000 de décès, 15,4% du total de nombre de décès chez la femme), après le cancer du poumon. Le taux de mortalité à travers le monde est inférieur à celui de l'incidence en raison d‟une survie plus favorable de cancer du sein dans les pays développés, avec des taux allant de 6 pour 100.000 en Asie de l'Est à 20 pour 100 000 en Afrique de l'Ouest (Globocan Estimation, 2018).
1.1.2. Epidémiologie Nationale
Au Maroc, le cancer du sein représente le tiers de l‟ensemble des cancers de la femme. En 2012, selon le Registre des Cancers de Rabat (RECRAB), 491 nouveaux cas chez les femmes a été enregistré, soit 39,9% des cancers féminins. Les femmes jeunes de moins de 35 ans
24
représentent 6,7% des cas, avec un âge médian de 50 ans. L‟incidence est plus élevée dans les tranches d‟âges 45-54 ans (144 pour 100 000) et 55-64 ans (131 pour 100 000) et reste relativement faible dans la tranche d‟âge 25-34 ans (16 pour 100 000) (Ministre de la Santé, 2012).
Selon le Registre des cancers de la Région du Grand Casablanca (RCRC), l‟incidence enregistré augmente constament au fil des années pour atteindre 39,9 nouveaux cas par 100 000 femmes en 2007 (RCRC, 2012).
1.2. Types du cancer de sein (Aspects cliniques du cancer du sein)
Le cancer du sein relève à un ensemble de proliférations néoplasiques de la glande mammaire qui diffèrent tant du point de vue histologique. En réalité le carcinome est un terme spécifique de morphologie histologique qui désigne les types les plus fréquents du cancer du sein d‟origine épithéliale. Les tumeurs malignes du sein les plus fréquents sont des adénocarcinomes (98%), parmi lesquels on distingue les carcinomes in situ ou non invasifs et les carcinomes invasifs ou infiltrants.
Le carcinome in situ (CIS) fait référence à une prolifération néoplasique limitée aux canaux et aux lobules par la membrane basale. En effet, les carcinomes in situ se répartissent entre carcinome canalaire in situ (CCIS) et lobulaire in situ (LCIS). Le carcinome canalaire in situ est une forme de cancer très précoce est plus commun. C‟est le plus fréquent que le carcinome lobulaire. Le carcinome lobulaire in situ également connu sous le nom de néoplasie lobulaire, est, quant à lui, plus rare, et correspond au développement des cellules anormales dans les lobules. Il possède une faible variation histologique et il est considéré comme un facteur de risque de développement du cancer du sein.
Le carcinome invasif ou infiltrant dont les cellules ont le potentiel d'envahir le système vasculaire et ainsi atteindre les ganglions lymphatiques régionaux et des sites distants. La plupart des cancers du sein sont invasifs, ou infiltrés, ce qui signifie qu'ils ont traversé les parois des glandes ou des conduits d'où ils provenaient et se sont développés dans le tissu mammaire environnant. Malheureusement, le carcinome est souvent infiltrant, ses formes les plus fréquentes sont le carcinome canalaire infiltrant (85 %) et le carcinome lobulaire infiltrant (5%). Bien que le cancer du sein ait généralement été désigné comme une maladie
25
unique, il existe jusqu'à 21 sous-types histologiques distincts et au moins quatre sous-types moléculaires différents.
1.3. Aspects moléculaires
Basé sur l'analyse génomique et l‟expression génique, le cancer du sein montre une hétérogénéité et une complexité au niveau moléculaire. Ainsi, il a été classifié en plusieurs sous-groupes moléculaires distincts. Un des principaux critères dans la classification moléculaire des cancers du sein repose sur l‟expression de trois récepteurs : les récepteurs des oestrogènes (ER), de la progestérone (PR) et du récepteur du facteur de croissance épidermique humain 2 HER2 (human epidermal growth factor receptor 2). Depuis plusieurs travaux, le classement des tumeurs mammaires compte désormais 6 sous-types moléculaires : luminal A, luminal B, basal-like, normal breast-like, HER2-enrichi (Eroles et al. 2012).
1.3.1. Tumeurs luminales
Le type luminal se caractérise par l‟expression des récepteurs des deux hormones stéroïdiennes clés PR+/ER+ ainsi que de leurs gènes associés (Hammond et al., 2010). Il est associé à un pronostic favorable et à une réponse aux traitements anti-hormonaux et constitue 60% des carcinomes mammaires (invasifs).
Parmi les lésions luminales, on distingue le sous-type A (HR+/HER2-), le plus hétérogène se caractérise par une croissance lente et moins agressif. Il se caractérise par une expression élevée de PR/ER et de leurs gènes cibles (GATA-3, FOXA1), par une faible expression des gènes liés à la prolifération cellulaire (Ki67) (Lavasani et Moinfar, 2012) et par une faible expression de Her2. Il représente 40% des cancers de sein. Par ailleurs 16% de ce type présente une mutation du gène suppresseur de tumeur p53. Les tumeurs luminales A sont associées au pronostic le plus favorable, particulièrement à court terme, en partie parce qu'elles sont plus sensibles à la thérapie anti-hormonale. (Eroles et al. 2012).
Comme les cancers A luminaux, les cancers B luminaux (HR+ / HER2+) sont ER+ et / ou PR+ et sont en outre définis comme étant hautement positifs pour HER2 ainsi pour son gène indicateur d'une grande proportion de cellules en division active le Ki67. Ils se se caractérisen par une faible expression de PR et une forte expression d‟ER. Les cancers du sein Luminal B constitue le phénotype le plus agressif avec un grade histologique élevé, un mauvais pronostic mais une meilleure réponse à la chimiothérapie. Ils ont tendance à être de grade supérieur et
26
sont associés à une survie plus faible que les cancers de la lumière A. le sous-type luminal B représente 20 % des cancers du sein qui présente 66 % de fréquence de mutation de p53.
1.3.2. Tumeurs basales
Le sous-type basal représente 15 à 20 % des cancers du sein. L‟une de ses caractéristiques est l‟absence de l‟expression des récepteurs ER, PR et Her2, ce qui lui confère la nomenclature de tumeur triple-négatif (TN). De plus, il ne répond pas à la thérapie endocrinienne. Il exprime fortement les cytokératines basales, les gènes épithéliaux basaux, LAM, P-cadherin, CAV1, 2, NES, CD44, EGFR et les gènes liés à la prolifération. Ce type présente une mutation de p53 dans 82 % des cas et une altération du gène BRCA1 (germinale, sporadique) qui est nécessaire à la réparation des dommages à l‟ADN, et son inactivation aboutit à l‟instabilité génétique et favorise la croissance des tumeurs (Eroles et al., 2012).
1.3.3. Triple négative (HR-/HER2-)
Appelés ainsi parce qu'ils sont récepteurs aux œstrogènes (ER)-, récepteurs de la progestérone (PR)- et HER2-, ces cancers sont deux fois plus fréquents chez les femmes noires que les femmes blanches aux États-Unis, et sont également plus fréquents chez les femmes préménopausées et chez les femmes une mutation du gène de l'occurrence du cancer du sein BRCA1. La majorité (environ 75%) des cancers du sein triple négatif se situent dans le sous-type de type basal défini par le profil d'expression génique. Les cancers du sein triple négatif ont un pronostic à court terme moins bon que les autres sous-types, en partie parce qu'il n'existe actuellement aucune thérapie ciblée pour ces tumeurs.
1.3.4. Le sous-type Her2
Les cancers HER2-enrichis se caractérisent par une sur-expression élevée et une amplification de Her2. Ce type constitue 10 à 15% des cancers du sein Ils ont tendance à croître et à se propager plus agressivement que les autres sous-types et sont associés à un pronostic à court terme plus défavorable que les cancers du sein HR+. Cependant, l'utilisation récente de thérapies ciblées pour les cancers HER2+ améliore les résultats.
27
2. Mécanismes moléculaires
2.1.
Sur le plan génétique
La cancérogenèse mammaire est un phénomène multifactoriel, impliquant plusieurs gènes, aussi bien dans les formes héréditaires (anomalies génétiques constitutionnelles) que dans les formes sporadiques (anomalies génétiques somatiques). Les modifications moléculaires les plus fréquemment décrites dans le cancer du sein sont des amplifications d‟oncogènes, et des mutations ou délétions de gènes suppresseurs de tumeurs (Thompson et Easton 2004). Les mutations peuvent toucher les chromosomes, l‟ADN, l‟ARN, et les protéines. A nos jours, de nombreuses modifications géniques ont donc été décrites dans les cancers du sein. Le nombre d‟oncogènes et d‟anti-oncogènes recensés ne cesse d‟augmenter ; ces gènes codent pour des protéines impliquées dans de nombreuses cascades de transduction telles que les ligands et les récepteurs aux facteurs de croissance, des facteurs de transcription ou encore des protéines régulatrices du cycle cellulaire. Comme pour toute tumeur solide, l‟hétérogénéité du cancer du sein implique qu‟il existe plusieurs voies menant à la carcinogenèse mammaire avec des étapes différentes (Hanahan et Weinberg, 2000).
Dans le cancer du sein, l‟activation des oncogènes par amplification génique a été fréquemment décrite. Le plus souvent une amplification génique est généralement associée à des niveaux élevés d‟expression d‟ARNm et de protéine. Cependant, il existe des cas de surexpression sans amplification du gène. Les amplifications les plus fréquentes dans le cancer sein concernent les oncogènes myc, ccdn1 et HER2/neu etc. Ces modifications au niveau des oncogènes se traduisent par des sites d‟expression aberrants ou des niveaux d‟expression anormalement élevés, et par conséquence, par des gains de fonctions tendant à favoriser la prolifération des cellules tumorales. La mise en évidence de gènes suppresseurs de tumeurs et leurs études sont plus récentes, et tendent à montrer leur intervention dans la carcinogenèse au même titre que les oncogènes. En effet, les gènes suppresseurs de tumeurs agissent à différents niveaux de la vie de la cellule et sont communément subdivisés selon leur fonction, en garants de la stabilité du génome, inhibiteurs de la croissance cellulaire au sens large et modulateurs du microenvironnement cellulaire.
28
Figure 3. Deux mécanismes possibles de la cancérogenèse. (A) Le (s) facteur (s) de
transcription ne peuvent plus se lier à la région promotrice d'un gène (tel que p53). Le gène n'est pas exprimé et les cellules endommagées peuvent proliférer et devenir cancéreuses. (B) Un proto-oncogène permet aux TF d'initier la transcription et d'exprimer le produit protéique. Modifié de (Nelson, 2008).
2.2. Sur le plan protéomique
La plupart des cancers sont létaux et les altérations métaboliques sont considérées comme une caractéristique de cette maladie mortelle. La génomique et la protéomique ont grandement contribué à la compréhension de la biologie du cancer. Il manque encore des liens comme en aval, il se produit une divergence moléculaire. Un portrait du profil métabolique devrait combler ces lacunes et stimuler la recherche sur le cancer. Les métabolites étant les produits finaux sont plus stables que les ARNm ou les protéines. Des études antérieures ont montré l'efficacité de métabolomique dans l'identification de biomarqueurs associés au diagnostic, au pronostic et au traitement du cancer. Les métabolites renseignent beaucoup sur l‟état fonctionnel du système biologique, en raison de leur proximité aux phénotypes d'organismes.
2.2.1. ROS et cancer
Les espèces réactives de l'oxygène (ROS) sont un groupe de molécules (radicaux hydroxyles, peroxydes, H2O2, oxyde nitrique) maintenues, à un niveau optimal, à travers des systèmes enzymatiques et non enzymatiques (Pongkittiphan et al., 2015). L'augmentation de la production de ROS ou la diminution de l'efficacité du système de défense antioxydant est responsable du stress oxydatif de la cellule (Trachootham et al., 2009).
29
Il a été rapporté que le stress oxydatif affecte toutes les phases du processus oncogènique comprenant l'initiation, la promotion et la progression (Lei et al., 2016 ; Reuter et al., 2010).
Le stress oxydatif est connu pour activer plusieurs facteurs de transcription modulant l‟expression de nombreux gènes impliqués dans les réponses immunitaires et inflammatoires, remodelage tissulaire et fibrose, cancérogenèse et métastases (Reuter et al., 2010). Les espèces réactives de l'oxygène sont connues pour modifier l'expression de plusieurs gènes par induction de mutations génétiques, entraînant une altération de l'équilibre entre prolifération cellulaire et apoptose (Rojas et al., 2016 ; Reuter et al., 2010 ; Roos et al., 2016). Dommage à l'ADN par ROS est maintenant accepté comme une cause majeure de cancer, et a été démontré dans le cancer du sein (Waris et al., 2006). Plus important encore, les ROS sont considérées comme un facteur essentiel dans le maintien du phénotype oncogène par activation de certaines voies de signalisation, notamment les voies MAPK / AP-1 et Les voies de NF-KB (Waris et al., 2006). D'autre part, les ROS sont également requis pour l‟induction de la mort cellulaire et peuvent donc agir en tant qu'agents antitumoraux qui dépendent de la concentration de ROS dans l'environnement cellulaire (Wang et al., 2008). En outre, les ROS sont connues pour améliorer l'invasion et la métastase tumorales en augmentant les taux de migration cellulaire (V. Rojas et al., 2016 ; S. Reuter et al., 2010). La famille d'enzymes oxydases NAD(P)H, connue comme une source majeure de ROS cellulaires, elle a été liée à la promotion de la survie et de la croissance des cellules tumorales dans le pancréas et dans les cancers du poumon (V. Rojas et al., 2016 ; S. Reuter et al., 2010). Les espèces réactives de l'oxygène régulent l'expression de la protéine d‟adhésion intercellulaire-1 (ICAM-1), une protéine de surface cellulaire cellules endothéliales et épithéliales, par l‟activation de NF-KB. ICAM- 1 et IL-8 régulent la migration des neutrophiles à travers l'endothélium, qui aident à la tumormétastase (S. Reuter et al., 2010). Un autre acteur clé de l'invasion tumorale processus est la régulation à la hausse de matrixmetalloproteinases spécifiques (MMP) qui sont des enzymes essentielles dans la dégradation de la plupart des composants de la membrane basale et matrice extracellulaire par H2O2 et NO (S. Reuter et al., 2010 ; J. Westermarck et al., 1999). Le mécanisme de régulation à la hausse de la RPM implique l‟activation de Ras, les membres de la famille MAPK ERK1 / 2, p38 et JNK, ou l'inactivation des phosphatases (S. Reuter et
al., 2010 ; J. Westermarck et al., 1999).
L'angiogenèse est essentielle à la survie des tumeurs solides et est également régulé par les ROS (S. Reuter et al., 2010). L'angiogenèse est régulée par un certain nombre d'oncogènes et des gènes suppresseurs de tumeurs tels que Ras, c-Myc, c-Jun, p53 muté, le récepteur du
30
facteur de croissance épidermique humain 2 et des stéroïdes coactivateurs par surexpression du VEGF ou la sous-expression de thrombospondine-1 (TSP-1), un suppresseur d'angiogenèse (Reuter et al., 2010 ; Westermarck et al., 1999).
2.2.2. Stress oxydatif dans une cellule tumorale
La principale caractéristique des cellules cancéreuses est l'activation aberrante des oncogènes et la désactivation des suppresseurs de tumeurs, qui favorisent leur prolifération non restreinte. Cependant, la condition préalable essentielle à la prolifération est également l‟abondance d‟énergie et de substrats pour l‟anabolisme. Par conséquent, la transformation oncogène est associée à la « transformation métabolique », un métabolisme généralement amélioré avec plusieurs schémas spécifiques servant à l'acquisition rapide et imprudente de blocs de construction énergétiques et métaboliques (Dong et al., 2017 ; Martinez-Outschoorn et al., 2017 ; Mullen et DeBerardinis, 2012 ; Sullivan et al., 2016). La transformation métabolique dans le cancer est un phénomène universel indépendamment conduit par plusieurs oncogènes et ressemblant au métabolisme des cellules normales lors de la réparation des tissus et de la réponse immunitaire (Smith et al., 2016). Les complexes respiratoires mitochondriaux sont les principales sources d'espèces réactives de l'oxygène (ROS) dans la cellule. La production de ROS mitochondriales est accrue lorsque les composants du complexe respiratoire restent plus souvent dans un état réduit en raison d'une disponibilité excessive de NADH (Korge et al., 2016), d'un manque d'oxygène (Sullivan et Chandel, 2014) ou d'un potentiel de membrane mitochondriale élevé (Jabørek et al., 2013). De manière importante, le flux de ROS mitochondriales est encore accru par l'activité interconnectée des enzymes NADPH oxydases (NOX) producteurs de ROS (Sullivan et Chandel, 2014). Dans des conditions normales, les faibles niveaux de ROS sont bien compensés avec un antioxydant machine et servent en fait de molécules de signalisation (Khramtsov et Gillies, 2014). L‟espèce primaire ROS, le superoxyde, est convertie avec l‟enzyme superoxyde dismutase (SOD) en peroxyde d‟hydrogène stable et moins réactif, qui est un substrat pour la signalisation rédox basée sur l‟oxydation spécifique des cystéines des protéines. Une élévation modérée des ROS mitochondriales est une caractéristique des cellules cancéreuses servant de stimulus à la prolifération des cellules cancéreuses par la désactivation de l'homologue suppresseur de tumeur phosphatase et tensine (PTEN) et autres phosphatases et activation simultanée du facteur nucléaire κB (NF-κB), de la protéine kinase B (Akt), cible mécanistique de la rapamycine (mTOR), et de nombreuses autres kinases impliquées dans la
31
signalisation oncogénique (Gào et Schöttker, 2017). Cependant, une production exagérée de ROS peut déborder de la barrière anti-oxydante et provoquer un stress oxydatif excessif entraînant la mort cellulaire (Niki, 2016).
2.2.3. L’état pro-oxydant chez les cellules cancéreuses mammaires
Le stress oxydatif a été impliqué dans la pathogenèse de plusieurs tumeurs malignes, y compris le cancer de l'ovaire (Gào et Schöttker, 2017). Les preuves suggèrent que les patients atteints d'un cancer de l'ovaire présentent une diminution des niveaux d'antioxydants en circulation et des niveaux plus élevés de stress oxydatif (Smith et al., 2016). Dans les deux dernières décennies, il a été rapporté que les tissus du cancer épithélial de l'ovaire (COE) et les cellules manifestent un état pro-oxydant caractérisé par une augmentation expression d'enzymes pro-oxydantes clés et diminution expression d'enzymes antioxydantes (Dong et al., 2017).
La prochaine génération de médicaments anticancéreux sera définie par des composés qui sélectivement tuer les cellules cancéreuses tout en laissant les cellules normales non perturbées. Les cellules cancéreuses génèrent plus de ROS et dépendent d'un système antioxydant hautement fonctionnel que les cellules normales (Raj et al., 2011). Les systèmes enzymatiques de désintoxication ROS qui empêchent l'induction de la mort cellulaire sont activés dans les cellules cancéreuses. Par conséquent, cibler les phénotypes de stress propres aux cellules cancéreuses et leurs gènes associés. Les vulnérabilités peuvent constituer une stratégie prometteuse pour le traitement du cancer (Lawless et al., 2010). Bouchmaa et al. (2018), ayant montrés que deux petites molécules innovantes ayant des activités anticancéreuses associées au métabolisme des ROS ont été caractérisées dans des modèles de cellules cancéreuses à savoir le cancer triple négatif (TNBC) et du cancer ER-Positif. Les auteurs ont indiqué que la réponse cellulaire à ces composés était dépendante de l'expression des ROS et pourraitent associés aux gènes associés au métabolisme des ROS (Bouchmaa et
al., 2018).
2.2.4. Systèmes antioxydants
Le réseau antioxydant cellulaire est essentiel pour la protection contre les dommages oxydatifs, maintien de l‟homéostasie rédox et bon fonctionnement de la signalisation rédox (Gào et Schöttker, 2017 ; Gorrini et al., 2013). Le principal tampon antioxydant et rédox hydrophile de la cellule est un tripeptide, le glutathion (GSH). Il réagit avec les ROS et les