HAL Id: hal-02800930
https://hal.inrae.fr/hal-02800930
Submitted on 5 Jun 2020HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Coloration mélanique et stratégies comportementales
chez la truite fario (Salmo trutta)
Vincent Roussille
To cite this version:
Vincent Roussille. Coloration mélanique et stratégies comportementales chez la truite fario (Salmo trutta). Biodiversité et Ecologie. 2014. �hal-02800930�
Université de Bourgogne - Master STS - ETEC Spécialité Biologie des Organismes et des Populations
Mémoire de stage de Master deuxième année, année universitaire 2013-2014
COLORATION MÉLANIQUE ET STRATÉGIES
COMPORTEMENTALES CHEZ LA TRUITE
FARIO (SALMO TRUTTA)
Par :
Vincent ROUSSILLE
Réalisé sous la direction de :
Lisa JACQUIN, Université Toulouse 3
Organisme d’accueil :
UMR 1224 ECOBIOP Écologie Comportementale et Biologie des Populations de Poissons INRA - Pôle d’hydrobiologie
Quartier Ibarron, 64310 Saint-Pée-sur-Nivelle
Remerciements
Je tiens tout d’abord à remercier vivement toutes les personnes faisant parti de l’INRA de Saint-Pée-sur-Nivelle pour leur accueil chaleureux et plus particulièrement Agnès Barbonnet, directrice de l’UMR ECOBIOP du pôle d’hydrobiologie, pour m’avoir accepté au sein de son unité de recherche lors de ces 6 mois de stage.
Je voulais bien entendu adresser mes plus sincères remerciements à Lisa Jacquin, qui m’a permis d’effectuer ce stage à ses côtés et qui m’a encadré durant ces 6 mois. Elle a su me faire confiance durant toute la mise en place et la réalisation du projet et son dynamisme et ses qualités humaines ont largement contribué au plaisir que j’ai eu à travailler avec elle sur ce projet. Je voulais d’autre part remercier Jacques Labonne, mon co-encadrant, et Cédric Tentelier, membre du projet, pour leurs conseils avisés et pour toutes les discutions enrichissantes que nous avons pu avoir.
Je tenais aussi à remercier tous les techniciens et ingénieurs du laboratoire ECOBIOP, qui ont participés de près ou de loin au projet, pour leur aide, leur gentillesse et leur bonne humeur au quotidien. En espérant n’oublier personne, les voici : Jacques Rives, Emmanuel Huchet, Pascale Coste, Frédéric Lange, Ester Carlut, Jean-Christophe Aymes, Stéphane Glise, François Guéraud et Aurélie Manicki.
Un grand merci à Franck Darritchon, garde-pêche de l'APRN (Association des Propriétaires et Riverains de la Nive) pour toute l’aide qu’il a pu nous apporter et pour tous les conseils qu’il a pu nous donner lors des expérimentations sur le terrain.
Je souhaitais remercier Jérôme Bugeon et Guillaume Evanno de l’INRA de Rennes pour leur collaboration à ce projet et leur aide concernant les analyses photographiques mais aussi Michel Le Hénaff de l’Université de Bordeaux, pour sa collaboration concernant les analyses immunitaires.
Je voulais terminer par remercier et témoigner mon affection à toutes les personnes que j’ai côtoyées au quotidien durant ces 6 mois et avec qui j’ai passé d’inoubliables moments de rigolade et qui ont grandement contribué au bonheur que j’ai eu à effectuer ce stage. Je veux bien sûr parler de Zoé, Jordi, Laure, Elie, Elorie, Karine, Ikram, Vivianna, Weiwei, Vincent V., Ludo, Alex, Gaïa, Vincent G. et Séverine.
TABLE DES MATIERES
Introduction ... 1
Matériels & Méthodes ... 4
Modèle biologique et variabilité de coloration mélanique ... 4
Mesure comportementale de gestion du stress ... 6
Mesure de succès reproducteur ... 7
Mesure d’investissement reproducteur ... 7
Analyses statistiques ... 9
Résultats ... 9
Différences mâles / femelles ... 9
Stabilité de la coloration mélanique ... 11
Coloration mélanique et gestion du stress ... 11
Coloration mélanique et succès reproducteur ... 12
Coloration mélanique et perte de poids ... 13
Coloration mélanique et investissement reproducteur ... 14
Discussion ... 15
Perspectives ... 19 Bibliographie
Introduction
La communication entre individus, qui repose pour une large part sur les signaux visuels chez certaines espèces, joue un grand rôle au sein des populations animales. En effet, les signaux visuels et plus particulièrement les signaux colorés présentés à la surface du derme (couleur des plumes, poils ou de la peau) constituent un moyen rapide d’échange d’informations. Cette émission passive et parfois honnête d’informations peut renseigner les congénères sur la condition corporelle (Jawor et al. 2004), l’immunocompétence (Saks et al. 2003) ou encore sur le statut social de l’émetteur, mais aussi sur ses caractéristiques génétiques, qui peuvent être utilisées lors du choix du partenaire (théorie des « bons gènes »). A l’échelle intra-spécifique, les individus d’un même sexe ou d’une même classe d’âge peuvent présenter des variations importantes de coloration conditions-dépendantes telles que les couleurs à base de caroténoïdes (pigments responsables des couleurs rouge et orange) mais aussi de couleurs génétiquement déterminées telles que les couleurs à base de mélanine.
La coloration mélanique (responsable de la coloration noire et brune) est un modèle de choix pour l’étude des processus évolutifs de maintien de la diversité intraspécifique. En effet, la coloration mélanique constitue la coloration la plus répandue chez de nombreux vertébrés (mammifères, oiseaux, reptiles, poissons). Chez certaines espèces, elle est due à l’agrégation de cellules appelées mélanophores contenant des vésicules, les mélanosomes, remplies de mélanine. Les variations de la coloration mélanique peuvent être dues aux variations du nombre de mélanophores (génétiquement déterminé) qui peut donner des individus plus ou moins ponctués par exemple ou avec des tâches noires plus ou moins étendues. Chez les poissons et les reptiles, les mélanosomes peuvent également migrer à l’intérieur des chromatophores sous contrôle hormonal, nerveux ou mixte et refléter l’état de stress de l’individu. Dans cette étude, nous nous sommes focalisés uniquement sur la composante constante génétique de la coloration mélanique (stable au cours de la vie de l’individu).
En effet, de nombreux travaux en génétique (Hoekstra 2006, Hubbard et al. 2010 ou encore McKinnon & Pierrotti 2010) ont montré que la coloration mélanique, en particulier l’étendue de coloration noire sur le corps, a un déterminisme principalement génétique, même si l’environnement à la capacité de moduler l’intensité de noir. Les polymorphismes de couleur mélanique ont donc été pendant longtemps des modèles privilégiés dans l’étude des mécanismes de maintenance de la variabilité intraspécifique en milieu naturel, comme l’ont montré les études sur la phalène du bouleau (Majerus 1998, Hubbard et al. 2010, Roulin
2004). Le polymorphisme de coloration (défini comme des variations discrètes de coloration mais étendu récemment à des variations continues, Roulin 2004) est en effet un moyen simple de caractériser visuellement le génotype des individus et de comparer les stratégies génétiques associées à ces différents morphes (Calsbeek & Sinervo 2008 ; Krüger 2008).
Les variations de coloration mélanique peuvent en effet affecter directement la valeur adaptative des individus comme quand elles confèrent des avantages en termes d’attractivité sexuelle et de risque de prédation (Majerus 1998). Toutefois, il a été décrit que certains traits phénotypiques sont liés à la coloration mélanique sans pour autant être affectés directement par les propriétés des pigments mélaniques comme par exemple l’agressivité ou encore l’activité sexuelle. Par exemple la testostérone a la capacité d’augmenter de façon simultanée la surface de coloration à base de mélanine et l’agressivité des moineaux domestiques Passer domesticus (Strasser & Schwabl 2004). Ces co-variations peuvent aussi être d’origine génétique, par l’action pléiotrope (touchant plusieurs tissus) des gènes impliqués dans la synthèse de la mélanine. En effet, les gènes codant pour la mélanine ont des effets pléiotropes sur d’autres composantes physiologiques, en particulier le taux de reproduction, la réponse au stress, l’immunité et l’activité (Ducrest et al. 2008). Dans ce cas présent, la sélection naturelle n’agit pas directement sur la coloration mais sur les traits d’histoire de vie qui lui sont associés et a fortiori sur les stratégies d’histoire de vie des individus.
Ainsi, la mélanine pourrait potentiellement être liée à différents types de stratégies d’histoire de vie (ensemble de traits d’histoire de vie associés à des coûts et à des bénéfices variables) génétiquement fixés et les signaler aux congénères mais cette hypothèse a encore été peu testée empiriquement (Roulin 2004). Par exemple, différents types de stratégies d’histoire de vie peuvent être sélectionnées selon plusieurs paramètres tels que les corrélations génétiques entre traits (architecture génétique), les conditions environnementales (parasites, disponibilité en nourriture) ou les caractéristiques propres aux individus (condition corporelle, taille, etc) et la sélection naturelle favorise les combinaisons de traits avantageuses en termes de valeur adaptative (Stearns 1992). Conceptuellement, les stratégies d’histoire de vie ont longtemps été caractérisées selon deux axes r et K (MacArthur & Wilson 1967 et Pianka 1970), élargies plus récemment le long d’un continuum de stratégies rapides-lentes dans le cadre du pace-of-life syndrome (Réale et al. 2010). Bien que les études empiriques ne soutiennent pas toujours ces classifications simplistes, elles fournissent un cadre conceptuel utile pour interpréter les variations de stratégies d’histoire de vie au sein des populations naturelles.
2
La stratégie r ou stratégie dite « rapide » se caractérise par un fort investissement reproducteur mais par une faible maintenance corporelle, par une faible réponse au stress et un investissement dans l’immunité non spécifique, par un comportement actif et une faible réponse au stress (type proactif) et serait favorisée dans un environnement peu compétitif mais instable. Ce type de stratégie pourrait potentiellement être associé voir signalé par une coloration mélanique foncée dans la mesure où les ligands et récepteurs responsables de la synthèse de la mélanine entrainent également une reproduction accrue, une plus grande agressivité et une plus grande activité (Ducrest et al. 2008). Cependant cette hypothèse reste encore à tester. A l’opposé, les individus plus clairs pourraient présenter des stratégies de type K dite « lente » favorisée dans des environnements stables, se traduisant par une faible reproduction mais une bonne maintenance corporelle et une bonne immunité spécifique, mais par une faible prise de risque et une plus forte réponse au stress (type réactif) (Jacquin et al. 2012). Cependant, peu d’études empiriques ont testé l’existence de tels liens entre les différents traits physiologiques (immunité), comportementaux (prise de risque) et morphologiques (coloration) qui pourraient évoluer ensemble dans les populations naturelles.
Dans cette étude, l’objectif était de caractériser la variabilité de coloration mélanique dans des populations sauvages de truites fario (Salmo Trutta) et de tester si les variations de la coloration mélanique pouvaient refléter des stratégies de traits d’histoire de vie (combinaisons de traits physiologiques et comportementaux) en environnement variable. Nous avons utilisé la truite fario ou truite commune comme modèle d’étude car cette espèce possède un fort polymorphisme de coloration qui se traduit par un nombre variable et facilement caractérisable de points noirs sur la robe. Des études ont montré que chez certains salmonidés et plus précisément chez la truite arc-en-ciel (Oncorhynchus mykiss) et le saumon Atlantique (Salmo salar), ce polymorphisme est associé à des variations individuelles de réponses au stress, de comportement et de résistance aux parasites (Kittilsen et al. 2009, 2012). En effet, des individus possédant beaucoup de points noirs montrent une réponse physiologique et comportementale (prise alimentaire) réduite face à un stress par rapport à des individus avec peu de points noirs. D’autres études ont montré que ce polymorphisme était aussi lié au succès reproducteur, avec les individus les plus noirs engendrant plus descendant viables que les individus clairs (Wedekind et al. 2008 ; Marie-Orléach et al. 2014).
Nous avons donc décidé d’étudier les relations entre la coloration mélanique (mesuré par la surface de points noirs composant la robe des individus) et trois traits d’histoire de vie centraux : la gestion du stress (mesurée par les modifications du rythme respiratoire après
induction d’un stress), le succès reproducteur (mesuré par le nombre de descendants viables) et l’investissement reproducteur (mesuré par la perte d’énergie au cours de la reproduction : perte de poids et de métabolites plasmatiques). En effet, la gestion du stress détermine la façon dont les individus réagissent aux variations de leur environnement, tandis que l’investissement reproducteur et le succès reproducteur sont intimement liés à la valeur adaptative des individus.
Afin de tester notre hypothèse, nous disposions de données de suivis de reproduction effectuées l’an passé. Une partie des données provenait d’une expérimentation réalisée en milieu semi-naturel car avec des conditions contrôlées (succès reproducteur et investissement reproducteur) tandis que l’autre partie des données provenaient d’une expérimentation effectuée en laboratoire (gestion du stress). Si notre hypothèse est vraie, nous nous attendions d’une part à ce que les truites les plus foncées investissent plus dans la reproduction que les truites les plus claires (plus grand nombre de descendants, plus grande perte de poids et de métabolites au cours de la reproduction). De plus nous nous attendions à ce que les individus les plus noirs présentent une meilleure gestion du stress se reflétant par une diminution plus rapide des battements operculaires après un évènement stressant.
Matériels & Méthodes
Modèle biologique et variabilité de coloration mélanique
La Truite fario (Salmo trutta) ou truite commune est une espèce de poisson itéropare appartenant à la famille des salmonidés. C’est une espèce strictement carnivore qui se nourrit principalement d’insectes, de crustacés mais aussi de poissons et qui a la particularité de présenter un fort polymorphisme de coloration. En effet, on observe une variation interindividuelle du nombre de points (allant d’une quasi absence de points jusqu’à une robe tigrée avec une très forte densité de points noirs), de la taille (qui peut varier selon l’état physiologique des individus), de la disposition et de l’intensité de la coloration des points noirs (coloration mélanique) et des points rouges (coloration caroténoïdique) mais aussi de la teinte générale de la robe. Pour notre étude, nous nous intéresserons uniquement à la coloration mélanique génétiquement déterminée, qui correspond à la variation
4 4
interindividuelle du nombre de points noirs sur la robe (figures 1a. et 1b.) et qui pourraient potentiellement refléter des stratégies génétiques alternatives (Kittilsen et al. 2009).
a.
b.
Figure 1 : a. : photographie d’un individu peu mélanique (peu de points noirs) ; b. : photographie d’un individu
très mélanique (beaucoup de points noirs).
Pour étudier les variations de la coloration mélanique interindividuelle, une photographie de chaque face des individus a été prise à l’aide d’un appareil photo numérique (de marque Pentax) et transférées sur ordinateur, permettant d’effectuer des analyses sous un logiciel prévu à cet effet à savoir Image J (logiciel de traitement et de modification d’images numériques). Avant cela, chaque individu a été anesthésié avec une dose standard de 0,3 ml/L de 2-phénoxyéthanol et placé parallèlement à une réglette graduée avec une précision au millimètre. Grâce au logiciel Image J, nous avons pu avoir des données sur le nombre de points noirs composant la robe, sur la surface de chaque point noir et sur la surface de l’ensemble des points noirs, ou encore sur la surface totale de noir (points noirs + reste de la robe).
Pour nos analyses, nous nous sommes focalisés sur une seule composante de la coloration mélanique à savoir la surface totale de points noirs. Cette surface correspond à la somme des aires de chaque point noir composant la robe du poisson et est présentée comme un pourcentage de la surface totale du corps afin de corriger par les différences de taille entre les individus. Un individu avec un fort pourcentage de noir correspond donc à un individu
avec un grand nombre de point et une grande surface de chaque point. Nous nous sommes focalisés sur cette mesure car elle reflète bien les variations du nombre total de cellules mélanophores qui composent la coloration génétiquement déterminée. De plus, ce type de coloration est stable au cours de la vie d’un individu. Des analyses séparées effectuées sur le nombre de points seul, sur la surface moyenne des points ou sur la coloration de la robe entière (points + fond) donnent des résultats qualitativement similaires et nous ne les présenterons pas dans ce rapport.
De plus, dans des papiers précédents, deux autres composantes de la coloration mélanique ont été quantifiées à savoir la darkness (« noirceur » ou pic de noir) ainsi que la valeur moyenne de noir qui correspondent à des mesures d’intensité de noir (cf Wedekind et al 2008). Cependant, ces deux variables n’ont pas été analysées car toutes les photographies n’avaient pas la même exposition lumineuse et ne permettaient donc pas d’analyse fiable d’intensité de couleur.
Mesure comportementale de gestion du stress
Les mesures comportementales de gestion du stress se sont déroulées en laboratoire et ont consisté à observer les variations du nombre de battements operculaires des individus au cours du temps suite à un stress de contention induit (déplacement et maintien dans un petit bac au sein d’un autre bac). Il s’agit d’une procédure classique pour mesurer le stress des poissons (e.g Bell et al. 2010, Øverli et al. 2002 ; Barreto & Volpato 2004 ; Volckaert et al. 2012). Le nombre de battements operculaires a été relevé à 4 instants différents (approximativement à 0, 5, 15 et 30 minutes) et sur une durée totale d’observation de 30 minutes.
Le nombre de battements operculaires reflète le taux de ventilation d’un individu. Ce dernier est une mesure de la réponse physiologique à un stress (Barreto & Volpato 2004) et est particulièrement intéressant puisqu’il reflète les pics de cortisol et peut être mesuré de façon non invasive et par conséquent à plusieurs reprises (Bell et al. 2010). Lors d’un stress, la concentration de cortisol libérée dans le sang augmente très rapidement et engendre une augmentation quasi instantanée du rythme cardiaque, ayant pour effet d’augmenter le besoin en oxygène et la libération du dioxyde de carbone. Pour répondre à ses besoins, une augmentation du nombre de battements operculaires est nécessaire. Une fois la situation de
stress passée et le pic de cortisol atteint, la concentration de cette hormone diminue dans le sang et le taux de ventilation diminue progressivement se traduisant par une baisse du nombre de battements operculaires au cours du temps pour revenir à un niveau basal.
Mesure de succès reproducteur
Pour tester les liens entre coloration et succès reproducteur, les expérimentations ont été menées entre Décembre 2010 et Mars 2011 dans un chenal expérimental comportant plusieurs sections permettant d’induire de la variabilité de débit de l’eau. Dans cette expérience, la moitié des individus a été exposé à un débit variable et l’autre moitié à un débit constant. Chaque section a fourni une zone de fraie dans sa partie amont avec une profondeur moyenne de 15 cm, ainsi que d'une zone de refuge avec des obstacles visuels. Les truites fario sauvages (29 femelles et 20 mâles d'une taille allant de 18cm à 38cm) ont été échantillonnées par pêche électrique dans la rivière Bastan (+43° 16' 2.51", -1° 22' 32.46") et transférées dans le chenal expérimental. Elles ont été acclimatées pendant 48h dans des réservoirs sans nourriture, puis anesthésiées individuellement (0,3 ml/L de 2-phénoxyéthanol), mesurées, pesées et photographiées sur une table de mesure (table à digitaliser) en condition de lumière standardisées. Des échantillons de sang (500 µl) ont été prélevés à partir de la veine caudale avec des seringues héparinées afin d’éviter que le sang ne coagule immédiatement. Les poissons se sont ensuite reproduits dans le chenal et le nombre de descendant par couple a été relevé afin d’avoir une estimation du succès reproducteur.
Mesure d’investissement reproducteur
L’investissement reproducteur mesure la dépense d’énergie d’un individu dans la reproduction. Une bonne mesure d’investissement est la perte de poids au cours de la reproduction. Le poids des individus a donc été mesuré avant et après reproduction. La perte de poids relative au cours de la reproduction a été calculée de la manière suivante :
(Poids après reproduction – Poids avant reproduction) Perte de poids relative =
Poids avant reproduction
Cependant la perte de poids peut aussi refléter la perte de gamètes (œufs et sperme) en particulier chez les poissons. Des prises de sang ont donc été effectuées avant et après reproduction pour mesurer les taux de métabolites circulants reflétant la dépense énergétique physiologique sans sacrifier le poisson. Par exemple, la variation de triglycérides circulants au cours de la reproduction est un bon proxy de l’énergie dépensée car ces triglycérides sont libérés de façon prioritaire dans le sang pour produire de l’ATP. Les acides gras libres (AGL), utilisés une fois les triglycérides consommés, ont également été mesurés. De plus, le taux de glucose circulants qui peut refléter des évènements stressants a été mesuré. Les échantillons de sang ont été centrifugés pendant 5min à 3500 tpm, 300 µl de plasma ont été prélevés et placés dans un nouveau tube, et immédiatement congelés à -20°C puis à -80°C. La concentration de glucose dans le plasma (kit Glucose RTU ™, bioMérieux, Marcy l'Etoile, France), de triglycérides (kit SOBIODA, bioMérieux) et d’acides gras libres (kit AGNE RH, Wako Chemicals, Neuss, Allemagne) ont été déterminées à l'aide de kits commerciaux adaptés à un format de microplaques selon des procédures standards (Panserat et al. 2002 ; Kamalam et al. 2012).
Les variations relatives de la concentration plasmatique de glucose, de triglycérides et d’acides gras libres (en g/L) au cours de la reproduction ont ensuite été calculées de la manière suivante :
([Métabolites après reproduction] – [Métabolites avant reproduction]) Variation en métabolites =
[Métabolites avant reproduction]
Ces variations varient entre -1 et 1, par conséquent, lorsque la variation est positive, le niveau des métabolites plasmatiques a augmenté au cours de la saison de reproduction alors qu'il a diminué lorsque la variation est négative.
Analyses statistiques
Les analyses statistiques ont été réalisées à l’aide du logiciel R (version 2.14.2) avec un seuil de 5% (α = 0.05). Tout d’abord, nous avons analysé les différences qui pouvaient exister entre les mâles et les femelles en termes de nombre de points noirs et de taille à l’aide de tests de Student, puis nous avons vérifié la stabilité de la coloration mélanique (surface de points noirs) au cours de la reproduction par des tests de corrélation de Pearson.
Le lien entre la coloration mélanique (surface de points noirs) et les différents traits étudiés (diminution du nombre de battements operculaires reflétant la réponse au stress, nombre de descendants reflétant le succès reproducteur, perte de poids et variations de la concentration en métabolites plasmatiques reflétant l’investissement reproducteur) a été testé grâce à des modèles linéaires généralisés (avec une fonction quasi-poisson pour le succès reproducteur). Dans chaque modèle, la coloration, le sexe et le débit de la rivière ont été inclus en variables explicatives et la taille en co-variable.
Les meilleurs modèles statistiques ont été sélectionnés par retrait successif des termes non significatifs (en commençant par les interactions). La normalité des résidus et l’homoscédasticité des modèles linéaires ont été testées avec un test de Shapiro et un test de comparaison de variance de Fisher ou de Bartlett.
Résultats
Différences mâles / femelles
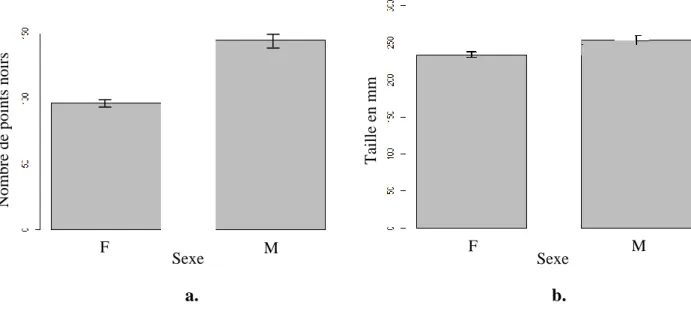
Les analyses statistiques ont révélées d’une part que les mâles possédaient en moyenne significativement plus de points noirs que les femelles (Test de Student : t1, 93 = - 3,50 ;
p-value < 0,001 ; figure 2a.) et d’autre part qu’ils étaient aussi en moyenne significativement plus grands que les femelles (Test de Student : t1, 98 = -2,50 ; p-value = 0,01 ; figure 2b.).
a. b.
Figure 2 : a. : Nombre moyen de points noirs selon le sexe des individus ; b. : Taille moyenne des individus
selon leur sexe
De plus, les mâles possédaient un nombre de points noir par centimètre carré de peau significativement plus élevé que les femelles (Test de Student : t1, 109 = - 2,74 ; p-value =
0,006) (figure 3).
Figure 3 : Nombre moyen de points noirs par centimètre carré selon le sexe des individus
10 Sexe Sexe Sexe F F M F M M N om br e de poi n ts n oi rs a u cm 2 N om br e de poi n ts n oi rs Tai ll e en m m
Stabilité de la coloration mélanique
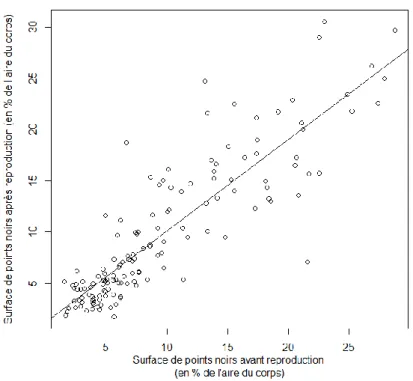
La surface de points noirs était très variable entre les individus mais relativement stable au sein d’un individu au cours de la saison de reproduction (régression linéaire fonction lm : t1, 141 = 21.41, p-value < 0.001, R²= 0.76, pente = 0.89 ; figure 4), ce qui montre que la
coloration mélanique telle qu’elle a été mesurée est stable au cours d’une saison de reproduction.
Figure 4 : Surface de points noirs après la reproduction (ordonnées) en fonction de la surface de points noirs
avant la reproduction (abscisse) (droite de corrélation de coefficient R² = 0.76).
Coloration mélanique et gestion du stress
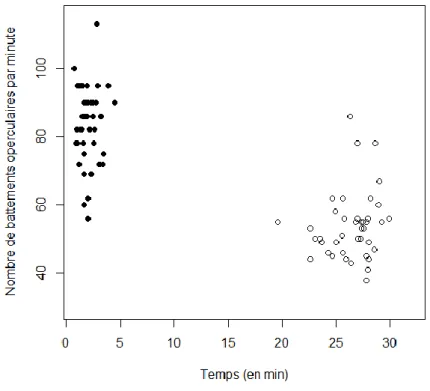
Le test de contention standard a bien induit un stress comme le montre la baisse du nombre de battements operculaires par minute observée entre le début et la fin des observations (figure 5).
Figure 5 : Représentation de la baisse du nombre de battements operculaires entre la première observation
(effectuée entre 0 et 5 min selon les individus, n=47) et la dernière observation (effectuée entre 19 et 30 min selon les individus, n=41)
Cependant, il n’existait pas de variabilité importante de la diminution du nombre de battements operculaires, et cette diminution n’était pas liée au sexe, à la taille, ou à la surface de points noirs des individus (modèles linéaires généralisés, p-value > 0.10).
De plus, il n’y a pas de différences significatives au niveau du nombre moyen de battements operculaires entre les individus clairs et foncés (modèle linéaire généralisé, effet de la surface de points noirs : t1, 45 = - 0.285 ; p-value = 0.77).
Coloration mélanique et succès reproducteur
Aucun lien n’a été détecté entre la surface de points noirs et le succès reproducteur (modèle linéaire généralisé, p-value > 0.05). Cependant, les individus de plus grande taille avaient plus de descendants que les petits individus ce qui est cohérent avec la littérature (modèle linéaire généralisé : t1, 148 = 7.01 ; p-value < 0.001).
Coloration mélanique et perte de poids
Sur la totalité des individus testés (n = 133), la majorité des individus ont perdu du poids au cours de la reproduction car en effet, seulement 8 individus présentaient un gain de poids à l’issue de la reproduction.
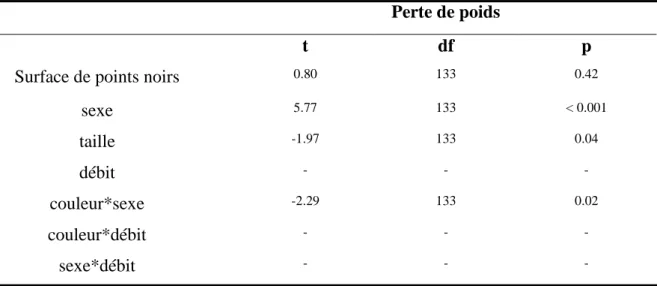
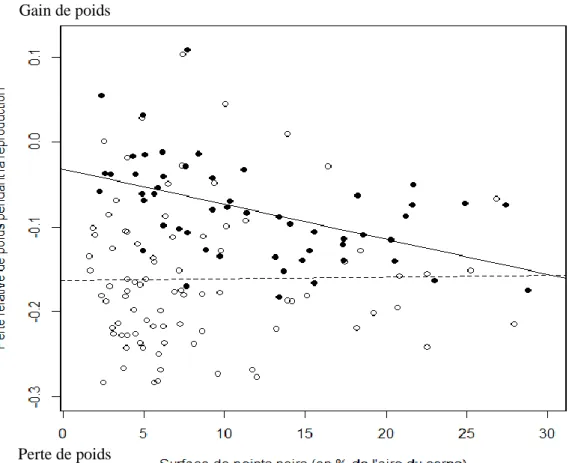
Les mâles et les femelles de différente couleur n’avaient pas la même perte de poids comme le montre l’interaction significative entre la surface de points noirs et le sexe (modèle linéaire généralisé : t1, 133 = - 2,29 ; p-value = 0.023). En effet, les mâles les plus foncés
perdaient plus de poids pendant la reproduction que les mâles plus clairs (tableau 1).
Tableau 1 : Perte de poids relative des individus au cours de la reproduction
Perte de poids
t df p
Surface de points noirs 0.80 133 0.42
sexe 5.77 133 < 0.001 taille -1.97 133 0.04 débit - - - couleur*sexe -2.29 133 0.02 couleur*débit - - - sexe*débit - - - - : retiré du modèle
De plus, les grands individus perdaient plus de poids que les petits individus (modèle linéaire généralisé, effet négatif de la taille : t1, 133 =- 1,97 ; p-value = 0,049) et les femelles
perdaient plus de poids que les mâles au cours de la reproduction (modèle linéaire généralisé, effet du sexe : t1, 133 =5,77 ; p-value < 0,001) (figure 6).
Figure 6 : Graphique représentant la perte de poids pendant la reproduction en fonction de la surface de points
noirs et du sexe des individus (points noirs = mâles ; points blancs = femelles)
Coloration mélanique et investissement reproducteur
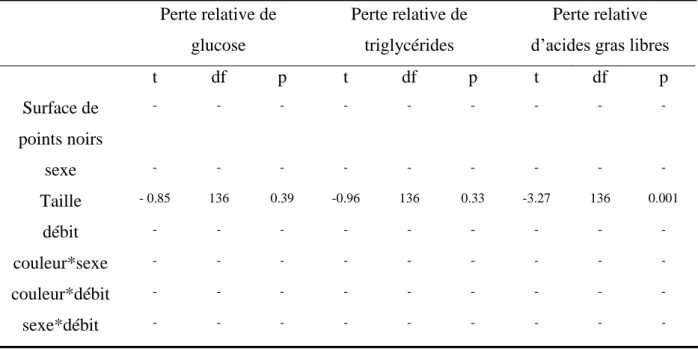
Aucun lien n’a été trouvé entre la surface de points noirs et les pertes relatives des trois métabolites étudiés (Glucose, Triglycérides, Acides gras libres : modèles linéaires généralisés, p-value > 0.05). Cependant, nous avons détecté un lien entre la perte relative en acides gras libres et la taille des individus (modèle linéaire généralisé, t1, 136 = -3.27, p-value =
0.0013) qui indique que ce sont les individus les plus grands qui perdent le plus d’acides gras libres au cours de la reproduction (tableau 2).
Gain de poids
Perte de poids
Tableau 2 : Variations en métabolites plasmatiques au cours de la reproduction. Perte relative de glucose Perte relative de triglycérides Perte relative d’acides gras libres
t df p t df p t df p Surface de points noirs - - - - sexe - - - - Taille - 0.85 136 0.39 -0.96 136 0.33 -3.27 136 0.001 débit - - - - couleur*sexe - - - - couleur*débit - - - - sexe*débit - - - - - : retiré du modèle Discussion
Différence mâles / femelles
Nous avons tout d’abord pu mettre en évidence que les mâles possédaient en moyenne plus de points noirs que les femelles. De plus, les mâles présentaient un nombre de points noirs par centimètres carré plus élevé que les femelles. Cela signifie que les mâles testés étaient en moyenne plus mélanique que les femelles. Ce dimorphisme sexuel suggère que la coloration mélanique pourrait être utilisée lors du choix du partenaire et être sous sélection sexuelle chez la truite fario mais ceci reste à prouver.
Stabilité de la coloration mélanique
Nous avons tout d’abord pu voir que la coloration mélanique était stable au cours de la saison de reproduction. Cette constatation est en accord avec la littérature car en effet, comme le décrit Brockmann (2001), ce type de coloration mélanique génétiquement déterminée
demeure stable dans le temps chez plusieurs espèces et donc tout au long de la vie des individus, et reflète bien un polymorphisme génétique. Cela conforte aussi l’idée que la procédure avec laquelle nous avons effectué les analyses sous le logiciel Image J est valable.
Coloration mélanique et diminution du nombre de battements operculaires
Nous avons observé, comme supposé, une diminution du nombre de battements operculaires après un test standard de contention induisant un stress mais que cette diminution n’était pas lié à la coloration des individus, ni aux autres variables testées. Cela pourrait nous laisser penser que la coloration mélanique n’a pas de lien direct avec la gestion du stress. Ceci est en contradiction avec plusieurs études montrant que, chez d’autres salmonidés que la truite fario, les individus les plus foncés présentent une meilleure gestion du stress (Kittilsen et al. 2009). Cependant, les résultats que nous obtenons peuvent aussi potentiellement indiquer que la coloration mélanique ne reflète pas la gestion du stress chez cette espèce, à l’inverse d’autres espèces de salmonidés comme le saumon d’Atlantique Salmo salar ou la truite arc-en-ciel Oncorhynchus mykiss.
De plus, le stress, de manière général, est un facteur qui est difficile à standardiser. En effet, il est délicat d’induire le même stress ou du moins un stress d’intensité équivalente à tous les individus lors d’une expérimentation. On pourrait alors éventuellement penser que le stress induit lors de l’expérience n’a pas été assez important, empêchant de détecter une différence, surtout si cette différence de gestion du stress entre les différents morphes colorés est faible. Ce faisant, nous ne pouvons pas affirmer que tous les individus aient reçu la même « dose » de stress (en prenant aussi en compte le fait que tous les individus ne réagissent pas de la même manière à un stress donné).
Il aurait donc été intéressant de procéder à des prises de sang avant, pendant et après stress afin d’avoir une quantification du taux de cortisol circulant pour pouvoir connaître le taux basal de cortisol (valeur prise au repos), la valeur du pic de cortisol, ainsi que le temps nécessaire pour retrouver un taux de repos. Cela aurait aussi pu permettre de savoir comment le stress avait affecté les individus ou plutôt de savoir si l’intensité du stress avait été suffisante pour observer des différences au niveau de la réponse au stress.
L’absence de résultats significatifs pourrait aussi être dû au fait que le nombre d’individu testé était insuffisant pour être représentatif de l’ensemble de la population. Durant le stage de 6 mois que j’ai effectué, nous avons mené une campagne de terrain additionnelle au cours de laquelle nous avons répété cette expérience de réponse à un stress directement en milieu naturel chez plus de 150 truites fario et sur 5 sites différents. En plus des données de battements operculaires, nous avons relevé à plusieurs intervalles de temps la durée de locomotion des individus sur un total de 30 minutes nous donnant des indications sur la gestion du stress ainsi que sur le comportement des individus. L’analyse future de ces données devrait pouvoir nous permettre d’étudier plus en profondeur le lien entre gestion du stress, comportement et coloration.
Coloration mélanique et succès reproducteur
Nos données n’ont pas mis en évidence de lien entre coloration mélanique et succès reproducteur ce qui est en contradiction avec la littérature. En effet, Marie-Orléach et al. (2014) ont décrit que les individus les plus noirs avaient un plus grand nombre de descendants viables, que ces descendants émergeaient plus tard et étaient aussi plus grands que les descendants issus d’individus clairs. Une autre étude effectuée chez la truite fario Salmo trutta (Wedekind et al. 2008) a montré que la coloration mélanique avait un lien direct avec la viabilité des embryons qui se traduisait par une meilleure viabilité des embryons issus d’individus foncés. Ceci pourrait indiquer que notre mesure de succès reproducteur n’est pas appropriée ou que les conditions de mesure (milieu semi-naturel) ne reflètent pas la réalité. Toutefois, nous trouvons un lien entre la taille des individus et leur succès reproducteur qui est cohérent avec la littérature. Tout ceci suggère que dans les populations que nous avons étudiées, la coloration mélanique ne joue pas de rôle dans le succès reproducteur.
Cependant, la manière de mesurer le succès reproducteur dans notre étude (nombre de descendants viables) prend à la fois en compte le succès d’accouplement des différents morphes colorés et la viabilité des descendants mais ne permet pas de les distinguer. Il est possible que les poissons les plus mélaniques possèdent une attractivité supérieure vis-à-vis des femelles par rapport aux individus peu mélaniques et qu’ils aient plus de descendants mais que leurs descendants ne survivent pas, auquel cas, lors des analyses, nous ne détectons pas de différences de succès reproducteur entre les différents morphes colorés. Des analyses séparées seraient utiles pour tester cette hypothèse.
Coloration mélanique et perte de poids
Effectivement, d’après nos analyses, les mâles les plus foncés perdent plus de poids lors de la reproduction ce qui signifie qu‘ils doivent sans doute parader plus ou copuler plus que les individus clairs (cette hypothèse irait dans le sens d’une attractivité supérieure des individus foncés). Cela peut aussi s’expliquer par le fait que les mâles foncés dépensent plus d’énergie dans la reproduction par exemple en étant plus actifs autour du nid pour repousser les autres mâles et les empêcher de féconder ou cannibaliser les œufs de leur partenaire. Cette hypothèse serait en accord avec les liens mis en évidence entre activité et mélanine chez les vertébrés (Ducrest et al. 2008) ou les liens entre taux de reproduction et mélanine chez les pigeons (Jacquin et al. 2012). Nous avons aussi mis en évidence que les grands individus perdaient plus de poids que les petits individus lors de la reproduction et que les femelles perdaient plus de poids que les mâles ce qui est cohérent avec la littérature (Warner 1962 ; Baum & Meister 1971) et suggère que la perte de poids telle qu’elle a été mesurée dans notre étude est un moyen fiable de quantifier l’investissement reproducteur des individus. Des études de choix de partenaire sont maintenant nécessaires pour préciser le signal véhiculé par la coloration mélanique.
Coloration mélanique et perte en métabolites
Il n’y avait pas différence de perte en métabolites au cours de la reproduction en fonction de la couleur des truites. Cela suggère que la différence d’investissement reproducteur entre les différents morphes colorés ne se reflète pas au niveau physiologique, ou du moins pas avec ces métabolites (glucose, triglycérides, acides gras libres). Durant la reproduction la demande énergétique est supposée être élevée car le nourrissage est réduit. Ici, la concentration en métabolites a peu diminuée lors de la reproduction, ce qui suggère le fait que la reproduction était peu couteuse d’un point de vue métabolique, ce qui a pu masquer les différences entre morphes colorés qui existeraient en milieu naturel.
Perspectives
Il serait intéressant d’observer si les liens entre coloration et traits d’histoire de vie sont constants ou varient en fonction de l’environnement. En effet, il est possible que certains traits soient co-sélectionnés dans certains environnements mais pas dans d’autres (par exemple s’il est avantageux d’être à la fois foncés et très actifs dans un environnement mais pas dans un autre). Cette année nous avons mené une étude de terrain avec plusieurs sites complémentaires. Plusieurs sites soumis à des perturbations variables ont été échantillonnés (en amont et en aval de piscicultures). Comme les stratégies r (type rapide) et une forte coloration mélanique ont tendance à être favorisées lorsque l’environnement se révèle être variable (ou instable), nous nous attendons dans les futures analyses à voir des liens entre traits, et ce préférentiellement en environnement perturbés c'est-à-dire en aval des piscicultures. Cela permettra dans le futur de préciser le rôle de la variabilité environnementale dans le maintien des liens entre traits et éventuellement de dégager des facteurs clés qui jouent un rôle dans le maintien du polymorphisme de couleur.
Bibliographie
Barreto, R. E. & Volpato, G. L. 2004. Caution for using ventilatory frequency as an
indicator of stress in fish. Behavioural Processes, 1, 43-51.
Baum, E. T. & Meister, A. L. 1971. Fecundity of Atlantic salmon (Salmo salar) from two
marine rivers. Journal of the Fisheries Research Board of Canada, 28, 764–767.
Bell, A. M., Henderson, L. & Huntingford, F. A. 2010. Behavioral and respiratory
responses to stressors in multiple populations of three-spined sticklebacks that diver in predation pressure. Journal of Comparative Physiology B, 180, 211-220.
Brockmann, H.J. 2001. The evolution of alternative strategies and tactics. Advances in the
study of behaviour, 30, 1-51.
Calsbeek, R. & Sinervo, B. 2008. Alternative reproductive tactics in reptiles. In Alternative
Reproductive Tactics, pp 332 – 342 Eds Oliveira R., Taborsky, M., Brockmann, H.J, Cambridge University Press.
Ducrest, A. L., Keller, L. & Roulin, A. 2008. Pleiotropy in the melanocortin system,
coloration and behavioural syndromes. Trends in Ecology & Evolution, 23, 502-510.
Hoekstra, H. E. 2006. Genetics, development and evolution of adaptive pigmentation in
vertebrates. Heredity, 97, 222-234.
Hubbard, J. K., Uy, J. A. C., Hauber, M. E., Hoekstra, H. E. & Safran, R. J. 2010.
Vertebrate pigmentation: from underlying genes to adaptive function. Trends in Genetics, 26, 231-239.
Jacquin, L., Récapet, C., Bouche, P., Leboucher, G. & Gasparini, J. 2012. Melanin-based
coloration reflects alternative strategies to cope with food limitation in pigeons. Behavioral Ecology, 23, 907-915.
Jawor, J. M., Gray, N., Beall, S. M. & Breitwisch, R. 2004. Multiple ornaments correlate
with aspects of condition and behaviour in female northern cardinals, Cardinalis cardinalis. Animal Behaviour, 67, 875-882.
Kamalam, B. S., Medale, F., Kaushik, S., Polakof, S., Skiba-Cassy, S. & Panserat, S.
2012. Regulation of metabolism by dietary carbohydrates in two lines of rainbow trout divergently selected for muscle fat content. The Journal of experimental biology, 215, 2567– 2578.
Kittilsen, S., Schjolden, J., Beitnes-Johansen, I., Shaw, J. C., Pottinger, T. G., Sørensen, C., Braastad, B. O., Bakken, M. & Øverli, Ø. 2009. Melanin-based skin spots reflect stress
responsiveness in salmonid fish. Hormones and Behavior, 56, 292-298.
Kittilsen, S., Beitnes-Johansen, I., Braastad, B. O., Øverli, Ø. 2012. Pigments, Parasites
Krüger, O. 2008. Alternative reproductive tactics in birds. In Alternative Reproductive
Tactics, 343-355.
MacArthur, R. H. & Wilson, E. O. 1967. The Theory of Island Biogeography. Princeton
University Press.
Majerus, M. E. 1998. Melanism: evolution in action. Oxford University Press.
Marie-Orleach, L., Roussel, J. M., Bugeon, J., Tremblay, J., Ombredane, D. & Evanno, G. 2014. Melanin-based coloration of sneaker male Atlantic salmon is linked to viability and
emergence timing of their offspring. Biological Journal of the Linnean Society, 111, 126-135.
McKinnon, J. S. & Pierotti, M. E. R. 2010. Colour polymorphism and correlated characters:
genetic mechanisms and evolution. Molecular Ecology, 19, 5101-5125.
Øverli, Ø., Pottinger, T. G., Carrick, T. R., Øverli, E. & Winberg, S. 2002. Differences in
behaviour between rainbow trout selected for high- and low-stress responsiveness. The Journal of Experimental Biology, 205, 391–395.
Panserat, S., Perrin, A. & Kaushik, S. 2002. High dietary lipids induce liver
glucose-6-phosphatase expression in rainbow trout (Oncorhynchus mykiss). The Journal of nutrition,
132, 137–141.
Pianka, E.R. 1970. On r- and K-selection. American Naturalist, 104, 592-597.
Réale, D., Garant, D., Humphries, M. M., Bergeron, P., Careau, V. & Montiglio, P. O.
2010. Personality and the emergence of the pace-of-life syndrome concept at the population level. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, 365, 4051-4063.
Roulin, A. 2004. The evolution, maintenance and adaptive function of genetic colour
polymorphism in birds. Biological Reviews of the Cambridge Philosophical Society, 79, 815-848.
Saks, L., Ots, I. & Hõrak, P. 2003. Carotenoid-based plumage coloration of male
greenfinches reflects health and immunocompetence. Oecologia, 134, 301-307.
Stearns, R. C. 1992. The evolution of life histories. Oxford university Press.
Strasser, R. & Schwabl, H. 2004. Yolk testosterone organizes behavior and male plumage
coloration in house sparrows (Passer domesticus). Behavioral Ecology and Sociobiology, 56, 491-497.
Volckaert, F. A. M., Hellemans, B., Batargias, C., Louro, B., Massault, C., Van Houdt, J. K. J., Haley, C., de Koning, D-J. & Canario, A. V. M. 2012. Heritability of cortisol
response to confinement stress in European sea bass dicentrarchus labrax. Genetics Selection Evolution, 44.
Warner, K. 1962. The landlocked salmon spawning at Cross Lake Thoroughfare, Maine.
Copeia, 1962, 131-136.
Wedekind, C., Jacob, A., Evanno, G., Nusslé, S. & Müller, R. 2008. Viability of brown
trout embryos positively linked to melanin-based but negatively to carotenoid-based colours of their fathers. Proceedings of the Royal Society B: Biological Sciences, 275, 1737-1744.
RÉSUMÉ
La coloration mélanique (coloration brune et noir de l’épiderme) a été décrite comme génétiquement déterminée et s’avère être très variable selon les individus. En effet chez la truite fario, les individus peuvent présenter une robe avec une quasi absence de points jusqu’à une robe tigrée avec une très forte densité de points noirs. La mélanine pourrait potentiellement être liée à différents types de stratégies d’histoire de vie (ensemble de traits d’histoire de vie associées à des coûts et à des bénéfices variables) génétiquement fixés. Ce faisant, notre étude a portée sur l’étude du lien entre la coloration mélanique et différentes stratégies comportementales et plus précisément sur les relations entre la surface de points noirs (composante de la coloration mélanique) et trois traits d’histoire de vie centraux : la gestion du stress (mesurée par les modifications du rythme respiratoire après induction d’un stress), le succès reproducteur (mesuré par le nombre de descendants viables) et l’investissement reproducteur (mesuré par la perte d’énergie au cours de la reproduction : perte de poids et de métabolites plasmatiques). Nous avons pu caractériser la variabilité de coloration mélanique chez la truite fario Salmo trutta et mettre en évidence que la coloration mélanique possédait un lien avec certains traits d’histoire de vie mettant en avant le fait que les variations de la coloration mélanique peuvent potentiellement refléter des stratégies d’histoire de vie (combinaisons de traits physiologiques et comportementaux).