HAL Id: tel-01815970
https://tel.archives-ouvertes.fr/tel-01815970
Submitted on 14 Jun 2018
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
évolutive et influence de l’environnement passé
Théo Gaboriau
To cite this version:
Théo Gaboriau. Diversité globale des poissons coralliens : histoire évolutive et influence de l’environnement passé. Biodiversité et Ecologie. Université Montpellier, 2018. Français. �NNT : 2018MONTG003�. �tel-01815970�
THÈSE POUR OBTENIR LE GRADE DE DOCTEUR
DE L’UNIVERSITÉ DE MONTPELLIER
En Sciences de l’Evolution et de la Biodiversité
École doctorale GAIA
Unité de recherche UMR MARBEC
Présentée par Théo Gaboriau
Le 09 Mars 2018
Sous la direction de
David Mouillot et Fabien Leprieur
Devant le jury composé de
[Alexandre ANTONELLI, Professeur, Université de Gothenburg] [Bernard HUGUENY, Directeur de recherche, IRD]
[Ana RODRIGUES, Directrice de recherche, CNRS] [Michel KULBICKI, Directeur de recherche émérite, IRD] [David MOUILLOT, Professeur, Université de Montpellier]
[Fabien LEPRIEUR, Maître de conférence, Université de Montpellier] [Fabien CONDAMINE, Chargé de recherche, CNRS]
[Loïc PELLISSIER, Professeur, ETH Zurich]
[Rapporteur] [Rapporteur]
[Examinatrice, Présidente du jury] [Examinateur] [Directeur de thèse] [Co-encadrant] [Invité] [Invité] !
Bio d iv e rsité de s Po isso n s Co r a llie n s : Histo ir e
Ev o lu tive e t In flue n ce d e l’En v ir o nn e me nt Pa ssé .
Rapport de gestion
i
R
ESUME
L’étude de la diversité des espèces de poissons habitant les récifs coralliens fascine les chercheurs du monde entier depuis plus de 200 ans. Comment ces organismes qui n’occupent que 1% de la surface des océans du globe peuvent-ils former un des groupes les plus riches des vertébrés existants ? La complexité de cette question ne réside pas seulement dans l’exceptionnelle diversité de formes, de couleurs et de comportements de ces espèces mais aussi dans l’inégale répartition de cette richesse. Des explorations du lagon de Mayotte, des côtes cubaines ou de la grande barrière de corail, donneront des perspectives très différentes de la diversité des poissons coralliens. Ces différences sont le résultat de processus ayant agi pendant des millions d’années durant lesquelles les poissons coralliens, ainsi que les espèces de coraux qui les abritent, ont été confrontés à des changements drastiques des conditions climatiques et à la dérive des continents. C’est l’influence de ces facteurs sur la répartition et la diversité des poissons coralliens, que j’ai étudié pendant ma thèse. Comprendre comment les espèces et les écosystèmes ont réagi aux changements environnementaux passés peut nous apporter des clés essentielles pour anticiper les changements à venir des écosystèmes que nous connaissons, sous l’influence des changements globaux. Les récifs coralliens étant sous une menace de plus en plus présente, je me suis particulièrement intéressé à l’influence de la disponibilité de l’habitat corallien sur les processus d’extinction, de dispersion et de spéciation (formation de nouvelles espèces par divergence génétique) des poissons coralliens. Afin de répondre à ces objectifs, plusieurs méthodes ont été employées. Dans un premier temps, deux approches différentes ont permis de montrer que les taux de diversification de plusieurs familles de poissons récifaux étaient dépendants de la fragmentation des habitats coralliens, et d’observer la concordance entre des évènements climatiques et tectoniques majeurs et l’évolution de la biodiversité des poissons coralliens. La première est une approche descriptive basée sur la répartition de la co-occurrence entre espèces sœurs et la seconde est une comparaison entre une reconstruction globale de la dynamique des habitats coralliens du Crétacé (≈ -140 millions d’années) à aujourd’hui et les taux de diversification de plusieurs grands groupes de poissons récifaux.
Ces deux approches ont permis de soulever une question centrale : comment cette dynamique de l’habitat influence-t-elle dans l’espace et le temps la diversité des poissons récifaux ? Pour répondre à cette question, une approche unique permettant de modéliser la dispersion, la spéciation et l’extinction des espèces dans un habitat changeant a été développée et appliquée à plusieurs clades d’organismes marins côtiers (coraux, palétuviers et poissons). Cette approche a permis de démontrer comment la dérive des continents a contraint la dynamique de l’habitat corallien et a façonné les gradients de diversité. Enfin, l’extension de cette approche aux récifs tempérés, a permis de montrer l’interaction entre l’influence de la dérive des continents et l’influence des processus écologiques sur la colonisation et le maintien d’espèces de poissons récifaux dans les milieux tempérés.
Ces travaux ouvrent la voie vers l’utilisation d’une nouvelle génération de modèles spatialisés de diversification et la prise en compte de la dynamique des habitats passés dans l’étude des processus de diversification.
Mots-clés : Poissons coralliens, récifs coralliens, diversification, paléo-environnement, modélisation spatiale,
phylogénie, gradients de biodiversité, fragmentation de l’habitat, spéciation, extinction dispersion.
A
BSTRACT
The exceptional diversity of fishes that inhabit coral reefs fascinates researched from all over the world since over 200years. How can those organisms, that only occupy 1% of the surface of the oceans, form one of the richest group of extant vertebrates? The complexity of this question does not only lie in the extraordinary diversity of morphologies, colors and behaviors, but also roots in the heterogeneous repartition of that richness. Explorations of Mayotte’s lagoon, Cuban coasts or the great barrier reef will show different perspectives of coral-reef fish’ diversity. Those pervasive differences are the result of processes that shaped, during millions of years the repartition of coral-reef species, their morphology and their behavior. During those millions of years of evolution, coral-reef fishes along with species that shelter them, faced massive climatic and tectonic changes. During my PhD, I studied the influence of those factors on the repartition and the diversity of coral-reef fishes. Understanding how species and ecosystems responded to important environmental changes can provide essential insights to anticipate future changes of ecosystem composition and functioning under global changes’ pressure. As coral-reefs are under more and more threatening pressures, I particularly focused on the influence of coral habitat availability on extinction, dispersion and speciation processes of coral-reef fishes.
To achieve this goal, several methods have been employed. First, a descriptive approach based on sister-species co-occurrence patterns and the comparison between a global reconstruction of coral-reef habitat dynamics from the Cretaceous (≈ -140 million years) to present and the evolution of several speciose groups of coral-reef fishes permitted to identify a link between diversification rates of several groups of coral-reef fishes and coral habitat fragmentation and to observe the concordance between major earth-history events and biodiversity dynamics of coral-reef fishes.
After the identification of a link between habitat fragmentation and coral-reef fishes’ diversification, an important question remains: What are the mechanisms underlying the influence of habitat dynamics on temporal and spatial variations of reef-fish biodiversity? To answer this question a unique approach allowing modeling of species dispersal, extinction and speciation in a gridded space varying in function of habitat dynamics, has been developed and applied to several groups of coastal marine organisms (corals, mangroves, fishes). This approach provided mechanistic insights about how plate movements drove coral reef habitat dynamics and shaped biodiversity gradients of several groups of coastal marine organisms. Finally, the extension of this approach to temperate reefs (rocky reefs), provided mechanistic insights about the interplay between the influence of tectonic events and ecological processes in the formation of present-day latitudinal gradient of biodiversity of reef-fishes. This thesis paves the way towards the use of a new generation of spatialized mechanistic models of macroevolution and the consideration of the influence of past-habitat dynamics in the study of diversification processes.
Keywords: Coral-reef fishes, coral-reef, diversification, paleo-environment, spatial modelling, phylogeny,
iii
R
EMERCIEMENTS
Je remercie en premier lieu les membres du jury de ma thèse qui ont accepté d’évaluer mes travaux et de participer à ce moment important qu’est la soutenance. Je suis honoré de votre participation.
Merci à mes encadrants de thèse qui ont été très complémentaires dans leur manière de m’encadrer. David, on ne s’est pas vu souvent mais nos entretiens ont toujours constitué des avancées dans ma réflexion, ma manière de présenter mon travail et mes approches. Ta manière de présenter tes idées et de convaincre les gens m’impressionne, j’espère atteindre ce niveau un jour. Fabien, je sais que les années de ma thèse ne constitueront surement pas les meilleures années de ta vie. Tu as malgré tout su être présent dans les moments où j’avais besoin de toi, et je te tire mon chapeau pour ça. Merci pour ton investissement et pour le partage de tes idées, merci pour ta bonne humeur et merci de m’avoir donné ton entière confiance.
Sans l’équipe de Zurich, ma thèse aurait été bien différente, je les remercie de m’avoir confié une partie de leurs projets, de m’avoir hébergé et montré les alentours de Zurich pendant mes séjours et de m’avoir impliqué dans le terrain de Mayotte. Ça a été une bouffée d’oxygène, j’espère que ma participation a été à la hauteur de vos espérances. Merci donc à Loïc de m’avoir fait venir plusieurs fois à Zurich pour collaborer, d’avoir participé à mes comités de thèse et d’avoir partagé tant de projets et d’idées avec moi. Merci à Camille. Tu m’as beaucoup aidé pendant ma thèse, que ce soit avec des conseils ou avec un support technique, tu m’as accueilli plusieurs fois chez toi malgré mon ventre (merci aussi à Séverine), et tu t’es investi sans rien demander en retour. T’es quelqu’un de bien derrière ce rôle de râleur. Merci aux petits Suisses, Giulia, Oskar, Patrice, Loïc C., Camille P., vous m’avez fait apprécier mes séjours à Zurich et le terrain à Mayotte, j’espère qu’on se reverra.
Merci à Nicolas Hubert de m’avoir lancé là-dedans, de m’avoir appris à comprendre et à maîtriser les rouages obscurs de la phylogénie moléculaire et d’avoir été toujours été très positif malgré les déboires autour de la publication de notre article.
Merci à toutes les personnes qui ont consacré leur temps et leur énergie à la récolte des nombreuses données que j’ai pu utiliser pendant cette thèse. Une bonne étude ne peut exister sans de bons jeux de données.
Merci à tous les « Montpelliérains » avec qui j’ai passé des supers années de thèse. Merci à tous les gens du labo et en particulier mes co-bureaux Marlène, Anne-so et Eva, c’était un honneur de partager mon bureau avec vous, c’est gentil de m’avoir laissé la meilleure place. Merci à Claire, Fabien, Laure, Amandine, François, Nicolas2, Seb, Frank, Clara, Corinne, Béatrice, pour les super conversations casse-croûte qui rendaient la vie au labo agréable. Merci de m’avoir régulièrement empêché d’aller manger dehors parce qu’il fait soi-disant trop froid. Merci à tous mes copaings de Montpèl, Blaise, Nono, Thodoris, et surtout aux résidents du 1706 avenue de Maurin, Alain, Yo, Valou, Iago-lito, Miche-miche, Marjo et Marine, on a ri.
Merci à mes amis de longue date avec qui j’ai appris la vie et qui ont donc une part de responsabilité dans tout ça. Merci à Baptiste et à Jésus vous êtes des modèles les gars (sur certains points). Merci Benoît, Max, Juliette, Suzelle, Steph, Jerem, Aude, Margot, Alexia, vous m’avez aidé à tenir pendant ces années difficiles et sans vous je ne serais pas là.
Un très grand merci à toute ma super famille, les tontons, les tatas, les cousins, c’est toujours un plaisir d’avoir une famille toujours motivée et de bonne humeur. Merci Mamie, pour ce que tu es et pour irradier l’amour autour de toi, j’aurais aimé que Papy soit là pour partager ça avec nous. Merci Titou et Lomette, d’avoir grandi avec moi. Un très grand merci à Papa et Maman de m’avoir toujours encouragé sans jamais me forcer et d’avoir si bien fait les choses que je n’échangerai ma place avec personne au monde.
Enfin, un grand merci à Félise, tu es là depuis le début de cette aventure donc c’est aussi un peu ta thèse. Merci de m’avoir supporté et de m’avoir soutenu pendant cette épreuve. Merci d’avoir tout fait pour tenter de me changer les idées et merci pour ton humanité.
A
VANT
-
PROPOS
Il me paraît important de prendre un petit peu de place avant mon manuscrit pour parler de ce que je ressens par rapport à mes travaux et par rapport à l’écologie en général. J’ai le sentiment que chaque scientifique passe par cette réflexion au fil de ses recherches et de ses découvertes, mais je trouve que nous n’en parlons pas assez. C’est pourquoi j’ai voulu en parler ici. Avant ma découverte des lois régissant le vivant et sa répartition, j’étais émerveillé devant le côté majestueux d’un chêne centenaire, devant l’étrangeté des fleurs de châtaigniers, devant les bourdonnements et les gazouillis incessants qui émanaient d’un tilleul au printemps. Aujourd’hui, si je suis encore émerveillé devant la forme, les odeurs et les sons, je suis bien plus émerveillé par la dramaturgie qui se cache derrière toutes ces choses. J’y vois la lutte acharnée pour la lumière et contre le froid qui ont conduit à la croissance de ce chêne. J’y vois la nécessité de se reproduire avec des individus différents, pour donner à sa descendance le patrimoine génétique suffisant pour survivre, qui a conduit à la formation de fleurs si étranges. Enfin, j’y vois les millions d’années d’évolution qui ont conduit des formes de vie totalement différentes à s’associer, à se trahir, à dépendre les unes des autres, jusqu’à se trouver ensemble le temps d’une saison. Au fil de ma thèse, je me suis aperçu que si je m’inflige des maux de têtes à trier des bases de données, à appréhender et formuler des modèles mathématiques, à lire des articles interminables, à comprendre des concepts qui me dépassent, c’est parce que connaître et imaginer l’histoire cachée derrière toutes ces choses, découvrir les nouveaux mystères que ces histoires soulèvent, me procurent un plaisir incomparable. Je me suis aussi aperçu que si je passe beaucoup de temps à préparer des cours, à discuter avec les étudiants en difficulté ou intéressés, à écrire des articles, ou à « sortir ma science » en société, c’est que je prends aussi beaucoup de plaisir à imaginer les gens être sensibles à ce que représente la présence d’un tilleul dans la cour d’une ferme en Limousin, d’une vache dans la jungle Cambodgienne ou d’une murène dans le lagon de Mayotte. J’espère donc humblement que le parcours des lignes qui suivent, suscitera chez le lecteur l’excitation relative à la découverte d’un nouveau mystère ou de nouvelles connaissances.
v
T
ABLE DES MATIERES
!"#$%"&'''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''(! )*#+,-.+&'''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''((! !/%/,.(/%/0+#&'''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''&(((! )1-0+23,434#&''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''&(1! 5-*6/&7/#&%-+(8,/#&'''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''&1! 9(#+/&7/#&:(;$,/#&'''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''&1((! <=-3(+,/&>&?&>0+,47$.+(40&;"0",-6/&''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''@! >'@&9A(0B6$/0./&7/&6A/01(,400/%/0+&3-##"&#$,&6-&,"3-,+(+(40&;"4;,-3=(C$/&7/&6-&*(47(1/,#(+"&'''''''&@! "#$#$!%&&'(!)*!+,-./(####################################################################################################################!0! "#$#0!%&&'(!)'1!-2('3/+(-421!5-4(-6*'1!##########################################################################################!7! "#$#7!%&&'(!)'!,/!)-1842-5-,-(9!)'!,:;/5-(/(!####################################################################################!7! >'D&9/&.-#&7/#&34(##40#&,".(B-$E&'''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''&F! "#0#$!<:-2&,*'2+'!)'1!.4*='.'2(1!('+(42-6*'1!##########################################################################!>! "#0#0!<:-2&,*'2+'!)*!+,-./(!##########################################################################################################!?! "#0#7!<:-2&,*'2+'!)'!,:9+4,4@-'!###################################################################################################!$A! >'G&H,4*6"%-+(C$/&'''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''&@I! <=-3(+,/&>>&?&J"+=47464;(/&'''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''@G! >>'@&)33,4.=/#&/E(#+-0+/#&?&34+/0+(/6&/+&6(%(+-+(40#&'''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''&@G! ""#$#$!B;943-'!1-.8,-1('!)'!,/!./+349=4,*(-42!###########################################################################!$7! ""#$#0!<'1!/8834+;'1!'.8-3-6*'1!'(!+4339,/(-='1!########################################################################!$C! ""#$#7!<'1!/8834+;'1!.9+/2-1(-6*'1!##########################################################################################!$C! >>'D&K,;-0(#-+(40&7$&%"%4(,/&'''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''&@L! <=-3(+,/&>>>&?&>0B6$/0./&7/&6-&;"4;,-3=(/&7/&6-".(-+(40&#$,&6-&,"3-,+(+(40&-.+$/66/&7/&6-& 7(1/,#(+"&7/#&34(##40#&,".(B-$E&+,43(.-$E&''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''D@! >>>'@&>0+,47$.+(40&'''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''&D@! >>>'D&<40#/,1-+(40&7/&6A=",(+-;/&7/&6-&;"4;,-3=(/&7/&6-".(-+(40&''''''''''''''''''''''''''''''''''''''''''''''&DG! >>>'G&>0B6$/0./&7/#&"180/%/0+#&7/".(-+(40&#$,&6/#&3-+,40#&7/&,(.=/##/&/+&7/&.44..$,,/0./& /0+,/&/#38./#&#M$,#&7/&34(##40#2,".(B-$E&''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''&DN! >>>'N&H/,#3/.+(1/#&'''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''&DF! <=-3(+,/&>O&?&(0B6$/0./&7/&6A/01(,400/%/0+&3-##"&#$,&6/#&+-$E&7/&7(1/,#(B(.-+(40&7/#& 34(##40#&,".(B-$E&'''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''DP! >O'@&>0+,47$.+(40&'''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''&DP! >O'D&9/#&/BB/+#&7/&6A/01(,400/%/0+&3-##"(+&.40+,-#+"#&'''''''''''''''''''''''''''''''''''''''''''''''''''''''''''&GI! >O'G&H/,#3/.+(1/#&'''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''&G@! <=-3(+,/&O&?&!/6(/,&6-&7Q0-%(C$/-+(-6/&7/#&=-*(+-+#&R&6-&7(1/,#(B(.-+(40&7/#&/#38./#&?&$0/& -33,4.=/&%".-0(#+(C$/&'''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''GG! O'D&:(7"6(+"&7/#&3,"7(.+(40#&7$&%4786/&SH9>5&-$E&7400"/#&/%3(,(C$/#&''''''''''''''''''''''''''''''''''''''&GF!
O'G&>0B6$/0./&7/&6-&7Q0-%(C$/&7/&6A=-*(+-+&#$,&6/#&;,-7(/0+#&7/&7(1/,#(+"&'''''''''''''''''''''''''''''''''''&GL! O'N&H/,#3/.+(1/#&''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''>! <=-3(+,/&O>&?&9/#&3,4./##$#&7/&%-.,4"146$+(40&R&6A4,(;(0/&7$&;,-7(/0+&6-+(+$7(0-6&7/& 7(1/,#(+"&7/#&34(##40#&,".(B-$E&''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''GP! O>'@&>0+,47$.+(40&'''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''&GP! O>'D&H,"7(.+(40#&;"0","/#&3-,&6/#&%".-0(#%/#&-6+/,0-+(B#&'''''''''''''''''''''''''''''''''''''''''''''''''''''''''''&N@! D"#0#$!%&&'(1!)'!,:/-3'!@94@3/8;-6*'!#########################################################################################!C$! D"#0#0!%&&'(1!)*!+421'3=/(-1.'!)'!2-+;'!(348-+/,'!####################################################################!C0! D"#0#7!%&&'(1!)'1!,-.-('1!9+4,4@-6*'1!########################################################################################!C7! D"#0#C!%&&'(1!)'!,/!=-('11'!):9=4,*(-42!#######################################################################################!CC! O>'G&9A(%34,+-0./&7/&6&U".=/66/&7/&+/%3#'''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''&NN! D"#7#$!"2&,*'2+'!)'1!+;/2@'.'2(1!):;/5-(/(1!E!,:9+;',,'!)'1!('.81!@94,4@-6*'1!######################!CC! "#7#0!"2&,*'2+'!)'1!834+'11*1!9+4,4@-6*'1!E!,:9+;',,'!)*!F*/('32/-3'!#######################################!CG! O>'N&H/,#3/.+(1/#&'''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''&NF! D"#C#$!H4229'1!8/,94I'2=-3422'.'2(/,'1################################################################################!C>! D"#C#0!J9293'3!)'1!8/(3421!.*,(-8,'1!#######################################################################################!C>! <=-3(+,/&O>>&?&<40.6$#(40#&/+&3/,#3/.+(1/#&'''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''NP! O>>'@&<40.6$#(40#&;"0",-6/#&'''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''&NP! D""#$#$!KL,'!)'!,/!)M2/.-6*'!)'!,:;/5-(/(!#################################################################################!CN! D""#$#0!O9(934@929-(9!18/(-/,'!'(!('.843',,'!)'1!834+'11*1!#####################################################!GA! D""#$#7!P4.8,9.'2(/3-(9!)'1!/8834+;'1!##################################################################################!GA! O>>'D&H/,#3/.+(1/#&''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''&FI! D""#0#$!"2&,*'2+'!3',/(-='!)'1!-2('3/+(-421!5-4(-6*'1!'(!)'!,/!)M2/.-6*'!)'1!;/5-(/(1!1*3!,/!+4I 4++*33'2+'!)'1!'18Q+'1!1R*31!#################################################################################################!GA! D""#0#0!S88,-+/(-421!/*T!.-,-'*T!('33'1(3'1!###############################################################################!G0! D""#0#7!<:-.843(/2+'!)'1!)4229'1!############################################################################################!G0! !"B",/0./#&V(*6(4;,-3=(C$/#&'''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''FG! ),+(.6/#&#.(/0+(B(C$/#&''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''''LP!
vii
L
ISTE DES
F
IGURES
Figure 1: Evolution de l’environnement et de la biodiversité des vertébrés sur les 130 derniers millions d’années.. ...1! Figure 2: Influence des mouvements des plaques tectoniques sur l’évolution du plateau continental (AA1).. ...4!
Figure 3: Richesse spécifique des poissons récifaux par cellule de 1° de côté (A4). ...5!
Figure 4: Mouvement du pic de diversité des organismes marins côtiers au cours du cénozoïque. ...7! Figure 5: Carte de l’Archipel Indo-Australien (IAA) représentant les plateaux continentaux de Sunda et Sahul.. ...8! Figure 6: Vue d'ensemble des caractéristiques du groupe des Acanthomorphes.. ...9! Figure 7. Schéma conceptuel de la dynamique de la biodiversité (inspiré de Goldberg et al., 2005).. ... 13! Figure 8: Durée estimée du maintien de l'héritage de différents processus dans les patrons de biodiversité selon Svenning et collaborateurs (2015).. ... 21! Figure 9 : Patrons de cooccurrence entre paires d’espèces sœurs de poissons récifaux à l’échelle de l’Indo-Pacifique.. ... 23! Figure 10 : Illustration des principaux patrons de cooccurrence entre espèces sœurs identifiés..
... 25! Figure 11 : Application de l'extension de GeoSSE à la diversification des Chaetodontidae dans l'Indo-Pacifique. ... 27! Figure 12 : Variation du nombre de patch d’habitat corallien, et de la surface totale d’habitat corallien pendant le Cénozoïque. ... 29! Figure 13 : Description des mécanismes du modèle SPLIT.. ... 34! Figure 14 : Richesse standardisée des Acroporidae au cours du temps.. ... 35! Figure 15 : Influence de la fragmentation de l'habitat sur la dynamique de la diversification simulée sous le modèle SLIT.. ... 36! Figure 16 : Dynamique de la diversité de l’Archipel Indo-Australien au cours du temps.. ... 37! Figure 17 : Comparaison des gradients de richesse observés et simulés... 42! Figure 18: Evolution du gradient latitudinal de diversité prédit par les différents mécanismes alternatifs. ... 43! Figure 19: Influence de la dynamique des habitats sur la bio-régionalisation des faunes de poissons récifaux.. ... 45! Figure 20: Gradients de température des océans présents à l’échelle globale (NOAA) ... 46!
1
C
HAPITRE
I :
I
NTRODUCTION GENERALE
I.1 L’influence de l’environnement passé sur la répartition géographique de la
biodiversité
L’inégale répartition de la biodiversité à la surface de la Terre résulte de processus ayant agi pendant plusieurs centaines de millions d’années. Ces processus sont à l’origine de variations importantes de la diversité entre les régions, mais aussi au cours du temps et au sein des groupes d’organismes (Fig. 1). Ils constituent donc des points clés de l’étude de la biodiversité et font l’objet de nombreuses études depuis plus de 150 ans. Pendant ces millions d’années d’évolution, la terre a connu de nombreuses variations environnementales à plusieurs échelles spatiales et temporelles (Svenning et al. 2015). Par conséquent, les groupes d’organismes et les régions que nous étudions ont été confrontés à des variations climatiques importantes (Fig. 1), à des catastrophes naturelles et à la dérive des continents (Fig. 2).
Figure 1: Evolution de l’environnement et de la biodiversité des vertébrés sur les 130 derniers millions d’années. En haut : Evolution de la température (Zachos et al. 2008) et du niveau de la mer (Miller 2005). En bas : Evolution du nombre de genre par grande classe de vertébrés estimé à partir des occurrences fossiles présentes dans la base paleodb (Alroy et al., n.d.).
Il est donc très probable que ces changements de l’environnement au cours des temps géologiques aient eu un effet important sur les processus de spéciation, d’extinction et de dispersion des organismes vivants (e.g. Condamine et al. 2013; Svenning et al. 2015). Par exemple, plusieurs études récentes montrent que les taux de spéciation et d’extinction au sein des clades(groupe d’organisme composé d’un ancêtre et de ses descendants) sont reliés à des changements majeurs de l’environnement aux échelles régionales et globales, telles que les phases de réchauffement climatique (Clapham et al. 2009; Condamine et al. 2013), la formation des chaines montagneuses (Antonelli & Sanmartín 2011; Lagomarsino et al. 2016) ou les variations du niveau de la mer (Steeman et al. 2009; Condamine et al. 2015). Il a aussi été observé que la plupart des extinctions de masse étaient associées à des changements climatiques importants (Erwin 2009). Plusieurs explications peuvent être proposées pour le comprendre ces liens de causalité (Brown 2014; Fine 2015).
I.1.1 Effet du climat
Les variations de température et de rayonnement solaire pourraient avoir une influence directe sur les processus de spéciation, d’extinction et de dispersion. En effet, les taux d’évolution étant reliés aux taux métaboliques, et les taux métaboliques étant eux-mêmes reliés à la température, on peut s’attendre à ce que des fortes températures accélèrent les processus de spéciation (Gillooly et al. 2005; Allen et al. 2006). De plus, on s’attend à ce que les régions qui reçoivent le plus d’énergie puissent supporter des populations plus importantes (Hutchinson 1959) grâce à l’importante quantité de ressources qu’elles possèdent. Ces importantes tailles de population réduiraient la probabilité d’extinction des espèces de manière stochastique (Brown 1981; Currie et al. 2004) et augmenterait leur probabilité de spéciation, en offrant une plus grande diversité génétique potentielle (Fischer 1960).
De plus, les variations de température pourraient aussi avoir une influence importante sur la gamme de température supportée par les espèces (Wiens and Donoghue 2004) : Durant leur évolution, les espèces provenant des milieux tempérés ont été confrontés à des variations de températures beaucoup plus importantes que les espèces provenant des milieux tropicaux, notamment en raison des changements saisonniers (Janzen 1967). On s’attend donc à ce que les espèces tropicales soient adaptées à des gammes de températures moins importantes que les espèces tempérées (Wiens & Graham 2005). De la même manière on s’attend à ce que les espèces apparues au cours des périodes de réchauffement climatiques, durant lesquelles la majeure partie de la planète était soumise à des conditions tropicales (e.g. milieu du Crétacé), n’aient subit aucune pression sélective pour s’adapter à des conditions de température variées (Mannion et al. 2014). Lors des périodes de refroidissement, on s’attend à ce que ces espèces aient peu d’aptitude à coloniser les zones tempérées, donc s’éteignent (Hawkins et al. 2007) ou se trouvent isolées par des barrières climatiques pouvant influencer la spéciation (Wiens 2004; Kozak & Wiens 2006)
INTRODUCTION GENERALE 3 I.1.2 Effet des interactions biotiques
L’observation des différences de richesses entre les zones tropicales et les zones tempérées suggère que les milieu tropicaux (plus chauds et recevant plus d’énergie) supportent un nombre d’espèce plus important que les milieux tempérés (Hutchinson 1959; MacArthur 1965; Pigot et al. 2016). Dans ce cas, les interactions entre espèces joueraient un rôle très important dans la réponse des taux de spéciation, d’extinction et de colonisation, à des variations environnementales (Ricklefs & Schluter 1994). Cette hypothèse part du postulat que la biodiversité d’une région connaît un équilibre défini par la quantité totale de ressource disponible (MacArthur 1965), et que cet équilibre est maintenu par les taux de spéciation et d’extinction (Rabosky & Hurlbert 2015). Ici encore, le lien entre quantité d’énergie disponible et taille des populations a son importance (MacArthur & Wilson 1963) : lorsqu’une espèce apparaît dans une région, la quantité limitée de ressource fait que la taille des populations des autres espèces doit baisser, augmentant ainsi leur probabilité d’extinction et diminuant leur probabilité de spéciation (Sepkoski 1978). A l’inverse, lorsque la quantité de ressources d’une région n’est pas complètement exploitée par les espèces qui la composent, on s’attend à ce que les taux de spéciation soient élevés et les taux d’extinction bas, jusqu’à la saturation de l’utilisation des ressources. Ces opportunités écologiques (Simpson 1953) pourraient expliquer les radiations observées après les extinctions de masse (Krug & Jablonski 2012), ou en réponse à l’apparition de nouveaux environnements (Antonelli & Sanmartín 2011; Linder et al. 2014). On peut donc s’attendre à ce que ce mécanisme génère des réponses importantes des taux de spéciation et d’extinction à des changements climatiques (Erwin 2009; Alroy 2010). Alternativement, une influence de l’environnement sur la diversification pourrait être amplifiée par une boucle de rétroaction positive due aux interactions biotiques (Calcagno et al. 2017). Selon cette hypothèse, la diversité des espèces offrirait de nouvelles opportunités écologiques à travers le développement de nouvelles stratégies de vie dépendantes des autres espèces.
I.1.3 Effet de la disponibilité de l’habitat
Les événements géologiques ou climatiques importants, comme les orogénèses ou les périodes glaciaires, génèrent des changements d’habitat. Ces changements, en engendrant la formation de barrières ou en fragmentant l’habitat (Fig. 2), créeraient un isolement entre populations et influencerait ainsi les taux de spéciation (Mayr 1963). Ils pourraient aussi favoriser les extinctions par disparition de l’habitat de certaines espèces (Jablonski & Bottjer 1991; Gaston & Blackburn 1996; Pellissier et al. 2014). De plus, ces évènements pourraient avoir une influence importante sur la surface des habitats disponibles et leur stabilité au cours du temps, qui seraient aussi des déterminants des taux de spéciation et d’extinction (Rosenzweig 1995; Chown & Gaston 2000; Losos & Schluter 2000; Fine & Ree 2006). D’une part, on s’attend à ce que les habitats les plus stables puissent maintenir des populations suffisamment longtemps pour permettre des événements de spéciation par divergence de niche (Stebbins 1974; Stephens & Wiens 2003). On s’attend aussi à ce que les habitats les plus vastes supportent des espèces aux aires de distributions les plus étendues (Rosenzweig 1995; Chown & Gaston 2000). Ces importantes aires de distribution permettraient aux
espèces d’avoir plus de chances d’être proche d’un refuge lors des phases de perte d’habitat ou de rencontrer des barrières à la dispersion (Rosenzweig 1995) favorisant l’isolement de populations et donc la spéciation. On s’attend donc à ce que l’influence des évènements climatiques et géologiques sur le maintien ou la perte d’habitats soit un déterminant important de la spéciation et de l’extinction. Enfin, Il a été identifié depuis très longtemps que ces changements d’habitat contraignent la dispersion des espèces au cours du temps (Wallace 1876). On s’attend donc à ce qu’ils aient une influence très importante sur les mouvements des populations qui vont façonner la distribution spatiale de la biodiversité.
Bien que de nombreuses hypothèses aient été proposées pour comprendre l’influence de l’environnement passé sur la répartition de la biodiversité, les mécanismes à l’œuvre sont encore mal compris.
Figure 2: Influence des mouvements des plaques tectoniques sur l’évolution du plateau continental (AA1). Les lignes pointillées blanches représentent l’estimation de la latitude des tropiques.
INTRODUCTION GENERALE 5
I.2 Le cas des poissons récifaux
Les poissons récifaux constituent un groupe majeur de vertébrés avec plus de 4000 espèces et une très importante diversité de forme, malgré le jeune âge des familles de ce groupe. L’origine du groupe des Acanthomorphes qui comprend 92% des espèces récifales a été estimée à -130 millions d’années (Near et al. 2013) tandis que plusieurs vagues de
Figure 3: Richesse spécifique des poissons récifaux par cellule de 1° de côté. Sur cette carte on ne considère que les poissons récifaux issus du groupe des Acanthomorpha (A4).
colonisation des récifs coralliens par les poissons ont été identifiées aux alentours des –66 millions d’années (Price et al. 2014). La répartition des poisson récifaux dans les océans a suscité l’intérêt de plusieurs générations de chercheurs (Bellwood & Meyer 2009) et recèle encore aujourd’hui beaucoup d’incertitudes (Cowman 2014). En effet, leur richesse est distribuée selon un gradient latitudinal des tropiques vers les pôles, mais aussi selon un gradient longitudinal, centré sur l’Archipel Indo-Australien (Fig. 5, IAA), formant un patron en cercles concentriques (Fig. 3).
Par ailleurs, les récifs concentrent plus de 50% de la biodiversité marine alors qu’elles ne couvrent que 1% de la surface des océans (Roberts et al. 2002). Afin d’expliquer ce patron exceptionnel, la répartition de la richesse des poissons récifaux a été reliée à des variables environnementales telles que la température de la surface de la mer et l’aire disponible d’habitat (Tittensor et al. 2010; Parravicini et al. 2013), à l’image de ce qui est proposé pour les grands clades terrestres (Kreft & Jetz 2007; Davies et al. 2007; Buckley & Jetz 2007). Cependant, la prise en compte des facteurs historiques et paléo-environnementaux semble aussi essentielle pour expliquer la répartition de la biodiversité des poissons récifaux (Tittensor et al. 2010; Parravicini et al. 2013; Pellissier 2014).
I.2.1 L’influence des mouvements tectoniques
En raison de leur caractère sessile, la répartition des coraux formateurs de récifs est fortement contrainte par les mouvements des plateaux continentaux au cours du temps (Renema et al. 2008; Keith et al. 2013). Le registre fossile des coraux et d’autres organismes côtiers sessiles (palétuviers, foraminifères benthiques) montre que la localisation des pics de diversité des organismes marins côtiers ont changé en fonction du temps (Renema et al. 2008), allant de l’ouest de l’océan Téthys pendant l’Eocène, à l’IAA à la fin du Miocène, en passant par la péninsule arabique entre l’Eocène et le Miocène (Fig. 4). Ce mouvement des pics de diversité suivant les évènements tectoniques majeurs, suggère que les collisions entre les plaques constituent un terreau fertile à la biodiversité marine, à travers la formation de nouvelles zones d’eau peu profondes, la formation d’îles apportant de nouvelles opportunités de colonisation et d’isolement, et la rencontre de population précédemment isolées (Renema et al. 2008; Keith et al. 2013). Plusieurs indices laissent à penser que la répartition des poissons récifaux pourrait avoir suivi la même trajectoire.
Premièrement, les distributions actuelles de richesse spécifique des coraux et des poissons récifaux sont corrélés à l’échelle des océans tropicaux (Bellwood et al. 2005), et la surface des récifs coralliens est l’un des meilleurs prédicteurs de la richesse en poissons des récifs tropicaux (Parravicini et al. 2013). Il est donc très probable que la répartition de la diversité des poissons ait suivi une trajectoire similaire à celle des coraux. Ensuite, bien que relativement pauvre (Patterson 1993), le registre fossile des poissons récifaux semble corroborer la présence d’une diversité importante de poissons dans la Téthys, laquelle constituait le plus grand paléo-océan tropicale avec la plus grande diversité en coraux. En effet, les fossiles les plus anciens des ancêtres de la majorité des poissons récifaux (-130 millions d’années) ont été trouvés dans ce qui était la partie ouest de la Téthys au cours de l’Eocène et aujourd’hui la mer Méditerranée qui en est une relique (Bellwood & Wainwright
INTRODUCTION GENERALE 7 2002; Renema et al. 2008). Cette origine téthyenne
des poissons récifaux a récemment été confirmée par des études de reconstruction biogéographique, lesquelles se basent sur la répartition actuelle des espèces et leurs relations phylogénétiques. Ces études suggèrent qu’une grande partie de la diversité de plusieurs grandes familles de poissons coralliens
(Chaetodontidae, Holocentridae, Labridae,
Pomacentridae) provient de la Téthys et datent d’avant le Miocène (-23 millions d’années ; Cowman & Bellwood 2013; Dornburg et al. 2015). Cette faune diversifiée aurait ensuite colonisé l’IAA à partir du Miocène lors de la fermeture de la Téthys via le passage de la Mer Rouge (Cowman & Bellwood 2013; Dornburg et al. 2015). Pour finir, de
nombreuses observations suggèrent que la
diversification des poissons récifaux a été considérablement accélérée par la colonisation des récifs coralliens (Alfaro et al. 2007; Bellwood et al. 2010; Bellwood et al. 2017). Il est donc très probable que les faunes des deux groupes d’organismes aient évolué de concert.
De nombreux indices semblent suggérer que la rencontre des plaques Eurasienne et Australienne (i.e. ayant formé l’IAA) a été, à partir du Miocène, une source de biodiversité (Briggs 2000). La formation de multiples îles engendrée par cette collision (Lohman et al. 2011) a permis la formation de nouveau récifs très divers sur une grande surface (Bellwood et al. 2017) offrant de nombreuses opportunités de spéciation (Mora et al. 2003; Barber & Bellwood 2005; Williams & Duda 2008). Par ailleurs, cette activité tectonique a aussi été à
l’origine de la formation de nombreux archipels périphériques séparés par des mers profondes (Lohman et al. 2011). Cette fragmentation aurait permis la colonisation de ces régions isolées ne permettant pas des échanges de diversité génétique importants avec les autres zones de récifs, et menant à la divergence des populations de poissons récifaux (Hodge et al. 2012). Ces patrons d’endémisme périphérique semblent être récurrents au niveau de l’IAA et ont été identifiés chez de nombreuses familles de poissons récifaux (Hodge et al. 2012; Tornabene et al. 2014; Puckridge et al. 2015)
!"#$%&'( )#$%&'(
Figure 4: Mouvement du pic de diversité des organismes marins côtiers au cours du cénozoïque. Les zones les plus riches sont représentées en rouge et les zones les plus pauvres en gris. Cette figure est tirée de Dornburg et al. (2015)
I.2.2 L’influence du climat
Les récifs coralliens sont très sensibles aux variations des conditions environnementales (Kleypas & Mcmanus 2010) et leur distribution au cours du temps pourrait avoir été fortement influencée par des changements d’environnement passés (Kiessling et al. 2012; Harnik et al. 2012). En conséquence, les espèces de poissons inféodées aux récifs pourraient avoir une réponse double aux variations climatiques, d’une part via les effets directs des conditions environnementales sur leur tolérance et d’autre part via les modifications de leur habitat. La plupart des effets climatiques sur la diversité des poissons récifaux reportés jusqu’à aujourd’hui datent du Pléistocène. En effet la pauvreté du registre fossile (Patterson 1993), et les difficultés à détecter les traces de l’influence du paléoclimat sur les patrons de diversité présents (Svenning et al. 2015), font que seule l’influence des évènements récents a pu être mise en évidence. Cependant, les cycles courts de glaciation du Pléistocène semblent avoir eu une influence très importante sur la répartition de la diversité en poissons récifaux (Ludt & Rocha 2014). Ces cycles de glaciations ont été à l’origine de variations du niveau de la mer très importants ayant entrainé l’émergence de plus de 90% du plateau continental dans certaines régions (Ludt & Rocha 2014) et d’une migration des coraux vers les pôles en raisons de trop fortes température équatoriales (Kiessling et al. 2012). Ces changements environnementaux auraient eu deux conséquences importantes sur la répartition des poissons récifaux.
Premièrement, l’émergence des plateaux
continentaux a causé la destruction d’une grande partie de l’habitat corallien ne laissant que quelques zones refuges dans les parties les plus profondes du plateau continental (Fig. 5). Les aires de distributions des poissons récifaux sont restées fortement contraintes aux refuges durant ces périodes et en portent encore la trace aujourd’hui (Pellissier et al. 2014). Ces zones refuges, principalement localisées autour de Madagascar et au niveau de l’IAA auraient grandement contribué à la survie des grands clades de poissons récifaux durant ces périodes de glaciation (Pellissier et al. 2014).
Deuxièmement, l’émergence des plateaux continentaux a généré des changements dans les courants entre les Océans Indiens et Pacifiques et aurait entraîné une diminution des flux géniques entre les populations des deux océans (Hubert et al. 2011, 2012; Gaither & Rocha 2013). Cette dernière auraient engendré des épisodes de vicariance successifs entre les poissons récifaux de l’Océan Indien et de l’Océan Pacifique qui auraient recolonisé l’IAA lors des périodes favorables (Gaither & Rocha 2013).
Figure 5: Carte de l’Archipel Indo-Australien (IAA) représentant les plateaux continentaux de Sunda et Sahul. Les niveaux de la mer ont baissé jusqu’à -120m durant les derniers maxima glaciaires émergeant une grande partie des plateaux continentaux.
INTRODUCTION GENERALE 9 Cette grande influence des variations environnementales récentes suggère que des variations climatiques antérieures pourraient aussi avoir eu une influence très importante sur la diversité des poissons récifaux et sa répartition autour du globe. Cette idée est renforcée par les différences de taux de diversification entre les clades tempérés et tropicaux de poissons récifaux (Siqueira et al. 2016).
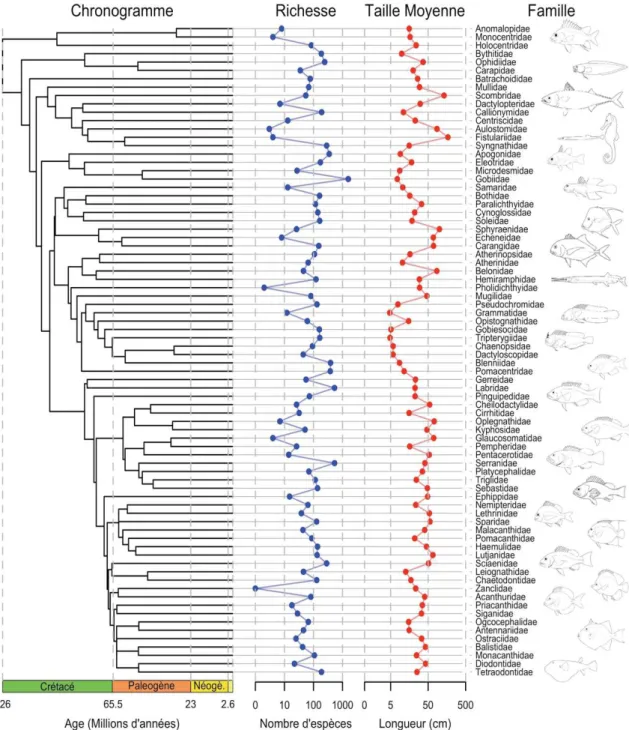
Figure 6: Vue d'ensemble des caractéristiques du groupe des Acanthomorphes. À gauche : Chronogramme des Acanthomorphes récifaux. Chaque famille d'Acanthomorphes contenant des espèces vivant sur des récifs tropicaux ou tempérés selon Fishbase (Froese & Pauly 2017), est inclue dans cette phylogénie. Les autres familles sont exclues. Ce chronogramme est tiré de la super-phylogénie reconstituée par Near et al. (2013). En bleu : Richesse spécifique de chaque famille selon Fishbase. En rouge : Longueur adulte moyenne pour chaque famille. La longueur maximale de chaque espèce a été récupérée sur Fishbase, et la taille moyenne a été calculée pour chaque famille. La richesse et la longueur moyenne sont présentées sur une échelle logarithmique À droite : Nom des familles de poissons récifaux et esquisses représentant les différences morphologiques entre famille (Fishbase).
I.2.3 L’influence de l’écologie
Les interactions entre espèces pourraient aussi avoir influencé de manière importante la diversité et les assemblages des poissons récifaux. En effet, plusieurs études montrent que leur diversification est étroitement liée à leurs interactions avec les coraux (Alfaro et al. 2007; Cowman & Bellwood 2011; Sorenson et al. 2014), faisant des récifs un habitat générateur d’espèces (Kiessling et al. 2010). Cette importante diversification a été reliée à la quantité d’énergie captée par les coraux et injectée dans l’écosystème (Fraser & Currie 1996), à la structure tridimensionnelle de l’habitat corallien (Gratwicke & Speight 2005) et à la complexité écologique des récifs (i.e. nombre d’interactions), qui offrent tous de nombreuses opportunités pour la spécialisation et la divergence (MacArthur & Levins 1964). Il a été par exemple montré que la complexité de l’habitat corallien est un déterminant important de la diversité des requins (Carcharhinidae, Sorenson et al. 2014), des poissons-ballons et des balistes (Tetraodontiformes, Alfaro et al. 2007), mais aussi que les interactions étroites entre les poissons-clowns et leurs hôtes pourraient être à l’origine de leur importante diversité (Amphiprion, Litsios et al. 2014). La richesse des poissons récifaux est très inégalement répartie entre les clades et des différences morphologiques très importantes sont observées au sein de familles phylogénétiquement proches (Fig. 6). Des études récentes suggèrent que les opportunités écologiques apportées par les récifs sont à l’origine de la richesse de nombreuses familles de poissons. Pour plusieurs familles, la radiation adaptative est associée avec un changement de régime alimentaire vers de la nourriture peu ciblée par les autres espèces, offrant de nombreuses opportunités pour la divergence (Chaetodontidae, Bellwood et al. 2010; Haemulids, Price et al. 2012; Acanthuroidei, Pomacentridae, Labridae, Lobato et al. 2014). Ces nombreuses opportunités pourraient être à l’origine de la très forte disparité de richesse et de morphologie entre les familles du groupe des Acanthomorphes (Fig. 6), qui regroupe la majorité des espèces de poissons récifaux (Bellwood & Wainwright 2002). En effet, il a été montré que chaque famille, parmi les plus diverses chez les Acanthomorphes, occupe une partie bien distincte de « l’espace morphologique » des récifs coralliens (Price et al. 2015), illustrant l’importance des interactions entre espèces dans le développement des espèces récifales.
I.3 Problématique
Bien que l’influence de l’environnement passé sur l’histoire évolutive des poissons récifaux ne soit plus à démontrer, les mécanismes au travers desquels la tectonique des plaques et les variations climatiques du cénozoïque ont façonné la diversité des poissons récifaux dans le temps et l’espace restent à explorer. L’objectif de cette thèse est d’apporter de nouveaux éléments de connaissance sur la manière dont l’environnement passé a modelé la répartition géographique actuelle de la biodiversité des poissons récifaux, en mettant l’accent sur la dimension spatiale de la diversification. Elle vise notamment à évaluer l’influence de la fragmentation de l’habitat et des variations de température passées sur les processus macroévolutifs des différentes familles d’Acanthomorphes. J’ai donc tenté de comprendre l’importance de ces variables sur la répartition spatiale des espèces des poissons récifaux et sur les processus d’extinction et de spéciation en milieu marin.
INTRODUCTION GENERALE 11 Ces questions sont d’autant plus importantes que les récifs et les communautés qu’ils abritent sont directement menacés par les changements globaux (Burke et al. 2011; Hughes et al. 2017). On s’attend à ce que les récifs connaissent un déclin équatorial (Couce et al. 2013) comme observé dans les registres fossile des ères interglaciaires du Pléistocène (Kiessling et al. 2012). Ce déclin conduirait à une fragmentation importante de l’habitat corallien pouvant causer des changements majeurs dans la composition des communautés de poissons coralliens (Bonin et al. 2011). Bien que la réponse des communautés de poissons coralliens à cette perte d’habitat puisse être évaluée sur une période très courte (Paddack et al. 2009), il existe très peu de méthodes permettant de prédire l’évolution à long terme de cette composante essentielle des écosystèmes côtiers source de nombreux biens et services. De plus les mesures de protections actuelles ne permettent pas la conservation d’une grande partie de l’information évolutive (Mouillot et al. 2016). Il est donc essentiel de comprendre la réponse des différentes familles de poissons coralliens aux des variations environnementales passées pour mieux anticiper leur devenir sous changements globaux.
Afin de répondre à ces objectifs, plusieurs types d’approches permettant de replacer les mécanismes spatiaux au centre de la discussion autour de la diversification des poissons récifaux ont été proposées. La première consiste à projeter sur une carte les métriques de co-occurrences entre espèces sœurs qui sont traditionnellement évaluées le long des arbres phylogénétiques (A1). Les suivantes s’appuient sur des reconstructions globales de la dynamique des habitats corallien pendant les 140 derniers millions d’années. La seconde approche consiste à utiliser des variables décrivant la topologie de l’habitat (fragmentation de l’habitat corallien et aire totale d’habitat corallien) dans une analyse de diversification classique ne prenant habituellement pas en compte la dimension spatiale (A2). Enfin, la troisième approche consiste à créer un modèle spatialisé de biodiversité permettant de prendre en compte la dynamique des habitats dans les processus de diversification et de dispersion des espèces (A3, A4, Aa1, AA2). Ce modèle de diversification se situe à la frontière entre la
macroécologie (prédiction de la répartition globale des espèces dans l’espace), la macroévolution (prédiction des taux de diversification) et la biogéographie (prédiction de la géographie de la spéciation, de l’extinction et de la dispersion des espèces).
13
C
HAPITRE
II :
M
ETHODOLOGIE
II.1 Approches existantes : potentiel et limitations
En raison du manque de données sur la biodiversité et les environnements passés couplé à l’impossibilité de tester les processus macroévolutifs expérimentalement, les méthodes permettant d’évaluer l’importance de l’environnement passé sur les processus macroévolutifs sont limitées. Il est donc important de décrire les différentes approches, ce qu’elles apportent, et quelles sont leurs limites. Dans cette partie, je vais d’abord décrire les principaux systèmes étudiés en macroévolution, puis les processus qui contrôlent les variables de ces systèmes. Ensuite je présenterai les deux types d’approche que j’ai utilisés pour tenter des comprendre ces processus : l’approche empirique et l’approche mécanistique.
II.1.1 Théorie simpliste de la macroévolution
Pour décrire les mécanismes qui contrôlent la diversité à large échelle les macroévolutionnistes considèrent deux principaux systèmes : la région et le clade (Fig. 6).
Une région peut être délimitée par différents critères tels que des limites topographiques, des faunes différentes (biorégions), des conditions
climatiques, ou à partir de critères
géographiques (e.g. quadrat de plusieurs kilomètres de côté). Le nombre d’espèces présentes dans une région (richesse spécifique) est contrôlé par trois principaux mécanismes : la spéciation, l’extinction et la colonisation à partir d’autres régions (Ricklefs 1987; Goldberg et al. 2005; Jablonski et al. 2016). Chaque évènement de spéciation va augmenter la richesse spécifique d’une région en créant un isolement reproducteur entre plusieurs populations d’une même espèce, qui vont diverger, pour former plusieurs espèces distinctes. La fréquence de ces événements est mesurée par le taux de spéciation
!"#. Chaque événement d’extinction va diminuer la richesse spécifique d’une région en entraînant la disparition d’une espèce de la zone géographique considérée. La fréquence de ces événements est mesurée par le taux d’extinction !$#. Enfin, chaque événement de colonisation par une espèce extérieure va aussi augmenter la richesse spécifique d’une région. La fréquence de ces événements est mesurée par le taux de colonisation !%#.
Un clade peut être délimité selon des critères taxonomiques (e.g. espèce, genre, famille, ordre) mais aussi selon d’autres critères communs (e.g. endothermes, espèces marines). Comme pour
Région
&'(
$
%
"
Clade
&)(
Figure 7. Schéma conceptuel de la dynamique de la biodiversité (inspiré de Goldberg et al., 2005). 2 systèmes sont étudiés : les régions et les clades. Les régions sont caractérisées leur environnement (T). Les clades sont caractérisés par le phénotype des espèces qui la composent (P). La diversité d’une région est une fonction de son taux de la spéciation !"#, de son taux d’extinction !$# et de son taux de colonisation en provenance des autres régions !%#. La diversité d’un clade est contrôlée par son taux de spéciation !"# et son taux d’extinction!$#.
la région, la richesse spécifique d’un clade est contrôlée par les mécanismes de spéciation et d’extinction (Nee et al. 1994). Cependant, les taux de spéciation et d’extinction des clades et des régions ne sont pas égaux, sauf dans le cas où le clade étudié est restreint à la région focale et où la région n’abrite pas d’autres clades.
II.1.2 Les approches empiriques et corrélatives
Traditionnellement, les études à l’échelle macroscopique en écologie ou en évolution s’appuient sur des approches empiriques et corrélatives basées sur des méthodes statistiques et de comparaison de modèles. Ces méthodes consistent à identifier des relations statistiques (e.g. corrélation) entre une variable décrivant la biodiversité (e.g. richesse spécifique d’une localité ou d’une région) et des variables associées à différentes hypothèses, comme par exemple la relation log-log entre le nombre d’espèces et la surface de l’habitat, ceci afin de hiérarchiser l’importance relative de ces hypothèses (Field et al. 2009). Par exemple, pour tenter de comprendre l’hétérogénéité de la richesse spécifique en poissons coralliens, Pellissier et collaborateurs (2014) ont relié la richesse de différentes régions à une variable environnementale passée : la distance aux refuges du quaternaire. Cette relation montre que l’hypothèse selon laquelle les refuges du quaternaire ont laissé leur empreinte sur les patrons de richesse spécifique actuels, est plausible, et que l’influence de la disponibilité de l’habitat sur les processus macroévolutifs mérite d’être étudiée. Cependant, elle ne permet ni d’identifier de relation causale entre la présence des refuges et les fortes richesses spécifiques, ni de comprendre l’influence de la disponibilité de l’habitat sur les processus macroévolutifs (spéciation, extinction dispersion). Ces méthodes permettent de proposer des explications narratives aux patrons et aux processus macroévolutifs, et d’appuyer ou d’invalider des hypothèses (Connolly et al. 2017). En revanche, ces méthodes ne permettent pas d’apporter des prédictions quantitatives de l’influence d’un processus sur les patrons de biodiversité. En écologie des communautés, les phylogénies moléculaires sont utilisées depuis de nombreuses années et des indices de biodiversité ont ainsi été développés pour prendre en compte l’influence de l’histoire évolutive des espèces sur la structure des assemblages aux échelles locales et régionales (NTI et NRI, Webb et al. 2002). Par exemple, Leprieur et collaborateurs (2015) ont identifié une relation entre le « Nearest Taxon Index » (NTI) qui décrit la proximité phylogénétique entre espèces présentes dans un même site, et la distance aux refuges du Quaternaire, suggérant que les épisodes de glaciations ont eu une influence sur les processus de spéciation.
II.1.3 Les approches mécanistiques
En macroévolution, la création de jeux de données très importants ainsi que l’augmentation de la puissance de calcul ont conduit à une prédominance des approches empiriques et corrélatives au dépens des approches mécanistiques, malgré leur fort potentiel. Ces approches consistent à caractériser les changements d’état d’un système comme une fonction explicite des évènements qui influencent ces changements (Connolly et al. 2017). Ce type d’approche présente trois grands avantages. Premièrement, l’incorporation d’une relation causale entre processus et patrons fait que la valeur des paramètres estimés a une interprétation biologique directe. Deuxièmement ces méthodes permettent généralement de générer des prédictions de
METHODOLOGIE 15 plusieurs variables différentes. Cela permet la comparaison avec de multiples patrons observés, ce qui rend la validation du modèle plus robuste (McGill 2003). Troisièmement, ce type d’approche permet d’aborder le modèle comme l’objet d’étude en lui-même en étudiant son comportement, afin de tester l’influence des postulats du modèle sur le système et les variables étudiés. Malgré, le potentiel de ces approches, elles comportent plusieurs écueils à éviter. Premièrement, des modèles avec des postulats très différents peuvent générer des prédictions très similaires. C’est pourquoi générer des prédictions pour plusieurs variables pour effectuer des comparaisons multiples est important pour construire des théories solides (McGill 2003). Deuxièmement, le seul moyen de tester la validité des modèles reste la comparaison entre données prédites par le modèle et données observées. Cette comparaison peut se faire à l’aide de l’écriture d’une fonction de vraisemblance et de méthodes numériques, lorsque la vraisemblance peut s’écrire de manière analytique, ou à partir de critères statistiques lorsqu’aucune fonction analytique ne peut être écrite. Ces méthodes de comparaison augmentent le risque de biais de confirmation si les théories proposées fournissent des prédictions réalistes. Par exemple, il a été montré que les méthodes permettant de modéliser simultanément la variation d’un ou plusieurs traits et les taux de spéciation et d’extinction le long d’un arbre phylogénétique (modèles SSE, Maddison et al. 2007; Fitzjohn 2010; Goldberg et al. 2011), génèrent un nombre important d’erreurs de type I (Rabosky & Goldberg 2015) alors que l’influence de nombreux traits sur les taux de diversification avait déjà été identifiée à l’aide ces modèles.
En macroévolution, ce type d’approche a été utilisée pour estimer les taux de spéciation et d’extinction des clades à partir de phylogénies moléculaires (Nee et al. 1994; Morlon 2014) ou de données fossiles (Raup et al. 1973; Silvestro et al. 2014). Ces méthodes ont pu être mises en œuvre pour tester l’influence de la diversité (Rabosky & Lovette 2008; Etienne et al. 2012; Manceau et al. 2015), des extinctions massives (Stadler 2011), de traits phénotypiques (Maddison 2007; Fitzjohn 2010; Goldberg & Igić 2012), ou encore de l’environnement passé (Condamine et al. 2013) sur les taux de spéciation et d’extinction des clades. En revanche, les approches mécanistiques visant à prédire l’influence des processus macroévolutifs sur les différences de diversité entre les régions sont plus rares (Gotelli et al. 2009). Une partie des modèles spatialisés de macroévolution sont uniquement théoriques et ne permettent pas de tester l’influence de variations environnementales réelles, bien qu’ils nous renseignent sur la manière dont certains processus peuvent agir sur les grands patrons de biodiversité (e.g. Pigot et al. 2010; Pigot et al. 2012; Aguilée et al. 2013; Albert et al. 2017). D’autres ont été construits pour permettre une comparaison avec des données réelles à travers l’écriture d’une fonction de vraisemblance, mais ne prennent en compte qu’une variation discrète des variables dans l’espace (e.g. Goldberg et al. 2011; Sukumaran et al. 2015; Valente et al. 2015), ou une variation selon un gradient environnemental (Colwell & Rangel 2010). Ces modèles ne permettent donc pas de générer des prédictions quantitatives de l’influence des processus macroévolutifs sur la diversité dans un espace continu à deux dimensions. Cependant, la variation continue des variables environnementales et de la distribution des espèces dans l’espace, rendent la prise en compte de la géographie indispensable pour comprendre les mécanismes à l’origine des gradients de biodiversité.