–––––---––––––---0p Année Universitaire 2017-2018 Laboratoire de Zoologie et Biologie Animale
THESE
Présentée pour l’obtention du Titre de Docteur de
L’Université Félix HOUPHOUËT-BOIGNY
Union-Discipline-Travail
Ministère de l’Enseignement Supérieur et de la Recherche Scientifique
KOFFI Alexandre Franklin
Spécialité : Entomologie et Gestion des Ecosystèmes
INSECTES NÉCROPHAGES SUR SUBSTRAT DE
PORC (Sus scrofa domesticus L.) EN ZONE
GUINÉENNE DE CÔTE D’IVOIRE : DIVERSITÉ,
DYNAMIQUE DES POPULATIONS ET
INTÉRÊT EN EXPERTISE MÉDICO-LÉGALE
Commission du Jury
Numéro d’ordre 2165 / 2018 Soutenu publiquement le, 20 Décembre 2018 M. M. Mme. Mme. TANO YaoABOUA Louis Roi N.
YEBOUÉ N’Guessan Lucie
YAPO ETTÉ A. Hélène
Professeur Titulaire Maître de Conférences Maître de Conférences Professeur Titulaire UFHB UFHB UJLoG UFHB Président Directeur Rapporteur Examinateur
DÉDICACES
Je dédie cette Thèse :
A mes frère et sœurs ainés, AMANY Georges,
KOFFI Soumaley Gisèle Epse DJABO, KOFFI Massan Reine, KOFFI Adrienne Kacou Bla et KOFFI Jeanne Konan Bla ; Qu’ils recoivent ici, l’expression de mes chaleureux et sincères remerciements pour leurs encouragements et leur indéfectible
soutien moral.
A mes enfants KOFFI Kevin Ange-Alexandre,
KOFFI Yoann Christian Emmanuel, KOFFI David Marc-Yvann, KOFFI Qetsia et KOFFI Daniel Esdras ;
Merci pour votre inestimable et affectueux soutien.
Au Professeur FOUA-BI Kouahou, Entomologiste émérite qui m’a initié à la recherche scientifique et m’a donné le goût de
REMERCIEMENTS
Cette thèse est le fruit de quatre années d’étude dont la réalisation a été possible grâce au soutien de plusieurs institutions. Que ces institutions trouvent ici l’expression de ma profonde gratitude :
L’Université Félix Houphouët-Boigny (UFHB) qui a bien voulu, à travers son administration, m’autoriser à reprendre mon cursus, là où je l’avais provisoirement suspendu ;
Le Programme d’Appui Stratégique à la Recherche Scientifique (PASRES – Côte d’Ivoire) qui m’a fait confiance et a financé ces travaux de recherche dans le cadre du Projet PASRES n° 130 ;
Le Centre Suisse de Recherche Scientifique de Recherche en Côte d’Ivoire (CSRS), qui a hébergé les fonds alloués à ce projet de thèse PASRES n° 130 ;
L’Institut National d’Hygiène Publique (INHP – Treichville), dont je suis issu et qui a autorisé l’utilisation d’un des laboratoires du Service de Lutte Anti Vectorielle pour les manipulations en salle ;
Les Directions du Centre National de Recherche Agronomique (CNRA – Adiopodoumé Km 17, Route de Dabou), du Zoo National d’Abidjan (ZNA) et du Centre National de Floristique (CNF) de l’Université Félix Houphouët-Boigny de Cocody, qui ont accepté que leurs sites hébergent les expériences de ces travaux de thèse en milieu naturel.
Cette thèse a été également réalisée grâce au soutien de plusieurs Responsables Administratifs Universitaires, Enseignants et Chercheurs des Universités de Côte d’Ivoire et de France; qu’ils trouvent ici l’expression de mes sincères remerciements :
Monsieur KOUAMELAN Essétchi Paul, Professeur Titulaire, Doyen de l’UFR des Biosciences pour les facilités administratives qu’il m’a accordées ;
Monsieur N’GORAN Eliezer, Professeur Titulaire, Directeur du Laboratoire de Zoologie et Biologie Animale de l’UFR des Biosciences, pour ses encouragements ;
Monsieur TANO Yao, Professeur Titulaire, Président de l’Université NANGUI ABROGOUA (UNA), qui malgré ses nombreuses occupations, m’a fait l’immense honneur de présider la commission du jury de cette thèse ; merci infiniment Professeur pour vos constants encouragements ;
Monsieur ABOUA Louis Roi Nondenot, Maître de Conférences (Laboratoire de Zoologie et Biologie Animale), Directeur Scientifique de cette thèse. Je lui suis infiniment reconnaissant pour la confiance qu'il m'a accordée et les discussions enrichissantes que nous avons eues. Outre ses qualités humaines, je salue la qualité de son encadrement, sa disponibilité pour répondre à mes questions, sa vigilance scientifique, ainsi que sa patience dans les corrections de mes écrits ;
Madame YEBOUE N’Guessan Lucie, Maître de Conférences (UJLoG de Daloa), pour ses observations pertinentes et avisées dans les corrections apportées à ce document de thèse. Merci Madame pour votre disponibilité à toute épreuve ;
Madame YAPO ETTÉ Hélène, Professeur Titulaire, Directrice de l’Institut de Médecine Légale d’Abidjan (IML), pour ses encouragements et ses précieux conseils. Malgré vos nombreuses occupations, vous n’avez pas hésité à siéger dans la commission du jury de cette thèse. Recevez Madame, à travers ces quelques lignes, l’expression de ma profonde gratitude ;
Monsieur KOUASSI Kouassi Philippe, Professeur Titulaire (UFHB), Président du Conseil Scientifique de l’UFR des Biosciences, qui malgré ses nombreuses charges, a accepté de corriger ce document. Merci Professeur pour vos observations et vos suggestions qui ont apporté une valeur scientifique ajoutée à ce document de thèse ;
Monsieur AKPESS Akpa Alexandre, Maître de Conférences (UFHB), qui par ses remarques pertinentes, a contribué à apporter une claire lisibilité dans la rédaction de ce document de thèse. Merci Docteur pour les échanges fructueux que nous avons eu et pour votre fraternelle et spontanée disponibilité ;
Madame OUALI N’GORAN Mauricette S. W., Maître de Conférences (UFHB), qui n’a pas hésité à me consacrer du temps et à me donner de précieux conseils pour la rédaction de ce document de thèse. Je tiens ici Docteur, à vous exprimer toute ma gratitude ;
Monsieur BLAHOUA Kassi Georges, Maître-Assistant (UFHB), qui malgré ses nombreuses occupations, a consacré un temps précieux à corriger ce document de thèse. Merci Docteur pour vos minutieuses et précieuses observations ;
Monsieur Damien CHARABIDZÉ, Maître de Conférences (Université de Lille II), Responsable du Laboratoire d’Entomologie Médico-légale de l’Institut de Médecine Légale de Lille (France), pour ses conseils avisés, depuis la conception du projet PASRES n° 130, jusqu’à la rédaction scientifique des différents articles publiés, en passant par la mise en œuvre des expériences sur le terrain. Je vous prie de bien vouloir recevoir ici, l’expression de mes vifs et chaleureux remerciements.
Enfin, j’adresse mes chaleureux et sincères remerciements à tous mes collaborateurs chercheurs, techniciens et étudiants, mes amis et connaissances qui n’ont nommément pas été cités dans ce document, pour l’aide et le soutien de quel que nature que ce soit, qu’ils m’ont apporté de près ou de loin.
TABLE DES MATIERES
TABLE DES MATIERES……… LISTE DES ABBREVIATIONS……….. LISTE DES FIGURES……….. LISTE DES TABLEAUX……….
INTRODUCTION……….………
CHAPITRE 1 : GENERALITES……….
1.1. Faune entomologique impliquée dans le processus de colonisation d’un cadavre de mammifère exposé à l’air libre………. 1.1.1. Diversité spécifique de la faune entomologique nécrophage d’un cadavre de
mammifère exposé à l’air libre……… 1.1.1.1. Ordre des Diptères……….. 1.1.1.2. Ordre des Coléoptères……… 1.1.1.3. Ordre des Hyménoptères……… 1.1.1.4. Ordre des Lépidoptères……….. 1.1.2. Processus de colonisation par les insectes d’un cadavre de mammifère exposé à l’air libre………. 1.1.2.1. Détection d’un cadavre exposé à l’air libre et déclenchement des pontes…………. 1.1.2.2. Succession des insectes sur un cadavre exposé à l’air libre et notion d’escouades…..
1.2. Rôle des insectes nécrophages dans le processus de décomposition d’un cadavre…. 1.2.1. Utilisation de l’écosystème-cadavre en fonction du régime alimentaire………. 1.2.2. Effets de l’activité des insectes nécrophages sur la décomposition des cadavres…….
1.3. Décomposition d’un cadavre de mammifère en tant que matière organique………. 1.3.1. Modification post mortem d’un cadavre de mammifère………. 1.3.1.1. Refroidissement du corps (algor mortis)………. 1.3.1.2. Rigidité cadavérique (rigor mortis)………. 1.3.1.3. Lividités cadavériques (livor mortis)……….
i v vi xiii 1 5 6 6 6 15 23 23 25 25 26 28 28 33 34 34 35 35 35
1.3.1.4. Déshydratation………... 1.3.1.5. Autolyse………. 1.3.1.6. Putréfaction……… 1.3.1.7. Squelettisation……… 1.3.2. Classification des stades de décomposition d’un cadavre……… 1.3.3. Paramètres influençant la décomposition d’un cadavre………..
1.4. Influence du climat sur l’évolution des niveaux populationnels des insectes nécrophages……….
1.5. Intérêt des insectes nécrophages en expertise médico-légale………. 1.5.1. Historique……… 1.5.2. Domaines d’application de l’entomologie forensique………. 1.5.3. Principes et méthodes de datation post-mortem en Entomologie médico-légale…… 1.5.3.1. Intervalle post-mortem « court »………. 1.5.3.2. Intervalle post-mortem « moyen » et « long »………. 1.5.3.3. ForenSeek : une approche nouvelle basée sur un programme informatique de simulation de développement des insectes nécrophages au sein de « l’écosystème-cadavre »……….
CHAPITRE 2 : MILIEU D’ETUDE, MATERIEL ET METHODES……….
2.1. Milieu d’étude………... 2.1.1. Situation géographique de la ville d’Abidjan………. 2.1.2. Végétation de la ville d’Abidjan………. 2.1.3. Climat de la ville d’Abidjan……… 2.1.4. Choix et localisation des sites expérimentaux………
2.2. Matériel et méthodes………. 2.2.1. Matériel………... 2.2.1.1. Matériel biologique……… 2.2.1.2. Matériel technique………. 2.2.2. Méthodes………. 2.2.2.1. Diversité des insectes nécrophages impliqués dans le processus de colonisation d’un cadavre de porc exposé à l’air libre………
36 36 36 37 37 38 40 42 42 43 44 44 49 49 51 52 52 52 54 54 64 64 64 64 72 72
2.2.2.2. Contribution des différents groupes d’insectes nécrophages au processus de décomposition d’un cadavre de porc exposé à l’air libre……… 2.2.2.3. Dynamique des populations des principaux Diptères nécrophages d’intérêt médico-légal………. 2.2.2.4. Identification et conservation des larves et adultes des insectes nécrophages……… 2.2.2.5. Traitement des données………..
CHAPITRE 3 : RÉSULTATS ET DISCUSSION………..
3.1. Faune entomologique nécrophage impliquée dans le processus de colonisation des cadavres de porc exposés à l’air libre……… 3.1.1. Entomofaune associée aux cadavres de porc exposés à l’air libre……… 3.1.1.1. Espèces identifiées………... 3.1.1.2. Diversité biologique de la faune entomologique associée aux cadavres……… 3.1.2. Processus de colonisation par les insectes nécrophages, d’un cadavre de porc exposé à l’air libre ……….. 3.1.2.1. Ordre des Diptères……….. 3.1.2.2. Ordre des Coléoptères……… 3.1.2.3. Ordre de succession des vagues d’insectes colonisant les cadavres de porc exposés.. 3.1.3. Discussion………...
3.2. Contribution des différents groupes d’insectes nécrophages au processus de décomposition d’un cadavre de porc exposé à l’air libre………. 3.2.1. Groupes d’insectes impliqués dans la décomposition des cadavres de porc………… 3.2.2. Perte de masse corporelle des cadavres de porc exposés à l’air libre………. 3.2.2.1. Effets des conditions climatiques sur la perte de masse corporelle des cadavres de porc……….. 3.2.2.2. Effets des activités des insectes nécrophages sur la perte de masse corporelle des cadavres de porc……….. 3.2.3. Discussion………...
3.3. Dynamique des populations des principaux Diptères d’intérêt médico-légal……… 3.3.1. Conditions climatiques expérimentales………... 3.3.2. Abondance relative et sex-ratio des espèces de Diptères capturés……….
78 80 82 86 92 93 93 93 95 105 105 107 107 114 120 120 120 120 122 125 128 128 128
3.3.3. Variations hebdomadaire et annuelle des niveaux populationnels des principaux Diptères nécrophages d’intérêt médico-légal……….. 3.3.3.1. Famille des Calliphoridae………... 3.3.3.2. Famille des Muscidae………. 3.3.3.3. Famille des Sarcophagidae………. 3.3.4. Discussion………... CONCLUSION……….. REFERENCES BIBLIOGRAPHIQUES……… ANNEXE……… 130 130 132 143 150 154 158 176
LISTE DES ABREVIATIONS
ADH : Accumulation Degré-Heure ADJ : Accumulation Degré-Jour ADN : Acide DésoxyriboNucléique
ANOVA : ANalysis Of Variance (Analyse de variance) CNF : Centre National de Floristique
CNRA : Centre National de Recherche Agronomique CO2 : Carbon diOxide (Dioxyde de Carbone)
EAFE : European Association for Forensic Entomology FHB : Félix Houphouët-Boigny
Ga1et Ga2 : Grille 1 et 2 donnant accès aux insectes nécrophages
Gt : Grille protégeant le cadavre témoin
GC-EAG : Gas Chromatography – ElectroAntennoGraphic IHM : Instruments Horaires Moineau
IPM : Intervalle Post Mortem J0, J1 : Jour 0, Jour 1 (Post mortem)
L1 : Larves stade 1
MP : Mégapixel
N : Nord (Coordonnées GPS) O : Ouest (Coordonnées GPS)
Pa1, Pa2 et Pt : Porc 1 accessible aux insectes, Porc 2 accessibles aux insectes et Porc témoin non
accessible aux insectes S1, S2 : Semaine 1, Semaine 2
SODEXAM : Société d'Exploitation et de Développement Aéroportuaire, Aéronautique et Météorologique
T1 : Température 1
USA : United States of America ZNA : Zoo National d’Abidjan
LISTE DES FIGURES
Figure 1 : Figure 2 : Figure 3 : Figure 4 : Figure 5 : Figure 6 : Figure 7 : Figure 8 : Figure 9 : Figure 10 : Figure 11 : Figure 12 : Figure 13 : Figure 14 : Figure 15 : Figure 16 : Figure 17 : Figure 18 :Morphologie générale d’une mouche, vue dorsale………... Morphologie générale d’une mouche, vue latérale………. Cycle de développement de la mouche domestique Musca domestica………… Quelques espèces de Calliphoridae. A – Lucilia sericata. B – Calliphora vicina. C – Calliphora vomitoria. D – Chrysomya albiceps……… Quelques espèces de Sarcophagidae. A – Sarcophaga carnaria. B – Sarcophaga africa. C – Sarcophaga argyrostoma. D – Sarcophaga tibialis…. Quelques espèces de Muscidae. A – Musca domestica. B – Stomoxys calcitrans……… Quelques espèces de Fanniidae. A – Fannia lustrator. B – Fannia canicularis.. Quelques espèces de Piophilidae. A – Piophila casei. B – Stearibia nigriceps... Quelques espèces de Phoridae. O - Conicera tibialis. P - Triphleba hyalinata... Vue dorsale de la morphologie générale d’un insecte appartenant à l’ordre des Coléoptères………. Différentes formes de larves de Coléoptères nécrophages. A – Larve de Staphylinidae. B – Larve de Cleridae. C – Larve de Dermestidae. D – Larve de Histeridae………... Quelques espèces de Cleridae. A – Necrobia rufipes. B – Korynetes ruficornis……… Quelques espèces de Histeridae. A – Margarinitus brunneus. B – Hister unicolor……….. Quelques espèces de Dermestidae. A – Dermestes maculatus. B – Anthrenus fuscus……….. Quelques espèces de Staphylinidae. A – Creophilus maxillosus. B – Philonthus Succicola……….. Quelques espèces de Silphidae. A – Nicrophorus humator. B – Tanatophilus sinuatus……….. Quelques espèces de Nitidulidae. A - Epuraea melanocephala. B - Stelidota coenosa………... Hyménoptère parasitoïde (guêpe) des Diptères nécrophages : Nasonia vitripennis………... 8 8 11 11 13 13 14 14 14 16 18 20 20 22 22 24 24 24
Figure 19 : Figure 20 : Figure 21 : Figure 22 : Figure 23 : Figure 24 : Figure 25 : Figure 26 : Figure 27 : Figure 28 : Figure 29 : Figure 30 : Figure 31 : Figure 32 : Figure 33 : Figure 34 : Figure 35 :
Succession des stades adultes (a) et juvéniles (b) d'insectes nécrophages sur un cadavre humain dans l'Est du Tennessee……… Schéma des relations trophiques liant les différents groupes écologiques présents sur un cadavre………... Courbes de croissance des larves de Lucilia sericata (Diptera : Calliphoridae)... Exemple chiffré de calcul d’un IPM avec la méthode des ADJ……….. Situation géographique de la Côte d’Ivoire en Afrique de l’Ouest………. Situation géographique de la ville d’Abidjan choisie comme zone d’étude…… Diagramme ombrothermique 2012 de la ville d’Abidjan (SODEXAM – Abidjan)………. Diagramme ombrothermique 2013 de la ville d’Abidjan (SODEXAM – Abidjan)………. Diagramme ombrothermique 2014 de la ville d’Abidjan (SODEXAM – Abidjan)………. Humidités Relatives moyennes mensuelles enregistrées au cours des années 2012, 2013 et 2014 au niveau de la ville d’Abidjan (SODEXAM – Abidjan)…. A - Vue satellitaire du site expérimental du CNRA (Source : Google Earth). B – Emplacement de la cage Ga1. C – Emplacement de la cage Ga2. D –
Emplacement de la cage Gt ………
A – Vue satellitaire du Zoo National d’Abidjan (Source : Google Earth). B – Emplacement de la cage Ga1. C – Emplacement de la cage Ga2. D –
Emplacement de la cage Gt………..
A – Vue satellitaire du Centre National de Floristique (Source : Google Earth). B – Emplacement de la cage Ga1. C – Emplacement de la cage Ga2. D –
Emplacement de la cage Gt ……….
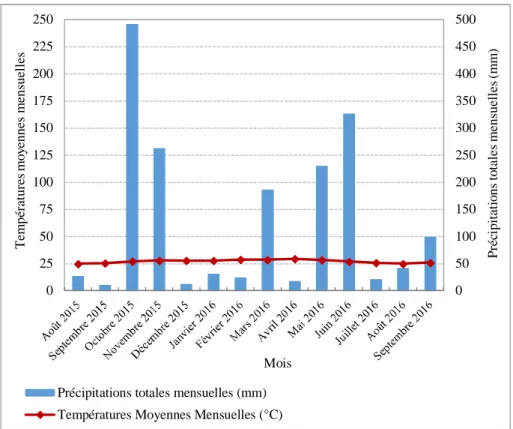
Localisation des sites dans la zone d’étude du District d’Abidjan………. Conditions climatiques de température moyenne et de pluviométrie enregistrées sur l’ensemble des trois sites expérimentaux d’août 2015 à septembre 2016………... Humidités relatives enregistrées sur l’ensemble des trois sites expérimentaux d’août 2015 à septembre 2016……… Durées totales mensuelles d’insolation enregistrées d’août 2015 à septembre 2016 sur l’ensemble des trois sites expérimentaux (SODEXAM)………..
29 31 46 48 53 53 55 55 56 56 57 59 60 61 62 62 63
Figure 36 : Figure 37 : Figure 38 : Figure 39 : Figure 40 : Figure 41 : Figure 42 : Figure 43 : Figure 44 : Figure 45 : Figure 46 : Figure 47 : Figure 48 : Figure 49 :
Matériel biologique. A - Cadavre de porc sur le site du CNF, B – Grappes d’œufs de Diptères nécrophages, C – Larves de Diptères nécrophages, D – Nymphes de Diptères nécrophages, E – Tas de Diptères nécrophages adultes, F – Portion de 500 g de foie et de viscère de porc……….. Cage Ga1 permettant à tous les insectes d’accéder au cadavre de porc exposé à
l’air libre………. Cage Ga2 permettant sélectivement aux Diptères nécrophages d’avoir accès au
cadavre de porc exposé à l’air libre……… Matériel technique 1. A – Cage Gt de protection des cadavres de porc contre
les insectes nécrophages. B – Piège à Diptères nécrophages. C – Cache-nez. D – Filet fauchoir. E – Boîte en plastique transparent pour le transport des insectes nécrophages. F – Matériel de récolte et de transport des insectes nécrophages piégés dans le cadre de la dynamique des populations………. Matériel technique 2. A – Bac d’élevage. B – Cage d’émergence des insectes adultes. C – Matériel entomologique servant à la préparation des insectes. D – Boîtes entomologiques. E – Essence de Lavandin. F – Matériel de pesage des cadavres de porc constitué de peson, de corde en nylon et de poulie simple…… Loupe binoculaire avec accessoire à micro caméra de marque et modèle « BRESSER MikroCamLab – 1,3 MP »……… Appareil photographique semi-professionnel de marque et modèle « Canon EOS 1100D »……….. Enregistreur thermo-hygromètre de marque et modèle « IHM – 172SI »…….. Cage Ga1 avec grille métallique à grandes mailles de 3,5 à 4 cm de diamètre….
Cage Ga2avec grille métallique à mailles très fines d’environ 1 mm de diamètre
et cônes sur les côtés………... Prélèvement des œufs pondus par les Diptères sur le cadavre de porc, pour être acheminés et mis en incubation au laboratoire……… Elevage au laboratoire, des larves issues des œufs de Diptères prélevés sur les cadavres de porc exposés sur les différents sites expérimentaux………. Dispositif de piégeage des insectes nécrophages à base de bacs jaunes et de fosses-pièges (pitt-fall trap) disposés autour du cadavre de porc exposé à l’air libre……… Disposition des bacs jaunes et des fosses-pièges au niveau du dos du cadavre de porc……… 65 66 66 68 70 71 71 73 74 74 76 76 77 77
Figure 50 : Figure 51 : Figure 52 : Figure 53 : Figure 54 : Figure 55 : Figure 56 : Figure 57 : Figure 58 : Figure 59 : Figure 60 : Figure 61 : Figure 62 : Figure 63 :
Dispositif expérimental. A - Cage Ga1 avec grille métallique à grandes mailles
de 3,5 à 4 cm de diamètre. B - Cage Ga2 avec grille métallique à mailles très
fines (1 mm de diamètre). C – Cage témoin Gt avec grille métallique à mailles
très fines (1 mm de diamètre). D – Dispositif de levée et de pesage des cadavres de porc en décomposition………... Vue d’ensemble du piège à Diptères nécrophages inspiré de celui de « Upton » (1991)………. Travail d’identification des insectes nécrophages récoltés au cours des différentes expériences réalisées sur le terrain……… Méthodes. A - Conservation des larves de Diptères dans des piluliers contenant de l’alcool à 60° et mise en collection provisoire des mouches adultes piquées et étiquetées. B – Préparation de spécimens adultes de Coléoptères, sur planche de polystyrène. C – Coléoptères piqués et étiquetés mis en collection définitive dans une boîte entomologique vitrée. D – Mouches diverses piquées et étiquetées mises en collection définitive dans une boîte entomologique vitrée... Piophila casei………. Hermetia illucens………... Chrysomya albiceps………... Necrobia rufipes………. A – Adulte de Margarinotus brunneus. B – Adulte de Dermestes maculatus. C – Adulte de Tenebrio molitor. D – Adulte de Trox nodulosus……… Sarcophaga carnaria ………. Ordre d’apparition et de succession des différents groupes d’insectes nécrophages, dans le processus de colonisation d’un cadavre de porc exposé à l’air libre en zone guinéenne de Côte d’Ivoire……… Absence de corrélation entre les températures hebdomadaires enregistrées du 17 mars au 30 juin 2016 et les taux cumulés de perte de masse corporelle des cadavres de porc………. Absence de corrélation entre les taux d’humidité relative hebdomadaires enregistrés du 17 mars au 30 juin 2016 et les taux cumulés de perte de masse corporelle des cadavres de porc……….. Absence de corrélation entre la pluviométrie relevée du 17 mars au 30 juin 2016 et les taux cumulés de perte de masse corporelle des cadavres de porc….
79 81 84 85 98 99 100 102 104 111 113 123 123 124
Figure 64 : Figure 65 : Figure 66 : Figure 67 : Figure 68 : Figure 69 : Figure 70 : Figure 71 : Figure 72 : Figure 73 : Figure 74 : Figure 75 :
Evolution comparée des taux cumulés de perte de masse corporelle des cadavres de porc Pa1, Pa2 et Pt (témoin), en fonction de l'intervalle post mortem
(IPM), du 17 mars au 30 juin 2016………. Sex-ratio (en pourcentage des effectifs totaux) calculé sur la base des individus capturés du 26 août 2015 au 23 août 2016………. Variations hebdomadaires des niveaux populationnels de Chrysomya albiceps dans les conditions de température enregistrées du 26 août 2015 au 23 août 2016……… Variations hebdomadaires des niveaux populationnels de Chrysomya albiceps dans les conditions de pluviométrie enregistrées du 26 août 2015 au 23 août 2016……… Variations hebdomadaires des niveaux populationnels de Chrysomya albiceps dans les conditions d’humidité relative enregistrées du 26 août 2015 au 23 août 2016……… Variations hebdomadaires des niveaux populationnels de Chrysomya albiceps dans les conditions d’insolation enregistrées du 26 août 2015 au 23 août 2016……… Absence de corrélation entre l’évolution hebdomadaire des effectifs de Chrysomya albiceps et les températures enregistrées du 26 août 2015 au 23 août 2016……… Absence de corrélation entre l’évolution hebdomadaire des effectifs de Chrysomya albiceps et les précipitations enregistrées du 26 août 2015 au 23 août 2016……… Absence de corrélation entre l’évolution hebdomadaire des effectifs de Chrysomya albiceps et l’humidité relative enregistrée du 26 août 2015 au 23 août 2016……… Absence de corrélation entre l’évolution hebdomadaire des effectifs de Chrysomya albiceps et les durées d’insolation enregistrées du 26 août 2015 au 23 août 2016………... Variations hebdomadaires des niveaux populationnels de Musca domestica dans les conditions de température enregistrées du 26 août 2015 au 23 août 2016……… Variations hebdomadaires des niveaux populationnels de Musca domestica dans les conditions de pluviométrie enregistrées du 26 août 2015 au 23 août 2016……… 124 129 131 131 133 133 134 134 135 135 137 139
Figure 76 : Figure 77 : Figure 78 : Figure 79 : Figure 80 : Figure 81 : Figure 82 : Figure 83 : Figure 84 : Figure 85 : Figure 86 :
Variations hebdomadaires des niveaux populations de Musca domestica dans les conditions d’humidité relative enregistrées du 26 août 2015 au 23 août 2016……… Variations hebdomadaires des niveaux populationnels de Musca domestica dans les conditions d’insolation enregistrées du 26 août 2015 au 23 août 2016……… Absence de corrélation entre l’évolution hebdomadaire des effectifs de Musca domestica et les conditions de températures enregistrées du 26 août 2015 au 23 août 2016………... Absence de corrélation entre l’évolution hebdomadaire des effectifs de Musca domestica et les précipitations enregistrées du 26 août 2015 au 23 août 2016……… Absence de corrélation entre l’évolution hebdomadaire des effectifs de Musca domestica et les conditions d’humidité relative enregistrée du 26 août 2015 au 23 août 2016………... Absence de corrélation entre l’évolution hebdomadaire des effectifs de Musca domestica et les durées d’insolation enregistrées du 26 août 2015 au 23 août 2016... Variations hebdomadaires des niveaux populationnels de Sarcophaga carnaria dans les conditions de température enregistrées du 26 août 2015 au 23 août 2016………... Variations hebdomadaires des niveaux populationnels de Sarcophaga carnaria dans les conditions de pluviométrie enregistrées du 26 août 2015 au 23 août 2016………... Variations hebdomadaires des niveaux populationnels de Sarcophaga carnaria dans les conditions d’humidité relative enregistrées du 26 août 2015 au 23 août 2016………... Variations hebdomadaires des niveaux populationnels de Sarcophaga carnaria dans les conditions d’insolation enregistrées du 26 août 2015 au 23 août 2016……… Absence de corrélation entre l’évolution hebdomadaire des effectifs de Sarcophaga carnaria et les températures enregistrées du 26 août 2015 au 23 août 2016……… 139 140 141 141 142 142 144 144 145 147 148
Figure 87 :
Figure 88 :
Figure 89 :
Absence de corrélation entre l’évolution hebdomadaire des effectifs de Sarcophaga carnaria et les précipitations enregistrées du 26 août 2015 au 23 août 2016……… Absence de corrélation entre l’évolution hebdomadaire des effectifs de Sarcophaga carnaria et l’humidité relative enregistrée du 26 août 2015 au 23 août 2016…………... Absence de corrélation entre l’évolution hebdomadaire des effectifs de Sarcophaga carnaria et les durées d’insolation enregistrées du 26 août 2015 au 23 août 2016………...
148
149
LISTE DES TABLEAUX
Tableau I : Tableau II : Tableau III : Tableau IV : Tableau V : Tableau VI : Tableau VII : Tableau VIII : Tableau IX : Tableau X : Tableau XI : Tableau XII : Tableau XIII : Tableau XIV : Tableau XV :Classification dichotomique (sens vertical) simplifiée des principales familles de Diptères (Delvare & Alberlenc, 1989)………..………. Succession des escouades d’insectes nécrophages suivant l’état de décomposition d’un cadavre de mammifère animal et/ou humain ……… Travailleurs de la mort se succédant sur un corps exposé à l’air libre ……… Facteurs intrinsèques et extrinsèques pouvant influencer le processus de décomposition d’un cadavre de mammifère animal et/ou humain……… Températures minimales nécessaires à l’activité de 3 espèces de Diptères………. Données récapitulatives relatives aux conditions climatiques enregistrées sur les sites expérimentaux du CNRA, du Zoo et du CNF, d’Août 2015 à Septembre 2016.. Périodes hebdomadaires de capture des Diptères nécrophages d’intérêt médico-légal………... Liste des espèces d’insectes nécrophages récoltés sur cadavre de porc exposé à l’air libre………... Espèces d’insectes nécrophages récoltées à différents stades de décomposition des cadavres de porc, sur les trois sites expérimentaux (CNRA, Zoo et CNF) au cours des trois séries d’expériences 1, 2 et 3……… Effectifs moyens et abondance relative des espèces de Diptères nécrophages récoltées sur les sites expérimentaux du CNRA, du Zoo et du CNF au cours des séries d’expériences 1, 2 et 3………. Effectifs moyens et abondance relative des espèces de Coléoptères nécrophages récoltées sur les sites expérimentaux du CNRA, du Zoo et du CNF au cours des séries d’expériences 1, 2 et 3………. Indices de Shannon (H’) et Equitabilité (E) des différents stades de décomposition des cadavres de porc exposés à l’air libre……….. Effectifs moyens des Diptères nécrophages adultes récoltés sur les sites du CNRA, du Zoo et du CNF, au cours des expériences de la série 2………. Effectifs moyens des Coléoptères nécrophages adultes récoltés sur les sites du CNRA, du Zoo et du CNF………. Evolution cadavérique des porcs et ordre de colonisation par les insectes nécrophages………... 9 27 30 39 41 63 83 94 96 101 103 106 106 108 109
Tableau XVI :
Tableau XVII :
Tableau XVIII :
Effectifs évolutifs des différentes Familles d’insectes nécrophages adultes piégés sur l’ensemble des sites expérimentaux du CNRA, du Zoo et du CNF………. Effectifs totaux et abondance relative des espèces capturés durant 52 semaines (ou une année entière), du 26 août 2015 au 23 août 2016……… Valeurs des Coefficients de Détermination r2 des tests de Corrélation linéaire (de Pearson) entre les variations hebdomadaires des effectifs des différentes espèces de Calliphoridae capturées et les différents paramètres climatiques enregistrés du 26 août 2015 au 23 août 2016………...
121
129
Le meurtre ou homicide volontaire est par définition, un acte par lequel une personne donne la mort à autrui. La protection de la vie humaine apparaît alors comme l'un des buts suprêmes de tout système juridique. Le meurtre serait l’aboutissement de plusieurs facteurs sociaux, humains et psychologiques, et pourrait être un délit inclus dans un contexte global qui est celui de la criminalité sous toutes ses formes (Nations-Unies, 2005).
Selon un rapport des Nations-Unies (2005), intitulé « Criminalité et Développement en Afrique », il y a de bonnes raisons de croire, que non seulement, l’Afrique a un grave problème de criminalité, mais aussi et surtout, que ce problème de criminalité sape les efforts de développement du continent. Heureusement, les dirigeants africains ont pris conscience du fait que, la pauvreté massive et le sous-développement qui alimentent les conflits, sont à la fois une cause et une conséquence de la criminalité. Selon Nelson Mandela, « … l’on ne peut s’attaquer avec succès à la criminalité que dans le contexte de programmes réussis de développement socioéconomique. Or, l’expansion économique et les programmes visant à atténuer la pauvreté sont eux-mêmes sapés par la criminalité et la corruption » (Schärf, 2003).
Les facteurs sociaux liés à la criminalité sont en rapport avec la pauvreté, les inégalités socio-économiques, la forte proportion des jeunes au sein de la population, l’urbanisation galopante, la prolifération des armes à feu et les moyens insuffisants de la justice pénale.
Concernant le facteur « insuffisance des moyens de la justice pénale », les problèmes suivants ont été identifiés : le nombre insuffisant de détectives et de juges, ainsi que l’incapacité des détectives à mener à terme les enquêtes judiciaires. Cet état de fait a pour conséquence directe, les faibles taux de condamnation observés dans la plupart des pays africains au sud du Sahara. La probabilité qu’un meurtre ou un assassinat débouche sur une condamnation est de 11 % en Afrique, contre 56 % aux États-Unis et 61% au Royaume-Uni (Economist Intelligence Unit, 2005).
Selon le même rapport des Nations-unies (2005), la faiblesse des systèmes de justice pénale en Afrique, tant au niveau des effectifs des principaux acteurs que sont les policiers et les juges, qu’au niveau des méthodes d’investigation, ouvre de nouvelles voies à la criminalité latente, à savoir la prolifération des armes à feu. La multiplication des conflits dans tout le continent et le sentiment croissant d’insécurité, facilite et aggrave la criminalité violente. Le nombre de décès causés par les armes à feu, en dehors des conflits, par exemple, à la suite de suicides ou d’homicides, est estimé à 200 000 par an (Nation-Unies, 2005). Le nombre de décès le plus élevé a été enregistré en Amérique Latine et dans les Caraïbes. L’Afrique vient au deuxième rang avec 18 % du total mondial. Le nombre de décès est compris entre 4,2 et 6,5 pour 100 000 habitants (Nation-Unies, 2005). Environ 35 % des homicides en Afrique sont commis au moyen d’une arme à feu (Commission de l’Union Africaine, 2004).
Si le développement est le processus qui permet l’évolution des sociétés, alors, la criminalité agit comme une sorte d’« anti-développement », et détruit les rapports de confiance sur lesquels repose la société. Du point de vue de l’économie du développement, la criminalité amenuise le capital social et humain. Des travaux de recherche menés par la Banque Mondiale, laissent supposer que le capital social est essentiel au développement, et que la criminalité peut détruire ce capital (Moser & Holland, 1997 ; Lock, 1999). En Amérique Latine et aux Caraïbes, une analyse a prouvé que « l’accumulation nette de capital humain » a été réduite de moitié au cours des 15 dernières années, pour cause de criminalité et de violence (Londono, 1996 ; Davis & Tebilcock, 1999).
Les répercussions de la criminalité sur le développement économique sont tout autant notables. Selon le Service « Riskwire » de « Economist Intelligence Unit », qui évalue la situation sécuritaire dans certains pays pour des hommes d’affaires étrangers, sur un total de 59 pays évalués à travers le monde, dont 6 africains, l’Afrique du Sud a reçu l’évaluation du risque la plus favorable en occupant la 29ème place mondiale. Le Kenya et le Nigeria ont respectivement occupé les 54ème et
59ème places (Economist Intelligence Unit, 2005). Dans les évaluations par pays, la criminalité et la
justice pénale figurent parmi les sujets qui préoccupent le plus, la plupart des pays subsahariens. C’est la raison pour laquelle, la justice pénale devrait se doter de moyens modernes d’investigation, afin de prévenir et lutter efficacement contre la criminalité, en général, et les meurtres ou homicides en particulier. Un de ces moyens demeure les sciences criminalistiques au service de la justice pénale. Celles-ci comprennent entres autres disciplines, l’Entomologie Forensique ou dans une moindre mesure, l’Entomologie Médico-légale.
L'entomologie médico-légale qui est une composante des sciences criminalistiques légales, regroupe tous les aspects de l'utilisation des insectes nécrophages au service de la justice pénale. Elle permet, à partir d’insectes nécrophages observés sur un cadavre, de dater le décès. La datation post mortem est un préalable à toute enquête judiciaire qui débute en principe, par deux questions essentielles : à quand remonte le décès et quelle en est la cause ?
L’utilisation des insectes pour dater un décès nécessite leur identification, et surtout une connaissance de certains aspects de leur biologie et de leur écologie.
En Côte d’Ivoire, la littérature mentionne très peu de travaux sur les insectes nécrophages, notamment ceux d’Adou (2014) portant sur l’anthropologie médico-légale, puis ceux de Dao et al. (2017) et de Yapo et al. (2017), relatifs à la biologie, respectivement, de Sarcophaga carnaria et de Lucilia sericata. Cependant, aucun travail répertoriant les insectes nécrophages, intervenant tout au long du processus de décomposition d’un cadavre de mammifère exposé à l’air libre, n’a été fait. De plus, aucune donnée relative à l’impact des paramètres climatiques sur la biologie, l’écologie et l’éthologie des insectes nécrophages, n’est disponible. Or, ces données locales sont essentielles pour une expertise d’entomologie médico-légale.
Dans le cadre de ces travaux, les questions de recherche suivantes ont été abordées :
· d’un point du vue entomologique, quels sont les insectes nécrophages qui colonisent un cadavre de mammifère exposé à l’air libre, en zone guinéenne de Côte d’Ivoire ? Et quel est le processus de colonisation qui en découle ?
· quels rôles jouent ces insectes nécrophages dans le processus de décomposition d’un cadavre exposé à l’air libre ?
· les principaux Diptères nécrophages utilisés pour la datation post mortem, sont-ils capables de coloniser un cadavre exposé à l’air libre, à n’importe quelle période de l’année ?
L’objectif global de ce travail de recherche, est donc de connaître les insectes nécrophages de Côte d'Ivoire, afin d’établir une base de données locale, permettant à moyen et long termes, l’utilisation de ces derniers dans une expertise médico-légale pour dater les décès.
Plus spécifiquement, il s’agit de :
® inventorier les insectes nécrophages récoltés sur un cadavre de porc exposé à l’air libre, en zone guinéenne de Côte d’Ivoire, en vue de mettre en relief, le processus de colonisation qui en découle ;
® déterminer la contribution des différents groupes d’insectes nécrophages, dans le processus de décomposition d’un cadavre de porc exposé à l’air libre ;
® suivre la dynamique des populations, des principaux Diptères nécrophages d’intérêt médico-légal.
En rapport avec les questions de recherche ci-dessus posées, les hypothèses suivantes ont été vérifiées :
1. lorsqu’un cadavre est exposé à l’air libre, en zone guinéenne de Côte d’Ivoire, une grande diversité d’insectes nécrophages colonise celui-ci, selon un ordre d’apparition lié à l’état de décomposition cadavérique ;
2. lorsque ces insectes colonisent le cadavre exposé à l’air libre, ils induisent par leurs diverses actions au sein de l’écosystème-cadavre, une importante perte pondérale ;
3. les principaux Diptères nécrophages utilisés pour la datation post mortem, sont capables de coloniser un cadavre de mammifère exposé à l’air libre, quelle que soit la période de l’année.
Le présent document a été structuré en 3 parties :
- la première partie présente les généralités relatives aux insectes nécrophages et leur action au sein de l’écosystème-cadavre ;
- la deuxième présente la zone d’étude, le matériel et les méthodes utilisés ;
- la troisième partie expose les principaux résultats obtenus suivis de la discussion. Une conclusion et des perspectives mettent fin à ce travail.
Ce chapitre consacré aux généralités traite des sujets relatifs à la faune entomologique nécrophage et son rôle dans la décomposition d’un cadavre de mammifère animal et/ou humain ainsi que de la colonisation de ce dernier par les insectes. Il fait également mention de leur utilisation en expertise d'entomologie médico-légale pour dater les décès dans le cadre d’enquête criminelle, lors de la découverte d’un cadavre. Compte tenu de la quasi inexistence de données sur les insectes nécrophages en Afrique, en général, et en Côte d’ Ivoire, en particulier, la quasi-totalité des informations et des illustrations abordée dans ce chapitre tire sa source des travaux scientifiques effectués en Amérique et en Europe, voire en Asie.
1.1. Faune entomologique impliquée dans le processus de colonisation d’un cadavre de mammifère exposé à l’air libre
1.1.1. Diversité spécifique de la faune entomologique nécrophage d’un cadavre de mammifère exposé à l’air libre
Les insectes font partie des arthropodes qui sont des animaux invertébrés caractérisés par un exosquelette rigide et la présence de pattes articulées. Au sein de cette classe, on trouve de nombreux ordres déterminés, notamment grâce à la morphologie des ailes. Bien que les escouades décrites par Mégnin (1894) donnent un aperçu de l’ensemble des insectes nécrophages qui se succèdent sur un cadavre pour le coloniser, la composition spécifique de l’entomofaune nécrophage peut varier d’un continent à un autre, d’un pays à un autre, et même dans un même pays, d’une localité à une autre. Il n’en demeure pas moins que certaines espèces soient couramment rencontrées sur presque tous les continents. Ces espèces appartiennent à quatre principaux ordres qui sont les Diptères, les Coléoptères, les Hyménoptères et les Lépidoptères. Parmi celles-ci, certaines sont fréquentes et largement répandues tandis que d’autres sont plus sporadiques. Dans le cadre de l’entomologie médico-légale, les espèces les plus représentées sont des Diptères appartenant aux familles des Calliphoridae, des Muscidae et des Sarcophagidae (Wyss & Chérix, 2006).
1.1.1.1. Ordre des Diptères
L’ordre des Diptères compte à ce jour, environ 150 000 espèces réparties à travers le monde. Par exemple, environ 30 espèces de Diptères nécrophages sont communément trouvées en France. C’est le quatrième ordre après celui des Coléoptères, des Hyménoptères et des Lépidoptères. Parmi les Diptères, seules les mouches ont aujourd’hui un intérêt en entomologie médico-légale. Les mouches nécrophages sont recensées dans plusieurs familles de Diptères (26 familles sont fréquemment citées dans la littérature), mais seules six familles sont couramment rencontrées sur les cadavres humains et y effectuent leur cycle de développement. Il s’agit des Calliphoridae, des
Sarcophagidae, des Fanniidae, des Muscidae, des Piophilidae et des Phoridae (Byrd & Castner, 2001 ; Wyss & Chérix, 2006).
a. Morphologie générale des Diptères nécrophages
Les Diptères nécrophages appartiennent au sous-ordre des Brachycères (antennes courtes avec moins de 6 segments) et au groupe des Cyclorrhaphes. Ils sont caractérisés par la présence d’une seule paire d’ailes antérieures, les ailes postérieures étant transformées en balanciers ou haltères. Le mésothorax est très développé, en relation fonctionnelle avec les muscles du vol, tandis que le prothorax et le métathorax ont régressés (Figures 1 et 2). Au sein des Diptères, les Brachycères adultes présentent des antennes courtes et trapues à leur base. Les larves sont hémicéphales ou acéphales (capsule céphalique très réduite) et les mandibules sont présentes sous forme de crochets mobiles ventraux insérés verticalement. Les Schizophores présentent une cicatrice frontale correspondant à la trace du ptilinum, un organe spécialisé que l’insecte gonfle pour briser la pupe. Cette suture est absente chez les Aschizes. Enfin, les Schizophores sont divisés en Acalyptères et Calyptères (Tableau I) ; ces derniers présentant des cuillerons thoraciques bien développés, contrairement aux Acalyptères (Delvare & Alberlenc, 1989).
b. Quelques aspects de la biologie des Diptères associés aux cadavres
Les Diptères nécrophages sont des insectes à métamorphose complète (holométabole). La larve est très différente de l’insecte adulte. Contrairement aux espèces appartenant à la famille des Sarcophagidae qui sont larvipares, la plupart des Diptères nécrophages sont ovipares (Byrd & Castner, 2001). Durant sa vie éphémère, une mouche femelle peut pondre entre 600 et 2 000 œufs selon les espèces. Ceux-ci sont plus ou moins oblongs (1 à 2 mm de long) et blancs, de forme allongée et ovale. Le cycle de développement s’articule en différentes étapes et transformations. Si la mouche pond partout, les larves et pupes exigent des conditions spécifiques pour se développer. Après un à deux jours, les œufs éclosent et donnent des larves apodes et acéphales, généralement blanchâtres (asticots). Celles-ci sont très voraces et muent plusieurs fois pendant 9 à 10 jours. La durée de développement de chaque stade est dépendante de la température (fonction linéaire) et est différente pour chaque espèce (Wyss & Chérix, 2006). Ces asticots vont passer par trois stades larvaires. Les larves de stade L3 sont les plus voraces. Les larves possèdent des capteurs sensoriels qui leur
permettent de percevoir leur environnement (odeur, température, humidité, composants chimiques et lumière) et de se déplacer vers les sites plus favorables à leur survie : sous les abreuvoirs, au milieu de la litière, sur de la matière organique en décomposition, etc. La masse larvaire qu’elles forment est très active et peut dépouiller très rapidement, un cadavre de ses chairs (Haskell et al., 1997). Peu de
Figure 1 : Morphologie générale d’une mouche, vue dorsale. (Anonyme, 2018a)
Tableau I : Classification dichotomique (sens vertical) simplifiée des principales familles de Diptères (Delvare & Alberlenc, 1989).
Brachycères Cyclorrhaphes
Aschizes Schizophores
Phoridae
Syrphidae
Haplostomates (Acalyptères) Thecostomates (Calyptères) Ephydridoides
Drosophilidae Tachinidés Calliphoriens
Calliphoridae Sarcophagidae Tetanoceroides Piophilidae Sepsidae Muscidés Muscinae Anthomyiinae (Fannia) Scatophagidoides Sphaeroceridae Heleomyzidae
temps après, les larves L3 s’immobilisent dans des endroits secs (le long des murs, au pied des poteaux
etc.) et prennent la forme d’un petit tonneau, appelé pupe, dont la peau se sclérifie et se mélanise au fur et à mesure que le temps passe. Ce changement de couleur plus ou moins marqué est une des techniques utilisées pour dater l’âge des pupes (Haskell et al., 1997). Une dizaine de jours plus tard, le sommet de la pupe se déchire et une mouche adulte (encore appelée imago) émerge. Mais plus il fait chaud et humide, plus le cycle est rapide. L’ensemble du cycle de développement peut ainsi se dérouler en 8 à 12 jours au cours de l’été, de la ponte de l’œuf à la mouche adulte (Figure 3). L’adulte a une durée de vie très variable selon les espèces et selon la température : de 8 (35°C) 51 jours (16°C).
c. Familles de Diptères nécrophages les plus fréquentes sur les cadavres humains et/ou animaux
ü Calliphoridae (1100 espèces mondiales) – Blow flies
Les Calliphoridae sont des Diptères de taille moyenne (4 à 16 mm) avec des reflets métalliques bleus (Calliphora), verts (Lucilia), bronzes ou noirs (Chinery, 1988 ; Byrd & Castner, 2001). Il s’agit d’une famille très importante en entomologie forensique (Figure 4). En effet, les Calliphoridae (blow flies) sont les premières à arriver sur le corps (dans les minutes qui suivent le décès), pour autant qu’il soit accessible et que les conditions climatiques leur soient propices (Smith, 1986 ; Anderson, 2001). Les Calliphoridae sont des insectes holométaboles (métamorphose complète). On distingue les stades de croissance suivants : l’œuf, les trois stades larvaires (L1, L2, L3), les larves migrantes (stade
prépupal), la pupe (ou nymphe) et enfin l’adulte appelé imago ou insecte parfait. Les Calliphoridae pondent à proximité des orifices naturels (nez, bouche, anus, organes génitaux), dans les plis cutanés, au niveau des plaies, le sang étant un élément très attractif même coagulé. (Amendt et al., 2004 ; Wyss & Chérix, 2006 ; Gennard, 2007). Les larves L1 sont incapables de percer la peau et donc ont
besoin d’un substrat protéique liquide pour se nourrir. Les larves L2 sont munies de crochets buccaux
et peuvent sécréter des enzymes protéolytiques leur permettant de perforer la peau (trous circulaires) et de progresser dans la colonisation du corps. Le troisième stade est le plus actif et se nourrit abondamment des tissus en décomposition. Après le stade L3, les larves vont cesser de s’alimenter et
se disperser en vue de leur métamorphose (Gomes et al., 2006). Elles peuvent migrer à plusieurs mètres du corps et vont soit s’enfoncer dans le sol (milieu naturel) entre 5 et 20 cm de profondeur, soit se dissimuler dans les vêtements, tapis, literies, sous les meubles des habitations, etc. (Turner, 2005 ; Gomes et al., 2006 ; Wyss & Chérix, 2006). L’arrivée de ces insectes sur le cadavre permet d’estimer un intervalle post-mortem court (Byrd & Castner, 2001 ; Wyss & Chérix, 2006). Selon Anderson (2001), les espèces nécrophages appartenant à cette famille, ont généralement un comportement diurne (pontes en journée) et ne volent pas par temps pluvieux.
Figure 3 : Cycle de développement de la mouche domestique Musca domestica (Anonyme, 2018b)
Figure 4 : Quelques espèces de Calliphoridae. A – Lucilia sericata. B – Calliphora vicina. C – Calliphora vomitoria. D – Chrysomya albiceps (Anonyme, 2018c).
Stade L1
Stade L2
Stade L3
A B
ü Sarcophagidae (2600 espèces mondiales) – Flesh flies
Les Sarcophagidae sont des Diptères assez trapus de 2 à 22 mm de longueur (Figure 5). Les espèces de cette famille se reconnaissent aisément par la présence d’un motif à damier (bandes ou tâches grisées) sur le thorax ou l’abdomen et par l’absence de coloration métallique (Wyss & Chérix, 2006). On retrouve des espèces de Sarcophagidae aussi bien au début du processus de décomposition du corps qu’aux stades les plus avancés (Byrd & Castner, 2001). Les adultes se retrouvent généralement sur les fleurs tandis que les larves se nourrissent de matières animales en décomposition ou d’excréments (Byrd & Castner, 2001 ; Wyss & Chérix, 2006).
ü Muscidae (4000 espèces mondiales) – Muscid flies
Les Muscidae sont une famille assez hétérogène. La taille de la mouche adulte peut fortement varier entre 2 et 18 mm (Figure 6). Les mouches de cette famille sont généralement de couleur terne (Wyss & Chérix, 2006). Beaucoup d’espèces de Muscidae sont ubiquistes et synanthropiques. On les retrouve souvent dans les habitations (Byrd & Castner, 2001).
ü Fanniidae (270 espèces mondiales)
Les Fanniidae sont des petites mouches (4 à 9 mm) qui se rencontrent principalement dans l’hémisphère nord (Wyss & Chérix, 2006). Elles sont généralement de couleur foncée (noire ou grise) avec parfois des tâches jaunes sur l’abdomen (Wyss & Chérix, 2006). Selon Wyss & Chérix (2006), on les rencontre préférentiellement dans les milieux boisés et sont plus rares en milieux ouverts (Figure 7).
ü Piophilidae (75 espèces mondiales) – Skipper flies
Les Piophilidae sont des Diptères de petite taille (2,5 à 6 mm de longueur), de couleur sombre mate ou brillante (Wyss & Chérix, 2006). D’après les travaux de Byrd & Castner (2001), elles se retrouvent dans de nombreux micro habitats tels que les charognes, les déchets humains, les os, les peaux et les fourrures (Figure 8).
ü Phoridae (3000 espèces mondiales) – Humpbacked flies
Les Phoridae sont également des Diptères de petite taille (1,5 à 6 mm de longueur) de couleur brune, noire ou jaunâtre (Wyss & Chérix, 2006). Contrairement à beaucoup d’autres espèces de Diptères, les Phoridae sont capables de coloniser les corps inhumés (Bourel et al., 2004). Selon Dewaele & Leclercq (2002), quatre espèces ont été observées sur des cadavres humains en Europe : Conicera tibialis Schmitz (« coffin fly »), Triphleba hyalinata Meigen, Megaselia rufipes Meigen et M. scalaris Loew (Figure 9).
Figure 5 : Quelques espèces de Sarcophagidae. A – Sarcophaga carnaria. B – Sarcophaga africa. C – Sarcophaga argyrostoma. D – Sarcophaga tibialis (Anonyme, 2018c).
Figure 6 : Quelques espèces de Muscidae. A – Musca domestica. B – Stomoxys calcitrans (Anonyme, 2018c).
A B
C D
Figure 7 : Quelques espèces de Fanniidae. A – Fannia lustrator. B – Fannia canicularis (Anonyme, 2018c).
Figure 8 : Quelques espèces de Piophilidae. A – Piophila casei. B – Stearibia nigriceps (Anonyme, 2018c).
Figure 9 : Quelques espèces de Phoridae. A - Conicera tibialis. B - Triphleba hyalinata (Anonyme, 2018c).
A B
A B
1.1.1.2. Ordre des Coléoptères
L’ordre des Coléoptères est l’ordre des insectes le plus important en nombre d’espèces (avec environ 370 000 décrites au monde). On les trouve pratiquement sur tous les continents.
a. Morphologie générale des Coléoptères nécrophages
Les coléoptères sont caractérisés par un exosquelette particulièrement dur. Cette structure constitue également la première paire d'ailes (élytres). L'anatomie générale est assez uniforme à travers l'ordre, bien que les organes et les appendices puissent varier considérablement en apparence. Comme tous les insectes, leur corps est divisé en trois sections: la tête, le thorax et l'abdomen (Figure 10).
La tête est largement sclérifiée et varie en taille. Les pièces buccales sont de type broyeuse et elles se retrouvent à l'avant de la tête. Les yeux sont composés et très variable d'une famille à l'autre. Les antennes sont les organes principaux pour l'odorat. Ils peuvent également servir d'organes tactiles pour analyser l'environnement, de moyen de communication pour l'accouplement ou encore de moyen de défense. Les antennes sont très variables chez les familles de Coléoptères. De plus, au sein de la même espèce, on retrouve également de légères différences entre les sexes. On retrouve plusieurs types d'antennes, les principales sont : filiforme, moniliforme, capitiforme, claviforme, styliforme, serriforme, pectiniforme, lamelliforme, et flabelliforme. Les Coléoptères ont des pièces buccales similaires à l'ordre des Orthoptères. Parmi ces pièces, on retrouve les mandibules, qui apparaissent comme de grandes pinces sur le devant de la tête. Elles se déplacent horizontalement et servent à saisir, écraser ou couper la nourriture ou les ennemis. Chez certaines espèces, les mandibules des mâles sont très développées et nettement élargis comparativement à celle des femelles (Gilliott, 1995).
Le thorax est segmenté en deux parties distinctes : le pro et le ptérathorax. Le ptérathorax comprend le mésothorax et le métathorax fusionnés. C'est également la partie du corps à laquelle les trois paires de pattes sont attachées (Powell, 2009).
Les pattes sont composées de plusieurs segments : coxa, trochanter, fémur, tibia et tarse. Ce dernier est segmenté généralement en deux ou cinq articles. À l'extrémité, on retrouve des griffes, généralement une paire. Les pattes servent principalement pour la locomotion et elles peuvent être de différentes formes. Certains Coléoptères, comme les Scarabées et certains Carabes, ont des pattes élargies et épineuses du type fouisseuses pour les aider à creuser. D'autres possèdent des fémurs plus larges et peuvent réaliser des bonds assez impressionnants, comme chez les Altises et certaines espèces de Charançons.
Les ailes antérieures, appelées élytres, sont connectées au ptérathorax. Elles sont épaisses et opaques. Les élytres ne sont pas utilisés lors du vol. Au repos, ils couvrent et protègent les ailes
Figure 10 : Vue dorsale de la morphologie générale d’un insecte appartenant à l’ordre des Coléoptères (Anonyme, 2018d). Antenne Œil composé Pronotum Elytre Fémur Tibia Tarses Tête Thorax Abdomen
postérieures, qui sont membraneuses et plus fragiles. Chez certains Coléoptères, la capacité de voler a été perdue. Par exemple certaines femelles de la famille des Phengodidae et des Lampyridae ne possèdent ni ailes et ni élytres (Powell, 2009).
L'abdomen qui est postérieur au thorax, est la partie derrière le métathorax et est composé d'une série d'anneaux. Ces segments possèdent une série de petits trous, appelés stigmates, qui permettent à l'insecte de respirer. Les deux principaux types sont les tergites (sur la face dorsale) et les sclérites (sur la face ventrale). Ces deux plaques sont articulées latéralement (pleure) par un repli membranaire (conjonctive) extensible, appelé repli tégumentaire pleural. Chez la plupart des Coléoptères, les tergites sont membraneux et elles sont cachées sous les élytres au repos. Les sclérites sont généralement plus larges et ils sont bien visibles sous l'abdomen. Leur niveau de sclérification peut être très variable. L'abdomen n'a pas d'appendices, mais quelques insectes Coléoptères tels que les Mordellidae ont des lobes sternaux articulés (Arnett et al., 2002).
b. Quelques aspects de la biologie des Coléoptères associés aux cadavres de mammifère Durant sa vie, une femelle peut produire une dizaine à plusieurs milliers d'œufs. Ces derniers sont pondus en fonction du substrat sur lequel les larves se développeront. Les soins parentaux apportés aux œufs varient selon les espèces, allant de la simple pose d'œuf sous une feuille à la construction de structures souterraines spécialisées (Powell, 2009). Chez la Chrysomèle Mimosestes amicus, on retrouve une stratégie de ponte d'œufs non fécondés, empilés sur des œufs fécondés, de manière à les protéger des parasitoïdes (Deas & Hunter, 2011).
Comme chez les Coléoptères adultes, les larves sont très variées en apparence (Figure 11). C'est généralement au stade de larve que l'insecte s'alimente le plus. Une fois sortie de l'œuf, elles ont tendance à être très voraces. Chez les phytophages, certaines espèces se nourrissent des parties externes des végétaux tels que le feuillage, la tige, les fleurs ou encore les fruits. Les larves de plusieurs familles, comme celles de Carabidae, de Coccinellidae, de Dytiscidae et de Staphylinidae sont prédatrices. La période larvaire est très variable selon les espèces et les conditions environnementales présentes (Gilliott, 1995). Pour compléter leur développement, les larves de Coléoptères passent par plusieurs mues. Chez la plupart des espèces, la larve gagne en poids et en taille au cours de sa croissance. C'est ce qu'on appelle une métamorphose du type holométabole. On rencontre également des familles qui pratiquent un autre type de métamorphose qualifiée d’hyper métabole. Dans ce type de développement, la larve de type triongulin est très mobile pour ensuite devenir une larve plus sédentaire. On retrouve l'hyper métamorphose chez les Meloidae et certains Staphylinidae, comme le genre Aleochara. Comme chez la plupart des Ptérygotes, à la fin du stade larvaire, la larve se transforme en nymphe. A partir de cette nouvelle forme, il en émergera un adulte entièrement formé. La nymphe qui ressemble à l'adulte, est généralement de couleur pâle avec
Figure 11 : Différentes formes de larves de Coléoptères nécrophages. A – Larve de Staphylinidae. B – Larve de Cleridae. C – Larve de Dermestidae. D – Larve de Histeridae (Anonyme, 2018d)
A B
les pattes et les antennes recroquevillées sur son corps. Elle est restreinte en mouvement, souvent immobile et n'a pas de mandibules. C'est donc un stade très sensible pour la prédation. Chez certaines espèces, la larve creuse une cavité ou se fabrique un abri à l'aide de matière organique pour pouvoir amorcer sa transformation (Eiseman & Charney, 2010).
c. Familles de Coléoptères nécrophages les plus fréquentes sur les cadavres humains et/ou animaux
La grande majorité appartient aux Dermestidae, aux Staphylinidae, aux Silphidae, aux Nitidulidae, aux Geotrupidae et aux Histeridae (Byrd & Castner, 2001 ; Wyss & Chérix, 2006).
Les larves et adultes de Dermestidae sont nécrophages, mais interviennent très tardivement dans le processus de décomposition, lorsque les tissus sont complètement momifiés et que seuls subsistent la peau et les os. Les Histeridae et les Silphidae regroupent de nombreuses espèces nécrophages intervenant généralement durant la période de décomposition active des tissus. Enfin, les Staphylinidae sont très fréquents, mais majoritairement nécrophiles. Ils chassent activement et peuvent donc influer fortement sur le processus de colonisation et de décomposition de petits cadavres, où les populations de larves de Diptères sont restreintes.
L’utilisation des Coléoptères en tant que bio indicateurs en entomologie forensique, n’en est toutefois qu’à ses prémisses. Cependant, lorsqu’une dépouille est à un stade de décomposition avancée, et qu’il ne reste plus que des tissus squelettiques secs, l’utilisation de certains Coléoptères (Dermestidae et Cleridae) peut se révéler pertinente (Kulshrestha & Satpathy, 2001).
ü Cleridae (3400 espèces mondiales) - Bone/Checkered beetles
Les Cleridae sont des insectes de petite taille (3 à 12 mm) avec une pilosité assez marquée et des couleurs vives (Figure 12). Les larves et les adultes sont prédateurs des œufs et des larves de Diptères nécrophages. On peut les rencontrer sur les cadavres à différents stades de décomposition, mais ils affectionnent plus particulièrement les stades avancés (Wyss & Chérix, 2006).
ü Histeridae (3900 espèces mondiales) - Clown beetles
Les Histeridae sont généralement assez petits (rarement plus de 10 mm) et de couleur noire avec un éclat brillant (Figure 13). Il s’agit d’une famille aux mœurs très variés. On les retrouve dans de nombreux milieux dont les cadavres où ils chassent les larves de Diptères. Ils peuvent exercer une prédation très importante sur les asticots et ainsi réduire de façon significative le nombre de larves de Diptères sur le cadavre (Byrd & Castner, 2001 ; Wyss & Chérix, 2006).
Figure 12 : Quelques espèces de Cleridae. A – Necrobia rufipes. B – Corynetes ruficornis (Anonyme, 2018d).
Figure 13 : Quelques espèces de Histeridae. A – Margarinitus brunneus. B – Hister unicolor (Anonyme, 2018d).
A B
ü Dermestidae (1000 espèces mondiales) - Skin beetles
Les Dermestidae sont de petite taille (2 à 12 mm). Leur corps est arrondi, recouvert de poils ou d’écailles de couleurs variées et formant des dessins caractéristiques. Les espèces du genre Dermestes se retrouvent sur les cadavres lorsque les tissus sont desséchés, mais peuvent également être présents plus tôt (Wyss & Chérix, 2006). Ils se nourrissent de divers types de matière organique sèche (Figure 14).
ü Staphylinidae (29 000 espèces mondiales) - Rove beetles
Les Staphylins sont reconnaissables à leur morphologie. Contrairement aux autres Coléoptères, leurs élytres ne recouvrent pas la totalité de leur abdomen (Figure 15). La taille des adultes varie fortement d’une espèce à l’autre, soit de 1 à 25 mm (Byrd & Castner, 2001). On les rencontre souvent dans les matières en décomposition où ils chassent d’autres petits insectes (Byrd & Castner, 2001). Sur les cadavres, ils sont généralement prédateurs des larves de Diptères nécrophages. Ils sont présents rapidement sur le corps et peuvent y rester tant qu’il y a une activité de prédation (Wyss & Chérix, 2006).
ü Silphidae (139 espèces mondiales) – Carrion beetles
La famille des Silphidae regroupe des individus de taille moyenne à grande (10 à 35 mm) avec des antennes en massue et un sens de l’olfaction très développé (Chinery, 1988 ; Byrd & Castner, 2001). En Europe occidentale, par exemple, trois sous-familles de Silphidae existent : les Nicrophorinae, les Silphinae et les Agyrtinae (Hastir & Gaspar, 2001 ; Wyss & Chérix, 2006).
Les Nicrophorinae sont des insectes de grande taille (généralement supérieure à 15 mm) et de couleur noire avec des élytres généralement ornées de bandes ou de taches orangées. On les rencontre généralement seul ou en couple sur les cadavres. Ils ont un comportement «fouisseur». Les petits cadavres (oiseaux, rongeurs, etc.) sont rapidement enfouis dans le sol. La femelle creuse des galeries sous le corps afin d’y pondre et d’y entasser des débris putréfiés qui serviront à alimenter sa descendance. Nicrophorus humator Olivier (14 à 25 mm) est une espèce que l’on rencontre fréquemment sur les cadavres de petits animaux, principalement en milieu forestier du printemps à l’été (Hastir & Gaspar, 2001).
Les Silphinae sont de taille moyenne à grande (habituellement inférieure à 20 mm) avec une forme généralement aplatie et de couleur foncée. Leur comportement est très proche de celui des Nicrophorinae, à l’exception qu’ils n’enterrent pas les corps. Silpha littoralis L. (16 à 23 mm) est une espèce que l’on retrouve sur les grandes charognes et parfois sous les amas d’algues en décomposition (Hastir & Gaspar, 2001).
Figure 14 : Quelques espèces de Dermestidae. A – Dermestes maculatus. B – Anthrenus fuscus (Anonyme, 2018d).
Figure 15 : Quelques espèces de Staphylinidae. A – Creophilus maxillosus. B – Philonthus succicola (Anonyme, 2018d).
A
B
La sous-famille des Agyrtinae rassemble des individus de plus petite taille et de couleur brune (Figure 16). Leur éthologie est actuellement peu connue. Ils semblent se nourrir de cadavres et d’escargots (Hastir & Gaspar, 2001 ; Wyss & Chérix, 2006). La seule espèce belge connue est Agyrtes castaneux F. et est carnassière (Hastir, 2002).
ü Nitidulidae (3000 espèces mondiales) – Sap beetles
Selon Byrd & Castner (2001), les Nitidulidae sont des insectes de petite taille (4 à 12 mm), ayant généralement une forme ovale ou allongée (Figure 17). On les trouve sous les écorces d’arbres, les champignons ainsi que dans les matières végétales et animales en décomposition. Certaines espèces du genre Omosita se rencontrent avec les Dermestes sur les cadavres, mais contrairement à ces derniers, elles tolèrent une plus grande humidité du substrat (Wyss & Chérix, 2006).
ü Geotrupidae (Environ 40 espèces en Europe) - Dung beetles
La famille des Geotrupidae comporte des Coléoptères de taille moyenne à grande (18 à 25 mm), de couleur foncée avec généralement des reflets métalliques. La plupart des géotrupes sont coprophages, mais certaines espèces du genre Geotrupes semblent pouvoir se nourrir de cadavres humains (Wyss & Chérix, 2006).
1.1.1.3. Ordre des Hyménoptères
Les Hyménoptères adultes sont pourvus de 4 ailes membraneuses et de pièces buccales du type broyeur-lécheur. La tête est séparée du thorax par un cou très mince caractéristique. En France, par exemple, ils sont principalement représentés par des guêpes prédatrices Apocrites. On trouve également des guêpes parasitoïdes de la famille des Pteromalidae, notamment Nasonia vitripennis W., 1836 qui pondent leurs œufs dans les pupes de Diptères Calliphoridae (Figure 18). Certaines espèces de fourmis (Formicidae) sont également nécrophages et peuvent laisser des lésions caractéristiques sur les cadavres. Mais en général, ces fourmis sont prédatrices des larves de Diptères nécrophages.
1.1.1.4. Ordre des Lépidoptères
Les Lépidoptères, sous leur forme adulte (papillons), sont caractérisés par deux paires d’ailes membraneuses recouvertes d’écailles colorées, un corps couvert d’un épais revêtement de soies et des pièces buccales succeuses (trompe). Peu d’espèces sont associées aux cadavres. Elles interviennent généralement tardivement, surtout durant la phase de rancissement des graisses et lorsque les tissus sont desséchés. Les espèces les plus fréquentes appartiennent à la famille des Tineidae.
Figure 16 : Quelques espèces de Silphidae. A – Nicrophorus humator. B – Tanatophilus sinuatus (Anonyme, 2018d).
Figure 17 : Quelques espèces de Nitidulidae. A - Epuraea melanocephala. B - Stelidota coenosa (Anonyme, 2018e).
Figure 18 : Hyménoptère parasitoïde (guêpe) des Diptères nécrophages : Nasonia vitripennis (Anonyme, 2018f).
A B
![Figure 28 : Humidités Relatives moyennes mensuelles enregistrées au cours des années 2012, 2013 et 2014 au niveau de la ville d’Abidjan [SODEXAM (Société d'Exploitation et de Développement Aéroportuaire, Aéronautique et Météorologique)]](https://thumb-eu.123doks.com/thumbv2/123doknet/14747045.756314/74.892.189.703.643.1068/humidités-relatives-enregistrées-exploitation-développement-aéroportuaire-aéronautique-météorologique.webp)
![Figure 35 : Durées totales mensuelles d’insolation enregistrées d’août 2015 à septembre 2016 sur l’ensemble des trois sites expérimentaux [SODEXAM (Société d'Exploitation et de Développement Aéroportuaire, Aéronautique et Météorologique)]](https://thumb-eu.123doks.com/thumbv2/123doknet/14747045.756314/81.892.193.705.142.512/mensuelles-enregistrées-expérimentaux-exploitation-développement-aéroportuaire-aéronautique-météorologique.webp)





