DOYENS HONORAIRES :
1962 – 1969 : Professeur Abdelmalek FARAJ 1969 – 1974 : Professeur Abdellatif BERBICH
1974 – 1981 : Professeur Bachir LAZRAK 1981 – 1989 : Professeur Taieb CHKILI
1989 – 1997 : Professeur Mohamed Tahar ALAOUI 1997 – 2003 : Professeur Abdelmajid BELMAHI
2003 – 2013 : Professeur Najia HAJJAJ – HASSOUNI
ADMINISTRATION :
Doyen
Professeur Mohamed ADNAOUI
Vice Doyen chargé des Affaires Académiques et estudiantines
Professeur Mohammed AHALLAT
Vice Doyen chargé de la Recherche et de la Coopération
Professeur Taoufiq DAKKA
Vice Doyen chargé des Affaires Spécifiques à la Pharmacie
Professeur Jamal TAOUFIK
Secrétaire Général
Mr. Mohamed KARRA
UNIVERSITE MOHAMMED V
1-
ENSEIGNANTS-CHERCHEURS MEDECINS ET PHARMACIENSPROFESSEURS :
Décembre 1984
Pr. MAAOUNI Abdelaziz Médecine Interne – Clinique Royale Pr. MAAZOUZI Ahmed Wajdi Anesthésie -Réanimation
Pr. SETTAF Abdellatif pathologie Chirurgicale
Novembre et Décembre 1985
Pr. BENSAID Younes Pathologie Chirurgicale
Janvier, Février et Décembre 1987
Pr. LACHKAR Hassan Médecine Interne
Pr. YAHYAOUI Mohamed Neurologie
Décembre 1989
Pr. ADNAOUI Mohamed Médecine Interne –Doyen de la FMPR
Pr. OUAZZANI Taïbi Mohamed Réda Neurologie Janvier et Novembre 1990
Pr. HACHIM Mohammed* Médecine-Interne
Pr. KHARBACH Aîcha Gynécologie -Obstétrique
Pr. TAZI Saoud Anas Anesthésie Réanimation
Février Avril Juillet et Décembre 1991
Pr. AZZOUZI Abderrahim Anesthésie Réanimation –Doyen de la FMPO
Pr. BAYAHIA Rabéa Néphrologie
Pr. BELKOUCHI Abdelkader Chirurgie Générale Pr. BENCHEKROUN Belabbes Abdellatif Chirurgie Générale
Pr. BENSOUDA Yahia Pharmacie galénique
Pr. BERRAHO Amina Ophtalmologie
Pr. BEZZAD Rachid Gynécologie ObstétriqueMéd Chef Maternité des Orangers
Pr. CHERRAH Yahia Pharmacologie
Pr. CHOKAIRI Omar Histologie Embryologie
Pr. KHATTAB Mohamed Pédiatrie
Pr. SOULAYMANI Rachida Pharmacologie – Dir. du Centre National PV Rabat Pr. TAOUFIK Jamal Chimie thérapeutique V.D à la pharmacie+Dir du
CEDOC+Directeur du Médicament Décembre 1992
Pr. AHALLAT Mohamed Chirurgie Générale Doyen de FMPT
Pr. BENSOUDA Adil Anesthésie Réanimation
Pr. CHAHED OUAZZANI Laaziza Gastro-Entérologie
Pr. CHRAIBI Chafiq Gynécologie Obstétrique
Pr. FELLAT Rokaya Cardiologie
Pr. GHAFIR Driss* Médecine Interne
Pr. JIDDANE Mohamed Anatomie
Pr. TAGHY Ahmed Chirurgie Générale
Pr. ZOUHDI Mimoun Microbiologie
Mars 1994
Pr. BENJAAFAR Noureddine Radiothérapie
Pr. BEN RAIS Nozha Biophysique
Pr. CAOUI Malika Biophysique
Pr. CHRAIBI Abdelmjid Endocrinologie et Maladies Métaboliques Doyen de la FMPA
Pr. EL AMRANI Sabah Gynécologie Obstétrique
Pr. EL BARDOUNI Ahmed Traumato-Orthopédie
Pr. EL HASSANI My Rachid Radiologie
Pr. ERROUGANI Abdelkader Chirurgie Générale- Directeur CHIS -Rabat
Pr. ESSAKALI Malika Immunologie
Pr. ETTAYEBI Fouad Chirurgie Pédiatrique
Pr. HASSAM Badredine Dermatologie
Pr. IFRINE Lahssan Chirurgie Générale
Pr. MAHFOUD Mustapha Traumatologie – Orthopédie
Pr. RHRAB Brahim Gynécologie –Obstétrique
Pr. SENOUCI Karima Dermatologie
Mars 1994
Pr. ABBAR Mohamed* Urologie Directeur Hôpital My Ismail Meknès
Pr. ABDELHAK M’barek Chirurgie – Pédiatrique
Pr. BENTAHILA Abdelali Pédiatrie
Pr. BENYAHIA Mohammed Ali Gynécologie – Obstétrique Pr. BERRADA Mohamed Saleh Traumatologie – Orthopédie
Pr. CHERKAOUI Lalla Ouafae Ophtalmologie
Pr. LAKHDAR Amina Gynécologie Obstétrique
Pr. MOUANE Nezha Pédiatrie
Mars 1995
Pr. ABOUQUAL Redouane Réanimation Médicale
Pr. AMRAOUI Mohamed Chirurgie Générale
Pr. BAIDADA Abdelaziz Gynécologie Obstétrique
Pr. BARGACH Samir Gynécologie Obstétrique
Pr. DRISSI KAMILI Med Nordine* Anesthésie Réanimation
Pr. EL MESNAOUI Abbes Chirurgie Générale
Pr. ESSAKALI HOUSSYNI Leila Oto-Rhino-Laryngologie
Pr. HDA Abdelhamid* Cardiologie - Directeur du Service de Santé des FAR Pr. IBEN ATTYA ANDALOUSSI Ahmed Urologie
Pr. OUAZZANI CHAHDI Bahia Ophtalmologie
Pr. SEFIANI Abdelaziz Génétique
Pr. ZEGGWAGH Amine Ali Réanimation Médicale
Décembre 1996
Pr. AMIL Touriya* Radiologie
Pr. BELKACEM Rachid Chirurgie Pédiatrie
Pr. BOULANOUAR Abdelkrim Ophtalmologie
Pr. GAOUZI Ahmed Pédiatrie
Pr. MAHFOUDI M’barek* Radiologie
Pr. OUZEDDOUN Naima Néphrologie
Pr. ZBIR EL Mehdi* Cardiologie Directeur Hôp. Mil.d’Instruction Med V Rabat
Novembre 1997
Pr. ALAMI Mohamed Hassan Gynécologie-Obstétrique
Pr. BEN SLIMANE Lounis Urologie
Pr. BIROUK Nazha Neurologie
Pr. ERREIMI Naima Pédiatrie
Pr. FELLAT Nadia Cardiologie
Pr. KADDOURI Noureddine Chirurgie Pédiatrique
Pr. KOUTANI Abdellatif Urologie
Pr. LAHLOU Mohamed Khalid Chirurgie Générale
Pr. MAHRAOUI CHAFIQ Pédiatrie
Pr. TAOUFIQ Jallal Psychiatrie Directeur Hôp. Arrazi Salé
Pr. YOUSFI MALKI Mounia Gynécologie Obstétrique Novembre 1998
Pr. BENOMAR ALI Neurologie – Doyen de la FMP Abulcassis
Pr. BOUGTAB Abdesslam Chirurgie Générale
Pr. ER RIHANI Hassan Oncologie Médicale
Pr. BENKIRANE Majid* Hématologie
Janvier 2000
Pr. ABID Ahmed* Pneumophtisiologie
Pr. AIT OUMAR Hassan Pédiatrie
Pr. BENJELLOUN Dakhama Badr.Sououd Pédiatrie
Pr. BOURKADI Jamal-Eddine Pneumo-phtisiologie Directeur Hôp. My Youssef
Pr. CHARIF CHEFCHAOUNI Al Montacer Chirurgie Générale
Pr. ECHARRAB El Mahjoub Chirurgie Générale
Pr. EL FTOUH Mustapha Pneumo-phtisiologie
Pr. EL MOSTARCHID Brahim* Neurochirurgie
Pr. MAHMOUDI Abdelkrim* Anesthésie-Réanimation
Pr. TACHINANTE Rajae Anesthésie-Réanimation
Pr. TAZI MEZALEK Zoubida Médecine Interne
Novembre 2000
Pr. AIDI Saadia Neurologie
Pr. AJANA Fatima Zohra Gastro-Entérologie
Pr. BENAMR Said Chirurgie Générale
Pr. CHERTI Mohammed Cardiologie
Pr. ECH-CHERIF EL KETTANI Selma Anesthésie-Réanimation
Pr. EL HASSANI Amine Pédiatrie Directeur Hôp. Chekikh Zaied
Pr. EL KHADER Khalid Urologie
Pr. EL MAGHRAOUI Abdellah* Rhumatologie
Pr. GHARBI Mohamed El Hassan Endocrinologie et Maladies Métaboliques
Pr. MDAGHRI ALAOUI Asmae Pédiatrie
Décembre 2000
Pr. ZOHAIR ABDELAH* ORL
Décembre 2001
Pr. BALKHI Hicham* Anesthésie-Réanimation
Pr. BENABDELJLIL Maria Neurologie
Pr. BENAMAR Loubna Néphrologie
Pr. BENAMOR Jouda Pneumo-phtisiologie
Pr. BENELBARHDADI Imane Gastro-Entérologie
Pr. BENNANI Rajae Cardiologie
Pr. BENOUACHANE Thami Pédiatrie
Pr. BEZZA Ahmed* Rhumatologie
Pr. BOUCHIKHI IDRISSI Med Larbi Anatomie
Pr. BOUMDIN El Hassane* Radiologie
Pr. CHAT Latifa Radiologie
Pr. DAALI Mustapha* Chirurgie Générale
Pr. DRISSI Sidi Mourad* Radiologie
Pr. EL HIJRI Ahmed Anesthésie-Réanimation
Pr. EL MAAQILI Moulay Rachid Neuro-Chirurgie
Pr. EL MADHI Tarik Chirurgie-Pédiatrique
Pr. EL OUNANI Mohamed Chirurgie Générale
Pr. ETTAIR Said Pédiatrie Directeur. Hôp.d’Enfants Rabat
Pr. GAZZAZ Miloudi* Neuro-Chirurgie
Pr. HRORA Abdelmalek Chirurgie Générale
Pr. KABBAJ Saad Anesthésie-Réanimation
Pr. KABIRI EL Hassane* Chirurgie Thoracique
Pr. LAMRANI Moulay Omar Traumatologie Orthopédie
Pr. LEKEHAL Brahim Chirurgie Vasculaire Périphérique
Pr. MAHASSIN Fattouma* Médecine Interne
Pr. MEDARHRI Jalil Chirurgie Générale
Pr. MIKDAME Mohammed* Hématologie Clinique
Pr. MOHSINE Raouf Chirurgie Générale
Pr. NOUINI Yassine Urologie Directeur Hôpital Ibn Sina
Pr. SABBAH Farid Chirurgie Générale
Pr. SEFIANI Yasser Chirurgie Vasculaire Périphérique Pr. TAOUFIQ BENCHEKROUN Soumia Pédiatrie
Décembre 2002
Pr. AL BOUZIDI Abderrahmane* Anatomie Pathologique
Pr. AMEUR Ahmed * Urologie
Pr. AMRI Rachida Cardiologie
Pr. AOURARH Aziz* Gastro-Entérologie
Pr. BAMOU Youssef * Biochimie-Chimie
Pr. BELMEJDOUB Ghizlene* Endocrinologie et Maladies Métaboliques
Pr. BENZEKRI Laila Dermatologie
Pr. BENZZOUBEIR Nadia Gastro-Entérologie
Pr. BERNOUSSI Zakiya Anatomie Pathologique
Pr. BICHRA Mohamed Zakariya* Psychiatrie
Pr. CHOHO Abdelkrim * Chirurgie Générale
Pr. EL ALAMI EL FELLOUS Sidi Zouhair Chirurgie Pédiatrique
Pr. EL HAOURI Mohamed * Dermatologie
Pr. FILALI ADIB Abdelhai Gynécologie Obstétrique
Pr. HAJJI Zakia Ophtalmologie
Pr. IKEN Ali Urologie
Pr. JAAFAR Abdeloihab* Traumatologie Orthopédie
Pr. KRIOUILE Yamina Pédiatrie
Pr. MABROUK Hfid* Traumatologie Orthopédie
Pr. MOUSSAOUI RAHALI Driss* Gynécologie Obstétrique
Pr. OUJILAL Abdelilah Oto-Rhino-Laryngologie
Pr. RACHID Khalid * Traumatologie Orthopédie
Pr. RAISS Mohamed Chirurgie Générale
Pr. RGUIBI IDRISSI Sidi Mustapha* Pneumophtisiologie
Pr. RHOU Hakima Néphrologie
Pr. SIAH Samir * Anesthésie Réanimation
Pr. THIMOU Amal Pédiatrie
Pr. ZENTAR Aziz* Chirurgie Générale
Janvier 2004
Pr. ABDELLAH El Hassan Ophtalmologie
Pr. AMRANI Mariam Anatomie Pathologique
Pr. BENBOUZID Mohammed Anas Oto-Rhino-Laryngologie
Pr. BENKIRANE Ahmed* Gastro-Entérologie
Pr. BOUGHALEM Mohamed* Anesthésie Réanimation
Pr. BOULAADAS Malik Stomatologie et Chirurgie Maxillo-faciale
Pr. BOURAZZA Ahmed* Neurologie
Pr. CHAGAR Belkacem* Traumatologie Orthopédie
Pr. CHERRADI Nadia Anatomie Pathologique
Pr. EL FENNI Jamal* Radiologie
Pr. EL HANCHI ZAKI Gynécologie Obstétrique
Pr. EL KHORASSANI Mohamed Pédiatrie Pr. EL YOUNASSI Badreddine* Cardiologie
Pr. HACHI Hafid Chirurgie Générale
Pr. JABOUIRIK Fatima Pédiatrie
Pr. KHARMAZ Mohamed Traumatologie Orthopédie
Pr. MOUGHIL Said Chirurgie Cardio-Vasculaire
Pr. OUBAAZ Abdelbarre* Ophtalmologie
Pr. TARIB Abdelilah* Pharmacie Clinique
Pr. TIJAMI Fouad Chirurgie Générale
Pr. ZARZUR Jamila Cardiologie
Janvier 2005
Pr. ABBASSI Abdellah Chirurgie Réparatrice et Plastique Pr. AL KANDRY Sif Eddine* Chirurgie Générale
Pr. ALLALI Fadoua Rhumatologie
Pr. AMAZOUZI Abdellah Ophtalmologie
Pr. AZIZ Noureddine* Radiologie
Pr. BAHIRI Rachid Rhumatologie Directeur. Hôp. Al Ayachi Salé
Pr. BARKAT Amina Pédiatrie
Pr. BENYASS Aatif Cardiologie
Pr. DOUDOUH Abderrahim* Biophysique
Pr. HAJJI Leila Cardiologie (mise en disponibilité)
Pr. HESSISSEN Leila Pédiatrie
Pr. JIDAL Mohamed* Radiologie
Pr. LAAROUSSI Mohamed Chirurgie Cardio-vasculaire
Pr. LYAGOUBI Mohammed Parasitologie
Pr. RAGALA Abdelhak Gynécologie Obstétrique
Pr. SBIHI Souad Histo-Embryologie Cytogénétique
Pr. ZERAIDI Najia Gynécologie Obstétrique
Avril 2006
Pr. ACHEMLAL Lahsen* Rhumatologie
Pr. AKJOUJ Said* Radiologie
Pr. BELMEKKI Abdelkader* Hématologie
Pr. BENCHEIKH Razika O.R.L
Pr. BIYI Abdelhamid* Biophysique
Pr. BOUHAFS Mohamed El Amine Chirurgie - Pédiatrique
Pr. BOULAHYA Abdellatif* Chirurgie Cardio – Vasculaire
Pr. CHENGUETI ANSARI Anas Gynécologie Obstétrique
Pr. DOGHMI Nawal Cardiologie
Pr. FELLAT Ibtissam Cardiologie
Pr. FAROUDY Mamoun Anesthésie Réanimation
Pr. HARMOUCHE Hicham Médecine Interne
Pr. HANAFI Sidi Mohamed* Anesthésie Réanimation
Pr. IDRISS LAHLOU Amine* Microbiologie
Pr. JROUNDI Laila Radiologie
Pr. KARMOUNI Tariq Urologie
Pr. KILI Amina Pédiatrie
Pr. KISRA Hassan Psychiatrie
Pr. KISRA Mounir Chirurgie – Pédiatrique
Pr. LAATIRIS Abdelkader* Pharmacie Galénique
Pr. LMIMOUNI Badreddine* Parasitologie
Pr. MANSOURI Hamid* Radiothérapie
Pr. OUANASS Abderrazzak Psychiatrie
Pr. SAFI Soumaya* Endocrinologie
Pr. SEKKAT Fatima Zahra Psychiatrie
Pr. SOUALHI Mouna Pneumo – Phtisiologie
Pr. TELLAL Saida* Biochimie
Pr. ZAHRAOUI Rachida Pneumo – Phtisiologie
Decembre 2006
Pr SAIR Khalid Chirurgie générale Dir. Hôp.Av.Marrakech
Octobre 2007
Pr. ABIDI Khalid Réanimation médicale
Pr. ACHACHI Leila Pneumo phtisiologie
Pr. ACHOUR Abdessamad* Chirurgie générale
Pr. AIT HOUSSA Mahdi* Chirurgie cardio vasculaire
Pr. AMHAJJI Larbi* Traumatologie orthopédie
Pr. AOUFI Sarra Parasitologie
Pr. BALOUCH Lhousaine* Biochimie-chimie
Pr. BENZIANE Hamid* Pharmacie clinique
Pr. BOUTIMZINE Nourdine Ophtalmologie
Pr. CHARKAOUI Naoual* Pharmacie galénique
Pr. EHIRCHIOU Abdelkader* Chirurgie générale
Pr. EL BEKKALI Youssef * Chirurgie cardio-vasculaire
Pr. ELABSI Mohamed Chirurgie générale
Pr. EL MOUSSAOUI Rachid Anesthésie réanimation
Pr. EL OMARI Fatima Psychiatrie
Pr. GHARIB Noureddine Chirurgie plastique et réparatrice
Pr. HADADI Khalid* Radiothérapie
Pr. ICHOU Mohamed* Oncologie médicale
Pr. ISMAILI Nadia Dermatologie
Pr. KEBDANI Tayeb Radiothérapie
Pr. LALAOUI SALIM Jaafar* Anesthésie réanimation
Pr. LOUZI Lhoussain* Microbiologie
Pr. MADANI Naoufel Réanimation médicale
Pr. MAHI Mohamed* Radiologie
Pr. MARC Karima Pneumo phtisiologie
Pr. MASRAR Azlarab Hématologie biologique
Pr. MRANI Saad* Virologie
Pr. OUZZIF Ez zohra* Biochimie-chimie
Pr. RABHI Monsef* Médecine interne
Pr. RADOUANE Bouchaib* Radiologie
Pr. SEFFAR Myriame Microbiologie
Pr. SEKHSOKH Yessine* Microbiologie
Pr. SIFAT Hassan* Radiothérapie
Pr. TABERKANET Mustafa* Chirurgie vasculaire périphérique
Pr. TACHFOUTI Samira Ophtalmologie
Pr. TAJDINE Mohammed Tariq* Chirurgie générale
Pr. TANANE Mansour* Traumatologie orthopédie
Pr. TLIGUI Houssain Parasitologie
Pr. TOUATI Zakia Cardiologie
Décembre 2008
Pr TAHIRI My El Hassan* Chirurgie Générale
Mars 2009
Pr. ABOUZAHIR Ali* Médecine interne
Pr. AGDR Aomar* Pédiatre
Pr. AIT ALI Abdelmounaim* Chirurgie Générale Pr. AIT BENHADDOU El hachmia Neurologie
Pr. AKHADDAR Ali* Neuro-chirurgie
Pr. ALLALI Nazik Radiologie
Pr. AMINE Bouchra Rhumatologie
Pr. BELYAMANI Lahcen* Anesthésie Réanimation
Pr. BJIJOU Younes Anatomie
Pr. BOUHSAIN Sanae* Biochimie-chimie
Pr. BOUI Mohammed* Dermatologie
Pr. BOUNAIM Ahmed* Chirurgie Générale
Pr. BOUSSOUGA Mostapha* Traumatologie orthopédique Pr. CHTATA Hassan Toufik* Chirurgie vasculaire périphérique
Pr. DOGHMI Kamal* Hématologie clinique
Pr. EL MALKI Hadj Omar Chirurgie Générale
Pr. EL OUENNASS Mostapha* Microbiologie
Pr. ENNIBI Khalid* Médecine interne
Pr. FATHI Khalid Gynécologie obstétrique
Pr. HASSIKOU Hasna * Rhumatologie
Pr. KABBAJ Nawal Gastro-entérologie
Pr. KABIRI Meryem Pédiatrie
Pr. KARBOUBI Lamya Pédiatrie
Pr. LAMSAOURI Jamal* Chimie Thérapeutique
Pr. MARMADE Lahcen Chirurgie Cardio-vasculaire
Pr. MESKINI Toufik Pédiatrie
Pr. MESSAOUDI Nezha * Hématologie biologique
Pr. MSSROURI Rahal Chirurgie Générale
Pr. NASSAR Ittimade Radiologie
Pr. OUKERRAJ Latifa Cardiologie
Pr. RHORFI Ismail Abderrahmani * Pneumo-phtisiologie
Octobre 2010
Pr. ALILOU Mustapha Anesthésie réanimation
Pr. AMEZIANE Taoufiq* Médecine interne
Pr. BELAGUID Abdelaziz Physiologie
Pr. CHADLI Mariama* Microbiologie
Pr. CHEMSI Mohamed* Médecine aéronautique
Pr. DAMI Abdellah* Biochimie chimie
Pr. DARBI Abdellatif* Radiologie
Pr. DENDANE Mohammed Anouar Chirurgie pédiatrique
Pr. EL HAFIDI Naima Pédiatrie
Pr. EL KHARRAS Abdennasser* Radiologie
Pr. EL MAZOUZ Samir Chirurgie plastique et réparatrice
Pr. EL SAYEGH Hachem Urologie
Pr. ERRABIH Ikram Gastro entérologie
Pr. LAMALMI Najat Anatomie pathologique
Pr. MOSADIK Ahlam Anesthésie Réanimation
Pr. MOUJAHID Mountassir* Chirurgie générale
Pr. NAZIH Mouna* Hématologie biologique
Pr. ZOUAIDIA Fouad Anatomie pathologique
Decembre 2010
Mai 2012
Pr. AMRANI Abdelouahed Chirurgie Pédiatrique Pr. ABOUELALAA Khalil* Anesthésie Réanimation
Pr. BENCHEBBA Driss* Traumatologie Orthopédique
Pr. DRISSI Mohamed* Anesthésie Réanimation
Pr. EL ALAOUI MHAMDI Mouna Chirurgie Générale Pr. EL KHATTABI Abdessadek* Médecine Interne
Pr. EL OUAZZANI Hanane* Pneumophtisiologie
Pr. ER-RAJI Mounir Chirurgie Pédiatrique
Pr. JAHID Ahmed Anatomie pathologique
Pr. MEHSSANI Jamal* Psychiatrie
Pr. RAISSOUNI Maha* Cardiologie
*Enseignants Militaires
Février 2013
Pr. AHID Samir Pharmacologie – Chimie
Pr. AIT EL CADI Mina Toxicologie
Pr. AMRANI HANCHI Laila Gastro-Entérologie
Pr. AMOUR Mourad Anesthésie Réanimation
Pr. AWAB Almahdi Anesthésie Réanimation
Pr. BELAYACHI Jihane Réanimation Médicale
Pr. BELKHADIR Zakaria Houssain Anesthésie Réanimation
Pr. BENCHEKROUN Laila Biochimie-Chimie
Pr. BENKIRANE Souad Hématologie biologique
Pr. BENNANA Ahmed* Informatique Pharmaceutique
Pr. BENSGHIR Mustapha* Anesthésie Réanimation
Pr. BENYAHIA Mohammed* Néphrologie
Pr. BOUATIA Mustapha Chimie Analytique et Bromatologie
Pr. BOUABID Ahmed Salim* Traumatologie Orthopédie
Pr. BOUTARBOUCH Mahjouba Anatomie
Pr. CHAIB Ali* Cardiologie
Pr. DENDANE Tarek Réanimation Médicale
Pr. DINI Nouzha* Pédiatrie
Pr. ECH-CHERIF EL KETTANI Mohamed Ali Anesthésie Réanimation Pr. ECH-CHERIF EL KETTANI Najwa Radiologie
Pr. ELFATEMI Nizare Neuro-Chirurgie
Pr. EL GUERROUJ Hasnae Médecine Nucléaire
Pr. EL HARTI Jaouad Chimie Thérapeutique
Pr. EL JOUDI Rachid* Toxicologie
Pr. EL KABABRI Maria Pédiatrie
Pr. EL KHANNOUSSI Basma Anatomie Pathologie
Pr. EL KHLOUFI Samir Anatomie
Pr. EL KORAICHI Alae Anesthésie Réanimation
Pr. EN-NOUALI Hassane* Radiologie
Pr. ERRGUIG Laila Physiologie
Pr. GHFIR Imade Médecine Nucléaire
Pr. IMANE Zineb Pédiatrie
Pr. IRAQI Hind Endocrinologie et maladies métaboliques
Pr. KABBAJ Hakima Microbiologie
Pr. KADIRI Mohamed* Psychiatrie
Pr. LATIB Rachida Radiologie
Pr. MAAMAR Mouna Fatima Zahra Médecine Interne
Pr. MEDDAH Bouchra Pharmacologie
Pr. MELHAOUI Adyl Neuro-chirurgie
Pr. MRABTI Hind Oncologie Médicale
Pr. NEJJARI Rachid Pharmacognosie
Pr. OUBEJJA Houda Chirurgie Pédiatrique
Pr. OUKABLI Mohamed* Anatomie Pathologique
Pr. RAHALI Younes Pharmacie Galénique
Pr. RATBI Ilham Génétique
Pr. RAHMANI Mounia Neurologie
Pr. REDA Karim* Ophtalmologie
Pr. REGRAGUI Wafa Neurologie
Pr. RKAIN Hanan Physiologie
Pr. ROSTOM Samira Rhumatologie
Pr. ROUAS Lamiaa Anatomie Pathologique
Pr. ROUIBAA Fedoua* Gastro-Entérologie
Pr. SALIHOUN Mouna Gastro-Entérologie
Pr. SAYAH Rochde Chirurgie Cardio-Vasculaire
Pr. SEDDIK Hassan* Gastro-Entérologie
Pr. ZERHOUNI Hicham Chirurgie Pédiatrique
Pr. ZINE Ali* Traumatologie Orthopédie
Avril 2013
Pr. EL KHATIB Mohamed Karim* Stomatologie et Chirurgie Maxillo-faciale MAI 2013
Pr.BOUSLIMAN Yassir Toxicologie
MARS 2014
Pr. ACHIR Abdellah Chirurgie Thoracique
Pr. BENCHAKROUN Mohammed * Traumatologie- Orthopédie
Pr. BOUCHIKH Mohammed Chirurgie Thoracique
Pr. EL KABBAJ Driss * Néphrologie
Pr. EL MACHTANI IDRISSI Samira * Biochimie-Chimie
Pr. HARDIZI Houyam Histologie- Embryologie-Cytogénétique
Pr. HASSANI Amale * Pédiatrie
Pr. HERRAK Laila Pneumologie
Pr. JANANE Abdellah * Urologie
Pr. KOUACH Jaouad* Génycologie-Obstétrique
Pr. LEMNOUER Abdelhay* Microbiologie
Pr. MAKRAM Sanaa * Pharmacologie
Pr. OULAHYANE Rachid* Chirurgie Pédiatrique
Pr. RHISSASSI Mohamed Jaafar CCV
Pr. SABRY Mohamed* Cardiologie
Pr. SEKKACH Youssef* Médecine Interne
Pr. TAZI MOUKHA Zakia Génécologie-Obstétrique
AVRIL 2014
Pr.ZALAGH Mohammed ORL
PROFESSEURS AGREGES :
DECEMBRE 2014
Pr. ABILKASSEM Rachid* Pédiatrie
Pr. AIT BOUGHIMA Fadila Médecine Légale
Pr. BEKKALI Hicham * Anesthésie-Réanimation Pr. BENAZZOU Salma Chirurgie Maxillo-Faciale Pr. BOUABDELLAH Mounya Biochimie-Chimie
Pr. BOUCHRIK Mourad* Parasitologie Pr. DERRAJI Soufiane* Pharmacie Clinique Pr. DOBLALI Taoufik* Microbiologie Pr. EL AYOUBI EL IDRISSI Ali Anatomie
Pr. EL GHADBANE Abdedaim Hatim* Anesthésie-Réanimation Pr. EL MARJANY Mohammed* Radiothérapie
Pr. FEJJAL Nawfal Chirurgie Réparatrice et Plastique Pr. JAHIDI Mohamed* O.R.L
Pr. LAKHAL Zouhair* Cardiologie
Pr. OUDGHIRI Nezha Anesthésie-Réanimation Pr. RAMI Mohamed Chirurgie Pédiatrique Pr. SABIR Maria Psychiatrie
Pr. SBAI IDRISSI Karim* Médecine préventive, santé publique et Hyg.
AOUT 2015
Pr. MEZIANE Meryem Dermatologie Pr. TAHRI Latifa Rhumatologie
JANVIER 2016
Pr. BENKABBOU Amine Chirurgie Générale Pr. EL ASRI Fouad* Ophtalmologie Pr. ERRAMI Noureddine* O.R.L
JUIN 2017
Pr. ABI Rachid* Microbiologie Pr. ASFALOU Ilyasse* Cardiologie
Pr. BOUAYTI El Arbi* Médecine préventive, santé publique et Hyg. Pr. BOUTAYEB Saber Oncologie Médicale
Pr. EL GHISSASSI Ibrahim Oncologie Médicale Pr. OURAINI Saloua* O.R.L
Pr. RAZINE Rachid Médecine préventive, santé publique et Hyg. Pr. ZRARA Abdelhamid* Immunologie
* Enseignants Militaires
2- ENSEIGNANTS – CHERCHEURS SCIENTIFIQUES
PROFESSEURS / PRs. HABILITESPr. ABOUDRAR Saadia Physiologie
Pr. ALAMI OUHABI Naima Biochimie – chimie
Pr. ALAOUI Katim Pharmacologie
Pr. ALAOUI SLIMANI Lalla Naïma Histologie-Embryologie
Pr. ANSAR M’hammed Chimie Organique et Pharmacie Chimique
Pr. BARKIYOU Malika Histologie-Embryologie
Pr. BOUHOUCHE Ahmed Génétique Humaine
Pr. BOUKLOUZE Abdelaziz Applications Pharmaceutiques Pr. CHAHED OUAZZANI Lalla Chadia Biochimie – chimie
Pr. DAKKA Taoufiq Physiologie
Pr. FAOUZI Moulay El Abbes Pharmacologie
Pr. IBRAHIMI Azeddine Biologie moléculaire/Biotechnologie
Pr. KHANFRI Jamal Eddine Biologie
Pr. OULAD BOUYAHYA IDRISSI Med Chimie Organique
Pr. REDHA Ahlam Chimie
Pr. TOUATI Driss Pharmacognosie
Pr. ZAHIDI Ahmed Pharmacologie
Mise à jour le 10/10/2018 Khaled Abdellah Chef du Service des Ressources Humaines
A Allah
Tout puissant
Qui m’a inspiré
Qui m’a guidé dans le bon chemin
Je vous dois ce que je suis devenue
Louanges et remerciements
A mon cher Papa
Aucune dédicace ne saurait exprimer l’amour,
l’estime, le dévouement et le respect que j’ai
toujours eu pour vous.
Rien au monde ne vaut les efforts fournis jour et
nuit pour mon éducation et mon bien être.
Ce travail est le fruit de tes sacrifices que tu as
consentis pour mon éducation et ma formation.
Que le bon Dieu ait ton âme papa chéri...
Je t’aimerai à jamais mon doudou…
A ma chère Maman
Aucun mot, aussi expressif qu’il soit, ne saurait
remercier à sa juste valeur l’être qui a consacré
sa vie à parfaire notre éducation avec un
dévouement inégal associé à beaucoup de
sacrifice.
Vous vous êtes investi à me transmettre le sens de
la responsabilité, de la persévérance et de la
droiture.
Merveilleuse maman j'espère que j'ai été à la
hauteur de vos espérances.
Puisse Dieu vous garder longtemps auprès de
nous et vous bénir infiniment.
A tous les membres de ma famille, mes proches et
mes amis
Je vous dédie ce travail en témoignage de mon
amour et mon attachement.
Puisse nos liens se pérennisent et se consolident à
jamais.
Qu’il me soit permis aujourd’hui de vous assurer
ma profonde et infinie reconnaissance.
J’implore Dieu qu’il vous apporte bonheur,
amour et que vos rêves se réalisent.
A tous ceux qui ont contribué, de près ou de loin à
l'élaboration de ce travail.
A tous les professeurs auprès de qui j’ai eu l’honneur
d’apprendre.
A notre professeur Présidente de thèse
Professeur L.CHAT
Professeur de Radiologie à la faculté de Médecine et
de Pharmacie de Rabat.
Nous sommes très sensibles à l’honneur que vous nous
faites en acceptant la présidence de notre jury de thèse.
Vous nous avez accueillis avec beaucoup de gentillesse
et d’égard.
Vos compétences, vos qualités humaines et la richesse
de votre enseignement n’ont jamais cessé de susciter
en nous l’admiration la plus profonde.
Veuillez croire, chère professeur à notre estime et
notre respectueuse considération.
A notre Professeur et Rapporteur de thèse
Professeur L.BENCHEKROUN
Professeur de Biochimie-Chimie à la faculté de
Médecine et de pharmacie de Rabat.
Votre compétence, votre droiture et votre simplicité
sont autant de qualité qui font de vous quelqu’un
d’exceptionnel.
Vous nous avez fait l’honneur de nous suivre durant
ce travail et de veiller à son élaboration en offriront
votre temps et vos conseils.
Aucune dédicace ne saurait exprimer à sa juste valeur
nos vifs remerciements.
A notre professeur et juge de thèse
Professeur Y. KRIOUILE
Professeur de Pédiatrie à la faculté de Médecine et de
Pharmacie de Rabat.
Vous nous avez honorés d’accepter avec grande
sympathie de siéger parmi notre jury de thèse.
Veuillez trouvez ici l’expression de notre grand respect
et nos vifs remerciements.
A notre professeur et juge de thèse
Professeur S. BOUHSAIN
Professeur de Biochimie-Chimie à la faculté de
Médecine et de Pharmacie de rabat.
Vous avez accepté en toute simplicité de juger ce
travail et c'est pour nous un grand honneur de vous
voir siéger parmi notre jury de thèse.
Nos remerciements les plus sincères en hommage à
votre sympathie et votre disponibilité.
Permettez-nous de vous présenter dans ce travail, le
témoignage de notre profond respect.
Spécial remercîment A notre maître et juge honoraire :
Professeur L.CHABRAOUI
Professeur de Biochimie-Chimie à la faculté de
Médecine et de Pharmacie de Rabat.
Nous sommes très émus par la spontanéité avec
laquelle vous avez accepté de nous encadrer dans
notre travail suggéré par votre bienveillance,
Il est vrai que votre récente retraite ne vous permet
plus selon les réglementations de la faculté de
continuer notre encadrement mais on est très honoré
par votre présence parmi notre jury de thèse.
Nous vous remercions pour l’intérêt que vous avez
manifesté pour notre travail.
Nous avons apprécié votre sympathie et vos qualités
humaines.
Spécial remercîment A notre Docteur
Madame S.DAHRI
Docteur Biologiste et responsable de l’unité des
Aminoacidopathies et Aciduries organiques au niveau
de centre des maladies héréditaires de métabolisme au
sein de Laboratoire Central de Biochimie à CHU Ibn
Sina de Rabat-Salé.
Nous vous sommes infiniment reconnaissants du
grand honneur que vous nous faites en acceptant de
participer à l’élaboration de notre travail.
Vous nous avez guidés tout au long de notre travail en
nous apportant vos précieux et pertinents conseils.
Nous vous remercions pour votre patience et votre
soutien lors de la réalisation de cette thèse.
Veuillez trouver ici l'expression de notre respectueuse
considération et notre profonde admiration pour toutes
LISTE DES ABREVIATIONS ADN : Acide désoxyribonucléique.
AG-I: Acidurie glutarique type I. Ala: Alanine.
Arg: Arginine.
ARSA : Aryl sulfatase A. Asn: Asparagine.
Asp NAT: L-aspartate N-acétyl transférase. ASPA: Aspartoacylase.
ASPAKO: Aspartoacylase knockout. BHE: Barrière hémato-encéphalique. CA: Calcium acetate.
CCM : chromatographie sur couche mince. CD: Canavan disease.
CG-SM : Chromatographie en phase gazeuse couplée à la spectroscopie de
masse.
CSN : Cellules souches neuronales. CVS : cellules de villosités choriales.
FIV : Fécondation in vitro.
GCDH: Glutaryl Co-enzyme A déshydrogénase. GCPII: Glutamate carboxypeptidase II.
GFAP : glial fibrillary acidic protein. Glu: Glutamate.
Gly: Glycine.
GTA: Glycéryl triacétate. His: Histidine.
IRM : Imagerie par résonnance magnétique. LCR : Liquide céphalo-rachidien.
Li : Lithium.
LiC6H5O7 : Citrate de lithium. LiCl : Chloride de lithium. Lys : Lysine.
MRS : spectroscopie de résonance magnétique nucléaire. NAA : acide N-acétyl-aspartique.
NAAG: N-acétyl-aspartyl glutamate. NO : Nitric oxyde : Oxyde nitrique.
NOS : nitric oxyde synthase : Oxyde nitrique synthase inductible. OL : Oligodendrocyte.
PCR : Polymerase chain reaction : Amplification en chaine par polymérase. RE : Réticulum endoplasmique.
ROS: Reactive oxygen species = espèces réactives de l’oxygène. Ser : Serotonine.
SNC : Système nerveux central. SNP : Système nerveux périphérique. TDM: Tomodensitométrie.
Tyr: Tyrosine.
LISTE DES FIGURES
Figure 1: Réseau de cellules cérébrales...6 Figure 2 : Mécanismes de propagation de l'influx nerveux ...8 Figure 3 : Cycles de myélinisation dans le système nerveux central au cours du développement. ... 11 Figure 4 : Réaction d’hydrolyse de l'acide N-acétyl-L-aspartique par l’aspartoacylase. ... 17 Figure 5 : Structure chimique de la NAA... 18 Figure 6: Représentation schématique du métabolisme de NAA ... 20 Figure 7 : Théorie de la pompe à eau. ... 22 Figure 8: Théorie de la dysmyélinisation: ... 24 Figure 9 : Cerveau d’un nourrisson, décédé à l’âge de 16 mois et demi, incliné pour montrer les parties orbitales des pôles frontaux. ... 30 Figure 10 : Sections horizontales des lobes occipitaux (nourrisson décédé à l’âge de 16 mois et demi). ... 31 Figure 11 : Système de chromatographie en phase gazeuse (CG). ... 37 Figure 12 : profil des acides organiques urinaires d'un patient atteint de la maladie de Canavan ... 38 Figure 13 : Un garçon de 22 mois présentant la maladie de Canavan ... 45 Figure 14: caractéristiques chronologiques de l'imagerie par résonance magnétique (IRM) chez un patient attient de la maladie de Canavan. ... 46 Figure 15 : Caractéristiques de la spectroscopie de résonance magnétique chez une patiente japonaise atteinte de la maladie de Canavan 1. ... 48 Figure 16: Réaction d’hydrolyse de l'acide N-acétyl-L-aspartique par l’aspartoacylase. ... 52 Figure 17 : Schéma du chromosome 17 montrant la localisation du gène codant pour l’enzyme ASPA ... 53 Figure 18: Carte restreinte du gène humain de l’ASPA. ... 54 Figure 19 : Représentation schématique du gène ASPA et distribution de toutes les mutations publiées (jusqu’à septembre 2016). ... 55 Figure 20 : Expression de l'ARNm d'ASPA dans différents tissus humains. ... 57 Figure 21 : Monomère de la protéine ASPA ... 58 Figure 22 : Profil de la chromatographie d’acides organiques chez un individu souffrant d'acidurie glutarique, type 1 ... 61 Figure 23 : l’arbre généologique illustrant la transmission autosomique récessive de la maladie de Canavan. ... 71
LISTE DES TABLEAUX
Tableau I: Aperçu des leucodystrophies. ... 12 Tableau II : Mécanismes pathologiques responsables de la maladie de Canavan. ... 27 Tableau III : Taux de NAA au niveau des urines et du plasma de deux patients atteints de la maladie de Canavan. ... 50 Tableau IV : Activité de l'aspartoacylase dans les fibroblastes cutanés chez les patients atteints de la maladie de Canavan et chez les sujets témoins ... 51 Tableau V : Concentrations de l’Acide aspartique urinaire chez les patients atteints de la maladie de Canavan et les sujets témoins ... 53 Tableau VI: Concentrations de l’acide N-acétylaspartique dans le liquide amniotique et l’activité de l'aspartoacylase dans les cellules du liquide amniotique dans une grossesse à risque par rapport aux témoins. ... 73
SOMMAIRE
Introduction ...1 Généralités ...4 I. Rappels physiologiques sur le système nerveux central et sur les leucodystrophies. ...5 1. La myélinisation ...7 2. Les leucodystrophies ... 12 II. Maladie de Canavan. ... 13 1. Historique ... 13 2. Épidémiologie : ... 15 3. Physiopathologie : ... 17 3.1. Le substrat N-acétyl-L-aspartate (NAA). ... 17 3.1.1 Localisation et distribution de NAA. ... 18 3.1.2 Métabolisme de NAA. ... 19 3.2. Mécanismes pathologiques responsables de la maladie. ... 21 3.2.1 Théorie de la pompe à eau et du déséquilibre osmolytique : ... 21 3.2.2 Théorie de la dysmyélinisation :... 23 3.2.3 La déficience en acétate compromet la différenciation des oligodendrocytes ... 24 3.2.4 Théorie du repliement et de la stabilisation des protéines : ... 25 3.2.5 Théorie du stress oxydatif : ... 25 4. Neuropathologie: ... 29 Partie pratique : Cas clinique ... 32 Discussion ... 41 1. Aspect clinique ... 42 1.1. La forme néonatale : ... 42 1.2. La forme Infantile (sévère) de la maladie de Canavan. ... 43 1.3. La forme douce / juvénile de la maladie de Canavan. ... 44 2. Paraclinique : ... 45 2.1. Radiologie : ... 45
2.2. Bilan biochimie métabolique : ... 49 3. Etude moléculaire. ... 53 3.1. Le gène d’aspartoacylase : ... 53 3.2. L’enzyme : Aspartoacylase (ASPA) ... 56 4. Diagnostic différentiel ... 60 4.1. Acidurie glutarique type 1 :... 60 4.2. Maladie d'Alexander ... 61 4.3. Gangliosidose à GM2 : ... 62 5. Approches thérapeutiques. ... 63 5.1. Traitements palliatifs ... 63 5.2. Traitements symptomatiques ... 64 5.3. Approches thérapeutiques non génétiques ... 65 5.4. Perspectives et orientations futures de la thérapie génique ... 68 6. Diagnostic Anténatal : ... 70 Conclusion ... 74 Résumés
1
2
Introduction
La maladie de Canavan est une maladie autosomique récessive causée par des mutations de perte de fonction dans le gène codant pour l'aspartoacylase (ASPA) localisé sur le bras court du chromosome 17 (ASPA, NG_008399.1, NM_000049.2). Cette enzyme a pour rôle d’hydrolyser l'acide N-acétyl-L-aspartique en acide N-acétyl-L-aspartique et l'acide acétique.
Elle a été décrite à partir des découvertes histologiques de Myrtelle M. Canavan en 1931 et encore caractérisée par van Bogaert et Bertrand en 1949, mais il a fallu près de 60 ans pour trouver la cause moléculaire de la maladie par Matalon et al. en 1988.
La mutation du gène unique a des effets pléiotropes. Les observations histopathologiques sont une vacuolisation spongiforme du cerveau, des ventricules dilatés et une dysmyélinisation. Le nombre d'astrocytes protoplasmiques augmente et on observe que leurs mitochondries sont anormalement allongées avec des crêtes déformées, suggérant une altération du métabolisme énergétique.
En raison du manque d'aspartoacylase, son substrat, le N-acétyl-L-aspartate (NAA), un osmolyte majeur du cerveau, s'accumule et conduit à une accumulation d'eau, ce déséquilibre au niveau cellulaire entraîne un retard de développement, un retard mental, une macrocéphalie, une hypotonie et une spasticité musculaire. On remarque plus tardivement l’apparition d’une atrophie optique et des convulsions chez ses patients.
3
Il existe une grande variation dans l'évolution clinique de la maladie de Canavan et les différentes formes sont classées en fonction de l'apparition de la maladie sous une forme congénitale, infantile et juvénile.
La tomodensitométrie ainsi que l'imagerie par résonance magnétique (IRM) du cerveau des patients atteints de la maladie révèlent une dégénérescence diffuse de la substance blanche et un pic élevé de NAA se remarque dans la spectroscopie par résonance magnétique nucléaire.
Outre les tests génétiques, le diagnostic biologique comprend la mesure des taux de NAA dans le sang et les urines. Les taux de NAA dans le sang et le liquide céphalo-rachidien sont multipliés par trois et les taux urinaires sont multipliés par 50 par rapport aux taux normaux. Le niveau de NAA est également augmenté dans le liquide amniotique ce qui permet d’effectuer les tests prénataux.
Bien que les patients atteints de la maladie aient une durée de vie considérablement réduite vu que le pronostic de la maladie est sombre et meurent généralement avant l'âge de dix ans, certains patients atteignent toutefois la deuxième et même la troisième décennie de la vie.
Dans ce travail, nous mettons le point sur cette pathologie rare en décrivant l’observation clinique d’un nourisson atteint de cette maladie au Maroc et à la lumière des données de la littérature nous essayerons de dégager les aspects : épidémiologique, histologique, physiopathologique, clinique, génétique, thérapeutique et évolutif de cette maladie.
4
5
I. Rappels physiologiques sur le système nerveux central et sur les leucodystrophies.
Au cours de l'évolution, les eucaryotes supérieurs ont été contraints de s'adapter à des défis toujours croissants, entraînant une augmentation de la taille et de la complexité du système nerveux.
Le système nerveux des vertébrés est organisé dans le système nerveux central (SNC) comprenant le cerveau et la moelle épinière. Le reste du système nerveux appelé le système nerveux périphérique (SNP) est subdivisé en SNP somatique et autonome.
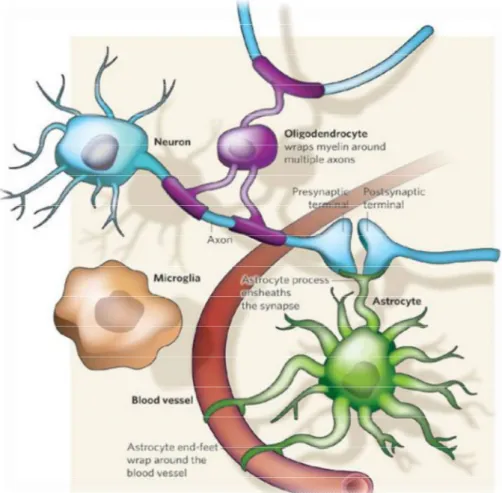
Notre cerveau ne représente que ~ 2% du poids corporel, mais consomme ~ 20% de l'oxygène total du corps et ~ 25% du glucose, montrant la grande activité et l'importance fondamentale de cet organe. Au-delà de cela, le cerveau humain contient des milliards de cellules, chacune ayant des rôles distincts, et forme plus de 100 000 milliards de synapses, démontrant la complexité de cet organe. Les types de cellules sont classés en neurones et en cellules gliales, ces dernières sont subdivisées en macroglia (astrocytes et oligodendrocytes) et en microglies [1].
Les cellules gliales ont été découvertes au 19ème siècle par Rudolph Virchow, qui les a considérées à tort comme de la «colle cérébrale» (grec «glia» = colle), fournissant un échafaudage pour soutenir la fonction neuronale. Cependant, les travaux des vingt dernières années indiquent un rôle plus polyvalent pour ces cellules et leur dysfonctionnement menant à plusieurs
6
maladies souligne l’importance fondamentale des cellules gliales dans le maintien du réseau cellulaire du cerveau [2].
Outre les neurones, la figure 1 lucide les différents types de cellules composant le cerveau. Les oligodendrocytes enveloppent les axones avec de la myéline pour accélérer la propagation du signal. Les astrocytes enferment les synapses et aident à la transmission du signal, ainsi que dans l'échange de facteurs avec le système sanguin sans oublier le rôle des microglies qui sont les cellules immunitaires résidentes du cerveau. [3]
7
1. La myélinisation :
La myéline est le constituant essentiel de la matière blanche dans le système nerveux central (la moëlle épinière et cerveau ), elle représente 40 à 50% de son poids sec.
La myéline est une membrane plasmique mal hydratée contenant 40% d'eau contrairement à la matière grise qui contient 80%.
Le poids sec de la myéline comprend 70% de lipides et 30% de protéines formés au niveau des oligodendrocytes (OL). Ce rapport lipide / protéine est très particulier à la membrane de myéline car c'est généralement l'inverse dans d'autres membranes cellulaires.
Sa composition unique (richesse en lipides et faible teneur en eau permettant l'isolation électrique des axones) et sa structure segmentaire unique responsable de la conduction saltatoire des impulsions nerveuses permettent la gaine de myéline de soutenir une conduction nerveuse rapide dans les fibres fines dans le système des vertébrés (figure 2). Conduction à grande vitesse, fidélité de la signalisation de transfert sur de longues distances, et économie spatiale sont les trois principaux avantages conférés au système nerveux des vertébrés grâce à la gaine de myéline [4].
8
Figure 2 : Mécanismes de propagation de l'influx nerveux [4].
A: conduction continue dans un axone non myélinisé.
B: conduction discontinue (saltatoire) de nœud à nœud dans un axone myélinisé. L'échelle d'amplitude est en millivolts.
Dans les diagrammes, les impulsions sont affichées dans leur étendue spatiale le long de la fibre à un instant donné.
Processus de myélinisation
La matière blanche et grise du cerveau et de la moelle épinière se distingue par la présence ou l’absence de gaines de myéline:
La matière blanche contient les axones myélinisés des neurones. (La couleur blanche provient des gaines de myéline).
9
La matière grise contient les portions non myélinisées des neurones (corps cellulaires, dendrites et terminaisons axonales), des axones non myélinisés et des névroglies.
La myélinisation du système nerveux périphérique précède celle du SNC. En effet, le processus débute dans les racines de la moelle épinière. Les racines motrices sont myélinisées avant les racines sensitives. Inversement dans le SNC ce sont les neurones sensitifs qui sont myélinisés avant les neurones moteurs.
Les cellules gliales responsables de la myélinisation du système nerveux ont des origines embryonnaires distinctes:
1. Les cellules gliales responsables de la myélinisation du SNC sont les oligodendrocytes, issus de la zone ventriculaire du neuroépithélium du tube neural.
2. Les cellules gliales responsables de la myélinisation du SNP sont les cellules de Schwann, issues des crêtes neurales.
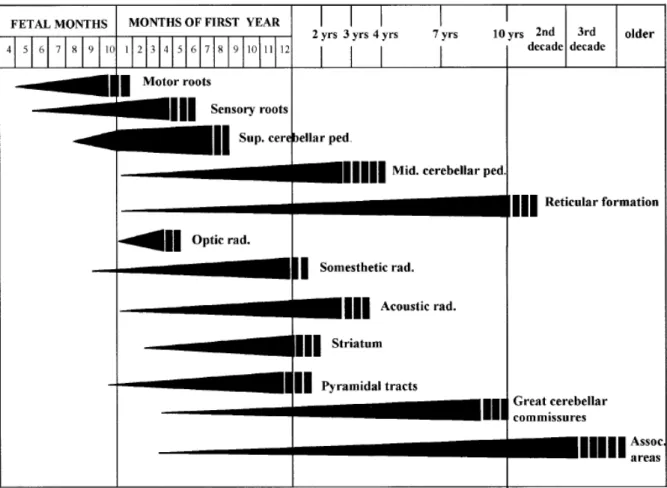
La première myélinisation est observée dès la 16ème semaine de gestation, dans la colonne de Burdach, mais ne prend son envol qu'à partir de la 24ème semaine. Elle n’atteint sa maturité qu’à deux ans environ et peut se poursuivre jusqu'à l'âge de 20 ans dans certaines fibres corticales, notamment les zones associatives, du coup, elle est étroitement lié aux étapes du développement. La progression de la myélinisation est prévisible et respecte quelques règles générales simples; la myélinisation progresse de :
1. centrale au périphérique. 2. caudale à rostrale.
10 4. sensorielle puis motrice.
Dans un premier temps, les cellules multi-traitées pré-oligodendrogliales se déposent le long des faisceaux de fibres de la future matière blanche, en conservant la capacité de se diviser. En effet, les mitoses sont présentes dans les rangées gliales longitudinales inter-fasciculaires. Deuxièmement, ces pré-oligodendrocytes deviennent des pré-oligodendrocytes immatures, caractérisés par l'acquisition de marqueurs spécifiques et prêts pour la myélinisation. Chaque oligodendrocyte émet plusieurs prolongements qui s'enroulent autour de différents axones adjacents. L'oligodendrocyte enroule sa membrane plasmique en couches superposées qui forment une spirale sur un segment d'axone ou internode (segment de fibre nerveuse entre deux nœuds de Ranvier). Les segments adjacents sont séparés par les nœuds de Ranvier, dépourvus de myéline où s'insèrent les prolongements des astrocytes [5].
11
Figure 3 : Cycles de myélinisation dans le système nerveux central au cours du
développement.
La largeur et la longueur des graphiques indiquent une progression de l'intensité de la coloration correspondant à la densité des fibres myélinisées; les bandes verticales à la fin des graphiques indiquent la tranche d'âge approximative de la fin de la myélinisation estimée à partir de la comparaison des tissus fœtaux et postnatals avec les tissus des adultes au cours des trois décennies suivantes. [6]
12
2. Les leucodystrophies : [7]
Le mot "leucodystrophie" est d'origine grecque (leucos - blanc, dysentresse, trophe - nutrition) et désigne un groupe de troubles neurodégénératifs essentiellement héréditaires caractérisés par des anomalies dans la formation ou le maintien de la gaine de myéline (dé / dysmyélinisation) dans le SNC, souvent aussi dans les nerfs périphériques.
Les bases moléculaires de ces maladies sont des mutations génétiques dans les cellules formant la myéline, les oligodendrocytes ou une défaillance de la myélinisation secondaire à un dysfonctionnement neuronal ou astroglial. Cela conduit à une rupture de l'interaction oligodendrocyte-neurone et par la suite à une perturbation du traitement de l'information.
À ce jour, plus de 20 maladies ont été identifiées comme leucodystrophies et sont classées en fonction de leurs organites cellulaires ou de leurs caractéristiques histologiques. Le tableau I résume les différents types de leucodystrophies et leurs causes et effets.
13
II. Maladie de Canavan. 1. Historique : [8]
1928: Globus et Strauss ont initialement reconnu la maladie de Canavan comme
étant une dégénérescence spongieuse du cerveau.
1931 : Myrtelle M. Canavan a décrit la maladie à partir de ces découvertes
histologiques.
1949 : Van Bogaert et Bertrand ont identifié les caractéristiques pathologiques
de la maladie et son lien avec l’origine familiale et ethnique en se basant sur une étude réalisée chez trois nourrissons Ashkénazes.
1964: Les études de Banker et al sur la transmission génétique de la maladie de
Canavan permettent de déduire que le mode de transmission est autosomique récessif.
1987-1988 : Hagenfeldt et al. et Matalon et al. ont pu respectivement trouvé la
cause moléculaire de la maladie. Ils ont révélé qu'une anomalie dans le métabolisme de l'acide N-acétylaspartique (NAA) causait la maladie de Canavan.
1994 : Kaul et al. ont déterminé l'organisation génomique du gène ASPA
humain et sa localisation au niveau du chromosome 17 humain.
1995 : Shaag et al. ont trouvé une variété de mutations dans le gène
aminoacylase-2 (ACY2) chez les patients non juifs atteints de la maladie de Canavan.
14
1999 : Matalon et Michals-Matalon ont établi l'évolution clinique de la maladie
de Canavan et ses différentes formes classées en fonction de l'apparition de la maladie sous une forme congénitale, infantile et juvénile.
2000 : Matalon et Michals-Matalon ont décrit les signes clinques relatifs à la
maladie de Canavan représentés par un retard de développement, un retard mental, une macrocéphalie, une hypotonie et une spasticité musculaire, une atrophie optique et des convulsions plus tardives.
15
2. Épidémiologie :
Bien que la maladie de Canavan se produit dans tous les groupes ethniques, la plupart des cas ont été déclaré chez les individus d'origine juive ashkénaze [9].
La maladie de Canavan est plus fréquente chez les personnes d’origine juives ashkénazes, avec une incidence de 1/6400 à 1 / 13.500 de la population [10].
La maladie de Canavan est beaucoup moins fréquente dans la population non juive avec une incidence de 1/ 200 000 à 1/ 400 000 dans différents pays tels que la Pologne orientale, la Lituanie et la Russie occidentale et l'Arabie Saoudite [11].
Les taux de portage pour des mutations causant la maladie de Canavan dans les populations non-Juifs n’est pas connue; cependant, il est supposé être beaucoup plus faible que le taux de portage dans la population juive ashkénaze [9] qui est estimé à 1/40 [8].
Au sein de la population ashkénaze, deux mutations, E285A (glutamine285 à alanine) et Y231X (tyrosine231 à codon terminal), représentent 98% des allèles de la maladie. En revanche, 50% des patients CD non ashkénaze qui sont d'origine européenne exprime la mutation A305E (alanine305-à-glutamine) [12].
16
Même si aucun cas n’a été rapporté au Maroc jusqu’à 2005; Zayed, H. soupçonne qu’il existe quelques juifs marocains qui sont porteurs ou qu’ils ont la maladie car aux Etats-Unis, il réside plus de 100.000 Juifs marocains et plus d’1 million d'Israéliens (15% de la population) sont d’origine marocaine.
Compte tenu de la fréquence da la maladie de Canavan parmi la population juive (y compris les juifs marocains), les marocains devraient montrer une fréquence considérable [13].
17
3. Physiopathologie :
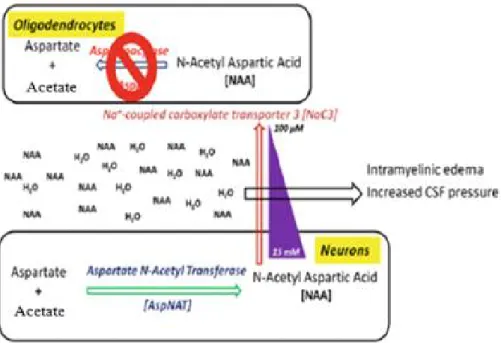
La maladie de Canavan ou la maladie de Canavan-van Bogaert-Bertrand) ; (Hérédité mendélienne en ligne numéro Man 271900) [11] ; (CD; # 271900 MIM) [13] est une maladie neurodégénérative [8, 14] présentée par une leucodystrophie progressive récessive autosomique héréditaire [13, 15] relativement rare [8]. Elle résulte de la déficience de l’aspartoacylase (ASPA; NP_000040.1) (autres noms: aminoacylase 2 / N-acétylaspartate amidohydrolase d'acides: ASPA / ACY2, EC # 3.5.1.15). [14]
Cette enzyme hydrolyse l'acide N-acétyl-L-aspartique en acide aspartique et l'acide acétique [11] selon la réaction suivante :
Figure 4 : Réaction d’hydrolyse de l'acide N-acétyl-L-aspartique par
l’aspartoacylase.
Le déficit de l’aspartoacylase conduit à l'accumulation de la N-acétyl-L-aspartate (NAA) dans le cerveau [16].
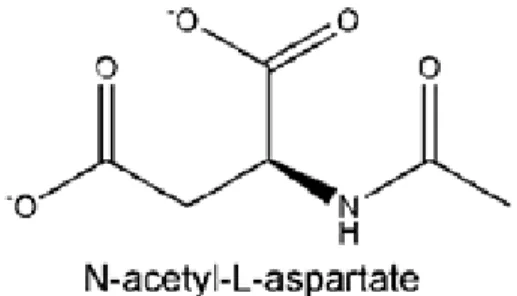
3.1. Le substrat N-acétyl-L-aspartate (NAA).
NAA est parmi les acides aminés libres les plus abondants dans le cerveau. Il a été isolé pour la première fois dans le cerveau du chat et du rat par Tallan et
18
al. en 1956. C'est un dérivé d'acide aminé avec un groupe amino-acétylé, portant deux charges négatives au pH physiologique [17].
Figure 5 : Structure chimique de la NAA. 3.1.1 Localisation et distribution de NAA.
Bien que les plus grandes quantités de NAA aient été trouvées dans le cerveau des mammifères et des oiseaux, les amphibiens et les poissons contiennent également de NAA. De plus, il n'est pas limité au SNC, il a été aussi observé dans le SNP et l'œil des vertébrés, mais en très faible quantité [18, 19].
En raison de ses fortes concentrations dans le cerveau et de son profil IRM bien caractérisé, il est utilisé comme marqueur de substitution pour la détermination non invasive de la densité et de l'intégrité neuronale [20].
L'établissement d'anticorps spécifiques contre le NAA a permis de déterminer sa localisation cellulaire [21] ; ainsi, le NAA était présent dans la plupart des populations de cellules neuronales, mais à des concentrations variables [22, 23].
Les études ont montré que, dans le SNC, le NAA se trouve principalement dans les neurones [19]. Cependant, des études plus récentes ont révélé que les
19
progéniteurs des oligodendrocytes, et probablement les oligodendrocytes matures, contenaient également de NAA [22, 24].
3.1.2 Métabolisme de NAA.
Le NAA est synthétisé à partir d'acétylcoenzyme A (Ac CoA) et d'aspartate dans les mitochondries des neurones par l'acétyl CoA / aspartate N-acétyltransférase 8L (ANAT, Nat8L, EC2.3.1.17) [25]. Le NAA est probablement également produit en microsomes [26].
Les niveaux intracellulaires de NAA se maintiennent à une concentration de 20 mM avec un gradient intracellulaire / extracellulaire supérieur à 200 [27].
Après stimulation, le NAA est libéré dans le liquide extracellulaire (ECF), absorbé par les oligodendrocytes, où le NAA est clivé en aspartate et en acétate. Ce dernier peut servir de source d'acétate pour la synthèse des lipides de la myéline, tandis que l'aspartate est recyclé dans les neurones.
Le dipeptide N-acétyl-aspartylglutamate (NAAG) est une autre source de NAA. Le NAAG est aussi synthétisé dans les neurones à partir du NAA et du glutamate catalysés par la NAAG synthase (NAAGS, EC.2.3.1.1) [28], sa concentration cellulaire est maintenue à 1 mM [27].
Après sa libération dans le liquide extracellulaire (ECF), le NAAG peut être clivé par la NAAG peptidase (glutamate carboxypeptidase II; folh1; EC 3.4.17.21), située à la surface des astrocytes. Alors que le NAA est encore métabolisé dans les oligodendrocytes. Le glutamate est absorbé par les astrocytes et converti en glutamine avant son retour vers les neurones [27].
20
Pris ensemble, le système NAA lie la communication intercellulaire entre les neurones, les astrocytes et les oligodendrocytes et est donc appelé « le système d’exploitation » du cerveau [27].
Figure 6: Représentation schématique du métabolisme de NAA [27] . NAA : N-acétyl-L-aspartate; NAAG : N-acétyl-aspartylglutamate; ANAT :
acétyl CoA / aspartate N-acétyltransférase; GPC-II : glutamate carboxypeptidase II; ASPA : aspartoacylase.
21
3.2. Mécanismes pathologiques responsables de la maladie.
Plusieurs hypothèses ont été proposées pour expliquer la physiopathologie de la maladie de Canavan :
3.2.1 Théorie de la pompe à eau et du déséquilibre osmolytique :
Contrairement aux cellules gliales, les neurones n'expriment pas les aquaporines et leur membrane semble être largement imperméable à l'eau car une grande partie de leurs axones sont isolés par la myéline [29, 30], par conséquent, les neurones ont établi d'autres mécanismes pour réguler leur osmolarité en co-transportant de l'eau contre le gradient ; les co-transporteurs ont par la suite été nommés «pompe à eau moléculaire» [31].
L'exportation d'eau est couplée à la libération de NAA, ce qui entraîne le co-transport d'au moins 32 molécules d'eau par molécule NAA [27].
La théorie suggère que l'accumulation du NAA pourrait entraîner un déséquilibre osmotique dans le cerveau [32].
Le NAA est synthétisé au niveau des neurones (compartiment anabolique) et hydrolysé au niveau des OL (compartiment catabolique).
Dans le cas normal, la concentration intraneuronale en NAA est de 10 à 14 mMol, tandis que sa concentration interstitielle est seulement de 80 à 100 microMol [33] indiquant un gradient de transport dirigé vers l'extérieur (milieu interstitiel périaxonal).
Pour maintenir l'équilibre osmotique tissu-espace extracellulaire (dans l'espace périaxonal), le NAA est rapidement capté et hydrolysé par les OL (grâce à l'aspartoacylase pour former l'aspartate et l'acétate) pour maintenir le
22
gradient de concentration. Les produits métaboliques sont repris au niveau des neurones par un mécanisme de transport actif pour compléter le cycle (synthèse du NAA à partir de l'acétate et de l'aspartate) [34].
Dans le cas de cette maladie, le déficit en ASPA va entraîner un défaut de captation et d’hydrolyse du NAA par les OL, ce qui conduit à l’accumulation du NAA, qui est un important osmolyte ; dans l’espace interstitiel périaxonal d’où le passage de l’eau par osmose du milieu intracellulaire vers le milieu interstitiel, ce qui est responsable d’un œdème intramyélinique, d’une augmentation de la pression du LCR et d’un rétrécissement des cellules voisines conduisant à la formation des vacuoles (figure 7).
23
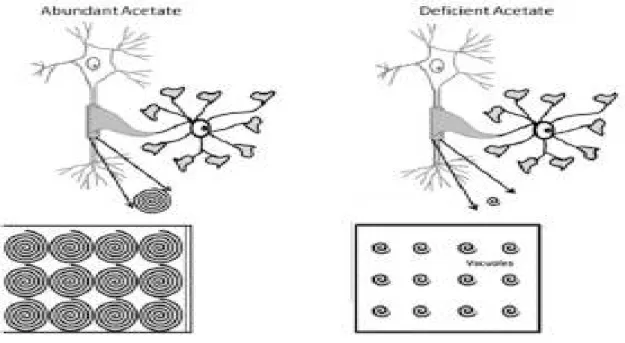
3.2.2 Théorie de la dysmyélinisation :
La maladie de Canavan se caractérise non seulement par une augmentation de NAA, mais aussi par une diminution de l'acétate et aspartate. L’une des causes principales de cette maladie peut être une baisse des groupes acétyle due à l’absence d’activité d’ASPA [35].
Le NAA présente une source d'acétate pour les lipides de la myéline ; en effet l'incorporation de la fraction acétate de NAA dans les lipides cérébraux était déjà suggérée dans les années 1960 [35], mais confirmée pour la première fois en 1991 par Burri et ses collègues. Ils pourraient montrer que l'acétate de NAA a été incorporé dans les lipides cérébraux, en particulier pendant les stades postnatals précoces en même temps que la myélinisation [36].
Cette théorie à été supporté par les études montrant que le taux des lipides non polaires et polaires, essentiels pour la synthèse de la myéline, ont été trouvés à 21-38% de moins chez les souris ASPA knock-out (ASPA-KO : souris dont l'activité de l'aspartoacylase est effondrée) que dans le type sauvage ce qui induit que l'hypomyélinisation dans la maladie de Canavan n'est pas surprenante selon Madhavaro [37].
24
Figure 8: Théorie de la dysmyélinisation:
l'acétate abondant permet une formation correcte des bicouches de myéline, tandis que dans l'insuffisance en acétate, les couches peuvent ne pas être complètement liées donnant lieu à des vacuoles dans l'espace interstitiel [38].
3.2.3 La déficience en acétate compromet la différenciation des oligodendrocytes :
ASPA peut être impliqué dans la régulation épigénétique de la maturation et le maintien de la myéline par la fourniture d’acétate [12].
Puisque les neurones transfèrent le NAA aux oligodendrocytes, l’acétate dérivé du NAA est probablement important pour les réactions d'acétylation des histones qui régulent la structure de la chromatine et la transcription des gènes dans ces cellules. Par conséquent, une diminution de l'acétate induite par le déficit en aspartoacylase peut modifier l'expression de gènes ce qui influence directement les réactions d’acétylations des histones empêchant ainsi la
25
différenciation normale des oligodendrocytes et conduisant à leur mort cellulaire et à des lésions neuronales pouvant être responsables de la formation des vacuoles [39].
3.2.4 Théorie du repliement et de la stabilisation des protéines :
Des cellules comme les oligodendrocytes, qui possèdent des voies de sécrétion actives des protéines, sont sensibles aux désordres du repliement des protéines. Spange et al. ont démontré que l'acétyl CoA (formé à partir de l’acétate dérivé du NAA) est un substrat important pour l’acétylation et la désacétylation des chaînes polypeptidiques naissantes au niveau du réticulum endoplasmique (RE) requises pour la stabilisation et le repliement correct des protéines [40].
Lin a démontré que la réduction de la disponibilité de l'acétyl CoA due à une carence en aspartoacylase pourrait avoir un effet négatif sur le repliement et la stabilisation des protéines, qui deviennent une cible pour la dégradation. Les oligodendrocytes sont très sensibles au stress associé aux perturbations dans la synthèse et le trafic des protéines au niveau du RE [41].
3.2.5 Théorie du stress oxydatif :
NAA peut jouer un rôle important dans le maintien de la l'intégrité métabolique des oligodendrocytes. L’élévation des marqueurs d’oxydation indique la survenue d’un état de stress qui cause la perte des oligodendrocytes suivie d’une démyélinisation dans les premiers jours de vie [42].
En effet, Pederzolli et al. ont démontré que les niveaux excessifs de NAA peuvent favoriser le stress oxydatif en stimulant la peroxydation lipidique,
26
l'oxydation des protéines et en diminuant les défenses antioxydantes non enzymatiques en augmentant la synthèse des espèces réactives de l’oxygène dans le cortex cérébral du rat [43] .
De plus, La NAA est connue pour induire des crises après administration intracérébro-ventriculaire chez le rat, probablement en raison de la surexcitation des récepteurs du glutamate [44].
Ajoutant à cela que Pederzolli et al. ont démontré que les niveaux excessifs de le NAA peuvent élever les niveaux de peroxyde d'hydrogène in vitro qui pourrait éventuellement être impliqué dans la progression de la neurodégénérescence caractéristique de la maladie de Canavan. Bien que ces résultats ne puissent être extrapolés aux humains, il révèle des mécanismes probables de la maladie vu que les paramètres du stress oxydatif se sont produits avec des concentrations élevées de NAA (~ 4 fois plus élevée) observés par Tsai et Coyle dans le plasma et le liquide céphalo-rachidien des patients atteints de la maladie [43].
Les niveaux excessifs de NAA peuvent aussi induire l'oxyde nitrique synthase inductible (iNOS) qui sert à produire de l'oxyde nitrique [14].
L'oxyde nitrique (NO) est une molécule de signalisation endogène qui est synthétisé à partir de L-arginine et O2 par une famille de NO synthases (NOS) qui comprend la NOS neuronale, inductible, et endothéliale ; respectivement (nNOS, iNOS et eNOS,). Résultat de la cytotoxicité de l'oxyde nitrique (NO) est la production de peroxynitrite, un produit hautement réactif de la réaction entre NO et superoxyde [45].
![Figure 2 : Mécanismes de propagation de l'influx nerveux [4].](https://thumb-eu.123doks.com/thumbv2/123doknet/15062384.699184/43.892.242.653.106.527/figure-mécanismes-propagation-influx-nerveux.webp)


![Figure 6: Représentation schématique du métabolisme de NAA [27] . NAA : N-acétyl-L-aspartate; NAAG : N-acétyl-aspartylglutamate; ANAT : acétyl CoA / aspartate N-acétyltransférase; GPC-II : glutamate carboxypeptidase II; ASPA : aspartoacylase](https://thumb-eu.123doks.com/thumbv2/123doknet/15062384.699184/55.892.167.733.276.725/représentation-schématique-métabolisme-aspartate-aspartylglutamate-acétyltransférase-carboxypeptidase-aspartoacylase.webp)