HAL Id: tel-03198887
https://tel.archives-ouvertes.fr/tel-03198887
Submitted on 15 Apr 2021
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Etude de la voie catabolique du tryptophane dans
différentes conditions pathologiques : exemple de la
phénylcétonurie et perspectives dans les maladies
cardiovasculaires
Lysiane Boulet-Le Gouar
To cite this version:
Lysiane Boulet-Le Gouar. Etude de la voie catabolique du tryptophane dans différentes condi-tions pathologiques : exemple de la phénylcétonurie et perspectives dans les maladies cardiovascu-laires. Médecine humaine et pathologie. Université Grenoble Alpes [2020-..], 2020. Français. �NNT : 2020GRALV040�. �tel-03198887�
THÈSE
Pour obtenir le grade de
DOCTEUR DE L’UNIVERSITE GRENOBLE ALPES
Spécialité : Physiologie Physiopathologies Pharmacologie Arrêté ministériel : 25 mai 2016
Présentée par
Lysiane BOULET, épouse LE-GOUAR
Thèse dirigée par Patrice FAURE, PU-PH, UniversitéGrenoble-Alpes, et
codirigée par Patrice FLORE, Maitre de Conférence, Université
Grenoble-Alpes
préparée au sein du Laboratoire HP2 Inserm U1042 dans l'École Doctorale Chimie et Sciences du Vivant
Etude de la voie catabolique du tryptophane
dans différentes conditions pathologiques :
exemple de la phénylcétonurie et
perspectives dans les maladies
cardiovasculaires
Thèse soutenue publiquement le 11 décembre 2020, devant le jury composé de :
Mr Jean-Louis PEPIN
PU-PH, Université Grenoble-Alpes, Président
Mr Didier BORDERIE
PU-PH, Université Paris-Descartes, Rapporteur
Mr François LABARTHE
PU-PH, Université de Tours, Rapporteur
Mme Marie NOWOCZYN
PH, CHU de Caen, Examinateur
Mme Christelle CORNE
PH, CHU de Grenoble-Alpes, Co-encadrante, Invitée
Mr Patrice FLORE
MC, Université Grenoble-Alpes, Co-directeur
Mr Patrice FAURE
1
Remerciements
Je tiens à remercier chaleureusement :
Monsieur le Professeur Jean Louis Pépin pour m’avoir fait l’honneur de présider mon jury de thèse. Je vous remercie également de m’avoir acceptée au laboratoire HP2, et j’espère sincèrement que la suite des explorations du métabolisme du tryptophane concernant les versants cardiovasculaires et BPCO seront à la hauteur de nos espérances.
Messieurs les Professeurs Didier Borderie et François Labarthe pour avoir accepté de juger mon travail. Vos remarques permettront d’améliorer la suite de cette recherche. C’est un honneur tout particulier de compter le président de la SFEIM dans mon jury.
Madame le Docteur Marie Nowoczyn pour avoir accepté de juger mon travail. C’est toujours un grand plaisir d’échanger avec toi, que ce soit de sciences ou de maladies héréditaires du métabolisme (mais pas que !).
Messieurs le Professeur Patrice Faure et le Maitre de Conférence Patrice Flore pour m’avoir encadré tout au long de ce travail. Au Professeur Faure, un merci particulier de m’avoir également accompagnée sur le versant hospitalier. A Patrice Flore, pour ta bienveillance qui n’a jamais fléchie durant ces 6 années, tes corrections rapides et pour tous les travaux à venir.
Madame le Docteur Christelle Corne, sans qui je ne serais pas là aujourd’hui. Je me souviens de mon premier stage en MHM, où je ne comptais que passer… C’était sans compter sur tes qualités humaines, ta vision du travail et ton amour des MHM qui a très rapidement déteint sur moi ! Un énorme merci pour tout l’encadrement et le soutien que tu m’as apportée au fil des années.
Madame le Docteur Odile Rigal qui, pour des raisons de titre n’a malheureusement pas pu faire partie officiellement de ce jury. Votre regard sur ce travail aurait été hautement pertinent et constructif, et je mesure à quel point c’est un gâchis de ne pas avoir pu en profiter.
2
Mes remerciements vont également à toutes les personnes ayant contribué de près ou de loin à l’ensemble des travaux exposés dans cette thèse :
A l’équipe Masse, présente et passée, pour toute votre aide logistique, vos précieux conseils largement exploités dans ce travail et votre bonne humeur au quotidien. En particulier, merci à Julien et Michael pour votre aide technique, à Cécile pour ton expertise masse et à Véronique pour votre supervision.
Au Docteur Gérard Besson pour votre aide statistique, ainsi que pour nous avoir suivies et aidées dans cette recherche qui à l’époque reposait sur des suppositions.
Au Professeur François Maillot, qui m’a fait l’honneur d’accepter à l’époque de juger mon travail de thèse d’exercice, ce qui a conduit à notre collaboration présente (et j’espère future), ainsi qu’à toutes les personnes ayant rendue cette collaboration possible, que ce soit à Tours ou à Grenoble, ainsi que toutes les personnes à travers la France qui ont permis le recrutement des patients.
A Isabelle et Laurent, pour votre aide précieuse concernant les commandes sur des bouts de chandelles.
Aux Professeurs Pascal Mossuz et Hervé Pelloux pour vos avis éclairés lors de mes comités de suivi de thèse.
A l’ensemble des personnes que ce travail m’a permis de côtoyer, en particulier Sébastien Bailleul, pour tous ces échanges scientifiques ou autres, Claire Arnaud pour ta bienveillance, et Guillaume Bourdier.
A l’ensemble de mes collègues qui m’ont permis de me concentrer sur ce travail en me déchargeant de la routine hospitalière, tout particulièrement à Laetitia et Christelle, mais également à tous ceux qui ont fait preuve de patience, comme les équipes de l’HPLC, de la masse et des maladies héréditaires du métabolisme.
3
A l’ensemble de ma famille et de mes amis, qui m’ont soutenue années après années, tout en s’étonnant encore de mon statut d’étudiante, finalement pas si éternel que ça. Une pensée à mes « copines de galère », Elodie, Julie et Laetitia, qui ont toutes brillamment soutenues avant moi.
A mes parents qui ont fait de moi ce que je suis. Merci pour tout ce que vous avez fait pour vos 3 enfants et votre soutien sans faille. Un merci particulier pour toi maman qui a subie toutes ces révisions au fil des ans, notamment lors de ma première année de pharmacie. Il est temps maintenant de penser un peu plus à vous.
A mon mari, Cédric, pour ton écoute et ton soutien quotidiens, même si tu ne comprends pas toujours de quoi je parle (il n’est jamais trop tard pour découvrir que la phénylcétonurie est une maladie !). Tu es mon rocher qui me permet de traverser sereinement toutes les épreuves passées, présentes et futures.
A mes deux monstres, Mathéo et Timothée, qui ont vu le jour durant ce travail. Vous êtes mes rayons de soleil, merci pour toute la joie que vous nous apportez.
4
Table des matières
Liste des Figures et Tables ... 7
Liste des abréviations ... 9
Introduction générale ... 11
Première partie : données de la littérature ... 14
1.1 La voie du tryptophane ... 15
1.1.1 Le métabolisme du tryptophane ... 15
1.1.1.1 Voie des kynurénines ... 17
1.1.1.2 Voie de la sérotonine ... 19
1.1.2 Métabolisme du tryptophane et clinique : état de l’art ... 21
1.1.2.1 Maladies Héréditaires du Métabolisme ... 21
1.1.2.2 Pathologies cardiovasculaires ... 24 Publication n°1 ………..……… 25 1.1.2.3 Cancérologie ... 36 1.1.2.4 Neurologie ... 37 Publication n°2 ………..……… 38 1.1.2.5 Aspects thérapeutiques ... 55 1.2 Applications cliniques ... 56 1.2.1 La phénylcétonurie (PCU) ... 56 1.2.1.1 Biochimie ... 56 1.2.1.2 Classification ... 59
5
1.2.1.3 Physiopathologie ... 60
1.2.1.4 Clinique ... 62
1.2.1.5 Diagnostic ... 63
1.2.1.6 Prise en charge ... 65
1.2.1.7 Tryptophane et phénylcétonurie : état de l’art ... 71
1.2.2 Le syndrome d’apnées obstructives du sommeil (SAOS) ... 75
1.2.2.1 Définitions ... 75
1.2.2.2 Epidémiologie ... 77
1.2.2.3 Physiopathologie ... 78
1.2.2.4 Complications cardiovasculaires ... 79
1.2.2.5 Prise en charge ... 79
1.2.2.6 Tryptophane et SAOS : état de l’art ... 80
1.3 Méthodes analytiques ... 82
1.3.1 Chromatographie liquide (LC) et spectrométrie de masse (MS): principes ... 82
1.3.1.1 Chromatographie liquide ... 82
1.3.1.2 Spectrométrie de masse ... 83
1.3.2 Principes analytiques pour le dosage du tryptophane et de ses métabolites : état de l’art……… ... 87
1.3.2.1 Dosage du tryptophane et de la sérotonine... 87
1.3.2.2 Dosage simultané de plusieurs molécules de la voie du tryptophane ... 88
Deuxième partie : travaux de thèse ... 90
6
2.2 Mise au point du dosage du Trp et de 8 de ses métabolites en HPLC-MS/MS ... 93
Publication n°3 ……….. 94
2.3 Intérêt de l’exploration de la voie métabolique du Trp dans la PCU ... 103
Publication n°4 ……….104
Publication n°5 ……….117
Discussion générale ... 127
Conclusions et perspectives ... 138
7
Liste des Figures et Tables
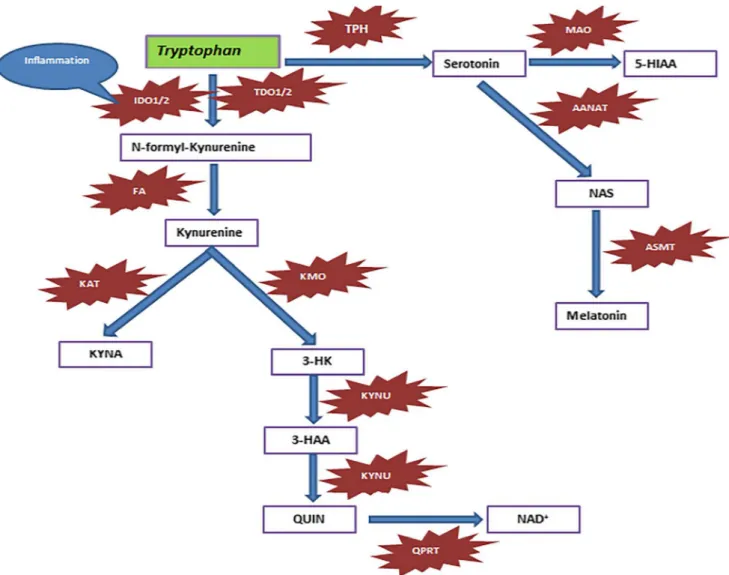
Figure 1 : Métabolisme du Trp chez l’homme, d’après Hénykova et al (2). ... 16
Figure 2 La voie des kynurénines, d’après Zuo et al (13). ... 18
Figure 3 : Voie métabolique de la sérotonine, d’après Dorszewska et al (17) ... 20
Figure 4 : Voies métaboliques des amines biogènes, d’après Marecos et al (32).. ... 22
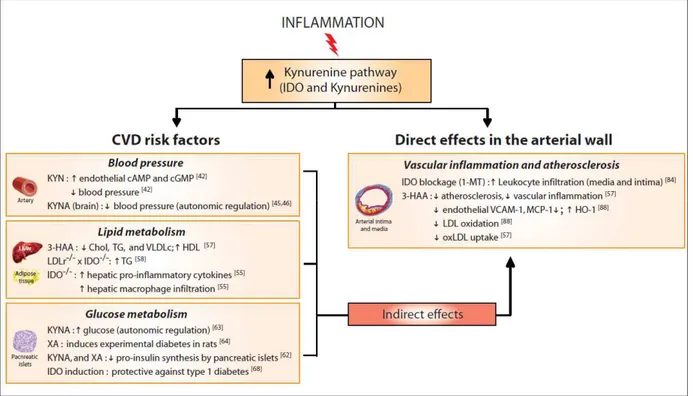
Figure 5 : Rôle de la voie des kynurénines dans le risque cardiovasculaire, l’inflammation vasculaire et l’athérosclérose, d’après Polyzos et al (50). ... 35
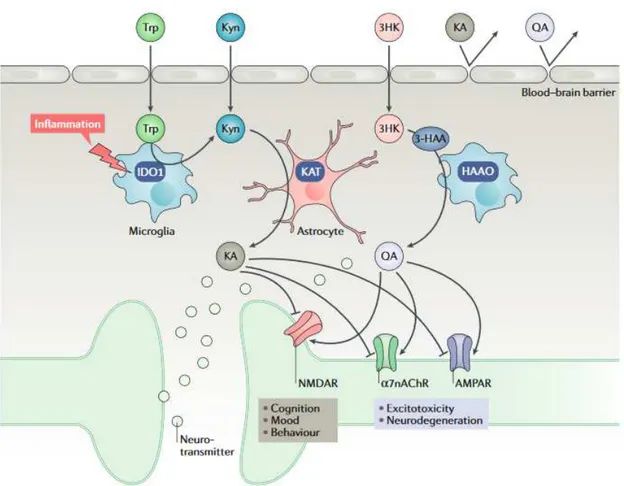
Figure 6 : Neuroactivité des métabolites du Trp, d’après Platten et al (60). ... 37
Figure 7 : Métabolisme de la phénylalanine, d’après Schuck et al (75). ... 57
Figure 8 : Métabolisme de la voie des ptérines et enzymes ptérines-dépendantes d’après Wiedemann et al (76). ... 58
Figure 9 : Répartition des déficits mondiaux de la voie du BH4 répertoriés d’après la base de données BIODEF, 2015 (84). ... 59
Figure 10 : Physiopathologie de la PCU : mécanismes possiblement impliqués dans les désordres neurocognitifs, d’après Van Wegberg et al (94)... 61
Figure 11 : Conduite à tenir lors d’un dépistage néonatal positif pour l’hyperphénylalaninémie, d’après le PNDS phénylcétonurie (74) ... 64
Figure 12 : Taux de Phe recommandés ou tolérés en France en fonction de l’âge, d’après Wiedemann (76). ... 66
Figure 13 : Thérapeutiques utilisables dans la PCU, disponibles en France (en vert), en cours d’étude avancée (en orange) ou à l’état de recherche (en jaune) ... 70
Figure 14 : Critères diagnostiques du SAOS, d’après Gautier-Veyret (183) ... 76
Figure 15 : Les 10 pays les plus touchés par le SAOS selon les critères de l'American Academy of Sleep Medicine 2012, d’après Benjafield et al (185)... 77
8
Figure 16 : Exemple d’enregistrement polysomnographique d’un patient présentant un SAOS,
d’après Dematteis et al (188) ... 78
Figure 17 : Conséquences et mécanismes intermédiaires du SAOS pouvant contribuer au risque cardiovasculaire, d’après Sanchez-de-la-torre et al (191)... 79
Figure 18 : Schéma d’une chaîne de chromatographie liquide, d’après l’Université de Lille (203) ... 83
Figure 19 : Source d’ionisation à pression atmosphérique par électro-nébulisation en mode positif, d’après Bioforma (204)... 84
Figure 20 : Schéma d’un spectromètre de masse en tandem, d’après Cheillan et al (205). .... 86
Figure 21 : Diagramme des différences représentant les concentrations de chaque analyte à T0 selon les modes de centrifugation utilisés lors de l’étude ECOPHEN ou la pratique courante de notre laboratoire. ... 114
Figure 22 : Modèle de l’étude CIH-GAIT, inspiré de (253) ... 133
Figure 23 : Modèle de l’étude pré-clinique, d’après Bourdier et al (255). ... 134
Figure 24 : Plan expérimental de l’étude HYPINT, d’après Borowik (258). ... 136
Tableau 1 : Thérapies en développement dans la PCU (année 2020), d’après Wiedemann et al (76) ... 69
Tableau 2 : Interactions entre les métabolismes de la Phe et du Trp ... 74
Tableau 3 : Avantages et inconvénients des différentes méthodes de dosage des acides aminés, d’après JF Benoist, cours DIU MHM (207).. ... 87
Tableau 4 : Liste non exhaustive des essais réalisés lors de la mise au point du dosage analytique des métabolites de la voie du Trp. ... 93
Tableau 5 : Biais obtenu lors de l’étude de stabilité des métabolites du Trp dans le sang total conservé à température ambiante (n=15). ... 115
9
Liste des abréviations
3HA : acide 3-hydroxyanthranilique 3HK : 3-hydroxykynurénine
5HIAA : acide 5-hydroxyindoleacétique 5HT : sérotonine
5HTP : 5-hydroxytryptophane AA : acide anthranilique
AADC : décarboxylase des L-acides aminés aromatiques AHR : récepteur aux arylcarbones
AK : acide kynurénique AP : acide picolinique AQ : acide quinolinique AX : acide xanthurénique BH4 : tétrahydrobioptérine
BHE : barrière hémato-encéphalique CIQ : Contrôle interne de qualité CVD : maladies cardiovasculaires DHPR : dihydroptéridine réductase ESI : électronébulisation ou électrospray GMP : glycomacropeptides
HMP : hyperphénylalaninémie modérée permanente HPA : hyperphénylalaninémie
HPLC : chromatographie liquide haute performance IAH : indice d’apnées-hypopnées
IDO : indoléamine-2,3-dioxygénase KAT : kynurénine aminotransférase KMO : kynurénine-3-monooxygénase KYN : kynurénine
10 KYNU : kynuréninase
LAT1 : transporteur des L-acides aminés de type 1 LC : chromatographie liquide
LCR : liquide céphalorachidien LNAA : L-acides aminés neutres MAO : monoamine oxydase
MHM : maladies héréditaires du métabolisme MRM : multiple reaction monitoring
MS : spectrométrie de masse
OMIM : online mendelian inheritance in man PAH : phénylalanine hydroxylase
PAL : phénylalanine-ammonia lyase PCU : phénylcétonurie
Phe : phénylalanine
PNDS : protocole national de diagnostic et de soins PPC : pression positive continue
QI : quotient intellectuel
SAOS : syndrome d’apnées obstructives du sommeil TDO : tryptophane-2,3-dioxygénase
TPH : tryptophane hydroxylase Trp : tryptophane
Tyr : tyrosine UV : ultraviolet
11
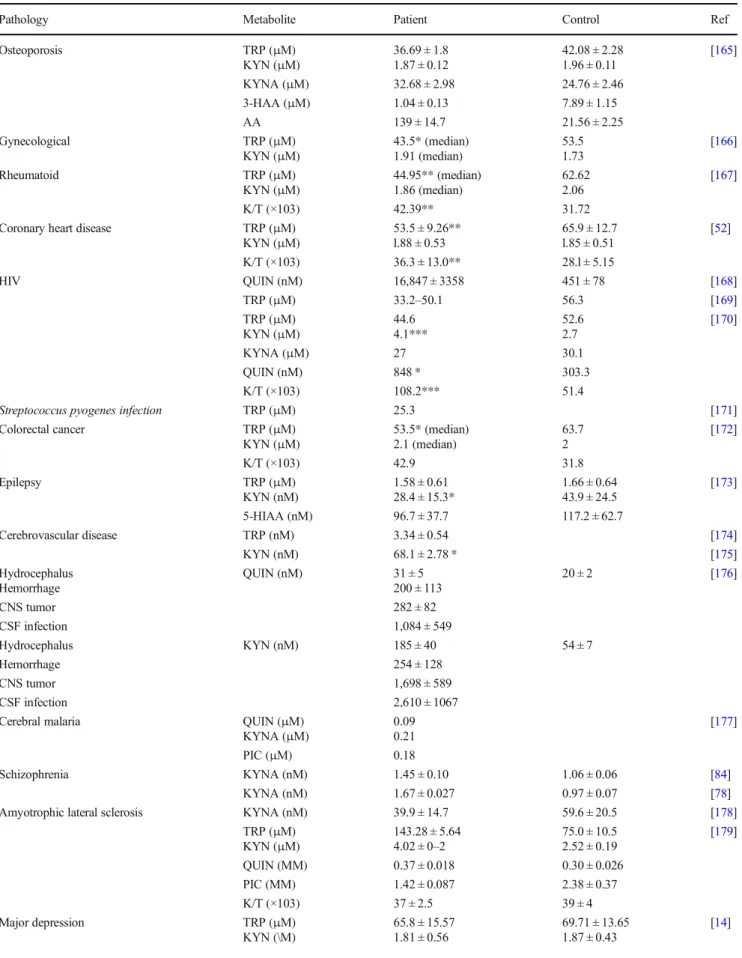
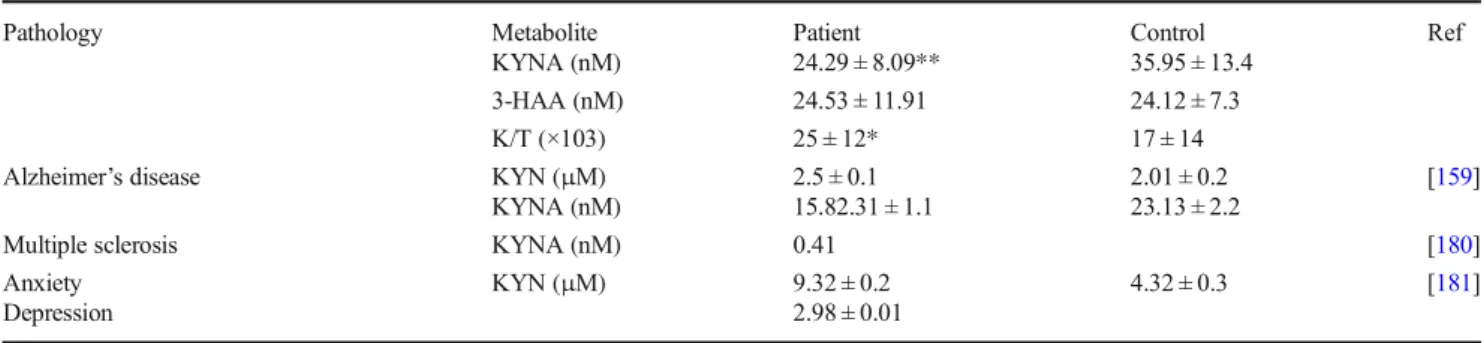
12
Le tryptophane (Trp), acide aminé essentiel, est catabolisé principalement selon deux voies : celle de la kynurénine (KYN), et celle de la sérotonine (5HT). Son métabolisme a été l’objet de nombreuses investigations ces dernières années, qu’il s’agisse de son implication en cancérologie, dans les pathologies cardiovasculaires, la dépression, le sommeil, ou encore dans les pathologies neurodégénératives.
La phénylcétonurie (PCU ; OMIM 261600) est une amino-acidopathie touchant le métabolisme de la phénylalanine (Phe), dont la prévalence est d’environ 1/16 000 bébés en France. Son évolution clinique s’est fortement améliorée depuis 1972, date à laquelle le dépistage systématique a été instauré en France. Cette pathologie se caractérise principalement par un retard mental sévère (quotient intellectuel (QI) < 50), pouvant être évité par l’instauration précoce d’un régime diététique. La physiopathologie neurologique reste cependant encore partiellement inconnue.
La prévention des maladies cardiovasculaires est un enjeu de santé publique majeur, et se base sur la maitrise des facteurs de risque. Le syndrome d’apnées obstructives du sommeil (SAOS), touchant 6 à 17% des adultes à travers le monde, fait partie de ces facteurs. Ce syndrome se caractérise par un collapsus pharyngé partiel ou total, une fragmentation du sommeil et une augmentation des efforts respiratoires et donc des séquences d’hypoxie – réoxygénations (hypoxie intermittente) responsables d’une inflammation de bas grade.
Plusieurs arguments rendent compte de la pertinence de l’exploration du métabolisme du Trp dans ces deux conditions pathologiques. Les voies métaboliques de la Phe et du Trp possèdent des éléments communs (transporteurs, cofacteurs et enzyme chaperonne, inhibitions de l’une des voies par des métabolites de l’autre voie). De plus, certains adultes atteints de PCU présentent des dysfonctions neuropsychologiques inexpliquées par leur concentration de Phe sanguine, ce qui pourrait être dû à des modifications de la voie métabolique du Trp, plusieurs kynurénines possédant des propriétés neuroactives. En ce qui concerne les maladies cardiovasculaires, plusieurs études récentes mettent en avant une modification du métabolisme du Trp, mais peu apportent un lien
13
mécanistique. La voie des kynurénines n’a par ailleurs jamais été explorée dans le SAOS à notre connaissance.
Le premier objectif de cette thèse a été de mettre au point une méthode analytique permettant de doser simultanément 9 molécules de la voie du Trp. Le second objectif a été d’évaluer ce métabolisme dans la PCU. Enfin, nous présentons les études cliniques et précliniques que nous souhaitons mener dans le domaine cardiovasculaire dans un futur proche.
La première partie de ce manuscrit consiste en un état de l’art concernant le métabolisme du Trp, la PCU, le SAOS et leurs liens respectifs, ainsi que les principes analytiques. Cette partie comporte notamment deux revues de la littérature : la première consacrée aux liens entre le métabolisme du Trp et le SAOS d’une part, et le métabolisme du Trp et le cancer d’autre part ; la seconde est consacrée au métabolisme du Trp, en particulier à la voie des kynurénines, dans les maladies neurodégénératives.
La seconde partie de ce manuscrit expose les différents travaux réalisés sous forme de trois articles scientifiques originaux : l’un concerne la mise au point analytique, les deux autres l’analyse du métabolisme du Trp dans des populations phénylcétonuriques.
Enfin, la troisième et dernière partie constitue une analyse critique et une synthèse des résultats de cette thèse. Les perspectives y sont également discutées.
14
15
1.1
La voie du tryptophane
1.1.1
Le métabolisme du tryptophane
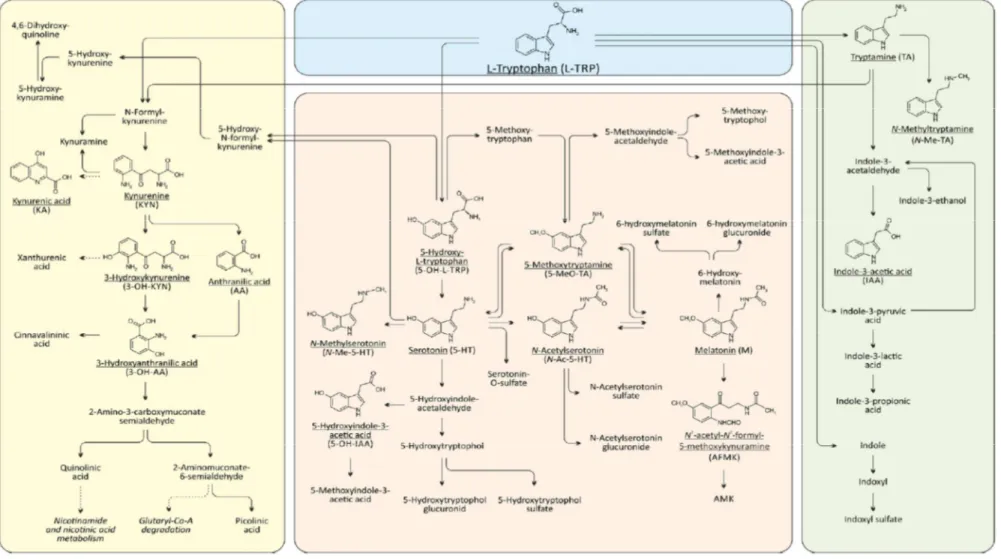
Le tryptophane (Trp) est un des 10 acides aminés essentiels, c’est-à-dire apportés uniquement par l’alimentation. Les apports nutritionnels du Trp sont capitaux, car il est le précurseur de plusieurs métabolites de grande importance, tels que la sérotonine (5HT) ou la mélatonine. Les apports nutritionnels conseillés en Trp varient selon le sexe et l’âge, allant de 4 mg/kg/j chez l’adulte à 20 mg/kg/j chez le nourrisson selon les recommandations françaises (1). Le Trp peut être catabolisé selon 3 voies métaboliques : la voie des kynurénines, celle du 5HT et celle des indoles (Figure 1).
16
Figure 1 : Métabolisme du Trp chez l’homme. La partie jaune représente la voie des kynurénines, la partie rose celle de la sérotonine, et la partie verte celle des indoles (métabolisme bactérien), d’après Hénykova et al (2).
17
La voie des kynurénines représente la majorité du catabolisme du Trp (environ 98% de sa dégradation) et conduit à la synthèse intracellulaire de nicotinamide. La kynurénine (KYN), métabolite pivot de la voie des kynurénines, permet ensuite la synthèse de différentes molécules, telles que les acides kynurénique (AK) et anthranilique (AA) ou la 3-hydroxykynurénine (3HK). Depuis une vingtaine d’années, la recherche concernant la voie des kynurénines est en plein essor, et des revues de la littérature relatent les implications physiologiques et pathologiques inhérents à cette voie (3,4).
La voie de la sérotonine (5HT) est quantitativement moins importante (environ 2% du catabolisme du Trp), mais son métabolisme, en particulier cérébral, ainsi que son implication dans la dépression et le sommeil en font une voie primordiale. Le 5HT est en effet impliqué dans la contraction du muscle lisse, la régulation de la pression artérielle ainsi que la neurotransmission périphérique et centrale (5). La mélatonine, métabolite issu du 5HT, est connue pour son importance dans la modulation du rythme circadien et en particulier pour son rôle dans l’induction du sommeil (6).
Enfin, une dernière voie, mineure, existe : la voie des indoles, ou voie des bactéries intestinales. Au niveau intestinal, 4 à 6% du Trp ingéré est immédiatement dégradé en différents produits, dont l’indole (7). Cette voie ne sera pas développée dans la suite de ce travail, même si de récentes études mettent en avant son implication dans l’axe microbiote intestinal-cerveau (8–10).
1.1.1.1 Voie des kynurénines
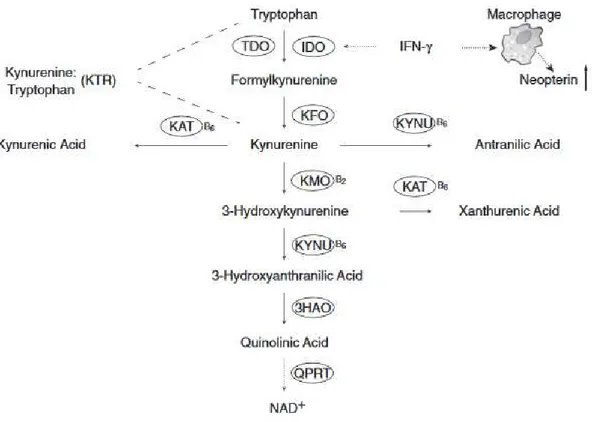
Le Trp est métabolisé en N-formylkynurénine via l’action de deux enzymes hème-dépendantes : l’indoléamine-2,3-dioxygénase (IDO), ubiquitaire et dépendante du statut inflammatoire (11), et la tryptophane-2,3-dioxygénase (TDO), essentiellement hépatique. Plus récemment, des chercheurs ont mis en évidence une seconde isoenzyme de l’IDO, l’IDO2, dont l’expression semble restreinte aux cellules présentatrices de l’antigène, au foie, au rein, au cerveau et au placenta (12). La N-formylkynurénine est ensuite convertie quasiment instantanément en KYN. L’acide 3-hydroxyanthranilique (3HA), issu du catabolisme de KYN en 3HK, sera converti par la 3HA-3,4-dioxygénase en acide 2-amino-3-carboxymuconique semialdéhyde, métabolite instable qui peut être
18
métabolisé en acide picolinique (AP), mais surtout qui se réarrange spontanément en acide quinolinique (AQ). Il est à noter qu’un grand nombre d’enzymes de cette voie sont dépendantes des vitamines B6 ou B2 (Figure 2).
Figure 2 La voie des kynurénines, d’après Zuo et al (13). Abréviations des enzymes : 3HAO : 3HA dioxygenase ; IDO : indoleamine 2,3-dioxygénase ; KAT : kynurénine aminotransférase ; KFO : kynurénine formylase ; KMO : kynurénine monooxygénase ; KYNU : kynuréninase ; QPRT : quinolinate phosphoribosyl transférase ; TDO : tryptophane 2,3-dioxygénase
Dans la circulation, le Trp est principalement lié à l’albumine (le Trp libre représentant uniquement 10-15% du Trp sanguin total) (14). A l’état physiologique, le Trp est métabolisé en KYN par la TDO. IDO1 étant très largement activée lors de conditions inflammatoires, le ratio KYN/Trp est considéré comme un marqueur de l’activité de IDO1 (15). TDO et IDO sont également activées par les glucocorticoïdes et l’interféron γ, alors que TDO est inhibée par le glucose et le nicotinamide. Le Trp libre est affecté par les concentrations en albumine, qui peuvent être modifiées au cours de la grossesse et dans les pathologies hépatiques et rénales. Une compétition peut également se mettre en place avec les acides gras libres, et plus généralement la lipolyse, le salicylate et l’alcool (4).
19
Les tenants et aboutissants de cette voie sont certes de mieux en mieux cernés, mais il existe encore de grandes parts d’ombre à élucider. Le chapitre « Métabolisme du tryptophane et clinique : état de l’art » s’attachera à expliciter plus en détail l’implication de cette voie dans différentes conditions pathologiques.
1.1.1.2 Voie de la sérotonine
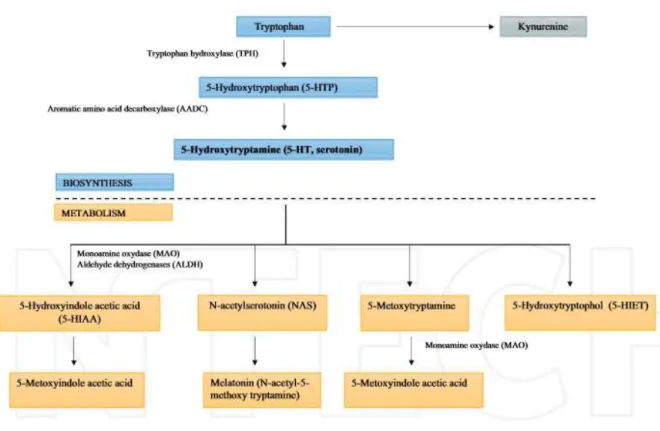
Le Trp est également métabolisé en 5-hydroxytryptophane (5HTP) par l’action de la Trp hydroxylase (TPH), enzyme limitante de cette voie. Cette enzyme existe sous 2 isoformes, TPH1 localisée au niveau de la rate, des cellules intestinales entérochromaffines, de la glande pinéale et du thymus, tandis que TPH2 est exclusivement présente dans les cellules neuronales (16). Le 5HTP est ensuite rapidement décarboxylé par la décarboxylase des acides aminés aromatiques (AADC) afin de synthétiser la sérotonine (5HT). Celle-ci est ensuite convertie en acide 5-hydroxy-indoleacétique (5HIAA), produit final excrété dans l’urine. Au niveau de la glande pinéale et de l’intestin, le 5HT peut également être converti en N-acétylsérotonine, elle-même transformée en mélatonine. Cette voie métabolique est représentée en Figure 3.
20
Figure 3 : Voie métabolique de la sérotonine, d’après Dorszewska et al (17)
La voie de la sérotonine est impliquée dans de nombreuses pathologies psychiatriques, telles l’anorexie (18), l’anxiété (19) ou encore la dépression (20). Un dysfonctionnement de cette voie est impliqué dans l’hypertension, la migraine, les arythmies cardiaques, la maladie de Raynaud, ou encore dans certains syndromes carcinoïdes (2,21). Depuis peu, cette voie est également impliquée dans les troubles du spectre autistique (22) ou encore dans la dépendance alcoolique (23) ou la douleur chronique (24). Le ratio 5HT/Trp a même été proposé comme marqueur d’agressivité (25). Les inhibiteurs de recapture de la sérotonine, tel que la fluoxétine, sont largement utilisés dans les pathologies précitées, en particulier en tant qu’antidépresseurs (26).
Parmi les métabolites du 5HT, 2 sont de grande importance : la mélatonine et le 5HIAA. Un déficit en mélatonine, communément appelée hormone du sommeil, est impliqué dans plusieurs pathologies, comme le cancer, la douleur, le syndrome métabolique, le diabète de type 2, la polyarthrite rhumatoïde ou certains troubles de l’humeur (27). Le 5HIAA est quant à lui essentiellement connu pour son rôle de biomarqueur des tumeurs endocrines (28).
21
Alors que le déficit en décarboxylase des L-acides aminés aromatiques (AADC), permettant la métabolisation du 5HTP en 5HT, commence à être bien connu (cf. ci-dessous le chapitre « Maladies Héréditaires du Métabolisme »), le déficit en TPH fait partie des sujets en cours d’étude. Les modèles animaux de déficience en TPH2 se sont multipliés (29), permettant une avancée dans la compréhension de la physiopathologie de cette voie, mais aucun déficit humain n’est à ce jour répertorié à notre connaissance.
La voie de la sérotonine est également fortement intriquée avec d’autres voies d’importances majeures pour la neuromédiation. Une interconnexion avec la voie du GABA est connue, dont les effets dépendent du stade de développement, du circuit neuronal et de la localisation cérébrale (30). La voie de la dopamine possède une enzyme commune avec la voie du 5HT, l’AADC, qui permet la synthèse de dopamine et de 5HT. De plus, certains récepteurs d’une voie sont localisés sur les neurones de l’autre voie, et les transporteurs de l’une possèdent également une affinité pour l’autre voie (30). Il est donc important de garder à l’esprit qu’une modification de la concentration en 5HT cérébrale peut avoir un effet sur la voie du GABA (et donc du glutamate) d’une part, mais également sur celle de la dopamine d’autre part.
1.1.2
Métabolisme du tryptophane et clinique : état de l’art
1.1.2.1 Maladies Héréditaires du Métabolisme
La PCU, objet de la présente étude, n’est pas la seule maladie héréditaire du métabolisme (MHM) dans laquelle l’étude de la voie du Trp présente un intérêt.
- La maladie de Harntup (OMIM 234500), est une pathologie du transporteur rénal des acides aminés neutres B0AT1. Le plus souvent asymptomatique, la clinique peut également être celle d’une dermatite photosensible, d’une ataxie cérébelleuse intermittente ou de symptômes psychotiques. Ces symptômes provenant probablement du déficit en Trp, le traitement actuel est l’acide nicotinique, métabolite final de la voie du Trp (31).
22
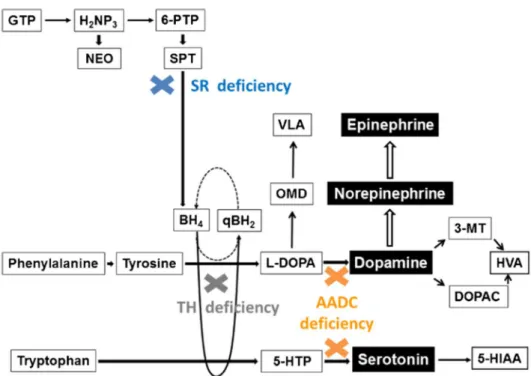
- Une autre pathologie importante est le déficit en décarboxylase des L-acides aminés aromatiques (AADC) (OMIM 608643). En effet, l’AADC permet la transformation du 5HTP en 5HT, mais également la synthèse de dopamine (Figure 4). Cette pathologie touche une centaine de patients à travers le monde, avec comme symptômes au moment du diagnostic une hypotonie, des crises oculogyres, un retard de développement ou d’autres anomalies du mouvement (32). Le traitement de première intention est constitué de vitamine B6 (cofacteur), d’agonistes dopaminergiques et d’inhibiteur de la monoamine oxydase B. Ce traitement peut être complété par un traitement symptomatique pouvant être constitué de molécules anticholinergiques, de mélatonine ou encore de benzodiazépines (33). Un traitement par thérapie génique est également en phase de recherche clinique (34). Une accumulation de 5HTP ayant été relatée dans cette pathologie (35), une modification de la voie des kynurénines est probable, dont la physiopathologie reste à explorer.
Figure 4 : Voies métaboliques des amines biogènes, d’après Marecos et al (32). Abréviations : AADC : décarboxylase des L-acides aminés aromatiques ; BH2 : 7,8-dihydrobioptérine ; BH4 : tétrahydrobioptérine ; DOPAC : acide 3,4-dihydroxyphénylacétique ; GTP : guanosine triphosphate cyclohydrolase I ; HVA : acide homovanillique ; H2NP3 : dihydronéoptérine triphosphate ; NEO : néoptérine ; OMD : 3-O-méthyldopa ; SPT : sépiaptérine ; SR : sépiaptérine réductase ; TH : tyrosine hydroxylase ; VLA : acide vanillacétique ; 5-http : 5-hydroxytryptophane ; 6-PTP : 6-pyruvoyl-tétrahydroptérine.
23
- Lors du déficit en monoamine oxydase (MAO) (OMIM 300615), enzyme permettant la dégradation de 5HT en 5HIAA, les patients peuvent présenter un comportement agressif, un retard mental modéré, des mouvements stéréotypés des mains, ainsi qu’un flush carcinoïde (36). Les inhibiteurs de la MAO, permettant de réduire la dégradation des amines biogènes, sont largement utilisés en thérapeutique, que ce soit en tant qu’antidépresseur (inhibiteur de la MAO-A) ou comme antiparkinsonien (inhibiteur de la MAO-B).
- L’acidurie xanthurénique, ou encéphalopathie par hydroxykynuréninurie, (OMIM 236800) est une pathologie dont la prévalence est inférieure à 1/ 1 000 000. Cette pathologie est caractérisée par une excrétion massive d’acide xanthurénique (AX), de KYN et de 3HK dans les urines, ces excrétions ne diminuant pas malgré un apport de vitamine B6. Les symptômes, une pellagre (association d’une dermatite, d’une diarrhée et de démence), sont ceux commun à tous les déficits en niacine (37).
- D’autres déficits présumés de la voie des kynurénines ont été décrits ; un déficit de conversion du Trp en KYN entrainerait un retard mental avec mouvement d’humeur et hypersexualité (38,39), tandis que le déficit en kynurénine-3-monooxygénase (KMO) (40) ainsi que l’hyperactivation de la picolinate synthase (qui permet la synthèse d’acide picolinique (AP) à partir du 2-aminomuconate 6-semialdehyde) (41) induiraient une pellagre.
La voie métabolique du Trp peut également avoir une importance dans d’autres MHM de manière plus indirecte.
- Dans l’acidurie glutarique de type I (OMIM 231670), pathologie responsable principalement d’une atteinte neurologique majeure avec macrocéphalie et hématomes sous-duraux, la glutaryl-CoA déshydrogénase (l’enzyme déficitaire), est également impliquée dans la voie de dégradation du Trp. Il n’existe pas de corrélation entre la
24
concentration cérébrale d’acide glutarique et le phénotype clinique (42), ce qui pourrait être expliqué par une accumulation de kynurénines neurotoxiques (43). Enfin, un régime alimentaire pauvre en Trp étant préconisée chez ces patients, un suivi de cette voie métabolique pourrait se révéler intéressant.
- Le métabolisme du Trp peut également avoir un grand intérêt dans les pathologies de la neurotransmission avec ou sans hyperphénylalaninémie (HPA). Nous expliciterons ci-après les liens entre la voie du Trp et le BH4, permettant de s’interroger sur l’implication de cette voie dans toute pathologie de synthèse ou de régénération du BH4.
- Enfin, le régime cétogène constitue un dernier pan reliant la voie du Trp et les MHM. En effet, ce régime, utilisé comme antiépileptique, augmente la concentration en Trp dans le système nerveux central, ainsi que la concentration du neuroprotecteur AK (44). Il semblerait que la voie métabolique du Trp, et en particulier AK, joue un rôle dans l’action antiépileptique du régime cétogène (45,46). Une modulation de la voie du Trp pourrait donc constituer un traitement efficace de certaines épilepsies métaboliques.
1.1.2.2 Pathologies cardiovasculaires
De nombreux auteurs ont impliqué la voie du Trp dans la pathologie cardiovasculaire, que ce soit en tant que facteur de risque (47), modulateur du stress oxydant (48) ou en tant que prédisposition génétique à l’hypertension artérielle (49). Les différentes implications de la voie du Trp dans les maladies cardiovasculaires ont fait l’objet de l’écriture d’une publication dont le but était de mettre en parallèle les similitudes entre voie du Trp et maladies cardiovasculaire (CVD) d’une part, et Trp et cancer d’autre part (Publication n°1).
25
Publication n°1
« Is tryptophan metabolism involved in sleep apnea-related cardiovascular
co-morbidities and cancer progression? »
L Boulet, P Flore, A Le Gouellec, B Toussaint, JL Pépin, P Faure
Medical Hypotheses 2015; 85: 415-23
Is tryptophan metabolism involved in sleep apnea-related
cardiovascular co-morbidities and cancer progression?
L. Bouleta,b,d, P. Florea,b,e, A. Le Gouelleca,c,d, B. Toussainta,c,d, J.L. Pépina,b,d, P. Faurea,b,d,⇑
aUniv. Grenoble Alpes, F-38041 Grenoble, France bINSERM U1042, HP2, F-38041 Grenoble, France
cTIMC/Therex Laboratory, UMR 5525 (CNRS-UJF), Faculty of Medicine, University of Grenoble Alpes, Grenoble F-38041, France dCentre Hospitalier Universitaire Grenoble, Hôpital Albert Michalon, F-38043 Grenoble, France
eCentre Hospitalier Universitaire Grenoble, Hôpital Sud, CS-90338 Echirolles, France
a r t i c l e i n f o
Article history: Received 3 April 2015 Accepted 21 June 2015
a b s t r a c t
Obstructive sleep apnea (OSA) is a multi-component chronic disease affecting 6–17% of adults in the gen-eral population. The main hallmark of OSA, intermittent hypoxia (IH), is reported as the main trigger for cardiometabolic co-morbidities. Recent studies, both in rodent models exposed to IH and in humans, have suggested an enhanced incidence and accelerated progression of cancer. However, mechanisms underlying the relationships between OSA and cardiovascular disease on one hand, and cancer on the other hand, have not been entirely deciphered yet. Tryptophan (TRP) metabolism results in nicotinamid and serotonin production, but also in the production of numerous intermediates such as kynurenine, anthranilic and kynurenic acids, 3-hydroxykynurenine, 3-hydroxyanthranilic and quinolinic acids. Each of these metabolites has been linked to cardiovascular disease and cancer mainly in epidemiologic stud-ies. We hypothesize that an alteration of TRP metabolism may play a role in OSA-related cardiovascular co-morbidities and might be one of the players in the relationship between cancer and intermittent hypoxia/OSA. If this is true, interventions aiming to modify TRP metabolism, may constitute a new ther-apeutic strategy against cardiovascular disease progression and cancer occurrence in OSA populations.
Ó2015 Elsevier Ltd. All rights reserved.
Background
OSA and its co-morbidities
Obstructive sleep apnea (OSA) is a multi-component chronic disease characterized by complete or partial pharyngeal collapse during sleep, resulting in intermittent hypoxia (IH), sleep fragmen-tation and increased respiratory efforts against obstructed airway [1]. Six to seventeen percent of adults are believed to have OSA, representing a serious and growing public health issue. OSA is associated with cardiovascular disease (CVD), like hypertension, arrhythmias, stroke, coronary artery disease (CAD) and metabolic syndrome. Co-morbidities are of major importance because it is well known that they have a significant impact on healthcare use [2]and mortality in patients with OSA[3,4]. Continuous positive airway pressure (CPAP), the first-line therapy for moderate to sev-ere OSA, markedly improves symptoms and quality of life in
symptomatic OSA but has a limited impact when prescribed for reducing cardio-metabolic risk in obese OSA [5–9]. Moreover, OSA may represent a common mechanism for the deadly triad: car-diovascular disease, diabetes, and cancer [10,11]. The precise underlying mechanisms of these OSA-related complications are still incompletely elucidated but might share common mecha-nisms[10].
Tryptophan (TRP) metabolism implication in cardiovascular disease and cancer
Recently, an important role of tryptophan (TRP) metabolism has been identified, both in cardiovascular disease and cancer[12]. TRP is catabolised into different molecules (Fig. 1): one of the major catabolic pathways (95% of TRP catabolism) is the kynurenine (KYN) pathway, leading to nicotinamid (NAD) via production of 3-hydroxyanthranilic acid (3HA); the other one, the serotonin (5HT) pathway, is quantitatively less important (less than 5% of TRP catabolism), but its unsteadiness is well known as a potential factor of depression and neurodegenerative diseases. Indoleamine 2,3 dioxygenase (IDO) is one of the main enzymes implicated in the degradation of TRP to KYN pathway and a cornerstone
http://dx.doi.org/10.1016/j.mehy.2015.06.022
0306-9877/Ó 2015 Elsevier Ltd. All rights reserved.
⇑ Corresponding author at: Institute of Biology and Pathology, Department of Biochemistry, Toxicology and Pharmacology, Grenoble Hospital, CS10207, 38043 Grenoble, France. Tel.: +33 476 76 54 84; fax: +33 476 76 56 64.
E-mail address:PFaure@chu-grenoble.fr(P. Faure).
Medical Hypotheses 85 (2015) 415–423
Contents lists available atScienceDirect
Medical Hypotheses
responsible for the metabolic shift to KYN pathway at the expense of 5HT pathway. Contrary to tryptophan 2,3-dioxygnesase (TDO), IDO activation is strongly dependant of inflammation status and among others, to the presence of interferon-c (INF-c) [13] and TLRs ligands.
Hypothesis
We hypothesize that an alteration of TRP metabolism is also involved in OSA-related co-morbidities and link with cancer. Thus, as a consequence, the modulation of TRP metabolism, with IDO inhibitors or other modulators of the pathway, may represent a new avenue for OSA patients.
Evaluation and discussion of the hypothesis
Tryptophan metabolism, obesity, diabetes and cardiovascular risk A number of studies exploring cardiovascular disease and TRP metabolism have been published during the last decade. The majority of these studies have showed an epidemiologic link between the complex TRP metabolism and cardiovascular risk, but, to our knowledge, the mechanistic link remains unknown.
Obese adults showed significantly elevated kynurenines serum levels and an increased KYN/TRP ratio (KTR)[14]. The elevated KTR in obese patient was shown in another study, and, due to chronic immune activation, persisted in spite of significant weight reduc-tion following bariatric surgery[15]. Moreover, a positive correla-tion between serum concentracorrela-tion of KYN and insulin resistance has been found in patients infected by hepatitis C[16]exhibiting a strong activation of IDO due to INF-c.
In several studies, TRP metabolism has been associated with cardiovascular risk. Indeed, KTR was markedly greater in patients
with established coronary heart disease compared to healthy con-trols[17], and was a predictor of new coronary events[18]. An increase in carotid intima/media thickness (IMT), a marker of atherosclerosis, has been associated with IDO activity [19]. Indeed, IDO presence[20]and increased KYN, 3HK and quinolinic acid (QA) levels[21]have been shown in advanced atherosclerosis plaques. Moreover, evidence suggests a role of INF in destabiliza-tion of atherosclerosis plaque, leading to acute coronary syndrome [22], which might be due to IDO activation. Moreover, there are other links between KYN pathway and atherosclerosis: an increased kynurenic acid (KA) concentration was found in hyper-homocysteinemia (a predictive factor of atherosclerosis) [23], whereas 3HA enhancement was associated with oxidative stress (involved in atherosclerosis by lipids oxidation)[24].
Hypertension is also linked to TRP metabolism since the over-expression of the kynureninase (KYNU) gene, which convert 3-hydroxykynurenine (3HK) into 3HA, but also KYN into anthrani-lic acid (AA) is involved in hypertension[25,26]. Indeed, a higher expression of KYNU mRNA in brainstem of spontaneously hyper-tensive rats (SHR) was shown compared with Wistar–Kyoto rats [25], strongly suggesting that the gene coding for KYNU is one of the genes contributing to central control of blood pressure in SHR. This is concordant with recent data reporting a rare variant KYNU gene in the Han Chinese Population, suffering from essential hypertension[26]. Another study showed that the gene of kynure-nine aminotransferase-1 (KAT), which degrades KYN into KA, is mutated in SHR leading to a decreased activity of the enzyme and a lower concentration of KA in SHR than in Wistar-rats[27].
In cardiac arrest resuscitated patients, the KYN pathway metabolites were significantly higher in patients who died early in intensive care unit compared with survivors, and high 3HA and KA serum levels at admission were independently associated with poor outcomes at 12 months[28]. Moreover, an increased serum and urinary KTR level in CAD patients might predict major
Fig. 1.The tryptophan catabolism via kynurenine and serotonin pathways. Abbreviations for enzymes: IDO: indoleamine 2,3-dioxygenase; KAT: kynurenine aminotransferase; KMO: kynurenine monooxygenase; KYNU: kynureninase; TDO: tryptophan 2,3-dioxygenase; TH: tryptophan hydroxylase; 5HTP DC: 5 hydroxytryptophandecarboxylase.
coronary event and CVD mortality[22,29]. Some authors proposed 5-hydroxy-tryptophan (5HTP), a metabolite of the 5HT pathway, as a potential biomarker for early diagnosis in acute coronary syn-drome, as its level was decreased in serum of patient at diagnosis [30].
It is noteworthy that in stroke, an increased KYN level in serum was seen 24 h after the event compared to controls, and the 3HA/AA ratio was markedly lower in patients compared to controls 14 days post-infarcts. Moreover, a decrease in 3HA level was strongly correlated with infarct volume size. Serum KA level seemed to predict mortality in these patients since people who died within 21 days had significantly higher level of KA than patients who survived[24]. Lastly, in a model of ischemic stroke, blocking KYNU activity has been shown to reduce substantially the size of cerebral infarcts[31].
The role of oxidative stress in cardiovascular disease, such as atherosclerosis, is well known. It appeared that almost all metabo-lites of the KYN pathway have redox properties, pro-oxidant or antioxidant, depending on environment [32]. Indeed, IDO, TDO, TRP and KYN seemed to be most of the time antioxidant, but can also be pro-oxidant in numerous in vitro conditions. On the other hand, 3HK and 3HA had a predominant pro-oxidant activity but can also be antioxidant. To our knowledge, KA possesses just anti-oxidant activity, whereas QA seemed to be only pro-oxidant [32]. The precise degree of involvement of these metabolites in redox balance is complex because of the multiple interactions between environment and pathology. It constitutes a fertile line of research to investigate.
Obstructive sleep apnea, obesity, diabetes and cardiovascular risk The association between OSA and obesity is well known, as 60– 90% of OSA patients are obese[33]. Even modest weight gain or loss respectively results in a significant worsening or improvement of sleep apnea in middle-aged individuals [34], whereas severe weight reduction by controlled diet or surgical means reduces OSA severity[35]. Moreover, apnea-hypopnea index (AHI) is signif-icantly correlated with intra-abdominal fat[36], and visceral fat accumulation is an important risk factor for OSA in obese patients [37], as for CVD[38]. Dyslipidemia is a prevalent finding in OSA population: total serum cholesterol and triglycerides levels is increased in OSA patients whereas high-density lipoproteins is decreased, independently of age and body mass index [39]. Besides, CPAP treatment lowers serum total cholesterol levels in some studies, but with limited clinical relevance compared to that of statins effect[7].
Insulin resistance has been shown to be independently associ-ated with OSA in normal-weight patients[40], as well as in obese OSA patients [41]. Moreover, increasing AHI is associated with worsening insulin resistance independently of obesity[41]. These findings have been confirmed by a large-scale epidemiologic study [42]. An enhanced proportion of type 2 diabetes mellitus and impaired glucose tolerance have been shown in OSA patients (30% and 20% respectively)[43]. These studies have shown a perni-cious association between OSA and insulin resistance, promoting CVD[44].
A strong causal relationship between OSA and hypertension has been shown in animal models[45], and in human epidemiological [46,47], prospective [48], and interventional studies [49]. Moreover, epidemiologic studies have shown an elevation of mor-tality and morbidity in OSA patients due to CVD and particularly stroke[50], and an increased incidence of heart failure in such a population, despite equivocal results for coronary heart disease [51]. Our group[52]and others[53]demonstrated an accelerating role of IH in atherosclerosis progression in apoE knockout mice (which develop spontaneously atherosclerosis). These studies
suggest that IH needs an additional factor such as dyslipidemia or inflammation, to cause or accelerate atherosclerosis. However, CPAP treatment, by suppressing intermittent hypoxia, reduces CVD morbidity and mortality[54,55].
As suggested previously, TRP metabolism may modulate oxida-tive stress, which has been recognized as a pivotal component in the pathophysiology of OSA and cardio-metabolic diseases [56,57]. Indeed, reactive oxygen species (ROS) are signaling mole-cules activating several detrimental cascades and have a role in cardiac injury, pre- and post-conditioning cardioprotection, dia-betes, and production of Nuclear Factor Kappa B (NF-jB) and hypoxia-inducible transcription factor 1 (HIF1) alpha transcrip-tional factors[58]. Increased oxidative stress underlies the patho-physiology of diabetes by impaired glucose uptake in muscle and fat and decreased insulin secretion [59]. It also contributes to hypertension [60], hyperlipidemia [61], insulin resistance [62] and obesity [63]. IH can then be beneficial by enhancement of the antioxidant defenses, or be deleterious by overproduction of ROS, depending on IH intensity, genetic susceptibility, life habits and environment[56]. ROS formation is enhanced in OSA patients compared to healthy subjects[64]leading to oxidative stress, but the contribution of OSA per se and its associated comorbidities to this increased oxidative stress remains unclear[7]. CPAP treatment appears to have a beneficial effect on oxidative stress in the major-ity of open studies done to date[7]. However, it was only investi-gated in one randomized sham-controlled trial[65], which limits the ability to conclude.
Inflammation also has a role in OSA since IH can activate NF-jB transcription in mouse[66]and culture cell, with no activation of HIF-1[67], and can be up-regulated in OSA patients[68], leading to an activation of inflammation (69). This activation is due, at least in part, to oxidative stress[70].
Fig. 2is a schematic representation showing the strong relation-ships between OSA and cardiovascular risk, in part due to oxidative stress and inflammation, and similar links between TRP metabo-lism and cardiovascular disease. Hypoxia is also directly associated with this TRP pathway, as an increased KA concentration was found in the brain of rats after neonatal hypoxia[71]. As molecular mechanisms have not been entirely elucidated therefore, we hypothesized that TRP metabolism might be one of the mecha-nisms involved in cardiovascular disease in OSA.
Tryptophan metabolism and cancer
In term of cancer research, TRP catabolism is increasingly being recognized as one of the key hallmarks of tumor escape to immune response. Briefly, key publications established this link. Historically, in the 1950s, urines of bladder cancer patients have been shown to present elevated level of AA, 3HA, KYN and 3HK [72]. Then in 1998, Munn and Mellor highlighted the link between immune tolerance and KYN pathway, and described the role of IDO that protects the mammalian fetus from maternal T-cell attack [73]. And more recently, subsequent studies developed that IDO activation could be a mechanism of immune suppression and immune tolerance that promotes the growth of tumor (reviewed in[74,75]).
The tryptophan-catabolizing enzymes in cancer that catabolize the first and rate-limiting step of TRP degradation along the KYN pathway, are IDO1 and 2 and TDO. They differ in structure, activity, regulation and tissular expression[76]. TDO is mostly expressed in liver and negligible in other normal tissues, and is responsible for the blood TRP homeostasis by metabolism of dietary TRP. Compilation of TDO expression form transcriptomic data of 9,169 human tumors, show a significant high level of TDO in various tumors compare to normal tissues. Moreover, TDO-expressing tumors in mice grow faster than TDO-not expressing tumors
[77]. IDO1 and 2 genes are both detectable in human but only IDO1 play a role in cancer[76]. IDO1 gene is weakly or not expressed in normal tissues, except in matured dendritic cells (DC) and lung parenchyma and some female cells (placenta, etc. . .) and expres-sion is commonly observed in human tumors both at RNA and pro-tein levels[78]. Various maturation stimuli as lipopolysaccharide, cytokines and prostaglandin-E2 (PGE2) can induce IDO1 in monocytes-derived DC. IDO1 deplete TRP in the local microenvi-ronment and thereby impaired T-cell mediated immune responses. Some downstream metabolites, namely 3HA and QA, have also a toxic action toward T-cells in vitro[79,80]. In vitro, transfection of recombinant IDO gene into tumor cell lines conferred on them the ability to inhibit antigen-specific T-cell responses [81]. Moreover, in vitro studies indicated that IDO expression by DC could promote the differentiation of regulatory T cells (Tregs), inducing immune tolerance, from naïve CD4+T cells[82]. In the
light of these results, IDO expressing DC has been proposed as one mechanism inducing tumor-immune tolerance[83]. 3HA has been shown to induce apoptosis in monocyte/macrophage cell line by an oxidative stress, involving production of hydrogen peroxide [84]. This molecule has also been shown to cause an increase in Tregs and a decrease in Th17[85]. These results, combined with the fact that Tregs have been shown to be a key component of acquired tolerance to tumors[86], suggest that 3HA may play an important role in suppressing immunity against tumors.
The 3 heme containing dioxygenase enzymes (TDO, IDO1 and IDO2) harbor some structural specificities concerning active site topology explaining why inhibitory molecules do not acts similarly on the 3 enzymes[87,88]. Initially IDO inhibitors have been devel-oped, the mains being the L or D enantiomers of 1-Methyl-D,L-tryptophan (1MT). 1DMT is under investigation in different clinical trials either alone or in combination with other
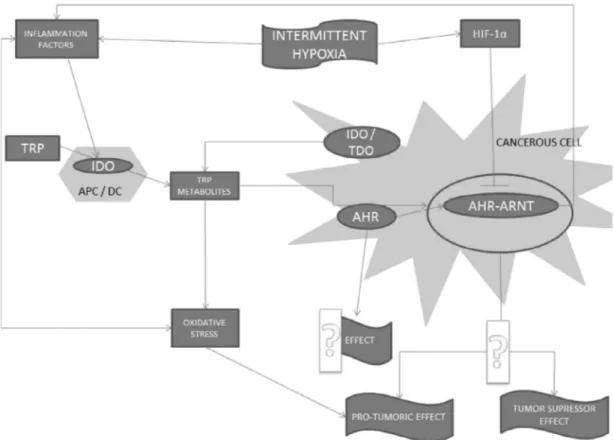
cancer therapies. More recently a new molecule based on a fluo-roderivative of indole (LM10), inhibiting TDO has been proven in mice to be useful in reversing tumoral immune resistance[77]. Selective inhibitors of IDO2 have also been isolated, one of the best being tenatoprazole a known proton pump inhibitor used in gastric ulcers therapy. Nevertheless it appears that a global tryptophan to kynurenine metabolism inhibitor able to block both TDO, IDO1 and IDO2 could improve efficacy in cancer treatment. Interestingly a series of classical antifungal imidazoles such as econazole, clotri-mazole displayed such a global inhibitory activity that could be used in clinic has they showed little effect on cellular toxicity[89]. A lot of studies and excellent reviews[90]have shown a link between TRP degradation via the KYN pathway and human aryl hydrocarbon receptor (AhR). Briefly, to regulate gene expression, cytosolic AhR needs to enter into the nucleus where it can be linked with AhR nuclear factor (ARNT) and this heterodimer is nec-essary for AhR transcriptional activity. The tumor-promoting role of the AhR has been established as transgenics mice with a consti-tutively active AhR spontaneously develop tumors[91]. Moreover, down regulation of AhR repressor (AhRR) expression enhances motility and invasion of cancer cell line in vitro and angiogenic potential in vivo, whereas expression of this repressor decreases cell growth and angiogenic potential[92]. Contradictory observa-tions about AhR had been reported in recent studies, leading to the idea that activation of AhR, depending on its activating ligand, can induce immunity or tolerance [93]. Indeed, AhR activation might be both pro-tumorigenic or tumor suppressor[94], since it is involved in differentiation of pro-inflammatory TH17 cells and Tregs[95], but its effects depends on ligands and the surrounding environment.
KYN has been shown to be positively correlated with transloca-tion of AhR into the nucleus within 1 h, enabling AhR translocatransloca-tion
Fig. 2.Schematic link between intermittent hypoxia and tryptophan metabolism in cardiovascular disease. Abbreviations: APC: antigen-presenting cells; DC: dendritic cells; IDO: indoleamine-2,3-dioxygenase; TRP: tryptophan. Inflammation and oxidative stress are well known as enhancers of cardiovascular complications. Enhanced oxidative stress induces inflammation, which in turn exacerbates oxidative stress. Intermittent hypoxia promotes cardiovascular disease. Inflammation activates IDO leading to an increased TRP catabolism via the kynurenine pathway, whereas TRP metabolites modify the redox balance. Epidemiological studies showed a link between TRP metabolites and cardiovascular disease, but the mechanism remains unknown.
Fig. 3.Schematic link between hypoxia and tryptophan (TRP) metabolism in cancerogenesis. Abbreviations: AHR: aryl hydrocarbon receptor; ARNT: AHR nuclear transcriptor; APC: antigen-presenting cells; DC: dendritic cells; HIF-1: hypoxia-inducible factor-1a; IDO: indoleamine-2,3-dioxygenase; TDO: tryptophan 2,3-dioxygenase; TRP: tryptophan. Inflammation activates IDO leading to an increase TRP catabolism via the kynurenine pathway, whereas TRP metabolites modify the redox balance. Cancerous cells modifies their environment via the canonical action of AHR, influencing the balance of tumorigenicity. Hypoxia, via the synthesis of HIF-1a, decreases the canonical action of AHR by its binding with ARNT. TRP metabolites also influence AHR: indeed kynurenine seems to help AHR translocation into the nucleus, and some TRP metabolism were AHR ligands. What it still remained uncertain is the effect of the non-canonical action of cytoplasmic AHR, and the mechanism modulating the tumorigenic balance of AHR.
Fig. 4.Schematic link between OSA and tryptophan (TRP) metabolism in cardiovascular disease and cancerogenesis. Arrows represent links between the different protagonists. The major question is the existence of a direct link between intermittent hypoxia and TRP metabolites. Seconds are mechanisms by which TRP metabolites are linked to cardiovascular disease and cancerogenesis. And third, by which way TRP metabolites can influence inflammation factors?
into the nucleus[96]. IDO and TDO sur-expression in cancerous cells has been linked with reduced survival rates[97], therefore there seems to exist a positive feedback loop between these two pathways. This is in agreement with the fact that AhR activation induces IDO expression by DC[93]. Moreover, one of the molecules synthetized by AhR activation is NF-jB, which is critical for the induction of IDO[98]. Other products of the KYN pathway, as KA and xanthurenic acid (XA), are also AhR ligand[99]and KA levels have been positively correlated with the size of pancreatic adeno-carcinomas[100].
Inflammation also plays a role in TRP catabolism regulation. Indeed, interleukin-6 (IL-6) down regulation of INF-c expression decreased KYN production and initiated T-cell apoptosis in vitro [101]. Reciprocally, TRP pathway can also regulate IL-6 production since IDO has been shown to enhance IL-6 production[102], like KA in presence of IL1B via induction of AhR pathway[99]. In addi-tion, KYN pathway can be enhanced in response to inflammatory stimuli via IDO.
In conclusion, although it is not fully understood, changes in the complex interactions between Trp pathway, AhR, inflammation and oxidative stress may favor a pro-tumoric environment. OSA and cancer
It has been recently suggested that OSA and IH play a role in cancer occurrence and progression [103]. Some authors have shown a dose–response association between OSA and some cancer-specific mortality[104], whereas others reported that the severity of obstructive sleep apnea was not independently associ-ated with the prevalence or incidence of cancer [105]. In an Australian population, moderate to severe OSA was associated with an increase of cancer incidence and mortality, but without evidence for a dose–response relationship[50]. Also some authors hypothesized that OSA may be a cause of overall cancer develop-ment through IH[106], other were not able to prove it, but found that the level of oxygen desaturation was associated with the development of smoking-related cancer[11,105].
In a mouse model of OSA, IH was associated with accelerated cancer progression[107], and an enhanced number of lung metas-tasis [108]. Others authors showed that a tumor placed in a hypoxic microenvironment synthesized HIF-1, thereby activating the expression of vascular endothelial growth factor (VEGF) [109], leading to tumor neovascularization and dissemination [110]. Interestingly, the circulating VEGF level was significantly higher in OSA patients compared to non-OSA[109].
Another interesting point is the link between HIF-1aand AhR pathway. Indeed, ARNT, the binding partner required by AhR to regulate gene expression, was also required by HIF-1a [111]. Hypoxia can thus inhibit AhR activation[112], probably by com-peting for heterodimer formation with the ARNT, the same way by which AhRR represses the transcription activity of AhR[92]. It seems that hypoxia might decrease AhR-ARNT activation (also called classical mechanism of AhR action) in the nucleus, but hypoxia may also be able to increase cytosolic AhR activity (non-classical mechanism) [113]. More studies are required to explain the complex and diverse actions of AhR (which are depend-ing of ligand, but also species and cells), and to determine the role of hypoxia as a modulating factor.
Inflammation also plays a role in cancer progression since population-based studies have shown that the use of anti-inflammatory agents was associated with a reduced incidence of some cancers[114]. Moreover, if inflammation is present in a tumor microenvironment, it contributes to tumor proliferation, angiogenesis, metastasis and resistance. This inflammation -induced metastasis involved cytokines such as tumor necrosis factor-a(TNFa) and IL-6, which have been shown to be commonly
increased in the bloodstream of animals exposed to intermittent hypoxia[115]and in OSA patients[69].
Finally, enhanced mortality and morbidity of cancer in OSA patients might be related to both AhR activity and inflammation, as seen in TRP metabolism.Fig. 3presents common mechanisms by which intermittent hypoxia and TRP metabolism may lead to cancerogenesis.
Conclusion
In this article, we have shown that TRP metabolism may play a central role in the associations between OSA, cardiovascular risk and cancerogenesis. It is also noteworthy that cardiovascular risk and cancerogenesis often share obesity as a common risk factor. Also, weight reduction has been associated with reduced cancer risk too[116]. Moreover, recent epidemiologic studies have identi-fied AhR upregulation as contributory to cardiovascular risk[117]. Fig. 4summarizes potential links between OSA and TRP meta-bolism, which merit further exploration. Indeed, as many previous studies have been more epidemiologic rather than mechanistic, the precise effects of each TRP catabolites in cancerogenesis and car-diovascular disease, and its link with IH, are still unknown. Therefore, a reliable quantification of TRP catabolism in OSA patients is necessary, both through KYN and 5HT pathways, in con-junction with mechanistic studies. We have recently developed TRP metabolism measures, using tandem mass spectrometry cou-pled with liquid chromatography in our laboratory.
This approach may lead to therapeutic options, as some authors have viewed IDO or TDO inhibitors as a potential anticancer ther-apy[77,118]. However, other potential targets in TRP metabolism need to be explored. The comprehension of mechanisms linking TRP metabolism to cardiovascular disease is necessary before per-forming interventional studies.
Finally, our knowledge about TRP metabolism and its involve-ment in cardiovascular disease and cancer and possibly in OSA has increased dramatically. A more thorough understanding of the TRP metabolism alterations linking these 3 diseases, as well as the development of pharmacological tools that can modulate this metabolism might influence the care management of OSA patients.
Conflict of interest
There are no conflicting interest. Acknowledgment
The authors thank Miss Mendelson (Ph.D.) for English corrections.
References
[1]Dempsey JA, Veasey SC, Morgan BJ, O’Donnell CP. Pathophysiology of sleep apnea. Physiol Rev 2010;90(1):47–112.
[2]Jennum P, Kjellberg J. Health, social and economical consequences of sleep-disordered breathing: a controlled national study. Thorax 2011;66(7):560–6. [3] Kendzerska T, Gershon AS, Hawker G, Leung RS, Tomlinson G. Obstructive sleep apnea and risk of cardiovascular events and all-cause mortality: a decade-long historical cohort study. In: Patel A, editor. PLoS Med, vol. 11, no 2; 2014. p. e1001599.
[4]Baguet J-P, Barone-Rochette G, Tamisier R, Levy P, Pépin J-L. Mechanisms of cardiac dysfunction in obstructive sleep apnea. Nat Rev Cardiol 2012;9(12):679–88.
[5]Pépin J-L, Tamisier R, Lévy P. Obstructive sleep apnoea and metabolic syndrome: put CPAP efficacy in a more realistic perspective. Thorax 2012;67(12):1025–7.
[6]Chirinos JA, Gurubhagavatula I, Teff K, Rader DJ, Wadden TA, Townsend R, et al. CPAP, weight loss, or both for obstructive sleep apnea. N Engl J Med 2014;370(24):2265–75.