HAL Id: tel-01823844
https://tel.archives-ouvertes.fr/tel-01823844
Submitted on 26 Jun 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
global de végétation : analyse de trois approches
complémentaires axées sur les écosystèmes forestiers
Marc Peaucelle
To cite this version:
Marc Peaucelle. Utilisation des traits fonctionnels au sein d’un modèle global de végétation : analyse de trois approches complémentaires axées sur les écosystèmes forestiers. Ecosystèmes. Université Pierre et Marie Curie - Paris VI, 2016. Français. �NNT : 2016PA066238�. �tel-01823844�
Université Pierre et Marie Curie
THÈSE DE DOCTORAT
ECOLE DOCTORALE DES SCIENCES DE L’ENVIRONNEMENT D’ILE DEFRANCE
U
TILISATION DES TRAITS FONCTIONNELS AU SEIN
D
’
UN MODÈLE GLOBAL DE VÉGÉTATION
A
NALYSE DE TROIS APPROCHES COMPLÉMENTAIRES AXÉES
SUR LES ÉCOSYSTÈMES FORESTIERS
présentée parMarc Peaucelle
Présentée et soutenue publiquement le 25 Mai 2016 devant le jury composé de :
Dr. Nicolas Viovy, Directeur de thèse
Dr. Philippe Ciais, Co-directeur de thèse
Dr. Pierre Ribstein, Président du jury
Dr. Eric Garnier, Rapporteur
Dr. Denis Loustau, Rapporteur
Dr. Isabelle Chuine, Examinateur
Remerciements
La thèse peut paraître un travail solitaire mais c’est en réalité une aventure partagée avec de nombreuses personnes : collègues, famille et amis. Voilà que ces trois années de thèse s’achèvent, il est temps de vous remercier.
Je tiens à remercier mes deux directeurs de thèse Nicolas Viovy et Philippe Ciais qui m’ont accueillis, guidé depuis la construction de mon projet jusqu’à son aboutissement, et qui se sont toujours montré disponibles durant ces trois années. Que ce soit d’un point de vu scientifique ou technique, je n’aurais jamais aboutit à ce manuscrit sans leurs conseils éclairés.
Valentin Bellassen, à l’origine de cette aventure et sans qui je ne serais pas arrivé au LSCE. Depuis le début de mon stage de master jusqu’au différents comités de thèse accompagné de Denis Loustau, ils m’ont toujours remis sur les rails lorsque j’avais tendance à m’égarer.
A l’ONF, je tiens à remercier Jean-François Dhôte et Christine Deleuze qui m’ont permis de travailler sur une problématique différente et m’ont fait découvrir un autre aspect de la recherche à travers la mission de conseil que j’ai effectué à leur côté, ainsi qu’aux côtés des différents acteurs impliqués dans le projet. Je remercie aussi Manuel Nicolas, toujours présent et de bon conseil, ainsi que toute l’équipe de RENECOFOR, dont les données d’observation, très précieuses, m’ont permis de mettre un pied dans le monde de la phénologie.
Je remercie Cédric Bacour pour son aide inestimable et les pauses café du midi, et sans qui une partie de ce travail n’aurait pu avoir lieu. Je remercie aussi Philippe Peylin, Fabienne Mai-gnan, Natasha Macbean, Nicolas Vuichard et tous ceux ayant eu des remarques constructives tout au long de ce projet.
Un clin d’oeil particulier à Amélie, qui a supporté tout ce temps la vue de mon bureau si bien rangé et l’odeur de café, au habitants du 712 et à tous les collègues qui ont été présent durant ces trois années.
Je remercie aussi les différents membres du jury, acteurs fondamentaux de ce projet, d’avoir accepté de prendre le temps d’évaluer ce travail.
chauffer.
Résumé
Dans les modèles globaux de la biosphère continentale, toute la végétation mondiale est généralement représentée par une dizaine de grand groupes fonctionnels (PFT-Plant Functional
Type), dont les caractéristiques (traits) sont fixes. Cette rigidité ne permet pas de représenter
correctement l’évolution de la végétation face aux pressions environnementales et anthropiques grandissantes, et est à l’origine de nombreuses incertitudes pour l’estimation des cycles bio-géochimiques associés.
Trois approches complémentaires axées sur l’utilisation des traits fonctionnels ont été ex-plorées à l’aide du modèle dynamique global de végétation ORCHIDEE afin d’améliorer la re-présentation des PFTs forestiers. La première approche consiste à augmenter le nombre de PFTs à partir d’une classification hiérarchique des espèces. La seconde approche permet d’extrapoler les traits observés pour chaque PFT existant grâce à des relations empiriques calibrées à partir de plusieurs variables environnementales. La dernière approche utilise la théorie de la coordi-nation de la photosynthèse afin d’estimer des distributions continues de traits en conditions optimales de photosynthèse. En parallèle, cette étude s’interroge sur les capacité d’un modèle global à représenter correctement les traits fonctionnels lorsqu’il est optimisé pour un flux de carbone
L’augmentation du nombre de PFTs permet d’améliorer significativement les caractéris-tiques et la représentativité spatiale des peuplements simulés de plus de 50%. Les deux autres approches permettent d’estimer des distributions de traits réalistes et mettent en évidence un rôle “tampon” important de la plasticité des traits sur les flux de carbone futurs. Les trois approches abordées ont mis en évidence certaines faiblesses du modèle liées à la représen-tation de la phénologie, de l’allocation de la biomasse ou encore du stress hydrique pour les conifères. Ces résultats ont menés à la mise en place d’une représentation explicite des proces-sus phénologiques pour les conifères sempervirents dans ORCHIDEE, qui à présent reproduit les dynamiques de LAI observées par télédétection. Enfin, le modèle ORCHIDEE ne peux pas être paramétré avec des observations directes de traits, privilégiant l’approche théorique pour simuler les distributions de traits. Cependant, l’assimilation de données d’observations de flux de carbone permet de faire le lien entre les traits mesurés à l’échelle foliaire et leur intégration à l’échelle de la canopée. Elle permet de retrouver des distributions de traits cohérentes avec les observations, ainsi que des relations trait-trait et trait-environnement qui sont observées à l’échelle foliaire.
tionnels, carbone, gestion forestière, phénologie, conifères
Abstract
Earth system models currently use a discretized representation of vegetation, grouping together the whole world species into a dozen of Plant Functional Types (PFT), whose characteristics (traits) are fixed. This rigidity does not allow to accurately represent the evolution of ecosystems and their associated bio-geochemical cycles, while vegetation is facing stronger environnemen-tal and anthropogenic pressures.
Three complementary approaches based on functional traits were tested in order to improve the representation of forests in the dynamic global vegetation model ORCHIDEE. Based on a hierarchical classification of species, the first approach is to increase the number of PFTs. The second approach extrapolates observed traits for each PFT from empirical relationships calibra-ted against different environmental variables. The last one uses the photosynthesis coordination theory which allows the estimation of functional traits in optimal photosynthesis conditions. In addition, this study explores the capacity of a global model to represent functional traits when optimized against a given carbon flux.
Increasing the number of PFTs significantly improves the estimations of stand characte-ristics and their spatial distribution by more than 50%. The two other approaches managed to reproduce realistics traits distributions and higlighted the “buffer” role of traits plasticity on futur carbon fluxes. Some weaknesses of the model linked to phenological processes, biomass allocation or hydric stress, emerged for conifers species. This led to the implementation of an explicit representation of the phenology for evergreen needleleaves PFTs in ORCHIDEE, which can now reproduce the LAI dynamic observed from remote sensing data. Finally, the ORCHIDEE model cannot be calibrated with in situ observations, emphasizing the theoretical approach to simulate continuous traits distributions. However, the assimilation of observed carbon fluxes allows to bridge the gap between traits measured at the leaf scale and the canopy. It reproduced consistent trait distributions with observations, and led to trait-trait and trait-environment relationships similar to those observed at the leaf scale.
Keywords : global vegetation model, ORCHIDEE, climate change, functional traits, carbon,
T
ABLE DES MATIÈRES
Table des figures x
Figures Supplementaires xii
Liste des tableaux xii
Tableaux Supplementaires xiii
1 Contexte général de l’étude et problématique 1
1.1 La forêt et son impact sur le climat . . . 3
1.2 Des pressions environnementales et anthropiques de plus en plus fortes . . . 6
1.3 Répondre aux enjeux actuels par la modélisation . . . 9
1.4 Vers une représentation de la végétation axée sur les traits fonctionnels . . . 11
1.5 Le modèle biosphérique ORCHIDEE . . . 13
1.6 Objectifs et étapes de cette étude . . . 19
2 Approche 1 : Discrétisation optimale en plusieurs PFTs 21 2.1 Introduction . . . 24 2.2 Method . . . 26 2.3 Results . . . 36 2.4 Discussion . . . 40 2.5 Conclusion . . . 47 2.6 Supplementary material . . . 48
3 Validation de l’approche 1 : modélisation des peuplements de conifères français 51 3.1 Introduction . . . 54 3.2 Method . . . 55 3.3 Results . . . 61 3.4 Discussion . . . 68 3.5 Conclusion . . . 74 3.6 Supplementary material . . . 75
4 Amélioration de la simulation des processus phénologiques pour les conifères tempérés 81 4.1 Introduction . . . 84
4.2 Method . . . 86
4.3 Results . . . 97
4.4 Discussion . . . 114
4.5 Conclusions and perspectives . . . 118
4.6 Supplementary material . . . 119
4.7 Etudes complémentaires . . . 127
5 Approche 2 : Acclimatation des traits aux conditions climatiques 135 5.1 Introduction . . . 138 5.2 Méthode . . . 141 5.3 Résultats . . . 151 5.4 Discussion . . . 174 5.5 Conclusion et perspectives . . . 179 5.6 Informations supplémentaires . . . 180
6.1 Introduction . . . 188 6.2 Méthode . . . 189 6.3 Résultats . . . 198 6.4 Discussion . . . 216 6.5 Conclusions . . . 226 6.6 Informations Supplémentaires . . . 228 7 Conclusions et perspectives 229 7.1 Résumé des principaux résultats . . . 230
7.2 L’objectif initial de thèse est-il atteint ? . . . 232
7.3 Perspectives . . . 233
Bibliographie 235 Annexe A : Mission de conseil au sein de l’ONF 255
T
ABLE DES FIGURES
1.1 Figure issue de Spracklen et al. 2008 résumant l’impact des différents processus bio-physiques et bio-chimiques liés aux milieux forestiers. . . 31.2 Figure issue de Pan et al. (2011). Représentation des flux de carbone pour différents biomes et différentes régions pour les périodes 1990-1999 et 2000-2007. . . 5
1.3 Structure du modèle ORCHIDEE . . . 14
2.1 Representation of the ORCHIDEE-FM model and related processes. . . 26
2.2 Boxplot representation of parameters for each species. . . 37
2.3 Boxplot representation of parameters for each species.(continued) . . . 38
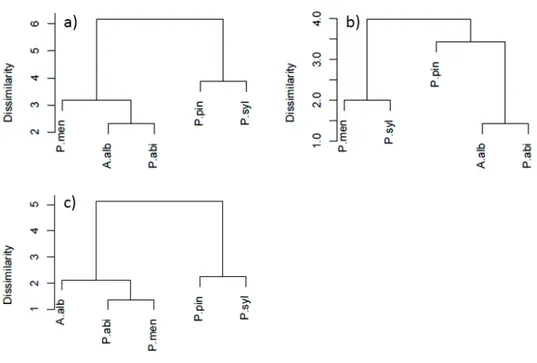
2.4 Clusters of species. . . 40
2.5 Distribution of the difference between observed and simulated volume increment. . . 41
3.1 Relationship between rdi and the dominant height . . . . 57
3.2 Interpolated NFI observations for 50y and 90y old stands. . . 60
3.3 Synthesis of S1, S2 and S3 simulations with 1, 2 or 5 PFTs. . . 64
3.4 Stand volume error for S1 . . . 65
3.5 Distribution of stand variables for S2. . . 66
3.6 Comparison between reference and S3 simulation. . . 67
3.7 Synthesis of S3 simulations with 1, 2 or 5 PFTs. . . 68
4.1 Localization of the 51 coniferous sites. . . 86
4.2 Chilling and forcing temperatures sums for a Pseudotsuga mensiezii stand. . . . 91
4.3 Budburst model optimization results for all species together. . . 99
4.4 Budburst model results for the validation dataset for each species and each model. . . 101
4.5 Results for each site and each year for the best model with all species together. . . 102
4.6 Comparison of optimization results for models M6, M7 and M9. . . 103
4.7 Possibility line between chilling and forcing units. . . 104
4.8 Correlation between Fcr i tand Tlong . . . . 104
4.9 Comparison of optimization results with temperature acclimation. . . 105
4.11 Needle survivorship probabilities. . . 106
4.10 Budburst model results at 0.25° and 0.5° spatial resolution. . . 107
4.12 Relationship betweenµ and λ parameters and the critical needle age of trees. . . . 108
4.14 Comparison between mean MODIS and observed budburst. . . 110
4.15 Temporal evolution of the mean budburst dates simulated from 1970 to 2100 for each model 111 4.16 Spatial distribution of needle emergence dates simulated by each model. . . 112
4.17 Evolution of the spatial distribution of needle emergence from 1970 to 2100 . . . 113
4.18 Temporal evolution of the mean budburst date with temperature acclimation. . . 114
4.19 Comparison between optimizations using RMSE or DIST metrics. . . 115
4.20 ORCHIDEE-FM simulations with phenological processes . . . 128
5.1 Résultats de la validation de la coordination de la photosynthèse parMaire et al.(2012) . . . 140
5.2 Etapes d’estimation des traits via la coordination de la photosynthèse . . . 147
5.3 Distribution spatiale des IC Vcmax25pour chaque PFT . . . 151
5.4 Comparaison des Vcmax25simulés avec deux relations différentes . . . 152
5.5 Distribution latitudinale des traits sur la période historique avec les relations traits-climat . . 153
5.6 Distribution latitudinale du ratio Jmax/Vcmax sur la période historique avec ORCve . . . . . 154
5.7 Distribution latitudinale des traits sur la période historique avec la coordination de la photo-synthèse . . . 156
5.8 Représentation de l’évolution spatio-temporelle de Vcmax25de 1901 à 2014 . . . 158
5.9 Représentation de l’évolution spatio-temporelle de SLA de 1901 à 2014 . . . 159
5.10 Représentation de l’évolution spatio-temporelle de Lag e,cr i tde 1901 à 2014 . . . 160
5.11 Distribution spatiale de Vcmax25et SLA simulés via ORCve . . . . 160
5.12 Distribution spatiale de Vcmax25et SLA simulés via ORColes . . . . 161
5.13 Représentation de l’évolution spatio-temporelle de Vcmax25de 2006 à 2090 . . . 162
5.14 Représentation de l’évolution spatio-temporelle de SLA de 2006 à 2090 . . . 163
5.15 Distribution latitudinale de la GPP pour chaque PFT pour la période 2000-2010 . . . 164
5.16 Carte des différences relatives de GPP simulées et observées . . . 165
5.17 Évolution de la GPP sur la période 2010-2090 . . . 166
5.18 Évolution de la GPP sur la période 2010-2090 pour chaque PFT . . . 167
5.19 Évolution de la variabilité spatiale et temporelle de la GPP sur la période 1982-2011 . . . 168
5.20 Distribution de la variabilité temporelle de la GPP . . . 170
5.21 Impact de la sensibilité des traits au CO2 . . . 171
5.22 Évolution de la GPP sur la période 2010-2090 pour chaque PFT . . . 172
5.23 Comparaison de différence de GPP avec les traits mis à jours tous les 5 ou 15 ans . . . 172
5.24 Carte des différences relatives de GPP simulées et observées . . . 173
5.25 Comparaison de la GPP simulée avec ORCco et ORColes sur la période 1910-2014 . . . 174
6.1 Représentation schématique du déplacement du CO2au niveau de la canopée. . . 190
6.2 Répartition des différentes tours à flux du réseau FLUXNET . . . 191
6.3 Classement des données de la base TRY en PFT d’ORCHIDEE . . . 194
6.4 Schéma des paramètres optimisés . . . 195
6.5 Densité des données de flux obtenues du réseau FLUXNET . . . 197
6.6 Distribution des RMSE relatives et des coefficient de variation des traits . . . 198
6.7 Comparaison des GPP optimisées pour chaque PFT . . . 199
6.8 Matrice des correlations des erreurs sur les paramètres . . . 200
6.9 Distribution des paramètres optimisés . . . 201
6.10 Comparaison des corrélations entre traits selon la performance des optimisations. . . 202
6.11 Illustration des différences de corrélations obtenues selon le critère de sélection des optimi-sations. . . 203
6.12 Matrice des corrélations entre paramètres pour tous les PFTs . . . 204
6.13 Relations linéaires globales entre différents paramètres . . . 206
6.14 Comparaison de la variabilité temporelle et spatiale pour chaque paramètre . . . 207
6.15 Comparaison des matrices de corrélations entre paramètres par groupes de PFTs . . . 208
6.16 Relations lai_max-mat et lai_max-sw pour tout les PFTs . . . . 209
6.17 Matrices de corrélations traits-environnement . . . 210
6.18 Relations linéaires traits-environnement observées pour les PFTs décidus . . . 211
6.19 Relations linéaires traits-environnement observées pour les PFTs sempervirents . . . 212
6.20 Comparaison des RMSE avec ou sans contrainte du SLA . . . . 214
6.21 Comparaison des matrices de corrélations trait-trait avec ou sans trade-off SLA=f(Lag e,cr i t) . 215 6.22 Comparaison des matrices de corrélations trait-environnement avec ou sans trade-off SLA=f(Lag e,cr i t) . . . 215
l’écosystème. . . 219
6.24 Résumé des relations trait-trait obtenues pour les PFTs sempervirents . . . 223
6.25 Résumé des relations trait-trait obtenues pour les PFTs décidus . . . 224
F
IGURES
S
UPPLEMENTAIRES
2.1 Representation of the Mahalanobis distance between each species for photosynthesis and biomass parameters. . . 482.2 Evolution of the relative density index against the dominant height over a rotation for a stand of Picea abies. . . . 49
3.1 Hierarchical classification without Vcmax25 . . . 79
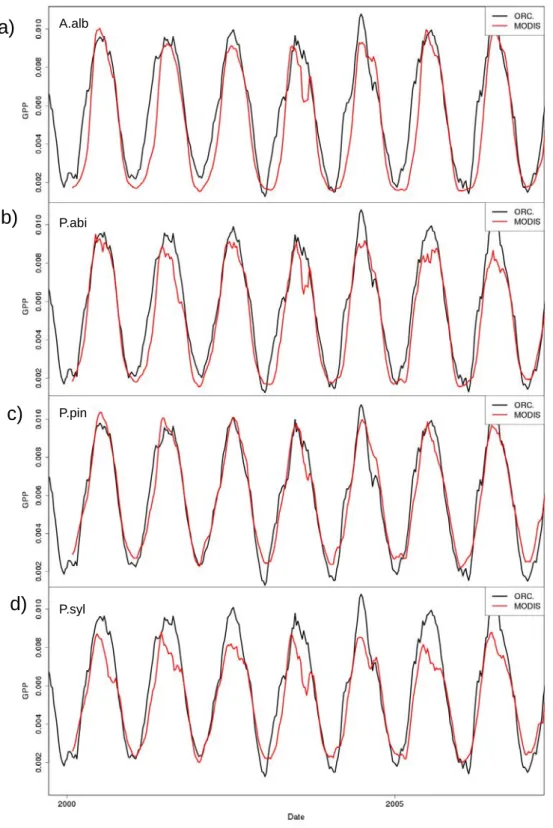
3.2 Comparison of mean seasonal GPP variations between MODIS observations and ORCHIDEE outputs . . . 80
4.1 Budburst model optimization results for all species using the validation dataset. . . 119
4.2 Budburst model optimization results for firs using the validation dataset. . . 120
4.3 Budburst model optimization results for pines using the validation dataset. . . 121
4.4 Results for each site and each year for the best fit obtain with pines (model M7). . . 122
4.5 Evolution of mean budburst from 1970 to 2100 without M4 and M5. . . 123
4.6 Comparison of mean budburst with linear or exponential acclimation to longterm tempera-tures . . . 123
5.1 Comparaison des Jmax25simulés avec deux relations différentes . . . 180
5.2 Distribution spatiale des IC SLA pour chaque PFT . . . . 181
5.3 Représentation de l’évolution spatio-temporelle de Jmax25de 1901 à 2014 . . . 182
5.4 Représentation de l’évolution spatio-temporelle de Jmax25de 2006 à 2090 . . . 183
5.5 Représentation de l’évolution spatio-temporelle de Lag e,cr i tde 2006 à 2090 . . . 183
6.1 Schéma récapitulatif des corrélations observées pour les PFTs décidus et sempervirents. . . . 228
L
ISTE DES TABLEAUX
1.1 Liste des stocks et flux de carbone à différentes échelles spatiales. . . 51.2 Liste des PFTs définis dans la version standard d’ORCHIDEE . . . 16
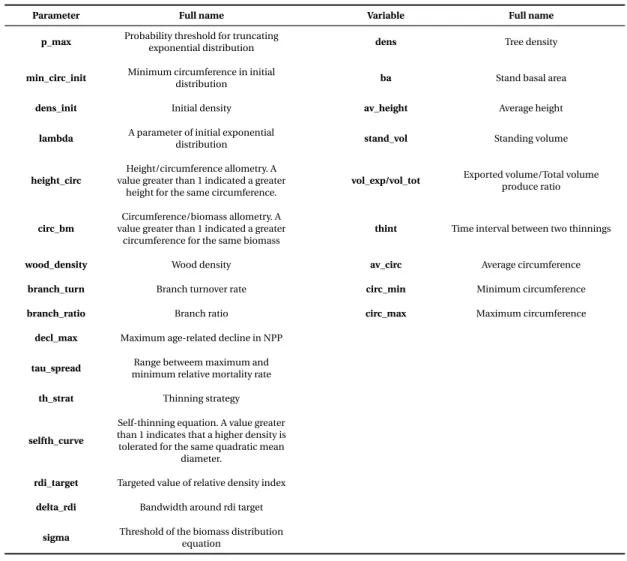
2.1 List of parameters used in ORCHIDEE-FM, equations and processes involved. . . 29
2.2 Median values reviewed for each species, values from previous otpimization of parameters and current values used in ORCHIDEE. . . 30
2.3 Number of values retrieved for each parameter . . . 31
3.2 Correlations table between observed and modeled stand variables . . . 65
3.3 Comparison between MODIS and ORCHIDEE GPP cycles. . . 71
4.1 Observed budburst date (Day of the Year) in the RENECOFOR network over the period 1997-2011. . . 97
4.2 Observed litterfall in the RENECOFOR network over the period 1997-2007. . . 98
4.3 Best model for each species . . . 100
4.4 Mean budburst dates between 1970 and 2100 . . . 111
4.5 Correlations table between observed and modelled stand variables . . . 128
5.1 Distribution des valeurs de Vcmax et Jmax extraits de la base TRY . . . . 142
5.2 Distribution des valeurs de SLA extraits de la base TRY . . . . 142
5.3 Variables climatiques utilisées pour établir les relations de traits. . . 142
5.4 Relations empiriques traits-climat pour Vcmax et Jmax . . . . 144
5.5 Relations empiriques traits-climat pour SLA . . . . 145
5.6 Relations liant SLA et Lag e,cr i taux concentration en azote . . . 148
5.7 Liste des simulations effectuées . . . 150
6.1 Liste des paramètres d’ORCHIDEE optimisés. . . 195
6.2 Liste des variables explicatives testées pour les relations entre traits (paramètres optimisés. . 196
T
ABLEAUX
S
UPPLEMENTAIRES
2.1 Parameters used in the sensitivity analysis ofBellassen et al.(2010) . . . 492.2 Optimized parameters in Kuppel 2012 . . . 50
2.3 Data sources for French sylvicultural reference systems . . . 50
3.1 Height and volume error associated with height computation. . . 76
3.2 Relative difference between simulated and observed stand variables for 50y old stand. . . 77
3.3 Relative difference between simulated and observed stand variables for 50y old stand.(continued) 78 4.1 Needle survivorship curves references . . . 124
4.2 Daily optimization parameters with all species for models M2 to M5. . . 125
C
H A P I T R E1
C
ONTEXTE GÉNÉRAL DE L
’
ÉTUDE ET
PROBLÉMATIQUE
C
OMMENTreprésenter la diversité et la complexité du monde végétal afin d’estimerau mieux les flux de matière et d’énergie à l’échelle globale ?
Les écosystèmes forestiers absorbent à eux seul 25% des émissions de carbone anthropique à l’échelle mondiale. Outre leur rôle dans le cycle des éléments, le maintient de ces écosystèmes a de nombreux intérêts sociétaux comme la protection des sols ou encore leur impact sur le cycle de l’eau.
Cependant, les forêts sont soumises à de plus en plus de pressions naturelles et anthropiques fortes. Les changements environnementaux augmentent les risques de mortalité et les politiques actuelles promeuvent des prélèvement accrus en biomasse afin de substituer aux matières fos-siles. Ainsi de nombreuses incertitudes pèsent sur l’évolution de nos forêts et leur capacité d’adaptation face à ces pressions sur le long terme.
Ce chapitre d’introduction illustre la nécessité d’améliorer notre compréhension des inter-actions entre les écosystèmes forestiers et leur environnement afin de lever ces incertitudes. Parmi d’autres méthodes, les modèles de végétation permettent d’intégrer les connaissances éco-physiologiques nécessaires afin d’évaluer différentes hypothèses sur le fonctionnement de la biosphère continentale.
Nos connaissances actuelles ne permettent pas de représenter dans un modèle toute la diversité du monde végétal, qui se retrouve ainsi catégorisée en grand groupes fonctionnels. Cependant, cette diversité est une des clés de l’adaptation de la biosphère aux changements globaux.
Ainsi, cette thèse propose d’évaluer trois approches complémentaires afin de représenter une certaine plasticité de la végétation au sein d’un modèle biosphérique global, ORCHIDEE.
1.1 La forêt et son impact sur le climat . . . 3
1.1.1 L’influence biophysique et biochimique des forêts . . . 3
1.1.2 Le rôle des forêts dans le cycle du carbone. . . 4
1.2 Des pressions environnementales et anthropiques de plus en plus fortes . . . 6
1.2.1 La forêt face aux changements globaux . . . 6
1.2.2 Une demande accrue en biomasse . . . 7
1.3 Répondre aux enjeux actuels par la modélisation . . . 9
1.3.1 La représentation de la végétation dans les modèles globaux : les PFTs . . . 9
1.3.2 Les limites d’une représentation par PFTs . . . 10
1.4 Vers une représentation de la végétation axée sur les traits fonctionnels . . . 11
1.4.1 Les traits fonctionnels . . . 11
1.4.2 L’utilisation actuelle des traits fonctionnels dans les modèles globaux . . . 12
1.5 Le modèle biosphérique ORCHIDEE . . . 13
1.5.1 Structure du modèle . . . 13
1.5.2 Photosynthèse et conductance . . . 14
1.5.3 Couvert végétal, phénologie et sols . . . 16
1.6 Objectifs et étapes de cette étude . . . 19
1.6.1 Les enjeux scientifiques . . . 19
1.1. La forêt et son impact sur le climat
1.1 La forêt et son impact sur le climat
1.1.1 L’influence biophysique et biochimique des forêts
La forêt influence le climat via différents processus : d’une part de manière locale par la ré-flexion du rayonnement solaire (albedo), et d’autre part de manière locale et régionale par son action sur le cycle de l’eau (évapotranspiration) et le cycle du carbone. La forêt est aussi émet-trice de méthane et de composés organiques volatiles, eux aussi pouvant impacter sur l’effet de serre (Fig.1.1).
L’albedo résulte du type de couvert, de l’humidité du sol, de la couverture neigeuse et de l’in-cidence et du type des rayonnement reçus. Il s’agit donc d’un processus sensible à l’usage des sols et au type de couvert. Les milieux forestiers possèdent généralement un albedo plus faible que les autres milieux et par conséquent absorbent plus de rayonnement (Anderson et al.,2010), ce qui se traduit par un réchauffement local plus fort que dans les autres écosystèmes.
En région tempérée, l’impact de l’albedo sur le climat reste incertain comparé aux milieux bo-réaux et enneigés (Bonan,2008).Bright et al.(2012) ainsi que (Haberl et al.,2013) soulignent que le bénéfice lié au stockage de carbone dans les forêts boréales pour de nouvelles plantations peut être contre-balancé par un effet de réchauffement local lié à l’absorption des rayonnement par la canopée qui est plus sombre que la neige. Ce constat se fait aussi pour les zones mon-tagneuses oùSchwaab et al.(2015) montrent que l’effet de séquestration de carbone en haute altitude dans les Alpes Suisses et dans des zones longuement enneigées est contrebalancé par l’albedo. AinsiSjølie et al.(2013) concluent que la prise en compte des effets d’albedo, sensible au choix des espèces et de l’intensité de gestion (Anderson et al.,2010;Otto et al.,2014), modi-fie significativement l’impact de la gestion, mettant alors en évidence l’impossibilité d’instaurer des politiques optimales si cet aspect n’est pas pris en compte.
atmospheric model to quantify the impact of biogenic boreal forest emissions on atmospheric aerosol, cloud properties and climate through the first aerosol indirect effect.
2. Boreal forests and climate
Forests have complex interactions with the atmosphere. They modify the surface–atmosphere exchange of energy, momentum, water, carbon dioxide and other trace gas and aerosol species (figure 1). Through these interactions, they impact regional and global climates. However, the impacts on large-scale climate are difficult to observe directly and predictions generally rely on global numerical models. Early studies, made using general circulation models, accounted only for the biophysical effects of the forest (e.g. Dickinson &
Henderson-Sellers 1988), whereas later studies evaluated both biophysical
and carbon cycle impacts. While these studies predict that tropical forests cause climate cooling, due to large carbon storage combined with large evapotranspiration (ET) promoting low-level cloud cover (e.g. Bala et al. 2007; Sampaio et al. 2007), the impact of boreal forests on climate is less certain.
Boreal forests (location shown in figure 2) have a dark canopy (with low
albedo) that obscures the snow-covered ground (with high albedo), absorbs sunlight and warms the climate (known as the snow–vegetation albedo effect) (Thomas & Rowntree 1992; Chalita & Le Treut 1994). This effect is predicted to dominate over the cooling from ET and carbon storage, meaning that boreal forests warm the climate (Bonan et al. 1992; Betts 2000; Claussen et al. 2001;Bala et al. 2007).Bala et al. (2007)predict that boreal forests warm
global climate by 0.88C. Randerson et al. (2006) used observations of the
+ forestation climate cooling climate warming + CO2 absorption + organic vapours + aerosol + reflection of sunlight + cloud droplet number and cloud
albedo – albedo + surface absorption of sunlight + evapotranspiration biogeochemical effects + cloud cover + leaf area index, root
depth and surface roughness
biophysical effects
Figure 1. A simplified schematic of the impacts of increased forestation on climate.
D. V. Spracklen et al. 4614
on September 1, 2015
http://rsta.royalsocietypublishing.org/
Downloaded from
FIGURE 1.1 – Figure issue de Spracklen et al. 2008 résumant l’impact des différents processus
bio-physiques et bio-chimiques liés aux milieux forestiers.
Les forêts jouent un rôle central dans le cycle du carbone. En effet, elles absorbent du CO2 par le processus de photosynthèse et permettent la séquestration de carbone dans la biomasse et dans les sols ce qui aura un effet refroidissant sur le climat. Cependant elle relarguent aussi du CO2par les processus de respiration, ce qui augmente l’effet de serre.
Ainsi, une forêt peux absorber plus de carbone qu’elle n’en relâche. On parle alors de “puits” de carbone. Dans le cas contraire, certaines forêts périssantes vont relarguer plus de carbone qu’elles n’en absorbent, on parle alors de “source” de carbone. Ces différents processus sont dépendant des conditions environnementales et de la santé des peuplements. Le rôle des forêts dans le cycle du carbone est détaillé dans la section suivante (1.1.2).
D’autres facteurs biophysiques tels que l’évapotranspiration et la formation d’aérosols peuvent contre-balancer les effets de l’albedo et de la séquestration de carbone. L’évaporation ainsi que la formation d’aérosols jouent un rôle dans la formation des nuages et par conséquent possèdent un effet refroidissant local (Spracklen et al.,2008;Anderson et al.,2010). L’effet refroi-dissant exercé par l’évaporation est surtout perceptible en milieu tropical (Bonan,2008). Une réduction des ressources en eau, liée par exemple à une hausse des évènements de sécheresse dans le futur, se traduit donc par une réduction de l’évapotranspiration et par un réchauffement local.
1.1.2 Le rôle des forêts dans le cycle du carbone.
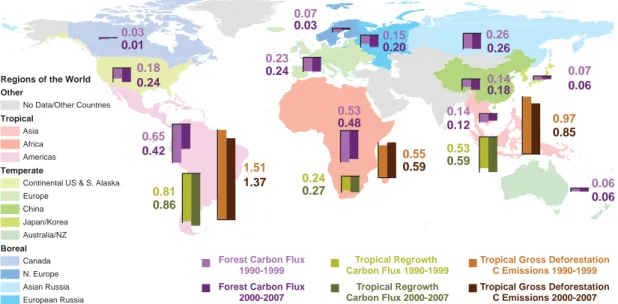
SelonPan et al.(2011) les stocks de carbone des forêts à l’échelle mondiale sont estimés à hauteur de 861(±66) GtC en 2010, dont 363(±28)GtC concernent la biomasse aérienne (42%), 73(±6)GtC le bois mort (8%), 383(±30)GtC pour le carbone du sol jusqu’à un mètre de profon-deur (44%) et 43(±3)GtC pour la litière (5%). Les forêts tempérées stockent moins de carbone (119±6GtC, 14%) que les forêts tropicales (471±93 GtC) et les forêts boréales (272±23 GtC) (Fig.1.2). La répartition des stocks est différente selon le biome considéré : en milieu tropical la majorité du carbone provient de la biomasse aérienne (56%) tandis qu’en milieu boréal le carbone se trouve principalement dans les sols (60%). Rapporté à la surface de forêts, cela re-présente en moyenne respectivement 242 et 239 tC ha−1pour les milieux tropicaux et boréaux et seulement 155 tC ha−1pour les milieux tempérés.
Toujours d’aprèsPan et al.(2011), une augmentation globale des stocks de carbone fores-tiers (tous compartiments compris) de 1.11(±0.82) GtC an−1est notable de 1990 à 2007. Dans les forêts établies ce puits s’élève à 2.4 ±0.4 GtC an−1ce qui représente environ 25% des émissions fossiles. En milieu tempéré (767Mha) le puits de carbone des forêts est estimé à 0.72 GtC an−1sur cette même période. En Europe le puits est estimé à 0.23GtC an−1(Table1.1).
Ce puits s’explique principalement par une politique d’afforestation importante couplée à des prélèvements en dessous de l’accroissement annuel dans de nombreux pays d’Europe, ce qui se traduit par des forêts jeunes et un puits de carbone important. SelonNabuurs et al. (2013) l’incrément des forêts en Europe excède les prélèvements d’environ 260 Mm3 an−1. Cependant l’auteur souligne que le puits de carbone européen montre ses premiers signes de saturation.
1.1. La forêt et son impact sur le climat
Cette saturation est essentiellement due à un vieillissement des forêts, à une augmentation des perturbations naturelles mais aussi à une intensification récente de la gestion forestière.
respectively (Table 2). An average C sink of 1.2 T 0.4 Pg C year–1for 1990 to 2007 is approx-imately half of the total global C sink in estab-lished forests (2.4 T 0.4 Pg C year–1
) (Table 1). When only the biomass sink is considered, about two-thirds of the global biomass C sink in estab-lished forests is from tropical intact forests (1.0 versus 1.5 Pg C year–1). The sink reduction in the period 2000 to 2007 (–23%) was caused by deforestation reducing intact forest area (–8%) and a severe Amazon drought in 2005 (21), which appeared strong enough to affect the tropics-wide decadal C sink estimate (–15%). Except for the Amazon drought, the recent excess of biomass C gain (growth) over loss (death) in tropical intact for-ests appears to result from progressively enhanced productivity (20, 21, 23). Increased dead biomass production should lead to enhanced soil C seques-tration, but we lack data about changes in soil C stocks for tropical intact forests, so the C sink for tropical intact forests may be underestimated.
Tropical land-use changes have caused net C releases in tropical regions by clearing forests for agriculture, pasture, and timber (24), second in magnitude to fossil fuel emissions (Table 3). Tropical land-use change emissions are a net balance of C fluxes consisting of gross tropical de-forestation emissions partially compensated by C sinks in tropical forest regrowth. They declined from 1.5 T 0.7 Pg C year–1
in the 1990s to 1.1 T 0.7 Pg C year–1for 2000 to 2007 (Table 1) due to reduced rates of deforestation and increased for-est regrowth (25). The tropical land-use change emissions were approximately equal to the total
global land-use emissions (Tables 1 and 3), be-cause effects of land-use changes on C were roughly balanced in extratropics (7, 24, 25).
Tropical deforestation produced significant gross C emissions of 3.0 T 0.5 and 2.8 T 0.5 Pg C year–1, respectively, for 1990 to 1999 and 2000 to 2007, ~40% of the global fossil fuel emissions. However, these large emission numbers are usu-ally neglected because more than one half was
offset by large C uptake in tropical regrowth for-ests recovering from the deforestation, logging, or abandoned agriculture.
Tropical regrowth forests (557 Mha) repre-sent ~30% of the total tropical forest area. The C uptake by tropical regrowth forests is usually implicitly included in estimated net emissions of tropical land-use changes rather than estimated independently as a sink (24). We estimate that
0.06 0.07 0.24 0.18 0.24 0.27 0.01 0.03 0.48 0.53 0.53 0.59 1.37 1.51 0.85 0.97 0.59 0.55 0.42 0.65 0.03 0.07 0.24 0.23 0.20 0.15 0.26 0.26 0.18 0.14 0.06 0.06 0.12 0.14 0.81 0.86 Regions of the World
Other No Data/Other Countries Tropical Asia Africa Americas Temperate
Continental US & S. Alaska Europe China Japan/Korea Australia/NZ Boreal Canada N. Europe Asian Russia European Russia Tropical Regrowth Carbon Flux 2000-2007
Forest Carbon Flux 2000-2007
Tropical Regrowth Carbon Flux 1990-1999
Forest Carbon Flux 1990-1999
Tropical Gross Deforestation C Emissions 1990-1999 Tropical Gross Deforestation
C Emissions 2000-2007
Fig. 1. Carbon sinks and sources (Pg C year–1) in the world’s forests. Colored bars in the down-facing direction represent C sinks, whereas bars in the upward-facing direction represent C sources. Light and dark purple, global
established forests (boreal, temperate, and intact tropical forests); light and dark green, tropical regrowth forests after anthropogenic disturbances; and light and dark brown, tropical gross deforestation emissions.
Table 3. The global carbon budget for two time periods (Pg C year−1). There are different arrangements to account for elements of the global C budget (see also table S6). Here, the accounting was based on global C sources and sinks. The terrestrial sink was the residual derived from constraints of two major anthropogenic sources and the sinks in the atmosphere and oceans. We used the C sink in global established forests as a proxy for the terrestrial sink.
Sources and sinks 1990–1999 2000–2007
Sources (C emissions)
Fossil fuel and cement* 6.5 T 0.4 7.6 T 0.4
Land-use change† 1.5 T 0.7 1.1 T 0.7
Total sources 8.0 T 0.8 8.7 T 0.8
Sinks (C uptake)
Atmosphere† 3.2 T 0.1 4.1 T 0.1
Ocean‡ 2.2 T 0.4 2.3 T 0.4
Terrestrial (established forests)§ 2.5 T 0.4 2.3 T 0.5
Total sinks 7.9 T 0.6 8.7 T 0.7
Global residuals|| 0.1 T 1.0 0.0 T 1.0
*See (2). †See (4, 7, 25). The global land-use change emission is approximately equal to the tropical land-use change emission,
because the net carbon balance of land-use changes in temperate and boreal regions is neutral (24, 38). ‡See (4). §Estimates
of C sinks in the global established forests (that are outside the areas of tropical land-use changes) from this study. Note that the carbon sink in tropical regrowth forests is excluded because it is included in the term of land-use change emission (see above and
Table 1). ||Global C residuals are close to zero when averaged over a decade. Uncertainties in the global residuals indicate either a
land sink or source in the 212 Mha of forest not included here, on nonforest land, or systematic error in other source (overestimate) or sink (underestimate) terms, or both.
www.sciencemag.org SCIENCE VOL 333 19 AUGUST 2011 991 RESEARCH ARTICLES
on August 22, 2011
www.sciencemag.org
Downloaded from
FIGURE1.2 – Figure issue de Pan et al. (2011). Représentation des flux de carbone pour différents biomes
et différentes régions pour les périodes 1990-1999 et 2000-2007.
TABLE1.1 – Liste des stocks et flux de carbone à différentes échelles spatiales selon Loustau et al. (2004), Marland et al.(2008) et Pan et al.(2011).
Echelle Emissions de C fossile (2000-2007)1
Aire forestière
(2007)2 Stocks de C forestier2 Flux de C forestier2
Monde 7.6±0.7 GtC an−1 3851.3 Mha
861GtC (363GtC aérien, 73GtC bois mort,43 litière, 383GtC sol)
223.6 tC ha −1 +1.1 GtC an−1 Biomes tempérés - 766.7 Mha 118.6±6.3 GtC (46.6 aérien, 3.3 bois mort, 12.1 litière, 56.7 sols) en 2007
154.7 tC ha-1 +0.72 GtC an−1 Europe 0.72±0.02 GtC an−1 144.5 Mha
24±3 GtC (10. aérien, 0.3 bois mort, 2 litière, 16.3 sols) en 2007 166.1 tC ha−1 +0.23 GtC an−1 France 103.8±2.3 MtC an−1(0.1±0.002 GtC an−1) 16 Mha 1059MtC 71 tC ha-1 en 1996 +18.7 MtC an−1
Selon laFAO(2010), la France fait partie des sept contributeurs principaux du stock Euro-péen avec l’Allemagne, la Suède, la Finlande, la Roumanie, l’Italie et la Pologne qui regroupent 70% des stocks de carbone de l’Europe. La forêt française est actuellement une forêt jeune et sous-exploitée en métropole. La surface actuelle afforestée (représentant environ 16 Mha soit 2400 Mm3) croît annuellement de 40 000 ha ce qui se traduit par une augmentation du stock en forêt de 103 Mm3par an. Actuellement le puits de carbone en France métropolitaine (18.7 MtC an−1) représente environ 18% des émissions de carbone fossile du pays (estimés à 103.8MtC 1. Emissions calculées via les données de Marland et al. (2008) : Global, Regional, and National fossil fuel CO2 emissions. In Trends : A compendium of data on global change. Carbon dioxide information analysis center, Oak Ridge National Laboratory, U.S. Department of Energy, Oak Ridge, Tenn., U.S.A.
an−1sur la période 2000-2007).
A maturité, une forêt tempérée (sol et biomasse) peut stocker entre 150 et 327 tC ha−1(Luyssaert et al.,2007). Actuellement le stock en France est évalué entre 50 et 71 tC ha−1en moyenne pour la biomasse aérienne et souterraine (Loustau et al.,2004;Lecocq et al.,2008) et 35-80 tC ha−1pour les sols (Lecocq et al.,2008), ce qui est inférieur à la moyenne fournie parPan et al.(2011). Le potentiel de séquestration en forêt est donc important en France.
Nous venons de voir qu’à une échelle globale, la forêt a une action forte et indéniable sur le cycle du carbone et les concentrations de CO2atmosphérique. En milieu boréal, l’albedo aura un effet souvent plus important que la séquestration de carbone et l’évapotranspiration sur le cli-mat local, de même qu’en milieu tropical l’effet refroidissant local de l’évapotranspiration prime sur l’albedo ou encore sur la séquestration du carbone. En revanche, l’impact local de ces diffé-rents processus en milieu tempéré est incertain (Bonan,2008), malgré deux récentes études qui tendent à confirmer le rôle important des interactions biophysiques de ces forêts avec le climat (Naudts et al.,2016;Alkama and Cescatti,2016).
1.2 Des pressions environnementales et anthropiques de plus en
plus fortes
1.2.1 La forêt face aux changements globaux
Par son impact sur le climat et sur le cycle du carbone, les forêts ont un pouvoir d’atténua-tion important sur les changements climatiques actuels. Cependant elles sont aussi de plus en plus soumises à des pressions anthropiques et naturelles qui rendent incertaine leur évolution face aux changements environnementaux.
Les modèles climatiques récents anticipent une augmentation globale des températures ainsi qu’une augmentation de la variabilité des précipitations à l’échelle régionale. Ainsi en Europe, la hausse des températures devrait atteindre 2 à 4°C en été pour les différents scénarios RCP4.5 (modérés) avec des vagues de chaleur de plus en plus fréquentes et longues (Jacob et al., 2014). De plus, les différentes projections montrent une diminution moyenne des précipitations en été avec une hausse de fréquence des fortes précipitations. A l’inverse, une hausse des préci-pitations sur toute l’Europe est prévue lors des périodes hivernales, couplée à une hausse de la fréquence des tempêtes.
Les forêts vont donc faire face à des modifications environnementales graduelles sur le court-moyen terme mais aussi à une augmentation de la fréquence des évènements extrêmes.
Plusieurs études font état à la fois d’effets positifs et négatifs des changements globaux sur la productivité forestière. Par exemple pour l’Europe, les différents modèles estiment que l’augmentation des concentrations en CO2 et des températures aura un effet bénéfique sur la croissance des arbres sur le court et moyen terme (Bonan, 2008;Peñuelas and Filella, 2009).
1.2. Des pressions environnementales et anthropiques de plus en plus fortes
En revanche cet effet bénéfique sera vite contre-balancé par une augmentation des tempêtes, des sécheresses et des dommages causés par les ravageurs (Allen et al.,2010;Seidl et al.,2014;
Bussotti et al.,2015). Dans des écosystèmes déjà soumis à des conditions hydriques
particu-lières, tels que dans le bassin Méditerranéen, une baisse de productivité et une hausse des mortalités importantes sont prévues (Lindner et al.,2010). Ainsi, on observe déjà une hausse de la mortalité dans les peuplement forestiers à des échelles régionales comme par exemple dans l’ouest des Etats-Unis oùVan Mantgem et al.(2009) ont mis en évidence un doublement du taux de mortalité naturelle dans les forêts non gérées, accompagné d’une baisse de la densité et de la surface terrière des peuplements. De mêmeNabuurs et al.(2013) ont mis en évidence une saturation du puits de carbone en Europe liée au viellissement des forêts et aux perturbations.
Il y a de nombreux intérêts sociétaux à maintenir les écosystèmes forestiers : séquestration de carbone et atténuation du climat, protection des sols, purification de l’eau, controle des ravageurs, etc... (Millennium Ecosystem Assessment,2005). Le maintient des forêts passe essen-tiellement par leur capacité d’adaptation aux changements.
L’acclimatation des arbres est principalement liée aux différents ajustements génétiques, de composition et de structure des populations. Par exemple, plusieurs études ont montré qu’une biodiversité élevée a un effet tampon sur l’impact des changements climatiques et des évène-ments extrêmes (Thompson et al.,2009;Isbell et al.,2015) du fait d’une meilleure exploitation des ressources écologiques (Bussotti et al.,2015).
Ainsi on peut distinguer plusieurs réponses adaptatives des forêts face aux changements clima-tiques (Bussotti et al.,2015) :
— la plasticité phénotypique, inter et intra-spécifique des traits fonctionnels qui permet un ajustement rapide des processus face aux changements environnementaux
— l’adaptation locale qui permet un ajustement sur le long terme des populations — la migration des essences
— l’extinction
Les aspects que je vais développer dans cette thèse sont plus particulièrement la plasticité phé-notypique et l’adaptation locale des essences forestières. Nous n’aborderons donc pas la migra-tion et l’extincmigra-tion.
La plasticité phénotypique peut être décrite par un ensemble de différentes caractéristiques fonctionnelles de l’arbre, aussi appelés traits fonctionnels (section1.4). Ils peuvent être très va-riables au sein d’une population soumise à des conditions climatiques différentes. Cette variabi-lité représente la diversité génétique et la capacité d’adaptation d’une espèce à des changements environnementaux rapides et à son adaptation sur le long terme (Wright et al.,2005b;Reich et al., 2007;Bussotti et al.,2015).
1.2.2 Une demande accrue en biomasse
En plus des pressions environnementales, les forêts doivent faire face à des pressions anthro-piques de plus en plus importantes. Lors de la conférence de Kyoto en 1997, la Convention-cadre des Nations Unies sur les changements climatiques a mis en avant la "neutralité carbone" de la
biomasse végétale, concept qui vient du choix initial de séparer les comptabilités entre émis-sions de carbone fossile et séquestration.
Pour la forêt, le carbone est comptabilisé sur la base de la variation annuelle des stocks aériens et souterrains. Pour éviter un "double compte", le carbone relâché ensuite par les produits bois n’est pas comptabilisé (émissions issues de la combustion de bois, par exemple). Dans le même esprit de simplification, cette comptabilité réglementaire est associée à un principe de "neutralité" pour l’atmosphère : la molécule de CO2 relâchée avait été initialement captée par photosynthèse, donc le bilan est considéré comme neutre (du moins dans le cadre d’une gestion forestière durable qui assure le renouvellement du potentiel photosynthétique). Ce prin-cipe est à l’origine du fort développement du bois énergie comme levier majeur de l’atténuation.
Une polémique autour de la neutralité carbone de la biomasse forestière à émergé en 2010 lorsque deux lettres de la communauté scientifique furent envoyées aux politiques afin de les alerter sur le danger de la notion de “carbone neutre” (Sedjo,2011). Le bilan carbone des forêts doit tenir compte du «coût carbone» de l’exploitation de la biomasse, tandis qu’à énergie com-parable, les énergies fossiles sont souvent moins émettrices de carbone que le bois, avec des différences toutefois faibles (Agostini et al.,2013). Le concept de neutralité carbone a fortement été remis en cause par la prise en compte de la temporalité des processus, de la spatialisation des émissions et de l’efficacité énergétique du bois par rapport aux énergies fossiles.
En France métropolitaine, la forêt est actuellement jeune et sous-exploitée. La surface ac-tuelle afforestée (représentant environ 16 Mha soit 2400 Mm3) croît annuellement de 40 000 ha ce qui se traduit par une augmentation du stock en forêt de 103 Mm3par an. SelonDeheza and Bellassen(2010), les forêts absorbent 72.3MtCO2par an (sur un total d’émisssions fossiles de 531 MtCO2e en 2007). Actuellement environ 50% de l’incrément en biomasse est prélevé en France, soit environ 70 Mm3, dont 37.7 Mm3(55%) est commercialisé, 22 Mm3 (32%) est auto-consommé (bois de chauffe, usage privé) et le reste correspond au bois mort et aux pertes (13%). Le bois d’œuvre représente la majeure partie du bois commercialisé en France, soit environ 60%. Cependant la fraction utilisée dans les constructions reste faible (4%) par rapport à d’autres pays tels que l’Allemagne (10%), le Royaume-Uni (20%) ou encore les pays nordiques (>80% ;Lippke et al. 2011). Le potentiel de substitution des matériaux énergivores est important en France.
Plusieurs études montrent que la prise en compte de la multifonctionnalité des forêts dans leur gestion (état des sols, de l’eau, de la biodiversité, des risques naturels, de l’économie ainsi que l’usage récréatif ) diminue fortement la quantité de biomasse prélevable. AinsiVerkerk et al. (2011) confirment que la France a l’un des plus grands potentiels d’approvisionnement en bois en Europe grâce à sa grande superficie de forêts. Cependant son potentiel à l’hectare reste faible dans les conditions actuelles. La prise en compte des objectifs techniques, socio-économiques et environnementales réduisent de 58% le potentiel de prélèvement (1,5-2 m3 ha−1an−1sur un potentiel de 3 m3ha−1an−1). Même un scénario de prélèvement supplémentaire “faible” impli-querait une intensification de la gestion. Ajouté à cela, la diversité des propriétaires forestiers (75
1.3. Répondre aux enjeux actuels par la modélisation
% de la superficie forestière française est privée) et de l’usage des forêts induit une pression de prélèvement d’autant plus importante sur des zones géographiques restreintes.
1.3 Répondre aux enjeux actuels par la modélisation
Nous avons vu en section1.1.1que les forêts ont différentes rétro-actions sur le climat selon le milieu et les échelles spatiales considérées, de même qu’elles sont soumises à des pressions de plus en plus importantes (section1.2).
Parmi d’autres méthodes, la modélisation mécaniste de la biosphère est un outil permettant d’intégrer nos connaissances éco-physiologiques des forêts et de tester différentes hypothèses à des échelles de temps et d’espace variables. Depuis quelques années, l’augmentation des capa-cités en calcul informatique ont permis la complexification des modèles globaux (Friedlingstein et al.,2006), accompagnée de difficultés croissantes à identifier les sources d’incertitudes. La représentation de la végétation terrestre est parmi l’une des plus grandes sources actuelle d’incertitudes des modèles climatiques (Friedlingstein et al.,2006;Moorcroft,2006;Bloom et al., 2016).
Afin d’analyser le devenir des forêts face aux différentes pressions qu’elles subissent, il est néces-saire d’améliorer la représentation des écosystèmes forestiers, et plus particulièrement l’impact de la gestion ainsi que l’impact du changement climatique et des évènements extrêmes.
1.3.1 La représentation de la végétation dans les modèles globaux : les PFTs
Afin de faire des prédictions à des échelles globales ou régionales, les modélisateurs ont besoin de représenter de manière simplifiée et gérable les quelques 300 000 espèces végétales actuellement connues dans le monde. La méthode la plus souvent employée est d’aggréger les espèces en un nombre réduit de groupes ce qui permet de réduire les connaissances nécessaires à la représentation de chaque espèce.
Dans les modèles biosphériques globaux, la classification des plantes est majoritairement basée sur la fonctionnalité des groupes formés (Prentice et al.,2007). On parle alors de types fonctionnels de plantes (PFT pour Plant Functional Type ;Lavorel et al. 2007). Malgré différents concepts de PFT (Wullschleger et al.,2014), la plupart des classifications sont définies sur la forme, la phénologie et le type de photosynthèse des végétaux qui indirectement reflètent leur capacité d’adaptation à leur environnement. Nous allons donc retrouver des classifications liées à la forme (herbacées versus ligneux), à la structure foliaire (feuilles versus aiguilles) ou encore à la phénologie (décidus versus sempervirents). De plus, certaines caractéristiques environne-mentales peuvent aussi être prises en compte dans la classification. Ainsi on distinguera les espèces de milieux tempérés, tropicaux ou encore boréaux.
L’idée sous-jacente à cette méthode de classification en groupe fonctionnels se traduit par le fait que chaque groupe de plantes possédant les mêmes caractéristiques auront la même straté-gie de réponse et d’adaptation aux modifications de leur environnement.
1.3.2 Les limites d’une représentation par PFTs
Dans la majorité des modèles, on retrouve une certaine généricité des processus implé-mentés pour tout les PFTs, dont seule la paramétrisation, fixe pour chaque PFT, change. Cette représentation a permis de représenter de nombreux processus comme par exemple la dyna-mique global de la végétation (Quillet et al., 2010), la reconstruction de la paléo-végétation
(Prentice and Webb,1998), ou encore a montré sont utilité dans l’étude des changements
cli-matiques (Sitch et al.,2008). Par exempleAlton(2011) montre en optimisant le modèle global de végétation JULES sur différentes observations, que la classification en PFT avec des para-mètres fixes est suffisante afin de simuler l’albedo, les radiations nettes et les ruissellements des écosystèmes. Cependant il montre aussi que la variabilité des paramètres optimisés du modèle est importante et que leur distribution se chevauche d’un PFT sur l’autre. Cette variabilité est à l’origine d’une grande incertitude sur la représentation des échanges de carbone dans son étude.
La classification discrète de la végétation utilisée dans les modèles globaux est donc de plus en plus remise en question. En effet, une représentation discrète de la végétation implique que les différences entre individus d’un même groupe sont moins importantes d’un point de vue fonctionnel que les différences entre groupes. Or plusieurs études mettent en évidence une variabilité importante des paramètres au sein des PFTs, dont la valeur est fixe dans les différents modèles (Wright et al.,2005a;Kattge et al.,2011). Ainsi, tandis que certains paramètres varient peu entre les PFTs, les paramètres liés au cycle du carbone, des nutriments et de l’eau varient beaucoup à l’échelle globale (Van Bodegom et al.,2012). D’après l’étude deReich et al.(2007), une paramétrisation fixe des PFTs ne permet d’expliquer qu’un tiers de la variation des traits foliaires.
Par ailleurs, les PFTs sont paramétrés sur des données d’observation récentes. Or, on s’attend à une modification des niches écologiques due aux changements environnementaux futurs, qui se traduira par une évolution des PFTs dont la paramétrisation actuelle sera insuffisante afin de les représenter (Van Bodegom et al.,2012). La rigidité de la représentation de la végétation est donc une limite importante pour simuler l’évolution des écosystèmes. Peu de modèles intègrent à ce jour des processus d’acclimatation de la végétation aux conditions environnementales changeantes (Smith and Dukes,2013). Par exemple, cette absence de représentation explicite de la diversité et de l’adaptation de la végétation au climat a menéCox et al.(2004) à prédire la disparition de la majorité de la forêt Amazonienne d’ici à 2080.
Afin de palier à ces différentes limites, plusieurs auteurs ont analysé les mérites de l’utilisa-tion des traits foncl’utilisa-tionnels pour représenter de manière continue la végétal’utilisa-tion (Reu et al.,2011; Pavlick et al.,2012;Verheijen et al.,2012), aspects que nous allons analyser dans la section sui-vante.
1.4. Vers une représentation de la végétation axée sur les traits fonctionnels
1.4 Vers une représentation de la végétation axée sur les traits
fonctionnels
1.4.1 Les traits fonctionnels
Un trait fonctionnel désigne tout caractère d’un individu pouvant donner une indication sur ses performances. Ces traits peuvent être des caractéristiques morphologiques, biochimiques ou physiologiques et ont la particularité d’être mesurables.
On distingue deux types de traits :
— les “traits de réponses” qui correspondent aux indicateurs de la réponse d’un individu aux variations de son environnement
— les “traits d’effets” qui donnent des indications sur l’effet d’un individu sur son environ-nement.
On observe depuis une dizaine d’années un effort important de création de bases de traits globales couvrant de larges gradients environnementaux (Ahas et al.,2002;Wright et al.,2004;
Kattge et al.,2011). La disponibilité de ces bases globales a permis l’émergence de plusieurs
théories sur l’adaptation des végétaux à leur environnement, comme le Leaf Economic Spectrum (LES ;Wright et al. 2004) qui caractérise le retour sur investiment des nutriments, indépendam-ment du type de plante ou du biome considéré.
La quantification de ces traits par rapport aux conditions environnementales, et leur couplage aux théories émergentes, semble donc une méthode prometteuse afin de modéliser la biodiver-sité des différents écosystèmes (Yang et al.,2015). Afin de comprendre l’intérêt des traits fonc-tionnels pour modéliser la végétation mondiale, il est nécessaire d’appréhender le rôle de la bio-diversité pour les cycles biogéochimiques.
Le terme biodiversité peut avoir différentes significations. Il peut représenter la diversité des écosystèmes, la diversité spécifique ou encore la diversité fonctionnelle d’un système. La biodi-versité qui nous intéresse pour cette étude correspond principalement à la dibiodi-versité fonction-nelle. Plusieurs mécanismes expliquent certains effets positifs de la diversité sur le fonctionne-ment des écosystèmes végétaux (Díaz and Cabido,2001) :
— Cette diversité permet d’assurer les fonctions de l’écosystème par des effets de com-plémentarité de niche (meilleur utilisation des ressources), de facilitation fonctionnelles (une espèce à un effet positif sur une autre), d’effet d’échantillonnage (les espèces avec un rôle fonctionnel important vont augmenter) et d’effet de dilution (réduction des effets de pathogènes).
— Cette diversité permet aussi d’assurer la stabilité des fonctions ecosystémiques grâce à la redondance des fonctions (effet d’assurance), une résilience accrue (effet portfolio) et des effets de compensation.
Dans notre contexte, qu’est la modélisation à large échelle, il apparait donc nécessaire de repré-senter précisément ces différents effets pour modéliser correctement la réponse de la végétation aux changements environnementaux actuels et futurs. Comme nous l’avons vu en section1.3.1, la végétation dans les modèles globaux actuels est le plus souvent représentée par des groupes
fonctionnels de plantes aux caractéristiques fixes (section1.3.1). L’utilisation des traits fonction-nels afin d’apporter de la variabilité au sein des différents PFT semble donc être une piste pro-metteuse (Yang et al.,2015).
1.4.2 L’utilisation actuelle des traits fonctionnels dans les modèles globaux
Parmi les récentes études ayant utilisé une représentation de la végétation dans les modèles globaux axée sur les traits fonctionnels, ont peux repertorier différentes approches.
La première méthode consiste à paramétrer les PFTs existants et à augmenter leur nombre à partir des observations de traits. Cette méthode est intéressante pour représenter des processus dépendants des espèces considérées comme par exemple la gestion forestière. Cependant, elle ne peut pas être mise en place à l’échelle globale. En effet plus le nombre de PFTs augmente, plus ils se ressemblent et plus la quantité d’information nécessaire à leur paramétrisation de-vient importante (Yang et al.,2015). A l’inverse pour des écosystèmes avec une faible variabilité spécifique il est possible d’augmenter le nombre de PFTs, jusqu’à attribuer un PFT par espèce (Naudts et al.,2014).
Par ailleurs, certains auteurs ont tenté de redéfinir les PFTs sur de nouveaux critères, comme par exemple les réponses bio-climatiques des traits (Díaz and Cabido,1997;Harrison et al.,2010; Chaturvedi et al.,2011).
La seconde approche consiste à implémenter de la plasticité au sein des PFTs existants. Plusieurs études ont utilisé des relations empiriques observées entre traits (“trade-off ”), ou avec des variables environnementales, afin de prédire des distributions continues des paramètres. Pour plusieurs traits, des relations avec le climat ont été identifiées (Wright et al.,2005b;Ordoñez et al.,2009;van Ommen Kloeke et al.,2012a) et peuvent être incluses dans les modèles globaux. Ainsi, à partir de relations entre trois traits photosynthétiques majeurs et plusieurs variables environnementales, Verheijen et al. (2015) montrent l’importance de la prise en compte de la variabilité spatiale et temporelle des traits sur l’assimilation du carbone par la biosphère terrestre. De même, plusieurs auteurs ont montré que l’utilisation de trade-off avait un rôle important afin de prédire l’assemblage des communautés et leur biodiversité (Reu et al.,2011; Andersen et al.,2012;Verheijen et al.,2016).
Enfin la dernière approche se veut de supprimer l’information PFT et d’estimer la valeur des traits fonctionnels à partir de principes d’optimalité. Plusieurs auteurs ont montré qu’en optimisant les paramètres de végétation pour des conditions environnementales données, on obtient une distribution continue des traits indépendante des PFTs qui permet de reproduire les différents flux biogéochimiques observés. Ainsi,Schymanski et al.(2009) présentent un nouveau modèle suivant l’hypothèse que la végétation maximise son profit carbone par rapport à des conditions environnementales données, et montrent que cette approche permet de s’affranchir d’une calibration PFT-dépendante du modèle.
glo-1.5. Le modèle biosphérique ORCHIDEE
baux des flux biogéochimiques sur la base de plusieurs trade-off qui déterminent la capacité de survie de la végétation simulée.
De même,Maire et al.(2012) mettent en avant la théorie de la coordination de la photosynthèse selon laquelle il existe un point de co-limitation de la carboxylation de la RUBISCO et de la ré-génération de la RuBP définis par la teneur en azote foliaire et les conditions environnementales.
Dans cette thèse j’aborderai ces trois différents aspects d’utilisation des traits à l’aide du mo-dèle dynamique global de végétation (DGVM) ORCHIDEE.
1.5 Le modèle biosphérique ORCHIDEE
Tout au long de ma thèse j’ai utilisé le modèle global de végétation ORCHIDEE-FM
(OR-ganising Carbon and Hydrology In Dynamic Ecosystems - Forest Management). ORCHIDEE a
été développé afin de simuler la dynamique de la biosphère continentale terrestre et les dyna-miques spatiales et temporelles des stocks et des flux de matière et d’énergie associés (Krinner
et al.,2005). Pour les écosystèmes forestiers, ORCHIDEE couplé au module de gestion forestière
(FM,Bellassen et al. 2010) permet de représenter explicitement les distributions en taille et en âge des peuplements.
1.5.1 Structure du modèle
ORCHIDEE est un modèle dit “big leaf ”, i.e. qui représente toutes les propriétés et les pro-cessus de la canopée en une seule feuille représentative, pouvant fonctionner à l’échelle locale (site) ou globale. ORCHIDEE-FM est composé de quatre modules, SECHIBA, STOMATE, FM et
LPJ (Fig.1.3) représentant des processus à des échelles temporelles différentes.
Le module SECHIBA calcule les échanges de carbone, d’eau et d’énergie à un pas de temps de 30 minutes. Le module STOMATE calcule les processus liés à l’allocation du carbone, la res-piration, la décomposition de la matière ou encore la phénologie à un pas de temps journalier. Enfin, FM et LPJ fonctionnent à un pas de temps annuel. FM calcule l’évolution des peuple-ments forestiers, leur structure, les processus de compétition entre les arbres, les perturbations naturelles et anthropiques ou encore la limitation de la production primaire nette (NPP) liée à l’âge des arbres. Le module LPJ sert quant à lui a calculer la dynamique de la végétation. Tout au long de cette thèse la distribution de la végétation a été imposée, le module LPJ n’a donc pas été utilisé.
Dans cette thèse je me suis particulièrement intéressé aux processus photosynthétiques et phénologiques des écosystèmes forestiers. Les sections1.5.2et1.5.3détaillent uniquement les équations et les paramètres d’ORCHIDEE qui ont été étudiés dans les différents chapitres de cette thèse. Pour une description complète du modèle, se référer àKrinner et al.(2005). A l’ex-ception des processus phénologiques, les équations sont génériques pour tous les PFTs et seule leur paramétrisation diffère.
�������� � �� ��� ������ ����������� ��������������� ��� ��� ����������� ����� �������������������� �� ���������� ��� �� ������ � ��������� � !�"#$��� !�"%��& '(( )��� ������� ��� ��� ������ �*��� +�,���������� ��-����� ������� .�-������� ���� ������ �� ��� ������ � ���������� /� ����0���-������� �� !�"%�&�� �������
(�����&������� ��������������������1�� -& ��-����������������� ��&� ���-&
!�"%�&�� .�-��������&�� 2((� ������ +�3� ���� 0� �����& +�,����4 +�3� )���� ,�� ����� ������ +��5����� �������� ������������ ��� 5�� +�3� ����������6�� ���� �� 7������ ��� .�-������������������ �����&��� ��������� ���������� ������������ 211 ����� ������ ���� ���� ���� �� ������ ���� ���� 8��� ���������� ����������� �������� ����5������� ��� 2�9�� ���� ��� ���� �����:� ���-����������� 444 ����� ��� ��� ���� ����� 7���; �������-� �*����� �������-���
FIGURE1.3 – Structure du modèle ORCHIDEE
1.5.2 Photosynthèse et conductance
ORCHIDEE permet de simuler les flux de matières et d’énergie entre la biosphère et l’at-mosphère. Il permet ainsi d’estimer les différentes composantes des flux d’assimilation et de respiration de CO2des écosystèmes, soit l’échange net de CO2de l’écosystème (NEE pour Net
Ecosystem Exchange) :
— Le flux brut de carbone vers la plante est appelé la productivité primaire brut (GPP pour
gross primary production) et correspond au carbone nécessaire pour synthétiser les
dif-férents éléments de la plante.
— Une partie de ce carbone sera utilisée afin d’entretenir les processus métaboliques et les tissus existants (respiration de maintenance, MR) ainsi que pour assurer la synthèse de nouveaux tissus (respiration de croissance, GR).
— Enfin ORCHIDEE simule les flux de carbone émit par la décomposition de la matière organique de la litière et des sols (respiration hétérotrophe HR).
N E E= T ER −GPP (1.1)
= MR +GR + HR − A