La médecine traditionnelle à base de plantes, trouve un accueil favorable auprès des populations fortement paysannes, non seulement, du fait qu’elle est héritée des ancêtres, mais parce qu’elle a prouvé son efficacité au fil du temps. De nombreuses préparations simples et composées de fines herbes ont été employées dans la thérapie de la lithiase rénale comme les parties aériennes de Herniaria hirsuta L (carryophyllaceae). Les graines de Nigella Sativa sont fréquemment employées dans la médecine traditionnelle dans le Moyen-Orient et quelques pays asiatiques pour le traitement de beaucoup de maux incluant la fièvre, le rhume de cerveau, le mal de tête, l'asthme, des maladies rhumatismales et des infections microbiennes diverses [106].
Une grande variété de plantes de tous les pays du monde a été utilisée comme remède en faveurs des urolithiasiques. Cependant, peu d’investigateurs ont consacré leurs efforts à étudier ces plantes en employant des méthodes scientifiques. Telles études sont nécessaires pour comprendre les mécanismes par lequel ces plantes manifestent leurs effets et pour identifier leur principe actif. A cet égard, les racines de rhubarbe, une plante médicinale chinoise, ont été évaluées pour son potentiel thérapeutique, pour traiter des déficiences rénales chez les rats. Les résultats ont montré des effets avantageux aussi bien dans la réduction de la protéinurie que dans la diminution de la concentration d’urée [107,108].
Une autre plante chinoise la Kampou, est connue pour être employée dans le traitement de diverses maladies depuis des centaines d’années. Elle a été aussi employée pour la prévention et le traitement des calculs rénaux. Une étude expérimentale a montré un effet inhibiteur des extraits de Kampou sur la cristallisation de l’oxalate de calcium in vitro et in vivo [109]. Dans cette étude, deux espèces de Kampou, Takusya (Alisma orientale) et Kogoscou (Prunella vulgaris), ont été employées pour évaluer leur effet prophylactique in vivo. Les résultats ont montré la prophylaxie significative de Takusya tandis que Kagosou n’a pas donné d’effet.
Le son de riz a été également évalué, avec des patients qui ont une hypercalciurie idiopathique [110]. Pendant le traitement, il a été remarqué une réduction de l’excrétion du calcium urinaire. Ces résultats ont été confirmés expérimentalement et cliniquement [111].
D’autres travaux ont montré l’effet de quelques plantes médicinales, comme Rosa canina, Zea mays et Herniaria hirsuta [112-114]. A l’exception de quelques petits effets sur la calciurie et la citraturie, aucun changement significatif n’a été observé pendant le traitement.
L’activité d’extraits aqueux obtenus de Coctus spirallis, une plante brésilienne a été également testée [115]. Au Maroc, comme dans beaucoup de pays, un grand nombre de
patients emploient des plantes médicinales pour le traitement de lithiase. Ainsi, les parties aériennes d’Herniaria hirsuta sont employées dans la médecine traditionnelle : diurétique, traitement des calculs rénaux. Une étude in vitro a été conduite pour évaluer son efficacité sur la cristallisation de l’oxalate de calcium [116]. Les résultats de cette étude ont montré que l’extrait d’herbe a considérablement promu la formation des cristaux de l’oxalate de calcium dans l’urine, en augmentant leur nombre, mais inversement leur taille diminue. De plus, la présence d’extrait de plante a favorisé la formation de l’oxalate de calcium dihydratée plutôt que le composé monohydraté.
A notre connaissance, aucune étude à ce jour n’a montré l’effet de l’Hordeum vulgaris, Thymus vulgaris, Matricaria cammomilla, Urtica dioica, Nigella sativa et Pétroselinum sativum.sur la prévention ou le traitement de la lithiase urinaire. Pour ce faire, ces plantes ont été choisies dans le but de tester leur potentiel pouvoir inhibiteur sur la cristallisation des phosphates calciques et ainsi évaluer leur efficacité sur la prévention de la formation des calculs urinaires phosphocalciques.
III-1 Etude de la cristallisation des phosphates dans l’urine artificielle en absence et en présence des substances naturelles
De nombreux travaux sur les processus de cristallisation ont été réalisés in vitro à partir des années 70. Ces études ont permis :
De préciser les conditions cinétiques et thermodynamiques de la formation des cristaux oxalo et phosphocalcique.
De tester l’activité inhibitrice de différentes substances chimiques ou naturelles.
Pour cela, de nombreux modèles de cristallisation in vitro, plus au moins éloignés de celles de l’urine humaine, ont été proposés. Ils utilisent des solutions aqueuses sursaturées, des urines synthétiques et des urines diluées ou entières [8, 117-120].
III-1-1 Etude de la cristallisation des phosphates en absence d’inhibiteur
Nous avons adopté pour l’étude de la cristallisation des phosphates un modèle simple [5]. Il présente en plus, une reproductibilité très satisfaisante. Néanmoins, la durée de l’expérience est longue (de 4 à 6 heures) et la phase de nucléation est trop longue (temps d’induction 1heure). Dans cet objectif, nous avons développé une méthode simple dont la durée de l’expérience est de 41 minutes avec un temps d’induction ne dépassant pas 17 minutes. Elle
l’agrégation cristalline en absence et en présence d’inhibiteurs. Elle est fondée sur le suivi de la cinétique de cristallisation par mesure en continu du temps d’induction (nucléation), la taille des cristaux et la taille des agrégats.
III-1-1-1 Méthodologie
On sait que la majorité des phosphates qui composent les calculs d’infection sont pH- dépendant. A cet effet nous les avons étudiés aux valeurs caractéristiques suivantes pH =6,5 et 8.
A pH =6,5, on peut avoir la formation simultanée du phosphate amorphe de calcium carbonaté (5,9-7,6) et de la brushite (5,9 -8 ,8), (Ca HPO4, 2 H2O).
A pH =8, on peut avoir la formation simultanée de la carbapatite (5,9-9) et de la struvite (6,7-9).
III-1-1-2 Préparation de l’urine artificielle
Pour cette étude, nous avons préparé l’urine artificielle [5], qui consiste à mélanger deux volumes égaux (150ml) de deux solutions A et B, dont la composition est la suivante :
● La solution A contient 11,02 g.Lֿ¹ de Na2SO4, 10 H2O, 1,46 g.Lֿ¹ de MgSO4, 7H2O, 4,64 g.Lֿ¹ de NH4Cl, 12,13 g.Lֿ¹ de KCl et 0,9 g.Lֿ¹ de Ca²+ .
La solution standard en ions Ca²+est préparée à partir de 0,9g de CaCO3 dissous dansHCl concentré.
● La solution B contient 2,65 g.Lֿ¹ de NaH2PO4, 2H2O, 18,82 g.Lֿ¹ de Na2HPO4, 12H2O, 13,05 g.Lֿ¹ de NaCl, 1g.Lֿ¹ de Na3C6H5O7, 2H2O et 0,05 g.Lֿ¹ de C2O4²- .
La solution en ions C2O4² ֿ est préparée à partir d’acide oxalique 0,05g.
III-1-1-3 Cristallisation à pH=6.5
Un volume de 150 ml de solution A est introduit dans un erlenmeyer, placé dans un bain- marie thermostaté à 37 °C. Un autre erlenmeyer avec le même volume de solution B est placé dans les mêmes conditions sous agitation au moyen d’un agitateur magnétique. On ajuste le pH voulu, par addition de HCl ou NaOH à la solution B.
Une fois la température stabilisée à 37°C dans les deux erlenmeyer, les solutions A et B sont mélangées pour donner l’urine artificielle à pH = 6,5.
Le produit de la réaction du mélange est agité pour empêcher la sédimentation de la phase formée. L’urine artificielle reste constamment maintenue sous agitation à 37 °C et à l’obscurité durant 41 minutes.
La cinétique est menée de la manière suivante : à des intervalles de temps déterminés (3 minutes) une goutte de la solution est prélevée. Elle est posée sur une cellule de Malassez équipée d’une lamelle. La taille des cristaux et des agrégats est suivie par microscope polarisant. Ce dernier est équipé d’un appareil photographique numérique (Sony® model DKC-CM30). La spectroscopie infrarouge à Transformée de Fourier a été utilisée pour déterminer et confirmer les phases cristallines qui se forment par cistallisation. A la fin de chaque expérience, le mélange réactionnel est retiré du bain-marie et filtré sur papier filtre (Millipore 0,45µm). Le précipité obtenu est récupéré après séchage à température ambiante pendant 24 heures. Un milligramme de l’échantillon est trés finement pulvérisé dans un mortier, qu’on mélange intimement avec 100 mg de bromure de potassium (KBr) anhydre. Le mélange est homogénéisé. La poudre, ainsi obtenue, est introduite dans le moule et soumise à une pression de 10 tonnes/cm² pendant 2 à 3 minutes, de façon à obtenir une pastille fine. Les spectres infrarouges ont été réalisés sur un spectrophotomètre IRTF Perkin-Elmer Spectrum One et identifiés par comparaison avec les spectres de références [121].
III-1-1-4 Cristallisation à pH=8
Nous avons développé une méthode simple pour la cristallisation des cristaux de la struvite à pH=8 dont la durée de l’expérience est de 60 minutes et permettant d’apprécier le temps d’induction (nucléation), la taille des cristaux et la taille des agrégats. La composition de la solution A à pH =6,5 diffère de celle à pH = 8 dans les concentrations de MgSO4, 7H2O et NH4Cl afin de favoriser la réduction du temps d’induction de la struvite qui passe de 50 minutes dans le modéle de Grasse et al à cinq minutes dans notre modèle.
L’urine artificielle a été préparée en mélangeant deux volumes égaux (150ml) de solution A composée de 11,02 g.Lֿ¹ de Na2SO4, 10H2O, 1g.Lֿ¹ de MgSO4, 7H2O, 4 g.Lֿ¹ de NH4Cl, 12,13 g.Lֿ¹ de KCl et 0,9 g.Lֿ¹ de Ca2+et B dont la composition est la même à pH = 6,5.
III-1-2 Cristallisation en présence des substances naturelles
Certaines espèces cristallines sont évocatrices d’une sursaturation urinaire pouvant relever de causes très différentes. La mise en évidence de l’action inhibitrice de quelques plantes médicinales sur la cristallisation des phosphates à pH = 6,5 et 8 peut avoir des retombées très
positives sur la santé des lithiasiques. Cela nous a incité à tester in vitro l’effet de ces substances naturelles selon différents modes de préparation sur la cristallisation des phosphates calcique et magnésique à partir de l’urine artificielle.
Le taux d’inhibition des cristaux, et/ou des agrégats est déterminé par la formule [122] :
I % = [1-(T Sub / T SI)] 100.
I % : Taux d’inhibition de la taille des cristaux et/ou des agrégats ;
T Sub : taille des cristaux et/ou des agrégats en présence des substances naturelles ; T SI : taille des cristaux et/ou des agrégats en absence des substances naturelles.
III-1-2-1 Méthodologie
La même méthodologie qu’en absence d’inhibiteurs a été suivie en présence des substances naturelles. A t = 0, les solutions (A et B) et la tisane ou l’extrait de la plante testée (10ml) sont mélangées simultanément.
III-1-2-2 Préparation des extraits
Les mêmes extraits préparés pour l’étude de l’activité antibactérienne vis à vis des germes de l’infection urinaire ont été testés contre la cristallisation de la brushite à pH = 6,5 et la struvite à pH = 8.
Rappelons que ces substances naturelles ont été préparées en décoction, macération et digestion et extraites par solvants organiques. Les solvants utilisés sont classés par polarité croissante. Il s’agit de l’éther de pétrole, le dichlorométhane, le méthanol, l’éthanol, et l’eau. Chaque solvant permet l’extraction de principes actifs bien déterminés.
III-2 Résultats
III-2-1 Cristallisation en absence des substances naturelles
Dans cette série d’expériences, l’influence des substances naturelles sur la cristallisation des phosphates à pH = 6,5 et 8 a été étudiée. L’étude est conduite de manière strictement parallèle à celle en présence des substances chimiques. Nous avons travaillé avec des mêmes paramètres proches des conditions physiologiques de formation des cristaux.
III-2-1-1 Cristallisation à pH = 6,5 III-2-1-1-1 Morphologie des cristaux
L’espèce cristalline qui s’est formée dans l’urine artificielle à ce pH est la brushite (photographie 4). Rappelons que le pH de précipitation de brushite varie entre 5,9 et 8,8 [12]. Des granulations
sont apparues après huit minutes de cristallisation (photographie 22). Elles ont été identifiées par microscope optique à lumière polarisée par leur faible polarisation et vérifiées par IRTF comme étant du phosphate amorphe de calcium carbonaté (PACC).
Photographie 20: Apparition des granulations de PACC à 8min de cristallisation. (10 x 40 x 2,5).
Photographie 22: apparition des agrégats de brushite de dimension moyenne de 25 µm à 23 mn de cristallisation (10 x 40 x 2,5).
Photographie 21 : Apparition des cristaux de la brushite de dimension moyenne de 2,5 µm à 17 min de cristallisation. (10 x 40 x 2,5).
Photographie 23: cristaux (10µm) et agrégats (55µm) de la brushite à 41 min (10 x 40 x 2,5)
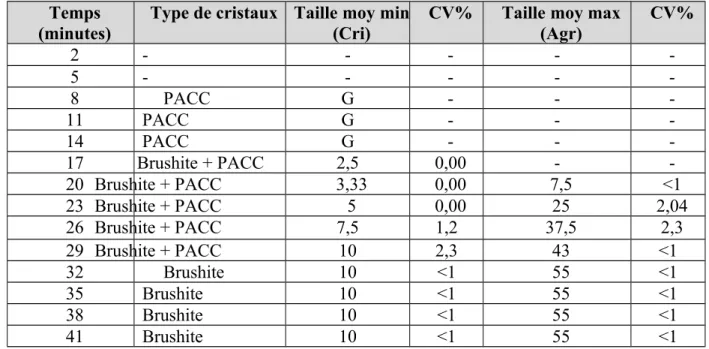
A l'aide d'un micromètre adapté au microscope optique à lumière polarisée, on mesure la taille moyenne des cristaux et des agrégats. Pour une bonne reproductibilité, les expériences ont été répétées trois fois. Les CV étaient inférieure à 5% dans toutes nos expériences. La taille moyenne des cristaux obtenue était de 10µm et celle des agrégats de 55µm (tableau 28).
Tableau 28: Evolution de la taille moyenne en µm des cristaux et des agrégats de brushite
Temps (minutes)
Type de cristaux Taille moy min (Cri)
CV% Taille moy max (Agr)
CV%
2 - - - - -
5 - - - - -
8 PACC G - - -
11 PACC G - - -
14 PACC G - - -
17 Brushite + PACC 2,5 0,00 - -
20 Brushite + PACC 3,33 0,00 7,5 <1
23 Brushite + PACC 5 0,00 25 2,04
26 Brushite + PACC 7,5 1,2 37,5 2,3
29 Brushite + PACC 10 2,3 43 <1
32 Brushite 10 <1 55 <1
35 Brushite 10 <1 55 <1
38 Brushite 10 <1 55 <1
41 Brushite 10 <1 55 <1
G: granulations de PACC; Cri: cristaux; Agr: agrégats; min: minimum; max: maximum.
Le tableau 28 montre que les cristaux de brushite et les agrégats sont apparus après 17 et 20 minutes respectivement. Les cristaux sont apparus sous forme de baguettes et de poinçons faiblement polarisants, plus ou moins agrégées, et sous forme aciculaires polarisants agrégés en gerbes (photographies 20, 21, 22 et 23). L’identification morphologique des cristaux et des agrégats a été effectuée en les comparant à ceux des planches d’identification données par Jungers et all. [12]. Au bout de quarante et une minutes, toutes les granulations ont été transformées en brushite.
III-2-1-1-2 Analyse IRTF
Pour déterminer et confirmer les phases cristallines qui se forment par cristallisation, nous avons utilisé la spectroscopie Infrarouge à Transformée de Fourier.
L’analyse spectrale du culot recueilli à la fin de l’expérience et l’identification avec le spectre de référence, montre que les cristaux formés sont la brushite. Ces résultats confirment l’étude morphologique. Le spectre 5, montre des bandes caractéristiques de la brushite. Il comporte des fréquences caractéristiques des phosphates et des molécules d’eau. On note la disparition des granulations qui n’apparaissent pas dans ce spectre. Toutes les granulations ont été transformées en brushite.
Spectre 5: Brushite à pH = 6,5 en absence d'inhibiteur.
Le spectre 5 obtenu par analyse spectroscopique confirme la présence de brushite pH = 6,5:
Valence des molécules d’eau à 3541-3488 cm-1;
Valence asymétrique des phosphates à 1136-1061-986 cm-1;
Bandes secondaires à 1649 cm-1 (fine), 1216 cm-1 et épaulement à 1000 cm-1 de la bande à 986 cm-1.
III-2-1-2 Cristallisation à pH = 8 III-2-1-2-1 Morphologie des cristaux
A ce pH, les granulations et les cristaux de struvite sont formés après cinq minutes de l’addition de la solution B (photographie 25). Les granulations ont été identifiées par microscope optique à lumière polarisée par leur intense polarisation et vérifiées par IRTF comme étant de la carbapatite. En effet, celle-ci précipite à pH: 5,9 - 9, alors que la struvite cristallise à pH: 6,7 - 9 [4]. Le pH = 8 est plus favorable à la formation de struvite et de carbapatite. Les cristaux de struvite formés à ce pH ont des formes rectangulaires et orthorhombiques (photographie 27).
Taille des cristaux et des agrégats
Les résultats sont regroupés dans le tableau 29. La taille maximum des cristaux est de 12,5µm et celle des agrégats est de 61µm. Nous remarquons que la taille des cristaux de struvite est plus importante à pH = 8 qu’à pH = 6,5.
PACC à 2min de cristallisation
Granulations de PACC
Photographie 20: apparition des granulations de PACC à 2 minutes de cristallisation (10 x 40 x 2,5).
germination de la struvite
Cri:2,5 µm
Photographie25: apparition des cristaux de la struvite de dimension moyenne de 2,5 µm à 5 min de cristallisation. (10 x 40 x 2,5).
Photographie 26: apparition des cristaux de la struvite 5 µm et des agrégats 10µm à 8 mn de cristallisation. (10 x 40 x 2,5).
Photographie 27: cristaux 12,5µmet agrégats 61µm de struvite enabsence d’inhibiteurs à 41min (10x40x2,5)
Tableau 29: Evolution de la taille en µm des cristaux et des agrégats de struvite à pH = 8 en absence d'inhibiteur.
Temps
(min) Type de
cristaux
Taille des cristaux
(µm)
CV% Taille des
agrégats (µm)
CV%
2 - - - - -
5 Carbapatite + struvite
2,5 - - -
8 Carbapatite + struvite
5 - 10 1,2
11 Carbapatite + struvite
7,5 - 22,5 2,04
14 Carbapatite + struvite
10 - 30,5 1,2
17 Carbapatite + struvite
12,5 - 31,5 1,2
20 Carbapatite + struvite
12,5 <1 38,6 1,2
23 Carbapatite + struvite
12,5 <1 45,5 1,2
26 Carbapatite + struvite
12,5 <1 56,75 1,2
29 Carbapatite + struvite
12,5 <1 61 1,2
32 Carbapatite + struvite
12,5 <1 61 2,3
35 Carbapatite + struvite
12,5 <1 61 1,2
38 Carbapatite + struvite
12,5 <1 61 <1
41 Carbapatite + struvite
12,5 <1 61 <1
44 Carbapatite + struvite
12,5 <1 61 <1
47 Carbapatite + struvite
12,5 <1 61 <1
50 Carbapatite + struvite
12,5 <1 61 <1
III-2-1-2-2Analyse IRTF
L’analyse spectrale du culot recueilli à la fin de l’expérience et l’identification avec les spectres de référence montre que les composés formés étaient principalement la carbapatite et la struvite (spectre 6).
Le dépouillement du spectre IRTF 6 obtenu confirme la formation de la carbapatite et de la struvite:
Bande phosphate à 1005 cm-1, concave à gauche;
Déformation de l'ion ammonium à 1435 cm-1;
Plateau des molécules H2O + ion NH4+ à 2345 cm-1.
Spectre 6 : Struvite à pH = 8 en absence d'inhibiteur.
Les espèces phosphatiques cristallisables étudiées sont dépendantes du pH du milieu, nous avons étudié la cristallisation de ces espèces à partir de l'urine artificielle à pH = 6,5 et 8.
Sans inhibiteur, les résultats montrent clairement qu’à pH = 6,5 c'est la brushite qui se forme. Les tailles maximum des cristaux et des agrégats sont respectivement de 10µm et 55µm à pH = 6,5.
La formation de la PACC est transitoire. Elle se transforme en brushite à partir de 29 minutes. Par contre à pH = 8, ce sont la struvite et la carbapatite qui se forment instantanément. Les tailles maximum des cristaux et des agrégats de struvite sont respectivement de 12,5µm et 61µm.
III-3 Cristallisation en présence des substances naturelles III-3-1 Cristallisation à pH=6.5
III-3-1-1 Etude de l’effet de Matricaria chamomilla préparé par décoction, digestion macération et extraite par solvants.
La même méthodologie qu’en absence d’inhibiteurs a été suivie en présence des substances naturelles. A t = 0, les solutions A et B et la tisane ou l’extrait de la plante testée (10ml) sont mélangées simultanément.
III-3-1-1-1 Morphologie des cristaux
L’analyse des prélèvements au microscope optique à lumière polarisante a montré que la morphologie des cristaux obtenus par la cristallisation phosphocalcique avec Matricaria chamomilla reste la même que celle de la cristallisation en absence d’inhibiteur (photographies 28,29 et 26).
Taille des cristaux et des agrégats
Photographie29 : diminution de la taille des cristaux de brushite à 2,5µm, soit une inhibition de 75% et disparition des agrégats en présence de l’extrait de Matricaria chamomilla (éthanol)
Photographie30: diminution de la taille des cristaux de brushite à 5µm, soit une
inhibition de 50% et disparition des agrégats en présence du marc de Matricaria
chamomilla.
Photographie 28 : diminution de la taille des cristaux de brushite à 5µm, soit une
inhibition de 50% et disparition des agrégats en présence de l’extrait de Matricaria chamomilla (éther de pétrole) Photographie : cristaux (10µm) et agrégats
(55µm) de la brushite à 41 min en absence d’inhibiteur (10 x 40 x 2,5)
III-3-1-1-2 Taille moyenne des cristaux et des agrégats
Nous avons déterminé la taille moyenne des cristaux de brushite en fonction du temps et en présence d’inhibiteur. Les résultats sont présentés en annexe 1.
D’après ces résultats, nous remarquons que cette plante exerce un effet inhibiteur remarquable sur la croissance et l’agrégation de la brushite. On a enregistré une nette diminution de la taille des cristaux et des agrégats pour la majorité des extraits.
Les temps d’induction et d’agrégation observés sont estimés à 17 min et 20 min respectivement. Ces temps sont les mêmes que ceux en absence d’inhibiteur. Les mêmes temps ont été enregistrés chez toutes les plantes.
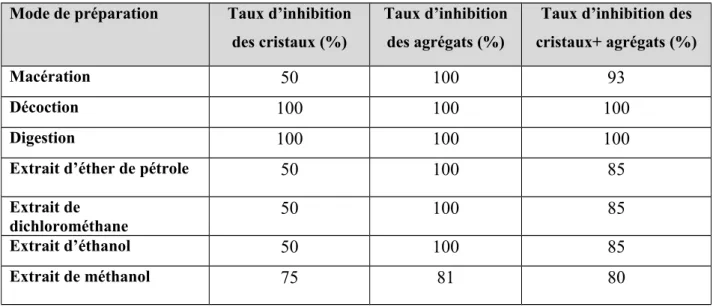
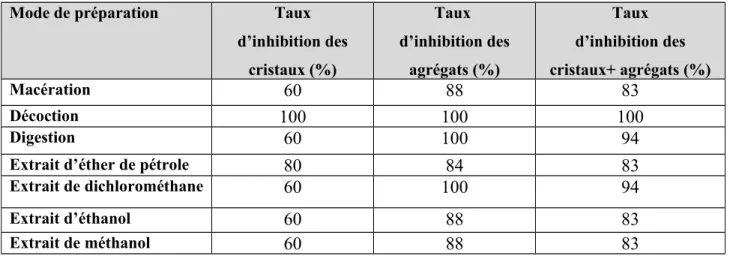
Le tableau 30, regroupe le taux d’inhibition (%) de la taille des cristaux et des agrégats de la brushite en présence de Matricaria chamomilla.
Tableau 30: Taux d’inhibition (%) de la taille des cristaux et des agrégats de la brushite Mode de préparation Taux d’inhibition
des cristaux (%)
Taux d’inhibition des agrégats (%)
Taux d’inhibition des cristaux+ agrégats (%)
Macération 50 100 85
Décoction 100 100 100
Digestion 100 100 100
Extrait d’éther de pétrole 50 100 93
Extrait de dichlorométhane 100 100 100
Extrait d’éthanol 75 100 93
Extrait de méthanol 100 100 100
Notre étude montre que la majorité des extraits de cette plante ont un effet remarquable sur l’inhibition de la brushite. Le taux d’inhibition des cristaux et des agrégats du digeste, décocté et l’extrait de dichlorométhane ainsi que le méthanol est de 100%.
Tous les extraits de cette plante ont un effet remarquable sur la désagrégation de la brushite.
Pour les extraits d’éthanol, d’éther de pétrole ainsi que le marc, on a enregistré un taux d’inhibition de la croissance des cristaux respectivement de 75 % et 50 %.
III-3-1-2 Etude de l’effet d’Urtica dioica III-3-1-2-1 Morphologie des cristaux
L’analyse morphologique des cristaux en présence d’Urtica dioica en solutions aqueuses et extraite par solvants organiques a montré que leur morphologie est la même que celle des cristaux en absence d’inhibiteur. Néanmoins la taille des cristaux et des agrégats a diminué photographies31, 32 et 33.
Photographie 31 : diminution de la taille des cristaux de brushite à 2,5µm, soit une inhibition de 75% et disparition
des agrégats en présence du décocté d’
Urtica dioica (10 x 40x 2,5).
Photographie 32 : diminution de la taille des cristaux de brushite à 2,5µm et des agrégats à 7,5µm, soit une inhibition des cri de50% et des agr de 87% en présence de l’extrait d’Urtica dioica (méthanol)(10 x 40x 2,5).
Photographie 33 : diminution de la taille des cristaux de brushite à 5µm, soit une inhibition de50% et disparition des agrégats en présence de l’extrait d’Urtica dioica (éthanol) (10 x 40x 2,5).
Photographie : cristaux (10µm) et agrégats (55µm) de la brushite à 41 min en absence d’inhibiteur (10 x 40 x 2,5)
III-3-1-2-2 Taille moyenne des cristaux et des agrégats
Nous avons déterminé la taille moyenne des cristaux de brushite en fonction du temps et en présence d’inhibiteur. Les résultats sont présentés en annexe 2.
Nous remarquons que l’effet remarquable de cette plante sur la brushite. La présence des extraits de cette plante a provoqué une nette diminution de la taille des cristaux et des agrégats de cette espèce cristalline.
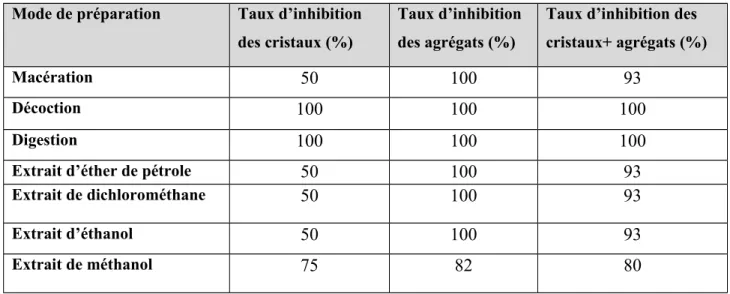
Le tableau 31 regroupe le taux d’inhibition (%) de la taille des cristaux et des agrégats de la brushite en présence d’ Urtica dioica
Tableau 31 : Le taux d’inhibition (%) de la taille des cristaux et des agrégats de la brushite
Mode de préparation Taux d’inhibition des cristaux (%)
Taux d’inhibition des agrégats (%)
Taux d’inhibition des cristaux+ agrégats (%)
Macération 100 100 100
Décoction 75 100 97
Digestion 100 100 100
Extrait d’éther de pétrole 100 100 100
Extrait de dichlorométhane 100 100 100
Extrait d’éthanol 50 100 93
Extrait de méthanol 75 87 85
On peut déduire que cette plante exerce le pouvoir inhibiteur le plus important sur la brushite.
La majorité de ses extraits inhibent totalement cette espèce cristalline. L’effet des autres extraits qui n’ont pas provoqué une inhibition totale de la brushite n’est pas négligeable et reste effectif, avec des taux d’inhibition dépassant 50 %. Le taux d’inhibition des cristaux + agrégats est important pour tous les extraits avec un domaine d’inhibition très peu étendu 85%
et 100%.
III-3-1-3 Etude de l’effet de Pétroselinum Sativum III-3-1-3-1 Morphologie des cristaux
L'analyse des prélèvements au microscope optique à lumière polarisante a révélé que la morphologique des cristaux obtenus en présence du marc de Pétroselinum Sativum n'a pas changé. La forme générale des cristaux reste sous forme de baguettes et de poinçons faiblement polarisants, plus ou moins agrégées (photographies 34, 35 et 36). Par contre en présence du décocté et digeste de cette même plante, la brushite a été inhibé totalement.
Brushite en présence du marc de pétroselinum sativum
Cri:2,5µm
Photographie 34 : diminution de la taille des cristaux de brushite à 2,5µm, soit une inhibition de75% et disparition des agrégats en présence du marcde Pétroselinum Sativum
Photographie : cristaux (10µm) et agrégats (55µm) de la brushite à 41 min en absence d’inhibiteur (10 x 40 x 2,5)
Brushite en présence de l’extrait de pétroselinum sativum (méthanol)
Agr:10,5µm
Cri:2,5µm
Photographie 36 : diminution de la taille des cristaux de brushite à 2,5µm et des agrégats à10,5µm, soit une inhibition des cri de 75%
et des agr 81% en présence de l’extrait de Pétroselinum Sativum (méthanol)
Brushite en présence de l’extrait de pétroselinum sativum (éthanol)
Cri:2,5µm
Photographie35:diminution de la taille des cristaux de brushite à 2,5µm, soit une inhibition de 75% et disparition des agrégats en présence de l’extrait dePétroselinum Sativum (éthanol)
III-3-1-3-2 Taille moyenne des cristaux et des agrégats
Nous avons suivi la taille moyenne des cristaux et des agrégats pour tous les modes de préparation de Pétroselinum Sativum, en fonction du temps par microscope optique à lumière polarisante.
Les résultats du suivi de l'évolution de la taille moyenne des cristaux de brushite à pH = 6,5 en présence de Pétroselinum Sativum sont présentés en annexe 3.
La décoction et la digestion de Pétroselinum Sativum agissent sur la nucléation de la brushite en empêchant complètement sa formation. La macération n’exerce pas le même effet sur les cristaux par contre, inhibe totalement l’apparition des agrégats. A la fin des expériences, la taille des cristaux de brushite en présence de Pétroselinum Sativum, s’est stabilisée à 8,75 µm au lieu de 10 µm, en absence d’inhibiteurs
Le tableau 32, regroupe le taux d’inhibition (%) de la taille des cristaux et des agrégats de la brushite en présence de Pétroselinum Sativum
Tableau 32: Le taux d’inhibition (%) de la taille des cristaux et des agrégats de la brushite
Mode de préparation Taux d’inhibition des cristaux (%)
Taux d’inhibition des agrégats (%)
Taux d’inhibition des cristaux+ agrégats (%)
Macération 50 100 93
Décoction 100 100 100
Digestion 100 100 100
Extrait d’éther de pétrole 50 100 85
Extrait de
dichlorométhane 50 100 85
Extrait d’éthanol 50 100 85
Extrait de méthanol 75 81 80
D’après notre étude, il en sort que le digeste et le décocté de cette plante inhibent totalement la brushite. Le marc et les extraits d’éther de pétrole, de dichlorométhane ainsi que l’éthanol agissentt beaucoup plus sur l’agrégation (inhibition totale) que sur la taille des cristaux de la
brushite. Le pourcentage d’inhibition des cristaux par ces mêmes extraits est le même soit 50%.
Le taux d’inhibition cristaux + agrégats le plus élevé correspond au marc (93 %), suivi par ceux des extraits d’éther de pétrole, de dichlorométhane et d’éthanol (85 %).
III-3-1-3-3 Analyse par infrarouge à transformer de fourrier (IRTF)
L’analyse spectrale du culot recueilli à la fin de l’expérience et l’identification avec les spectres de références montre l’inhibition totale de la brushite en présence du décocté et digeste de Pétroselium Sativum (spectre 7). Les bandes caractéristiques de la brushite sont remplacées par celles du PACC qui sont facilement éliminées par la voie urinaire.
Spectre…: PACC à pH =6,5
Spectre 7 : spectre du PACC en présence du digeste de Pétroselium Sativum (Feuilles)
Le spectre montre des bandes caractéristiques du PACC. Il comporte des fréquences caractéristiques de cette dernière.
Bande phosphate, arrondi, forte, asymétrique et centré sur 1062cm-1
Pas de bande à 600 cm-1
III-3-1-4 Etude de l’effet du Thymus vulgaris préparé par décoction, digestion macération et extrait par solvants.
III-3-1-4-1 Morphologie des cristaux
L’analyse des prélèvements au microscope optique à lumière polarisante a révélé que la morphologie des cristaux de brushite obtenus pour les préparations de Thymus vulgaris n’a pas changé, la forme générale des cristaux reste sous forme de baguettes et de poinçons faiblement polarisants, plus ou moins agrégées et sous formes aciculaires polarisantes agrégées en gerbes, comme pour le cas des cristaux en absence d’inhibiteur (photographies 37, 38, 39, 40 et 41).
Photographie 37 : diminution de la taille des cristaux de brushite à 5µm, soit une inhibition de 50% et disparition des agrégats en présence du marc Thymus vulgaris
Photographie 38 : nucleus de PACC en
présence du digeste de Thymus vulgaris Photographie39 : disparition des cristaux de la brushite et les granulations de PACC en présence de décocté de Thymus vulgaris
Photographie : cristaux (10µm) et agrégats (55µm) de la brushite à 41 min en absence d’inhibiteur (10 x 40 x 2,5)
III-3-1-4-2 Taille moyenne des cristaux et des agrégats
Nous avons mesuré la taille des cristaux et des agrégats de la brushite en présence de Thymus vulgaris comme inhibiteur. Les valeurs obtenues sont présentées en annexe 4.
L’effet de cette plante sur la taille des cristaux et des agrégats de la brushite est aussi remarquable. La majorité des extraits ont provoqué la désagrégation de la brushite. Pour le reste des extraits, on a enregistré la présence de cristaux de tailles trop faibles.
Les temps d’induction et d’agrégation observés en présence des différents extraits de cette plante sont estimés à 17 min et 20 min respectivement. Ces mêmes temps ont été enregistrés en absence d’inhibiteur.
Le tableau 32, regroupe le taux d’inhibition (%) de la taille des cristaux et des agrégats de la brushite en présence des extraits du Thymus vulgaris.
Photographie 40: diminution de la taille des cristaux de brushite à 5µm, soit une inhibition de 50% et disparition des agrégats en présence l’extrait de Thymus vulgaris (éther de pétrole)
Photographie 41 : diminution de la taille des cristaux de brushite à 5µm, soit une inhibition de 50% et disparition des agrégats en présence de l’extrait de Thymus vulgaris (éthanol)
Tableau 32 : Taux d’inhibition (%) de la taille des cristaux et des agrégats de la brushite Mode de préparation Taux d’inhibition
des cristaux (%)
Taux d’inhibition des agrégats (%)
Taux d’inhibition des cristaux+ agrégats (%)
Macération 50 100 93
Décoction 100 100 100
Digestion 100 100 100
Extrait d’éther de pétrole 50 100 93
Extrait de dichlorométhane 50 100 93
Extrait d’éthanol 50 100 93
Extrait de méthanol 75 82 80
Nous remarquons que le décocté et le digeste du Thymus vulgaris, inhibent totalement les cristaux de la brushite. Le marc, les extraits d’éther de pétrole, de dichlorométhane et d’éthanol sont responsables de la désagrégation de ces cristaux, par contre leur taille a diminuée de moitié (50%). Ces mêmes extraits, ont donné le taux d’inhibition cristaux + agrégats le plus élevé (93 %).
L’effet des autres extraits sur l’agrégation de cette espèce cristalline n’est pas aussi important mais reste effectif. Le taux d’inhibition de l’agrégation le plus faible est de 82%
correspondant à l’extrait du méthanol. Ce dernier a provoqué une nette diminution de la taille des cristaux de brushite, traduite par un taux d’inhibition de 75 %.
Le taux d’inhibition des agrégats est toujours supérieur ou égale à celui des cristaux pour tous les modes de préparation de cette plante.
III-3-1-4-3 Analyse IRTF
L’analyse par IRTF des précipités obtenus aprés chaque cristallisation nous a confirmé que la seule éspèce cristalline formée était la brushite (spectre 8). Il n’y a aucune trace de granulations.
Spectre 8 : spectre de brushite à pH = 6.5 en présence du Tymus vulgaris (macération 24 heures).
Le spectre 8 montre des bandes caractéristiques de la brushite. Toutes les granulations se sont transformées en brushite.
Valence des molécules d’eau à 3487-3540 cm-1 ;
Valence asymétrique des phosphates à 986-1065-1137 cm-1 ;
Bandes secondaires à 1648 cm-1 (fine), 1212 cm-1 et épaulement à 1000 cm-1 de la bande à 986 cm-1 .
III-3-1-5 Etude de l’effet de l’Hordeum vulgare préparé par décoction, digestion macération et extrait par solvants.
Pour évaluer l’effet inhibiteur du l’Hordeum vulgare sur les étapes de cristallisation phosphocalcique, des solutions de cette plante selon différents modes de préparations sur la cristallisation phosphocalcique
III-3-1-5-1 Morphologie des cristaux
L’étude de la cinétique de la cristallisation, en présence de l’Hordeum vulgare a révélé la formation de la brushite, comme le montre les photographies, 42, 43 et 44. La morphologie des cristaux et des agrégats obtenus n’a pas changé par rapport à sans inhibiteur. Néanmoins la taille a diminué pour le marc et les extraits d’éther de pétrole, éthanol et méthanol. Pour les autres modes de préparations, les cristaux et les agrégats sont inhibés totalement.
Tisanes de l’Hordeum vulgare
III-3-1-5-2 Taille moyenne des cristaux et des agrégats
Les tailles moyennes des cristaux et des agrégats, en présence de l’Hordeum vulgare comme inhibiteur ont été mesurées. Les valeurs obtenues sont représentées en annexe 5.
Photographie 44 : diminution de la taille des cristaux de brushite à 5µM, soit une inhibition de 50% et disparition des agrégats en présence du marc de l’Hordeum vulgare
Photographie 43: diminution de la taille des cristaux de 75% et des agrégats de 78% de la brushite en présence de L’extrait d’Hordeum vulgare (méthanol)
Photographie 42 : Nucleus de PACC en Présence du décocté, digeste et de l’extrait de dichlorométhane de l ’Hordeum vulgare Photographie : cristaux (10µm) et agrégats
(55µm) de la brushite à 41 min en absence d’inhibiteur (10 x 40 x 2,5)
Il en sort que le décocté et le digeste du l’Hordeum vulgare ainsi que l’extrait de dichlorométhane inhibent totalement les cristaux de brushite. Alors qu’en présence du marc et les extraits d’éther de pétrole et de méthanol de cette plante, la taille moyenne des cristaux de brushite est réduite à 2,5 µm au lieu de 32,5µm en absence d’inhibiteur.
Le marc et l’extrait d’éthanol ont provoqué la disparition complète des agrégats de brushite.
Tous ces extraits de l’Hordeum vulgare n’ont provoqué aucun ralentissement dans le temps de nucléation. Les temps d’induction et d’agrégation sont les mêmes par rapport à sans inhibiteur, ils sont de 17min et 20 min respectivement.
Le tableau 33, regroupe le taux d’inhibition (%) de la taille des cristaux et des agrégats de la brushite en présence de l’Hordeum vulgare
Tableau 33 : Taux d’inhibition (%) de la taille des cristaux et des agrégats de la brushite Mode de préparation Taux d’inhibition
des cristaux (%)
Taux d’inhibition des agrégats (%)
Taux d’inhibition des cristaux+ agrégats (%)
Macération 75 100 97
Décoction 100 100 100
Digestion 100 100 100
Extrait d’éther de pétrole 50 85 79
Extrait de dichlorométhane 100 100 100
Extrait d’éthanol 50 100 93
Extrait de méthanol 75 78 77
La plante préparée par digestion, décoction et extraite par le dichlorométhane inhibe les cristaux et les agrégats à 100%. Le marc et l’extrait d’éthanol ont inhibé totalement les agrégats mais les cristaux à 50%. Quant aux extraits du méthanol, d’éther de pétrole, d’éthanol et le marc, nous enregistrons les taux d’inhibition (cristaux + agrégats) qui sont respectivement de 77%, 79%, 93% et 97%.
Nous remarquons que le pourcentage d’inhibition des agrégats est toujours supérieur ou égale à celui des cristaux pour tous les modes de préparations.
III-3-2 Cristallisation à pH= 8
III-3-2-1 Etude de l’effet de Matricaria chamomilla préparé par décoction, digestion macération et extraite par solvants.
III-3-2-1-1 Morphologie des cristaux
L’analyse des prélèvements au microscope optique à lumière polarisante a montré que la morphologie des cristaux obtenus par la cristallisation phosphocalcique avec Matricaria chamomilla reste la même que celle de la cristallisation en absence d’inhibiteur (.photographies 45, 46,47, 48 et 49).
116
Struvite en présence de l’extrait de Matricaria camomilla (méthanol)
Cri:5µm
Photographie 47 : diminution de la taille des cristaux de 60% et disparition des agrégats Struvite en présence du marc de Matricaria
camomilla
Cri:2,5 µm Agr:10,5µm
Photographie 46 : diminution de la taille
Struvite en présence du digeste et décocté de Matricaria camomilla
Cri:2,5µm
Agr:8,74µm
Photographie 45 : diminution de la taille des cristaux de 80 % et des agrégats de 86% de la struvite en présence du décocté et de digeste de Matricaria chamomilla
Chapitre III : Etude de l’effet de quelques substances naturelles sur la cristallisation des phosphates calciques et magnésiques
III-3-2-1-2 Taille moyenne des cristaux et des agrégats
En présence des différents extraits de Matricaria chamomilla, les tailles moyennes des cristaux de struvite ont été mesurées, regroupées et présentées en annexe 6.
Ces résultats montrent une nette diminution de la taille des cristaux et des agrégats de struvite en présence de tous les extraits de cette plante. Les extraits de dichlorométhane et de méthanol ont provoqué la désagrégation de la struvite.
Les temps d’induction observés en présence des différents extraits sont estimés à 5 min et 8 min pour la nucléation et l’agrégation respectivement. Les mêmes temps sont enregistrés chez toutes les plantes.
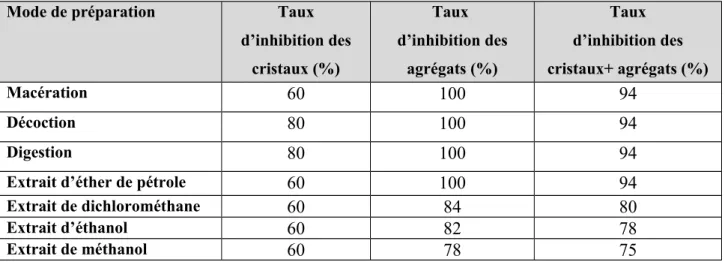
Le tableau 34 regroupe le taux d’inhibition (%) de la taille des cristaux et des agrégats de la brushite en présence de Matricaria chamomilla
Agr:61µm
Nucleus de PACC
Photographie: cristaux (12,5µm) et agrégats (61µm) de struvite en absence d’inhibiteurs (10x40x2,5)
Photographie 49 : diminution de la taille des cristaux de 60% et disparition des agrégats de struvite en présence de l’extrait de Matricaria chamomilla (dichlorométhane) Photographie 48 : diminution de la taille
des cristaux de 80% et des agrégats de 82%
de la struvite en présence des extraits de Matricaria chamomilla (éther de pétrole et éthanol)
Tableau 34: Taux d’inhibition (%) de la taille des cristaux et des agrégats de la struvite
Mode de préparation Taux
d’inhibition des cristaux (%)
Taux d’inhibition des
agrégats (%)
Taux d’inhibition des cristaux+ agrégats (%)
Macération 80 83 83
Décoction 80 86 85
Digestion 80 86 85
Extrait d’éther de pétrole 80 82 82
Extrait de dichlorométhane 60 100 94
Extrait d’éthanol 80 82 82
Extrait de méthanol 60 100 94
Nous constatons que le pourcentage d’inhibition des cristaux est presque le même pour toutes les préparations de cette plante et se limite entre 60 et 80%.
Les extraits de dichlorométhane et méthanol enregistrent le taux d’inhibition des agrégats le plus important, soit 100% suivi du digeste et le décocté avec le même pourcentage d’inhibition, soit 86%.
Le taux d’inhibition cristaux + agrégats le plus important correspond à l’extrait de dichlorométhane (94 %).
L’effet inhibiteur important de cette plante est sûrement du à sa richesse en substance actives telles que les tanins, hétérosides, sels minéraux.
III-3-2-2 Etude de l’effet d’Urtica dioica III-3-2-2-1 Morphologie des cristaux
L’analyse morphologique des cristaux en présence d’Urtica dioica selon différents modes de préparation a montré que leur morphologie est la même que celle des cristaux en absence d’inhibiteur (Photographies 50, 51,52, 53 et 54). Néanmoins la taille a diminué.
Photographie 50 : diminution de la
taille des cristaux de 80% et des agrégats de 100 % de la struvite en présence du digeste d’Urtica dioica
Photographie 52: diminution de la taille des cristaux de 60% et des agrégats de 78 % de la struvite en présence de l’extrait Urtica dioica (méthanol )
Photographie51 : diminution de la taille des cristaux de 60 %et des agrégats de 82% de la struvite en présence de l’extrait d’Urtica dioica (dichlorométhane et éthanol)
Photographie 53 : diminution de la taille des cristaux de 60% et disparition des agrégats de la struvite en présence de l’extrait d’Urtica dioica (éther de pétrole)
Photographie 54: diminution de la taille des cristaux de 60% et des agrégats de 84% de la struvite en présence de l’extrait d’Urtica dioica (dichlorométhane )
Struvite en absence d’inhibiteurs à pH =8 Cri:12,5 µm
Agr:61µm
Nucleus de PACC
Photographie: cristaux (12,5µm) et agrégats (61µm) de struvite en absence d’inhibiteurs (10x40x2,5)
III-3-2-2-2 Taille moyenne des cristaux et des agrégats
Nous avons mesuré la taille moyenne des cristaux de struvite en fonction du temps et en présence d’inhibiteur. Les résultats sont regroupés en annexe 7.
Ils montrent que tous les extraits de cette plante ont provoqué une nette diminution des cristaux de struvite. Le marc, le décocté, le digeste et l’extrait d’éther de pétrole d’Urtica dioica ont empêché la formation des agrégats de cette espèce cristalline.
La présence de ces extraits n’a pas agit sur le temps d’induction et celui d’agrégation de la struvite. Ces temps sont les mêmes que ceux en absence d’inhibiteur.
Le tableau 35, regroupe le taux d’inhibition (%) de la taille des cristaux et des agrégats de la struvite en présence d’ Urtica dioica
Tableau 35: Taux d’inhibition (%) de la taille des cristaux et des agrégats de la struvite
Mode de préparation Taux
d’inhibition des cristaux (%)
Taux d’inhibition des
agrégats (%)
Taux d’inhibition des cristaux+ agrégats (%)
Macération 60 100 94
Décoction 80 100 94
Digestion 80 100 94
Extrait d’éther de pétrole 60 100 94
Extrait de dichlorométhane 60 84 80
Extrait d’éthanol 60 82 78
Extrait de méthanol 60 78 75
On peut déduire que le marc, le digeste, le décocté ainsi que l’extrait d’éther de pétrole inhibent totalement la formation des agrégats de struvite.
La majorité des extraits agissent de la même efficacité sur la croissance des cristaux de struvite, leurs taux d’inhibition se limitent entre 60 % et 80%.
Le pourcentage cristaux + agrégats le plus élevé est celui du digeste, marc, décocté et l’extrait d’éther de pétrole avec le même taux 94 %, suivi 80% pour le dichlorométhane.
III-3-2-3 Etude de l’effet de Pétroselinum Sativum III-3-2-3-1 Morphologie des cristaux
L'analyse des prélèvements au microscope optique à lumière polarisante a révélé que la morphologique des cristaux obtenus en présence de Pétroselinum Sativum selon différents mode de préparation n'a pas changé par rapport à sans inhibiteur (photographies 55, 56 et 57).
Struvite en absence d’inhibiteurs à pH =8
Cri:12,5 µm
Agr:61µm
Nucleus de PACC
Photographie: cristaux (12,5µm) et agrégats (61µm) de struvite en absence d’inhibiteurs (10x40x2,5)
Struvite en présence de l’extrait de Pétroselinum sativum(éther de pétrole)
Cri:5µm
Agr:7,5 µm
Photographie 57: diminution de la taille des cristaux de 60% et des agrégats de 88% de struvite en présence de l’extrait de Pétroselinum Sativum (éther de pétrole).
struvite en présence de l’extrait de Pétroselinum sativum
(dichlorométhane)
Cri:5µm
Photographie 55: diminution de la taille des cristaux de 60% et disparition des agrégats de struvite en présence de l’extrait de Pétroselinum Sativum (dichlorométhane)
Struvite en présence des extraits de Pétrosélinum sativum (éthanol et méthanol
Agr:7,5 µm Cri:5µm
Photographie 56: diminution de la taille des cristaux de 60% et des agrégats de 88%
de struvite en présence de l’extrait de Pétroselinum Sativum (éthanol et méthanol).
III-3-2-3-2 Taille moyenne des cristaux et des agrégats
Nous avons suivi les tailles moyennes des cristaux et des agrégats pour les six modes de préparation de Pétroselinum Sativum, en fonction du temps par microscope optique à lumière polarisante. Les résultats sont présentés en annexe 8.
Nous constatons d’aprés ces résultats que la diminution de la taille des cristaux et des agrégats de struvite est trés importante.
L’effet du décocté du Pétroselinum Sativum sur la struvite est remarquable. Ce dernier a provoqué l’inhibition totale de cette espèce cristalline.
Le digeste ainsi que l’extrait de dichlorométhane inhibent la formation des agrégats de la struvite.
Le tableau 36, regroupe le taux d’inhibition (%) de la taille des cristaux et des agrégats de la struvite en présence de Pétroselinum Sativum
Tableau 36: Taux d’inhibition (%) de la taille des cristaux et des agrégats de la struvite
Mode de préparation Taux
d’inhibition des cristaux (%)
Taux d’inhibition des
agrégats (%)
Taux d’inhibition des cristaux+ agrégats (%)
Macération 60 88 83
Décoction 100 100 100
Digestion 60 100 94
Extrait d’éther de pétrole 80 84 83
Extrait de dichlorométhane 60 100 94
Extrait d’éthanol 60 88 83
Extrait de méthanol 60 88 83
Nous constatons que la décoction de cette plante inhibe totalement la formation des cristaux de struvite.
Le même effet important a été enregistré sur la brushite. Le digeste ainsi que l’extrait de dichlorométhane agissent beaucoup plus sur les agrégats que sur les cristaux en inhibant totalement l’agrégation de ces cristaux. Leur taux d’inhibition enregistré pour les cristaux est de 60%.
Le taux d’inhibition des cristaux le plus élevé est de 80% correspondant à l’extrait d’éther de pétrole suivi de 60% pour le reste des préparations.
III-3-2-3-3 Analyse par infrarouge à transformer de fourrier (IRTF)
L’analyse spectrale du culot recueilli à la fin de l’expérience et l’identification avec les spectres de références montre l’inhibition totale de la struvite en présence du décocté de Pétroselium Sativum
Le spectre 9 montre des bandes caractéristiques de la carbapatite. Il comporte des fréquences caractéristiques de cette dernière.
Valence asymétrique des PO43- à 1037 forte, asymétrique à gauche, épaulée à 1100 cm-1.
Bandes symétriques faible de PO43- à 961 cm-1.
Valence carbonate 1459 et 1419 cm-1.
Spectre 9: spectre de carbapatite en présence de du décocté de Pétroselium Sativum.
III-3-2-4 Etude de l’effet du Thymus vulgaris III-3-2-4-1 Morphologie des cristaux
L’analyse morphologique des cristaux de struvite en présence de Thymus vulgaris préparé par décoction, digestion macération et extraite par solvants, a montré que la morphologie des cristaux n’a pas changé, comme dans le cas des cristaux en absence d’inhibiteur. Néanmoins la taille des cristaux formés est beaucoup moins importante par rapport à sans inhibiteur (photographies 58, 59, 60, 61,62, 63 et 64)
124 Struvite en présence de l’extrait de
Thymus vulgaris (éthanol)
Agr:8,74 µm Cri:2,5 µm
Photographie 61 : diminution de la taille des
Struvite en présence de l’extrait de Thymus vulgaris(méthanol)
Cri:2,5 µm Agr:10µm
Photographie 62 : diminution de la taille des Photographie59 : diminution de la taille des cristaux de
80 % et des agrégats de 84 % de struvite en présence du digeste de Thymus Vulgaris
Photographie: Cristaux (12,5µm) et Agrégats (61µm) de struvite en absence d’inhibiteurs (10x40x2,5)
Photographie 58 : diminution de la taille des cristaux de 80 % et disparition des agrégats de la struvite en présence du décocté de Thymus vlgaris.
Photographie 60 : diminution de la taille des cristaux de 80 % et disparition des agrégats de la struvite en présence de l’extrait de Thymus Vulgaris (éther de pétrole).
III-3-2-4-2 Taille moyenne des cristaux et des agrégats
En utilisant un micromètre adapté au microscope optique à lumière polarisée, les tailles moyennes des cristaux et des agrégats, en présence de Thymus vulgaris comme inhibiteur ont été mesurées. Les valeurs obtenues sont représentées en annexe 9.
Nous constatons d’après ces résultats que l’addition des extraits de cette plante à l’urine artificielle a provoqué une nette diminution des tailles des cristaux et des agrégats de la struvite. Pour certains extraits d’éther de pétrole et de dichlorométhane, ceci a provoqué la désagrégation de cette espèce cristalline.
Photographie63 : diminution de la taille des cristaux de 60 % et disparition des agrégats de struvite en présence de l’extrait de Thymus vulgaris (dichlorométhane).
Photographie 64 : diminution de la taille des cristaux de 80 % et des agrégats de 84 % de la struvite en présence du marc de Thymus vulgaris
Rappelons que les temps d’induction et d’agrégation observés en présence des différents extraits sont les mêmes qu’en absence d’inhibiteur. Ils sont estimés à 5 min et 8 min respectivement. Les mêmes temps ont été enregistrés chez toutes les plantes.
Le tableau 37 regroupe le taux d’inhibition (%) de la taille des cristaux et des agrégats de la struvite en présence du Thymus vulgaris.
Tableau 37 : taux d’inhibition (%) de la taille des cristaux et des agrégats de la struvite
Mode de préparation Taux
d’inhibition des cristaux (%)
Taux d’inhibition des
agrégats (%)
Taux d’inhibition des cristaux+ agrégats (%)
Macération 80 83 83
Décoction 80 100 97
Digestion 80 83 94
Extrait d’éther de pétrole 80 100 97
Extrait de dichlorométhane 60 100 94
Extrait d’éthanol 80 86 85
Extrait de méthanol 80 83 83
Nous remarquons que le décocté et les extraits d’éther de pétrole et de dichlorométhane de cette plante agissent sur les agrégats avec un pourcentage élevé de 100%.
Le même effet a été enregistré sur la brushite à pH = 6,5. Ce qui nous laisse supposer que ce sont les mêmes substances actives qui ont agit sur la struvite
Le taux d’inhibition des cristaux est de 80 %pour la majorité les préparations de cette plante.
Nous constatons aussi que le taux d’inhibition cristaux + agrégats le plus élevé est celui de 97
% correspondant à la décoction et les extraits d’éther de pétrole suivi de 94% pour l’extrait de dichlorométhane et le digeste, 85% pour l’extrait d’éthanol.
III-3-2-5 Etude de l’effet de l’Hordeum vulgare préparé par décoction, digestion macération et extrait par solvants.
III-3-2-5-1 Morphologie des cristaux
L’étude de la cinétique de cristallisation en présence de l’Hordeum vulgare a révélé une formation des granulations de la carbapatite et des cristaux de la struvite (photographies 65, 66, 67, 68 et 69).
La morphologie des cristaux et des agrégats obtenus par effet des différents extraits de la plante n’a pas changé, la forme générale des cristaux et des agrégats est restée orthorhombique et rectangulaire, comme pour le cas des cristaux en absence d’inhibiteur.
Struvite en présence du décocté d’Hordeum vulgare
Agr:20,75µm Cri:2,5µm.
Photographie 65 : diminution de la taille des cristaux de 80 % et des agrégats de 66 % de la struvite en présence du décocté de l’Hordeum vulgare.
Cri:6,25µm Agr:30,75µm Struvite en présence du marc d’Hordeum vulgare
Photographie 67 : diminution de la taille des cristaux de 50 %et des agrégats de 50% de la struvite en présence du marc l’Hordeum vulgare.
Struvite en présence de l’extrait d’Hordeum vulgare (éthanole)
Cri:5µm Agr:28,34µm
Photographie 66 :diminution de la taille des cristaux de 60 % et des agrégats de 54% de la struvite en présence de l’Hordeum vulgare (éthanol).
Photographie 68: diminution de la taille des cristaux 60 % et des agrégats 59% de brushite en présence du digeste d’Hordeum vulgare
Photographie69: diminution de la taille des cristaux 60 % et des agrégats 41% de struvite en présence de l’Hordeum vulgare (éther de pétrole)
Struvite en absence d’inhibiteurs à pH =8 Cri:12,5 µm
Agr:61µm
Nucleus de PACC
Photographie: Cristaux (12,5µm) et arégats (61µm) de struvite en absence d’inhibiteurs (10x40x2,5)
III-3-2-5-2 Taille moyenne des cristaux et des agrégats
La mesure des tailles des cristaux et des agrégats de struvite en présence de décocté, digeste, marc et les extraits par solvants de l’Hordeum vulgare a donné les valeurs regroupées en annexe 10.
D’après ces résultats nous remarquons que l’effet des extraits d’Hordeum vulgare sur la struvite est moyen par rapport aux autres plantes. L’effet de certains extraits sur l’agrégation n’était pas aussi important. L’extrait d’éther de pétrole a provoqué une diminution de la taille des agrégats de 41 %.
Le tableau 38, regroupe le taux d’inhibition (%) de la taille des cristaux et des agrégats de la struvite en présence de l’Hordeum vulgare.
Tableau 38 : Taux d’inhibition (%) de la taille des cristaux et des agrégats de la struvite.
Mode de préparation Taux d’inhibition des cristaux (%)
Taux d’inhibition des agrégats (%)
Taux d’inhibition des cristaux+ agrégats (%)
Macération 50 50 49
Décoction 80 66 69
Digestion 60 59 59
Extrait d’éther de pétrole 60 41 44
Extrait de dichlorométhane 60 50 52
Extrait d’éthanol 60 54 55
Extrait de méthanol 60 51 52
Nous remarquons que le taux d’inhibition des cristaux est toujours plus élevé ou égale aux taux d’inhibition des agrégats. De même pour les pourcentages d’inhibition des cristaux + agrégats.