La sursaturation du milieu urinaire est l’un des facteurs fondamentaux de la cristallisation des calculs, ou plus exactement celle des constituants des calculs.
Normalement, il existe dans les urines un équilibre entre promoteurs (calcium, phosphate, oxalate) et inhibiteurs de cristallisation (pyrophosphate, magnésium, citrate, nephrocalcine, glycoaminoglycane, Tamm-Horsfall glycoprotéine, osteopontin, etc…) [122-133].
La mise en évidence d’une éventuelle action inhibitrice de quelques substances chimiques sur la cristallisation des phosphates à pH = 6.5 et 8 peut avoir des retombées très positives sur la santé des lithiasique. Cela nous a incité à tester in vitro l’effet de ces substances chimiques sur la cristallisation des phosphates calcique et magnésique à partir de l’urine artificielle.
IV-1 Etude de la cristallisation des phosphates en présence des substances chimiques IV-1-1 Méthodologie
Les substances chimiques sont utilisées séparément. La même méthodologie en absence d’inhibiteur a été suivie. A t = 0 les solutions (A et B) et la substance chimique sont mélangées simultanément.
IV-1-2 Substances chimiques testées
Le tableau 39 donne les différentes substances chimiques testées et leurs concentrations.
Tableau 39. Concentrations des substances chimiques
Substances chimiques Concentration (mmol/l)
Acide citrique 0,1 - 6
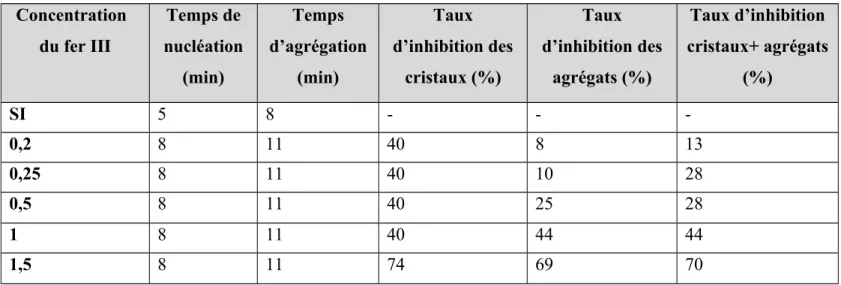
Fer III 0,125-1,5
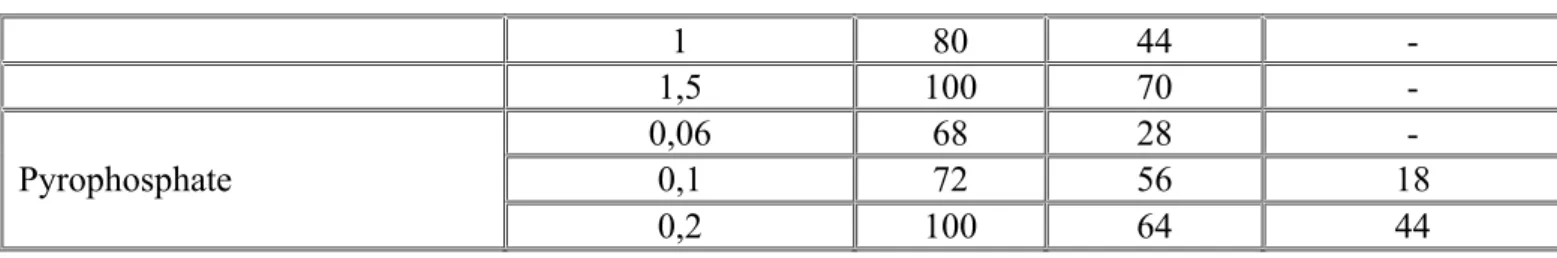
Pyrophosphate 0,06-0,2
IV-2 Résultats
IV-2-1 Cristallisation à pH = 6.5
La cristallisation seule favorise la formation de la brushite à pH=6,5. Les granulations sont apparues après cinq minutes. Les tailles maximum des cristaux étaient de 10 µm et celles des agrégats de 61µm.
IV-2-1-1 Etude de l’effet de l'acide citrique
Pour recouvrir la plage d'excrétion physiologique, une gamme de concentration en acide citrique a été testée [134] allant de 0,1 à 6 mmol/l.
La cristallisation des phosphates à pH= 6,5 en absence d'inhibiteur, induit à la formation de la brushite ( hydrogénophsphate de calcium dihydraté) et des granulations qui ont été identifiées par microscopie optique à lumière polarisée comme étant des phosphates amorphes de
calcium carbonaté (PACC).
IV-2-1-1-1 Morphologie des cristaux
L'analyse des prélèvements au microscope optique à lumière polarisante a révélé que la morphologie des cristaux obtenus en présence d’acide citrique n'a pas changé, la forme générale des cristaux reste sous forme de baguettes et de poinçons faiblement polarisants, plus ou moins agrégées, et sous forme aciculaires polarisants agrégés en gerbes, comme pour le cas des cristaux en absence d'inhibiteurs (photographies 70, 71 et 72).
brushite en présence de 0,1 mmol/l d’acide citrique
Cri:7,5 µm
Agr:37,5 µm
Photographie 70: diminution de la taille des cristaux de 25 % et des agrégats de 32% en présence d'acide citrique à 0,1mmol/l (10 x 40x 2,5).
Photographie: cristaux (10µm) et agrégats
(55µm) de la brushite à 41 min (10 x 40 x 2,5)
IV-2-1-1-2 Taille moyenne des cristaux et des agrégats
Les résultats du suivi de l'évolution de la taille moyenne des cristaux de brushite en fonction du temps, en présence de l’acide citrique sont présentés en annexe 11.
Nos résultats montrent qu'en présence de l’acide citrique, la taille des cristaux diminue en fonction de la concentration en acide citrique.
En absence d’inhibiteurs les cristaux sont apparus après 17 min de cristallisation. Toutes les concentrations de l’acide citrique retardent la nucléation de la brushite (temps d’induction >
17 minutes).
L’acide citrique à toutes les concentrations a un effet inhibiteur remarquable sur les agrégats de la brushite qui se traduit par la diminution de leur taille ainsi qu’un ralentissement dans le temps de leur apparition.
Le tableau 39, regroupe les temps d’induction et d’agrégation ainsi que le taux d’inhibition (%) de la taille des cristaux et des agrégats de la brushite en présence et en absence de l’acide citrique.
Granulations de PACC