ﺎﻨﺘﻤﻠﻋ ﺎﻣ ﻻﺇ ﺎﻨﻟ ﻢﻠﻋ ﻻ ﻚﻧﺎﺤﺒﺳ
ﻢﻴﻜﳊﺍ ﻢﻴﻠﻌﻟﺍ ﺖﻧﺃ ﻚﻧﺇ
ﺔﻳﻵﺍ :ﺓﺮﻘﺒﻟﺍ ﺓﺭﻮﺳ
31
FACULTE DE MEDECINE ET DE PHARMACIE - RABAT DOYENS HONORAIRES :
1962 – 1969 : Professeur Abdelmalek FARAJ 1969 – 1974 : Professeur Abdellatif BERBICH 1974 – 1981 : Professeur Bachir LAZRAK 1981 – 1989 : Professeur Taieb CHKILI
1989 – 1997 : Professeur Mohamed Tahar ALAOUI 1997 – 2003 : Professeur Abdelmajid BELMAHI 2003 – 2013 : Professeur Najia HAJJAJ - HASSOUNI ADMINISTRATION :
Doyen : Professeur Mohamed ADNAOUI
Vice Doyen chargé des Affaires Académiques et estudiantines Professeur Mohammed AHALLAT Vice Doyen chargé de la Recherche et de la Coopération
Professeur Taoufiq DAKKA
Vice Doyen chargé des Affaires Spécifiques à la Pharmacie Professeur Jamal TAOUFIK
Secrétaire Général : Mr. El Hassane AHALLAT
1- ENSEIGNANTS-CHERCHEURS MEDECINS ET
PHARMACIENS PROFESSEURS:
Mai etOctobre 1981
Pr. MAAZOUZI Ahmed Wajih Chirurgie Cardio-Vasculaire Pr. TAOBANE Hamid* Chirurgie Thoracique Mai et Novembre 1982
Pr. BENOSMAN Abdellatif Chirurgie Thoracique Novembre 1983
Pr. BENSAID Younes Pathologie Chirurgicale Pr. EL ALAOUI Faris Moulay El Mostafa Neurologie
Janvier, Février et Décembre 1987
Pr. AJANA Ali Radiologie
Pr. CHAHED OUAZZANI Houria Gastro-Entérologie Pr. EL YAACOUBI Moradh Traumatologie Orthopédie Pr. ESSAID EL FEYDI Abdellah Gastro-Entérologie
Pr. LACHKAR Hassan Médecine Interne
Pr. YAHYAOUI Mohamed Neurologie
Décembre 1988
Pr. BENHAMAMOUCH Mohamed Najib Chirurgie Pédiatrique
Pr. DAFIRI Rachida Radiologie
Pr. HERMAS Mohamed Traumatologie Orthopédie Décembre 1989
Pr. ADNAOUI Mohamed Médecine Interne –Doyen de la FMPR Pr. BOUKILI MAKHOUKHI Abdelali* Cardiologie
Pr. CHAD Bouziane Pathologie Chirurgicale Pr. OUAZZANI Taïbi Mohamed Réda Neurologie
Janvier et Novembre 1990
Pr. CHKOFF Rachid Pathologie Chirurgicale Pr. HACHIM Mohammed* Médecine-Interne
Pr. KHARBACH Aîcha Gynécologie -Obstétrique Pr. MANSOURI Fatima Anatomie-Pathologique Pr. TAZI Saoud Anas Anesthésie Réanimation Février Avril Juillet et Décembre 1991
Pr. AL HAMANY Zaîtounia Anatomie-Pathologique
Pr. AZZOUZI Abderrahim Anesthésie Réanimation –Doyen de la FMPO
Pr. BAYAHIA Rabéa Néphrologie
Pr. BELKOUCHI Abdelkader Chirurgie Générale Pr. BENCHEKROUN Belabbes Abdellatif Chirurgie Générale Pr. BENSOUDA Yahia Pharmacie galénique
Pr. BERRAHO Amina Ophtalmologie
Pr. BEZZAD Rachid Gynécologie Obstétrique Pr. CHABRAOUI Layachi Biochimie et Chimie
Pr. CHERRAH Yahia Pharmacologie
Pr. CHOKAIRI Omar Histologie Embryologie
Pr. KHATTAB Mohamed Pédiatrie
Pr. SOULAYMANI Rachida Pharmacologie – Dir. du Centre National PV
Pr. CHAHED OUAZZANI Laaziza Gastro-Entérologie Pr. CHRAIBI Chafiq Gynécologie Obstétrique
Pr. DAOUDI Rajae Ophtalmologie
Pr. DEHAYNI Mohamed* Gynécologie Obstétrique Pr. EL OUAHABI Abdessamad Neurochirurgie
Pr. FELLAT Rokaya Cardiologie
Pr. GHAFIR Driss* Médecine Interne
Pr. JIDDANE Mohamed Anatomie
Pr. TAGHY Ahmed Chirurgie Générale
Pr. ZOUHDI Mimoun Microbiologie
Mars 1994
Pr. BENJAAFAR Noureddine Radiothérapie
Pr. BEN RAIS Nozha Biophysique
Pr. CAOUI Malika Biophysique
Pr. CHRAIBI Abdelmjid Endocrinologie et Maladies Métaboliques Pr. EL AMRANI Sabah Gynécologie Obstétrique
Pr. EL AOUAD Rajae Immunologie
Pr. EL BARDOUNI Ahmed Traumato-Orthopédie Pr. EL HASSANI My Rachid Radiologie
Pr. ERROUGANI Abdelkader Chirurgie Générale- Directeur CHIS
Pr. ESSAKALI Malika Immunologie
Pr. ETTAYEBI Fouad Chirurgie Pédiatrique
Pr. HADRI Larbi* Médecine Interne
Pr. HASSAM Badredine Dermatologie
Pr. IFRINE Lahssan Chirurgie Générale
Pr. JELTHI Ahmed Anatomie Pathologique
Pr. MAHFOUD Mustapha Traumatologie – Orthopédie
Pr. MOUDENE Ahmed* Traumatologie- Orthopédie Inspecteur du SS
Pr. RHRAB Brahim Gynécologie –Obstétrique
Pr. SENOUCI Karima Dermatologie
Mars 1994
Pr. ABBAR Mohamed* Urologie
Pr. ABDELHAK M’barek Chirurgie – Pédiatrique
Pr. BELAIDI Halima Neurologie
Pr. JALIL Abdelouahed Chirurgie Générale Pr. LAKHDAR Amina Gynécologie Obstétrique
Pr. MOUANE Nezha Pédiatrie
Mars 1995
Pr. ABOUQUAL Redouane Réanimation Médicale Pr. AMRAOUI Mohamed Chirurgie Générale Pr. BAIDADA Abdelaziz Gynécologie Obstétrique Pr. BARGACH Samir Gynécologie Obstétrique
Pr. CHAARI Jilali* Médecine Interne
Pr. DIMOU M’barek* Anesthésie Réanimation Pr. DRISSI KAMILI Med Nordine* Anesthésie Réanimation Pr. EL MESNAOUI Abbes Chirurgie Générale Pr. ESSAKALI HOUSSYNI Leila Oto-Rhino-Laryngologie Pr. HDA Abdelhamid* Cardiologie - Directeur ERSM Pr. IBEN ATTYA ANDALOUSSI Ahmed Urologie
Pr. OUAZZANI CHAHDI Bahia Ophtalmologie Pr. SEFIANI Abdelaziz Génétique
Pr. ZEGGWAGH Amine Ali Réanimation Médicale Décembre 1996
Pr. AMIL Touriya* Radiologie
Pr. BELKACEM Rachid Chirurgie Pédiatrie Pr. BOULANOUAR Abdelkrim Ophtalmologie Pr. EL ALAMI EL FARICHA EL Hassan Chirurgie Générale
Pr. GAOUZI Ahmed Pédiatrie
Pr. MAHFOUDI M’barek* Radiologie
Pr. MOHAMMADI Mohamed Médecine Interne
Pr. OUADGHIRI Mohamed Traumatologie-Orthopédie
Pr. OUZEDDOUN Naima Néphrologie
Pr. ZBIR EL Mehdi* Cardiologie
Novembre 1997
Pr. ALAMI Mohamed Hassan Gynécologie-Obstétrique
Pr. BEN SLIMANE Lounis Urologie
Pr. BIROUK Nazha Neurologie
Pr. CHAOUIR Souad* Radiologie
Pr. ERREIMI Naima Pédiatrie
Pr. FELLAT Nadia Cardiologie
Pr. HAIMEUR Charki* Anesthésie Réanimation Pr. KADDOURI Noureddine Chirurgie Pédiatrique Pr. KOUTANI Abdellatif Urologie
Novembre 1998
Pr. AFIFI RAJAA Gastro-Entérologie
Pr. BENOMAR ALI Neurologie – Doyen Abulcassis Pr. BOUGTAB Abdesslam Chirurgie Générale
Pr. ER RIHANI Hassan Oncologie Médicale
Pr. EZZAITOUNI Fatima Néphrologie
Pr. LAZRAK Khalid * Traumatologie Orthopédie
Pr. BENKIRANE Majid* Hématologie
Pr. KHATOURI ALI* Cardiologie
Pr. LABRAIMI Ahmed* Anatomie Pathologique Janvier 2000
Pr. ABID Ahmed* Pneumophtisiologie
Pr. AIT OUMAR Hassan Pédiatrie
Pr. BENJELLOUN DakhamaBadr.Sououd Pédiatrie
Pr. BOURKADI Jamal-Eddine Pneumo-phtisiologie Pr. CHARIF CHEFCHAOUNI Al Montacer Chirurgie Générale Pr. ECHARRAB El Mahjoub Chirurgie Générale Pr. EL FTOUH Mustapha Pneumo-phtisiologie Pr. EL MOSTARCHID Brahim* Neurochirurgie
Pr. ISMAILI Hassane* Traumatologie Orthopédie Pr. MAHMOUDI Abdelkrim* Anesthésie-Réanimation Pr. TACHINANTE Rajae Anesthésie-Réanimation Pr. TAZI MEZALEK Zoubida Médecine Interne Novembre 2000
Pr. AIDI Saadia Neurologie
Pr. AIT OURHROUI Mohamed Dermatologie Pr. AJANA Fatima Zohra Gastro-Entérologie
Pr. BENAMR Said Chirurgie Générale
Pr. CHERTI Mohammed Cardiologie
Pr. ECH-CHERIF EL KETTANI Selma Anesthésie-Réanimation
Pr. EL HASSANI Amine Pédiatrie
Pr. EL KHADER Khalid Urologie
Pr. EL MAGHRAOUI Abdellah* Rhumatologie
Pr. GHARBI Mohamed El Hassan Endocrinologie et Maladies Métaboliques Pr. HSSAIDA Rachid* Anesthésie-Réanimation
Pr. ABABOU Adil Anesthésie-Réanimation Pr. BALKHI Hicham* Anesthésie-Réanimation Pr. BENABDELJLIL Maria Neurologie
Pr. BENAMAR Loubna Néphrologie
Pr. BENAMOR Jouda Pneumo-phtisiologie
Pr. BENELBARHDADI Imane Gastro-Entérologie
Pr. BENNANI Rajae Cardiologie
Pr. BENOUACHANE Thami Pédiatrie
Pr. BEZZA Ahmed* Rhumatologie
Pr. BOUCHIKHI IDRISSI Med Larbi Anatomie Pr. BOUMDIN El Hassane* Radiologie
Pr. CHAT Latifa Radiologie
Pr. DAALI Mustapha* Chirurgie Générale Pr. DRISSI Sidi Mourad* Radiologie
Pr. EL HIJRI Ahmed Anesthésie-Réanimation Pr. EL MAAQILI Moulay Rachid Neuro-Chirurgie
Pr. EL MADHI Tarik Chirurgie-Pédiatrique Pr. EL OUNANI Mohamed Chirurgie Générale
Pr. ETTAIR Said Pédiatrie
Pr. GAZZAZ Miloudi* Neuro-Chirurgie Pr. HRORA Abdelmalek Chirurgie Générale
Pr. KABBAJ Saad Chirurgie Thoracique
Pr. LAMRANI Moulay Omar Traumatologie Orthopédie
Pr. LEKEHAL Brahim Chirurgie Vasculaire Périphérique Pr. MAHASSIN Fattouma* Médecine Interne
Pr. MEDARHRI Jalil Chirurgie Générale
Pr. MIKDAME Mohammed* Hématologie Clinique
Pr. MOHSINE Raouf Chirurgie Générale
Pr. NOUINI Yassine Urologie
Pr. SABBAH Farid Chirurgie Générale
Pr. SEFIANI Yasser Chirurgie Vasculaire Périphérique Pr. TAOUFIQ BENCHEKROUN Soumia Pédiatrie
Décembre 2002
Pr. AL BOUZIDI Abderrahmane* Anatomie Pathologique
Pr. AMEUR Ahmed * Urologie
Pr. AMRI Rachida Cardiologie
Pr. AOURARH Aziz* Gastro-Entérologie
Pr. BAMOU Youssef * Biochimie-Chimie
Pr. CHOHO Abdelkrim * Chirurgie Générale Pr. CHKIRATE Bouchra Pédiatrie
Pr. EL ALAMI EL FELLOUS Sidi Zouhair Chirurgie Pédiatrique Pr. EL HAOURI Mohamed * Dermatologie
Pr. EL MANSARI Omar* Chirurgie Générale Pr. FILALI ADIB Abdelhai Gynécologie Obstétrique
Pr. HAJJI Zakia Ophtalmologie
Pr. IKEN Ali Urologie
Pr. JAAFAR Abdeloihab* Traumatologie Orthopédie
Pr. KRIOUILE Yamina Pédiatrie
Pr. LAGHMARI Mina Ophtalmologie
Pr. MABROUK Hfid* Traumatologie Orthopédie Pr. MOUSSAOUI RAHALI Driss* Gynécologie Obstétrique Pr. MOUSTAGHFIR Abdelhamid* Cardiologie
Pr. NAITLHO Abdelhamid* Médecine Interne
Pr. OUJILAL Abdelilah Oto-Rhino-Laryngologie Pr. RACHID Khalid * Traumatologie Orthopédie
Pr. RAISS Mohamed Chirurgie Générale
Pr. RGUIBI IDRISSI Sidi Mustapha* Pneumophtisiologie
Pr. RHOU Hakima Néphrologie
Pr. SIAH Samir * Anesthésie Réanimation
Pr. THIMOU Amal Pédiatrie
Pr. ZENTAR Aziz* Chirurgie Générale
Janvier 2004
Pr. ABDELLAH El Hassan Ophtalmologie
Pr. AMRANI Mariam Anatomie Pathologique Pr. BENBOUZID Mohammed Anas Oto-Rhino-Laryngologie Pr. BENKIRANE Ahmed* Gastro-Entérologie Pr. BOUGHALEM Mohamed* Anesthésie Réanimation
Pr. BOULAADAS Malik Stomatologie et Chirurgie Maxillo-faciale
Pr. BOURAZZA Ahmed* Neurologie
Pr. CHAGAR Belkacem* Traumatologie Orthopédie Pr. CHERRADI Nadia Anatomie Pathologique
Pr. EL FENNI Jamal* Radiologie
Pr. EL HANCHI ZAKI Gynécologie Obstétrique Pr. EL KHORASSANI Mohamed Pédiatrie
Pr. TARIB Abdelilah* Pharmacie Clinique
Pr. TIJAMI Fouad Chirurgie Générale
Pr. ZARZUR Jamila Cardiologie
Janvier 2005
Pr. ABBASSI Abdellah Chirurgie Réparatrice et Plastique Pr. AL KANDRY Sif Eddine* Chirurgie Générale
Pr. ALAOUI Ahmed Essaid Microbiologie
Pr. ALLALI Fadoua Rhumatologie
Pr. AMAZOUZI Abdellah Ophtalmologie
Pr. AZIZ Noureddine* Radiologie
Pr. BAHIRI Rachid Rhumatologie
Pr. BARKAT Amina Pédiatrie
Pr. BENHALIMA Hanane Stomatologie et Chirurgie Maxillo Faciale
Pr. BENYASS Aatif Cardiologie
Pr. BERNOUSSI Abdelghani Ophtalmologie Pr. CHARIF CHEFCHAOUNI Mohamed Ophtalmologie Pr. DOUDOUH Abderrahim* Biophysique Pr. EL HAMZAOUI Sakina* Microbiologie
Pr. HAJJI Leila Cardiologie (mise en disponibilité)
Pr. HESSISSEN Leila Pédiatrie
Pr. JIDAL Mohamed* Radiologie
Pr. LAAROUSSI Mohamed Chirurgie Cardio-vasculaire Pr. LYAGOUBI Mohammed Parasitologie
Pr. NIAMANE Radouane* Rhumatologie
Pr. RAGALA Abdelhak Gynécologie Obstétrique
Pr. SBIHI Souad Histo-Embryologie Cytogénétique Pr. ZERAIDI Najia Gynécologie Obstétrique
Décembre 2005
Pr. CHANI Mohamed Anesthésie Réanimation Avril 2006
Pr. ACHEMLAL Lahsen* Rhumatologie
Pr. AKJOUJ Said* Radiologie
Pr. BELMEKKI Abdelkader* Hématologie
Pr. BENCHEIKH Razika O.R.L
Pr. BIYI Abdelhamid* Biophysique
Pr. BOUHAFS Mohamed El Amine Chirurgie - Pédiatrique Pr. BOULAHYA Abdellatif* Chirurgie Cardio – Vasculaire Pr. CHENGUETI ANSARI Anas Gynécologie Obstétrique
Pr. HARMOUCHE Hicham Médecine Interne Pr. HANAFI Sidi Mohamed* Anesthésie Réanimation Pr. IDRISS LAHLOU Amine* Microbiologie
Pr. JROUNDI Laila Radiologie
Pr. KARMOUNI Tariq Urologie
Pr. KILI Amina Pédiatrie
Pr. KISRA Hassan Psychiatrie
Pr. KISRA Mounir Chirurgie – Pédiatrique Pr. LAATIRIS Abdelkader* Pharmacie Galénique Pr. LMIMOUNI Badreddine* Parasitologie
Pr. MANSOURI Hamid* Radiothérapie
Pr. OUANASS Abderrazzak Psychiatrie
Pr. SAFI Soumaya* Endocrinologie
Pr. SEKKAT Fatima Zahra Psychiatrie
Pr. SOUALHI Mouna Pneumo – Phtisiologie
Pr. TELLAL Saida* Biochimie
Pr. ZAHRAOUI Rachida Pneumo – Phtisiologie Octobre 2007
Pr. ABIDI Khalid Réanimation médicale
Pr. ACHACHI Leila Pneumo phtisiologie
Pr. ACHOUR Abdessamad* Chirurgie générale
Pr. AIT HOUSSA Mahdi* Chirurgie cardio vasculaire Pr. AMHAJJI Larbi* Traumatologie orthopédie
Pr. AMMAR Haddou* ORL
Pr. AOUFI Sarra Parasitologie
Pr. BAITE Abdelouahed* Anesthésie réanimation Pr. BALOUCH Lhousaine* Biochimie-chimie Pr. BENZIANE Hamid* Pharmacie clinique Pr. BOUTIMZINE Nourdine Ophtalmologie Pr. CHARKAOUI Naoual* Pharmacie galénique Pr. EHIRCHIOU Abdelkader* Chirurgie générale Pr. ELABSI Mohamed Chirurgie générale Pr. EL MOUSSAOUI Rachid Anesthésie réanimation
Pr. EL OMARI Fatima Psychiatrie
Pr. GANA Rachid Neuro chirurgie
Pr. MARC Karima Pneumo phtisiologie
Pr. MASRAR Azlarab Hématologique
Pr. MOUTAJ Redouane * Parasitologie
Pr. MRABET Mustapha* Médecine préventive santé publique et hygiène
Pr. MRANI Saad* Virologie
Pr. OUZZIF Ezzohra* Biochimie-chimie
Pr. RABHI Monsef* Médecine interne
Pr. RADOUANE Bouchaib* Radiologie
Pr. SEFFAR Myriame Microbiologie
Pr. SEKHSOKH Yessine* Microbiologie
Pr. SIFAT Hassan* Radiothérapie
Pr. TABERKANET Mustafa* Chirurgie vasculaire périphérique
Pr. TACHFOUTI Samira Ophtalmologie
Pr. TAJDINE Mohammed Tariq* Chirurgie générale
Pr. TANANE Mansour* Traumatologie orthopédie
Pr. TLIGUI Houssain Parasitologie
Pr. TOUATI Zakia Cardiologie
Décembre 2007
Pr. DOUHAL ABDERRAHMAN Ophtalmologie Décembre 2008
Pr ZOUBIR Mohamed* Anesthésie Réanimation Pr TAHIRI My El Hassan* Chirurgie Générale Mars 2009
Pr. ABOUZAHIR Ali* Médecine interne
Pr. AGDR Aomar* Pédiatre
Pr. AIT ALI Abdelmounaim* Chirurgie Générale Pr. AIT BENHADDOU El hachmia Neurologie
Pr. AKHADDAR Ali* Neuro-chirurgie
Pr. ALLALI Nazik Radiologie
Pr. AMAHZOUNE Brahim* Chirurgie Cardio-vasculaire
Pr. AMINE Bouchra Rhumatologie
Pr. ARKHA Yassir Neuro-chirurgie
Pr. AZENDOUR Hicham* Anesthésie Réanimation Pr. BELYAMANI Lahcen* Anesthésie Réanimation
Pr. BJIJOU Younes Anatomie
Pr. BOUHSAIN Sanae* Biochimie-chimie
Pr. BOUI Mohammed* Dermatologie
Pr. BOUNAIM Ahmed* Chirurgie Générale
Pr. EL OUENNASS Mostapha* Microbiologie
Pr. ENNIBI Khalid* Médecine interne
Pr. FATHI Khalid Gynécologie obstétrique Pr. HASSIKOU Hasna * Rhumatologie
Pr. KABBAJ Nawal Gastro-entérologie
Pr. KABIRI Meryem Pédiatrie
Pr. KARBOUBI Lamya Pédiatrie
Pr. L’KASSIMIHachemi* Microbiologie
Pr. LAMSAOURI Jamal* Chimie Thérapeutique Pr. MARMADE Lahcen Chirurgie Cardio-vasculaire
Pr. MESKINI Toufik Pédiatrie
Pr. MESSAOUDI Nezha * Hématologie biologique
Pr. MSSROURI Rahal Chirurgie Générale
Pr. NASSAR Ittimade Radiologie
Pr. OUKERRAJ Latifa Cardiologie
Pr. RHORFI Ismail Abderrahmani * Pneumo-phtisiologie
Pr. ZOUHAIR Said* Microbiologie
PROFESSEURS AGREGES : Octobre 2010
Pr. ALILOU Mustapha Anesthésie réanimation Pr. AMEZYANE Taoufik* Médecine interne Pr. BELAGUID Abdelaziz Physiologie
Pr. BOUAITY Brahim* ORL
Pr. CHADLI Mariama* Microbiologie
Pr. CHEMSI Mohamed* Médecine aéronautique
Pr. DAMI Abdellah* Biochimie chimie
Pr. DARBI Abdellatif* Radiologie
Pr. DENDANE Mohammed Anouar Chirurgie pédiatrique
Pr. EL HAFIDI Naima Pédiatrie
Pr. EL KHARRAS Abdennasser* Radiologie
Pr. EL MAZOUZ Samir Chirurgie plastique et réparatrice
Pr. EL SAYEGH Hachem Urologie
Pr. ERRABIH Ikram Gastro entérologie
Pr. LAMALMI Najat Anatomie pathologique
Pr. BELAIZI Mohamed* Psychiatrie
Pr. BENCHEBBA Driss* Traumatologie Orthopédique
Pr. DRISSI Mohamed* Anesthésie Réanimation
Pr. EL ALAOUI MHAMDI Mouna Chirurgie Générale Pr. EL KHATTABI Abdessadek* Médecine Interne
Pr. EL OUAZZANI Hanane* Pneumophtisiologie
Pr. ER-RAJI Mounir Chirurgie Pédiatrique
Pr. JAHID Ahmed Anatomie pathologique
Pr. MEHSSANI Jamal* Psychiatrie
Pr. RAISSOUNI Maha* Cardiologie
Février 2013
Pr. AHID Samir Pharmacologie – Chimie
Pr. AIT EL CADI Mina Toxicologie
Pr. AMRANI HANCHI Laila Gastro-Entérologie
Pr. AMOUR Mourad Anesthésie Réanimation
Pr. AWAB Almahdi Anesthésie Réanimation
Pr. BELAYACHI Jihane Réanimation Médicale
Pr. BELKHADIR Zakaria Houssain Anesthésie Réanimation
Pr. BENCHEKROUN Laila Biochimie-Chimie
Pr. BENKIRANE Souad Hématologie
Pr. BENNANA Ahmed* Informatique Pharmaceutique
Pr. BENSEFFAJ Nadia Immunologie
Pr. BENSGHIR Mustapha* Anesthésie Réanimation
Pr. BENYAHIA Mohammed* Néphrologie
Pr. BOUATIA Mustapha Chimie Analytique
Pr. BOUABID Ahmed Salim* Traumatologie Orthopédie
Pr. BOUTARBOUCH Mahjouba Anatomie
Pr. CHAIB Ali* Cardiologie
Pr. DENDANE Tarek Réanimation Médicale
Pr. DINI Nouzha* Pédiatrie
Pr. ECH-CHERIF EL KETTANI Mohamed Ali Anesthésie Réanimation Pr. ECH-CHERIF EL KETTANI Najwa Radiologie
Pr. ELFATEMI Nizare Neuro-Chirurgie
Pr. EL GUERROUJ Hasnae Médecine Nucléaire
Pr. EL HARTI Jaouad Chimie Thérapeutique
Pr. EL JOUDI Rachid* Toxicologie
Pr. EL KABABRI Maria Pédiatrie
Pr. FIKRI Meryim Radiologie
Pr. GHANIMI Zineb Pédiatrie
Pr. GHFIR Imade Médecine Nucléaire
Pr. IMANE Zineb Pédiatrie
Pr. IRAQI Hind Endocrinologie et maladies métaboliques
Pr. KABBAJ Hakima Microbiologie
Pr. KADIRI Mohamed* Psychiatrie
Pr. LATIB Rachida Radiologie
Pr. MAAMAR Mouna Fatima Zahra Médecine Interne
Pr. MEDDAH Bouchra Pharmacologie
Pr. MELHAOUI Adyl Neuro-chirurgie
Pr. MRABTI Hind Oncologie Médicale
Pr. NEJJARI Rachid Pharmacognosie
Pr. OUBEJJA Houda Chirurgie Pédiatrique Pr. OUKABLI Mohamed* Anatomie Pathologique
Pr. RAHALI Younes Pharmacie Galénique
Pr. RATBI Ilham Génétique
Pr. RAHMANI Mounia Neurologie
Pr. REDA Karim* Ophtalmologie
Pr. REGRAGUI Wafa Neurologie
Pr. RKAIN Hanan Physiologie
Pr. ROSTOM Samira Rhumatologie
Pr. ROUAS Lamiaa Anatomie Pathologique
Pr. ROUIBAA Fedoua* Gastro-Entérologie Pr. SALIHOUN Mouna Gastro-Entérologie
Pr. SAYAH Rochde Chirurgie Cardio-Vasculaire Pr. SEDDIK Hassan* Gastro-Entérologie
Pr. ZERHOUNI Hicham Chirurgie Pédiatrique
Pr. ZINE Ali* Traumatologie Orthopédie
Avril 2013
Pr. EL KHATIB Mohamed Karim* Stomatologie et Chirurgie Maxillo-faciale
Pr. GHOUNDALE Omar* Urologie
Pr. ZYANI Mohammad* Médecine Interne
Pr. ALAMI OUHABI Naima Biochimie – chimie
Pr. ALAOUI KATIM Pharmacologie
Pr. ALAOUI SLIMANI Lalla Naïma Histologie-Embryologie
Pr. ANSAR M’hammed Chimie Organique et Pharmacie Chimique
Pr. BOUHOUCHE Ahmed Génétique Humaine
Pr. BOUKLOUZE Abdelaziz Applications Pharmaceutiques Pr. BOURJOUANE Mohamed Microbiologie
Pr. BARKYOU Malika Histologie-Embryologie Pr. CHAHED OUAZZANI LallaChadia Biochimie – chimie
Pr. DAKKA Taoufiq Physiologie
Pr. DRAOUI Mustapha Chimie Analytique Pr. EL GUESSABI Lahcen Pharmacognosie Pr. ETTAIB Abdelkader Zootechnie Pr. FAOUZI Moulay El Abbes Pharmacologie
Pr. HAMZAOUI Laila Biophysique
Pr. HMAMOUCHI Mohamed Chimie Organique Pr. IBRAHIMI Azeddine Biologie moléculaire Pr. KHANFRI Jamal Eddine Biologie
Pr. OULAD BOUYAHYA IDRISSI Med Chimie Organique
Pr. REDHA Ahlam Chimie
Pr. TOUATI Driss Pharmacognosie
Pr. ZAHIDI Ahmed Pharmacologie
Pr. ZELLOU Amina Chimie Organique
Mise à jour le 09/01/2015 par le Service des Ressources Humaines
A Allah
Tout puissant
Qui m’a inspiré
Qui m’a guidé dans le bon chemin
Je vous dois ce que je suis devenu
Louanges et remerciements
Pour votre clémence et miséricorde
À mes très chers parents
AISSA Yamna et ESSABAAOUI Driss
Tous les mots du monde ne sauraient exprimer l’immense
amour que je vous porte, ni la profonde gratitude que je vous témoigne
pour tous les efforts et les sacrifices que vous n’avez jamais cessé de
consentir pour mon instruction et mon bien-être.
Vous avez été pour moi au long de mes études le plus grand symbole
d''amour, de dévouement qui ont ni cessé ni diminué.
Vos prières m'ont été d''un grand soutien au cours de ce long parcours.
J’espère avoir répondu aux espoirs que vous avez fondés en moi.
Je vous rends hommage par ce modeste travail en guise de ma
reconnaissance éternelle et de mon infini amour.
Puisse dieu être le témoin de ma profonde reconnaissance et vous
accorder la santé, le bonheur et une longue vie.
A beau-frère Hassan LHEDMAT
Mon conseiller, et ami fidèle, qui m’a assisté
dans les moments difficiles et m’a pris doucement par la main pour
traverser ensemble des épreuves pénibles….
Je te suis très reconnaissante, et je ne te remercierai
jamais assez pour ton amabilité, ta générosité,
A ma chère sœur Laila ESSABAAOUI,
son mari Hassan LHEDMAT et leur enfants Ilyas et Hiba
Et
A mon frère Rachid ESSABAAOUI, son épouse Khadija
et leurs enfants Mehdi et Badre-eddine
Vous étiez toujours présent aux moments
les plus difficiles et cela force mon respect.
Votre présence, Vos conseils et votre confiance
en moi m’ont été d’une grande aide.
En témoignage de l’attachement, de l’amour
et de l’affection que je porte pour vous.
En reconnaissance de votre soutien incontestable et de votre
encouragement, je vous dédie ce travail avec tous mes vœux de bonheur,
de santé et de réussite.
A ma chère sœur Samira ESSABAAOUI
et son fils Mourad
Et
A mon frère Rida ESSABAAOUI
J’espère avoir été à la hauteur de votre estime
et que ce travail soit un témoignage de mes sentiments
les plus chers que j’ai pour vous.
Vous avez toujours été pour moi un exemple
de sérieux de sagesse et d’intégrité.
Votre présence a toujours été un réel réconfort
et a suscité beaucoup d’espoir pour moi.
Merci pour votre soutien et votre confiance en moi.
Que Dieu vous bénisse et vous accorde la santé,
La prospérité et une vie heureuse.
A mes chères amies
Je ne peux trouver les mots justes et sincères
pour vous exprimer mon affection et mes pensées, vous êtes pour
moi des frères, sœurs et des amis sur qui je peux compter.
En témoignage de l’amitié qui nous uni et des souvenirs de tous les
moments que nous avons passé ensemble, je vous dédie ce travail et je
vous souhaite une vie pleine de santé et de bonheur.
ET
À TOUTES LES PERSONNES
QUI ONT PARTICIPÉ A
NOTRE MAITRE PRÉSIDENT DE THESE
Monsieur le Professeur M.ZOUHDI
Professeur de Microbiologie
Vous nous avez accordé un immense honneur
et un grand privilège en acceptant la présidence de notre jury de thèse.
Nous vous remercions aussi pour la gentillesse et la spontanéité avec
lesquelles vous avez bien voulu diriger ce travail.
Nous vous prions, cher Maître, d'accepter dans ce travail le témoignage
de notre haute considération, de notre profonde reconnaissance et de
A
NOTRE MAITRE ET RAPPORTEUR DE THESE
Le Professeur S.TELLAL
Professeur de Biochimie
Je vous remercie énormément de m’avoir si bien aidé
à mener à bien ce travail, vous n’avez jamais lésiné ni sur votre
temps ni sur votre savoir tout le long de ce travail.
Qu’il me soit permis, madame, de vous exprimer ma profonde
gratitude et mes sincères remerciements.
Merci pour votre sympathie, votre gentillesse et votre totale
disponibilité
A
NOTRE MAITRE ET JUGE DE THESE
Le Professeur S.EL HAMZAOUI
Professeur de Microbiologie
Je vous remercie, madame, de m’avoir fait l’honneur
d’accepter de faire partie de mon jury de thèse.
Qu’il me soit permis, madame, de vous exprimer toute ma
reconnaissance, mon respect et mon estime.
Veuillez croire, madame, à l’expression de mes sentiments
les plus distingués
NOTRE MAITRE ET JUGE DE THESE
Le Professeur A. LAATIRIS
Professeur de Pharmacie Galénique
Je vous remercie, monsieur, de m’avoir fait l’honneur
d’accepter de faire partie de mon jury de thèse.
Qu’il me soit permis, monsieur, de vous exprimer toute ma
reconnaissance, mon respect et mon estime.
Veuillez croire, monsieur, à l’expression
de mes sentiments les plus distingués.
LISTE DES ABREVIATIONS
ACC: American college of cardiology AHA: American heart association ALF: Alfiméprase
ANP: Peptide auriculaire natriurétique ASIC: Acid sensing ion channels ATx : arachnotoxine
AVC : Accident vasculaire cérébral BIC: bicuculline
BNP : Peptide natriurétique cérébral ou de type B BPP : Peptides potentialisant l’effet de la bradykinine BV: bee venom
BVT: Bee Venom Acupuncture
CNP : Peptide natriurétique de type C
CNRS : Centre de recherche national de la recherche scientifique DBP disulfide-bridged peptides
DNP: Dendroaspis natriuretic peptide DT2: Diabète de type 2
ECA : Enzyme de conversion de l’angiotensine EMA : Agence Européenne du médicament FDA: Food and Drug administration
IEC : Inhibiteur de l’enzyme de coversion KA: kainic acid
KGD: Lysine‐Glycine‐ Aspartate
LAAO: L‐amino acide oxydase
LEMS : Le syndrome myasthénique de Lambert-Eaton L-Glu : L-glutamate
NaV : Canaux sodiques Voltage-dépendants NDA: New Drug Application
NDBP: non-disulfide-bridged peptides BP NEP: Endopeptidase neutre
NGF: Nerve Growth Factor NMDA : N-Méthyl-D-Aspartate NPR: Natriuretic peptide receptor
OAP : Occlusions artérielles périphériques Picro : picrotoxine
PLA2 : Phospholipases A2 PTZ: pentylénetétrazole
RGD: Arginine‐Glycine‐Aspartate
SEP : sclérose en plaque
SNC : système nerveux central TLE: Enzymes thrombiniques
TPA: 12-O-tetradecanoyl phorbol-13-acetate VSCC : Voltage-Sensitive Calcium Channels
LISTE DES FIGURES
Figure 1: Photo de la vipère brésilienne Bothrops jararaca (5) ... 15 Figure 2 : Structure du BPP 5a et du BPP 9a (7) ... 17 Figure 3 : Développement du captopril (10) ... 20 Figure 4: Photo du Mamba vert Dendroaspis angusticeps (12) ... 21 Figure 5: Structure des peptides natriurétiques humains(14) ... 23 Figure 6: Structure du CNP, DNP et CD-NP (17)... 26 Figure 7:Photo de Sistrurus miliarius barbouri (23) ... 30 Figure 8: Structure moléculaire de l'échistatine (26) ... 32 Figure 9: Photo de la vipère Echis carinatus (27) ... 32 Figure 10: Comparaison des sites catalytiques de la thrombine et desTLE (A,B et AB) au niveau du fibrinogène (31) ... 36 Figure 11: Photo de Agkistrodon rhodostoma (36) ... 39 Figure 12: Photo de la vipère mocassin à tête cuivrée Agkistrodon contortrix
contortrix (37) ... 40
Figure 13: Structure tridimensionnelle de la fibrolase (39) ... 41 Figure 14: Photos de Trimeresurus flavoviridis(43)... 45 Figure 15: Structure tridimensionnelle de la mambalgine 2 (52) ... 49 Figure 16: Photo de Mamba noir Dendroaspis polylepsis polylepsis (53) ... 49 Figure 17:photo de monstre de gila (Heloderma Suspectum) (56) ... 53
patients diabétiques de type 2 recevant différents types de traitement de base. Les résultats sont exprimés par les différences obtenues versus placebo.(55) ...
55
Figure 19: Effets de l’exénatide 2 x 10 µg par jour sur le taux d’HbA1c
(histogrammes grisés), sur le poids corporel et sur l’incidence des épisodes hypoglycémiques nocturnes par comparaison à un traitement par insuline (histogrammes clairs) dans trois études réalisées chez des patients diabétiques de type 2 insuffisamment contrôlés par antidiabétiques oraux (55). ... 57 Figure 20: Photo de Conus magus (67) ... 63 Figure 21: Structure du ziconotide (68) ... 63 Figure 22: Photo de Conus geographus (81) ... 68 Figure 23: Photo de conus victoriae (87) ... 71 Figure 24: Photo de conus marmoreus (89) ... 73 Figure 25: Photo de conus catus (96) ... 75 Figure 26: Photo de Conus purpurascens (98) ... 76 Figure 27: Photo de la coquille de Conus imperialis (103) ... 78 Figure 28: Photo de Leiurus quinquestriatus (111) ... 83 Figure 29: Photo de Pandinus imperator (113) ... 83 Figure 30: Photo de Mesobuthus martensii (114) ... 85 Figure 31:photo de Latrodectus mactans(veuve noire) (121) ... 88 Figure 32: Photo de Phoneutria nigriventer(123) ... 89 Figure 33: Photo de Argiope aurantia (125) ... 92 Figure 34: Photo de Argiope lobata(126) ... 94 Figure 35: Photo de Parawixia bistriata (128) ... 95 Figure 36: Proposition sur l’effet antiarthritique de la mélletine (129) ... 102
LISTE DES TABLEAUX
Tableau I: Effets des désintégrines extraits du venin de serpent sur les cellules cancéreuses (44) ... 45 Tableau II: Nomenclature des toxines selon leur cible pharmacologique (64, 65) ... 61 Tableau III: Situation en septembre 2004 de l’ACV1 dans les différentes phases nécessaires à une mise sur le marché. En rouge les phases achevées, en bleu les phases à effectuer (86). ... 70 Tableau IV: Potentiel thérapeutique de différentes familles de conotoxines (66) ... 80 Tableau V: Liste des peptides scorpine-like obtenus de venin de différents scorpions (112) ... 84 Tableau VI: Les effets de l’apipuncture (BVA) sur l’arthrite rhumatoïde (136) ... 104 Tableau VII: Exemple d’un protocole de piqûres chez un patient atteint de SEP (138) ... 106
INTRODUCTION ... 1
I. GENERALITES ... 5 1. Quelques définitions ... 5 2. Présentation et répartition des animaux venimeux ... 6 3. Composition et mode d’action des venins(3) ... 8 3.1 Composition ... 8 3.2 Mode d’action des venins ... 10 II. LES TOXINES DECOUVERTES CHEZ LES VERTEBRES ... 13 1. Les toxines extraites des serpents et outils de développement thérapeutique ... 13
1.1 Généralités sur les venins de serpents ... 13 1.2 Applications thérapeutiques des toxines extraites du venin des serpents ... 14
1.2.1 Cardiologie... 14 1.2.1.1 Les peptides potentialisant l’effet de la bradykinine et développement du premier médicament mis sur le marché dérivé du venin de serpent : le captopril... 14
1.2.1.1.1. Les peptides potentialisant l’effet de la bardykinine ... 15 1.2.1.1.2 Le développement de captopril ... 18
1.2.1.2.1 Peptides natriurétiques humains ... 22 1.2.1.2.2 Peptide natriurétique ophidien : le DNP ... 25 1.2.1.2.3 CD-NP Cenderitide ... 26 1.2.2 Hématologie ... 28 1.2.2.1 Médicaments mis sur le marché dérivés des désintégrines de venin de serpent ... 28
1.2.2.1.1 Les désintégrines ... 28 1.2.2.1.2 L’eptifibatide ... 29 1.2.2.1.3 Tirofiban ... 31 1.2.2.2 Molécules dérivées des enzymes protéolytiques ophidiennes ... 34 1.2.2.2.1 Les sérine-protéases ... 35 1.2.2.2.1.1 Enzymes thrombiniques ophidiennes (TLE) ... 35 1.2.2.2.1.2 L’Ancrod ... 37 1.2.2.2.2 Les métallo-protéases ... 39 1.2.2.2.2.1 Les enzymes fibrinolytiques ... 39 1.2.2.2.2.2 La fibrolase ... 40 1.2.2.2.2.3 L’alfiméprase ... 42 1.2.3 Cancérologie ... 43
1.2.4 Analgésie (les mambalgines) ... 48 2. Les toxines extraites du venin de monstre de Gila (lézard) et outils de développement thérapeutique ... 51 2.1 Diabétologie ... 51 2.1.1 Exénatide ... 52 2.1.1.1 Origine et structure ... 52 2.1.1.2 Mécanisme d’action ... 54 2.1.1.3 Efficacité clinique ... 55 III. LES TOXINES DECOUVERTES CHEZ LES INVERTEBRES ... 59 1. Les toxines extraites du venin des cônes marins et leurs applications ... 59
1.1 Généralités sur les venins des cônes marins ... 59 1.2 Applications thérapeutiques de certaines toxines ... 62 1.2.1 Prialt™, Ziconotide (ω-conotoxine MVIIA)... 62 1.2.2 CGX-1007 (conantokine G) ... 67 1.2.3 CGX-1160 (contulakine G) ... 69 1.2.4 ACV1 (α-Conotoxine Vc1.1) ... 70 1.2.5 Xen2174 (χ-conotoxine MrIA) ... 72 1.2.6 AM336 (ω-conotoxine CVID) ... 74 1.2.7 CGX-1051 (κ-conotoxine PVIIA) ... 75
1.2.9 α-conotoxine ImI ... 78 1.2.10 Autres perspectives ... 78 2. Les toxines extraites du venin des scorpions et leurs applications thérapeutiques ... 81
2.1 Généralités sur les venins de scorpions ... 81 2.2 Applications thérapeutiques de certaines toxines ... 81 2.2.1 Chlorotoxine ... 81 2.2.2. Scorpine ... 83 2.2.3 Toxine BmK IT-AP ... 85 3. Les toxines extraites du venin des araignées et leurs applications en médecine ... 86
3.1 Généralités sur le venin des araignées ... 86 3.2 Applications thérapeutiques de certaines toxines ... 87 3.2.1 Arachnotoxine ... 87 3.2.2 PnPP-19 ... 88 3.2.3 acylpolyamines... 89 3.2.3.1 Les maladies cérébrovasculaires ... 90 3.2.3.1.1 Delucemine ... 91 3.2.3.1.2 Autres perspectives ... 92
3.2.3.2.2 Parawixine... 94 4. Utilisations thérapeutiques du venin d’abeilles ... 96 4.1 Généralités sur le venin d’abeille ... 96 4.1.1 Composition du venin d’abeille ... 96 4.1.2 Pratique de l’apipuncture ... 98 4.2 Outils de développement et applications thérapeutiques ... 99 4.2.1 Venin d’abeille et cancer ... 99 4.2.2 Venin d’abeille et rhumatismes ... 100 4.2.3 Venin d’abeille et sclérose en plaque ... 105
CONCLUSION ... 108 RESUMES ... 111 REFERENCE BIBLIOGRAPHIQUE ... 115
Buffon disait : « Si les animaux n’existaient pas, ne serions-nous pas encore plus Incompréhensibles à nous-mêmes ? ».
Bactéries, virus, micro-algues, champignons, plantes et animaux comptent de nombreuses espèces produisant des poisons biologiques extrêmement divers qui leur permettent de survivre dans des environnements difficiles.
Ces substances, nommées toxines, agissent avec efficacité souvent à faible dose, altérant le bon fonctionnement physiologique des proies. Certaines sont douées d'activités enzymatiques. D'autres possèdent une capacité à se fixer spécifiquement sur des cibles importantes au plan physiologique (organes, système nerveux…), ce qui engendre des perturbations majeures qui conduisent souvent à la mort de l'organisme touché.
Ces substances chimiques sont évidemment perçues comme des menaces potentielles par l'espèce humaine, par leur accumulation dans la chaîne alimentaire ou leur utilisation en tant qu'armes biologiques. Les venins occasionnent de fortes douleurs, des perturbations physiologiques, parfois dangereuses, quelquefois mortelles.
Et pourtant ces toxines animales sont étudiées pour leur potentiel biotechnologique et leurs applications thérapeutiques comme par exemple le traitement des maladies nerveuses et cardiovasculaires, les cancers, le diabète, les désordres auto-immuns, la douleur et autres pathologies.
Les toxines qui nous intéressent dans cette synthèse bibliographique sont principalement extraites du venin de serpents, de lézards, de cônes marins, de scorpions, d’araignées et d’abeilles.
Nous espérons, par cette thèse, contribuer à la connaissance de ces différentes toxines, leurs origines, ses modes d’action et leurs applications dans la médecine humaine.
C’est pourquoi, dans notre travail, nous aborderons dans un premier temps des généralités sur les différents animaux venimeux et leurs venins. Dans un deuxième temps, les toxines des vertébrés, leurs modes d’action et leurs applications thérapeutiques avant de s’intéresser aux toxines des invertébrés.
I. GENERALITES
1. Quelques définitions
De nombreux organismes vivants, procaryotes ou eucaryotes, sont capables d’élaborer des substances toxiques. En biologie animale, on appelle « venins » des poisons d’origine animale représentant des armes d’attaque ou de défense envers un animal d’une autre espèce ou envers l’homme. Ces venins sont soit injectés, soit projetés sur un prédateur potentiel ou une proie en vue de la paralyser ou de la tuer, soit excrétés à la surface du tégument, soit contenus dans les milieux intérieurs ou les tissus des animaux. On distinguera les animaux venimeux actifs, capables d’injecter leur venin, ou du moins ayant un comportement offensif (scorpions, serpents), des animaux venimeux passifs dont le venin ne s’exprime qu’en situation de défense (batraciens, diplopodes). La limite entre ces deux catégories (classification d’Habermehl, 1981) n’est cependant pas si tranchée (projection de venin par exemple).De plus, on fera la différence entre les animaux venimeux, qui préférentiellement seront traités dans ce travail, et les animaux vénéneux dont l’ingestion ou le contact avec leur milieu intérieur (sang ou tissus) provoque des réactions nocives d’empoisonnement (poisson-globe, papillons et autres insectes). Les venins actifs et passifs sont le plus souvent des substances complexes formées par sécrétion. On peut en extraire des toxines (du grec toxicon : poison pour flèche), c’est-à-dire des espèces chimiques bien définies, à effet physiologique nocif plus ou moins spécifique, et d’autres substances.
Un venin contient souvent plusieurs toxines, plusieurs enzymes, etc. Rappelons qu’il existe chez les procaryotes (bactéries), chez les eucaryotes végétaux (protistes végétaux et végétaux pluricellulaires), ainsi que chez les champignons, de très nombreuses toxines (toxines bactériennes, alcaloïdes) et parfois même de véritables venins (euphorbiacées, urticacées, bufoténine de certains champignons. Certaines de ces substances sont utilisées par les animaux pour leur protection.
Les venins se situent donc dans un vaste ensemble de substances produites par les êtres vivants et intervenant dans les relations entre animaux : ces substances sont dites séméiochimiques. Parmi elles, celles à effets interspécifiques sont les substances allélochimiques comprenant les allomones et les kairomones.
Les venins et les substances défensives (dont la limite est souvent floue) sont des allomones qui procurent un avantage adaptatif à l’organisme qui les produit. Le venin est en général sécrété par l’animal lui-même dans des glandes spécialisées, on parlera alors de venin d’origine endogène. Certains venins, notamment chez les hyménoptères, contiendraient des phéromones qui pousseraient les individus constituant la colonie à des réactions collectives, défensives ou agressives. Par contre, de nombreux animaux, vertébrés comme invertébrés, utilisent pour leur défense des substances qu’ils ne produisent pas eux-mêmes mais qu’ils empruntent à des bactéries, des algues unicellulaires, des végétaux, voire à d’autres animaux ; on parlera alors de venins ou de substances toxiques d’origine exogène (tétrodotoxine et saxitoxine par exemple) (1).
Les venins se rencontrent dans tous les embranchements du règne animal. La toxicité envers l’homme doit être mise à part : l’homme représente un hôte ou un ennemi relativement exceptionnel pour les animaux venimeux, jamais une proie, sauf rarissimes exceptions. Mais la toxicité envers l’homme d’une part, la richesse des venins en composants de haute activité spécifique d’autre part, ont une telle importance médicale qu’elles justifient les préoccupations et les travaux des chercheurs, des médecins et des populations concernées.
La répartition géographique des animaux venimeux montre que c’est dans la zone intertropicale et dans les zones tempérées chaudes qu’ils sont les plus couramment répandus. Il y a diminution du nombre d’animaux venimeux à partir des zones intertropicales vers le nord et vers le sud. Cette distribution peut avoir plusieurs causes : d’une part, des causes paléogéographiques, l’origine de certains groupes se situant dans ces zones, d’autre part, la formation des plaques continentales et les migrations au cours des temps géologiques qui ont aussi contribué à la répartition actuelle. On constate souvent que la toxicité d’une espèce ou d’un groupe zoologique varie en fonction de la température et dépend des saisons. Souvent, les animaux venimeux ont un fort taux d’endémisme mais certaines espèces sont cependant assez largement réparties. Les animaux venimeux, qui sont surtout des prédateurs carnivores, occupent des biotopes où il y a souvent abondance de proies: strate arbustive et litière des forêts, steppes. Dans les déserts où les proies sont plus rares, les animaux venimeux compensent ce handicap par des stratégies de chasse plus efficaces. Parfois, les animaux venimeux se sont accoutumés à l’homme et vivent dans ses cultures (araignées, serpents) ou même dans les villes (scorpions, araignées).
Le développement des élevages amateurs et commerciaux pose, dans de nombreux pays occidentaux, des problèmes de santé et des problèmes médico-légaux qu’il est urgent de résoudre. Les animaux venimeux sont répartis aussi bien dans le milieu terrestre que dans le milieu marin. En milieu marin, les animaux peuvent être fixés (sessiles) ou vagiles. Les vertébrés marins sont représentés par de nombreux poissons mais aussi par quelques serpents marins au venin très toxique. En milieu terrestre, les arthropodes venimeux sont très nombreux : arachnides, myriapodes, insectes. Parmi les vertébrés, batraciens et serpents prédominent ; les mammifères et oiseaux venimeux se réduisent à quelques espèces.
Dans un phylum ou dans une classe, le pourcentage d’espèces venimeuses est très variable : faible chez les mammifères (quelques espèces concernées seulement), très élevé chez les araignées (toutes les familles sauf une) et même égal à 100 % chez les scorpions (2).
3. Composition et mode d’action des venins(3)
3.1 Composition
Les venins sont en général constitués d’un mélange de plusieurs substances qu’il est possible de séparer. Les unes, les toxines ont une action nocive plus ou moins spécifique ; les autres sont des composés dont l’action n’est en principe pas nocive, du moins aux concentrations biologiques utilisées par les cellules mais dont la concentration dans les venins peut entraîner une toxicité. Ce sont par exemple de nombreuses enzymes, des amines biogènes (sérotonine, histamine, acétylcholine), des ions, des protéines diverses (bradykinine par
exemple). Des antibiotiques (peptides antibactériens), un facteur de croissance (NGF) etc., peuvent être également présents. Actuellement, l’analyse des venins, et en particulier de certaines toxines, est extrêmement avancée, à tel point que leurs structures moléculaires sont aussi connues que celles de l’hémoglobine, de la ribonucléase ou de l’insuline. Les toxines animales peuvent être des corps relativement simples, rarement aliphatiques, communément cycliques plus ou moins complexes (alcaloïdes par exemple). Ce sont très souvent des polypeptides et des protéines dont le nombre de résidus des séquences en acides aminés est généralement inférieur à 75 (serpents, scorpions). De nombreuses toxines marines ne sont pas des protéines mais des composés organiques (chaînes hétérocycliques). Nombre de toxines ont des parentés structurelles avec des défensines circulantes présentes dans le sang. Les toxines protéiques des venins de serpents, de scorpions, des cônes et des cnidaires font l’objet de recherches très avancées : on connaît la structure spatiale de leur molécule, l’emplacement des sites toxiques et des sites antigéniques (se liant aux récepteurs cellulaires des membranes ou aux anticorps). La charge électrique de certains radicaux, la conformation de ces molécules toxiques, sont susceptibles d’expliquer grâce à leur spécificité le mode d’action des réactions toxine-récepteur ou antigène-anticorps.
3.2 Mode d’action des venins
L’action d’un venin sur une proie doit être extrêmement rapide. Tout concourt en effet soit à une paralysie fulgurante, indispensable à la nutrition et évitant ainsi une réaction agressive de la proie ou une longue recherche en cas d’échappée, soit à un effet dissuasif envers un agresseur. Les toxines agissent en général à très faible dose, ce sont des poisons très violents. Certaines enzymes (hyaluronidase) ont pour rôle de faciliter la diffusion des autres constituants du venin. Les toxines peuvent agir sur différents sites de l’organisme.
Des techniques de marquage radioactif des venins ou des toxines permettent de déterminer les tissus cibles ; des méthodes d’étude plus fines de liaison entre la toxine et ses récepteurs cellulaires (différents sites d’un canal ionique par exemple) sont actuellement appliquées. Le spectre de spécificité d’une toxine est plus ou moins large. Certaines toxines, dites pantropes, ont un large spectre d’action, elles atteignent de nombreux tissus, ce sont par exemple les cytotoxines et les cardiotoxines. D’autres toxines, telles les neurotoxines, ont comme cibles les cellules excitables : les neurones et leurs synapses (dont les jonctions neuromusculaires) et le sarcolemme, c’est-à-dire la membrane plasmique du muscle.
Les toxines, peuvent être classées selon leur mode d’action ou selon leur structure chimique, mais d’autres classifications ont été proposées. Le nom d’une toxine dépend en général de l’animal qui la produit : cobratoxine de cobra, palytoxine de Palythoa (cnidaire), scorpiotoxines des scorpions. Lorsque plusieurs toxines sont présentes dans le venin d’un même animal, on a souvent rajouté une lettre grecque, voire un indice chiffré. Ces lettres font
éventuellement référence au mode d’action (ex. : α-bungarotoxine, β-bungarotoxine) mais il est possible également de faire référence à l’animal qui y est sensible : mammatoxine (qui agit sur les mammifères) ; insectotoxines (agissant sur les insectes) ; crustacéotoxine (sur les crustacés).
Mis à part leur pouvoir toxique spécifique, de nombreuses toxines protéiques ont un pouvoir antigénique, autrement dit, leur présence dans l’organisme induit une réaction de défense mettant en jeu le système immunitaire. C’est sur les réactions immunitaires que sont basées la sérothérapie et la vaccination. En dehors de la liaison antigène-anticorps, les venins interagissent avec de nombreux facteurs du système immunitaire : leur action sur les plaquettes sanguines, sur l’endothélium vasculaire ou sur le système du complément en sont des exemples.
Les toxines découvertes
chez les vertébrés
II. LES TOXINES DECOUVERTES CHEZ LES VERTEBRES
1. Les toxines extraites des serpents et outils de développement
thérapeutique
1.1 Généralités sur les venins de serpents
D’après Chippaux (2002) les venins de serpents sont principalement composés d’enzymes et de toxines. Parmi les enzymes, il est possible de décrire des phospholipases parmi lesquelles la phospholipase A2 forme la majorité, des acétylcholinestérases, des phosphoestérases, des L-amino-acide-oxydases, des hyaluronidases, des protéases et d’autres enzymes comme des amylases, des transaminases, etc. En ce qui concerne les toxines, on rencontre des neurotoxines postsynaptiques classées en trois groupes. Le premier regroupe les neurotoxines alpha à chaîne courte (60-62 acides aminés, 4 ponts disulfures), le second, les neurotoxines alpha à chaîne longue (66-74 acides aminés, 5 ponts disulfures) et le troisième, les neurotoxines kappa (66-70 acides aminés, 5 ponts disulfures).
Ces protéines ont comme particularité la formation d’une structure tertiaire en trois doigts. On rencontre aussi des neurotoxines présynaptiques possédant une activité phospholipase A2 appelées neurotoxines beta, elles aussi scindées en trois groupes, les neurotoxines beta monocaténaires, la bêta-bungarotoxine et les neurotoxines beta composées de plusieurs sous-unités. Les venins peuvent contenir aussi des cardiotoxines cytotoxiques, des dendrotoxines qui favorisent
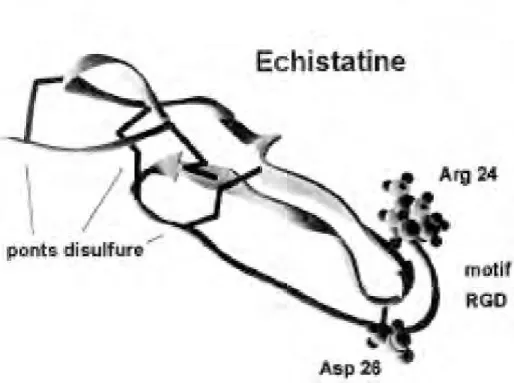
des myotoxines, des sarafotoxines qui sont de puissants vasodilatateurs et des désintégrines qui inhibent les intégrines.
Les venins de serpents possèdent encore d’autres types de composés comme du NGF, des protéines actives sur les thrombocytes, des inhibiteurs et activateurs enzymatiques sans effet toxique, des facteurs capables d’activer le complément…(4).
1.2 Applications thérapeutiques des toxines extraites du venin des serpents
1.2.1 Cardiologie
1.2.1.1 Les peptides potentialisant l’effet de la bradykinine et développement du premier médicament mis sur le marché dérivé du venin de serpent : le captopril
La découverte de la bradykinine, par Rocha et Silva en 1949, et des peptides potentialisant l’effet de la bradykinine par Ferreira en 1965, dans le venin de la vipère brésilienne Bothrops jararaca (figure 1), a joué un rôle important dans la compréhension de la physiopathologie cardiaque et le développement de médicaments antihypertenseurs.
Figure 1: Photo de la vipère brésilienne Bothrops jararaca (5)
En effet, les peptides potentialisant l’effet de la bradykinine, présents dans le venin de serpent de la vipère brésilienne, ont été de très bons candidats pour le développement structural du premier médicament inhibiteur de l’enzyme de conversion (IEC), le captopril, utilisé dans le traitement de l’hypertension artérielle.
1.2.1.1.1. Les peptides potentialisant l’effet de la bardykinine
Les peptides potentialisant l’effet de la bradykinine (BPP) sont des petits peptides constitués de 5 à 13 acides aminés, riches en proline, qui agissent en inhibant l’enzyme de conversion de l’angiotensine I (ECA) (6). L’ECA est une métalloprotéine à zinc présente dans le plasma sanguin, les liquides interstitiels et dans tous les organes dont le cœur, les reins, le cerveau, les tissus vasculaires, l’endothélium et le muscle lisse. L’ECA a une activité exopeptidase qui catalyse
hypertension car elle s’oppose à la vasodilatation entraînée par la bradykinine, hormone peptidique, en entraînant la dégradation de cette dernière. En inhibant l’ECA, les BPP s’opposent donc à l’effet hypertenseur en agissant à deux niveaux : ils entraînent d’une part une augmentation du taux de bradykinine et d’autre part une diminution du taux d’angiotensine II.
Le premier BPP isolé par Ferreira et al. En 1970 est un penta‐peptide, le BPP5a (Figure 2), composé de 5 acides aminés : acide Glutamique-Lysine‐Tryptophane‐Alanine-Proline. Les études du BPP5a sur les modèles animaux démontrent bien un effet antihypertenseur mais qui est de courte durée car trop sensible aux réactions de dégradation enzymatique. Malgré les résultats non pertinents, les BPP ont continué à faire l’objet de nombreuses études dans le développement d’une molécule anti-hypertensive.
1.2.1.1.2 Le développement de captopril
A partir des travaux de Ferreira et al, Cushman et Ondetti isolent et caractérisent à partir du venin de Bothrops jararaca un nouveau nonapeptide potentialisant l’effet de la bradykinine : le BPP9a aussi appelé Téprotide (Figure 2). Le Téprotide plus stable que le BPP5a, du fait de la présence de quatre résidus de l’acide aminé Proline, est le point de départ du développement du captopril (Figure 3).
Le Téprotide est le premier IEC à avoir été étudié chez des patients hypertendus et à avoir démontré une réelle activité anti-hypertensive. Cependant la limite du Téprotide est son manque d’activité par voie orale. Cushman et Ondetti entament alors des études de relation structure activité afin de développer une molécule anti-hypertensive pouvant être administrée par voie orale. Leurs études ont permis d'affiner le modèle hypothétique du site actif de l'ECA et de déterminer la séquence du substrat se liant au site actif de l’ECA. La séquence des trois acides aminés Tryptophane-Alanine-Proline du Téprotide, ou la séquence plus stable Phénylalanine-Alanine-Proline, ont ainsi été jugées optimales pour se lier au site actif de l'ECA. Un essai fut organisé avec pour base l’acide benzylsuccinique, un analogue de la Phénylalanine, ayant la capacité de masquer le site actif de la carbopeptidase A et de se lier à une molécule de Proline, selon les séquences mises en évidence auparavant. Cette molécule, la benzylsuccinyl-L-proline bien que d’éfficacité médiocre possédait toutes les propriétés d’un inhibiteur spécifique de l’enzyme de conversion. La synthèse de dérivés de cette structure montra que lorsque la fonction carboxylate est remplacée par une fonction sulfhydryl, une augmentation de plus de 2000
fois la capacité inhibitrice de la molécule été observée. L’adjonction d ‘une fonction méthyl en 2 sur le résidu succinyl montra une augmentation de 15 fois la capacité inhibitrice de la molécule. Le captopril fut ainsi crée en 1974 (8, 9).
Le captopril, LOPRIL®, chef de file des IEC, obtient une autorisation de mise sur le marché en 1981 et sera commercialisé par le laboratoire Squibb. Il sera rapidement suivi de nombreux analogues concurrents tels que l’énalapril (RENITEC®), le lisinopril (ZESTRIL®), le ramipril (TRIATEC®) ou encore le périndopril (COVERSYL®).
Les inhibiteurs de l’enzyme de conversion continuent à être de nos jours une importante classe médicamenteuse indiquée dans le traitement de l’hypertension artérielle en monothérapie en première intention ou associée à d’autres antihypertenseurs. Ils sont également indiqués dans le traitement de l’insuffisance cardiaque congestive, de l’insuffisance du myocarde en phase aiguë, en post-infarctus du myocarde et pour le traitement des complications rénales chez le diabétique.
Figure 3 : Développement du captopril (10)
a. Téprotide, nonapeptide extrait du venin de Bothrops jararaca, inhibiteur de l’enzyme de conversion de l’angiotensine
b. Relation structure activité du téprotide avec le site de liaison de l’enzyme de conversion de l’angiotensine
c. Premier composé synthétisé à partir des données pharmacologiques obtenues par les études de relation structure activité. Le problème de ce composé est qu’il développe une faible affinité avec le site de liaison malgré une très bonne sélectivité pour l’enzyme de conversion
d. Captopril médicament administré par voie orale, le groupement thiol qui remplace le carboxyle de (c) permet d’obtenir une meilleure affinitétout en conservant la bonne sélectivité.
1.2.1.2 Molécule en développement dérivée des peptides natriurétiques ophidiens
Le venin de serpent représente une source importante de peptide natriurétique. Le premier peptide natriurétique qui a été identifié dans le venin de Dendroaspis angusticeps (Figure 4), mamba vert de la famille des Elapidés, est le Dendroaspis natriuretic peptide (DNP). Par la suite les études de nombreux autres venins de serpents comme le Micrurus corallinus, Bothrops
jararaca, Trimeresurus flavoviridis, Trimeresurus gramineus, Agkistrodon halys blomhoffii, Pseudocerates persicus, Crotalus durissus cascavella, Bungarus flaviceps et 10 espèces d’Elapidés Australiens, ont aussi permis de mettre en
De par leur structure et leur fonction proches des peptides natriurétiques humains (Figure 5), les peptides natriurétiques issus du venin de serpent sont des candidats potentiels pour le développement de nouveaux médicaments dans le domaine cardiovasculaire.
Afin de mieux comprendre l’action du DNP et son intérêt dans le développement d’une molécule thérapeutique, il paraît important de faire un rappel sur les peptides natriurétiques humains.
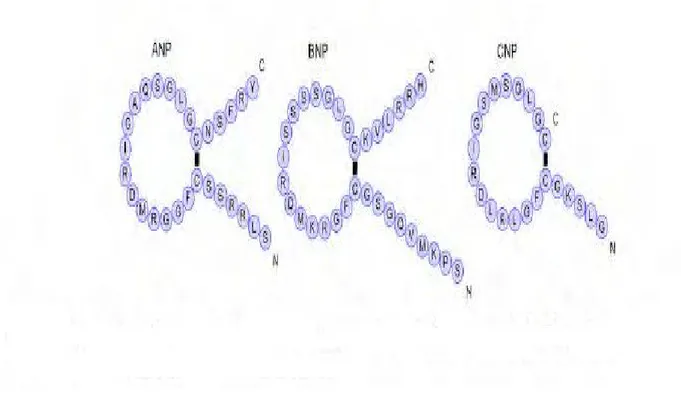
1.2.1.2.1 Peptides natriurétiques humains
Les peptides natriurétiques humains ont fait l’objet de nombreuses recherches durant ces dernières années. Ces peptides sont des hormones sécrétées par diverses cellules dont notamment les cellules cardiaques et les cellules endothéliales (cellules constitutives de la paroi interne des vaisseaux sanguins). Ils sont aux nombres de trois : le peptide auriculaire natriurétique (ANP), le peptide natriurétique cérébral ou de type B (BNP) et le peptide natriurétique de type C (CNP). Ces peptides renferment une structure cyclique commune de 17 acides aminés et d’un pont disulfure. Ils jouent un rôle fondamental dans l’homéostasie cardiovasculaire et rénale (13). Les peptides natriurétiques agissent sur des récepteurs appelés Natriuretic Peptide Receptor (NPR) appartenant à la famille des récepteurs à activité guanylate- cyclase. Il existe trois types de récepteurs NPR qui sont le NPR-A, le NPR-B et le NPR-C. Ces récepteurs sont situés aussi bien au niveau de la membrane plasmique qu’au niveau du cytosol et sont exprimées dans la plupart des types cellulaires. Les peptides natriurétiques sont éliminés par le récepteur NPR-C qui ne possède aucune activité enzymatique et sont dégradés par un enzyme qui est l’endopeptidase neutre (NEP).
ANP et BNP
Les peptides ANP et BNP sont sécrétés majoritairement par les cellules cardiaques et agissent sur les tissus cibles cardiaques et rénaux en se liant au récepteur NPR-A. Ils ont pour effet une hypotension par dilatation artérielle et veineuse, par augmentation de la diurèse et de la sécrétion urinaire de sodium ainsi que par une diminution de rénine et d’aldostérone (13).
CNP
Les effets physiologiques du CNP se liant au récepteur NPR-B, ne sont pas très bien connus. Contrairement à l’ANP et au BNP, le CNP induit uniquement une dilation des veines et n’a qu’une action limitée sur la fonction rénale et donc sur la pression artérielle. Ce dernier a une faible action sur la diurèse, la sécrétion urinaire de sodium ainsi que sur l’aldostérone (14). De par ses effets le CNP entraîne moins d’effet hypotenseur que l’ANP et le BNP. Cette différence d’action au niveau rénal, avec l’ANP et le BNP, peut s’expliquer structuralement par l’absence de queue au niveau de la partie C-terminale du CNP (Figure 5). Elle peut aussi s’expliquer par le fait que le CNP soit plus rapidement dégradé par la NEP. Outre son effet de dilatation veineuse, diverses études sur le CNP ont permis de mettre en évidence une action antiproliférative au niveau des fibroblastes cardiaques (15).
Les propriétés des peptides natriurétiques ont ainsi motivé le développement du BNP recombinant, le nésiritide NATRECOR®. Le nésiritide est utilisé aux USA, et en Suisse dans le traitement de l’insuffisance cardiaque aiguë décompensée Cependant l’intérêt de son utilisation est controversé. Des
études effectuées en 2005 ont démontré que le nésiritide entraîne des effets délétères sur la fonction rénale et augmente significativement le taux de mortalité des patients traités par le nésiritide par rapport à un placebo ou à un traitement conventionnel. Les résultats de ces études ont donc engendré une forte diminution de son utilisation dans les pays concernés (14).
Afin de diminuer, voire supprimer les effets délétères entraînés par les thérapeutiques émergentes comme le nésiritide, des peptides chimériques sont développés tel que Le Cenderitide dont nous verrons les propriétés plus loin.
1.2.1.2.2 Peptide natriurétique ophidien : le DNP
Le DNP découvert en 1992, fait partie de la famille des peptides natriurétiques. D’un point de vue structural, le DNP possède, tout comme les peptides natriurétiques humains, une structure cyclique de 17 acides aminés et d’un pont disulfure (Figure 6). Cependant il possède une plus grande séquence d’acide aminé au niveau de la partie C-terminale soit 15 acides aminés contre 5 acides aminés pour l’ANP, 6 acides aminés pour le BNP et aucun pour le CNP. Cette différence structurale confère au DNP une plus grande résistance à la dégradation par la NEP. Le DNP agit sur le récepteur NPR-A (16) et engendrent un effet proche de l’ANP et du BNP qui est une hypotension par dilation artérielle et veineuse, par augmentation de la diurèse, et par augmentation de la sécrétion urinaire de sodium (15).
1.2.1.2.3 CD-NP Cenderitide
L’association chimérique d’un peptide d’origine humaine à un peptide d’origine animale comme les serpents, permet d’augmenter les effets favorables du peptide natriurétique humain et de diminuer voire de supprimer les effets défavorables de ce dernier. Le CD-NP (Figure 6) est un peptide chimérique qui associe à la fois le peptide natriurétique humain de type C au peptide natriurétique du venin de Dendroaspis angusticeps, le DNP. Développé pour le traitement de l’insuffisance cardiaque, le CD-NP est formé de 37 acides aminés, soit 22 acides aminés issus du CNP et 15 acides aminés issus de la partie C-Terminale du DNP. Il agit à la fois sur le récepteur NPR-A et NPR-B.