تيبعــــــشلا تيطازقـــــويدلا تيزئاشجلا تيرىــــــهوجلا يولعلا ثحبلا و يلاعلا نيلعتلا ةراسو
République Algérienne Démocratique et Populaire
Ministère de l’Enseignement Supérieur et de la Recherche Scientifique ةعماج
لـــــجيج
UNIVERSITĒ MOUHAMMED SEDDIK BENYAHIA
Mémoire de fin d’études
En Vue de l’obtention du diplôme : Master Académique en Biologie
Option : Agroalimentaire et contrôle de qualité Thème
Membres de Jury : présenter par:
Présidente : Mme Benhamada N. Melle Bousbia Hadda Examinateur : Mr Laib S. Melle Biad Amina Encadreur : Dr. Laggoune S. Année Universitaire : 2017-2018 ةاـــيحلا و تـــــعيبطلا مىلع تيلك سق ــــ ن مىلع و تيقيبطتلا ايجىلىيبوزكيه غتلا ذ تي Faculté des Science de la Nature et de la Vie
Département de Microbiologie Appliquée et des Sciences Alimentaires
Analyse senserielle, microbiologique et physicochimique de l’eau
de consommation provenant du citernage de la région de
Avant tout, nous tenons à remercier Dieu le tout puissant, le Miséricordieux, de nous avoir donner le courage, la force, la santé et la persistance et de nous avoir permir de finaliser ce
travail dans de meilleures conditions.
Nous exprimons nos sincères remerciements ainsi que notre grande reconnaissance à tous ceux qui ont contribué de près ou de loin à la réalisation de ce projet de fin d’étude et leur exprimer notre gratitude pour l’intérêt et le soutien qu’ils nous ont généreusement accordé.
Nos remerciements s’adressent à notre encadreur : Mme LAGGOUNE Soheila pour avoir diriger notre projet de fin d’étude. La confiance et le soutien, qu’elle nous a accordé, nous
ont permis de mener à bien ce travail.
Aux membres du jury : Mr Laib Said et Benhamada Nabila qui ont daigné laisser leurs multiples occupations pour se donner la peine d'examiner ce travail, nous leur sommes infiniment reconnaissants. Leurs critiques et suggestions contribuerons certainement à
rehausser la valeur scientifique de ce travail.
Nous remercions tous les pérsonnes qui travaillaient au Centre Algérien de Contrôle de Qualité et de l’Emballage (C.A.C.Q.E), pour leur aide précieuse, et surtout madame la
directrice du laboratoire et l’ingénieur: Mr : Bousbia Mohammad.
Nous tenons également à présenter nos plus vifs remerciements à Mr : Kherrat Mokhtar : ingénieur de laboratoire à l’université de Mohammed Seddik Ben Yahia-Jijel de nous avoir
aidé.
Enfin, nous remercions tous les enseignants du Département de SNV de l’Université Mohammed Seddik Ben Yahia-Jijel., pour leur contribution à notre formation, et en
particulier les enseignants de contrôle de qualité et microbiologie.
Amina et Hadda
Au tout puissant Allâh
A toi la louange, Ô la lumière des cieux ; de la terre et de ce qu’ils renferment. Gloire à toi de nous avoir assisté de ta
lumière et en toute circonstance matin et soir.
Je tiens à dédier ce modeste travail à :
A mon défunte père : malgré son absence, mais leur souvenir est restera toujours graver dans nos esprits, car le temps peut diminuer la douleur
mais n'amène jamais l'oubli.
A Ma chère mère : Mariem Pour ses sacrifices et ses encouragements, Dieu lui donne une longue vie.
A mes chères sœurs :Naima, Nacira, Djamila, Farida,et leurs epouses enfants : Aya, Nada, Aymen, Maram, Wassim, Amanni, Wissal, Youssef, Anasse, Chayma, et leur et mes frères : Rafik, Reda, fouad, Houssam.
Mes oncles et mes tantes.
Mes amies, tout particulièrement :
Wahiba, Fatima, Nihad, Aafaf, Massouda, Amina , Faten, Nadia, Amira, Halima, Minocha, Ilhame.
Je dédie ce mémoire en premier lieu à ceux qui m’ont donné la vie, qui m’ont été la source De l’amour, de la tendresse, et du courage, qui m’ont soutenu durant tous les moments de ma vie A mes très
Chers parents Ahcen et Noura
En priant Dieu jour et nuit qu’il les garde et les protège pour moi. A mon chère frère : Messaoud pour ses encouragements.
A mes belles sœurs : Dalila, Fatima Zohra, Selma et leurs épouses et leurs enfants : Ayoub, Asma, Adem
A toute la famille surtout ma chère grand-mère, et grand-père, a tous mes oncles et mes tantes et à tous mes cousins et mes cousines
A mes chères amies Ysmine, Nadira et Chahla
A tous mes camarades de contrôle de qualité la promotion 2018 sans exception.
Sommaire Remerciements
Liste des abréviations Liste des tableaux Liste des figures
Introduction ... 01
Chapitre I: Généralités sur les eaux I.1. Propriétés de l’eau ... 3
I.1.1. Propriétés physiques ... 3
I.1.2. Propriétés chimiques ... 3
I.1.3. Propriétés optiques ... 3
I.2. Cycle d’eau ... 3
I.3. Ressources des eaux ... 4
I.3.1. Eaux de surfaces... 4
I.3.2. Eaux souterraines ... 4
I.4. Besoin en eau ... 4
I.5. Potabilité de l’eau ... .5
I.5.1. Définition de l’eau potable ... 5
I.5.2. Les types de l’eau destinée à la consommation humaine... 5
I.5.2.1. Les eaux de pluies ou eaux météoriques ... 5
I.5.2.2. Les eaux de sources ... 5
I.5.2.3. Les eaux minérales ... 5
I.6. Les différents types de pollution des eaux ... 5
I.6.1. Définition ... 5
I.6.2. Pollution chimique ... 5
I.6.3. Pollution biologique ... 6
I.6.4. Pollution physique ... 6
Chapitre II : Les caractéristiques générales de l’eau potable II.1. Caractéristiques de l’eau potable ... 7
ΙΙ.1.1. Les caractéristiques organoleptiques ... 7
II.1.1.1. Couleur ... 7
II.1.1.2. Odeur ... 7
II.1.1.3. Goût et saveur ... 7
ΙΙ.1.2. Les caractéristiques physicochimiques ... 7
ΙΙ.1.2.1. Le potentiel d’hydrogène (pH) ... 7
ΙΙ.1.2.2. La température ... 7
ΙΙ.1.2.3. Conductivité électrique (CE) ... 8
ΙΙ.1.2.4.Turbidité ... 8
II.1.3. Caractéristiques microbiologiques ... 8
potable ... 9
II.1.3.4. Critères d’analyses Bactériologiques de l’eau ... 9
II.1.3.5. Paramètres bactériologiques de l’eau ... 9
II.2. Les maladies à transmissions hydriques ... 11
II.2.1. Le choléra ... 11
II.2.2. La fièvre typhoïde et paratyphoïde ... 11
II.2.3. La dysenterie ... 12
II.2.4. Les hépatites virales ... 12
Chapitre III : Matériel et méthodes III.1. Matériel utilisés ... 13
III.2. Méthodes ... 13
III.2.1. Site de prélèvement ... 13
III.2.2. Prélèvement de l'eau ... 13
III.2.3. Mode de prélèvement ... 14
III.2.4. Conditions du prélèvement ... 14
III.2.4.1. Echantillonnage d’eau pour les analyses bactériologiques ... 14
III.2.4.2. Echantillonnage d’eau pour analyses physico-chimiques ... 15
III.3. Méthodes d’analyses ... 15
III.3.1. Méthodes d’analyses organoleptiques ... 15
III.3.1.1. Détermination de l'odeur ... 15
III.3.1.2. Évaluation du goût ... 15
III.3.1.3. Détermination de la couleur (examen visuel) ... 16
III.3.2. Méthodes d’analyses physico-chimiques ... 16
III.3.2.1. Mesure de la température ... 16
III.3.2.2. Mesure du potentiel d’hydrogène (pH) ... 16
III.3.2.3. Mesure de la conductivité électrique (CE)... 17
III.3.2.4. Mesure de la turbidité ... 17
III.3.2.5. Dosage des métaux lourds (cadmium, zinc, cuivre) par spectrophotomètre d’adsorption atomique avec flamme... 17
III.3.3. Méthodes d’analyses microbiologiques ... 18
III.3.3.1. Critères microbiologiques ... 18
III.3.3.2. Les équipements et les milieux des cultures ... 18
III.3.3.3. Méthode d’analyse et réglementation ... 18
III.3.3.4. Analyses bactériologiques ... 18
III.4. Etude statistique ... 24
Chapitre IV : Résultats et discussion IV.1. Qualité organoleptique ... 25
IV.1.1. Couleur ... 25
IV.1.3. Odeur ... 25
IV.2.1. Qualité physicochimique ... 26
IV.2.1.1. Température ... 26
IV.2.1.2. Potentiel hydrogène (Ph ... 26
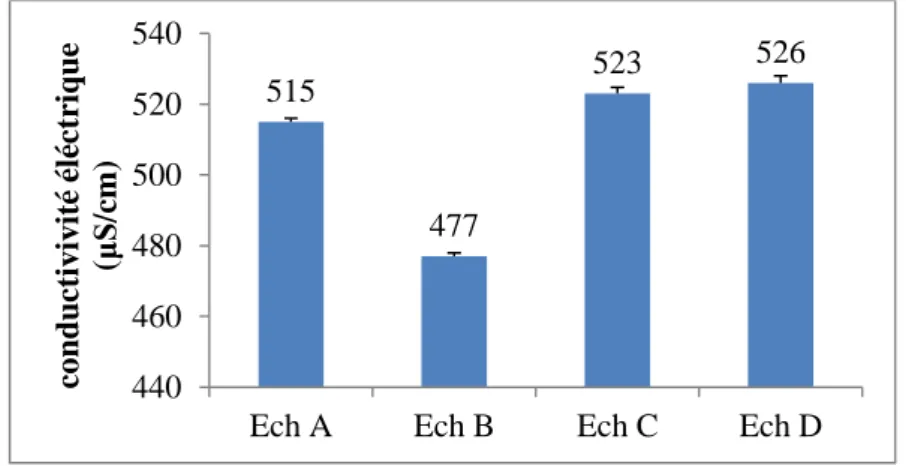
IV.2.1.3. Conductivité ... 27
IV.2.1.4. Turbidité ... 28
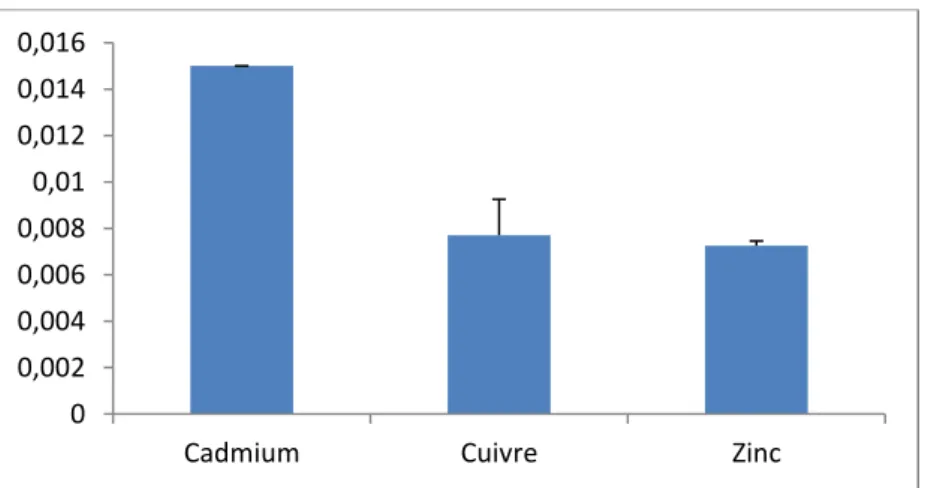
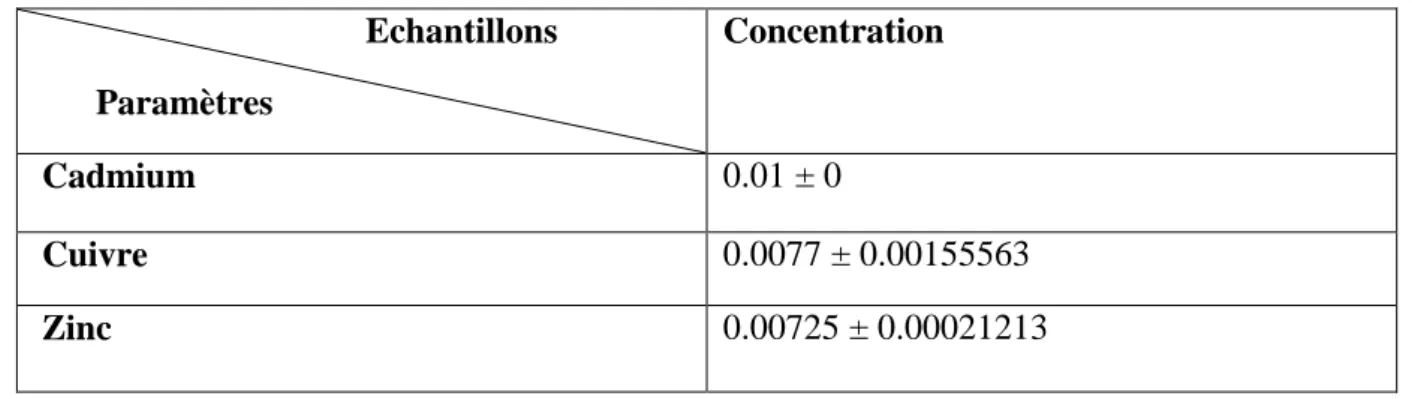
IV.2.1.5. Les métaux lourds ... 29
IV.3. Qualité microbiologique... 30
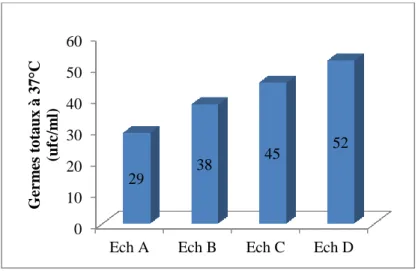
IV.3.1. Germes totaux ... 31
IV.3.2. Coliformes totaux ... 33
IV.3.2.1. Coliformes fécaux ... 33
IV.3.3. Streptocoques fécaux ... 34
IV.3.4. Clostridium sulfito-réducteurs ... 34
IV.4.5. Staphylocoque ... 35
IV.4.6. Levures et moisissures ... 36
IV.4.7. Salmonelles ... 36
Conclusion ... 37 Références bibliographique
ASR : Anaerobies Sulfito-Réducteurices. CO2 : Dioxyde de carbone.
C.S.R : Clostridium sulfito-réducteurs. D/C : Double Concentration.
DRBC : Dichoran Rose Bengal Chloramphénicol.
Eva Litsky : Bouillon à l’éthyle violet et azide de sodium. H+ : Ion d’hydrogène.
JORA : Journal Officiel République Algérienne.
MKTTn : Muller-Kauffmann au Tétrathionate-novobiocine. NPP : Nombre le Plus Probable.
NTU : Unité de Turbidité Néphélométrique. OMS : Organisation Mondiale de Santé. PCA : Plat Count Agar.
pH: Potentiel d’Hydrogène.
RVS : Rappaport-Vassiliadis avec Soja. S/C : Simple Concentration.
TSE : Tryptone- Sel –Eau. UFC : Unité Formant Colonie. XLD : Xylose Lysine Désoxycholate.
Liste des figures
Figure N°01 : Mode opératoire pour la recherche de Salmonella. Figure N°02 : Température des échantillons d’eaux.
Figure N°03 : Potentiel redox des échantillons d’eaux.
Figure N°04 : Conductivité électriques des échantillons d’eaux. Figure N°05 : Turbidité des échantillons d’eaux.
Figure N°06 : Teneur en cadmium, zinc, cuivre dans les échantillons de l’eau.
Figure N°07 : Dénombrement des germes totaux à 22°C des échantillons d'eau de citerne, étudiés.
Figure N°08 : Dénombrement des germes totaux à 37°C des échantillons d'eau de citerne, étudiés.
Tableau N°01 : La qualité de l’eau en fonction de Conductivité. Tableau N°02 : Dates de prélèvements.
Tableau N°03 : Germes recherchée selon l’arrête du 24/01/1998, selon les méthodes verticales.
Tableau N°04 : Germes pathogènes et indicateurs d’hygiènes recherchées selon les méthodes horizontales.
Tableau N°05 : Les analyses organoleptiques des échantillons de l’eau.
Introduction
1 L’eau est indispensable à la vie et tous les hommes devraient disposer d’un approvisionnement satisfaisant en eau. Un meilleur accès à une eau de boisson saine peut se traduire par des bénéfices tangibles pour la santé. Tous les efforts doivent être consentis pour obtenir une eau de boisson saine que possible (Maoudombaye et al., 2016).
L'eau en tant que liquide est considérée comme un solvant universel, il se congèle à 00C, il peut devenir vapeur à 1000C qui est sa température d'ébullition, mais ses principales caractéristiques sont qu'il est inodore, incolore et sans goût (Gerard, 1999). La plus grande partie des eaux du globe terrestre sont marines (97%). Les eaux douces ne représentent qu’une partie mineure. Elles constituent cependant une source importante d’eau potable (Merzoug et al., 2011).
L’eau est utilisée pour de nombreux usages essentiels : la boisson, la préparation des repas, l’hygiène, l’entretien de l’habitation, les loisirs, la fabrication dans l’industrie, l’irrigation des cultures et l’abreuvement du bétail (Leemans et al., 2008). Les origines des eaux de consommation sont multiples, mais ceux qui répondent aux normes de potabilités sont très peu nombreuses. L’eau fournie aux consommateurs doit satisfaire aux normes nationales en matière de potabilité et à toutes les autres conditions imposées par l’administration sanitaire (Bouziani, 2000).
La consommation d’une eau potable est un facteur déterminant dans la prévention des maladies liées à l’eau, doit bénéficier d’une attention particulière. En effet, l’eau destinée à la consommation humaine ne doit contenir ni substances chimiques dangereuses, ni germes nocifs pour la santé (Coulibaly, 2005).
Le principal risque pour la santé lié à l'eau de boisson est la contamination directe ou indirecte par les excréta humains ou animaux, et notamment la contamination fécale. Si la pollution est récente et si elle provient de porteurs de maladies entériques contagieuses, des micro-organismes pathogènes peuvent être présents dans l'eau. Si celle-ci est utilisée comme boisson ou dans la préparation des aliments (OMS, 2000).
En outre, la pollution guette à chaque instant et de plus en plus toutes nos belles réserves, c’est pour cela qu’il est devenu très utile de procéder à des contrôles et analyses physico-chimiques et microbiologiques de l’eau périodiquement. Cependant, Les eaux de surface sont des eaux de mauvaise qualité, elles sont presque toujours contaminées et doivent par conséquent être correctement traitées avant tout usage domestique, par contre les eaux souterraines représentent une importante source d’eau destinée à la consommation humaine (Margat, 1992).
Le contrôle de la qualité de l'eau est un outil qui peut être utilisé pour identifier une eau de boisson salubre que ce soit à la source, dans un système de distribution. L'analyse de l'eau joue un rôle important dans la protection de l’environnement et la santé des consommateurs. De ce fait, l’eau doit être nécessairement analysée, surveillée et l’évaluation de sa qualité repose sur les paramètres physico-chimiques et bactériologiques (Bain et al., 2012).
2 L’objectif de ce travail consiste à faire des analyses physicochimiques, sensorielles et bactériologiques pour déterminer la qualité de l’eau de citerne vendue dans la région de Tassoust – Jijel. Ce manuscrit est divisé en trois parties :
-La première partie est consacrée pour l’étude bibliographique, qui est composée de deux chapitres comme suit:
Le premier chapitre est un rappel sur l’eau d’une façon générale, et les diverses pollutions qui l’affectent.
Le deuxième chapitre montre les caractéristiques organoleptiques et physico-chimiques et bactériologiques de l'eau et ses microorganismes avec les maladies à transmission hydrique.
-La deuxième partie est consacrée à la méthodologie adoptée pour réaliser la partie expérimentale.
3 I.1. Propriétés de l’eau
L'eau est un composé chimique simple aux multiples propriétés. I.1.1. Propriétés physiques
Masse volumique: elle varie avec la température et la pression. Pour l'eau pure sous pression normale, elle passe par un maximum à environ 4°C (exactement 3,982°C) (Degrement, 2005).
Tension superficielle: elle se forme facilement grâce à l'expérience de l'aiguille qui flotte à la surface de l'eau dans un verre. Cette tension superficielle due aux liaisons hydrogène entraine aussi la montée de l'eau dans un tube capillaire (Kemmer, 1984). Elle diminue avec l'augmentation de la température, et augmente avec l'addition de sels dissous (Degrement, 2005).
Viscosité: on l'appelle souvent frottement interne. Lorsque la température augmente, la viscosité diminue, le traitement devient plus facile, les opérations de sédimentation et de dégazage sont plus rapides. La présence de sels dissous augmente la viscosité car il y a augmentation du degré d'association (Ouali, 2008).
I.1.2. Propriétés chimiques
L'eau est l'un des agents ionisants les plus connus comme la plupart des substances sont solubles dans l'eau, on l'appelle fréquemment le solvant universel. L'eau s'allie avec certain sel pour former des hydrates et réagit avec des oxydes des métaux pour des acides. Elle est utilisée comme catalyseur dans de nombreuses réactions chimiques importantes. L'eau est sans aucun doute une molécule très polaire. C'est une propriété qui a des implications considérables pour les systèmes vivants (Bertrand, 2008).
I.1.3. Propriétés optiques
La transparence de l'eau dépend de la longueur d'onde de la lumière qui la traverse (Degrement, 2005). L'eau est transparente aux (UV) ultra-violet, absorbe le rouge au visible ce qui explique la couleur bleue de l'eau.
Les propriétés optiques sont utilisées dans le contrôle de l'efficacité de traitements d'épuration et pour mesurer certaines formes de pollution (Ouali, 2008).
I.2. Cycle d’eau
La connaissance de l’origine de l’eau, de son cycle, de sa dynamique dans la nature et sa répartition dans l’espace et dans le temps est une donnée fondamentale. L’eau fait partie d’un cycle naturel en perpétuel mouvement entre la terre et l’atmosphère (Ayad, 2016).
L’eau s’évapore constamment au-dessus des océans, des lacs et des forêts, elle est condensée sous forme de nuages et ensuite transportée dans le ciel par vents. Dans le ciel, les nuages se condensent sous forme de vapeur d’eau autour des particules de poussières, puis tombent en précipitations sous forme de pluie ou de neige, sous l’action de phénomènes
Chapitre I Généralité sur les eaux
4 météorologiques complexes où interviennent surtout les vents et les différences de température (Ayad, 2016).
L’eau qui ruisselle pénètre dans le sol où elle s’infiltre et va remplir les nappes souterraines. Elle traverse des couches de plus en plus profondes du sol et va abandonner dans son cheminement la quasi-totalité des impuretés dont elle s’était chargée (Bouziani, 2000). Les eaux souterraines circulent elles aussi, une partie se jetant directement dans la mer et le reste venant alimenter les rivières à leur source ou par le biais d’un affluent. Enfin, l’eau peut revenir directement à sa phase liquide dans l’atmosphère par la transpiration des végétaux qui éliminent ainsi une partie de l’eau contenue dans le sol et conservent une partie de l’eau de pluie dans leur feuillage (Valverde, 2008).
I.3. Ressources des eaux
Les réserves disponibles d’eaux naturelles sont constituées des eaux souterraines des eaux de surface retenues ou en écoulement :
I.3.1. Eaux de surface
Comprennent les stagnantes (lacs, étangs…etc.) ou courantes (rivières, fleuves) (Jacques, 2007). Ces eaux proviennent surtout des pluies et sont constitués d’un mélange d’eau de ruissellement et d’eau souterraine qui alimentent les rivières, les vallées, les barrages.
Ce sont des eaux de moins bonne qualité parce qu’elles sont presque toujours contaminées c'est-à-dire cette source est caractérisé par une pollution microbienne et chimique maximale, mais ces eaux sont fréquemment utilisées dans les régions à forte densité de population ou très industrialisées (Bouziani, 2000).
I.3.2. Eaux souterraines
On trouve les eaux souterraines sous la plupart des terres émergées du globe. Leur origine est due à l’accumulation des infiltrations dans le sol qui varie en fonction de sa porosité et de sa structure géologique. Les eaux souterraines sont généralement d’excellente qualité physico-chimique et bactériologique (Cardot, 1999). Elles restent jusqu’à présent les meilleures ressources en eau potable (Margat, 1992). Et son caractérisées par leurs capacités de renouvellement (Jacques, 2007).
I.4. Besoin en eau
Les deux tiers du corps humain sont composés d’eau; une cellule en contient à peu près 80% d'eau. Le besoin quotidien d’un adulte est d’environ de 35g/kg rapporté au poids corporel ; ceci signifie qu’un adulte de 70kg a besoin d’environ 2,5l d’eau potable par jour, soit 50. 000 à 60. 000 l, au cours d’une vie. Les hommes peuvent vivre plusieurs semaines sans manger, mais ne peuvent tenir que 5 à 6 jours sans boire. L’eau est évacuée par le rein, par respiration, par la transpiration et par d’autres voies ; elle est remplacée par des boissons et par l’eau présente dans la nourriture. A titre d'exemple les légumes et fruits renferment de 90% (Bliefert et Perraud, 2001).
5 I.5. Potabilité de l’eau
I.5.1. Définition de l’eau potable
«L’eau potable est une eau qui peut être bue par l’homme sans danger pour sa santé, elle doit pour cela répondre à un certain nombre de normes fixées par l’Organisation Mondial de la Santé» (OMS, 2004). C’est une eau non susceptible de porter atteinte à la santé de celui qui la consomme. Cette eau ne doit pas contenir d’agents pathogènes ou toxiques, ni d’éléments chimiques indésirables. Elle ne doit pas présenter un danger microbien (bactéries, virus, parasites, etc.). De plus, c’est une eau agréable à boire, claire et sans odeur (Jacques, 2007). I.5.2. Les types de l’eau destinée à la consommation humaine
I.5.2.1. Les eaux de pluies ou eaux météoriques
Les eaux de pluies pouvant être collectées à partir des toitures des maisons dans des récipients ou dans des impluviums. A l’origine ces eaux sont pures sur le plan microbiologique, mais sur le plan chimique, il leur manque souvent certaine éléments indispensables à la santé comme le sodium, magnésium, manganèse, fer, iode (OMS, 1972). I.5.2.2. Les eaux de source
Une eau de source est une eau d’origine souterraine microbiologiquement saine et protégée contre les risques des pollutions, apte à la consommation sans autre traitement que décantation, filtration (grossière) et/ou aération et/ou adjonction de gaz carbonique (Grosclaude, 1999).
L’eau fournie est le plus souvent de bonne qualité, lorsque la source a été aménagée. Contrairement aux eaux minérales naturelles, leur composition n’est pas systématiquement stable (Zella, 2007).
I.5.2.3. Les eaux minérales
Les eaux minérales sont des eaux profondes qui peuvent contenir certains éléments en concentration supérieure à la concentration autorisée pour les eaux potables et qui sont douées de propriétés thérapeutiques reconnues. Elles sont distribuées en bouteille, avec parfois certains traitements bien définis comme décantation naturelle, élimination et/ou réincorporation du CO2 originale (Degrément, 2005).
I.6. Les différents types de pollution des eaux I.6.1. Définition
On appelle pollution de l'eau toute modification défavorable chimique, physique ou biologique de la qualité de l'eau qui a un effet nocif sur les êtres vivants qui consomment cette eau. Quand les êtres humains consomment de l'eau polluée, il y a en général des conséquences sérieuses sur leurs santés. La pollution de l'eau peut aussi rendre l'eau inutilisable pour l'usage désiré (Ramade, 2000).
I.6.2. Pollution chimique
La pollution chimique est définie comme la présence des substances dissoutes indésirables ou dangereuses. Ce sont des corps dépourvus de vie qui peuvent être nuisibles à l’homme. L’eau contient naturellement des composés chimiques. C’est quand ils sont en excès (par
Chapitre I Généralité sur les eaux
6 rapport à une norme) ou qu’ils apparaissent là où ils ne devaient pas qu’ils causent la pollution (Lanvegin et al., 2000).
I.6.3. Pollution biologique
Elle provient de l’agriculture, des hôpitaux et même des vies domestiques. Elle peut introduire dans l’eau des microorganismes dont certains sont pathogène. De nombreux microorganismes vivants naturellement dans l’intestin de l’homme et des animaux peuvent survivre assez longtemps dans l’eau. Toutefois l’eau peut abriter des bactéries, mycètes, protozoaires, des virus etc (Jacque, 2007).
I.6.4. Pollution physique
La pollution physique est due à la présence des matières (inorganiques) telles que le sable, le limon, l’argile ou de la matière végétale. La contamination physique affecte la couleur, l’odeur ou le goût. Elle se traduit par un trouble ou une coloration plus ou moins prononcée (Leroy, 1999).
7 II.1. Caractéristiques de l’eau potable
ΙΙ.1.1. Les caractéristiques organoleptiques
Il existe quelques paramètres indicateurs importants en pratique qui peuvent fournir des indications de la qualité de l’eau. Des valeurs indicatives sont recommandées en matière de turbidité, couleur, goût, odeur, en vue de la surveillance de l’approvisionnement en eau des petites collectives (Savary, 2010).
II.1.1.1. Couleur
La coloration d'une eau est dite vraie ou réelle lorsqu'elle est due aux seules substances en solution. Elle est dite apparente quand les substances en suspension y ajoutent leur propre coloration. Les couleurs réelles et apparentes sont approximativement identiques dans l'eau claire et les eaux de faible turbidité (Rodier et al., 2005).
II.1.1.2. Odeur
Toute odeur est un signe de pollution ou de présence de matières organiques en décomposition. L'odeur peut être définie comme :
▪ L'ensemble des sensations perçues par l'organe olfactif en flairant certaines substances volatiles. La qualité de cette sensation particulière est provoquée par chacune de ces substances (Rodier et al., 2005).
II.1.1.3. Goût et saveur
▪ Le goût peut être défini comme l'ensemble des sensations gustatives, olfactives et de sensibilité chimique commune perçue lors de la boisson est dans la bouche.
▪ La saveur peut être définie comme l'ensemble des sensations perçues à la suite de la stimulation par certaines substances solubles des bourgeons gustatifs (Rodier et al., 2005). ΙΙ.1.2. Les caractéristiques physicochimiques
ΙΙ.1.2.1. Le potentiel d’hydrogène (pH)
Le pH d’une eau est une indication de sa tendance à être acide ou alcaline, il est fonction de l’activité des ions hydrogènes H+
présents dans cette eau. Dans les eaux naturelles cette activité est due à de différentes causes en particulier l’ionisation de l’acide carbonique et de ses sels (Rodier et al., 2009). Les valeurs limites du pH sont comprises entre 6,5 et 9 (JORA, 2011). Au-dessous de ce seuil l’eau est dite « agressive », elle a un effet corrosif sur les canalisations et peut mener à la dissolution de certains métaux toxiques tels que le plomb des conduites (Savary, 2010 ; Bouziani, 2000).
ΙΙ.1.2.2. La température
La température est un facteur important pour une eau de boisson, elle influe sur une certaine propriété de l’eau telle que la solubilité de l’oxygène, la vitesse de réaction chimique et biochimique. De plus la prolifération des bactéries est favorisée par une élevation de température (Belghiti et al., 2013).
Chapitre II Les caractéristiques générales de l’eau potable
8 ΙΙ.1.2.3. Conductivité électrique (CE)
Elle exprime la capacité de conduction de courant électrique d’une eau. Toute eau est plus ou moins conductrice. Cette conductivité électrique est liée à la présence des ions dans l’eau, l’existence d’une relation entre la teneur des sels dissous d’une eau et sa conductivité (Savary, 2010).
Elle permet d’apprécier le degré de minéralisation de l’eau dans la mesure où la plupart des matières dissoutes dans l’eau se trouvent sous forme d’ions chargés électriquement comme montre le tableau N°01 (Kahoul et Touhami, 2014).
Tableau N°01 : La qualité de l’eau en fonction de Conductivité (Bemmoussat et al., 2014).
100 μs /cm < conductivité <200 μs /cm Minéralisation faible 200 μs /cm < conductivité <333 μs /cm Minéralisation moyenne
333 μs /cm < conductivité <666 μs /cm Minéralisation moyenne accentuée 666 μs /cm < conductivité <1000 μs /cm Minéralisation importante
conductivité >1000 μs /cm Minéralisation élevée
ΙΙ.1.2.4.Turbidité
La turbidité de l’eau est due à la présence de matériaux solides en suspension qui réduisent sa transparence. C’est le premier paramètre perçu par le consommateur (Brasilia, 2013). Une forte turbidité de l'eau révèle la précipitation de fer, aluminium ou manganèse due à une oxydation dans le réseau, et favorise aussi la fixation et la multiplication des micro-organismes, rendant sa qualité bactériologique suspecte (OMS, 2004).
II.1.3. Caractéristiques microbiologiques
L'eau destinée à l'alimentation humaine contient une multitude de microorganismes pathogènes, agents d'infections humaines redoutables. Ce sont des bactéries, des virus, voire des champignons et des algues (Haslay et Leceler, 1993).
L'eau compte tenu de ses propriétés physico-chimique est trop souvent utilisée par l'homme comme un vecteur d'évacuation de la majorité de ses déchets, ainsi polluée, elle devienne un vecteur de pollution (Heriarivony et al., 2015).
II.1.3.1. Qualité microbiologique
L’eau ne doit contenir ni microbe, ni bactérie pathologique, ni virus qui pourraient entraîner une contamination bactériologique et être la cause d’une épidémie. Les dénombrements des bactéries consistent à rechercher des germes aérobies, c'est-à-dire se développant en présence d’oxygène (Rodier, 1996).
La présence de coliformes fécaux ou de streptocoques fécaux indique une contamination de l’eau par des matières fécales. La présence d’autres coliformes, de staphylocoques laisse
9 supposer une contamination fécale. Dans les deux cas, des mesures doivent être prise pour interdire la consommation de l’eau ou en assurant le traitement (Rodier, 1996).
II.1.3.2. Flore microbienne de l’eau
Les micro-organismes rencontrés dans l’eau sont très variés, leur nature dépend de celle de l’eau analysée : eau de captage ou distribution, eau de traitement ou de circuits industriels, eaux résiduaires, ces micro-organismes sont classés en trois types :
1. Les germes typiquement aquatique : ce sont des bactéries (Vibrions, Pseudomonas…). 2. Les germes telluriques : ce sont des bactéries sporulées (bacilles, Clostridium…) ou apportant aux germes Streptomyces et des spores fongiques.
3. Les germes de pollution humaine ou animale : ce sont des germes souvent pathogènes et essentiellement d’origine intestinale (E. coli, salmonelles et streptocoques fécaux...).
On peut également rencontrer dans l’eau des parasites (kystes d’amibes) et des virus (Poliomyélite virus des hépatites virales) (Berne, 1972).
II.1.3.3. Facteurs d’environnement affectant la survie des microorganismes dans l’eau potable
Température
La survie des bactéries diminue avec la température. En moyenne l’optimum de température de stockage voisine les 15 à 20°C, il y’a aussi des microorganismes vivant à une température proche de 37°C. Dans le cas particulier des bactéries thermophiles, l’optimum de survie est à environ 45°C (Perry et al., 2004).
Potentiel d’hydrogène pH
Le pH ou potentiel Hydrogène de l'eau mesure sa concentration en ion H+. Il traduit son caractère acide ou basique, le pH de l'eau influe sur la vie des bactéries (acidophiles neutrophiles et basophiles). L'eau potable doit avoir un pH compris entre 6,5 et 8,5 (Perry et al., 2004).
Oxygène dissous
La solubilité de l’oxygène dissous est fonction de la température, de la pression de l’atmosphère et de la salinité, l'oxygène dissous est influencé par la présence de végétaux, les matières organiques, des organismes et des germes aérobies…. etc. (Perry et al., 2004). II.1.3.4. Critères d’analyses bactériologiques de l’eau
Le contrôle bactériologique réalisé dans ce contexte, porte sur la quantification des germes indicateurs de contamination fécale : les coliformes et les streptocoques fécaux. D’autres indicateurs non spécifiques ont été utilisés comme complémentaires : les germes totaux et les
Clostridium sulfito-réducteurs.
Implique aussi la recherche de certains germes pathogènes : Escherichia coli, Salmonella,
Shigella, Vibrio, Pseudomonas aeruginosa et les Staphylocoques (Leyral et al., 2002).
II.1.3.5. Paramètres bactériologiques de l’eau
Chapitre II Les caractéristiques générales de l’eau potable
10 A. Recherche des Germes totaux
Ce sont des germes qui développent dans des conditions aérobies. Leur présence est indicatrice de pollution bactérienne. Leur dénombrement donne une information sur la qualité hygiénique de l’eau destinée à la consommation humaine. Ainsi, ils renseignent sur le degré de production des nappes d’où à analyser (Bourgois et al., 1991).
B. Recherche des coliformes totaux
Les coliformes sont considérés depuis longtemps comme de bons indicateurs microbiens de la qualité de l'eau de boisson, notamment parce qu'ils sont faciles à détecter et à dénombrer dans l'eau (OMS, 2000). Selon l’organisation internationale de standardisation, il s’agit de bacilles gram Négatifs (BGN) non sporulés oxydase négative aérobies ou anaérobies facultatifs, capables de fermenter le lactose avec production d’acide et de gaz en 24 à 48 heures à une température comprise entre 36°C et 37°C. Elles existent dans les matières fécales mais se développent également dans les milieux naturels (Leyral et al., 2002).
C. Recherche des Coliformes Thermo-tolérants
Les coliformes thermotolérants forment un sous-groupe de bactéries de coliformes qui fermentent le lactose à une température comprise entre 44 à 45°C pendant 24heures. Ce groupe comporte plusieurs souches différentes (Citrobacter freundii, Entérobacter aerogenes,
Klebsiella...etc.), la souche type est Escherichia coli (Brasilia, 2013).
Les coliformes fécaux ne se trouvent que chez les animaux, ce qui fait d’eux un indicateur intéressant. Leur présence dans l’eau traduit donc nécessairement une contamination fécale (Diop, 2006).
Escherichia coli
Les bactéries E. coli sont considérées comme le meilleur indicateur de contamination fécale. Leur présence dans l’eau signifie que cette dernière est contaminée par une pollution d’origine fécale et qu’elle peut donc contenir des microorganismes pathogènes (OMS, 2000). Bien que la plupart de ces bactéries ne soit pas pathogènes, elles peuvent présenter des risques pour la santé, ainsi pour que la qualité de l'eau, provoquant des odeurs et saveurs désagréables (Brasilia, 2013).
D. Recherche des streptocoques
Le terme «streptocoques fécaux» désigne les streptocoques généralement présents dans les fesses de l'homme et des animaux, les streptocoques fécaux se multiplient rarement dans l’eau polluée et leur persistance est supérieure à celle d’E. coli et des coliformes (OMS, 2000). Il s’agit de cocci à Gram positif (CGP) de forme sphérique ou ovoïde, se présentant en chainettes plus ou moins longues, non sporulées aéro-anaérobies facultatives, ne possédant ni catalase ni oxydase, ce sont des hôtes normaux d’homme et ne sont pas considérés comme pathogène (Berne, 1972).
E. Recherche de Clostridium sulfito-réducteur
Clostridium sulfito-réducteurs sont souvent considérés comme des témoins de pollution
11 Ce sont des bacilles Gram positifs, anaérobies stricts, isolés ou en chaînettes, mobiles, catalase positif, réduisent le sulfite de sodium en sulfure.
La forme sporulée des Clostridium sulfito-réducteurs est beaucoup plus résistante que les formes végétatives (Bourgois et Mescle., 1996).
F. Salmonelles
Les Salmonelles appartiennent à la famille des Entérobacteriaceae, bacille à Gram négatif, anaérobie facultatif, habituellement mobiles grâce à une ciliature péritriche, mais des mutants immobiles peuvent exister (Bourgeois et Mescle, 1996).
Les sérotypes adaptés à l'homme sont: Salmonella typhi et sérotypes S. paratyphi A et S.
sendai, responsables de la fièvre typhoïde humaine.
Les Salmonelles sont en général considérées comme pathogènes bien que leur virulence et leur pouvoir pathogène varient énormément (Camille et Bernard, 2003).
II.2. Les maladies à transmissions hydriques
Dans la nature, l'eau n'est pas toujours source de vie car elle peut véhiculer en particulier un nombre de micro-organismes, bactéries, virus et parasites en tous genres qui y vivent et s'y développent (Rodier, 1999).
Les principaux symptômes de toutes les maladies hydriques sont les suivants : diarrhées ou rarement constipations, crampes abdominales, fièvre et vomissements. Cette similitude de symptômes ne facilite pas l'établissement d'un diagnostic sûr, c'est pourquoi, pour aider le médecin dans cette tâche, on doit lui fournir le maximum d'indices (pays récemment visités, personnes rencontrées, aliments consommés, précautions prises et risques professionnels (François, 2008).
Les maladies ayant pour origine des bactéries véhiculées par l'eau sont nombreuses, les plus rencontrées sont:
II.2.1. Le choléra
Le choléra est une infection bactérienne aiguë du tractus intestinal, pouvant entraîner rapidement. Après adhérence de Vebrion cholerae à la surface des cellules épithéliales de l’intestin elles se multiplient et produisent une entérotoxine altérant le processus ionique avec pour conséquence des pertes d’eau et d’électrolytes sous forme de diarrhées sévères et de vomissements. Le malade en l’absence de traitement adapté meurt. La transmission de cette maladie est féco-orale (Soumre, 1997).
II.2.2. La fièvre typhoïde et paratyphoïde
La fièvre typhoïde et paratyphoïde est causée par les bactéries Salmonella typhi, S. para
typhi A, B et C respectivement. Les germes de la typhoïde et de la paratyphoïde passent dans
les sels et l’urine des personnes infectées. Les personnes deviennent infectées par l’eau de boisson qui a été contaminée par des effluents contenant des bactéries. Une fois que les bactéries pénètrent dans l’organisme d’une personne, elles se multiplient et se propagent des intestins dans le courant sanguin (OMS, 2015).
Chapitre II Les caractéristiques générales de l’eau potable
12 II.2.3. La dysenterie
Terme générique qui caractérise des maladies entraînant une diarrhée douloureuse et sanglante accompagnée de coliques, de nausées et de vomissements, dysenterie bacillaire ou shigellose (causée par diverses bactéries), dysenterie amibienne ou amibiase (causée par des amibes). Seule la shigellose peut entraîner la mort (Briere, 2000).
II.2.4. Les hépatites virales
Les deux principaux virus responsables d’hépatites virales aiguës sont le virus de l’hépatite A (VHA) et le virus de l’hépatite E (VHE). Tous deux sont transmis par voie féco-orale et peuvent provoquer de grandes épidémies. L’eau joue un rôle majeur dans leur transmission. Toutefois, ils correspondent à deux modèles épidémiologiques différents (Pierre et Bernard, 2012).
Chapitre III Matériel et méthodes
13 III.1. Matériel
III.1.1. Verreries
- Flacons en verre de 250ml, avec bouchon à vis métallique. - Pipettes graduées.
- Tubes à essais stériles. - Pipettes Pasteur. - Becher.
- Eprouvettes graduées.
Avant chaque utilisation, la verrerie doit être soigneusement lavée, rincée, séchée et stérilisée au four Pasteur à 180°C pendant 30 minutes.
III.1.2. Appareillages - Autoclave.
- Bec benzène.
- pH mètre marque (Hanna instriment).
- Conductivité mètre marque (Hanna instriment). - Turbidité mètre marque (Hanna instriment). - Bain-marie marque (memmert).
- Four pasteur.
- Etuves réglées à 37°C; et 44°C marque (memmert).
- Spectrophotomètre d’adsorption atomique avec flamme. III.1.3. Outils
- Anse de platine. - Boites de Pétri stériles. - Portoirs.
- Pipette de pasteur.
III.1.4. Milieux de cultures
Des milieux de cultures solides et liquides sélectives ont été utilisés pour la recherche et l'isolement de différentes flores présentes dans l’eau analysée (Annexe 01).
- Gélose PCA : (Plat Count Agar), est préconisée pour le dénombrement de la flore aérobie mésophile totale.
- Bouillon lauryl sulfate : est un milieu sélectif pour l’isolement et dénombrement des coliformes (fécaux et totaux).
- Bouillon de Rothe : est utilisé pour effectuer le test présomptif de recherche et de dénombrement des entérocoques dans les eaux d’alimentation, les produits surgelés et les autres produits alimentaires par la méthode du nombre le plus probable.
- Bouillon BLBVB: Milieu sélectif destiné pour l’isolement des entérobactéries et pour l’E.
coli on utilise bouillon d’E. coli.
- Bouillon Eva Litsky : est utilisé pour effectuer le test confirmatif de recherche et de dénombrement des streptocoques fécaux (entérocoques) dans les eaux d’alimentation, les eaux résiduaires, les surgelés et les autres produits alimentaires par la méthode du nombre le plus probable.
14 - Gélose Tryptose-Sulfite-Cyclosérine (TSC) : est utilisée pour le dénombrement des spores de Clostridia sulfito-réducteurs dans les eaux, et les produits alimentaires.
- Gélose Baird Parker: est un milieu d’isolement utilisé pour la recherche et dénombrement des staphylocoques à coagulase positive dans les produits alimentaires.
- Gélose Dichoran Rose Bengal Chloramphénicol (DRBC) : milieu sélectif pour l’isolement des levures et moisissures dans les produits alimentaires.
- Gélose Xylose Lysine Désoxycholate (XLD) : est utilisée pour l’isolement des salmonelles dans les produits alimentaires ainsi que dans les autres prélèvements (les eaux, par exemple) susceptibles d’en contenir, après enrichissement préalable dans les bouillons Rappaport-Vassiliadis avec Soja (RVS) et Muller-Kauffmann au Tétrathionate-novobiocine (MKTTn).
III.2. Méthodes
III.2.1. Site de prélèvement
Des échantillons d’eau vendue en citernes dans la région de Tassoust–Jijel, quatre prélèvements (tableau N°02) sont effectués à partir d’une citerne choisie aléatoirement. L’échantillonnage est réalisé durant quatre semaines.
Tableau N°02 : Dates de prélèvements.
Échantillons Échantillon A Échantillon B Échantillon C Échantillon D Date de prélèvement
22 avril 2018 29 Avril 2018 06 Mai 2018 14 Mai 2018
III.2.2. Prélèvement de l’eau
Le prélèvement d’un échantillon d’eau est une opération délicate à laquelle le plus grand soin doit être apporté. L’échantillon doit être : homogène parce que de toute façon, en présence d’une turbidité significatif, les résultats analytique pourront être faussés par le manque d’homogénéité du prélèvement représentatif et obtenir sans modifier les caractères physico-chimiques et microbiologiques de l’eau, il convient que le préleveur ait une connaissance précise des conditions du prélèvement et de son importance pour la qualité des résultats analytique(Rodier, 1996).
III.2.3. Mode de prélèvement
Le mode de prélèvement variera suivant l’origine de l’eau, dans le cas de prélèvement à un robinet, si le but est le contrôle de l’eau de distribution (Rodier, 1996).
III.2.4. Conditions du prélèvement
III.2.4.1. Echantillonnage d’eau pour les analyses bactériologiques
Les conditions essentielles à respecter pour le prélèvement sont d’abord le respect des règles d’asepsie et la non modification de la flore au cours du prélèvement et du transport d’échantillons. Les manipulations effectuées au cours du prélèvement ne doivent en aucun cas être à l’origine d’une contamination, d’où : la nécessité d’utiliser des instruments stériles et de travailler dans des conditions stériles (Guiraud, 2003).
Chapitre III Matériel et méthodes
15 Certains instruments doivent être désinfectés sur les lieux du prélèvement. Le trempage dans l’alcool et le flambage sont parfois insuffisants car la température atteinte n’est pas assez élevée. Il est nécessaire d’utiliser des flacons propres, secs, étanches, à col large stérilisés par autoclavage à 121°C pendant 30min ou encore à usage unique et stériles. Quand le prélèvement aseptique est réalisé, il faut identifier immédiatement le produit avec une étiquette ou une référence (Guiraud et Galzy, 1980).
Si l’échantillon doit être transporté, et la durée du transport dépasse 1heure, et si la température extérieure est supérieure à 10°C (Joffin et Joffin, 2010). Les prélèvements seront transportés dans des glacières dont la température doit être comprise entre 4 à 6°C. Même dans de telles conditions, l’analyse bactériologique doit débuter dans un délai maximal de 8heures, après le recueil de l’échantillon. Si exceptionnellement l’analyse doit être reportée, il faut entreposer les échantillons à 4°C (Rodier et al., 2005).
Après prélèvement, les échantillons sont transportés aseptiquement à la température de 4°C dans des isothermes à l’obscurité pour assurer une conservation satisfaisante (Larpent, 1997). III.2.4.2.Echantillonnage d’eau pour l’analyse physico-chimique
Les échantillons d’eau nécessaires à l’analyse physico-chimique ont été prélevés selon la méthode décrite par (Rodier et al., 2009), dans des flacons jetables en matière plastique et conservés à 4°C, ensuite analysés dans les 24heures qui suivent.
III.3. Méthodes d’analyses
L’étude expérimentale consiste à effectuer des analyses physico-chimiques et microbiologiques de l’eau de citernes vendue à la région de Tassoust – Jijel.
Les analyses microbiologiques ont été réalisées au sein du Centre Algérien de Contrôle de la Qualité et de l’Emballage (C.A.C.Q.E), et les analyses physico chimique ont été réalisées au sein du laboratoire de contrôle de qualité du département de Microbiologie Appliquée et des Sciences Alimentaires de l’université Mohammed Saddik Ben Yahia-Jijel.
III.3.1. Méthodes d’analyses organoleptiques III.3.1.1. Détermination de l’odeur
Pour obtenir approximativement l’échelle des intensités des odeurs, il est opéré de la façon suivante : dans une première fiole conique mettre 50ml d’échantillon, dans une deuxième 16ml, dans une troisième 6ml et compléter chaque flacon à 240ml avec de l’eau inodore, dans une quatrième, mettre 240ml d’eau inodore. Pour être complète, la détermination est effectuée à froid (25°C) et à chaud (60°C) après chauffage sur plaque ou dans un bain-marie. Ne pas faire varier la température de plus de 1 degré au cours d’une opération. Secouer chaque flacon 3 ou 4 fois avant de sentir pour caractériser le type d’odeur (Rodier et al., 2005).
III.3.1.2. Évaluation du goût
Il est effectué par dégustation dans un local réservé à cet usage et s’assurer de la propreté rigoureuse de la verrerie employée. Avant chaque dégustation, l’opérateur se rincera la bouche avec de l’eau de référence. Effectuer la dégustation à 30°C et quelquefois à 20°C.
16 L’opérateur prendra de l’eau en quantité suffisante dans sa bouche (15ml environ) pour l’imprégner en totalité. Deux méthodes utilisables conjointement, vu leur rapidité, sont recommandées.
Dans l’un prendre un peu d’eau dans la bouche et la faire voyager d’un côté à l’autre (éventuellement, faire passer un peu d’air au travers) puis la rejeter. Dans le suivant, laisser une petite quantité d’eau dans la partie antérieure de la bouche en contact avec les papilles de la pointe de la langue, sans agiter, pendant 5 à 10secondes (ceci particulièrement pour les eaux froides). Avaler ensuite doucement, certains goûts se développant immédiatement après déglutition (Rodier et al., 2005). Pour la présente étude la dégustation est effectuée par une équipe d’au moins trois opérateurs.
III.3.1.3. Détermination de la couleur (examen visuel)
Cette méthode rapide donne une première indication sur la coloration apparente de l’eau. C’est la seule qui puisse être utilisée sur le terrain de manière simple. Elle consiste à placer l’échantillon à analyser non filtré dans une bouteille incolore, de préférence en verre, propre d’au moins un litre, d’examiner l’intensité de la couleur et la teinte de l’échantillon sous lumière diffusée sur un fond blanc. Si l’échantillon contient des matières en suspension, le laisser, si possible décanter avant examen (Figarella et Leyral, 2002).
III.3.2. Méthodes d’analyses physico-chimiques III.3.2.1. Mesure de la température
La température de l’eau, joue un rôle non négligeable dans l’intensité de la sensation de l’eau. Elle est le facteur le plus apprécié pour une eau destinée à la consommation humaine (Gregorio et Pierre-Marie, 2007).
La mesure de la température a été effectuée en plongeant immédiatement le thermomètre dans le flacon d’eau à analyser pendant 5minutes. La lecture doit se faire à travers les parois du flacon. Généralement, les appareils de mesure de la conductivité ou du pH possèdent un thermomètre intégré (Rodier et al., 2009).
III.3.2.2. Mesure du potentiel d’hydrogène (pH)
Le pH est l’une des mesures que l’on doit effectuer le plus fréquemment, il est relié à la teneur en ions H+ et aussi à l’acidité et l’alcalinité de l’échantillon. Le pH-mètre est l’appareil le plus utilisé pour la mesure du pH (Benaissa et al., 2016). Le PH est déterminé selon la méthode suivante :
- Brancher le pH-mètre, le laisser se stabiliser pendant quelques minutes, installer les électrodes aux entrées correspondantes sur l’appareil.
- Etalonner l’appareil à l’aide d’une solution tampon. Ensuite rincer l’électrode avec de l’eau distillée et avec l’échantillon à analyser.
- Amener l’échantillon d’eau à analyser à la température désirée.
- Plonger l’électrode dans l’échantillon à analyser et lire la valeur de pH directement.
- Après chaque détermination du pH, on retire l’électrode, on la rince et à la fin de l’expérience, on la laisse tremper dans l’eau distillée) (Rodier et al., 2009).
Chapitre III Matériel et méthodes
17 III.3.2.3. Mesure de la conductivité électrique (CE)
La conductivité électrique d’une eau permet d’évaluer la teneur en sels dissous de l’échantillon d’eau et sa force ionique. La mesure de la conductivité est utilisée entre autre comme moyen pour tester la qualité d’une eau.
Pour la détermination de la conductivité, nous avons utilisé un conductimètre multiéléments. Par le suivie de cette méthode :
-D’une façon générale, la verrerie doit être rigoureusement propre et rincée avec de l’eau distillée avant l’usage.
- On rince plusieurs fois la cellule à conductivité, d’abord avec de l’eau distillée puis en la plongeant dans un récipient contenant de l’eau à examiner.
- La mesure est faite dans un deuxième récipient en prenant soin que les électrodes de platine soient complètement immergées.
-On agite le liquide (barreau magnétique) afin que la concentration ionique entre les électrodes soit identique à celle du liquide ambiant. Cette agitation permet aussi d’éliminer les bulles d’air sur les électrodes.
- Le résultat est donné directement en μs/cm (Rodier et al., 2005). III.3.2.4. Mesure de la turbidité
La turbidité peut être évaluée par un certain nombre de méthodes qui sont pratiquées suivant les nécessités sur le terrain ou au laboratoire. La mesure de la turbidité de l’eau peut s’effectuer en utilisant l’effet Tyndall ou l’opacimétrie. L’effet Tyndall est utilisé plus spécialement pour la mesure des faibles turbidités (eau de boisson), l’opacimétrie est appliquée aux eaux de fortes turbidités (eaux brutes, eaux résiduaires) (Rodier et al., 2009).la mesure de la turbidité est réalisé par cette méthode :
Après remplissage de la cuvette de mesure propre et bien essuyée au papier hygiénique contenant l’échantillon à analyser, bien homogénéisé, la mesure s’effectue rapidement. Il est nécessaire de vérifier l’absence de bulle d’air avant la mesure. La mesure est obtenue directement en Unité de Turbidité Néphélométrique (NTU) (Rodier et al., 2005).
III.3.2.5. Dosage des métaux lourds (cadmium, zinc, cuivre) par spectrophotomètre d’adsorption atomique avec flamme.
Le dosage des métaux lourds à l’aide de spectrophotomètre est se fait par la méthode suivante :
- Diminuer le pH inférieur à 2 par addition d’acide nitrique.
- Nébuliser l’eau à analyser dans une flamme air –acétylènes légèrement oxydante en intercalant de l’eau distillée entre chaque échantillon.
- Effectuer la lecture à la longueur d’onde 283nm. Tenir compte de la valeur lue pour le témoin, se reporter à la courbe d’étalonnage (Savary, 2003).
18 III.3.3. Méthodes d’analyses microbiologiques
III.3.3.1. Critères microbiologiques
Un critère microbiologique applicable à un aliment permet de s’assurer qu’un produit ou un lot de produits est acceptable compte tenu de l’absence ou de la présence du nombre de microorganismes, y compris les parasites, et/ou de la quantité de leurs toxines/métabolites, par unité de masse, de volume, de superficie ou par lot (Joffin et Joffin, 2010).
III.3.3.2. Les équipements et les milieux des cultures
Les équipements doivent permettre aux activités du laboratoire d’être effectuées à la fois efficacement et dans des conditions de sécurités.
Pour produire des données microbiologiques faibles, il est essentiel d’avoir du matériel qui fonctionne bien.
Pour chaque instrument, la nature et la fréquence des vérifications du bon fonctionnement et la personne responsable de ces dernières doivent être indiquées.
Les milieux de culture doivent satisfaire à toutes les exigences nutritives des microorganismes, il peut se présenter sous forme liquide ou solide. Il est préférable d’employer des milieux de culture déshydratés du commerce pour garantir l’informité méthodologique et la commodité des analyses. Toutefois, si un milieu n’est pas disponible dans le commerce, il faut le préparer sur place (les milieux sont préparés selon la norme ISO. 11133-1).
III.3.3.3. Méthode d’analyse et réglementation
La fiabilité de la surveillance de la qualité sanitaire des aliments dépend notamment des méthodes utilisées pour effectuer les analyses :
- Méthodes horizontales et verticales
ISO publie méthodes normalisées par l’analyse microbiologique des produits alimentaires en : Des méthodes horizontales : ce sont des directives générales qui constituent souvent des méthodes de référence certaines sont simplifiées et constituent des méthodes de routine utilisable pour tous les produits.
Des méthodes verticales : sont spécifiques à un produit ou un type de produit (produits carnés, produits de pèche…) et aussi spécifique pour un germe (Exp : les
Staphylococcus aureus dans le lait en poudre) (ISO. 4833-1).
III.3.3.4. Analyses bactériologiques
Les germes recherchés et les méthodes normalisées utilisées sont consignés dans le tableau N°03, N°04.
Chapitre III Matériel et méthodes
19 Tableau N°03 : Germes recherchés selon l’arrête du 24/01/1998, selon les méthodes verticales.
Germes recherchés Méthode d’analyse Principe de la méthode
Germes aérobies à 22°C ISO 6222
Comptage de colonie. Ensemencement en
profondeur sur gélose PCA. Germes aérobies à 37°C
ISO 6222
Comptage de colonie. Ensemencement en
profondeur sur gélose PCA. Coliformes à 37°C
ISO 9308/2
Technique NPP.
Ensemencement en milieu liquide (Lauryl sulfate).
Coliformes fécaux ISO 9308/2
Technique NPP,
ensemencement en milieu liquide (Lauryl sulfate).
Streptocoques D/50ml ISO 7899/1 Ensemencement en milieu liquide (Rothe). C.S.R. à 46°C /1ml ISO 15213 Ensemencement en milieu gélosé en anaérobiose. C.S.R. à 46°C /20ml ISO 15213 Ensemencement en milieu gélosé en anaérobiose.
Tableau N°04 : Germes pathogènes et indicateurs d’hygiènes recherchés selon les méthodes horizontales.
Germes recherchés Méthode d’analyse Principe de la méthode
Salmonella ISO 6579 Nécessite quatre phases
successives : pré-enrichissement, l’enrichissement, isolement, l’identification.
Levures et moisissures ISO 21527-1 Comptage de colonie.
Ensemencement en surface sur gélose DRBC.
Staphylococcus aureus ISO 6 888-3 Dénombrement sur milieu Baird
20 A. Préparation de l’échantillon
La quantité d’échantillon distinguer pour le laboratoire doit être suffisante pour les besoins d’analyse. Pour effectuer une série de dilutions décimales on utilise le diluant Tryptone- Sel – Eau jusqu’à la dilution 10-2
. Selon la méthode suivante :
- préparer un tube à partir de la suspension mère. Pour cette étude les dilutions10-1 et 10-2 sont utilisées.
- Marquer le tube de dilution (10-1, 10-2).
- A l’aide d’une pipette graduée stérile de 10ml, transférer 9ml de TSE dans le tube à vis stérile.
- 1ml de la suspension mère (100) est prélevée par une pipette graduée stérile est introduite dans un tube à vis contenant 9ml de TSE, la pipette ne devant pas pénétrer dans les 9ml de diluant. Il représente la dilution 10-1.
- Homogénéiser soigneusement ce tube, jeter la pipette utilisée dans un conteneur approprié (ISO. 6887-1).
B. La recherche des germes aérobies à 22°C et 37°C
La recherche des germes aérobies est basé sur l’aptitude de microorganismes se développant bien sur milieu ordinaire, ce qui exclut un nombre important de germes : c’est le cas des bactéries filamenteuses, des bactéries sulfureuses et ferrugineuses, des germes anaérobies, etc. Leur détermination est se fait par un prélèvement aseptique à l’aide d’une pipete stérile. 1ml de la dilution 10-0 et placé dans une boite de pétri stérile, puis on coule la gélose PCA et mélanger la boite par un mouvement de forme 8, en faire la même méthode pour l’ensemencement des autres dilutions 10-1
,10-2 (l’ensemencement en masse).
Inverser les boites à leur autre coté et les incuber à 22°C pendent 72h (ISO. 6222 ; Rodier et al., 2009).
C. La recherche des germes aérobies à 37°C
Même méthode pour l’ensemencent des germes aérobies à 22°C sauf que l’incubation et à 37°C pendant 72h.
Chaque boite retenue devra contenir à plus 300 colonies et ou moins 15 colonies (ISO. 6222 ; Rodier et al., 2009). On calcule le nombre N des microorganismes présent dans l’échantillon à l’aide de la formule suivante :
C : la somme des colonies comptées sur toutes les boites retenues. V : le volume de l’inoculum appliqué à chaque boite de pétri en ml. N1 : nombre de boites retenus à la première dilution.
N2 : nombre de boites retenus à la deuxième dilution.
Chapitre III Matériel et méthodes
21 D. Dénombrements des coliformes
Le dénombrement des coliformes permet de révéler la présence ou l’absence d’une contamination fécale. Il est basé sur l’aptitude des coliformes à dégrader le lactose dans un milieu lactosé avec production de gaz, en acidifiant le milieu.la méthode de détermination est se fait par un ensemencement d’une série de 3 tubes avec cloche de Durham comme suivante :
- 10ml échantillon avec 10ml de milieu lauryl sulfate D/C. - 1ml échantillon avec 10ml de milieu lauryl sulfate S/C. - 0.1ml échantillon avec 10ml de milieu lauryl sulfate S/C. - Incuber à 37°C pendant 24h à 48h.
Test confirmatif : coliformes totaux
A partir d’un tube positif de lauryl sulfate, ensemencer par anse de platine quelques goûttes dans un tube contenant 10ml de BLBVB.
Incuber à 37°C pendant 24h à 48h (ISO. 9308-2 ; Rodier et al., 2005). Test confirmatif : coliformes fécaux
A partir d’un tube positif de BLBVB, ensemencer par anse de platine quelques goûttes dans un tube avec cloche contenant 10 ml de bouillon d’Escherichia coli.
- Incuber à 44°C pendant 24h.
-Après l’incubation la présence d’Escherichia coli est indiquée par :
L’apparition d’un anneau rouge cerise témoin de la production d’indol et donc de la présence d’E. coli, à partir de l’ajout de quelques goutte gouttes de réactif de Kovacs (ISO.9308-2 ; Rodier et al., 2005).
E. Recherche et dénombrement des streptocoques fécaux Test présomptif
Pour confirmer ou infirmer une contamination fécale les bactéries donnant une réaction positives avec les milieux d’enrichissement (bouillon glucose à l’azide de sodium ou milieu de Rothe), les Streptocoques fécaux croissent dans ce milieu et fermentent le glucose avec formation d’acide, ce qui provoque le virage de la coloration de l’indicateur de pH du pourpre au jaune et le test confirmatif se fait par l’utilisation de milieu Eva Litsky. Le dénombrement des streptocoques fécaux est se fait selon le protocole suivant :
- A partir de l’eau à analyser, porter aseptiquement on ajoute 50ml dans un flacon contenant 50ml de milieu Rothe D/C.
- L’incubation se fait à 37°C pendant 24 à 48heures.
Les résultats seront considérés comme positif, lorsque le flacon présente un trouble microbien accompagné d’un virage du milieu pendant cette période est présumée contenir un streptocoque fécal.
Test confirmatif
Le test de confirmation est basé sur la confirmation des Streptocoque fécaux éventuellement présents dans le test de présomption.
Le flacon de milieu Rothe positifs, on ajoute quelques goûttes à l’aide d’une pipette Pasteur de milieu Eva Litsky et incuber se fait à 37°C pendant 24heures.
22 Les résultats seront considérés comme positif, les tubes présentant à la fois :
- Un trouble microbien.
- Une pastille violette (blanchâtre) au fond des tubes (ISO. 7899-1 ; Lebres et Mouffok, 2008).
F. Recherche et dénombrement de Clostridium sulfito-réducteurs
La présence des Clostridium sulfito-réducteurs et un indicateur de contamination fécale ou tellurique. Les Clostridium sulfito-réducteurs sont des anaérobies stricts cultivant à 37°C possèdent des sports résistant au moins 10minutes à 80°C, réduisant les sulfates en sulfures selon la réaction suivante :
6H+ + 6é + SO-3- S2- + 3H2O
Le dénombrement se fait comme suit :
Pour 20ml de l’eau à analyser on prend 4 tubes stériles, on met dans chaque tubes 5ml d’échantillon (solution mère). Et dans un autre tube stérile on met 1ml d’échantillon, puis porter au bain marie à 80°C pendant 10min afin de détruire les formes végétatives.
- Faire fondre la gélose TSC, refroidir.
- On coule la gélose TSC en dessus pour garder l’anaérobiose. - Incubation à 46°C pendant 48heures.
Les Clostridium sulfito-réducteurs se développent sous forme de grosse colonies noires dues à la réaction des sulfites qui se précipitant avec les ions de fer, chaque colonies noire est issue d’une spore (ISO. 15213 ; Guiraud et Galzy., 1980).
G. Recherche des staphylocoques
Les Staphylococcus fait l’objet d’une recherche et dénombrement sur le milieu Baird Parker.
- A l’aide d’une pipette pasteur, distribuer dans trois boite de pétrie 0.1ml de la solution mère, sur la surface de 15ml du milieu mis en boite, étaler soigneusement l’inoculum le plus rapidement possible à la surface du même milieu en essayant de ne pas toucher le bord de la boite avec l’étaleur stérile.
- Procéder de la même façon, pour les différentes dilutions : 10-1, 10-2. - La boite sera incubée à 37°C pendant 48h.
- Après 48h d’incubation, le fond de la boite doit présenter des colonies caractéristiques et/ou non caractéristiques.
- Les colonies caractéristiques sont noires, brillantes, convexes et entourées d’un halo clair du à l’hydrolyse des protéines de l’œuf. Des zones opaques dues à l’activité lipolytique peuvent apparaitre plus tardivement (après 24h) dans le halo clair (ISO. 6888-3 ; Joffin et Joffin, 2010).