Royaume du Maroc Université Mohammed V
Faculté de Médecine et de Pharmacie de RABAT
MEMOIRE
En vue de l’obtention du Diplôme National de Spécialité Médicale en
HEPATO-GASTROENTEROLOGIE
Présenté par :
Dr. AZIB Nada
Sous la direction du :
Professeur
ERRABIH Ikram Service de médecine BAnnée universitaire : 2020
La corticothérapie a-t-elle toujours sa place
dans la prise en charge de la Maladie de
À MON MAITRE, ET RAPPORTEUR DE MEMOIRE
LE PROFESSEUR IKRAM ERRABIH
Professeur d’hépato-gastro- entérologie
de la clinique médicale « B », CHU Ibn Sina de Rabat
Nous avons eu de la chance de compter parmi vos étudiants et de profiter de
l’étendue de votre savoir.
Nous tenons à vous déclarer nos remerciements les plus sincères pour avoir
accepté de diriger ce travail et avoir vérifié à son élaboration avec patience et
disponibilité.
Votre dévouement au travail, votre modestie et votre gentillesse imposent le
respect et représentent le model que nous serons toujours heureux de suivre.
Mais au-delà de tous les mots de remerciements que nous vous adressons, nous
voudrons louer en vous votre amabilité, votre courtoisie et votre générosité.
Ce fut très agréable de travailler avec vous pendant tout mon parcours de
spécialisation. Puisse ce travail être à la hauteur de la confiance que vous nous
avez accordée.
Sans vous ce mémoire n’aurait pas vu le jour.
Tout l’honneur vous revient.
À MON MAITRE,
LE PROFESSEUR OUAZZANI LAAZIZA
Professeur d’hépato-gastro-entérologie et chef de service de la clinique
médicale « B » CHU Ibn Sina de Rabat
Qu’il nous soit permis de témoigner à travers ces quelques lignes notre
admiration à la valeur de votre compétence, votre rigueur ainsi que votre
gentillesse, votre sympathie et votre dynamisme.
Vous m’avez accueillie avec amabilité et sympathie durant tout mon parcours,
malgré vos nombreuses occupations professionnelles.
Que ce travail soit une occasion de vous exprimer notre gratitude, de respect et
d’admiration les plus sincères.
À MON MAITRE,
LE PROFESSEUR BENZZOUBEIR NADIA
Professeur d’hépato-gastro-entérologie
Clinique médicale « B» CHU Ibn Sina de rabat
Vous m’avez fortement inspirée par votre compétence ainsi que
vos qualités humaines irréprochables.
Nous ne saurons exprimer à travers ces lignes, notre grande estime et
nos plus vifs remerciements pour Votre culture scientifique, votre compétence,
votre rigueur .
Nous vous prions de trouver dans ce travail le témoignage de notre
reconnaissance et l’assurance de nos sentiments respectueux.
À MON MAITRE
LE PROFESSEUR EL BACHA HICHAM
Professeur assistant d’hépato-gastro-entérologie
J’ai eu l’immense privilège de travailler avec vous ces derniers mois.
Vous avez été une source d’inspiration pour moi, votre sérieux et votre
dévouement sont un exemple à suivre
À MADAME LE DOCTEUR SOUIDINE FARIDA
Spécialiste en hépato-gastro-entérologie
Vous avez laissé un grand vide après votre départ
Durant nos années d’étude, nous avons eu la chance de vous connaitre
Je garde en mémoire le souvenir d’un Médecin très comptent, humble et
toujours souriant
Je n’oublierai jamais votre professionnalisme, votre disponibilité et votre
humanisme.
À TOUS LES MEDECINS DE LA CLINIQUE MEDICALE « B »
A NOS MAITRES DU SERVICE DE MEDECINE C
MADAME LE PROFESSEUR : BENELBEGHDADI IMANE
PROFESSEUR D’HEPATO GASTRO ENTEROLOGIE ET CHEF DE
L’UPR
ET MADAME LE PROFESSEUR : AJAN A FATIMA ZAHRA
CHEF DE SREVICE DE MEDECINE C
CHU Ibn Sina RABAT
Nous vous remercions pour la qualité de votre accueil et votre
professionnalisme sans égal. Vos efforts colossaux nous sont très
encourageants.
Puissent ces mots témoigner de notre grand respect à votre égard.
Nous vous sommes très reconnaissants.
La maladie de Crohn (MC) est une maladie chronique invalidante. Le développement récent de la biothérapie, au premier rang desquels se trouvent les anti-TNF alpha ont fait naître de nouveaux espoirs modifiant la prise en charge de cette pathologie, notamment en termes de sevrage et / ou moins d'utilisation de corticostéroïdes. L'objectif de notre travail est d’étudier la place de la corticothérapie dans la prise en charge de la maladie de Crohn (CD) chez les patients sous anti-TNF.
Matériel et méthodes
Il s'agit d'une étude rétrospective descriptive et analytique étalée sur 7 ans entre janvier 2012 et décembre 2019 au sein de la clinique médicale B du CHU Ibn Sina à Rabat, portant sur 511 patients suivis pour MICI dont 289 Crohn et incluant une série de 36 patients traités par biothérapie (Infliximab ou Adalimumab deux molécules actuellement disponibles chez nous) ayant eu recours à la corticothérapie au moins une fois depuis le diagnostic de leur maladie de Crohn. Pour chaque patient, nous avons analysé : l'âge, le sexe, les antécédents, le type et la localisation de la MC, l’indication et le type d'anti-TNF utilisé, son efficacité notamment en termes de sevrage et / ou de moindre recours aux corticostéroïdes.
Résultats.
Sur un total de 511 cas de MICI, 36 cas de maladie de Crohn sont sous biothérapie (21 sous Infliximab et 15 sous Adalimumab) dont 7 sous combothérapie. L'âge moyen était de 35,9 ans (16-58 ans) avec un sex-ratio de (22F / 14H = 1,5) en faveur des femmes. Avant le début de la biothérapie, tous les patients ont reçu une ou plusieurs cures de corticoïdes orale, 28% (n = 10) ont été mis sous corticothérapie locale et 5,5% (n = 2) ont reçu des corticoïdes injectables. Les anti-TNF ont permis de sevrer 6 patients soit 16,16% cortico-dépendants le recours à la chirurgie a été nécessaire chez un seul patient soit 3%. Les corticoïdes oraux ont été repris pendant le traitement par biothérapie et de manière temporaire chez 3 patients soit 8,3% ayant un Crohn iléocolique (2 patients sous Adalimumab
et un patient sous Infliximab). Le nombre de perfusions d’infliximab reçues avant la poussée nécessitant la reprise des corticoïdes était de 4 perfusions (S0, S2, S6, S8) et le nombre moyen d'injections d'Humira était de 20 injections.
Conclusion :
Cette étude dans la vraie vie met en exergue que les biothérapies ont permis une meilleure prise en charge de nos patients, avec un sevrage et/ou un moindre recours aux corticoïdes, une cicatrisation muqueuse, une cicatrisation des fistules, et une diminution du recours à la chirurgie.
LISTE
5-ASA : 5-aminosalicylés
6-MP : 6-mercaptopurine
ADA : Adalimumab
AMM : Autorisation de mise sur le marché
AZA : Azathioprine
CBP : Cortisol binding protein
CDAI : Crohn’s disease activity index
CHARM : Candesartan in Heart Failure Assessment of Reduction in
Mortality and morbidity
CM : Cicatrisation muqueuse
CRH : Corticotropin releasing hormone
CRP : Protéine C réactive
ECCO : European Crohn’s and Colitis Organization
ECCO : European Co-operative Crohn’s disease Study
FC : Fragment cristallisable
GR : Glucocorticoids
IFX : Infliximab
IgG1 : Immunoglobulines G1
MC : Maladie de Crohn
MICI : Maladie inflammatoire chronique intestinale
NCCDS : National Cooperative Crohn's disease Study
RCH : Rectocolite hemorragique
SES-CD : Simple Endoscopic Score for Crohn Disease
SU : Step up
TD : Top down
TNF : Tumor Necrosis Factor Receptor
LISTE
Liste des tableaux
Tableau 1 : type d’intervention chirurgicale avant l’introduction des
biothérapies... 19
Tableau 2 : approche thérapeutique par Infiliximab chez nos patients ... 20 Tableau 3 : approche thérapeutique par Adalimumab chez nos patients ... 21 Tableau 4 : Médicaments capables de modifier l’histoire naturelle de la MC .. 42
Liste des figures
Figure 1 : mécanismes d’action des corticoïdes ... 8
Figure 2 : Répartition des patients selon le sexe ... 14
Figure 3 : Topographie des lésions selon la classification de Montréal ... 16
Figure 4 : Profil de la MC selon la classification de Montréal ... 16
Figure 5 : Différents traitements pris avant l’introduction des biothérapies ... 18
Figure 6 : lésions tissulaires cumulées dans la MC au cours de son évolution (Score de Lémann) ... 32
Figure 7 : Essai CHARM pour le maintien de la rémission par l’adalimumab au cours de la MC ... 35
Figure 8 : Différentes stratégies thérapeutiques utilisées dans la MC ... 39
Figure 9 : définition de la rémission profonde précoce ... 39
Figure 10 : Stratégie Step-up vs. top-down ... 43
REMERCIEMENTS ... RESUME ... LISTE DES ABREVIATIONS ... LISTE DES ILLUSTRATEUR ...
INTRODUCTION ... 1
RAPPELS SUR LES CORTICOIDES ... 4
I. Historique ... 5
II. Mécanisme d’action des corticoïdes ... 6
III. Corticorésistance : Définition ... 9
IV. Corticodépendance : Définition ... 9
MATERIEL ET METHODES ... 10
I. Lieu d’étude ... 11
II. Type et période de l’étude ... 11
III. Recueil des données ... 11
IV. Critères d’inclusion ... 11
V. Suivi ... 12 RESULTATS ... 13 I. Données épidémiologiques ... 14 A. Age ... 14 B. Sexe ... 14 C. Antécédents ... 14
II. Caractéristiques de la maladie de Crohn ... 15
A. Symptomatologie clinique ... 15
B. Localisation/ Phénotype ... 15
C. Lésions ano périnéales... 17
D. Les manifestations extra digestives : ... 17
III. Traitement antérieur avant anti TNF ... 17
A. Traitement médical ... 17
IV. Traitement par biothérapies ... 19
A. Indications ... 19
B. Types d’ANTI TNF administrés ... 19
C. Evolution sous anti TNF ... 22
DISCUSSION ... 23
I. Traitement par corticoïdes ... 24
A. Exposition aux corticoïdes ... 24
B. Efficacité des corticoïdes dans l’induction de la rémission ... 24
1. Corticoïdes systémiques ... 25
2. Budésonide ... 25
C. Indication des corticoïdes dans la maladie de Crohn selon ECCO ... 26
D. Posologie des corticoïdes dans la maladie de Crohn ... 26
1. Corticoïdes systémiques ... 26
2. Budesonide ... 28
3. Corticoïdes par voie rectale : bétaméthasone et hydrocortisone ... 29
E. Principaux effets indésirables des corticoïdes. ... 29
F. Précautions et surveillance. 35 ... 30
G. Inefficacité des corticoïdes dans le maintien de la rémission. ... 31
II. Traitement par ANTI TNF ... 33
A. Molécules ... 33
1. L’infliximab ... 33
2. L’adalimumab ... 33
3. Le certolizumab ... 34
B. Intérêt des anti TNF dans l’induction et le maintien de la rémission de la MC réfractaire aux traitements conventionnels ... 34
1. Infliximab ... 34
2. Adalimumab ... 35
C. Recommandation pour le traitement de la MC en fonction de la localisation et de la sévérité de la maladie selon ECCO ... 36
D. Stratégies thérapeutiques dans la MC ... 37
E. Step Up Vs Top Down ... 42
CONCLUSION ... 46
ANNEXES ... 48
1
2
La maladie de Crohn (MC) est une maladie inflammatoire chronique intestinale pouvant toucher tout le tube digestif de la bouche à l’anus évoluant par poussées entrecoupées de rémission.
Les causes de l’inflammation ne sont pas encore connues et sont vraisemblablement multiples, impliquant des facteurs génétiques, auto-immuns et environnementaux.
Le comportement de la maladie décrit comme inflammatoire (B1), sténosant (B2), fistulisant (B3) définit le phénotype clinique sur la base de la classification de Montréal, la maladie de Crohn s'exprime, au niveau anopérinéal, par trois types de lésions : les ulcérations, les suppurations et les sténoses.
De nombreux médicaments existent pour le traitement de la maladie de Crohn, mais ils présentent des limites. Le schéma thérapeutique peut varier selon le phénotype de la maladie et son intensité.
Le traitement conventionnel repose sur des anti-inflammatoires locaux, des corticoïdes, des immunosuppresseurs puis des anticorps anti-TNFα dans les formes plus sévères.
Les corticoïdes ont été historiquement les premiers à faire preuve de leur efficacité dans le traitement des poussées modérées à sévères de la MC. Ils permettent une régression rapide des symptômes dans 60 à 90% des cas cependant, ils ont des effets secondaires fréquents notamment une corticodépendance, dans près d’un tiers des cas, avec des complications métaboliques et osseuses rajoutant a ça leur inefficacité pour le maintien de la rémission.
Tout cela limite leur emploi et pousse à instaurer un traitement associé adéquat à base d’immunosuppresseur et/ou d’une biothérapie.
Depuis une dizaine d’années, les biothérapies, au 1er rang desquelles figurent les agents anti-tumor necrosis factor (anti-TNF), ont révolutionné la prise en charge des patients atteints de MC réfractaire au traitement standard. Ces avancées
3
thérapeutiques sont toutefois contrebalancées par un risque d’infections sévères d’environ 4 %, et d’un possible sur risque de lymphomes. Certains auteurs ont suggéré que les biothérapies ciblées, qui peuvent induire une cicatrisation complète des lésions intestinales, pourraient modifier l’histoire naturelle de la MC si elles étaient prescrites précocement chez les malades, permettant ainsi d’éviter une évolution défavorable.
Peut-on aujourd’hui avoir une maladie de Crohn et ne jamais recevoir de corticoïdes ? En dehors des formes ultra bénignes et qui le restent toute la vie (c’est une exception, sans doute moins de 10 % des cas), c’est impossible compte tenu de l’expression symptomatique des poussées franches et de la rapidité d’action des corticoïdes. Les corticoïdes paraissent encore incontournables dans une forme sévère de maladie de Crohn débutante. Mais les conséquences sont de moins en moins acceptées, et plus redoutés et il existe, et existera d’autres possibilités thérapeutiques.
L’objectif de notre étude est de déterminer si la prescription des corticoïdes a encore un avenir face à la place grandissante que prennent les biothérapies dans la prise en charge de la MC.
Nous étudierons aussi les évidences scientifiques concernant l’efficacité des corticoïdes dans la rémission de la MC, leurs limites d’utilisation, les autres alternatives thérapeutiques et leur impact sur l’histoire naturelle de la MC, et ensuite nous tenterons de dégager une proposition d’utilisation pratique de ces traitements selon les recommandations de l’ECCO.
4
RAPPELS SUR LES
CORTICOIDES
5
I. Historique
Tadeus Reichstein (1897–1996), Professeur à la faculté de pharmacie de Bâle fut considéré comme le précurseur de la chimie des stéroïdes. Il isola durant les années 1930, plus de vingt dérivés hormonaux biologiquement actifs (1). Edward Calvin Kendall (1886–1972), chimiste américain spécialisé dans le domaine de la chimie endocrinienne, avait isolé, dès 1936, la 11 -déhydrocorticostérone. On commençait à comprendre les relations entre les structures chimiques et l’action physiologique et donc la pharmacologie de ces stéroïdes.
C’est à Rochester, dans la Mayo Foundation, qu’Edward Calvin Kendall et ses collaborateurs (2), s’étaient lancés dès 1933 dans la purification des extraits corticosurrénaliens qu’on avait nommé « cortine » (3). Dès 1939, Kendall avec l’aide de Lewis Sarett prépara le composé E nommé « cortisone » (4).
La synthèse totale de la cortisone a été réussie en 1952 (5). Edward Kendall partagea son espoir thérapeutique dans le domaine de la polyarthrite rhumatoïde avec Philip S. Hench, fondateur du premier service de rhumatologie « Arthritis Service », en 1926 (5). Pour la première fois une patiente souffrant de polyarthrite rhumatoïde était traitée par cette hormone et l'amélioration était spectaculaire (5). Hench, Kendall et Reichstein partagèrent le prix Nobel de médecine et physiologie en 1950 (6).Dans une revue thérapeutique datée de 1951, Randall Sprague, de la Mayo Clinic, décrivit les multiples effets de la corticothérapie (7). Entre autres, la cortisone a une action anti-inflammatoire en particulier sur la synoviale, modifie la prolifération des lymphocytes et des éosinophiles, manifeste des propriétés antiprolifératives, est antiallergique et minimise les réactions d’hypersensibilité, y compris pour les réactions consécutives aux infections bactériennes ou aux manifestations inflammatoires, améliore les symptômes des maladies intestinales inflammatoires (8).
6
interniste du Saint Mary's Hospital à Londres, indiqua une liste non exhaustive des maladies et situations cliniques pour lesquelles ce traitement était indiqué : rhumatisme articulaire, colite ulcéreuse, dermatomyosite, polyarthrite rhumatoïde, leucémie lymphoïde, psoriasis, lupus érythémateux disséminé, asthme, érythème noueux, urticaire.Dans le domaine des maladies inflammatoires chroniques intestinales, Truelove publia, en 1955, le premier essai contrôlé en aveugle chez les patients atteints de RCH, et démontra que les corticoïdes étaient efficaces et diminuaient la mortalité par rapport au placebo (9).
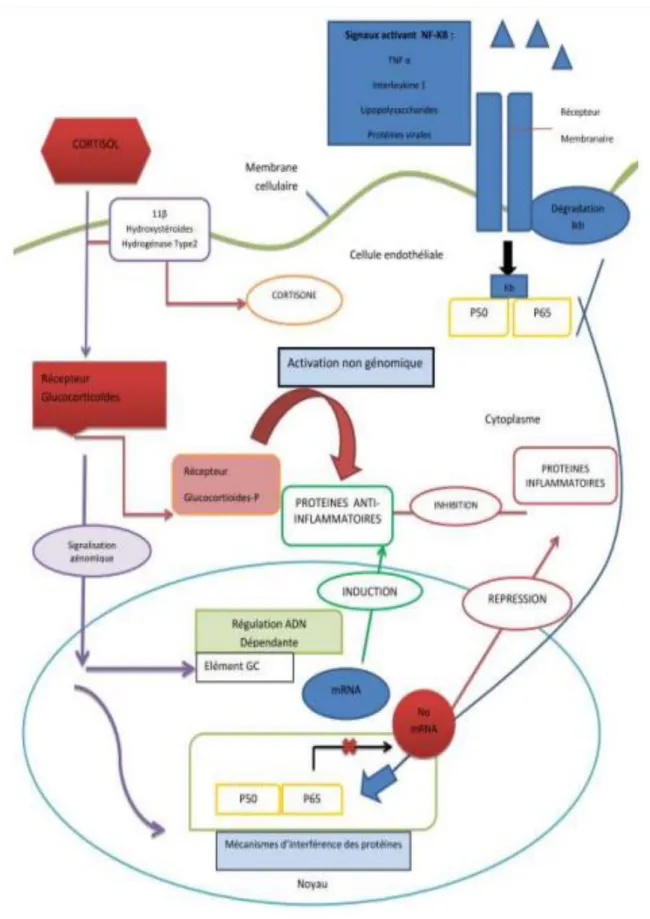
II. Mécanisme d’action des corticoïdes
L’hypothalamus contrôle la sécrétion de la CRH (corticotropin releasing hormone) dans le système portal hypophysaire. En retour, la CRH stimule la sécrétion de corticotropine par l’hypophyse antérieure. La corticotropine stimule la synthèse et la sécrétion du cortisol par le cortex surrénalien (8). 90 % du cortisol endogène est fixé au transporteur cortisol binding protein (CBP) (3). Seule la fraction libre circulante exerce une activité biologique et est transformé en cortisone par la 11 β hydroxystéroïde déshydrogénase de type 2. A l’inverse, la 11 β hydroxysteroide déshydrogénase de type 1 convertit la cortisone en cortisol (10).
Le récepteur des glucocorticoïdes (GR) est un membre de la famille des stéroïdes– hormone-récepteurs, qui appartient à la famille des facteurs de transcription (8). Il se lie au cortisol avec une forte affinité (11). Le gène du récepteur de GC humain NR3C1 est localisé sur le chromosome 5q32-32 et possède 9 exons (12). La variation de structure et d’expression du gène produit une diversité de signalisation (12).
7
Au niveau de la cellule, le cortisol agit par le biais de 3 voies différentes (Figure
1). Le complexe CGR –cortisol migre vers le noyau où il se lie aux séquences
d’ADN appelées glucocorticoïdes responsive éléments qui facilite ou inhibe la transcription par ARN polymérase II (transactivation et transrepression). Par ailleurs, il existe une régulation d’autres gènes impliquant une interaction complexe cortisol-GR avec d’autres facteurs de transcription comme le NF KB (13). Enfin, il y a la mise en œuvre d’une signalisation transmembranaire associée au récepteur et un second messager (voie non génomique) (7).
Il a été mis en évidence que le récepteur aux glucocorticoïdes inhibe l’inflammation en utilisant ces 3 mécanismes d’action (13). Il existe des effets directs et indirects sur le génome ainsi que des mécanismes n’impliquant pas de génome (13). Les glucocorticoïdes ainsi que leurs récepteurs sont à l’amont des voies de régulations et bloquent différentes voies d’inflammation. Ils peuvent inhiber la production de prostaglandines par activation de l’annexite 1 et de la Cyclooxygénase 2 (14). Une seconde protéine anti inflammatoire est induite par les GC : la MAPK phosphatase 1.
Les cytokines, infections bactériennes et rayons UV activent les cascades de MAPK. Les complexes GC-GCR interagissent aussi avec NFKB pour bloquer son activité transrationnelle (15). Le TNFα, l’IL-1, les pathogènes microbiens, les infections virales et autres signaux inflammatoires activent des voies de signalisation qui activent IkB kinases.
Des travaux suggèrent que les GC peuvent avoir un effet rapide sur l’inflammation par un mécanisme non génomique, le mieux décrit étant l’activation de l’oxyde nitrique synthétase endothéliale (16).
Les principaux glucocorticoïdes de synthèse utilisés pour le traitement des MICI sont : la prednisone (Cortancyl®), la prednisolone (Hydrocortancyl®, Solupred®), et la méthylprednisolone (Médrol®, Solu-Médrol®)
8
9
III. Corticorésistance : Définition
Selon le consensus ECCO de 2012, la cortico-résistance est définie comme la persistance d’une maladie active malgré un traitement par prednisolone à une dose supérieure à 0.75mg/kg/j sur une période de 4 semaines (17).
IV. Corticodépendance : Définition
La Corticodépendance, est définie par :- l’impossibilité de réduire la dose de corticoïdes en dessous d’un équivalent prednisolone de 10mg/jour dans les 3 mois suivants le début des corticoïdes - Ou la survenue d’une récidive dans les 3 mois suivant l’arrêt des corticoïdes. Ces limites sont arbitraires. Cependant il s’agit de celles utilisées dans les essais cliniques (17).
10
MATERIEL
ET METHODES
11
I. Lieu d’étude
Notre étude a été menée au sein du service d’Hépato-Gastroentérologie et Proctologie Médecine B du CHU Ibn Sina Rabat.
II. Type et période de l’étude
Il s’agit d’une étude rétrospective descriptive et analytique étalée sur 7 ans entre janvier 2012 et décembre 2019 portant sur 511 patients suivi pour MICI dont 289 Crohn et incluant une série de 36 patients traités par biothérapies ayant eu recours une ou plusieurs fois à la corticothérapie.
III. Recueil des données
Les informations sont recueillies à partir de l’étude des dossiers de patients exploités selon une fiche préétablie (annexe1) comportant les données épidémiologiques cliniques des malades, les caractéristiques de la MC (la localisation, le profil de la maladie, l’indication, le type de l’anti TNF et de la corticothérapie utilisée ainsi que leurs voies d’administration), leurs suivis (efficacité, échec).
IV. Critères d’inclusion
Nous avons inclus dans notre étude tous les patients ayant une maladie de Crohn dont le diagnostic de certitude a été posé sur des critères cliniques, endoscopiques, morphologiques, histologiques, biologiques et évolutifs.
Tous nos patients ont été traités par au moins trois perfusions d’Infliximab à la dose de 5mg/kg aux semaines 0,2,6 puis toutes les huit semaines, ou au moins quatre injections d’Adalimumab en sous cutanée à la dose d’attaque de 80mg suivie de 40mg à la deuxième semaine puis toutes les semaines. Les contre-indications ont été strictement respectées.
12
Les indications des anti TNF dans notre série étaient la maladie de Crohn fistulisante, et /ou en échec aux traitement conventionnels (immunosuppresseur, Corticodépendance, Corticorésistance) ou une récidive post opératoire appréciée par le score de Rutgeerts (annexe2).
L’échec à l’Imurel est défini par la persistance de la symptomatologie clinique au-delà de six mois de traitement à une dose adapté (2 à 2,5mg/kg/j).
Nos patients avaient au moins reçu depuis le diagnostic de leur MC une ou plusieurs cures de corticoïde systémique à la dose de 1mg/kg/j pendant 2 à 4 semaines (prednisone, prednisolone, méthylprednisolone), corticoïdes topiques (suppositoires, lavements) ou corticoïdes à libération intestinale : budésonide à la dose de 9 mg/j en une prise pendant 4 semaines.
Les indications de la corticothérapie dans notre série étaient la maladie de Crohn (iléale étendue, iléo colique, colique) en poussée modérée à sévère.
V. Suivi
L’efficacité des corticoïdes a été évaluée par le score de Lichtiger (annexe3) en cas de poussée sévère et le score de Harvey-Bradshaw (annexe 4) ou l’indice de Best en cas de poussée modérée (annexe 5), l’activité endoscopique a été évaluée par le score SES-CD (annexe 6).
L’efficacité du traitement par Infliximab ou Adalimumab a été évaluée, à l’occasion de chaque nouvelle perfusion ou injection par l’indice de Best.
L’efficacité a été définie par la rémission de la maladie grâce au score clinique d’activité de la maladie CDAI établi sur 7 jours inférieur à 150 points, une cicatrisation muqueuse, et une régression des lésions morphologiques à l’entéro scanner ou l’entéro IRM. Pour les patients corticodépendants et /ou cortico résistants l’efficacité a été évaluée par une sevrage et/ou un moindre recours aux corticoïdes.
13
14
I. Données épidémiologiques
Entre janvier 2012 et décembre 2019, 289 patients atteints de maladie de Crohn ont été recensés dont 36 sous anti TNF (21 sous Infliximab et 15 sous Adalimumab) répondant à nos critères d’inclusion.
A. Age
L’âge moyen de nos patients était de 35,9 ans avec des extrêmes d’âge allant de 16 à 58 ans.
B. Sexe
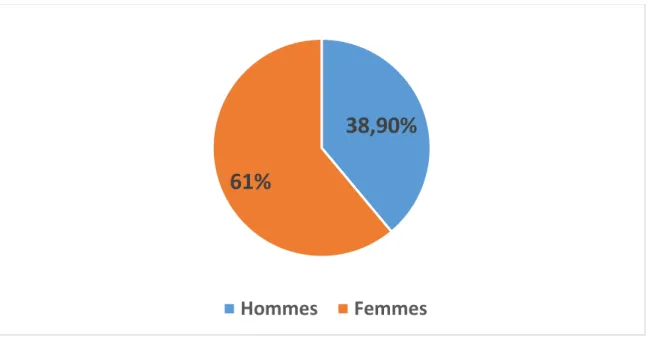
Notre travail a porté sur 36 patients dont 14 de sexe masculin (soit 38,9%) et 22 de sexe féminin (soit 61%) avec un sex-ratio de (22F/14H=1,5) en faveur des femmes.
Figure 2 : Répartition des patients selon le sexe
C. Antécédents
Dans notre série deux patients ont un antécédent d’appendicectomie (5,55%) un seul cas de maladie de Crohn familiale est rapporté (2,8%) et une notion de tabagisme actif chez 4 patients (11%).
38,90%
61%
15
II. Caractéristiques de la maladie de Crohn
A. Symptomatologie clinique
- Diarrhée : il s’agissait de diarrhée chronique > 3 selles par jour, liquidienne en cas d’atteinte iléale, glairosanglante en cas de lésions coliques.
- Douleurs abdominales : à type de crampes au niveau de la fosse iliaque gauche ou à type syndrome de Koenig dans les formes sténosantes.
- Syndrome dysentérique : fait d’épreintes, ténesmes, faux besoins et d’une diarrhée afécale glaireuse et muco-purulente associée, parfois sanglante.
B. Localisation/ Phénotype
Au terme du bilan endoscopique et radiologique, la localisation et le phénotype de la maladie de Crohn chez les patients de notre série a été caractérisé selon la classification de Montréal.
L’atteinte iléo colique (L3) étaient prédominante retrouvé chez 19 de nos patients soit (52,7%) suivie par l’atteinte colique (L2) chez 10 patients soit (27,7%) l’atteinte iléal +/- caecale (L1) chez 5 patients soit (14%) à noter deux cas de MC étendue soit (5,6%).
16
Figure 3 : Topographie des lésions selon la classification de Montréal
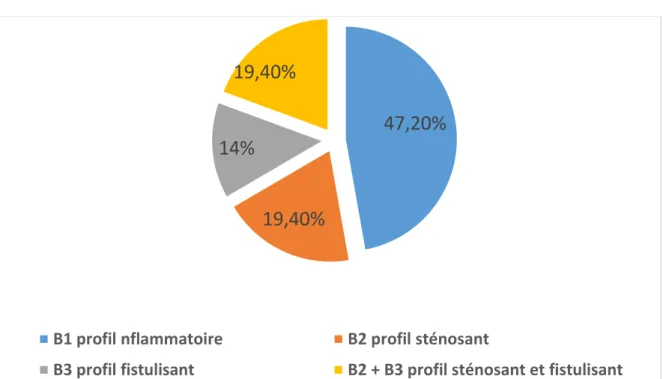
17 patients avaient un profil inflammatoire (B1) soit (47,2%), 7 patients avaient un profil sténosant (B2) soit (19,4%), 5 patients avaient un profil fistulisant(B3) soit (14%) et 7 patients avaient un profil à la fois sténosant et fistulisant (B2+B3) soit (19,4%).
Figure 4 : Profil de la MC selon la classification de Montréal 14%
27,70% 52,70%
L1 iléo coecale L2 colique L3 iléo colique
47,20%
19,40% 14%
19,40%
B1 profil nflammatoire B2 profil sténosant
17
C. Lésions ano périnéales
Les lésions ano périnéales ont été retrouvées chez 29 patients (80%) avec la possibilité de l’existence concomitante de deux voir même de trois types de lésions : les abcès et les fistules anales étaient l’atteinte ano périnéale prédominante.
D. Les manifestations extra digestives :
L’atteinte articulaire dans notre série a été retrouvée chez 15 patients soit 41,6% cette atteinte était dominée par les arthralgies inflammatoires périphériques. L’examen cutanéo muqueux systématique de nos malades avait retrouvé un Pyedorema Gangrenosum chez un patient soit (2,8%) et un érythème noueux chez deux patients soit (5,6%).
L’atteinte oculaire a été notée chez un patient représentée par une uvéite antérieure.
III. Traitement antérieur avant anti TNF
A. Traitement médical
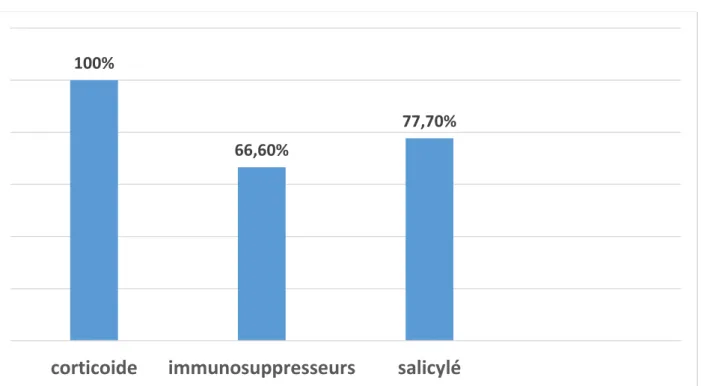
L’étude des dossiers de patients a permis de mettre en évidence qu’au moins 77,7% des patients (n=28) ont été traités par dérives salicylés.
Avant l’instauration de biothérapie, tous nos patients avaient reçu un traitement à base de corticoïdes.
Tous les patients avaient reçu au moins une cure de corticoïde orale à la dose de 0.75 à 1 mg/kg/jr pendant une période de 4 semaines en pleine dose suivie d’une dégression progressive.2 patients soit (5,5%) avaient reçu des Corticoïdes injectables pour une poussée sévère de Crohn colique, et 10 patients soit (28%) avaient été mis sous Corticothérapie locale.2 cas seulement ont reçu du budésonide. Ces deux patients étaient de sexe féminin et avaient une maladie de
18
Crohn iléo colique droite en poussée légère à modérée, la dose d’attaque était de 9mg/jour pendant six semaines en prise unique le matin, suivie d’une dégression progressive de 3mg/mois jusqu’à l’arrêt complet au bout de 12 mois. Un nombre important des patients 66,6% soit (n=24) a bénéficié d’un traitement par immunosuppresseurs de type azathioprine (2-2,5mg/kg/j) ou 6 mercaptopurine (1à1,5mg/kg/j).
Figure 5 : Différents traitements pris avant l’introduction des biothérapies
B. Traitement chirurgical
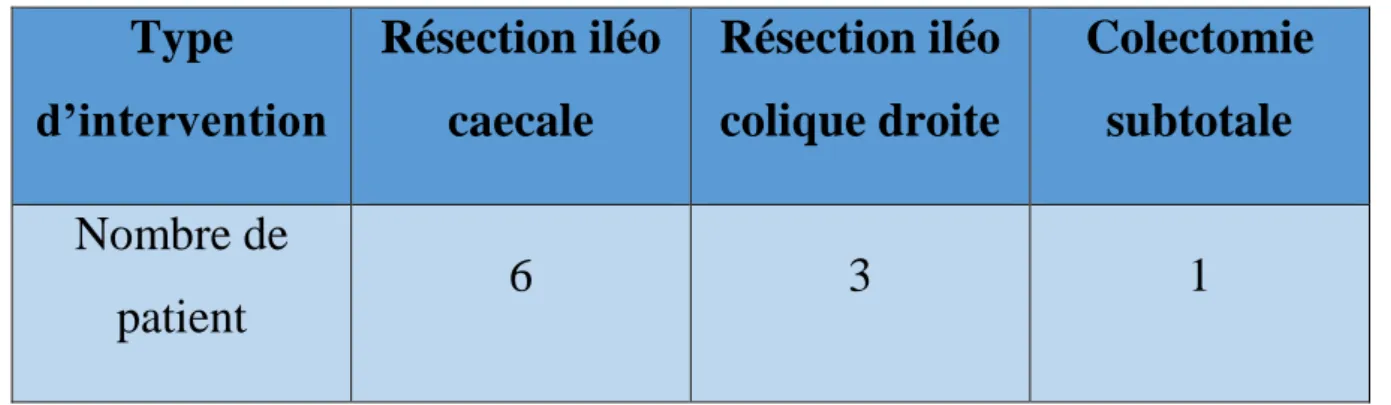
Avant l’introduction des biothérapies 10 soit 28% de nos patients ont eu recours à une chirurgie soit d’emblée ou au cours de l’évolution.
- 6 patients soit (16,6%) avaient eu une résection iléo caecale.
- 3 patients soit (8,33%) avaient eu une résection iléo colique droite. - 1 patient soit (2,8%) a eu une colectomie subtotale.
100%
66,60%
77,70%
19
Tableau 1 : type d’intervention chirurgicale avant l’introduction des biothérapies
IV. Traitement par biothérapies
A. Indications
Dans notre série les biothérapies ont été prescrits chez 36 patients atteints de maladie de Crohn (dont 21 sous Infliximab, et 15 sous Adalimumab) et selon un schéma d’escalade thérapeutique selon les recommandations de l’ECCO 2017. Dont :
- 29 cas (80,5%) ayant une maladie de Crohn fistulisante - 11cas (30,5%) ayant présenté une corticodépendance - 3cas (8,3%) ayant présenté une corticorésistance
- 12cas (33,3%) ayant présenté un échec aux traitements conventionnels (salicylés, immunosuppresseurs)
- 2cas (5,5%) de récidive post opératoire avec un score de Rutgeerts > i2
B. Types d’ANTI TNF administrés
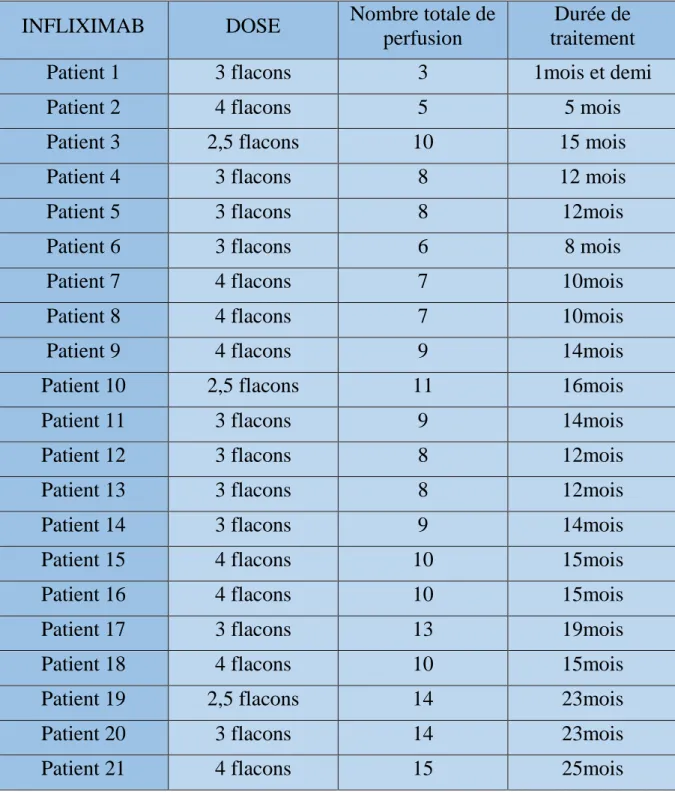
Dans notre série 21 patient ont été traités par infiliximab à la dose de 5mg/kg à la semaine 0,2,6 puis toutes les 8 semaines. Le nombre moyen de perfusions pour l’ensemble des patients était de 6,74 avec des extrêmes allant de 3à 15. La durée moyenne de prise était de 9,35 mois (2à 21 mois).
Type
d’intervention
Résection iléo
caecale
Résection iléo
colique droite
Colectomie
subtotale
Nombre de
patient
6
3
1
20
Tableau 2 : approche thérapeutique par Infiliximab chez nos patients
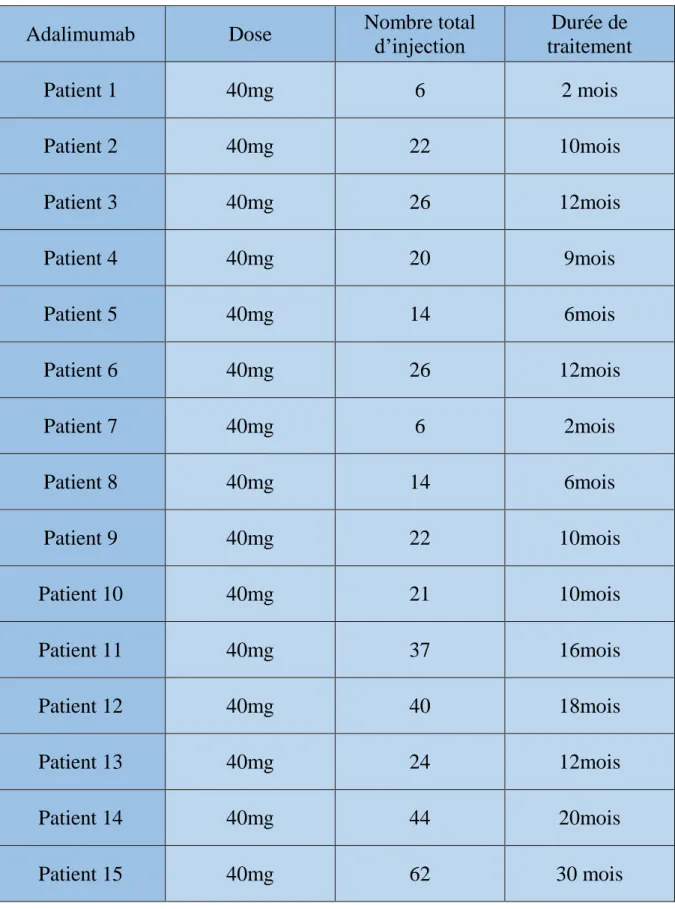
15 patients ont été traités par Adalimumab à la dose de 80 mg à S0 et 40mg à S2 puis 40 mg toutes les deux semaines. Le nombre moyen d’injections était de 32,2 avec des extrêmes allant de 6 à 62. La durée moyenne de la prise était de 15,3 mois avec des extrêmes allant de 2 à 30 mois.
INFLIXIMAB DOSE Nombre totale de
perfusion
Durée de traitement
Patient 1 3 flacons 3 1mois et demi
Patient 2 4 flacons 5 5 mois
Patient 3 2,5 flacons 10 15 mois
Patient 4 3 flacons 8 12 mois
Patient 5 3 flacons 8 12mois
Patient 6 3 flacons 6 8 mois
Patient 7 4 flacons 7 10mois
Patient 8 4 flacons 7 10mois
Patient 9 4 flacons 9 14mois
Patient 10 2,5 flacons 11 16mois
Patient 11 3 flacons 9 14mois
Patient 12 3 flacons 8 12mois
Patient 13 3 flacons 8 12mois
Patient 14 3 flacons 9 14mois
Patient 15 4 flacons 10 15mois
Patient 16 4 flacons 10 15mois
Patient 17 3 flacons 13 19mois
Patient 18 4 flacons 10 15mois
Patient 19 2,5 flacons 14 23mois
Patient 20 3 flacons 14 23mois
21
Tableau 3 : approche thérapeutique par Adalimumab chez nos patients
Adalimumab Dose Nombre total d’injection Durée de traitement Patient 1 40mg 6 2 mois Patient 2 40mg 22 10mois Patient 3 40mg 26 12mois Patient 4 40mg 20 9mois Patient 5 40mg 14 6mois Patient 6 40mg 26 12mois Patient 7 40mg 6 2mois Patient 8 40mg 14 6mois Patient 9 40mg 22 10mois Patient 10 40mg 21 10mois Patient 11 40mg 37 16mois Patient 12 40mg 40 18mois Patient 13 40mg 24 12mois Patient 14 40mg 44 20mois Patient 15 40mg 62 30 mois
22
C. Evolution sous anti TNF
Les 36 patients ont bien répondu au traitement d’induction après une évaluation clinico biologique par le score de Best et cela deux semaines après la fin de la sixième semaine S6.
Chez 29 patients soit (80,5%) le traitement d’induction par biothérapie a induit une amélioration des symptômes cliniques avec cicatrisation muqueuse une régression des lésions morphologiques et une diminution du score de Best <150. Trois patients ont eu une amélioration clinique partielle durant le traitement d’induction, ce qui a conduit à un doublement de dose pour l’Infliximab vu que le taux résiduel d’infliximab était bas respectivement (0,7 µg/mL,1 µg/mL,2,5µg/Ml (VN :3,0-7,0)).
Chez quatre patients aucune amélioration significative des symptômes n’a été noté ce qui a conduit à un switch vers un autre anti TNF après que le dosage des anticorps est revenu positif.
Les anti-TNF ont permis de sevrer 6 patients corticodépendants. Les corticoïdes per os étaient repris au cours du traitement par biothérapie et de manière temporaire chez 3 patients ayant une maladie de Crohn iléo colique (2 patients sous Adalimumab et un patient sous Infliximab). Le nombre de perfusions d’infliximab reçues avant la poussée ayant nécessité la reprise des corticoïdes était de 4 perfusions (S0, S2, S6, S8) et le nombre moyen d’injections d’Humira est de 20 injections.
Chez les 6 patients qui ont présenté une complication à type de sténose sous anti-TNF, le recours à la chirurgie a été nécessaire chez 1 patient présentant une sténose iléo caecale ayant bénéficié d’une résection iléo-caecale.
23
24
I. Traitement par corticoïdes
A. Exposition aux corticoïdes
Le traitement qui a été le mieux analysé dans les études en population sur la MC est la corticothérapie. Dans une étude danoise ayant inclu 196 patients avec une MC diagnostiquée entre 1979 et 1987, après un suivi médian de 3,4 ans, 56 % des patients avaient été exposés aux corticoïdes et 84 % d’entre eux avaient été traités pendant la première année suivant le diagnostic (18).
Dans une étude concernant la cohorte MICI de Nancy, les probabilités de recevoir des corticoïdes dans les 5 années suivant le diagnostic de la maladie de Crohn est de71% (19).
Une étude Canadienne, publiée en 2014, portant sur une base de données de population MICI, montre que l’exposition cumulée aux corticoïdes n’est pas diminuée chez les patients diagnostiqués pendant l’ère des biothérapies. La proportion de patients atteints de MICI ayant reçu une prescription de corticoïdes dans les 1, 5 et 10 ans suivants le diagnostic était de 35%, 52.0% et 62% respectivement (20).
Aujourd’hui en dehors des formes ultra bénignes (moins de 10%), c’est quasi impossible, compte tenu de leur efficacité et rapidité d’action, d’avoir une MC et ne jamais recevoir des corticoïdes. (21-22) Ces données concordent avec les résultats de notre étude et expliquent le fait que tous nos patients ont reçu des corticoïdes par voie systémique.
B. Efficacité des corticoïdes dans l’induction de la rémission
La corticothérapie garde une place importante dans la prise en charge de la maladie de Crohn en poussée, et n’a aucune place dans le traitement d’entretien et donne une rémission dans 90% des cas.
25
Dans la maladie de Crohn, deux types de corticoïdes peuvent être utilisés, les corticoïdes systémiques et le budésonide, corticoïde à action locale intestinale avec un faible passage systémique. (22)
1. Corticoïdes systémiques
Deux essais majeurs ont montré que les corticoïdes étaient efficaces pour induire une rémission de la MC. La première menée par « la National Cooperative Crohn's disease Study » (NCDDS) portant sur162 patients, ayant obtenu une rémission de 60% avec une dose d’attaque de 0,5 à 0,75 mg / kg / jour de prednisone orale avec une dégression sur 17 semaines, contre 30% sous placebo .(23-24) L'étude comparable sur 18 semaines de « l’European Co-operative Crohn’s Disease Study » (ECCDS) portant sur 105 patients a atteint une rémission de 83% sous 6-méthylprednisolone orale à la dose de 1 mg / kg / jour contre 38% sous placebo .(25)
2. Budésonide
Une revue systématique publiée en 2018 (26), ayant inclus des études randomisées contrôlées pour montrer l’efficacité du budésonide dans l’induction et le maintien de la rémission clinique à huit semaines à un an, a montré qu’une dose de 9mg/j de budésonide est plus efficace que le placebo pour induire une rémission clinique dans la MC iléocæcale active, mais moins efficace que les corticoïdes classiques en particulier chez les patients en poussée sévère ou ayant un Crohn pancolitique.
Une dose de 9 mg par jour pendant huit semaines, suivi d'un sevrage de la dose à l'arrêt, est considéré comme le schéma posologique optimal.
26
C. Indication des corticoïdes dans la maladie de Crohn selon
ECCO
-Atteinte étendue du grêle en poussée modérée à sévère :
Les corticoïdes systémiques sont recommandés à la dose de 0,75 à 1 mg/kg/j permettent l'obtention d'une rémission clinique entre 3 à 7 semaines.
-Atteinte iléocaecale :
En cas de poussée minime : le budésonide à la dose de 9 mg/jour
En cas de poussée modérée : le budésonide ou les corticoïdes classiques En cas de poussée sévère : les corticoïdes classiques sont recommandés. -Atteinte colique :
Les corticoïdes classiques sont recommandés en cas de poussée, dans la maladie de Crohn colique, associés à des lavements en cas d’atteinte distale.
D. Posologie des corticoïdes dans la maladie de Crohn
1. Corticoïdes systémiques
Les spécialités disposant d’une AMM dans ce cadre sont répertoriées dans le tableau ci-dessous (27).
Recommendation 1.3. ECCO CD Treatment GL [2019]
In patients with active, moderate-to-severe Crohn’s disease, we suggest the use of systemic corticosteroids for the induction of clinical response and remission
27
La posologie utilisée pour un traitement d’attaque chez l’adulte est comprise entre 0,75 et 1 mg/kg/j d’équivalent prednisone, soit 0,075 à 0,15 mg/kg/j de dexaméthasone ou bétaméthasone, ou 0,4 à 0,8 mg/kg/j de méthylprednisolone. Le traitement doit être pris de préférence en une prise le matin au cours du repas (28).
La durée du traitement est en général de quelques semaines mais varie en fonction de la sévérité de la maladie, des effets indésirables éventuels et de la dénutrition associée. Le traitement au long cours est fortement déconseillé en raison du risque d’effets indésirables dépendant des doses journalières et cumulées (28-29)
L’arrêt des corticoïdes peut être envisagé lorsque la maladie est contrôlée durablement, mais l’arrêt doit toujours être progressif lors d’un traitement prolongé afin d’éviter une insuffisance surrénalienne aiguë. La décroissance des doses se fait de manière lente en fonction de la durée de la corticothérapie et de la dose de départ : en général, la dose est diminuée de 10% tous les 8 à 15 jours. Une fois la dose de 5mg d’équivalent prednisone par jour atteinte, il est possible de
28
remplacer le corticoïde par de l’hydrocortisone à 20mg/j jusqu’à reprise de la fonction corticotrope (27).
L’efficacité des corticoïdes doit être jugée entre 2 et 4 semaines (30). Habituellement, l’absence de réponse clinique après deux semaines de traitement est suffisante pour définir l’échec dans la maladie de Crohn et le traitement par corticoïdes systémiques peut être interrompu.
Le danger principal de la corticothérapie systémique au cours des phases actives de la MC est l’installation d’une corticodépendance, observée dans près d’un tiers de cas. (31) dans notre série, la corticodépendance était observée chez 30,5% d’entre eux ce qui constitue le tiers des malades traités par corticoïdes.
2. Budesonide
Le budésonide est un médicament de la famille des corticoïdes qui a la particularité d’avoir une action essentiellement locale, limitée à l’intestin. En effet, il ne diffuse que faiblement dans la circulation sanguine et a donc moins d’effets secondaires que les autres corticoïdes. (32) Il se présente sous forme de gélules de 3 mg. Chaque gélule contient des granules gastro-résistants. Les gélules sont conçues pour libérer le médicament au niveau de l’iléon et du côlon droit). La posologie employée le plus souvent est de 3 gélules (soit 9 mg/j) en traitement d’attaque pour une durée de 8 semaines, en une prise le matin et puis en traitement d’entretien, la dose recommandée est de 2 gélules (soit 6 mg de budésonide), en une seule prise le matin, le traitement doit être arrêté progressivement pour une durée totale de 9 mois. Les gélules doivent être avalées avec de l’eau et ne doivent pas être ouvertes ou mâchées. (32)
Le budésonide est prescrit dans les poussées de maladie de Crohn d’intensité légère ou modérée, affectant la fin de l’intestin grêle et/ou le début du côlon, avec une réduction importante des effets secondaires (environ 35 %) par rapport aux corticoïdes systémiques. (21,31,32)
29
Ce traitement n’est encore pas disponible au Maroc ce qui peut expliquer sa faible utilisation chez nos patients. Ce médicament a été utilisé chez 2 de nos patients qui présentaient une maladie de Crohn iléo colique droite en poussée légères à modérée.
3. Corticoïdes par voie rectale : bétaméthasone et hydrocortisone
Il existe deux spécialités administrées par voie rectale ayant une AMM dans la prise en charge de la MC colique mais ne faisant toutefois pas partie des recommandations de prise en charge : Colofoam® mousse rectale (hydrocortisone) et Betnesol® solution rectale (bétaméthasone) (28,33).
La posologie pour le traitement des poussées est d’une administration par jour de préférence le soir au coucher pendant 2 à 3 semaines, puis éventuellement une administration tous les deux jours. Le traitement doit être le plus bref possible (généralement moins de 2 semaines) en raison du risque de passage systémique. Un traitement d’entretien est également possible avec Betnesol® à raison de 4 à 6 lavements par mois. Le patient doit être couché sur le côté au moment de l’administration (27).
E. Principaux effets indésirables des corticoïdes.
Les données sur la proportion de patients souffrant d'effets indésirables suite à l'utilisation des corticoïdes était démontrée dans un essai portant sur 162 patients ayant reçu de la prednisolone par voie orale (34)
La fréquence des EI était cinq fois plus élevée chez les patients recevant des corticoïdes par rapport au placebo.
Les effets indésirables des corticoïdes sont dose-dépendants et apparaissent plutôt après plusieurs mois d’utilisation ou lors d’une utilisation à forte dose. Ils sont de plusieurs types :
30
Hydro-électrolytiques : hypokaliémie, rétention hydrosodée, hypertension artérielle…
Endocriniens et métaboliques : syndrome de Cushing iatrogène, intolérance au glucose et diabète, freinage de l’axe hypothalamohypophysaire…
Musculo-squelettiques : ostéoporose, ostéonécrose des têtes fémorales, atrophie musculaire…
Cutanés : acné, atrophie, hypertrichose, retard de cicatrisation…
Digestifs : ulcère gastro-duodénal, ulcérations de l’intestin grêle, hémorragie digestive…
Oculaires : glaucome et cataracte
Neuropsychiques : euphorie, excitation et insomnie (27).
F. Précautions et surveillance. 35
La corticothérapie au long cours doit être associée à un régime hyperprotidique pour limiter le catabolisme protéique, et pauvre en sucres d’absorption rapide et en sel en raison respectivement de l’effet diabétogène et du risque de rétention hydrosodée.
Des apports suffisants en calcium et vitamine D sont indispensables pour prévenir le risque d’ostéoporose, et une supplémentation pourra être mise en place le cas échéant.
La corticothérapie augmente le risque d’infection, c’est pourquoi il convient de rechercher la présence d’un foyer infectieux avant mise en place du traitement, et d’éviter le contact avec des personnes atteintes de varicelle ou de rougeole. Une corticothérapie au long cours doit s’accompagner d’un suivi adéquat : glycémie, kaliémie, signes d’infection, ostéodensitométrie après au moins 3 mois cumulés de traitement à plus de 7,5mg de prednisone par jour, surveillance clinique en cas d’antécédent d’ulcère gastro-duodénal et adjonction d’IPP si
31
nécessaire, examen ophtalmologique après 5 mois de traitement cumulés, surveillance étroite en cas de colite ulcéreuse ou sigmoïdite diverticulaire en raison du risque de perforation… (27)
G. Inefficacité des corticoïdes dans le maintien de la rémission.
Bien qu'ils soient bons pour induire une rémission, les corticoïdes sont inefficaces pour la maintenir (36,37,38).
Une étude menée par « the National Cooperative Crohn’s Disease Study » (NCCDS), portant sur 274 patients atteints de MC en rémission clinique a montré que malgré une dose d’entretien de prednisone allant jusqu'à 20 mg par jour, on ne pouvait pas empêcher la survenue de poussées ou de récidive de la maladie après chirurgie. Les rechutes sont survenues chez 25% après 1 an et 40% après 2 ans. (39) Des taux de rechute à un an plus élevés ont été signalés avec le budésonide à une dose d’entretien de 6 mg ; jusqu'à 61% dans une étude et 59% dans une autre étude, qui étaient similaires aux taux obtenus avec le placebo (67% et 63%, respectivement) (40,41)
Dans le comté d’Olmsted, parmi 171 patients avec une MC après un an de traitement par corticoïde, 32 % avaient une réponse prolongée, 28 % étaient corticodépendants, et 38 % avaient dû recourir à la chirurgie (42)
Pourra-t-on alors se passer des corticoïdes au profit des biothérapies ?
Historiquement, les corticostéroïdes ont été la classe thérapeutique la plus utilisée pour l'induction de la rémission dans la maladie de Crohn, ils entrainent la baisse de production de cytokines inflammatoires et du NF ‐ κB, atténuant ainsi la réponse inflammatoire.
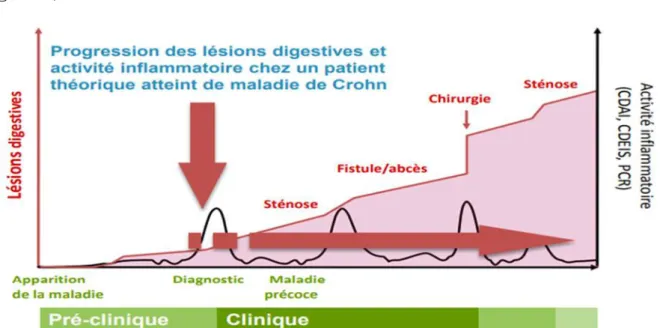
La maladie de Crohn se présente initialement sur un mode purement inflammatoire dans 80 % des cas, tandis que 20 % des patients présentent d’emblée une forme compliquée de sténose ou de fistule. Cependant, après 10 ans d’évolution, près de 50 % des patients développent des sténoses ou des fistules
32
(43). Ces complications et les opérations qui en résultent induisent des lésions tissulaires irréversibles qui peuvent être quantifiées par le score de Lémann (44)
(figure 6).
Figure 6 : lésions tissulaires cumulées dans la MC au cours de son évolution (Score de Lémann)
Les objectifs historiques de la prise en charge de la MC, à savoir l’induction de la réponse et du maintien de la rémission clinique ne semblent pas modifier son histoire naturelle. Actuellement, les objectifs thérapeutiques de la MC convergent vers l’obtention d’une rémission profonde précoce sans corticoïdes, d’une cicatrisation muqueuse endoscopique ainsi que d’une réduction des taux d’hospitalisation et de chirurgie. L’introduction précoce d’azathioprine et/ou des molécules anti-TNFα représenté pour l'essentiel actuellement par (infliximab, Adalimumab) est une option thérapeutique possible et permettra, vraisemblablement, d’atteindre de nouveaux objectifs thérapeutiques que sont la réduction de la destruction de la paroi intestinale, la prévention des complications (sténose, fistule, abcès) et le maintien d’une physiologie gastro-intestinale normale.
L’utilisation de ces nouvelles thérapeutiques biologiques, comme alternative à la corticothérapie dans les poussées de MC n'est pas encore à l'ordre du jour. Le
33
consensus ECCO publiée en 2010 préconisait déjà une utilisation plus large et plus précoce des TNF. Les experts recommandaient de considérer les anti-TNF en cas de maladie cortico-résistante ou cortico-dépendante et d’intolérance à la corticothérapie. La nouveauté par rapport au libellé de l’AMM est principalement la possibilité de débuter un anti-TNF en cas de cortico-dépendance. Ceci s’explique par le fait que les anti-TNF ont une efficacité en traitement d’attaque et d’entretien dans les MICI et que, dans certaines de ces situations (signes d’imprégnation cortisonique, complications cortico-induites, maladie sévère et/ou invalidante), il n’est pas possible d’attendre 3 mois l’efficacité d’un immunosuppresseur (thiopurines ou méthotrexate).(33)
II. Traitement par ANTI TNF
A. Molécules
1. L’infliximab
L’infliximab est un anticorps monoclonal de types IgG1, chimérique humanisé à 75% et d’origine murine à 25%, neutralisant le TNF-α circulant et transmembranaire. Il fixe le complément entrainant une cytotoxicité anticorps dépendante et induit l’apoptose des lymphocytes activés par la lamina propria. (45, 46,47,48,49)
2. L’adalimumab
L’adalimumab est un anticorps monoclonal 100% humain, il se lie au TNFα circulant et transmembranaire, et comme l’infliximab, induit une cytotoxicité et une apoptose lymphocytaire. Bien qu’il soit à priori faiblement immunogène, l’apparition d’anticorps antiadalimumab survient cependant chez 8.4% à 10% des patients. (45,48,50)
34
3. Le certolizumab
Le certolizumab correspond à un fragment Fab d’un anticorps monoclonal anti-TNFα humanisé lié à une molécule de polyéthylène glycol permettant d’augmenter sa biodisponibilité et sa durée de demi-vie. Il exerce son activité sur le TNF-α circulant et sur le TNF transmembranaire, il ne passe pas la barrière placentaire en raison de l’absence de fragment Fc. (48) Il n’induit pas d’apoptose des monocytes ni des lymphocytes du sang périphérique humain, ni de dégranulation des neutrophiles. (46) Cette molécule n’est pas disponible au Maroc.
B. Intérêt des anti TNF dans l’induction et le maintien de la
rémission de la MC réfractaire aux traitements conventionnels
1. Infliximab
Dans la maladie de Crohn luminale c’est l’infliximab qui a été le premier à obtenir une A.M.M dans la MC réfractaire en traitement d’induction. Cette AMM du 13 août 1999 était basé sur les résultats de l’essai de Targan et al qui a montré un pourcentage de rémission clinique de 48%, quatre semaines après une perfusion d’une dose de 5mg/kg d’infliximab chez des malades en poussée de leur maladie de Crohn contre 4% dans le groupe placebo. (51,52)
-L’étude Accent 1 a montré qu’à un an, les taux de rémission clinique étaient significativement plus élevés sous infliximab 5 ou 10 mg/kg (35%) que sous placebo (15 %). La durée médiane avant perte de réponse était également significativement plus courte sous placebo que dans les groupes infliximab. Par ailleurs cette étude, a montré l’intérêt de l’infliximab dans le sevrage en corticoïdes : le pourcentage des malades en rémission et sevrés de corticoïdes à la semaine 54 était de 29% dans les groupes 5mg/kg et 10mg/kg combinés contre 9% dans le groupe placebo. Au bout d’un an de traitement, le nombre de patients en rémission était également significativement plus élevé dans les groupes infliximab que placebo. (48,51,53)
35
2. Adalimumab
L’efficacité de l’adalimumab en traitement d’induction et d’entretien de la maladie de Crohn a été évalué par l’étude CLASSIC I (54). Ces études ont montré un bénéfice du traitement d’induction par adalimumab, chez des patients naïfs d’anti-TNFα pour l’étude Classic I et chez des patients intolérants ou en échec secondaire à l’infliximab pour l’étude Gain.
G.Fiorino et al. (55) ont montré à travers leur étude que l’adalimumab est efficace pour maintenir la rémission clinique, endoscopique, et le sevrage en corticoïde dans les formes modérées à sévères de la maladie de Crohn pendant une période de trois ans.
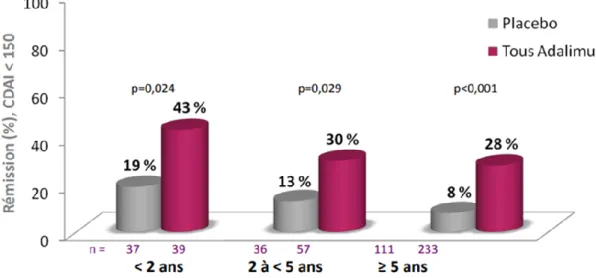
Dans l’essai CHARM 4 (56) du maintien de la rémission avec l'adalimumab chez les patients atteints de MC modérée à sévère, il a été montré qu’à la semaine 56, le taux de rémision clinique (score CDAI<150) était significativement plus élevé pour les patients traités par l'adalimumab versus patients sous placebo (19% contre 43% pendant 2 ans ; p= 0,024; 13% contre 30% pendant 2 à 5 ans ; p = 0,028; 8% contre 28% pendant ≥ 5 ans, p=0.001).
Figure 7 : Essai CHARM pour le maintien de la rémission par l’adalimumab au cours de la MC
36
C. Recommandation pour le traitement de la MC en fonction de
la localisation et de la sévérité de la maladie selon ECCO
- Atteinte iléo-caecale :
Activité minime : il faut préférer un traitement par Budésonide à la dose de 9 mg/j. Le bénéfice de la mesalazine est limité et les antibiotiques ne sont pas recommandés. L’abstention thérapeutique est une option pour les symptômes minimes.
Activité modérée : il faut préférer le budésonide à la dose de 9mg/j ; ou les corticoïdes systémiques. Une antibiothérapie peut être ajoutée s’il existe un doute 44 sur des complications septiques. L’aziathioprine/6-mercaptopurine ou le méthotrexate en association avec les corticoïdes peuvent être une alternative. Le traitement par anti-TNF peut être considéré comme une alternative chez les patients dont l’activité a été prouvée et qui ont présenté une corticorésistance, une corticodépendance, ou une intolérance aux corticoïdes. Les risques devront être discutés avec le patient.
Activité Sévère : elle doit être traitée initialement par des corticoïdes systémiques. En cas de rechute, le traitement anti TNF avec ou sans immunosuppresseur est une option appropriée en cas de preuve objective d’activité de la maladie. Pour les patients ayant des poussées peu fréquentes, il est possible de reprendre une corticothérapie associée à un immunomodulateur. La chirurgie est une alternative raisonnable chez certains patients et doit aussi être considérée et discutée, notamment en l’absence de réponse au traitement médical dans les 2 à 6 semaines.
-Atteinte colique : la sulfasalazine ne doit être prescrite qu’en cas d’activité faible
de la maladie, dans le cas contraire, les corticoïdes sont plus appropriés. Pour les patients rechuteurs, le traitement anti TNF avec ou sans immunosuppresseur sera indiqué en cas de preuve objective d’activité modérée à sévère de la maladie. Pour les patients ayant des poussées peu fréquentes, il est possible de reprendre des
37
corticoïdes avec un immunosuppresseur. Avant de débuter un anti-TNF ou IS, la chirurgie doit aussi être considérée et discutée.
-Atteinte étendue du grêle : peut être traité par corticoïdes systémiques ou
thiopurines ou méthotrexate. En cas de rechute, le traitement par anti-TNF avec ou sans immunosuppresseur sera indiqué en cas de preuve objective d’activité modérée à sévère de la maladie. Un support nutritionnel doit être mis en place et les options chirurgicales doivent être discutées à un stade précoce.
-Atteinte œsophagienne et gastroduodénale : il convient d’introduire un
inhibiteur de la pompe à protons, et si nécessaire, d’ajouter des corticoïdes par voie systémique avec des thiopurines ou du méthotrexate. Les anti-TNF sont une alternative pour les maladies sévère ou réfractaires. Une dilatation endoscopique ou une chirurgie est indiquée pour les symptômes obstructifs (57).
- Maladie de Crohn corticodépendante
Les patients dépendent des corticostéroïdes et naïfs aux immunosuppresseurs doivent être traités par thiopurine ou méthotrexate ou anti-TNF. Les options chirurgicales devraient également être discutées.
- Maladie de Crohn Corticorésistance
Les patients présentant des signes objectifs de maladie active réfractaire aux corticostéroïdes doivent être traités avec une stratégie basée sur les anti-TNF, bien que les options chirurgicales doivent également être envisagées et discutées à un stade précoce.
D. Stratégies thérapeutiques dans la MC
La prise en charge de la MC comprend des traitements d’attaque qui ont pour objectif de mettre un terme à la poussée, et des traitements de maintien dont le but est de prévenir l’apparition de nouvelles poussées et ainsi de prolonger la rémission. La chirurgie est plutôt utilisée en dernière ligne ou pour le traitement des complications, puisqu’elle ne permet pas la guérison définitive et expose à un risque de perte de fonction (58).
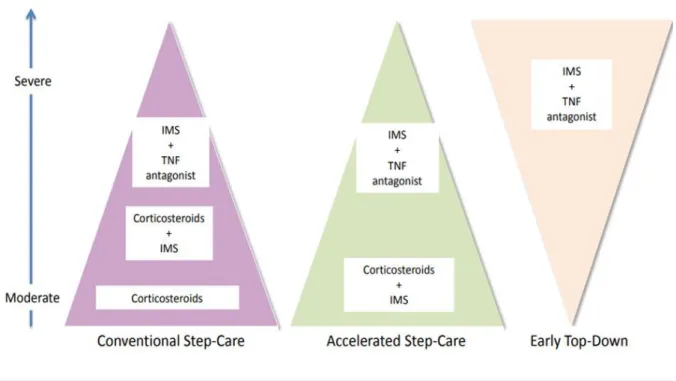
38
Jusqu’à relativement récemment, c’est essentiellement la mesure de l’activité clinique qui guidait l’escalade progressive de nos thérapeutiques selon le degré de sévérité « STEP UP » qui consiste en l’addition progressive de traitements en cas d’inefficacité ou d’intolérance aux traitements de première ligne comportant moins de risques. Le premier traitement utilisé est une corticothérapie brève (budésonide en première intention pour les atteintes iléales ou iléocoliques, puis corticothérapie systémique en cas d’inefficacité). En cas d’inefficacité, un immunosuppresseur est ajouté à la corticothérapie. Les immunosuppresseurs ne doivent pas être utilisés seuls pour l’induction de la rémission en raison de leur latence d’efficacité (2 à 3 mois pour les thiopurines, 6 à 8 semaines pour le méthotrexate).
On réservait l’utilisation précoce des anti-TNF aux maladies d’emblée sévères, compliquées au diagnostic, ou en cas de Corticodépendance.
Actuellement, le concept de rémission profonde associant une rémission clinique et une cicatrisation muqueuse (CM) endoscopique même partielle devient notre objectif thérapeutique dans le cadre de la stratégie du « treat to target » car la CM influence positivement l’évolution de la maladie par le maintien d’une rémission stable à long terme et diminue le risque d’interventions chirurgicales. Il est surtout établi que la CM est plus souvent obtenue par les traitements anti-TNF quand ils sont utilisés précocement dans les 2 premières années du diagnostic à un stade où il n’existe pas de destruction irréversible de la paroi intestinale.
Cet objectif de cicatrisation muqueuse nous pousse à aller au-delà des symptômes vers des stratégies plus agressives précocement avec une fenêtre d’opportunité pour essayer de modifier l’histoire naturelle de la MC, dans les 18 premiers mois, soit d’emblée avec désescalade progressive « TOP DOWN » ou rapidement progressive « STEP UP » accéléré.
39
En contre partie ces stratégies, augmentent le risque d’effets indésirables, surtraite les patients ayant une maladie légère à modérée et est plus couteuse que la stratégie « step-up » (59,60).
Figure 8 : Différentes stratégies thérapeutiques utilisées dans la MC
Figure 9 : définition de la rémission profonde précoce
40
Il est donc essentiel de déterminer les facteurs de risques évolutifs péjoratifs vers une maladie « invalidante » afin de limiter les traitements précoces majeurs par anti-TNF à une population ciblée de patients et éviter de surtraiter en inversant la balance bénéfice/risque.
Facteurs de risques d’évolution péjorative justifiant une stratégie thérapeutique précoce des MC modérées par des médicaments capables de modifier l’histoire naturelle de la MC [tableau 4]
Atteinte du grêle étendue ou multifocale Atteinte sévère du tube digestif haut Lésions endoscopiques sévères coliques Les atteintes périnéales (LAP)
Atteinte rectale avec ulcérations
Les rares formes fistulisantes et sténosantes d’emblées qui ne correspondent pas à des séquelles d’une maladie ancienne passée inaperçue
L’âge inférieur à 40 ans au diagnostic et le tabagisme étant des facteurs aggravants.
Lors de la coloscopie
La présence de lésions sévères est un facteur prédictif de recours à la chirurgie : le risque de colectomie est multiplié par 5. Un traitement médical plus intensif se justifie.
Lésions endoscopiques sévères :
Ulcérations profondes mettant à nu la musculeuse Décollements muqueux
Ulcérations profondes occupant plus du tiers de la superficie d’un segment rectocolique (abrasion muqueuse)
41
Facteurs prédictifs de réponses à une biothérapie
Maladie récente
Maladie colique isolée
Absence de chirurgie abdominale Patient jeune et non-fumeur
Lésions ulcérées iléo-coliques à l’endoscopie Absence de sténose
CRP élevée
Traitement continu
Concentration sanguine d’infliximab élevée
Ayant toujours à l’esprit les résultats de l’essai SONIC [2] montrant les deux facteurs prédictifs favorables d’utilisation de la stratégie d’optimisation (IFX-AZA) chez les patients naïfs : CRP élevée et la présence de lésion endoscopique. Des marqueurs de lésions tissulaires, anatomiques, génétiques et immunologiques sont en cours d’études.
42
Tableau 4 : Médicaments capables de modifier l’histoire naturelle de la MC
E. Step Up Vs Top Down
La plupart des patients qui ont une maladie de Crohn active sont traités initialement avec des corticostéroïdes. Bien que cette approche contrôle généralement les symptômes, de nombreux patients deviennent résistants aux corticostéroïdes ou en dépendent, et une exposition prolongée est associée à un risque accru de mortalité.
Une étude, menée par Daniel Hoekman et al, (61) a eu pour but de déterminer si l’effet positif (en termes de rémission et de réduction du recours aux corticoïdes) d’une combothérapie par anti-TNF associé à un immunosuppresseur (azathioprine, méthotrextate ou 6-mercaptopurine) instaurée d’emblée selon la stratégie top-down (TD) chez des patients naïfs, se maintenait à long terme et modifiait le cours évolutif de la maladie.
43
Les auteurs ont repris de manière rétrospective la série des patients ayant une maladie de Crohn et ayant participé à l’essai contrôlé randomisé de l’équipe de Geert D’Haens, publié dans le Lancet en 2008 et qui comparait la combothérapie « TD » d’emblée à un traitement conventionnel Step-Up (SU). Cet essai mené sur deux ans avait conclu à un effet positif de la stratégie « TD » en termes d’induction, du maintien de la rémission et de la réduction des besoins en corticoïdes, néanmoins, elle ne semble pas améliorer significativement le taux global de rémission, de recours à la chirurgie et la cicatrisation muqueuse endoscopique.
Figure 10 : Stratégie Step-up vs. top-down
L’essai le plus important de l’année 2008 est SONIC (62), essai randomisé contrôlé en double aveugle comparant l’infliximab seul et l’association infliximab + azathioprine à l’azathioprine seule chez les patients atteints de maladie de Crohn n’ayant jamais reçu de traitement immunomodulateur et biologique.