FACULTE DES SCIENCES DE LA NATURE ET DE LA VIE ET DES SCIENCES DE LA TERRE DEPARTEMENT DE BIOLOGIE
Réf : ……./UAMOB/F.SNV.ST/DEP.BIO/2017
MEMOIRE DE FIN D’ETUDES
EN VUE DE L’OBTENTION DU DIPLOME MASTER
Domaine : SNV Filière : Sciences BiologiquesSpécialité : Sciences et Gestion de l’Environnement
Présenté par :
ZEMOURI Mourad
Thème
Etude cytogénétique de quelques espèces végétales de la flore
de kéfrida (Wilaya de Bejaia) avec un accent sur les
endémiques.
Soutenu le : 28 / 06 / 2017 Devant le jury composé de :
Nom et Prénom Grade
M.REMINI Hocine MCB Univ. de Bouira Président
M. BOUCHIBANE Mebarek MAA Univ. de Bouira Promoteur
M. LAMINE Salim MAA Univ. de Bouira Examinateur
Au terme de ce modeste travail, je tiens à remercier tout d’abord le bon Dieu Allah qui m’a donné la volonté et le courage de reprendre le monde des études après une longue interruption.
- Je remercie Monsieur BOUCHIBANE Mebarek, Maître Assistant à l’université AMO de Bouira pour avoir accepté de m’encadrer ainsi que pour son aide, sa disponibilité et ses conseils et orientations ;
- Je remercie M. REMINI Hocine Maitre de Conférence à l’université AMO de Bouira pour avoir accepté de présider le jury de soutenance.
- Je remercie LAMINE Salim Maitre Assistant à l’université AMO de Bouira pour avoir accepté d’examiner et de juger mon travail.
- Je remercie Pr. SAHNOUNE Mohamed Directeur de Laboratoire de Recherche en Ecologie et Environnement de l’université A/MIRA de Bejaia pour avoir accépté d’accomplir la partie pratique au sein du laboratoire, je le remercie aussi pour ses conseils, ses orientations et surtout pour ses encouragements.
- Je tiens à remercier tout particulièrement tous les membres (enseignants chercheur et doctorants) de l’équipe de recherche : Caractérisation des ressources phylogénétique, du Laboratoire d’Ecologie et Environnement à l’Université A. Mira pour m'avoir initié à la cytogénétique. Je leur exprime ma profonde gratitude pour m'avoir fait profiter de leurs connaissances.
- Je tiens à remercier tous les membres (enseignants chercheur et doctorants) du Laboratoire d’Ecologie et Environnement à l’Université A. Mira pour leurs encouragements et conseils.
- Je remercie aussi mes chers amis et collègues « Ingénieurs de Laboratoires » de l’université AMO de Bouira
- Je remercie tous ceux et toutes celles qui ont contribué, de près ou de loin, à la réalisation de ce modeste travail.
Introduction ... 01
I/Chapitre I : Revue bibliographique... 03
I.1/ Intérêts des familles étudiées ... 03
I.1.1/ Intérêts de la famille des Fabaceae ... 03
I.1.1.1/ Intérêt agronomique des Fabaceae ... 03
I.1.1.2/ Intérêt zootechnique ... 04
I.1.2/ Intérêts de la famille des Lamiacées ... 04
I.1.2.1/ Intérêt cosmétique et alimentaire... 04
I.1.2.2/ Intérêt pharmaceutique ... 05
I.1.3/ Intérêts de la famille des Iridaceae ... 06
I.1.4/ Intérêt de la famille des Liliacées ... 06
I.2/ Classification interne des espèces étudiées ... 07
I.2.1/ Classification dans le genre Medicago ... 07
I.2.2/ Classification dans le genre Allium L. ... 08
I.2.3/ Classification dans le genre Phlomis ... 09
I.2.4/ Classification dans le genre Iris ... 09
I.3/ Répartition et écologie des espèces étudiées ... 10
I.3.1/ Les espèces du genre Medicago ... 10
I.3.2/ Allium triquetrum L. ... 11
I.3.3/ Phlomis bovei De Noe. ... 11
I.3.4/ Iris unguicularis Poir. ... 11
I.4/ Intérêt de la cytogénétique végétale ... 12
1.4.1/ Définition et intérêt... 12
1.4.2/ Les chromosomes ... 12
1.4.2.1/ Différents types de chromosomes ... 13
I.5/ Caryologie des espèces étudiées ... 14
I. 6/ Diagnoses des espèces étudiées ... 15
I.6.1/ Medicago arabica L. ... 15
I.6.2/ Medicago murex Willd. ... 16
I.6.3/ Allium triquetrum L... 16
I.6.4/ Phlomis bovei de Noé ... 17
ІІ.1/ Matériel utilisé ... 18
ІІ.1.1/ Les espèces étudiées et leurs origines ... 18
ІІ.1.2/ Récolte des boutons floraux ... 18
ІІ.1.3/ Récolte des gousses ... 19
ІІ.1.3.1/ Mise à germination des graines ... 20
ІІ.1.3.2/ Mise en culture des plantules ... 20
ІІ.2/ Analyse des méioses polliniques ... 20
ІІ.2.1/ Préparation des solutions ... 20
ІІ.2.1.1/ Le fixateur ... 20
ІІ.2.1.2/ Le colorant ... 21
ІІ.2.2/ Le matériel végétal à observer ... 21
ІІ.2.3/ Les différentes étapes de l’analyse de la méiose ... 21
ІІ.2.3.1/ Prélèvement et fixation……….21
ІІ.2.3.2/ Hydrolyse à HCl ... 21
ІІ.2.3.3/ Choix des boutons floraux ... 21
ІІ.2.3.4/ La coloration ... 22
ІІ.2.3.5/ L’observation ... 22
ІІ.2.3.6/ Photographie ... 22
ІІ.3/ Analyse de la fertilité pollinique ... 22
ІІ.3.1/ Le matériel végétal utilisé ... 22
ІІ.3.2/ Technique d’étude de la fertilité pollinique... 23
ІІ.3.3/ La technique de coloration des grains de pollen ... 23
ІІ.3.4/ Estimation du taux de fertilité pollinique ... 23
ІІ.4/ Analyse de la mitose ... 24
ІІ.4.1/ Préparation des solutions ... 24
ІІ.4.1.1/ Le fixateur ... 24
ІІ.4.1.2/ Le colorant ... 24
ІІ.4.1.3/ La solution de colchicine ... 24
ІІ.4.2/ Le matériel végétal utilisé ... 24
ІІ.4.3/ Les principales étapes de l’analyse de la mitose... 25
ІІ.4.3.1/ Prétraitement ... 25
ІІ.4.3.2/ La fixation ... 25
ІІ.4.3.3/ L’hydrolyse à HCl ... 25
ІІ.4.3.6/ Observation ... 26
ІІ.4.3.7/ Photographie ... 26
III/ Chapitre III : Résultats et discussions ... 27
III.1/ Medicago arabica L. ... 27
III.1.1/ Analyse de la mitose ... 27
III.1.2/ Analyse de la fertilité pollinique ... 28
III. 2/ Medicago murex ... 28
III.2.1/ Analyse de la méiose ... 29
III.2.2/ Analyse de la fertilité pollinique ... 30
III. 3/ Allium triquetrum L. ... 30
III.3.1/ Analyse de la méiose ... 31
III.3.2/ Analyse de la fertilité pollinique ... 32
III. 4/ Iris unguicularis Poir. ... 32
III.4.1/ Analyse de la méiose ... 33
III.4.2/ Analyse de la fertilité pollinique ... 33
III. 5/ Phlomis bovei De Noé : ... 34
III.5.1/ Analyse de la mitose ... 34
III.6/ Autres résultats et leurs commentaires ... 35
III.6.1/ Les différents stades de la mitose : ... 35
III.6.2/ Les principales phases de la méiose : ... 37
III.6.3/ Quelques anomalies de la méiose : ... 38
III.6.4/ Cellules du tapétum chez l’espèce I. unguicularis ... 40
Conclusion générale et perspective ... 42
Liste des tableaux Page
Tab. I : Classification dans le genre Allium L. 8
Tab. II : Classification dans le genre Phlomis L. 9
Tab. III : Classification de l’espèce Iris unguicularis Poir. 9
Tab. ІV : Origine géographique des espèces étudiées, date
et heure de fixation des boutons floraux. 18
Tab. V : Origine géographique des espèces étudiées, date et
heure de la récolte des gousses et des graines. 19
Tab. VI : Fertilité pollinique de Medicago arabica L. 28
Tab. VІI : Fertilité pollinique de Medicago murex Willd 30
Tab. VІІI : Fertilité pollinique d’Allium triquetrum L. 32
Liste des figures Page Fig. 1 : Représentation schématique de quelques type de chromosomes
(Griffiths et al., 2002) 14
Fig. 2 : Localisation géographique de la zone d’étude 19
Fig. 3 : Luzerne d’Arabie (Medicago arabica L) 27
Fig. 4 : Mitoses de Medicago arabica L. (stade de métaphase) 28
Fig. 5 : Luzerne murex (Medicago murex) 29
Fig. 6 : Méioses de M. murex (stade de métaphase І). 29
Fig. 7 : Allium triquètre (Allium triquetrum L.) 31
Fig. 8 : Méioses d’Allium triquetrum L. 31
Fig. 9 : Iris d’Algérie (Iris unguicularis Poir.) 32
Fig. 10 : Méioses d’Iris unguicularis Poir. (Stade de métaphase I) 33
Fig. 11 : Phlomis (Phlomis bovei De Noe.) 34
Fig. 12 : Mitose de Phlomis bovei De Noe. 35
Fig. 13 : Les différents stades de la mitose chez Phlomis bovei De Noé 36 Fig. 14 : Les principales phases de la méoise des espèces étudiées. 37 Fig. 15 : Anomalies associées à la méiose observées chez M. murex. 38 Fig. 16 : Photographie de grains de pollen normaux (fertiles) et anormaux
(stériles) d’Allium triquetrum et M. arabica L. 39
Fig.17 : Les différentes cellules du tapetum observées chez I. unguicularis
1
La cytogénétique fait le lien entre la cytologie et la génétique. Les premiers travaux chez les végétaux ont débuté au cours de la seconde moitié du 19e siècle mais c’est surtout à partir des années 1920, que la cytogénétique s’est développée et son importance n’a cessé de croitre par la suite (Jahier et al., 1992).
La cytogénétique est l’une de nombreuses disciplines sur lesquelles s’appuie l’amélioration des plantes. Elle participe à la connaissance du matériel végétal utilisé (Nombre de chromosomes, polyploïdie) et l’exploitation de la variabilité intraspécifique (Jahier et al., 1992).
Les études caryologiques jouent un rôle prépondérant dans les recherches biosystématiques en vue de la compréhension des relations phylogénétiques (Stebbins, 1971 ; Grant, 1986). Mais, leur développement est lié à l’évolution des techniques de marquages des chromosomes. Les techniques classiques, qui permettent une vision morphologique de la cellule en métaphase, ont rendu possible le dénombrement des chromosomes et l’établissement de caryotypes (Darlington & Lacour, 1940).
Le dénombrement chromosomique joue un rôle important dans l’évaluation de la biodiversité et de sa conservation (Martinez & Perker, 1995).
Le secteur de Kéfrida, comme toute la région des Babors (petite Kabylie), présente une flore riche et diversifiée, avec un nombre appréciable en espèces endémiques au sens large, grâce aux conditions climatiques exceptionnelles, associées à une topographie très accidentée (Maire, 1926). La végétation de ce secteur (Kéfrida) à fait l’objet de quelques études consacrées à l’inventaire floristique et phytogéographique (Quézel, 1956 ; Quézel & Santa, 1962-63 ; Bouchibane et al., 2017), utilisation des ressources phytogénétiques (Nouioua, 2012), mais très peu d’étude caryologique ont été réalisées sur la végétation de ce secteur (Bouchibane, 2009).
L’objectif de notre étude et de connaitre le nombre chromosomique de quelques espèces du secteur de Kéfrida dans le but de déterminer la variabilité génétique de ces espèces. Ainsi essayer d’améliorer certaines étapes des techniques utilisées pour analyser les méioses et les mitoses, pour les faire adapter à notre matériel végétal.
2
Dans ce mémoire, nous présentons d’abord, une synthèse bibliographique sur les espèces étudiées et sur la cytogénétique. La deuxième partie est consacrée au matériel végétal analysé ainsi que la méthodologie utilisée. Dans la troisième partie nous exposons les résultats obtenus et leurs interprétations. Nous terminons avec une conclusion générale et perspective.
3 I/ Chapitre I : Revue bibliographique
I.1/ Intérêts des familles étudiées
I.1.1/ Intérêts de la famille des Fabacées (Fabaceae)
L’importance accordée aux Fabaceae tient aux nombreux avantages que ces espèces peuvent présenter, et qui justifient leur utilisation à grande échelle, dans les régions tempérées et tropicales du monde (Langer & Hill, 1982 in Adouane, 2009). La famille des Fabaceae (Légumineuses) est l’une des familles les plus abondantes
et les plus diversifiées des plantes supérieures. Elle compte quelques 1700 espèces réparties en quelques 700 genres, parmi ces espèces on trouve des plantes alimentaires, fourragères, ornementales et médicinales (Tootill, 1984 ; Allaby, 1992).
I.1.1.1/ Intérêt agronomique des Fabacées (Fabaceae)
La luzerne (M. sativa) appartient à la famille des Fabaceae bien connue pour ses avantages. La luzerne représente la plus importante culture fourragère du monde ; elle est cultivée sur quelques 33 millions d’hectares (Bolton, 1972). Medicago sativa est probablement la première plante fourragère cultivée par l’homme.
Une luzernière peut nourrir et engraisser jusqu'à 40 brebis par hectare avec leurs agneaux et en outre produire de 22 à 25000 kg/hectare de matière sèche (FAO, 1993). Il est concevable que les luzernes irriguées, puissent nourrir deux fois plus d’ovins (Marble, 1984 in Bettache & Ounecer, 2000). Dans quelques régions du monde, les cultures de luzernes (Fabaceae) annuelles ont été développées pour remplacer les céréales dans les systèmes de rotation avec le blé pour fournir une coupure aux développements de parasites et de maladies des céréales (Ovalle et al., 1990 in Delpozo
et al., 2000 ; Abdelkefi & Marrakchi, 2000 ). Ces médiques fournissent une meilleure
couverture au sol et peuvent être employées comme engrais verts (Brummer et al., 1995 ; Bouton, 1996 ; Shrestha et al.,1998).
Les plantes de la famille des Fabaceae sont caractérisées par leur capacité de fixer l’azote atmosphérique, grâce à une symbiose existant entre la plante et une bactérie (Rhizobium Meliloti), qui se développe dans leurs systèmes racinaires (Mauries, 1994 ;
4
Zakhia, 2001). Grâce à cette symbiose, les Fabaceae apporte l’équivalent de 15% de la quantité totale d’azote fournie par l’industrie à l’agriculture française (Genier et al., 1992).
I.1.1.2/ Intérêt zootechnique
Les légumineuses fourragères fournissent au bétail une nourriture particulièrement riche en protides, en vitamines et en sels minéraux (Foury, 1954).
Les ovins pâturant les luzernes annuelles exclusivement, présentent un gain moyen journalier de 220g de poids vif par tête. Alors que ceux alimentés traditionnellement, avec pâture de jachère et paille de lentille, ont un gain moyen journalier de 100g uniquement. Cette différence s’explique par le fait que les luzernes annuelles fournissent 10 fois plus d’unités fourragères que les jachères (Anonyme, 1979 in Aït Ouaret & Sahnoune, 1998).
I.1.2/ Intérêts de la famille des Lamiacées (Lamiaceae)
Les lamiacées comprennent 6 500 espèces dont l’aire de dispersion est extrêmement étendue, mais avec une prépondérance pour les régions méditerranéennes : Thym, Lavande, Romarin caractérisent la flore des garrigues. Les
Lamiacées sont rares, par contre, dans les régions arctiques et en haute montagne.
C’est une famille très homogène : une lamiacée est facile à reconnaitre (Dupont & Guignard, 2012). En Algérie, cette Famille comprend 29 genres et 140 espèces se développant aussi bien dans les zones méditerranéennes que sahariennes (Nouioua, 2012).
I.1.2.1/ Intérêt cosmétique et alimentaire
Une trentaine d’espèces de Lamiacées sont utilisées comme épice ou en parfumerie telle la lavande (Ramade, 2008). Elles se remarquent par leurs odeurs pénétrantes d’où le nom de plantes aromatiques qui leur est attribué (Nouioua, 2012). La plupart des espèces appartenant à cette famille sont aromatiques et possèdent des huiles essentielles (Lawrence, 1992). Les huiles essentielles aromatiques sont principalement présentes dans les feuilles, mais elles peuvent être trouvées dans toutes
5
les parties supérieures des plantes. Elles sont précieuses dans les industries ; agroalimentaires, aromatologie , cosmétiques, parfumerie, pesticide et pharmaceutique (Kaufmann & Wink, 1994 ; Ozkan, 2008).
Certaines des espèces de la famille des Lamiacées sont utilisées comme herbes culinaires et cultivées pour ses feuilles comestibles, par ex. Basilic (Ocimum sp.), Menthe (Mentha piperita L.), romarin (Rosmarinus officinalis L.), sauge (Salvia
officinalis L.), salé (Satureja hortensis L.), marjolaine (Origanum majorana L.)
L'origanum (Origanum vulgare L.), le thym (Thymus vulgaris L.), la lavande (Lavandula angustifolia Mill.) (Licina et al. 2013).
Plusieurs espèces de la famille des Lamiaceae comprennent également des plantes largement utilisées dans la médecine traditionnelle comme remède contre divers troubles (Carović-Stanko et al, 2016).
I.1.2.2/ Intérêt pharmaceutique
Plus de 90 espèces de Lamiaceae sont inscrites dans la pharmacopée, leurs activités sont dues à la présence de véritables réservoirs sous-cuticulaires représentés par de nombreux poils glanduleux qui sécrètent des essences, constituant ainsi de véritables unités de production pour les alcools (géraniol, linalol, bornéol, terpinéol) provenant des Genres Lavandula, pour les aldéhydes provenant de Melissa officinale L., pour les cétones (camphre, carvone, thuyone, pulégone, menthone) provenant de
Lavandula stoechas L. et pour les dérivés phénoliques (thymol, carvacrol, eugénol et
estragol) provenant essentiellement du genre Thymus, de diverses espèces du genre
Origanum pour les hydrocarbures (terpéniques et non terpéniques), enfin pour les
oxydes provenant de Mentha piperita L. ; Salvia officinalis L. et de l’Hyssopus
officinalis L. dont une sous espèce est caractéristique de la région d’Oran. En plus de
ces plantes sont inscrites au codex, de nombreuses espèces de Lamiaceae sont utilisées dans la pharmacopée populaire : Ajuga iva Schr., 5 espèces de Marrubium L.et plus de 20 taxons de Teucrium L. (Nouioua, 2012).
6 I.1.3/ Intérêts de la famille des Iridaceae
La famille des Iridaceae comprend 1800 espèces dont les iris, les glaïeuls, les crocus. En Algérie, elle compte 4 genres et 21 espèces (Quézel & Santa, 1962-63).
Cette famille se caractérise par sa richesse en polyphénols. Les flavonoїdes tels que la rutine, la disomine, la lutéoline et la quercétine, sont aujourd’hui de plus en plus commercialisés pour diverses applications médicamenteuses, alimentaires et cosmétologiques (Akroum, 2012).
Le safran est une épice chère noble, rare et d’une grande valeur commerciale. Elle dérive des stigmates de Crocus sativus L. une fleur de la famille des Iridacée. On l’appelle «l’or des agriculteurs ou l’or végétal». Ce précieux produit possède de nombreuses vertus médicinales (Moutiq et al., 2011).
I.1.4/ Intérêt de la famille des Liliacées
Cette famille compte près de 2000 espèces largement répandues dans les diverses régions du globe. La plupart se font remarquer par l’élégance, la splendeur ou le parfum de leurs fleurs. Tout le monde connait le Lis, la Tulipe, la Jacinthe, dont les innombrables variétés sont le plus bel ornement des parterres au printemps. On sait la place importante que tiennent dans nos jardins potagers plusieurs espèces du genre
Allium. Les bulbes et les racines de quelques autres étaient jadis employés comme
purgatifs et diurétiques. Enfin quelque espèces exotiques sont encore mises à profit par la médecine et l’industrie (Coste, 1937). Le genre Allium compte des espèces alimentaires (ail, oignon, poireau, échalote…) (Dupont & Guignard, 2012), des espèces (Allium Cepa ; Allium fistulosum et Allium sativum) avec des activités antibactériennes et antifongiques (Benmeddour et al., 2015).
7
I.2/ Classification interne des espèces étudiées
I.2.1/ Classification dans le genre Medicago
En se basant sur un certain nombre de caractères, Lesins & Lesins (1979) ont classé le genre Medicago, en 4 sous-genres :
(a) Sous-genre n°1 : Lupularia M. lupulina L.
M. secundiflora. Durieu (b) Sous-genre n°2 : Orbicularia. Section Carstiensae Kozuk. Section Cretaceae Bieb. Section Platycarpae E. small. Section Orbiculares Urb. Section Hymenocarpos Ser. Section Heynianae Greu. (c) Sous-genre n°3 Medicago Section Falcago Reiche Section Papillosae Section Arboreae Section Suffruticosae
(d) Sous-genre N° 4 : Spirocarpos Section Rotatae (Urb) Hein Section Leptospirae (Urb) Hein Section Pachyspirae (Urb) Hein Section Intertextae (Urb) Hein
8
Les deux sections qui nous intéressent dans cette présente étude sont :
1 - La section des Leptospirae qui se classe dans le sous-genre N° 4 : Spirocarpos. Les Leptospirae comptent 10 espèces : M. polymorpha (L.), M. arabica Hudson, M. minima Bartalini, M. tenoreana Seringe, M. disciformis de Candolle, M. sauvagei Nègre, M. laciniata (L.) Miller, M. coronata (L.) Bartalani, M. lanigera Winkler et Fedtschenko, M. praecox de Candolle
2- Section Pachyspirae (Urb) Hein qui se classe aussi dans le sous-genre N° 4 : Spirocarpos. Les Pachyspirae comptent 09 espèces : M. soleirolii, M. tornata,
M. littoralis, M. truncatula, M. rigidula, M. murex, M. constricta, M. turbinata, M. doUata.
I.2.2/ Classification dans le genre Allium L.
Friesen et al. (2006), on subdivisé le genre Allium en 15 sous-genres (Allium,
Amerallium, Melanocrommyum, Reticulatobulbosa, Cepa, Polyprason, Rhizirideum, Cyathophora, Butomissa, Porphyroprason, Vvedenskya, Anguinum, Caloscordum, microscordum et Nectaroscordum) en se basant sur les relations phylogénétiques.
L’espèce étudiée est classée dans le sous genre Amerallium et la section Briseis (Tab. I).
Tab. I : Classification dans le genre Allium L.
Rang Nom Scientifique
Règne Plantes
Sous embranchement Angiospermes
Classe Monocotylédones Ordre Aspragales Famille Liliaceae Sous-famille Allioidées Genre Allium L. Sous-genre Amerallium. Section Briseis
9 I.2.3/ Classification dans le genre Phlomis
Phlomis bovei De Noé. est classée dans la famille des Lamiaceae et le genre Phlomis L. Ce dernier fait partie de la section Phlomis (Mathiesen, 2006) (Tab. II).
Tab. II. Classification dans le genre Phlomis L.
Rang Nom Scientifique
Règne Plantes
Angiospermes ou Magnoliaphyta Enangiospermes
Supérieures gamopétale Astéridées
Ordre Lamiales
Famille Lamiacées
Sous famille Lamoideae Harley
Genre Phlomis L
Section Phlomis
Espèce Phlomis Bovei De Noé
I.2.4/ Classification dans le genre Iris
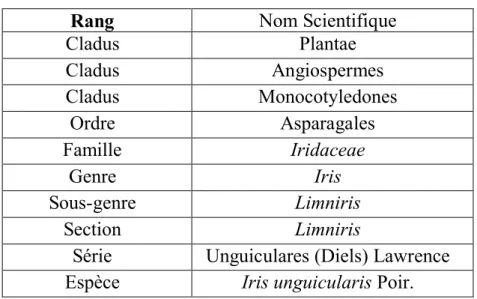
Le genre Iris L. appartient à la famille des Iridaceae. Lawrence (1953) a subdivisé le genre Iris en trois catégories infragénériques à savoir : sous-genre, section et série. Le taxon en question a été classé dans la série Unguiculares (Diels) Lawrence, la Section Limniris et le Sous-genre Limniris (Tab. III).
Tab. III. Classification de l’espèce Iris unguicularis Poir.
Rang Nom Scientifique
Cladus Plantae Cladus Angiospermes Cladus Monocotyledones Ordre Asparagales Famille Iridaceae Genre Iris Sous-genre Limniris Section Limniris
Série Unguiculares (Diels) Lawrence
10
I.3/ Répartition et écologie des espèces étudiées
I.3.1/ Les espèces du genre Medicago
M. arabica et M. Murex, comme toutes les espèces annuelles du genre Medicago, sont originaires du bassin méditerranéen et des régions adjacentes (Heyn, 1963 ; Lesins & Lesins, 1979 ; Cockset al., 1980 ; Bounejmate, 1996).
Les aires d’origines de toutes les espèces annuelles du genre Medicago est le « croissant fertile » recouvrant les pays ou régions actuels de Turquie, d’Iran, d’Irak et du sud du Caucase et le pourtour méditerranéen (Prosperi et al., 1993). Ces espèces ont ensuite conquis l’ensemble de la zone méditerranéenne et les steppes avoisinantes (Derek & Ernest, 1997).
M. arabica est inféodée à des environnements particuliers, qui est fréquent en Corse, Sardaigne (Italie) et Grèce, mais rare en Espagne et en Afrique du Nord (Olivieri
et al., 1991). Elle préfère les zones les plus humides (Négre, 1959). M. arabica pousse
sur des sols aux textures moyennes à grossières et légèrement acide (Abdelguerfi et al., 1988).
M. murex se trouve dans tout le bassin méditerranéen. Elle est assez abondante
sur les îles méditerranéennes (Chypre, Crète, Sicile, Sardaigne et la Corse). Sur le continent près de la mer, elle a été trouvée en Turquie, en Grèce, en Italie, dans le sud de la France et en Espagne (Lesins & Lesins, 1979).
Elle pousse sur des sols légèrement acide ou neutre dans les régions à pluviométrie élevée en Algérie (Abdelguerfi et al., 1988). Elle n’est présente que sous les fortes pluviométries (700 – 1100 mm), mais à des altitudes variables (50 à 1100m). Négre, (1959), signale cette espèce dans les plaines atlantiques du Maroc, et dans la région humide du Nord-Est algérien. D’après, Quezel & Santa, (1962), M. murex, pousse dans les broussailles et les pâturages. Elle est assez commune dans le Tell algéro-constantinois.
11 I.3.2/ Allium triquetrum L.
Allium triquetrum L. est originaire de la Méditerranée occidentale et centrale ;
Portugal, Sud de l’Espagne (y compris les Baléares), France (y compris la Corse), Italie (y compris la Sardaigne et la Sicile), Algérie, Maroc et Tunisie (Perring, 1962 in BSBI, 2011).
Il a été naturalisé dans le sud de l'Australie en 1909, et maintenant il se trouve dans la Nouvelle-Galles du Sud, victoria, Tasmania et dans l’Ouest de l’Australie, En Irlande, en Turquie, en Afrique du Sud, en Argentine, aux États-Unis, et en Nouvelle-Zélande (Parson & Cuthbertson, 2001 ; Perring, 1962 in BSBI, 2011).
L’Allium triquetrum L. s’installe dans des friches sèches à fraîches et préfère une exposition ensoleillée à semi-ombragée. Le substrat doit être sableux, limono-graveleux ou argilo-sableux. Cette espèce est indicatrice des zones humides et elle supporte des températures jusqu’à -12° C (Baba-Aissa, 1999).
En Algérie, Cette espèce présente dans le Nord, jusqu’au Tell Constantinois, mais elle est assez rare dans l’Ouest. Elle se rencontre dans les Forêts et les broussailles (Quézel & Santa, 1962). Au Maroc, cette espèce a été signalée dans les broussailles et
les lieux ombragés humides (Orch, 2013).
I.3.3/ Phlomis bovei De Noé.
Cette espèce est une endémique de L’Algérie et de la Tunisie (Dobignard & Chatelain, 2010- 2013). Elle pousse dans les milieux humides montagneux du Nord-est de L’Algérie (Quézel & Santa, 1962 – 63).
I.3.4/ Iris unguicularis Poir.
Iris unguicularis Poir. est une espèce endémique Algéro-tunisienne (Quézel &
Santa, 1962 – 63). Elle Pousse dans les broussailles, les forêts, les rocailles et les garrigues. Commun dans le Tell algéro-constantinois jusqu’à environ 1600 m d’altitude (Quézel & Santa, 1962 – 63 ; Beniston & Beniston, 1984).
12 I.4/ Intérêt de la cytogénétique végétale
1.4.1/ Définition et intérêt
La cytogénétique fait le lien entre la cytologie et la génétique. Les premiers travaux chez les végétaux ont débuté au cours de la seconde moitié du 19e siècle mais c’est surtout à partir de 1920 que la cytogénétique s’est développé et son importance n’a cessé de croitre par la suite. La cytogénétique est d’abord une science d’investigation. Elle a activement contribué à la compréhension des mécanismes héréditaires et la nouvelle classification du monde végétale (taxonomie et phylogénie). Elle participe à : La connaissance du nombre de chromosomes matériel végétal utilisé, l’établissement des cartes génétiques, L’exploitation de la variabilité intraspécifique, interspécifique ou induite et l’amélioration des plantes (Jahier et al., 1992).
La cytogénétique végétale est une discipline sur laquelle s’appuie l’amélioration des plantes. Cette dernière a connu de prodigieux développements lorsqu’on a découvert les propriétés de la colchicine, agent permettant de doubler le stock chromosomique de cellules végétales. On a donc pu imaginer faire des super-plantes, en augmentant le nombre de chromosomes (plantes polyploïdes). On a aussi pu imaginer d'exploiter plus systématiquement les hydrides entre espèces ; en effet, ceux-ci sont normalement stériles pour cause de non-appariement des chromosomes parentaux en méiose ; le doublement de leur nombre, rétablissant une situation disomique pour chacun d'eux, permet une méiose subnormale et restaure dans une certaine mesure la fertilité. C'est ainsi que l'hybride blé x seigle (en latin : Tritium x Seal) donne après traitement à la colchicine une structure amphidiploïde (hybride interspécifique) fertile, le triticale (Bemard & Bemard, 1992).
1.4.2/ Les chromosomes
Sont des structures en forme de bâtonnets faites de chromatine (matériel génétique), visible pendant la division cellulaire. Sur chaque chromosome sont alignés les gènes dans un ordre fixe. Chaque chromosome porte une zone de constriction primaire dénommé centromère ; c’est le point de liaison des deux chromatides sœurs.
13
Les segments chromosomiques situés de part et d’autre du centromère constituent les deux bras du chromosome. La position du centromère permet de distinguer un bras cour et un bras long (Griffiths et al., 2002).
1.4.2.1/ Différents types de chromosomes
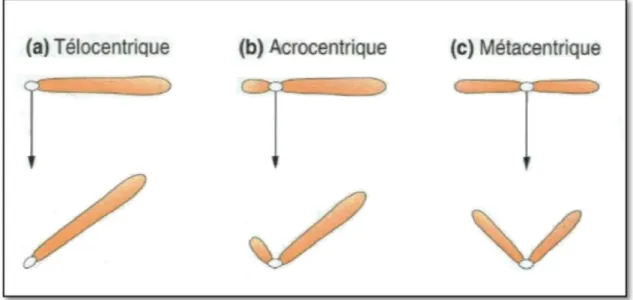
Griffiths et al. (2002), ont classé les chromosomes selon la position de leurs centromères en 3 groupes (Fig. 1) :
A/ Chromosome télocentrique
Un chromosome télocentrique a son centromère situé à l’une des extrémités, lorsque le chromosome migre durant la division cellulaire, il apparait comme une simple baguette.
B/ Chromosome acrocentrique
Un chromosome acrocentrique a son centromètre quelque part entre l’extrémité et le milieu du chromosome, au cours de son déplacement, le chromosome ressemble à un J.
C/ Chromosome métacentrique
Un chromosome métacentrique a son centromère au milieu et ressemble à un V au cours de sa migration.
14
Fig. 1 : Représentation schématique de quelques type de chromosomes (Griffiths et al., 2002)
I.5/ Caryologie des espèces étudiées
Il ressort de la documentation consultée que M. arabica est une espèce diploïde avec 2n=16 chromosomes, alors que M. murex est diploïde avec 2n = 14 chromosomes (Heyn, 1963 ; Lesins & Lesins, 1979 ; Small & Jomphe, 1989 ; Bena et al., 1998).
Divers auteurs, qui ont travaillé sur la cytologie du genre Medicago, exposent la difficulté à compter et à reconnaître la morphologie des chromosomes causée par l'encombrement des petits chromosomes qui se chevauchent sur la plaque métaphasique (Heyn, 1956). Les chromosomes de M. arabica et de M. murex, sont petits et montrent une mauvaise séparation à la métaphase et se prêtant mal à la coloration (Lesins & Lesins, 1979 ; Gillespie & Mc Comb, 1991).
Dans quelques espèces du genre Medicago, les chromosomes sont relativement petits, de 2,2 à 3,2 μm de long. Les centromères sont à la position médiane à sub-médiane dans au moins 7 couples chromosomiques. Le satellite fait presque la moitié de la longueur totale du chromosome qui le porte. Parfois cela peut donner l'apparence de deux chromosomes séparés (Lesins & Lesins, 1965). Les parties des chromosomes se chevauchent soit au niveau des extrémités soit au niveau des satellites, ce qui
15
explique que certains auteurs ont estimé incorrectement le nombre 2n dans certaines espèces du genre Medicago (Lesins & Lesins, 1963).
Chez le genre Allium, les chromosomes sont de grandes tailles (Guern et al., 1991 ; Jauzein et al., 2002). Des diploïdes, tétraploïdes et des héxaploïdes ont été trouvés chez ce genre (Allium) (Guern et al., 1991). Selon Friesen et al. (2006), Allium triquetrum L. est un taxon diploïde qui possède 16 chromosomes (2n = 16), avec un nombre chromosomique de base x = 8.
Les études caryologiques réalisées sur le genre Phlomis, montrent que la polyploïdie n’est pas fréquente dans ce genre et le nombre chromosomique de base x = 10 et 11 (Chaksanova & Kaplanbekova, 1971; Azizian & Cutler, 1982). D’après, Azizian & Cutler (1982), Phlomis samia subsp. moroccana, provenant du Maroc, très proche de Phlomis bovei, est diploïde avec 2n = 20 chromosomes.
Très peu d’étude caryologiques ont été réalisées sur Iris unguicularis Poir. La première étude caryologique réalisée sur cette espèce (Iris unguicularis Poir.) a été menée par Simonet (1928) ; où il affirme que le taxon est tétraploïde possédant un nombre chromosomique de 2n = 4x = 40 avec un nombre de base x = 10.
En 1990 une autre étude a été réalisée sur l’Iris unguicularis Poir. où plus de 60 spécimens ont été récoltés sur littoral et le tell algérien. Le résultat de cette étude rapporte un autre nombre chromosomique diploïde (2n=20) avec un nombre chromosomique de base x = 10 (Davis & Jury, 1990).
I. 6/ Diagnoses des espèces étudiées
I.6.1/ Medicago arabica L.
Selon Lesins & Lesins (1979), Plantes de 40 à 65 cm de long, tiges couchées, ramification abondante provenant de la base. Stipules larges, profondément dentées. Folioles larges, amples, 11-23 mm x 14-32 mm, obcordées, obovées, généralement avec une tache anthocyanique au milieu, Glabre sur le côté supérieur. Pédoncule ± long du pétiole correspondant, 2 à 5 fleurs, avec une arrête terminale. Fleurs de 5 à 6 mm de long. Pédicelle est inférieur que le tube de calice; Bractée aussi longues que le
16
pédicelle, souvent plus longues. Calices 2,5-3 mm de long, peu couvertes de poils. Corolle jaune vif; ovale; les ailes plus courtes que la carène. Gousses matures cylindrique à sphérique, planes aux deux extrémités, de couleur jaune-paille à brunâtres, glabres, épineuses. Spires 3,5-6, tournant dans le sens des aiguilles d'une montre. Graines de jaune à brunâtre, 2,5-3,5 mm x 1,2-1,5 mm, 1-3 par spire, séparées
I.6.2/ Medicago murex Willd.
D’après Lesins & Lesins (1979)
Plantes de 30 à 90 cm de long, tiges couchées à obliques, provenant de la base et se ramifiant secondairement. Parties végétatives glabre, ou peu couvertes de simples poils semi-verticaux. Stipules profondément incisées, parfois avec incisions secondaires, formant de longues dents; Dans les nœuds supérieurs, les stipules se forment parfois en une seule dent. Folioles 9-21 mm x 8-12 mm, obovés à coniques ; face supérieur glabre, la face inférieure couverte de quelques poils surtout le long de la nervure centrale. Pédoncule de 1 à 6 fleurs, avec une arrête terminale, généralement 2 à 5 fois plus longue que le pétiole correspondant, Rarement un peu plus long que, ou aussi long que le pétiole. Fleurs de 4 à 7 mm de long. Pédicelle inferieur au tube de calice; Bractées ont ± la longueur du pédicelle. Calice de 3 à 4 mm de long. La corolle jaune, généralement moins de deux fois plus longue que le calice, est rarement égale ou plus de deux fois plus longue; Les ailes nettement plus longues que la carène.
Gousses matures sphérique, de couleur grises-verdâtre à noir, épineuse ou inerme, 6 à 9 spires par gousse. Graines 3.5-4.5 mm x 1.5-2.5 mm, souvent en forme d'arc, 1 à 2 graines par spire, séparées.
I.6.3/ Allium triquetrum L.
Tige molle, de 10-40 cm, très nettement triquètre et à angles aigus ; se rétrécissant sous l'inflorescence. Feuilles glabres, planes. Fleurs blanches, grandes (tépales de 10-18 mm de long); dressées puis nutantes ou pendantes (Quézel & Santa, 1962-63).
17 I.6.4/ Phlomis bovei de Noé
Herbes vivaces à tiges puissantes 50-80 cm, peu rameuses. Feuilles inférieures triangulaires cordiformes à la base, les florales lancéolées pétiolées. Calice à dents triangulaires courtes égalant le 1/8 de la longueur du tube (Quézel & Santa, 1962- 63).
I.6.5/ Iris unguicularis Poir.
Plante rhizomateuse à rhizome rampant. Feuilles linéaires. Divisions du périanthe de coloration très variable. Capsule bosselée, oblongue-trigone, brusquement contractée en bec de 4 mm env. Graines brun noir. Floraison décembre-avril, avec des fleurs de couleurs violettes (Quézel & Santa, 1962-63).
Chapitre II : Matériel et méthodes
Chapitre II : Matériel et méthodes
18 ІІ/ Chapitre II : Matériel et méthodes
Ce travail a été réalisé au Laboratoire de Recherche en Ecologie et Environnement de l’université abderrahmane MIRA à Béjaïa (UAM- Béjaïa).
ІІ.1/ Matériel utilisé
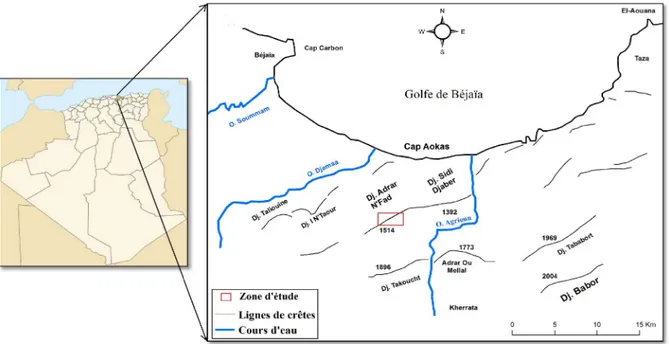
ІІ.1.1/ Les espèces étudiées et leurs origines
Notre échantillonnage a été fait dans le secteur de Kéfrida (fig.2). Notre étude a porté sur cinq espèces appartenant à quatre familles botaniques de plantes vasculaires. Ces espèces sont : Médicago arabica L. (Famille des Fabaceae) ; Medicago murex Willd. (Famille des Fabaceae), Allium triquetrum L. (Familles des Liliaceae) ; Phlomis
bovei De Noe (Famille des Lamiaceae), Iris unguiculais Poir (Familles des Iridaceae).
Le choix des espèces est basé essentiellement sur la rareté et sur l’endémisme, mais nous avons aussi pris en considération la disponibilité du matériel végétal. Les taxons récoltés de différentes stations sont représentées dans le Tableau ІV.
Tab. ІV :Origine géographique des espèces étudiées, date et heure de fixation des boutons floraux. Espèces Origine géographique Altitude (m) Date de fixation Heure de fixation Temps (météorologique) à la récolte Coordonnées GPS
Allium triquetrum L. Kéfrida
(Tighzert) 550 03/03/2017 12h30
Ciel dégagé, il fait chaud
36,580628 ° 5,256204 °
Medicago murex Willd. Kefrida
(Acherouf) 800 24/02/2017 10h30
Ciel dégagé, il fait chaud
36,565387 ° 5,2566006 °
Iris uguiculari Poir. Kefrida
(Tadefelt) 1200 08/04/2017 14h00
Ciel nuageux avec pluie, il fait frais
36,578792 ° 5,246679 °
ІІ.1.2/ Récolte des boutons floraux
Nous avons récolté les boutons floraux (les plus jeunes et les moins jeunes) au stade avant l’anthèse pour tous les taxons étudiés. Ces boutons floraux ont été mis immédiatement dans des tubes à essai contenant la solution de fixateur (Ethanol, chloroforme et acide acétique 6:3:1). La première récolte s’est faite le 24/02/2017 (Tab.
Chapitre II : Matériel et méthodes
19
Fig. 2 : Localisation géographique de la zone d’étude.
Chaque tube à essai comportant les boutons floraux porte une étiquette sur laquelle on mentionne le nom de la station, altitude approximative (m), nom de l’espèce, date de fixation, heure de fixation (Tab. ІV).
ІІ.1.3/ Récolte des gousses et des graines
Nous avons ramassé des gousses appartenant aux espèces sur lesquelles notre étude a porté. Les gousses de chaque espèce ont été récoltées dans des sachets en papier portant le nom de la station, altitude approximative (m), nom de l’espèce et la date de récolte. Ces gousses sont destinées à une mise en culture pour l’analyse de la méiose, fertilité pollinique et l’analyse de la mitose (Tab V).
Tab. V : Origine géographique des espèces étudiées, date et heure de récolte des gousses et des graines. Espèces Origine géographique Altitude (m) Date de récolte Coordonnées GPS
Phlomis bovei de Noé Kéfrida
(Tadefelt) 1200 03/03/2017
36,578792 ° 5,246679 °
Medicago arabica L. Kefrida
(Acherouf) 800 24/02/2017
36,565387 ° 5,2566006 °
Chapitre II : Matériel et méthodes
20 ІІ.1.3.1/ Mise à germination des graines
A partir des gousses récoltées dans les différentes stations, nous avons récupéré les graines les plus saines et les avons, scarifiées à l’aide de papier verre. Les graines scarifiées de chaque taxon sont déposées sur du papier filtre coupé aux même dimensions que la base de la boite de pétri, humidifiées à l’eau et mises à germer à l’obscurité. Dans chaque boite de pétri, comportant les graines, on place une étiquette portant, le nom de la station, le nom de l’espèce et date de mise à germination.
ІІ.1.3.2/ Mise en culture des plantules
Après la germination, on place 4 jeunes plantules dans chaque pot en plastique contenant du sol. Nous avons aussi récolté des plantules entières à partir de leur milieu d’origine et transplantées dans des pots en plastique au laboratoire. Les plantules contenues dans des pots sont mises à l’extérieur du laboratoire (sur les bords des fenêtres, orientation Ouest) et sont arrosées régulièrement à l’eau de robinet.
Chaque pot porte une étiquette sur laquelle on note le nom de la station, le nom de l’espèce et la date de plantation.
ІІ.2/ Analyse des méioses polliniques
ІІ.2.1/ Préparation des solutions
ІІ.2.1.1/ Le fixateur
Le fixateur utilisé est celui du Carnoy ІІ composé de : 6 volumes d’éthanol absolu,
3 volumes de chloroforme,
1 volume d’acide acétique absolu.
Ce fixateur assure un arrêt rapide des divisions cellulaires, sans léser ou détruire la structure chromosomique, et une bonne conservation du matériel végétal par son rôle aseptisant, et il assure une meilleure conservation pour la disponibilité du
Chapitre II : Matériel et méthodes
21
matériel végétal pendant une longue période, lorsqu’il est conservé à l’obscurité à 4°C (Jahier et al., 1992) .
ІІ.2.1.2/ Le colorant
Le colorant utilisé est à base d’orceine lactopropionique préparé selon Dyer (1963) modifié selon Love & Love (1975). Dans un grand erlenmeyer, on dissout 2 g d’orcéine dans 23 ml d’acide propionique et 23 ml d’acide lactique, ensuite on ajoute de l’eau distillée jusqu'à 100 ml et on agite bien la solution puis on filtre. La solution d’orcéine ainsi obtenue se conserve longtemps dans un flacon en verre fumé.
ІІ.2.2/ Le matériel végétal à observer
Les anthères constituent un matériel de choix pour analyser les chromosomes. La principale difficulté consiste à récolter les anthères au moment ou les cellules mères des grains de pollens (CMP) subissent la méiose.
ІІ.2.3/ Les différentes étapes de l’analyse de la méiose
Le protocole d’analyse des méioses polliniques comporte les étapes suivantes :
ІІ.2.3.1/ Prélèvement et fixation
Durant la période de floraison, les boutons floraux sont prélevés très jeunes (apex des tiges) et mis immédiatement dans des tubes à essai contenant la solution de fixateur.
ІІ.2.3.2/ Hydrolyse à HCl
Les boutons floraux fixés sont transférés dans le HCl à 60 ° C pendant 3 à 4 minutes. Cette étape a pour but de ramollir les cellules et éclaircir le cytoplasme. Après l’hydrolyse, les boutons floraux sont remis encore dans le fixateur.
ІІ.2.3.3/ Choix des boutons floraux
Sous la loupe binoculaire, à l’aide de deux aiguilles, on prend une fleur à partir d’un bouton floral le plus jeune, et on la met sur une lame propre en lui ajoutant une
Chapitre II : Matériel et méthodes
22
goutte d’eau, ensuite on fait sortir les anthères qu’on écarte les unes des autres à l’aide d’une aiguille. On laisse sécher la goutte d’eau, puis on passe à la coloration.
ІІ.2.3.4/ La coloration
Cette étape consiste à mettre une goutte du colorant sur une lame préparée, et recouvrir d’une lamelle, puis on met du papier filtre sur la lamelle pour éliminer l’excès du colorant en exerçant une légère pression avec le pouce pour étaler les anthères et libérer les cellules mères polliniques.
ІІ.2.3.5/ L’observation
Après la coloration, on passe la préparation au microscope photonique pour observer les cellules en méiose. Les cellules mères polliniques sont repérées facilement à l’aide d’un objectif de grossissement (G = 10 ou G = 40). L’observation des chromosomes est obtenue par un grossissement supérieur le plus souvent avec le grossissement (G = 100). Pour pouvoir compter les chromosomes, on doit chercher des divisions cellulaires au stade métaphasique où les chromosomes sont plus ou moins contractés, ce qui facilite leur individualisation.
ІІ.2.3.6/ Photographie
Les bonnes préparations sont photographiées à l’aide d’un microscope trinocualire OPTIKA-B350 équipé d’un appareil photo numérique adapté.
ІІ.3/ Analyse de la fertilité pollinique
ІІ.3.1/ Le matériel végétal utilisé
Les boutons floraux mûrs sont récoltés au stade avant l’anthèse pour toutes les
espèces étudiées. Ces boutons floraux sont mis tout de suite dans le fixateur (Ethanol, chloroforme et acide acétique 6:3:1) contenu dans un tube à essai hermétiquement fermé, puis conservés à l’obscurité.
Chapitre II : Matériel et méthodes
23
ІІ.3.2/ Technique d’étude de la fertilité pollinique
La technique utilisée pour étudier la fertilité pollinique a été inspirée du protocole de Mertens et Hamnersmith (1998). Cette technique est la coloration au bleu de coton au lactophenol. Le colorant est composé de :
8 volumes de glycérine,
4 volumes d’acide lactique à 85%,
4 volumes d’un mélange de cristaux de phénol (1 g de phénol + 4 ml d’eau distillée).
2 volumes d’eau distillée,
1 volume de bleu d’aniline à 1% (0.05 ml + 100 ml d’eau distillée).
ІІ.3.3/ La technique de coloration des grains de pollen
Sous la loupe binoculaire, sur une lame de microscope dans une goutte d’eau on fait sortir les anthères à partir d’une fleur en utilisant deux aiguilles, ensuite on écrase les anthères pour libérer le maximum de grains de pollen. On élimine les débris de la fleur et les anthères vides, puis on laisse sécher la goutte d’eau contenant les grains de pollen. On ajoute alors une petite goutte de bleu de coton et on recouvre d’une lamelle. Les grains de pollen sont vite colorés et on les observe au microscope photonique. On compte entre 400 et 500 grains de pollen par fleur puis on calcule le taux de fertilité pollinique. Les grains de pollen colorés uniformément d’un bleu foncé sont considérés viables et fertiles, alors que ceux de forme et de tailles anormales et non colorés uniformément sont considérés non viables et stériles.
ІІ.3.4/ Estimation du taux de fertilité pollinique
Le taux de fertilité pollinique est le rapport de la somme des grains de pollen fertiles sur la somme des grains de pollen fertiles et non fertiles (stériles).
TF = n / N * 100
TF = Taux de fertilité pollinique
Chapitre II : Matériel et méthodes
24
N = Nombre total de grains de pollen ; normaux (fertiles) et anormaux (stériles).
ІІ.4/ Analyse de la mitose
ІІ.4.1/ Préparation des solutions
ІІ.4.1.1/ Le fixateur
Le fixateur utilisé est composé de : 3 volumes d’éthanol
1 volume d’acide acétique glacial
Ce fixateur détruit toute vie cellulaire. Il doit avoir une action rapide pour bloquer toute évolution des divisions cellulaires. Il permet de conserver l’intégrité structurale des chromosomes et d’améliorer l’absorption des colorants (Love & Love, 1975 ; Jahier et al., 1992).
ІІ.4.1.2/ Le colorant
Comme dans ІІ.2.1.2 .
ІІ.4.1.3/ La solution de colchicine
Dans un flacon en verre, on dissout 0,05 g de colchicine dans 100 ml d’eau distillée, on agite bien la solution, et on la laisse pour quelques heures, le temps que les grains de colchicines se dissolvent complètement. La solution obtenue est celle de colchicine à 0,05%. La colchicine a pour effets principaux de bloquer les divisions cellulaires au stade métaphasique et de contracter les chromosomes.
ІІ.4.2/ Le matériel végétal utilisé
Les méristèmes racinaires de graines germées, constituent un matériel de choix pour observer les chromosomes en mitose.
Chapitre II : Matériel et méthodes
25
ІІ.4.3/ Les principales étapes de l’analyse de la mitose
ІІ.4.3.1/ Prétraitement
A partir des graines germées, on prélève avec des pinces propres les pointes des racines d’environ 2 cm. Ces pointes des racines seront mises tout de suite dans un tube à essai contenant la solution de colchicine à 0,05% pour une durée de deux heures à l’obscurité.
ІІ.4.3.2/ La fixation
Après le prétraitement, les pointes des racines sont transférées dans un tube à essai contenant le fixateur pour une durée de 5 minutes.
ІІ.4.3.3/ L’hydrolyse à l’acide Chlore-Hydryque (HCl)
Une solution de HCl (1N) sera mise au bain-marie à 60° C pendant 5 minutes. Les racines fixées sont ensuite transférées dans cette solution de HCl (1N) préchauffée à 60° C, contenu dans un tube à essai, puis remise au bain-marie à 60° C pour encore 3 minutes pour M. arabica et 10 minutes pour P. bovei de Noé.
ІІ.4.3.4/ Coloration
Après l’hydrolyse, les racines sont transférées, dans le colorant contenu dans un tube à essai, puis mises au bain- marie à une température de 60°C pendant 3 minutes pour M. arabica et 10 minutes pour P. bovei de Noé.
ІІ.4.3.5/ Préparation des lames et lamelles
Sous la loupe binoculaire, avec une pince propre, on prend une racine et on la met sur une lame de microscope, et avec une lame de rasoir on coupe l’extrémité de la racine colorée en rouge, puis on ajoute une goutte du colorant (orcéine lactopropionique), on place alors la lamelle et, après avoir éliminé le surplus de colorant à l’aide du papier absorbant, nous écrasons avec le pouce perpendiculairement à la lamelle, en prenant soin de ne pas la déplacer.
Chapitre II : Matériel et méthodes
26 ІІ.4.3.6/ Observation
Cette étape consiste à passer la préparation au microscope optique, pour observer les cellules en mitose. On doit chercher des cellules au stade métaphasique afin de pouvoir compter les chromosomes.
ІІ.4.3.7/ Photographie
Les préparations réussies seront photographiées, à l’aide d’un microscope trinocualire OPTIKA-B350 équipé d’un appareil photo numérique adapté.
27 III/ Chapitre III : Résultats et discussions III.1/ Medicago arabica L.
Cette espèce est caractérisée par la présence d’une tache noire sur les folioles (Fig. 3). Elle est rare en Algérie (Quézel & Santa, 1962-63).
Fig. 3: Luzerne d’Arabie (Medicago arabica L.) III.1.1/ Analyse de la mitose
L’analyse de la mitose portée sur 40 méristèmes racinaires appartenant à 40 graines de M. arabica a montré une assez bonne séparation des chromosomes à la métaphase, permettant ainsi un dénombrement correct des chromosomes (2n = 16). (Fig. 4)
28
Ce résultat de 2n = 16 chromosomes, rejoint ceux obtenus par différents auteurs pour M. arabica (Heyn, 1963 ; Lesins & Lesins, 1979 ; Agarwall, 1983 ; Bena et al., 1998).
III.1.2/ Analyse de la fertilité pollinique
L’analyse de la fertilité pollinique réalisée sur 3 fleurs de M. arabica est présentée dans le tableau VI.
Tab. VI : Fertilité pollinique de Medicago arabica L. Espèce Nombre de plantes
analysées Nombre de fleurs analysées Taux de fertilité pollinique (%). M. arabica 3 3 89 – 94
La fertilité pollinique des plantes analysées est très élevée, elle varie de 89 à 94% (Tab. VI). Ce taux élevé est comparable à celui obtenu par Benmouhoub (2007) pour
M. arabica L. et pour M. polymorpha à tache noire au centre des folioles. III. 2/ Medicago murex
Cette espèce est glabre, présentant 1-4 fleurs/grappe, avec des folioles de couleur vert foncé (Fig. 5).
29
Fig. 5: Luzerne murex (Medicago murex) III.2.1/ Analyse de la méiose
L’analyse de la méiose faite sur 120 fleurs de M. murex a donné une bonne séparation des chromosomes à la métaphase I. De ce fait les chromosomes ont été dénombrés d’une façon sûre. Sur les plaques métaphasiques Fig. 6, ce nombre est de 2n=14.
30
Ce résultat de 2n = 14 chromosomes, s’accorde avec ceux obtenus par Heyn (1963) ; Lesins & Lesins (1979) ; Small & Jomphe (1989) ; Bena et al. (1998), pour
M. murex Willd.
III.2.2/ Analyse de la fertilité pollinique
L’analyse de la fertilité pollinique effectuée sur 3 fleurs de M. murex est présentée dans le tableau VIІ.
Tab. VIІ : Fertilité pollinique de Medicago murex Willd Espèce Nombre de plantes
analysées Nombre de fleurs analysées Taux de fertilité pollinique (%). M. murex 3 3 95 - 97
La fertilité pollinique des plantes analysées est très élevée, elle varie de 95 à 97% (Tab. VIІ.). Ce taux élevé est comparable à celui obtenu par Bouchibane (2009) pour les différents morphotypes de M. polymorpha L. (87 – 99%). Cette dernière (M.
polymorpha L.) est proche de M. murex, présentant tout les deux le même nombre de
chromosomes (2n = 14).
III. 3/ Allium triquetrum L.
Ce taxon est présent dans tout le Nord de l’Algérie. Il présente des fleurs blanches (Fig. 7).
31
Fig. 7 : Allium triquètre (Allium triquetrum L.) III.3.1/ Analyse de la méiose
L’analyse de la méiose réalisée sur 80 fleurs d’Allium triquetrum L. a donné une bonne séparation des chromosomes à la métaphase avec 8 bivalents (Fig. 8) d’où 2n=16.
Ce nombre chromosomique de 2n=16 a été signalé par Friesen et al. (2006), pour
Allium triquetrum L.
32 III.3.2/ Analyse de la fertilité pollinique
Trois fleurs d’Allium triquetrum L. ont fait l’objet d’une analyse de la fertilité pollinique, les résultats obtenus sont présentés dans le tableau VIІІ.
Tab. VIІІ : Fertilité pollinique d’Allium triquetrum L.
Espèce Nombre de plantes analysées Nombre de fleurs analysées Taux de fertilité pollinique (%). Allium triquetrum L. 3 3 97 - 99
La fertilité pollinique des plantes analysées est très élevée, elle varie de 97 à 99% (Tab. VIІІ).
III. 4/ Iris unguicularis Poir.
Cette espèce est une endémique de l’Algérie et de la Tunisie (Quézel & Santa, 1962-63). Elle est assez commune dans notre région d’étude. Ce taxon est connu par ses fleurs violettes (Fig. 9).
33 III.4.1/ Analyse de la méiose
L’analyse de la méiose faite sur 90 fleurs d’Iris unguicularis Poir. a montré une séparation insuffisante des chromosomes au cours de la métaphase I. Du coup, les chromosomes ne peuvent être comptés de façon correcte sur les plaques métaphasiques (Fig. 10).
Fig. 10 : Méioses d’Iris unguicularis Poir. (Stade de métaphase I)
Cette séparation insuffisante des chromosomes à la métaphase I, peut s’expliquer par le manque de connaissance sur le moment de la fixation des boutons floraux.
III.4.2/ Analyse de la fertilité pollinique
L’analyse de la fertilité pollinique effectuée sur trois fleurs d’Iris unguicularis Poir. a donné les résultats présentés dans le tableau IX.
Tab. ІX : Fertilité pollinique d’Iris unguicularis Poir.
Espèce Nombre de plantes
analysées Nombre de fleurs analysées Taux de fertilité pollinique (%). Iris unguicularis Poir. 3 3 89 - 92
Les fleurs des différentes plantes analysées ont montré un taux de fertilité pollinique élevé, il varie de 89 à 92 % (Tab. ІX).
34 III. 5/ Phlomis bovei De Noé :
Cette espèce est une endémique Algéro-tunisienne (Dobignard & Chatelain, 2010-2013). Elle présente des feuilles inférieures triangulaires cordiformes à la base (Fig. 11). Phlomis bovei De Noé. est rare et inscrite sur la liste de l’UICN, 1997 (Walter & Gillet, 1998).
Fig. 11 : Phlomis (Phlomis bovei De Noé.) III.5.1/ Analyse de la mitose
L’analyse de la mitose portée sur 65 méristèmes racinaires de Phlomis bovei De Noé. a donné une séparation insuffisante des chromosomes au cours de la métaphase, de ce fait les chromosomes ne peuvent être comptés de façon correcte sur la plaque métaphasique (Fig. 12). Une estimation de 16 à 18 chromosomes a été faite. Cette mauvaise séparation des chromosomes à la métaphase est probablement due à la mauvaise qualité de la colchicine utilisée comme prétraitement.
35
Fig. 12 : Mitose de Phlomis bovei De Noé.
III.6/ Autres résultats et leurs commentaires
III.6.1/ Les différents stades de la mitose :
Les différents stades de la mitose ont pu être observés chez Phlomis bovei De Noé. La figure 13 montre les principales phases de la mitose.
36
Fig. 13: Les différents stades de la mitose chez Phlomis bovei De Noé.
A: Interphase; B: Prophase ; C : Métaphase ; D : Début Anaphase ; E: Fin Anaphase ; F : Télophase ; G : Deux Cellules filles
A
B CD E
37 III.6.2/ Les principales phases de la méiose :
Les principales phases de la méiose ont été observées pour les différentes espèces étudiées. La figure 14 montre les principaux stades de la méiose chez les différentes espèces étudiées.
Fig. 14 : Les principales phases de la méoise des espèces étudiées.
A : Prophase ; B : Metaphase I ; C : Metaphase II ; D : Télophase II ; E : Tétrades ; F : Grains de pollen
A
B
C
D
38 III.6.3/ Quelques anomalies de la méiose :
Nous avons remarqué que certaines cellules présentent des tétrades anormales (Pentades et Triades) et d’autres présentent des cytomixies (Fig. 15).
Fig. 15: Anomalies associées à la méiose observées chez M. murex.
A: Triade, B: Pentade, C : Cytomixie (la flèche indique une connexion cytoplasmique).
Ces anomalies (Pentades et Triades) sont liées à la formation de chromosomes retardataires et de micronoyaux (Pupilli et al., 1995; Mendes- Bonato et al ., 2001).
La cytomixie est un transfert de chromosomes d’une cellule à une autre, à travers des connexions cytoplasmiques. Des conditions environnementales et des facteurs génétiques, non élucidés, peuvent induire cette anomalie (Love, 1938 et Bass et al., 2003). Certains auteurs pensent que certains facteurs peuvent être responsables de son
A
B
39
apparition comme les agents chimiques tels que la colchicine et les herbicides, le changement des processus biochimiques entraînant la modification du microenvironnement des anthères lors de la microsporogénése et enfin l’influence des gènes (Bellucci et al., 2003). Cette anomalie a été observée chez M. murex Willd.
La technique utilisée pour étudier la fertilité pollinique en nous inspirant du protocole de Mertens et Hamnersmith (1998) a donné des résultats satisfaisants dans la mesure où on a pu distinguer facilement les grains de pollen normaux (fertiles) et les grains de pollen anormaux (stériles), ce qui nous a permis de calculer aisément le taux de fertilité pollinique pour chaque espèce.
La figure 16 est une photographie qui montre les grains de pollen normaux (fertiles) et les grains de pollen anormaux (stériles) de certaines espèces étudiées.
Fig. 16 : Photographie de grains de pollen normaux (fertiles) et anormaux (stériles) d’Allium triquetrum et M. arabica L.
A : Grain de pollen fertile d’Allium triquetrum ; B : Grain de pollen sterile d’Allium
triquetrum ; C : Grain de pollen fertile de M. arabica ; D : Grain de pollen sterile de M. arabica
A
B
40
III.6.4/ Cellules du tapétum chez l’espèce I. unguicularis
Durant les manipulations des méioses poliniques chez I. unguicularis Poir. on a remarqué la présence de cellules un peu blizzaroîdes à cause de leurs natures polynucléé. Après une recherche bibliographique, il s’est avéré que se sont les cellules du tapetum. En effet ; la paroi d’une anthère est réellement constituée de cinq couches. C’est au début de la méiose, que les cinq couches de tissu sont différenciées et reconnues. En comptant de l’extérieur vers l'intérieur : la couche de tissu tapetum est classée quatrième juste au dessus de la couche des cellules mères (Pacini et Keijzer, 1989).
La plupart des cellules du tapetum ; au lieu de se diviser via une mitose normale, elles se divisent par endo-mitose ce qui est appelé aussi une mitose inhibée (Sharma et all., 2012).
Cette division (endo-mitose) est un type de division nouveau pour la cytologie des cellules du tapetum. Le cycle endo-mitotique consiste en endo-prophase, endo-metaphase, endo-anaphase et endo-telophase. Tout au long du processus, la membrane nucléaire reste intacte, il n'y a pas de formation de centrioles et par conséquent il n’existe aucun mouvement anaphasique des chromosomes. Ainsi, tous les chromosomes restent dans le même noyau, ce qui augmente le degré de polyploïdie (Witkus, 1945).
Selon Schrauwen et al., (1996) ; la couche de cellules tapetum a comme rôle : Alimentation des gamétophytes mâles en développement.
Sécrétion des enzymes telles que β-1, 3-glucanases pour décomposer la paroi callosique qui entoure les tétrades polliniques.
Participation dans la formation de l’exine du pollen.
La synthèse et la sécrétion des substances lipoïdiques qui seront déposées sur la surface des grains de pollen matures pour les protéger de la déshydratation. Production et sécrétion de composés protéiques impliqués dans la réhydratation
pendant la germination et la croissance du tube pollinique après le transfert du grain de pollen sur le stigmate.
La figure 17 ci-dessous montre les différentes cellules du tapetum qu’on a pu observer durant l’analyse des méioses chez l’espèce I. unguicularis Poir.
41
B
Fig. 17 : Les différentes cellules du tapetum observées chez I. unguicularis Poir. A : Cellule binucléée ; B : Cellule trinucléée ; C : Cellule trinucléée dont un noyau
est en division ; D : Cellule tétranucléée.
A
C
D
42
Cinq espèces végétales, ont fait l’objet d’une analyse cytogénétique : Trois espèces ont été analysées pour leurs méioses (Medicago murex Willd, Allium.
triquetrum L. et Iris unguicularis Poir.) et deux espèces ont été analysées pour leur
mitoses à savoir M. arabica L. et Phlomis bovei De Noé.
L’analyse de la mitose portée sur les méristèmes racinaires appartenant aux graines germées de Medicago arabica L. et de Phlomis bovei De Noé, a montré dans la plupart des cas une séparation insuffisante des chromosomes à la métaphase, mais sur une plaque métaphasique, on a pu dénombrer 16 chromosomes (2n = 16) chez
Medicago arabica L. Par contre, chez Phlomis bovei De Noé, les chromosomes, n’ont
pas pu être comptés de façon sûre. Toutes les phases de la mitoses ont été observées chez Phlomis bovei De Noé.
L’analyse de la fertilité pollinique effectuée sur les boutons floraux de quatre espèces (M. murex Willd, M. arabica L. ; Allium. triquetrum L. et Iris unguicularis Poir.) a donné un taux de fertilité pollinique élevé pour toutes les espèces : 89 – 94% (M. arabica L.), 95 – 97% (M. murex Willd.), 97 – 99% (Allium triquetrum L.), 89 – 92% (Iris unguicularis Poir.).
L’analyse de la méiose faite sur les boutons floraux avant anthèse a indiqué une ségrégation normale à 8 bivalents (2n=16) pour Allium. triquetrum L. et 7 bivalents (2n=14) pour M. murex Willd. Les principaux stades de la méiose ont pu être observés pour les espèces étudiées. Quelques anomalies de la méiose ont été relevées (Cytomixie, Pentades et triades), mais à une fréquence très faible.
Perspectives
Améliorer les techniques utilisées pour analyser les méioses et les mitoses, et élargir l’étude à d’autres espèces rares et endémiques de la région,