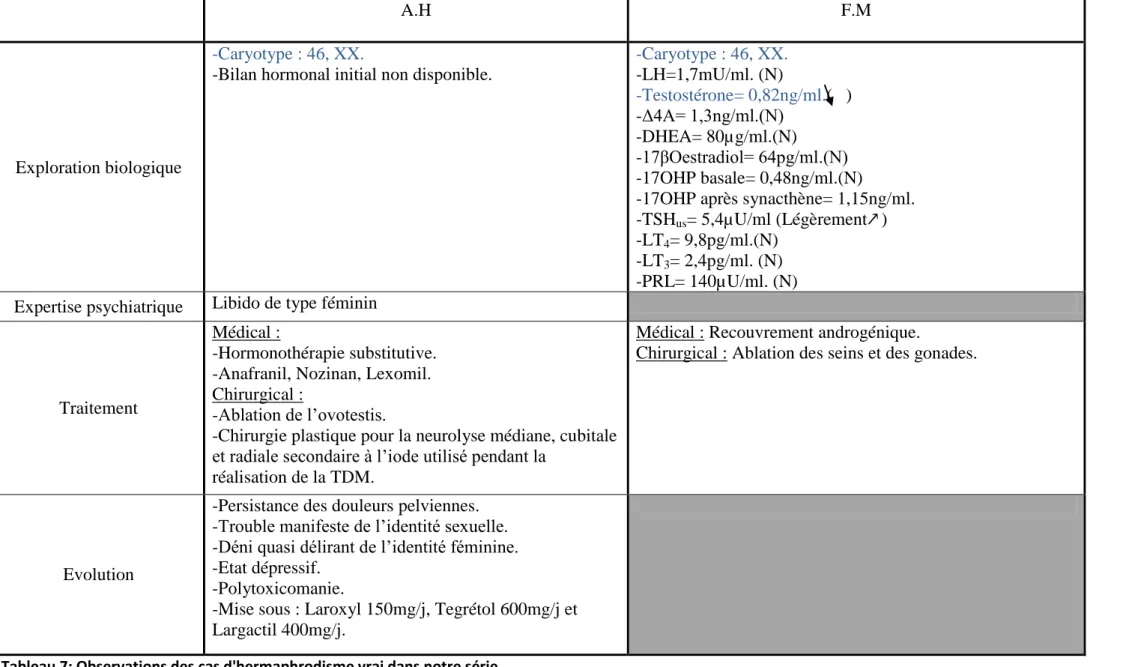
1
UNIVERSITE MOHAMMED V- SOUISSI FACULTE DE MEDECINE ET DE PHARMACIE
-RABAT- ANNEE: 200 THESE N°:
L
L
e
e
s
s
d
d
é
é
s
s
o
o
r
r
d
d
r
r
e
e
s
s
d
d
u
u
d
d
é
é
v
v
e
e
l
l
o
o
p
p
p
p
e
e
m
m
e
e
n
n
t
t
s
s
e
e
x
x
u
u
e
e
l
l
:
:
a a pprrooppooss ddee 0099 ccaass E Enn uunniittéé dd''eennddooccrriinnoollooggiiee ddee rraabbaattTHESE
Présentée et soutenue publiquement le :………..
PAR
Mlle. Mounia AMZERIN
Née le 24 Octobre 1983 à Casablanca
Pour l'Obtention du Doctorat
en Médecine
MOTS CLES Ambiguïtés sexuelles – Pseudohermaphrodisme masculin –
Pseudohermaphrodisme féminin – hermaphrodisme vrai – Hormones sexuelles.
JURY Mr. A. SEFIANI PRESIDENT Professeur de Génétique Mr. A. CHRAIBI RAPPORTEUR Professeur d'Endocrinologie et Maladies Métaboliques Mr. M. ABBAR Professeur d'Urologie Mr. F. RKIOUAK Professeur d'Endocrinologie et Maladies Métaboliques Mr. M. A. BEN YAHIA
Professeur de Gynécologie Obstétrique
2
Dédicaces
Toutes les lettres ne
sauront trouver les
mots qu’il
faut…
Tous les mots ne sauraient
exprimer la gratitude,
l’amour,
le respect, et la
reconnaissance.
Je dédie ce modeste
travail,
3
A mes très chers parents Rakoucha et Idriss,
A qui je dois tout et pour qui aucune dédicace ne saurait exprimer à sa
juste valeur mon grand amour, mon respect, ma reconnaissance et
l’attachement que j’ai toujours eu pour vous. Vos encouragements, conseils et
sacrifices m’ont toujours inspiré et éclairé. Vous avez toujours été à mes
cotés pour me soutenir, m’écouter, m’épauler et également pour partager mes
joies et mes moments de bonheur. Vous m’avez tout enseigné, je vous dois le
sens de responsabilité que j’ai appris. Vous êtes les investigateurs de ma
réussite. Ce travail, je vous le dois et aucune phrase ne saurait exprimer ma
grande reconnaissance et mon amour filial. Que Dieu vous prête longue vie
4
A mon frère Abdessamad,
Pour ton soutien et ton affection.
Que ce modeste travail soit l’expression de mon amour fraternel.
Que dieu te protège et te procure bonheur, santé et prospérité.
Je t’adore Abdou…
A ma Grand-mère Fatima,
Tu es ma deuxième mère,
Tu es l’exemple de dévouement, de bonté et d’honnêteté.
Les mots semblent si dénués de sens qu’il est difficile de trouver
l’expression qui traduise mon amour et mon affection pour toi…
A la mémoire de mes grands pères ElAlami et Omar,
A la mémoire de ma grand-mère Bahriya,
Puisse Allah, vous accueillir en son vaste paradis parmi les fidèles et les
sincères
5
A mes cousins et cousines.
A Tous les membres de ma famille
En témoignage de ma gratitude et l’expression de mon affection la plus
sincère, je vous dédie ce travail.
Que Dieu vous protège et vous procure bonheur, santé et prospérité.
A Tous mes amies
,
Saloua Jowhar (Merci d’avoir été à mes côtés, sans ton soutien je ne sais comment
j’aurai pu achever ce travail), Asmae Benarchid (Je n’oublierai jamais ce que tu as
fait pour moi depuis le début de mes recherches), Ikram Lori, Mounia Alhyan (Nos
moments de fourire, je les garderai pour toujours…), Sarah Elouazzani, Mounia
Aoulad chaâra, Siham Leshoub, Lamyaa Baïdi, Mariam Asseban,
A
tous nos maîtres des facultés de médecine
de Rabat.
Vous nous avez guidés le long de notre parcours avec passion tout en
nous transmettant votre savoir.
Je vous dédie cette thèse en témoignage le plus sincère de mon profond respect et
gratitude.
A tous ceux que j’ai omis de citer,
A tous ceux qui m’ont aidé de près ou de loin dans la réalisation
de cette thèse.
Veuillez trouver ici l’expression de mon profond respect,
ma reconnaissance et mon estime.
6
7
A notre maître et président de thèse,
Monsieur SEFIANI Abdelaziz,
Professeur de Génétique.
Nous sommes très sensibles à l’honneur que vous nous faites en acceptant de
présider notre jury de thèse.
Nous avons toujours apprécié vos qualités professionnelles et humaines.
Veuillez trouvez ici, cher maître, l’expression de notre reconnaissance la plus
grande et notre estime la plus profonde.
A notre maître et rapporteur de thèse,
Monsieur CHRAIBI Abdelmjid,
8
Professeur d’endocrinologie et des maladies
métaboliques.
Vous nous avez fait un très grand honneur en nous encadrant tout au long de ce
travail.
Vous nous avez toujours accueillies avec le sourire, la bienveillance et la
simplicité. Votre modestie jointe à votre compétence seront pour nous un exemple
à suivre dans l’exercice de notre profession.
Veuillez trouver ici, le témoignage de notre profonde reconnaissance et notre haute
considération.
A notre maître et juge de thèse
Monsieur ABBAR Mohamed,
9
Votre présence à ce jury nous est particulièrement chère.
Nous avons eu le privilège d’avoir été parmi vos élèves, et nous avons toujours été
impressionnés par vos qualités humaines, votre bonté et votre dévouement pour la
médecine et l’enseignement.
Qu’il nous soit permis de vous exprimer notre profond respect et toute notre
reconnaissance.
10
A notre maître et juge de thèse,
Monsieur RKIOUAK Fouad,
Professeur d’endocrinologie et des maladies
métaboliques.
Nous vous remercions du grand honneur que vous nous faites en acceptant de
faire partie de notre jury.
Vous nous avez accueillis avec modestie et beaucoup de simplicité.
Nous sommes
particulièrement touchés par la spontanéité et la gentillesse avec lesquelles vous
avez bien voulu juger notre modeste travail.
Veuillez trouver ici, l’expression de notre profonde gratitude et notre haute
considération.
11
A notre maître et juge de thèse,
Monsieur BENYAHIA Mohammed Ali,
Professeur de Gynécologie-Obstétrique,
Nous sommes très reconnaissants du grand honneur que vous nous faites en
acceptant de juger notre modeste travail.
Nous vous présentons nos vifs remerciements pour votre accueil. Nous sommes
honorés de compter parmi vos étudiants. Votre culture scientifique et votre
simplicité exemplaire sont pour nous un objet d’admiration.
Que votre sérieux et votre rigueur de travail soient pour nous un exemple à suivre.
Veuillez trouvez ici, le témoignage de notre profond respect et de notre sincère
gratitude.
Sommaire
12 RAPPEL
THEORIQUE……….7
I/-Classification : ... 18
II/-Le Pseudohermaphrodisme masculin : ... 19
A)-Déficits de la fonction testiculaire : ... 20
B)-Insensibilité des organes cibles à des androgènes normaux : ... 22
III/-Le pseudohermaphrodisme féminin : ... 25
B)-Le déficit en 11β-hydroxylase : ... 29
C)-Le déficit en 3β-hydroxystéroïde déshydrogénase : ... 30
D)-Le déficit en aromatase : ... 30
IV/-L’hermaphrodisme vrai : ... 31
V/-Le choix du sexe : ... 35
VI/-Traitement : ... 37
A)-L’hormonothérapie : ... 37
B)- La chirurgie : ... 40
C)-Les indications : ... 44
D)- La prise en charge psychologique : ... 46
VII/-Cas particulier de la prise en charge anténatale : ... 46
A)-Le diagnostic anténatal: ... 46
B)-Le traitement anténatal ... 47
C)-La prévention : ... 48 MATERIEL ET METHODES……….………41 I/-Objectif de l’étude : ... 49 II/-Matériels et Méthodes : ... 50 OBSERVATIONS……… ……44 RESULTATS……… ……53
I)-Le pseudohermaphrodisme masculin : ... 62
A)-Fréquence : ... 62 B)-Age du diagnostic : ... 63 C)-Sexe d’élevage : ... 63 D)-Motif de consultation : ... 63 E)-Antécédents : ... 64 F)-Examen Clinique : ... 64 G)-Bilan morphologique : ... 65 H)-Bilan biologique : ... 67 I)-Diagnostic étiologique : ... 68
13
K)-Evolution : ... 69
II)-Le pseudohermaphrodisme féminin : ... 69
A)-Fréquence : ... 69 B)-Age du diagnostic : ... 69 C)-Sexe d’élevage : ... 69 D)-Motif de consultation : ... 69 E)-Antécédents : ... 70 F)-Examen Clinique : ... 70 G)-Bilan morphologique : ... 70 H)-Bilan biologique : ... 71
I)- Diagnostic étiologique : ... 72
J)-Expertise psychiatrique et traitement : ... 72
K)-Evolution : ... 72 III)-L’hermaphrodisme vrai :... 72 A)-Fréquence : ... 72 B)-Age du diagnostic : ... 72 C)-Sexe d’élevage : ... 72 D)-Motif de consultation : ... 73 E)-Antécédents : ... 73 F)-Examen Clinique : ... 73 G)-Bilan morphologique : ... 73 H)-Bilan biologique : ... 74
I)-Expertise psychiatrique et traitement : ... 74
J)-Evolution : ... 75
DISCUSSION……… …….67
I/- Le pseudohermaphrodisme masculin : ... 76
II/-Le pseudohermaphrodisme féminin : ... 85
III/-L’hermaphrodisme vrai : ... 91 Conclusion... 99 Références bibliographiques ... 101 Résumé ... 116 ... 118 Abstract ... 119
15
16
INTRODUCTION
La naissance d’un enfant avec des organes génitaux anormaux est une situation alarmante, aussi bien pour les parents que pour les professionnels de santé : la principale question qui surgit est l’identité sexuelle du malade.
Des termes comme : ambiguïté sexuelle, état intersexué, hermaphrodisme.., longtemps utilisés, sont devenus controversés. Ils ne sont plus acceptés ni par les patients ni par leurs familles, l’inclusion du sexe dans une étiquette diagnostique augmente leur confusion et être désigné par le nom d’une créature mythique est percutant.
Ainsi, et grâce au progrès spectaculaire de la biologie moléculaire en matière de la compréhension des mécanismes du développement sexuel, une réévaluation des notions standards est devenue indispensable : des ateliers et des groupes de travail regroupant des experts internationaux ont été organisés, et un consensus a été élaboré
[37-53]
.
La nouvelle nomenclature doit refléter les atouts de la biologie moléculaire et s’accommoder aux variabilités phénotypiques. Les termes choisis doivent être précis et compréhensibles pour les patients et leurs familles sans les offenser.
L’appellation « les désordres du développement sexuel » ou « DSD » (Disorders of Sex Development) est recommandée. Elle désigne les états congénitaux où le développement du sexe chromosomique, gonadique ou anatomique est atypique.
Une fois l’anomalie du développement sexuel diagnostiquée, une attitude rapide, mais réfléchie, doit être adoptée, afin de limiter l’inévitable traumatisme que cette situation comporte ; d’autant plus qu’il peut s’agir d’une urgence à éliminer en 1er
lieu comme dans le cas du syndrome de perte de sel dans le cadre de l’hyperplasie congénitale des surrénales : cause la plus fréquente des pseudohermaphrodismes féminins.
Cela ne serait possible qu’au terme d’une démarche diagnostique et d’une enquête étiologique bien conduites, afin d’assigner dans les plus brefs délais un sexe définitif et assurer ainsi une prise en charge multidisciplinaire : médicale, éventuellement chirurgicale, mais aussi psychologique. Cette dernière s’avère de nécessité absolue surtout si le diagnostic de l’anomalie du développement sexuel est posé tardivement.
17
Nous rapportons le travail sur les désordres du développement sexuel réalisé à propos de neuf cas colligés en unité d’endocrinologie de Rabat durant la période 1989-2007. On y cite les motifs de consultation et on décrit les différents tableaux cliniques ainsi que les résultats des explorations paracliniques réalisées. On y rapporte également les éléments des diagnostics positif et étiologique et les modalités thérapeutiques.
18
I/-Classification :
Il existe plusieurs classifications qui permettent de mieux élucider les différents désordres du développement sexuel. La classification actuellement proposée est :
19
Appellation ancienne Nouvelle appellation proposée
Etat intersexué DSD -Pseudohermaphrodisme masculin. -Mâles XY insuffisamment virilisés. 46, XY DSD -Pseudohermaphrodisme féminin. -Femmes XX virilisées. 46, XX DSD
Hermaphrodisme vrai Ovotestis DSD
Mâles XX 46, XX testicules DSD
Sexe inversé XY 46, XY dysgénésie gonadique complète
Tableau 1:Nouvelle Classification des désordres du développement sexuel [37-53]
II/-Le Pseudohermaphrodisme masculin :
Le pseudohermaphrodisme masculin (PHM) se définit par la présence de testicules et d’un caryotype 46, XY chez des sujets porteurs d’OGE et/ou internes ambigus. La présentation clinique peut aller du simple hypospadias à l’apparence complètement féminine. Cet éventail de tableaux cliniques résulte des différents niveaux que peut intéresser le déficit. Le diagnostic étiologique est souvent difficile. Il repose sur des examens biologiques d’interprétation délicate, mais aussi sur des explorations radiologiques et cœlioscopiques [48]
20
Les PHM peuvent être répartis en deux catégories : A)-Déficits de la fonction testiculaire :
Il peut s’agir de :
1)-Blocs enzymatiques sur la biosynthèse de la testostérone [48]:
Pouvant intéresser n’importe quel niveau de la cascade enzymatique : de la chaîne de biosynthèse du cholestérol à la testostérone. Ils sont souvent surrénaliens en même temps que testiculaires. Les formes complètes peuvent être mortelles en raison des déficits en minéralocorticoïdes et/ou glucocorticoïdes qu’elles entraînent. Ils sont transmis sur un mode récessif autosomique ou lié à l’X.
Le contraste entre le taux plasmatique élevé des stéroïdes en amont du bloc et le taux bas des stéroïdes au-delà du bloc sur la voie de biosynthèse, fait le diagnostic.
21
Figure 1: Schéma de biosynthèse des hormones stéroïdes.
2)-Insensibilité des cellules de Leydig aux gonadotrophines :
Il peut s’agir d’une LH bioinactive ou d’un récepteur anormal. Toute mutation intéressant le gène de ce récepteur (chromosome 2p21) peut
22
en être responsable. Plusieurs mutations, transmises selon un mode autosomique récessif, ont été rapportées. Quand il s’agit d’une LH anormale, le test à l’HCG est positif alors qu’il est négatif en cas d’anomalie du récepteur avec un taux élevé de LH [2-45-48-49-80-101]
.
3)-Rarement, par trouble de l’hormonogenèse testiculaire non stéroïdienne :
C’est une anomalie de transmission autosomique récessive, responsable de la persistance des dérivés müllériens par absence ou inactivité de l’hormone antimüllérienne (AMH). Il est du dans 84% des cas à des mutations du gène du récepteur de l’AMH [27]
. Le diagnostic est généralement fait chez des adolescents au cours d’une intervention pour ectopie testiculaire.
B)-Insensibilité des organes cibles à des androgènes normaux :
*Rôle des androgènes :
La testostérone, principal androgène, traverse la membrane cellulaire et pénètre la cellule par diffusion passive sous sa forme libre. Elle y est réduite, par une enzyme spécifique : la 5α-réductase, en dihydrotestostérone (DHT). Cette dernière est responsable de la masculinisation in utéro des OGI et de la maturation sexuelle avant la puberté. Alors que la testostérone semble être plus importante pour la stimulation des canaux de Wolff pendant le développement sexuel, la formation des OGI, la régulation des gonadotrophines et la spermatogenèse [9-48].
23
Embryon Canaux de Wolff OGE
Puberté Voix Muscles OGE Prostate Pilosité
Tableau 2: Androgénodépendance des caractères sexuels primaires et
Secondaires chez les sujets de sexe masculin.
Figure 2 : Mécanisme d’action des androgènes au niveau de leurs cellules cibles. T : Testostérone, Tb : Testostérone liée (bound), Tu : Testostérone libre
(unbound)
Δ4A : Δ4-androstènedione, DHA : déhydroépiandrostérone R : récepteur, R’ : récepteur activé.
L’insensibilité aux androgènes est la cause la plus fréquente des
PHM [9-48]. On distingue :
24
Anciennement appelée testicule féminisant, à transmission récessive liée à l’X. Le sujet est de morphotype féminin avec des OGE bien développés [46].
Photo 1:Phénotype d'un testicule féminisant.
Elle est due à un défaut du récepteur périphérique des androgènes
[46-48]
. Chez les sujets adultes, le taux de la testostérone plasmatique est deux à quatre fois plus élevé que la normale. L’œstradiol plasmatique atteint des chiffres féminins. Le taux de LH est élevé, celui de FSH est normal ou modérément élevé. L’anomalie du récepteur a été attribuée dans 80% des cas à une mutation du gène responsable. La littérature décrit de plus en plus de nouvelles mutations [7-52], Gottlieb en a recensé plus de 800 portant sur le gène du RA (www.mcgill.ca/androgendb/). La présence de mutations familiales a été également citée [7-52-89] .Dans les autres cas, une altération de la capacité de liaison du récepteur et/ou une anomalie des coactivateurs ont été évoquées[48].
b)-La forme incomplète : soit par
-Anomalie du récepteur : Cette étiologie réalise un groupe très hétérogène de présentations cliniques, depuis l’absence presque complète jusqu’à l’accomplissement quasi-total de la virilisation. On y retrouve le même profil biologique de la forme complète mais à un degré moindre. L’étude du récepteur a mis en évidence des anomalies moléculaires dans 30% des cas [2]. Ce sont des mutations qui n’abolissent que partiellement l’activité du récepteur.
25
-Déficit en 5α-réductase : Ce type de déficit est transmis sur le mode autosomique récessif. Il est caractéristique par la distorsion entre le développement normal masculin des dérivés wolffiens (épididymes, déférents, vésicules séminales) et la différenciation féminine des OGE. A la naissance, le patient présente un hypospadias sévère. A la puberté, le phallus se développe, devient fonctionnel, la voix et la musculature prennent des caractéristiques masculines et la pilosité apparait.
Photo 2:Aspect des OGE de type féminin chez un nourrisson de 11 mois présentant Un déficit en 5α-réductase.
Sur le plan biologique, le rapport DHT/T plasmatique (normalement 1/10) est de 1/40 pouvant atteindre 1/100 après stimulation à l’HCG. L’étude moléculaire et de l’activité de la 5α-réductase sur des biopsies de peau (homogénats de fibroblastes) affirment le diagnostic [103].
III/-Le pseudohermaphrodisme féminin :
Le PHF réalise un état dans lequel, les sujets avec caryotype 46, XX normal et des ovaires normaux présentent certains éléments du phénotype masculin avec notamment une virilisation des OGE. Cette dernière est due à une imprégnation androgénique anormale du fœtus de sexe féminin pendant la vie embryonnaire.
Ces androgènes sont soit d’origine fœtale par hyperplasie
congénitale des surrénales (HCS) soit d’origine maternelle endogène (Tumeurs virilisantes ovariennes ou surrénaliennes) ou exogène (prise de drogues virilisantes pendant la grossesse) [48].
L’HCS constitue la cause la plus fréquente des PHF [9-37-41-48]
, son incidence est estimée à 1 cas sur 10000 à 15000 naissances vivantes
[36]. C’est une anomalie à transmission autosomique récessive
26
la stéroïdogénèse surrénalienne [4-36]. Le bloc enzymatique, quelque soit le niveau sur la voie de biosynthèse du cortisol entraîne un déficit en cortisol et une hypersécrétion d’ACTH responsable de l’hyperplasie surrénalienne [48].
Le sexe d’élevage est souvent féminin quand l’ambiguïté génitale est découverte à la naissance. Parfois, le nouveau né est sévèrement virilisé et est donc déclaré de sexe masculin [25-26].La présentation clinique des HCS, dépend de l’âge de la manifestation du trouble, du type et du degré du déficit enzymatique [36].
A)-Le déficit en 21α-hydroxylase :
C’est le bloc enzymatique le plus fréquent, il représente 09 cas sur 10 d’HCS [4-9-36-48-61]
.
On distingue deux tableaux :
-La forme classique (FC): Associe une virilisation de degré variable avec ou sans perte de sel [4-86].
La masculinisation des OGE a été classée par Prader en cinq stades :
27
II = Hypertrophie clitoridienne, vestibule vulvaire étroit en entonnoir, dans lequel urethre et vagin s’abouchent séparément, mais la distance entre ces deux orifices est diminuée.
III = Clitoris péniforme, fusion et épaississement des grandes lèvres prenant un aspect scrotal. Persistance d’un sinus urogénital où débouchent urethre et vagin.
VI = Pénis hypospade, prépuce en capuchon, Abouchement vaginal dans la lumière urethrale.
V = Masculinisation complète : aspect de garçon cryptorchide. Abouchement vaginal variable, soit très haut situé à la face postérieure de l’urethre, soit absent.
Figure 3: Classification de Prader [48].
Photo 3: Stade V de Prader chez une patiente avec HCS.
L’ambiguïté des OGE remarquée à la naissance attire généralement l’attention avant la manifestation de la perte de sel. Parfois, la virilisation est sévère conduisant à déclarer le nouveau né de sexe masculin jusqu’à l’apparition d’un signe faisant évoquer l’HCS. Le cas échéant, la perte de sel se manifeste vers J8-J15 de la naissance et peut revêtir le
tableau d’une déshydratation aigue avec collapsus ou subaiguë (vomissements, cassure de la courbe pondérale, hypotonie,…). Des cas de convulsions par hypoglycémie ont été également rapportés [48-61-86].
28
Photo 4: Aspect ambigu des OGE à la naissance chez un nouveau né présentant une HCS.
-La forme non classique (FNC) : Se manifeste par un hirsutisme dans 60% des cas, des troubles menstruels dans 54% et par une acné chez 33% des patients. Parfois, aucun signe clinique d’HCS n’est observé [61].
Une dystrophie ovarienne polykystique fait souvent partie du tableau clinique qu’il soit classique ou non [42]
.
la 17OHP est classiquement très élevée, supérieure à 50ng/ml pour une normale inférieure à 3ng/ml. Elle peut être normale dans les formes non classiques. Quand une perte de sel est associée les ionogrammes sanguin et urinaire révèlent une hyponatrémie à natriurèse conservée et une hyperkaliémie à kaliurèse basse. Parfois, une hypercalcémie et une acidose sont aussi notées. L’aldostérone est effondrée et l’activité rénine plasmatique est élevée [9-36-48-61-86]
. Le dosage de la 17OHP salivaire a été récemment cité dans la littérature comme un moyen diagnostique non invasif, facile et reproductible puisque son taux est directement corrélé à celui de la 17OHP plasmatique [87]. Dans de nombreux pays, le déficit en 21α-hydroxylase est dépisté systématiquement chez tous les nouveaux nés par dosage de la 17OHP sur sang séché recueilli sur papier buvard à J3 de vie
[86]
. Le gène de la 21α-hydroxylase se situe sur le chromosome 6p21.3. On distingue deux gènes homologues : l’actif CYP21B et l’inactif CYP21A. Le déficit enzymatique résulte de l’un des deux mécanismes responsables de la mutation génétique. Il peut s’agir d’un réarrangement par délétion (12%) ou conversion (10%), ou d’une mutation ponctuelle. Seuls 01 à 02% des cas sont dus à une mutation de novo. La survenue d’une mutation ou de l’autre est fortement liée à l’origine ethnique [104]
. Une notion particulière à ce déficit est la corrélation génotype-phénotype. Certaines mutations sont responsables de la forme classique
29
et d’autres de la forme non classique. Pour que le patient soit atteint de la forme classique il faut que les deux allèles du gène soient porteurs d’une mutation responsable d’une forme classique. La forme non classique est due soit à la présence de deux mutations entraînant une forme non classique soit à la présence d’une mutation responsable d’une forme classique et d’une autre responsable d’une forme non classique[61-86].
*Complications :
Le syndrome de perte de sel reste la complication la plus redoutable. Il engage aussi bien le pronostic vital que fonctionnel. Quand une insuffisance surrénalienne est associée, l’incidence des décès est plus élevée, les femmes sont encore moins fertiles et les comorbidités neurologiques sont plus fréquentes. Désormais, le décès dans le cadre des HCS peut survenir également dans le cadre de comorbidités cardiaques [4-54].
Les fonctions cognitives sont souvent altérées. Des études ont prouvé que les personnes atteintes ont une mémoire faible pour les événements négatifs et leur capacité de la reconnaissance spatiale est inférieure à celle de la population normale [20-56-67].
Le traitement pourrait avoir également ses propres complications. L’obésité et les troubles de croissance sont les plus retrouvés [30]
. Le traitement par l’hydrocortisone peut également favoriser l’apparition rapide d’une dystrophie ovarienne [42]
. Quoique des études récentes suggèrent que la structure ovarienne chez les adolescentes ayant reçu un traitement précoce est parfaitement normale [29].
B)-Le déficit en 11β-hydroxylase :
Il a été décrit pour la première fois en 1955 par Eberlain et Bongiovanni comme un syndrome associant virilisation et hypertension artérielle. Il représente 08 à 10% des cas d’HCS [9-48-72]
. La virilisation se manifeste à la naissance par une ambiguïté des OGE et tardivement par une masculinisation progressive avec une croissance rapide aboutissant, en l’absence du traitement, à une petite taille à l’âge adulte par maturation épiphysaire précoce. L’HTA par rétention sodique, présente dans 2/3 des cas, est généralement d’apparition tardive, après l’âge de 03 ans. Quoique sa manifestation chez un nourrisson de 03 mois a été documentée [64]. Elle est le plus souvent modérée, mais des états d’HVG avec rétinopathie et encéphalopathie hypertensive ont été cités dans la littérature [81-82-86].
30
Le tableau virilisation-HTA n’est pas toujours présent. Parfois, des femmes trop virilisées sont normotendues et d’autres moyennement virilisées présentent une HTA maligne. Le 11-désoxycortisol (composé S) et la désoxycorticostérone sont augmentés, aussi bien à l’état basal qu’après stimulation par le synacthène. La testostérone et le Δ4A sont élevés. Le cortisol peut être normal ou bas. La rénine est basse par excès de synthèse des métabolites des minéralocorticoïdes. La 17OHP dans ce cas n’est que modérément élevée. L’exploration urinaire met en évidence un taux élevé de 17-cétostéroïdes [9-48-72-86].
Le gène de la 11β-hydroxylase CYP11B1 se situe sur le chromosome 8q21-22. Une cinquantaine de mutations ont été décrites jusqu’à ce jour. Elles sont à type de délétions, insertions, réarrangements et substitutions [48-72-91].
C)-Le déficit en 3β-hydroxystéroïde déshydrogénase :
Exceptionnellement, il peut s’agir d’un déficit en 3β-hydroxystéroïde déshydrogénase, elle représente 01 à 10% des cas [9-13-48-86-95]. Les OGE sont normalement féminins pouvant présenter parfois une légère virilisation. Un syndrome de perte de sel est observé dans la moitié des cas rapportés[88]. Dans les formes sans perte de sel, l’enfant présente une légère accélération de la croissance avec une clitoridomégalie. A l’âge adulte, il s’agit surtout d’un hirsutisme avec des troubles menstruels [48-78-86].
Le caryotype est constamment 46, XX. Le bilan morphologique montre des OGI internes de type féminin. Les résultats de l’exploration biologique dépendent eux aussi du type du déficit enzymatique et de la présence ou non d’une perte de sel. Le diagnostic biologique repose sur
l’augmentation des rapports DHA/Δ4A et
17OHpregnénolone/Progestérone. L’élévation du rapport 17OHpregnénolone/cortisol est également très informative [55-62]. Le cortisol est diminué. La rénine est augmentée si une perte de sel est associée. La 17OHP peut parfois être augmentée par conversion hépatique des précurseurs surrénaliens [9-48-86].
La 3β-hydroxystéroïde déshydrogénase est codée par deux gènes situés sur le chromosome 1p11-13. Une trentaine de mutations ont été décrites chez 60 patients [88]. Tous les mécanismes sont possibles [78-86].
D)-Le déficit en aromatase :
L’aromatase assure la conversion de la testostérone en œstradiol et du Δ4A en œstrone dans de nombreux tissus, notamment les gonades, le placenta, le foie et le tissu adipeux [48]. Le gène responsable est localisé au niveau du chromosome 15p21. Le PHF est le résultat du
31
déficit en aromatase placentaire. Pendant la grossesse, les androgènes non convertis en œstrogènes entrainent la virilisation du fœtus féminin et de la mère. A la naissance, les enfants présentent une clitoridomégalie, des bourrelets de type masculin avec chez certains un seul orifice périnéal. A la puberté, les caractères sexuels secondaires ne se développent pas et une virilisation progressive s’installe.
Sur le plan biologique, Les androgènes et les gonadotrophines sont élevés, tandis que les taux d’œstradiol et d’œstrone sont bas ou non détectables.
IV/-L’hermaphrodisme vrai :
L’hermaphrodisme vrai ou ovotestis DSD, est défini par la
bipotentialité gonadique. Autrement dit, c’est la coexistence chez le même individu de tissus ovarien et testiculaire bien différenciés, sous forme de gonades séparées ou d’ovotestis [10-105]. C’est une anomalie de
détermination gonadique très rare [10-17-33-105], On en a cité environ 400 cas dans la littérature [11-59].
La majorité des cas d’HV sont sporadiques. Mais plusieurs formes familiales ont été décrites [23-39-79-97-105]. La coexistence dans la même famille des cas d’HV et de mâles XX a été rapportée, suggérant que ces deux tableaux représentent l’expression différente d’une même anomalie génétique [14-47-48-105]. L’âge maternel avancé, les grossesses gémellaires et l’assistance médicale à la procréation sont considérés comme des facteurs augmentant le risque de chimérisme : L’un des mécanismes génétiques impliqués dans l’HV [10-57-58-65]
32
Le diagnostic est posé à la naissance à l’occasion de la constatation d’une ambiguïté des OGE. Sinon, l’enfant est classiquement déclaré de sexe masculin en raison d’une certaine virilisation génitale [1-17-85-96-105]
, et c’est l’apparition secondaire d’un signe d’appel à la puberté qui conduit à poser le diagnostic de l’HV. Typiquement, les sujets développent des OGE de type masculin et des seins [48-77]. Il peut s’agir par exemple d’une simple hernie inguinale [16] ou d’une masse scrotale [12]
.
L’ensemble de ce tableau témoigne d’une sécrétion hormonale
mixte, mais aussi d’un déficit de la sécrétion testiculaire, au moins pour ce qui concerne la formation de l’hormone antimüllérienne.
Le caryotype classique en matière d’HV est 46, XX. Mais d’autres formes ont été rapportées : 46, XY ; des mosaïques tels que 46, X+22p/46, XY ; 45, X0/46, X dic Y ; 46, XX/45, X0 [11-12-97] ... Une trisomie 22 associée a été rapportée dans 01 cas[105]. En se basant sur des techniques de biologie moléculaire et d’analyse d’ADN, d’autres études ont permis de proposer des hypothèses expliquant le mécanisme de l’HV [10-75-94]
. Le gène SRY localisé sur le chromosome Y est reconnu comme le 1er déterminant du développement gonadique masculin. Son mécanisme d’action n’est pas encore bien élucidé. Son pic d’expression pendant la phase embryonnaire coïncide avec la différenciation des cordons sexuels. Cette expression est suivie de très près par celle d’un autre gène clé de la différenciation sexuelle : le SOX9 (chromosome 17). L’activité du gène SRY est inhibée par le DSS (chromosome Xp21). Un autre gène, WnT4 (chromosome 11p), est essentiel pour le développement féminin ; il supprime le développement sexuel masculin. La moindre aberration dans l’expression de l’un de ces gènes pourrait conduire au développement d’un HV [15-48-51-75-76]
.
Quand le caryotype est 46, XX, trois mécanismes ont été suggérés pour expliquer la présence du tissu testiculaire : un mosaïsme caché, une translocation du SRY du chromosome Y vers le chromosome X ou une mutation portant sur un autosome impliqué dans la différenciation testiculaire [105]. La translocation du gène SRY serait la cause la plus commune [75-97]. De nombreuses études ont noté que peu de patients porteurs d’un caryotype 46, XX sont SRY+, et ont conclu qu’il s’agit probablement d’une mutation portant sur des gènes autres que SRY et WnT4 [15]. Parfois, la recherche du gène SRY au niveau des leucocytes sanguins revient négative alors qu’il est détecté dans le tissu gonadique du même patient [32-38-105].
Quand il s’agit d’un caryotype mosaïque, deux mécanismes sont évoqués : le chimérisme qui résulte de la fusion postzygotique de deux zygotes différents chez le même embryon, et le mosaïsme qui résulte d’un accident postzygotique donnant deux lignées cellulaires différentes sur le plan cytogénétique [10].
33
L’exploration cœlioscopique peut parfois se révéler utile pour préciser l’anatomie génitale interne [9]
.Elle permet de pratiquer une biopsie gonadique tout en épargnant au malade une laparotomie exploratrice quand la chirurgie ablative n’est pas nécessaire [66]
. L’ovotestis est la gonade la plus fréquente [73-75-94-102]
. Toutes les combinaisons sont possibles : 1)-ovotestis bilatéral 2)-ovotestis unilatéral avec ovaire ou testicule controlatéral 3)-testicule d’un côté ovaire de l’autre. La localisation des gonades est déterminée par leur nature : les ovaires sont généralement situés dans l’aire ovarienne tandis que les testicules sont de siège scrotal, mais ils peuvent également se présenter dans le canal inguinal ou en intraabdominal. Le siège de l’ovotestis dépend de la nature du tissu gonadique prédominant
[105]. Quand l’ovotestis est unilatéral, il est habituellement du côté droit, il
est abdominal dans la moitié des cas et il est associé à une trompe de Fallope dans 65% des cas [73-97].
Dans le cas où l’ovotestis est associé à un ovaire controlatéral, le développement de l’utérus est complet. Par contre, si l’ovotestis est bilatéral, une agénésie utérine est notée dans 13% des cas. L’ovotestis s’associe dans 65% des cas à une trompe de Fallope et au canal déférent dans le reste [73].
34
Photo 5: Aspect macroscopique d'un ovotestis.
1: ovaire ; 2: utérus ; 3: ovotestis
La biopsie gonadique, sous réserve du bon choix de la zone à biopsier et le volume de la pièce, est un examen de 1er ordre pour l’identification d’un ovotestis. Il peut être bilobé (les tissus ovarien et testiculaire sont unis par un pédicule) ou ovoïde (le tissu ovarien est disposé en casquette au dessue du tissu testiculaire). La proportion des composantes ovarienne et testiculaire est variable d’un patient à l’autre et l’albuginée occupant le reste de la gonade peut prendre le même aspect que celui observé dans le PHM, ce qui rend parfois la tâche difficile à l’anatomopathologiste [73]
35
Figure 4: Ovotestis. La composante ovarienne forme une couronne autour du tissu
Testiculaire.
L’intérêt de l’étude anatomopathologique réside également dans la détection précoce d’une tumeur chez les patients présentant un désordre du développement sexuel [73]. Elle doit être très précise, la moindre erreur conduisant par exemple à la méconnaissance d’un ovotestis, qui laissé à tort en place, pourrait être responsable de nombreuses complications à long terme. De même quand du tissu testiculaire est gardé chez une patiente où le sexe féminin a été choisi
[70-97]
.
V/-Le choix du sexe :
La stratégie de réassignement du sexe était longtemps basée sur le sexe chromosomique. Actuellement, elle tient compte également du sexe d’élevage. Ce dernier, selon plusieurs auteurs, reste le meilleur prédicateur de l’identité sexuelle à l’âge adulte [18-19]
. Généralement, on s’aide de plusieurs paramètres pour arriver, avec le patient et sa famille, à choisir le sexe qui serait le plus optimal.
Dans les PHM, La décision du sexe n’est pas toujours évidente [9]
. Dans les PHF, le choix du sexe est généralement aisé, puisqu’il s’agit le plus souvent d’une fille porteuse d’un bloc surrénalien [9]
. D’après plusieurs études, le sexe féminin serait le choix idéal dans le cadre des PHF par HCS. Du fait que l’on considère qu’il s’agit d’une malformation génitale qui peut être corrigée par la chirurgie [4]. Cependant, la revue de la littérature a laissé conclure que ni le fait
36
d’opter pour le sexe chromosomique ni le changement de sexe ne peuvent exclure une éventuelle apparition de troubles de l’identité sexuelle plutard dans la vie [25-Meyer-Bahl Burg et al. 1996 ; Zucker et al 1996].
Dans les HV, le potentiel fonctionnel des OGE, les données laparoscopiques, le sexe d’élevage, les chances ultérieures de fertilité ainsi que l’orientation psychosexuelle du malade [9-11-33-105]
constituent les paramètres à considérer pour le choix du sexe définitif. Le choix du sexe féminin serait approprié quand le pénis est de petite taille, quand il existe des dérivés müllériens avec un ovaire ou lorsque le chromosome Y est présent dans une gonade anormale intraabdominale. Le sexe masculin serait choisi devant un pénis de taille plus grande avec un testicule normal au niveau du scrotum [11].
*Législation [85] :
Une fois le sexe définitif assigné, la déclaration à l’état civil doit être faite le plus tôt possible.
Dans le « Dahir du 4 septembre 1915 » constituant l’état civil au Maroc, le chapitre II précise les modalités de déclaration de la naissance :
Article 23 : L’acte de naissance énoncera le jour, l’heure et le lieu de naissance, le sexe de l’enfant et le prénom qui lui sera donné. Article 21 : Les déclarations de naissance se font dans le premier mois. Ce délai passé, la déclaration ne peut être établie qu’en vertu du jugement rendu par le tribunal de première instance.
Le chapitre V traite la rectification des actes de l’état civil qui est ordonnée par le président du tribunal de première instance. La lettre doit être appuyée par un certificat médical justifiant la nécessité du changement.
37
VI/-Traitement :
Le traitement en matière des désordres du développement sexuel comprend deux volets : médical basé sur l’hormonothérapie et chirurgical. L’assistance psychologique est, bien entendu, toujours de mise.
A)-L’hormonothérapie [99]
:
L’hormonothérapie fait partie intégrante de la prise charge thérapeutique des malades atteints d’un désordre du développement sexuel. Elle est indiquée soit pour supprimer un excès d’hormones non souhaitées par un effet freinateur, soit pour compenser un éventuel déficit hormonal. Elle peut avoir un intérêt vital comme dans le cadre de l’insuffisance surrénalienne observée dans les HCS. Pour ces fins, androgènes, œstrogènes et progestérone sont commercialisés sous différentes formes galéniques.
1)-Les androgènes : a)-La testostérone :
Elle peut être administrée par voie orale, intramusculaire, transdermique ou sous forme d’implants sous cutanés. Les doses et les voies d’administration sont variables en fonction de l’âge :
-Chez le nouveau né, elle est indiquée pour agrandir le phallus. La voie intramusculaire est la plus utilisée : 25mg/ 03 semaines avec un maximum de trois doses. La voie transdermique (gel à 5% de testostérone) peut avoir également des résultats favorables.
38
-Pour l’induction de la puberté, on utilise des petites doses de 40mg/j en une prise, avec augmentation progressive sur deux ans jusqu’à arriver à une dose maximale de 80-120mg/j. Une dose supplémentaire par voie intramusculaire peut être nécessitée (100mg/ 04 semaines puis 250mg/mois à l’âge de 14-15 ans).
b)-La dihydrotestostérone :
Elle existe sous forme de gel de DHT 2,5%. Les essais cliniques ont rapporté des résultats favorables quand il s’agit d’un déficit en 5α- réductase.
c)-Les effets secondaires et la surveillance du traitement :
Il s’agit principalement de : La rétention liquidienne, la polyglobulie, les apnées du sommeil et les changements d’humeur. La surveillance devrait donc inclure des dosages réguliers de l’hémoglobine et des transaminases.
Les effets de l’androgénothérapie sur la croissance prostatique demeurent mal précisés. Une surveillance attentive de la prostate par un toucher rectal annuel avec un dosage éventuel de PSA s’impose.
2)-Les œstrogènes :
Pour le déclenchement de la puberté, on utilise des petites doses d’éthinyl-œstradiol : 10mg/j pendant 03 mois, puis une association œstroprogestative permettant des cycles artificiels et des menstruations s’il existe un utérus [9]
39 Type Dose minimale efficace chez les adultes Dose épargnant l’os Œstrogène équine conjuguée 0.3-0.625 mg/j 0.625 mg/j Oral Œstradiol 2 mg/j 2 mg/j Œstriol 1-2 mg/j Transdermique Œstradiol 25-50 mg/j 50 mg/j Implant S/C Œstradiol 25-50 mg/ 06 mois 25-50 mg/06 mois Œstrogènes à
action locale Œstradiol Suppositoires
Œstriol Crème vaginale,
ovules
Œstrone suppositoires
Œstrogène équine
conjuguée crème
Dienoestrol crème
Tableau 3: Œstrogènes disponibles [74]
Le développement de l’utérus, quand il est présent, serait le paramètre de surveillance le plus sensible et le plus accessible, bien que la mesure de la densité osseuse reste préférée par de nombreux investigateurs.
40
L’administration peut être orale, transdermique, intramusculaire ou intra-utérine. D’une façon cyclique (10-12 j/mois) ou continue.
Progestérone Traitement cyclique Traitement continu
combiné -Norethistérone. -Acétate de Norethistérone. -Acétate de medroxyprogestérone. -Levonorgestrel. -Dydrogestérone. -Acétate de Cyprotérone. 0.7-10.5 mg/j 1.25 mg/j 5-10 mg/j 60-90 µg/j 10-20 mg/j 2 mg/j 0.35-0.7 mg/j 1.25 mg/j 2.5-5 mg/j 30-60 µg/j 10 mg/j 1 mg/j
Tableau 4: différentes doses de la progestérone en fonction de type du traitement. 4)-Glucocorticoïdes :
Ils trouvent leur place dans les HCS. Les doses excessives doivent être évitées en raison de la multiplicité des effets secondaires : Retard de croissance, morphotype cushinoïde, obésité,…
Les modalités du traitement par les glucocorticoïdes seront détaillées ci-dessous.
5)-Minéralocorticoïdes :
Les minéralocorticoïdes sont indiqués quand il y a un syndrome de perte de sel associé dans le cadre des HCS. Ils permettent de compenser le déficit en aldostérone. La fludrocortisone est la molécule de choix.
B)- La chirurgie :
La génitoplastie est féminisante ou masculinisante en fonction du sexe choisi. L’apport vasculo-nerveux du bourgeon génital est assuré par un pédicule dorsal qui doit être conservé quelque soit la nature de la chirurgie. Elle doit être pratiquée le plus tôt possible avec un minimum de réinterventions [9].
41
1)-La génitoplastie masculinisante :
Elle consiste en une découdure de la verge avec urethroplasie.
Cette dernière peut être réalisée soit par l’intermédiaire de la peau pénienne ou de la muqueuse vésicale, soit par la reconstruction anatomique directe du corps spongieux de l’urethre [9-18]
. Un remplacement total de l’urethre est également possible grâce à la technique d’Asopa/Duckett [18-85]
.
Figure 5: Urethroplastie à l'aide des tubes d'Asopa/Duckett [18].
Elle consiste en un remplacement complet de l’urethre manquant. Si le prépuce est disponible, un tube est constitué par un rectangle de muqueuse préputiale pédiculé, sinon par une greffe libre de muqueuse buccale. Le tube est ensuite interposé entre le méat ectopique et l’apex du gland.
42
A : Coudure de la verge, scrotum bifide, hypospadias, poche vaginale périnéale. B : Sonde métallique mesurant la profondeur vaginale.
C : Résultat de la génitoplastie en utilisant la procédure d’Asopa/Duckett.
Deux complications sont à redouter : la sténose de l’urethre et la fistule ou nécrose du lambeau. Dans ce cas une réintervention chirurgicale est nécessaire.
Figure 6: Désastre esthétique avec multiples fistules.
2)-La génitoplastie féminisante :
Elle est basée sur clitoridoplastie et/ou la vaginoplastie.
La chirurgie du bourgeon génital consiste à réséquer du tissu caverneux avec conservation du pédicule vasculo-nerveux dorsal du gland. Parfois, une résection dorsale de réduction du gland est nécessaire. Cette technique est actuellement préférée par rapport aux techniques de plicature et d’enfouissement car elle donne de meilleurs résultats.
La vaginoplastie est pratiquée dans le même temps opératoire que la clitoridoplastie. La technique à utiliser dépend de l’anatomie de l’axe génital. La vaginoplastie peut être simple (plastie YV), avec abord périnéal pour l’abaissement de la cavité vers le périnée ou de remplacement par transfert de lambeau colique ou cutané à partir de la cuisse[21].Cette dernière est effectuée après la puberté, essentiellement dans les PHM par insensibilité aux androgènes.
43
Photo 7: Résultats de la génitoplastie féminisante [9].
A, B : Vues opératoires de la vaginoplastie et de la clitoridoplastie. C : Résultat à un an.
D, E : Résultat en début de puberté et à l’âge adulte.
Les complications les plus citées sont la sténose vaginale et l’hyposensibilité clitoridienne [34-40-43-69]
. 3)-Attitude vis-à-vis des gonades :
Dans les PHM, quand le sexe choisi est féminin, la gonadectomie est faite dans le même temps opératoire que la génitoplastie. Le risque de survenue de néoplasie gonadique est augmenté en cas d’insensibilité aux androgènes, il s’agit le plus souvent de tumeurs germinales. Les adénomes des cellules de Sertoli sont présents dans 25% des cas
[8-44-83]
.
Dans les PHF, les ovaires sont normaux. La fertilité est normale si la freination d’un éventuel bloc surrénalien est satisfaisante. Ils sont donc laissés en place si le sexe féminin a été choisi.
Dans les hermaphrodismes vrais et certaines dysgénésies gonadiques asymétriques, il est possible de différencier la zone testiculaire et la zone ovarienne pour réaliser une gonadectomie partielle, quitte à la compléter à la puberté si la gonade s'avère non fonctionnelle. L’incidence des tumeurs gonadiques chez les patients atteints d’HV est de 04,6% [73]. Elle varie avec les caryotypes des patients : Elle est plus élevée chez les sujets 46, XY [33-73-97]. Le gonadoblastome et le séminome sont les types les plus fréquents. Il peut s’agir également d’une tumeur du sac vitellin, d’un tératome ou d’une
44
tumeur carcinoïde [28-59-73].Un cas de carcinome invasif des cellules squameuses du vagin chez une patiente 46, XX a été rapporté [17].
C)-Les indications :
Elles dépendent du type de la pathologie et du sexe choisi [76].
1)-Le pseudohermaphrodisme masculin :
Le traitement est fonction du sexe choisi et du mécanisme de la pathologie.
2)-Le pseudohermaphrodisme féminin :
*Le cas particulier de l’hyperplasie congénitale des surrénales : Il fait appel à deux volets :
Médical : basé sur l’hormonothérapie substitutive, dont la voie d’administration dépend de l’état clinique du malade.
1.L’hydrocortisone : par voie orale, pour remplacer le déficit en
cortisol. Dose d’attaque : 50mg/m2/j pendant 10 à 15j. Dose d’entretien :
20 à 25mg/m2/j chez le nouveau né et 10 à 15mg/m2/j chez l’enfant plus grand. Des glucocorticoïdes à action prolongée peuvent être indiqués pour optimiser la croissance, compléter le cycle ovulatoire et améliorer la fertilité [36-72].
2.La fludrocortisone : par voie orale, pour remplacer l’aldostérone
en cas de perte de sel. 25µg*2/j à réadapter par la suite.
Dans le cas où le sexe féminin a été choisi, Un traitement combinant gluco et minéralocorticoïdes pourrait permettre aux patientes peu fertiles de tomber enceintes [35], mais avec le risque de retrouver l’HCS chez le nouveau né par exposition aux androgènes maternels pendant la vie fœtale [68]
.
3.Traitement antihypertenseur : dans le cadre du déficit en
11β-hydroxylase. On peut utiliser les inhibiteurs calciques ou la spironolactone [72-61-86].
4.Les analogues de la GnRH (devant une puberté précoce induite
par le traitement) et l’hormone de croissance (si la croissance est lente)sont parfois indiqués dans le cadre du déficit en 11β-hydroxylase
[30-72]
45
Devant une insuffisance surrénalienne aigue, c’est la voie veineuse qui se trouve indiquée. Le traitement est basé sur la réhydratation, l’apport du sel, des glucocorticoïdes et des minéralocorticoïdes. Le relais par voie orale peut se faire dès la normalisation clinique et biologique [86].
Chirurgical : La technique chirurgicale varie avec le stade de virilisation et le sexe choisi. Quand le sexe est féminin, le principe général est d’abaisser l’orifice vaginal au périnée et d’effectuer une clitoridoplastie [86]. Quand le sexe choisi est masculin, l’intervention associe : l’ablation des structures müllériennes, la cure de l’hypospadias, la correction de la coudure de la verge et du scrotum et l’insertion de prothèses testiculaires [31]. La voie laparoscopique est possible [100].
L’âge idéal de la chirurgie est encore mal codifié. Il varie entre 06
[86]
et 18 mois [36]. Mais toutes les études convergent vers le fait que la chirurgie, si indiquée, doit être réalisée le plus tôt possible afin d’éviter la confusion des patients envers leur identité sexuelle. Une réintervention à l’âge adulte est souvent bénéfique pour l’optimisation de la fonction sexuelle [34-92].
Le pronostic de la chirurgie dépend de la proximité de l’abouchement de l’urethre dans le vagin par rapport au plan périnéal [48]
. La possibilité d’une surrénalectomie laparoscopique devant des enfants présentant une HCS réfractaire au traitement médical a été évoquée dans la littérature. Les effets à long terme ont été estimés sans influence nuisible ni sur le potentiel de croissance ni sur la fertilité [63].
3)-L’hermaphrodisme vrai :
Sexe choisi
Traitement médical
traitement chirurgical Temps de la
chirurgie Féminin -Œstrogènes. -Progestérone. -Après la puberté. -Réduction du clitoris. -Vaginoplastie. -Réduction labioscrotale. -Garder l’ovaire et la portion ovarienne de l’ovotestis. Ablation des testicules avant 06-08 sem. Masculin -Testostérone préopératoire [33] . -Testostérone après la puberté. -Réparation hypospadias. -Transposition scrotale. -Garder le canal déférent. -Garder le testicule et la portion testiculaire de l’ovotestis. -Orchidopexie. 06-18 mois. 03-06 mois [22-23-32-33-93] .
46
D)- La prise en charge psychologique :
Les influences potentielles de l’environnement et le profil propre à la
maladie rendent le conseil et l’éducation des patients ainsi que leurs parents une étape importante de la prise en charge. La guidance professionnelle optimiserait les résultats et préviendrait des éventuels troubles de l’identité sexuelle, permettant une meilleure qualité de vie
[19]
.
La prise en charge psychologique est toujours de mise. Elle doit encadrer l’ensemble de la prise en charge, depuis la confirmation du diagnostic et jusqu’à la mise au point du traitement. Elle doit être poursuivie tout au long de la vie des patients afin d’évaluer leur devenir à long terme.
VII/-Cas particulier de la prise en charge anténatale :
A)-Le diagnostic anténatal
[9-86]:
47
-La découverte d’OGE ambigus au cours d’une échographie du 2ème
trimestre. Dans ce cas, une 2ème échographie de contrôle est indispensable.
Figure 7: Un aspect ambigu des OGE au coure d'une échographie anténatale.
1 : Gland ; 2 : Infundibulum ; 3 : Bourgeon ; 4 : Bourrelets.
Si l’aspect inhabituel se confirme, on réalise un dosage de la testostérone et de la 17OHP dans le liquide amniotique. La recherche d’une anomalie du récepteur des androgènes et la réalisation d’un caryotype par amniocentèse sont également possibles.
-Dans le cadre du dépistage de la forme classique d’un bloc surrénalien chez le fœtus d’un couple à risque (connu porteur d’une mutation responsable de la forme classique de l’HCS ou ayant déjà eu un enfant atteint). Le diagnostic est confirmé par une biopsie trophoblastique à 10 SA.
B)-Le traitement anténatal [24-36-86-90]:
L’intérêt du diagnostic anténatal réside en la possibilité de l’instauration d’un traitement anténatal, administré à la mère, à base de la dexaméthasone.
48
Cette molécule a été choisie car elle ne se lie pas à la transcortine, elle traverse la barrière fœtoplacentaire et son action inhibitrice sur l’axe corticotrope est plus importante que le cortisol [24].
La dose préconisée est de 20µg/Kg/j en trois prises sans dépasser 1,5mg/j et sans interruption jusqu’à la fin de la grossesse.
C)-La prévention :
Elle consiste à instaurer le traitement par la dexaméthasone chez la mère à risque avant 09SA. Le traitement est continué jusqu’au terme de la grossesse uniquement si la biopsie trophoblastique de la 10ème SA revient positive [99].
Les résultats du traitement anténatal sont spectaculaires. Cependant, l’innocuité de cette procédure n’est pas encore établie. Une surveillance rapprochée est donc nécessaire pour une meilleure évaluation à long terme [36-90-99].
49
I/-Objectif de l’étude :
Il s’agit d’une étude rétrospective portant sur les cas de DDS qui
ont été colligés au service d’endocrinologie du centre hospitalier universitaire Avicenne de Rabat entre les années 1989 et 2007. Tous les dossiers des patients qui se sont présentés pour motif de DDS ont été inclus. Cette étude a concerné 09 dossiers après avoir exclu 04 en
Matériel et méthodes
50
raison d’un bilan incomplet et 01 qui a été enregistré à tort comme étant une ambiguïté sexuelle.
II/-Matériels et Méthodes :
Notre étude a porté sur les points suivants :
L’interrogatoire : Qui s’est intéressé particulièrement à l’identification du malade, au motif de consultation, à la notion de consanguinité des parents, à la prise de médicaments par la mère au cours de la grossesse, à la présence de cas familiaux similaires et l’existence ou non de pathologies associées .
L’examen clinique : A porté sur la collecte des critères phénotypiques, ainsi que la recherche de malformations associées.
L’exploration morphologique : A comporté une échographie abdominopelvienne et une génitographie. La TDM et la mammographie ont également été indiquées dans certains cas.
Le bilan biologique : A permis d’une part le dosage des gonadotrophines et des stéroïdes sexuels aussi bien à l’état de base qu’après stimulation, et d’autre part la recherche d’une perte de sel grâce aux ionogrammes sanguin et urinaire.
L’analyse cytogénétique : A été effectuée grâce à un caryotype.
Une cœlioscopie et une étude anatomopathologique ont également fait partie du bilan dans certains cas : notamment quand l’échographie abdominopelvienne n’a pas été concluante.
Et enfin, une expertise psychiatrique a été réalisée pour aider au choix thérapeutique et assurer un bon accompagnement psychologique des patients.
51
52
Fiche d’exploitation :
Identité Nom: énom: Pr Age: Origine: Sexe d'élevage: N° du dossier: Date d'entrée: Motif de consultation: Antécédents: Personnels: Familiaux: Consanguinité: Cas similaire: Sexe d'élevage: Motif de consultation: Age du diagnostic: Sexe déclaré: Clinique: Examen général: Phénotype: Poids: Taille: Périmètre crânien: Tension artérielle: Examen gynécologique/urologique: Gonade →droite: →gauche: Bourrelets génitaux: Bourgeon génital: Pilosité: Orifices: Seins (femme): Gynécomastie (homme): Autres signes:53 Bilan biologique: : Ionogramme sanguin Ionogramme urinaire: LH: FSH: Cortisol: Test HCG: Œstradiol: 17OHP: Testostérone: Caryotype: iologique: Bilan rad Echographie: Génitographie: UCG: Autres explorations: Cœlioscopie: Laparotomie: Anatomie pathologique: Diagnostic étiologique: Traitement: Sexe retenu:
Sexe désiré par les parents: Sexe assigné:
Traitement:
Médical:
54
N.H N.S B.M S.F B.S G.A
ville Rabat Rabat Tiflet Kalaâ Zagora Béni Mellal
Sexe d’élevage masculin
féminin puis masculin après caryotype
ï féminin féminin féminin
Motif de consultation ambiguïté génitale ambiguïté génitale
ambiguïté génitale ambiguïté génitale
aménorrhée primaire ambiguïté génitale
Age de consultation 05 ans 08ans 18 ans 19 ans 33 ans 05 ans
ATCD
Personnels : opéré à l’âge d’un an pour ectopie testiculaire bilatérale. Familiaux : Frère présentant le même tableau. Personnels : opéré à l’âge de 05 ans pour hypospadias et descente du testicule gauche. Familiaux : frère présentant le même tableau. RAS RAS Hépatite C découverte à l'âge de 31 ans. - Consanguinité
parentale de 3ème degré. -Prise
d’oestroprogestatifs pendant 1er mois de
grossesse. - 02 injections à visée abortive. Examen clinique -Phénotype androïde. -Scrotum vulviforme. -Organe pénoclitoridien 2,5cm. -Bourgeons mammaires absents. -Phénotype androïde. -Scrotum plat bien dessiné. -Verge 03cm. -Testicule droit non palpable. -Bourgeons mammaires absents. -Phénotype androïde. -2 grandes lèvres non fusionnées. -Verge 04cm -hypospadias+ un 2ème méat. -Gonades non palpables. -Pilosités pubienne triangulaire, axillaire et faciale présentes. -Seins non développés. -Erections. -Phénotype androïde. -2 grandes lèvres . -Clitoris hypertrophié -deux orifices vulvaires -Gonades palpables en position inguinale -Pilosité pubienne triangulaire -Syndrome malformatif : pieds creux, mains amyotrophiées, cyphoscoliose -Phénotype androïde. -grandes et petites lèvres bien développées. -Clitoris normal -Orifice urethral et orifice vaginal -Gonades : 02 masses inguinales sensibles -Pilosité pubienne fournie, axillaire présente, faciale absente Hymen présent’ -Spéculum de vierge :profondeur vaginale de 1,5cm sans col visible -Seins stade III de Tanner
-Phénotype féminin. -grandes lèvres d'aspect
scrotal.
-Bourgeon 1,5cm -Orifices : un sur la face
ventrale du clitoris, un vulvaire -Gonades palpables en position inguinale -Signes d’insuffisance somatotrope : nanisme, front bombé, visage poupin, acromicrie, petites mains, petits pieds
![Tableau 1:Nouvelle Classification des désordres du développement sexuel [37-53]](https://thumb-eu.123doks.com/thumbv2/123doknet/15060524.698604/19.892.141.772.97.664/tableau-nouvelle-classification-désordres-développement-sexuel.webp)
![Figure 3: Classification de Prader [48] .](https://thumb-eu.123doks.com/thumbv2/123doknet/15060524.698604/27.892.223.658.366.732/figure-classification-de-prader.webp)

![Tableau 3: Œstrogènes disponibles [74]](https://thumb-eu.123doks.com/thumbv2/123doknet/15060524.698604/39.892.116.799.96.804/tableau-œstrogènes-disponibles.webp)