HAL Id: tel-03117184
https://tel.archives-ouvertes.fr/tel-03117184
Submitted on 21 Jan 2021HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Gènes du métabolisme des xénobiotiques : rôle prédictif
dans les niveaux de contamination biologique par les
polluants environnementaux et implication dans le
risque de cancer du sein. Analyse de l’étude CECILE
Takiy Eddine Berrandou
To cite this version:
Takiy Eddine Berrandou. Gènes du métabolisme des xénobiotiques : rôle prédictif dans les niveaux de contamination biologique par les polluants environnementaux et implication dans le risque de cancer du sein. Analyse de l’étude CECILE. Cancer. Université Paris Saclay (COmUE), 2018. Français. �NNT : 2018SACLS598�. �tel-03117184�
Gènes du métabolisme des xénobiotiques:
rôle prédictif dans les niveaux de
contamination biologique par les polluants
environnementaux et implication dans le
risque de cancer du sein.
Analyse de l
’étude CECILE.
Thèse de doctorat de l'Université Paris-Saclay préparée à L’université Paris-Sud
École doctorale n°570 Santé Publique EDSP
Spécialité de doctorat : Santé publique- Épidémiologie
Thèse présentée et soutenue à Villejuif, le 20 décembre 2018, par
Takiy Eddine BERRANDOU
Composition du Jury :
Monsieur Philippe BROËT Président
Professeur des universités-praticien hospitalier, Université Paris-Saclay (INSERM U1018)
Madame Isabelle BALDI Rapporteur
Professeur des universités-praticien hospitalier, Université de Bordeaux (INSERM U1219)
Madame Sabine PLANCOULAINE Rapporteur
Chargée de recherche,
Université Sorbonne Paris Cité (INSERM U1153)
Madame Chantal GUIHENNEUC-JOUYAUX Examinatrice Professeur des universités,
Université Sorbonne Paris Cité (EA 4064)
Madame Danièle LUCE Examinatrice
Directrice de recherche,
Université Rennes 1 (INSERM U1085)
Monsieur Pascal GUÉNEL Directeur de thèse
Directeur de recherche,
Université Paris-Saclay (INSERM U1018)
NN T: 2 0 1 8 S A CLS5 9 8
Titre : Gènes du métabolisme des xénobiotiques : rôle prédictif dans les niveaux de contamination
biologique par les polluants environnementaux et implication dans le risque de cancers du sein. Analyse de l’étude CECILE.
Mots clés : cancer du sein, tabagisme, polluants organochlorés persistants, gènes du métabolisme des
xénobiotiques, interactions gènes-environnement
Résumé : Les gènes du métabolisme des
xénobiotiques (MX) impliqués dans l’activation et l’élimination des cancérogènes environnementaux pourraient moduler le risque de cancer du sein, mais leurs effets dans ce cancer ont été peu étudiés et sont mal connus.
Les objectifs de la thèse étaient d’étudier le rôle des gènes MX dans le cancer du sein d’une part, et dans les niveaux biologiques de cancérogènes mammaires suspectés, d’autre part. Les analyses ont porté sur les données d’une étude cas-témoins en population sur les cancers du sein (étude CECILE). L’association avec le cancer du sein a été étudiée (1) avec les variants du gène NAT2 qui déterminent le type d’acétyleur lent ou rapide de chaque individu ; (2) les polymorphismes des gènes MX étudiés conjointement au niveau de chacun des gènes et au niveau de l’ensemble du pathway à l’aide d’une méthode exploratoire de type « gene-set ». Dans chacune de ces approches, les interactions avec la consommation de tabac ont été étudiées. Dans une dernière partie, nous avons cherché à identifier les polymorphismes des gènes MX prédictifs des concentrations sanguines de
polluants organochlorés persistants (p,p’-DDE et PCB153) chez les témoins de l’étude CECILE. Le risque de cancer du sein était augmenté chez les femmes ayant un profil génétique NAT2 d’acétyleuses rapides par rapport aux femmes ayant un profil d’acétyleuses lentes. Parmi les acétyleuses lentes, les femmes fumeuses avaient un risque de cancer du sein augmenté par rapport aux non fumeuses indiquant l’existence d’une interaction tabac-NAT2. L’approche « gene-set » montrait que les polymorphismes au niveau de plusieurs gènes MX et au niveau de l’ensemble du pathway étaient associés collectivement au cancer du sein. L’association entre le cancer du sein et l’ensemble des polymorphismes du pathway XM était observée chez les fumeuses, indiquant le rôle de la consommation de tabac dans cette association. Enfin, nous avons montré l’effet du gène CYP2B6 en tant que déterminant des niveaux sanguins de p,p’-DDE et PCB153.
Nos résultats mettent en évidence un rôle des gènes XM dans le cancer du sein qui peut être expliqué par leur fonction dans le métabolisme et l’élimination des cancérogènes environnementaux.
Title: Xenobiotic metabolism genes: prediction of biological contamination levels by environmental
pollutants and implication in breast cancer risk. Analysis of the CECILE study.
Keywords : breast cancer, active smoking, persistent organochlorine pollutants, xenobiotic metabolism
genes, gene-environment interactions
Abstract: The xenobiotic metabolism (XM) genes
involved in the activation and elimination of environmental carcinogens may modulate breast cancer risk, but their effects in breast cancer have been little studied and are poorly understood. The objectives of the PhD were to study the role of XM genes in breast cancer on the one hand, and in the biological levels of suspected breast carcinogens on the other. The analyses were based on a population-based case-control study on breast cancer (CECILE study). We investigated the association of breast cancer (1) with NAT2 gene variants that determine the type of slow or rapid acetylator in each individual; (2) with polymorphisms of XM genes that were studied jointly at the gene and at the XM pathway level using a gene set method. In each of these approaches, interactions with tobacco consumption were studied. In a final section, we sought to identify polymorphisms of XM genes that predict blood concentrations of persistent organochlorine pollutants (p,p'-DDE and PCB153) among the
controls of the CECILE study.
The risk of breast cancer was increased in women with a NAT2 genetic profile of rapid acetylators compared to women with a profile of slow acetylators. Among slow acetylators, current smokers had an increased risk of breast cancer compared to non-smokers, indicating an interaction between tobacco smoking and NAT2 genotype. The gene set approach showed that polymorphisms at the level of some XM genes and at the level of the entire pathway were collectively associated with breast cancer. The association between breast cancer and all pathway XM polymorphisms was observed in female smokers, indicating a role for tobacco smoking in this association. Finally, we have shown that CYP2B6 gene was a determinant of blood levels of p,p'-DDE and PCB153.
Our results highlight a role of XM genes in breast cancer that is explained by their function in the metabolism and elimination of environmental carcinogens.
LABORATOIRE D’ACCUEIL
Les travaux de cette thèse ont été réalisés au sein du centre de recherche en épidémiologie et santé des populations (CESP) ; INSERM U1018 ; Équipe « Épidémiologie des cancers : Gènes et Environnement ».
FINANCEMENT
Le financement de cette a été assuré par l’université PARIS-SUD, dans le cadre d’un contrat doctoral de et d’une mission d’enseignement à l’université
REMERCIEMENTS
Tout d'abord, j'aimerais exprimer ma sincère gratitude à mon directeur de thèse Pascal Guénel, pour m’avoir confié ce travail et de m’avoir accordé toute sa confiance. Je le remercie également de m’avoir donné l’opportunité d’assister aux congrès internationaux afin de présenter mes travaux. Je lui suis également reconnaissant pour ses qualités scientifiques et sa rigueur lors de nos discussions enthousiastes sur les résultats obtenus et sur les détails des approches utilisées. Pendant ces trois années de formation, j’ai vécu une expérience enrichissante autant au niveau professionnel qu’humain, j'ai beaucoup appris à ses côtés et je lui adresse toute ma gratitude et admiration. Pascal GUÉNEL, je n'aurais pas pu imaginer avoir un meilleur directeur de thèse et mentor pour mes études de doctorat.
Je tiens à exprimer ma gratitude envers les membres de jury de ma thèse qui ont accepté de juger ce travail de recherche. Je remercie Mr Philippe BROËT pour m’avoir fait l’honneur de présider le jury. Je remercie madame Sabine Plancoulaine et madame Isabelle BALDI d’avoir accepté d’être rapporteurs de cette thèse et pour leurs remarques et commentaires enrichissantes. Je remercie également madame Chantal Guihenneuc-Jouyaux et madame Danièle Luce d’avoir accepté d’être examinateurs et d’apporter leur expertise.
Je tiens à remercier l’École Doctorale en Santé Publique (EDSP) pour avoir financé ce travail de thèse. Je remercie les membres de l’EDSP, en particulier le directeur Jean Bouyer, d’avoir assuré les bonnes conditions d’apprentissage au sein de la formation offerte et pour d’être à l’écoute des doctorants. Je remercie également à Fabienne Renoirt pour son aide, sa patience et sa bonne humeur.
Je remercie madame Josiane Warszawski pour m’avoir confié l’enseignement de TD et de TP du Master 1 santé publique. C’était ma première expérience à cette échelle et fut fort enrichissante et intéressante.
Je souhaite remercier vivement tous les membres, anciens et actuels, de l’équipe « Cancer et Environnement » du CESP pour toutes ces pauses conviviales et pour tous les bons moments partagés que ce soit autour des gâteaux, des chouquettes et des pots. Merci d’avoir rendu l’ambiance de travail si agréable et stimulante. Un merci particulier à Thérèse pour m’avoir donné l’opportunité d’intégrer l’équipe durant mon stage M2, pour l’encadrement de qualité dont elle m’a fait bénéficier et pour sa relecture des articles. Je remercie également Gaëlle, ma voisine de bureau durant les trois années de thèse, pour tous
les moments agréables incluant les discussions scientifiques et les rigolades interminables. J’en garde de très bons souvenirs sauf ce qui concerne la température du bureau (LOL). Merci à Yves pour sa joie de vivre, pour la musique et surtout pour les moments « très FOOTBALL » avec les footeux de l’Inserm.
Merci à mes amis actuels ou anciens doctorants membres de l’association « DOC SP » avec qui ces années ont été agréables notamment à travers nos after-work et week-end d’intégration.
Un grand merci à mes amis d’Oran, de Paris et de Saint-Denis pour leurs soutiens moral et pourm’avoir fait passer des moment mémorables et loufoques.
Je remercie ma famille pour son soutien extraordinaire durant mes longues années d’études et de thèse. Un merci particulier à ma sœur Zahrat el Hayat et mon frère Mohammed d’avoir été toujours là pour moi. Je souhaite remercier également mes neveux Siradj et Uwais et ma nièce Aminah pour toute la joie que vous m’avez amené.
Pour la fin, je souhaite remercier ma chère maman pour toutes ses pensées et prières et son soutien infaillible et spécial dédicace à l’âme de mon cher papa pour qui j’ai continué l’aventure afin de réaliser ce rêve que j’ai depuis l’enfance. Père, je te suis reconnaissant pour tout ce que tu as fait. Sans toi, je ne serais jamais où je suis maintenant.
1
TABLE DE MATIÈRES
Productions Scientifiques ... 5
Communications ... 7
Liste des tableaux ... 9
Liste des figures ... 11
Liste des abrévéations ... 13
I. Introduction ... 17
1. Le sein ... 17
1.1. Anatomie et physiologie ... 17
1.2. Histologie ... 18
2. Cancer du sein : épidémiologie descriptive ... 19
2.1. Incidence ... 19
2.2. Mortalité ... 20
3. Cancer du sein : Facteurs de risque établis / suspectés ... 21
3.1. Facteurs génétiques ... 21
3.1.1. Gènes rares de susceptibilité à forte pénétrance ... 21
3.1.2. Gènes rares de susceptibilité à pénétrance modérée ... 22
3.1.3. Allèles communs de susceptibilité à faible pénétrance ... 23
3.2. Facteurs non génétiques ... 23
3.2.1. Facteurs hormonaux et reproductifs ... 23
3.2.2. Facteurs anthropométriques ... 25
3.2.3. Facteurs liés au mode de vie ... 26
3.2.4. Facteurs environnementaux ... 27
4. Facteurs de risque suspectés étudiés dans le cadre de la thèse ... 28
4.1. Facteurs de risque environnementaux suspectés ... 28
4.2. Gènes du métabolisme des xénobiotiques (MX) ... 28
4.2.1. Métabolisme des xénobiotiques... 28
4.2.2. Rôle des gènes MX dans le métabolisme des hormones ... 30
4.2.3. Relation entre les gènes MX et le cancer du sein ... 31
4.2.4. Gènes du MX : quel intérêt pour l’étude des expositions environnementales 37 4.3. Exposition à la fumée de tabac ... 38
4.3.1. Fumée de tabac ... 38
4.3.2. Tabac actif : revue épidémiologique / effet propre et interaction GxE ... 38
4.3.3. Tabac passif : revue épidémiologique / effet propre et interaction GxE ... 39
4.4. Polluants organiques persistants (POP) ... 40
4.4.1. Définition ... 40
4.4.2. Modes de contamination ... 41
4.4.3. Effets toxiques / perturbation endocrinienne ... 41
4.4.4. DDT ... 42
4.4.5. PCB ... 45
II. OBJECTIFS ... 53
III. Matériel ... 57
1. Population d’étude (étude CECILE) ... 57
1.1. Sélection des cas ... 57
1.2. Sélection des témoins ... 57
2
3. Données de génotypage ... 59
3.1. Design de la puce ADN « BELUHCA » – Sélection des SNP et des gènes ... 59
3.2. Contrôle qualité (SNP) ... 60
3.3. Contrôle qualité (sujets) ... 60
3.4. Stratification de la population : Analyse en composantes principales (ACP) ... 61
4. Concentrations sanguines des polluants organiques persistants (POP) ... 62
IV. Rôle du gène NAT2 dans le cancer du sein et interaction avec la consommation de tabac (approche fonctionnelle) ... 67
1. Introduction ... 67
2. Méthodes ... 67
2.1. Échantillon d’analyse ... 67
2.2. Variables liées au tabagisme ... 67
2.3. Phénotype d’acétylation dérivés des polymorphismes du gène NAT2 ... 68
2.4. Analyses statistiques ... 69
2.4.1. Association entre le tabagisme et le cancer du sein ... 69
2.4.2. Association entre le phénotype acétyleur NAT2 et le cancer du sein ... 69
2.4.3. Interaction entre le tabagisme et le phénotype acétyleur NAT2 ... 69
3. Résultats ... 70
3.1. Description de la population d’étude ... 70
3.2. Tabac et cancer du sein ... 70
3.3. Effet propre du phénotype acétyleur du gène NAT2 ... 73
3.4. Phénotype d’acétylation NAT2 et tabagisme ... 74
4. Discussion ... 75
4.1. Tabac et cancer du sein ... 75
4.2. NAT2 et cancer du sein : effets propres et interaction avec la consommation de tabac…. ... 76
4.3. Forces et limites ... 77
5. Conclusion ... 77
V. Rôle des gènes MX dans le cancer du sein et interaction avec la consommation de tabac (approche « gene-set ») ... 81
1. Introduction ... 81
2. Méthodes ... 81
2.1. Échantillon d’analyse ... 81
2.2. Gènes MX sélectionnés ... 81
2.3. Analyse par ensemble de gènes (approche « gene-set ») ... 81
2.3.1. Méthode ARTP ... 82
2.3.2. Principe de la méthode ARTP ... 82
2.4. Analyses statistiques ... 83
2.4.1. Analyse SNP par SNP ... 83
2.4.2. Analyse « Gene-set » : méthode ARTP ... 84
2.4.3. Correction pour tests multiples ... 84
3. Résultats ... 85
3.1. Effet des gènes du pathway MX (Approche SNP par SNP) ... 85
3.1.1. Effet propre des SNP ... 85
3.1.2. Interaction SNP x statut tabagique ... 85
3.2. Effet des gènes et de l’ensemble du pathway MX (Approche « Gene-Set ») ... 86
3.2.1. Effet propre des gènes ... 86
3.2.2. Interaction avec le statut tabagique ... 88
3
4.1. Synthèse des résultats ... 91
4.2. Effet propre (gènes) ... 92
4.4.6. CYP2C18 et le CYP2C19... 92
4.4.7. AKR1C2 ... 93
4.4.8. ALDH1A3 ... 93
4.4.9. NAT2 ... 93
4.3. Interaction avec le tabac actif (gènes) ... 94
4.4.10. CYP3A43 et COMT ... 94
4.4. Effet propre et interaction / stratification sur statut tabagique (pathway) ... 95
4.5. Forces et limites ... 95
5. Conclusion ... 97
VI. Déterminants environnementaux et génétiques des niveaux de p,p’-DDE et PCB153…. ... 101
1. Introduction ... 101
2. Méthodes ... 101
2.1. Population d’étude ... 101
2.2. Sélection des gènes pris en compte ... 101
2.3. Mesures de p,p’-DDE et de PCB153 (variables à expliquer) ... 102
2.4. Analyses statistiques ... 102
2.4.1. Analyse SNP par SNP ... 102
2.4.2. Analyse groupée des SNP... 103
2.4.3. Pourcentage de variance expliquée par les SNP ... 103
3. Résultats ... 104
3.1. p,p’-DDE ... 104
3.1.1. Déterminants non génétiques des niveaux de p,p’-DDE ... 104
3.1.2. SNP associés aux niveaux de p,p’-DDE (analyse SNP par SNP) ... 105
3.1.3. Analyse groupée des SNP... 106
3.2. PCB153 ... 108
3.2.1. Déterminants non génétiques des niveaux de PCB153 ... 108
3.2.2. SNP associés aux niveaux de PCB153 (analyses SNP par SNP) ... 109
3.2.3. Analyse groupée des SNP... 110
4. Discussion ... 112
4.1. Synthèse des résultats ... 112
4.2. Déterminants génétiques des niveaux d’exposition aux composés organochlorés…. ... 112
4.3. Forces et limites ... 114
5. Conclusion ... 115
VII. Conclusion générale et perspectives ... 119
Perspectives ... 121
VIII. Références ... 125
5
Productions Scientifiques
Article 1
Publié ou acceptédéfinitivement en révision soumis en préparation Référence :
Berrandou, T., C. Mulot, E. Cordina-Duverger, P. Arveux, P. Laurent-Puig, T. Truong and
P. Guenel (2018). "Association of breast cancer risk with polymorphisms in genes involved in
the metabolism of xenobiotics and interaction with tobacco smoking : a gene-set analysis." Int J Cancer.
Article 2
Publié ou acceptédéfinitivement en révision soumis en préparation Référence :
Berrandou, T., C. Mulot, E. Cordina-Duverger, P. Arveux, P. Laurent-Puig, T. Truong and
P. Guenel. "Active and passive tobacco smoking, NAT2 gene polymorphisms and breast
cancer risk".
Article 3
Publié ou acceptédéfinitivement en révision soumis en préparation Référence :
Berrandou, T., E. Cordina-Duverger, C. Mulot, T. Truong and P. Guenel (2018). "Persistent Organochlorine Pollutants : Genetic variations associated with DDE and PCB153 blood levels among women in France".
7
Communications
Communication orale
Berrandou T, Cordina-Duverger E, Mulot C, Truong T, Guenel P. Persistent Organochlorine Pollutants: Genetic variations associated with DDE and PCB153 blood levels among women in France. ISES-ISEE 2018 Joint Meeting. Août 2018, Ottawa, Canada.
Communications affichées
Berrandou T, Cordina-Duverger E, Mulot C, Arveux P, Kerbrat P, Laurent-Puig P, Truong
T, Guenel P. Tobacco smoking, genes involved in the metabolism of xenobiotics and breast
cancer risk, 26th IGES meeting. Septembre 2017, Cambridge, R-U.
Berrandou T, Cordina-Duverger E, Mulot C, Truong T, Guenel P. Persistent Organochlorine Pollutants: Genetic variations associated with DDE and PCB153 blood levels among women in France. ISES-ISEE 2018 Joint Meeting. aout 2018, Ottawa, Canada.
9
Liste des tableaux
Tableau 1 : les gènes de forte pénétrance du cancer du sein et leurs syndromes associés ... 22 Tableau 2 : les gènes de pénétrance modérée du cancer du sein, leurs fonctions et leurs
phénotypes connus ... 22
Tableau 3: synthèse des SNP dans les gènes MX étudiés dans les études par approche
gène-candidat ... 36
Tableau 4 limites de détection (LD) en μg/L, quantification (LQ) en μg/L et distribution des niveaux des composés organochlorés dans le sang mesurés chez les témoins de l’étude CECILE ... 63
Tableau 5 : répartition des cas et des témoins selon l’âge, le département et les principaux facteurs de risque hormonaux, reproductifs ou liés au mode de vie ... 71
Tableau 6: odds ratios de cancer du sein associé au tabagisme actif. Ensemble des femmes et
stratification selon le statut ménopausique. ... 72
Tableau 7 : odds ratio d’association entre le risque de cancer du sein et le phénotype d’acétyleur NAT2 chez toutes les femmes et selon le statut ménopausique ... 73
Tableau 8: odds ratios de l’association entre le risque de cancer du sein et le statut tabagique selon le phénotype acétyleur NAT2 chez toutes les femmes et dans les sous-groupes pré et post-ménopausées. ... 74
Tableau 9: puissance statistique pour mettre en évidence un OR de 1,10, 1,20, 1,30 ou 1,40
pour l’effet propre des SNP avec α=0.05 dans l’étude CECILE. Chez toutes les femmes et dans les sous-groupes selon le statut ménopausique population ... 84
Tableau 10: résultats significatifs obtenus dans les analyses SNP par SNP. Odds ratios pour
chaque copie du variant mineur (effet propre) et ‘p’ d’association ou d’interaction corrigé pour le test multiple (FDR). ... 85
Tableau 11: les ‘p’ d’association entre le cancer du sein et les gènes ou l’ensemble du pathway du Métabolisme des Xénobiotiques. Toutes les femmes et stratification en fonction du statut ménopausique ... 86
Tableau 12: les ‘p’ d'interaction entre les gènes XMP et le statut tabagique chez toutes les femmes et dans les sous-groupes stratifiées selon le statut ménopausique. ... 88
Tableau 13: les ‘p’ d’association entre le risque de cancer du sein et l’ensemble du pathway MX obtenus par la méthode ARTP dans chaque sous-groupe défini selon le statut tabagique et le statut ménopausique. ... 90
Tableau 14: synthèse des résultats de l’association de la variation génétique dans les gènes MX avec le cancer du sein et son interaction avec le statut tabagique (ST). Les résultats sont issus d’analyses SNP par SNP et de l’analyse « gene-set » par la méthode ARTP ... 91
10
Tableau 15: exp(Δ*β) et IC95% obtenus à partir de la régression linéaire multivariée, associés avec les déterminants non génétiques des niveaux de p,p’-DDE chez les femmes témoins de l’étude CECILE ... 104
Tableau 16 : exp(β), IC à 95% et p(FDR) obtenus à partir de la régression linéaire
multivariée des niveaux de p,p’-DDE et les 10 SNP les plus significatifs (approche SNP par SNP). ... 106
Tableau 17 : exp(Δ*β) et IC à 95% obtenus à partir de la régression linéaire multivariée des
associations entre les niveaux sanguins de p,p’-DDE et l’ensemble de déterminants non génétiques et des SNP les plus significatifs. ... 107
Tableau 18 : calcul de R² des différents modèles linéaires des niveaux sanguins de p,p’-DDE ... 107
Tableau 19 : exp(Δ*β) et IC95% obtenus à partir de la régression linéaire multivariée, associés avec les déterminants non génétiques des niveaux de PCB153 chez les femmes témoins de l’étude CECILE. ... 108
Tableau 20: exp(β), IC à 95% et p (FDR) obtenus à partir de la régression linéaire multivariée des niveaux sanguins de PCB153 et les 10 tops SNP (approche SNP par SNP).110
Tableau 21 : exp(Δ*β) et IC à 95% obtenus à partir de la régression ordinale multivariée des
associations entre les niveaux sanguins de PCB153 et l’ensemble de déterminants non génétiques et des SNP les plus significatifs. ... 111
Tableau 22 : calcul de R² des différents modèles linéaires des niveaux sanguins de PCB153
... 111
Tableau 23: localisation des SNP significatifs et les scores de prédiction de fonction obtenu à
11
Liste des figures
Figure 1 : coupe du sein et de la paroi thoracique antérieure ... 17 Figure 2: carcinomes lobulaire (A) et canalaire (B) ... 18 Figure 3 : taux d'incidence standardisés des cancers du sein de la femme dans le monde
(2012) ... 19
Figure 4 : taux de mortalité standardisés des cancers du sein de la femme dans le monde
(2012) ... 20
Figure 5 : les phases I et II du métabolisme des xénobiotiques ... 29 Figure 6 : les étapes de la biosynthèse des hormones stéroïdiennes et les gènes MX impliqués
dans chacune des phases. ... 30
Figure 7: principaux source d’exposition aux composés organochlorés ... 41
Figure 8 : (A) : dichloro-diphényl-trichloro-éthane (C14H9Cl5 / DDT),et (B) :
Dichlor-odiphény-ldichloro-éthylène (C14H8Cl4 / p,p’-DDE ) ... 42
Figure 9: voie métabolique proposée pour la conversion du p,p'-DDE en son dérivé de
méthylsulfonyle ... 44
Figure 10 : structure chimique des PCB ... 45 Figure 11: schéma métabolique général pour un congénère représentatif des PCB (PCB136).
Les enzymes impliquées dans le métabolisme sont indiquées par les lettres A, B et D-N, la lettre C indiquant les transformations non enzymatiques. ... 48
Figure 12 : flow chart de la sélection des sujets de l’étude ... 58
Figure 13 : projection des individus des sujets des populations HapMap (CEU, CHB, JPT,
YRB) et sujets de l’étude CECILE sur les 2 premières composantes principales. ... 61
Figure 14: manhattan plot de l’analyse par régression ordinale des associations entre les niveaux sanguins de p,p′-DDE et 357 SNP dans les 54 gènes CYP et GST. Avec -10log (valeur p) sur l'axe des y et la position des SNP sur les chromosomes sur l'axe des x. La ligne rouge indique le seuil 5% de significativité après correction FDR. ... 105
Figure 15: manhattan plot de l’analyse par régression ordinale des associations entre les niveaux sanguins de PCB153 et 357 SNP dans les gènes 54 CYP et GST. Avec -10log (valeur p) sur l'axe des y et la position des SNP sur les chromosomes sur l'axe des x. La ligne rouge indique le seuil 5% de significativité après correction FDR. ... 109
13
Liste des abréviations
ACP : Analyse en Composantes Principale
ARTP : Adaptive Rank Truncated Product
CIRC : Centre International de Recherche sur le Cancer (IARC)
DDT : Dichloro-Diphényl-Trichloroéthane
DL : Déséquilibre de Liaison
FDR False Discovery Rate
HAP Hydrocarbures Aromatiques Polycycliques
IC 95% : Intervalle de Confiance à 95%
IMC : Indice de Masse Corporelle
LD : Limite de Détection
LQ Limite de Quantification
MAF : Minor Allele Frequency (fréquence de l’allèle mineur)
MX : Métabolisme des Xénobiotiques
OR : Odds Ratio
p,p’-DDE : 1,1-Dichloro-2,2-bis(p-chlorophényl)éthylène P-A : Paquet-Années
p: Degré de significativité des tests
PCB : Polychlorobiphényle
POP : Polluants Organiques Persistants
15
17
I. Introduction
1. Le sein
1.1. Anatomie et physiologie
Le sein désigne l’organe contenant la glande mammaire (Figure 1). Il est situé sur le dessus des muscles pectoraux. Cette glande fait partie de l'appareil reproducteur féminin et sa fonction principale est la lactation. Le sein commence à se développer au cours de la vie embryonnaire, mais n'est complètement développé et différencié qu'à l'âge adulte après la première grossesse à terme. Durant la puberté, les hormones stéroïdes sexuelles (principalement les œstrogènes) stimulent le développement et la croissance de tissus composant le sein, augmentant ainsi la taille et le volume du sein. Celui-ci subit d'importants changements physiologiques dus aux fluctuations hormonales pendant les menstruations, la grossesse, l'allaitement et la ménopause.
Le sein est principalement constitué de tissu adipeux, de tissu conjonctif (stroma) et de tissu glandulaire (épithélium). La structure interne de base du sein est constituée d’une vingtaine de lobes, chacun contenant vingt à quarante lobules (Figure 1). Chaque lobule est lui-même composé d’alvéoles, lieux de synthèse et de sécrétion du lait. Le lait est transporté par les canaux lactifères dans 15 à 20 canaux galactophores, qui drainent séparément chacun des lobes et débouchent à la surface du mamelon par des pores indépendants. Une involution des unités lobulaires se produit chez la femme pendant la ménopause, en réponse à l'arrêt de la production des hormones ovariennes.
18
1.2. Histologie
Les cancers du sein sont constitués en très grande majorité de carcinomes qui surviennent de la composante épithéliale du sein. On distingue les carcinomes lobulaires (Figure 2-A) qui se développent à partir des lobules et les cancers canalaires (Figure 2-B) qui se développent à partir des canaux lactifères. Les sarcomes sont des cancers rares qui représentent moins de 1 % des cancers du sein et ne sont pas décrits ci-dessous.
Les carcinomes in situ sont des cancers " pré-invasifs " qui n'ont pas envahi le tissu mammaire, mais qui ont le potentiel de devenir invasifs. Dans les cancers invasifs, les cellules cancéreuses s'infiltrent à l'extérieur des lobules (Figure 2-A) et des canaux lactifères (Figure 2-B) pour se développer dans le tissu conjonctif ou se propager dans les ganglions lymphatiques ou d'autres organes.
19
2. Cancer du sein : épidémiologie descriptive
2.1. Incidence
Dans le monde, le cancer du sein est le plus fréquent des cancers chez la femme avec 1,67 million de nouveaux cas diagnostiqués en 2012 (Ferlay et al. 2015). L’incidence dans les pays développés est plus élevée que dans les pays moins développés (Figure 3) avec un rapport d’incidence de quatre environ (ex : 27 pour 100.000 en Afrique Centrale ou l’Est de l’Asie contre 96 pour 100.000 en Europe de l’Ouest).
Figure 3 : taux d'incidence standardisés des cancers du sein de la femme dans le monde
(2012)
Source: GLOBOCAN 2012, International Agency for Research on Cancer
En France, le taux d’incidence standardisé a atteint 137 pour 100.000 personnes-années, représentant plus de 54.000 nouveau cas en 2012 (Ferlay et al. 2013). L’incidence a suivi une tendance haussière entre 1980 et 2005 (Belot et al. 2008), pouvant être expliquée par la mise en place des programmes de dépistage systématique et par l’augmentation de l’utilisation des traitements hormonaux de la ménopause (THM) durant les années 1990. À partir de 2005 une stabilisation de l’incidence puis une légère diminution sont observés. Cet inversement de tendance peut être expliqué par la diminution de prescription des THM combiné à un effet de saturation de dépistage (Molinie et al. 2014).
20
2.2. Mortalité
Le cancer du sein est la cinquième cause de mortalité par cancer à travers le monde. En 2012, le nombre de décès était estimé à 522.000 (Ferlay et al. 2015). Le cancer du sein représente la première cause de mortalité par cancer chez les femmes issues dans les pays sous-développés et se classe deuxième après le cancer du poumon dans les pays développés. L’écart entre les taux de mortalité dans les pays développés et pays sous-développés (Figure 4) est réduit par rapport à l’écart entre les taux d’incidence du fait d’une survie plus favorable dans les pays développés.
Figure 4 : taux de mortalité standardisés des cancers du sein de la femme dans le monde
(2012)
Source : GLOBOCAN 2012, International Agency for Research on Cancer
En France, le cancer du sein a causé 11.930 décès chez les femmes en 2012 (Ferlay et al. 2013). Le taux de mortalité par cancer du sein a baissé durant les dernières décennies. Cette baisse peut être expliquée par l'impact de la mise en place des programmes de dépistage mais pourrait être également attribuée aux progrès thérapeutiques considérables au cours des dernières décennies (Molinie et al. 2014).
21
3. Cancer du sein : Facteurs de risque établis / suspectés
3.1. Facteurs génétiques
Les femmes ayant des antécédents familiaux de cancer du sein ont un risque accru de contracter à leur tour un cancer du sein. Les femmes dont la mère ou la sœur est atteinte sont deux fois plus à risque que la population générale (Stratton et al. 2008). Moins de 30% des cancers du sein sont attribuables à des antécédents familiaux. On estime que 5% à 10% de tous les cancers du sein sont héréditaires et attribuables à des prédispositions génétiques (Evans et al. 2005), mais les altérations génétiques responsables de ces cancers du sein ne sont pas entièrement connues (Stratton et al. 2008). Les cancers du sein héréditaires sont souvent caractérisés par un diagnostic précoce et un risque en excès de cancer du sein bilatéral (Turnbull et al. 2008) .La grande majorité des cas familiaux sont dus à des gènes rares à forte pénétrance. Au cours des dernières années, d'autres gènes rares à pénétrance modéré et des allèles communs à faible pénétrance ont également été identifiés.
3.1.1. Gènes rares de susceptibilité à forte pénétrance
Les mutations des gènes BRCA1 et BRCA2 sont les prédispositions majeures au cancer du sein. Les mutations, les réarrangements ou délétions des gènes BRCA1 et BRCA2 sont transmis selon un modèle autosomique dominant. . BRCA1 et BRCA2 sont impliqués dans la réparation des dommages d'ADN par recombinaison homologue (Chen et al. 1999). Les défaillances de cette fonction importante contribuent à la tumorigenèse (Murphy et al. 2010).
D'autres gènes rares mais à forte pénétrance incluant PTEN (FitzGerald et al. 1998, Tan et al. 2012), TP53 (Garber et al. 1991, Birch et al. 2001, Rapakko et al. 2001), CDH1 (Pharoah et al. 2001), et STK11 (Boardman et al. 1998, Lim et al. 2004), confèrent chacun un syndrome pathologique distinct (Tableau 1). Collectivement avec BRCA1 et BRCA2, il est estimé que les gènes à forte pénétrance connus sont responsables d’environ 25 % des cas incidents de cancer du sein familiaux (Antoniou et al. 2006, Walsh et al. 2006, Shiovitz et al. 2015).
22 Tableau 1 : les gènes de forte pénétrance du cancer du sein et leurs syndromes associés
Gene Syndrome Caractéristiques du syndrome non cancéreux
BRCA1 BRCA2
Syndrome héréditaire du cancer du sein/ovaire
PTEN Syndrome des hamartomes
Syndrome de Cowden Lésions cutanées de type pathognomoniqueMacrocéphalie, maladie bénigne du sein et de la thyroïde, fibromes utérins, maladie de Lhermitte-Duclos, fibromes, lipomes, hamartomes intestinaux, retard mental.
TP53 Syndrome de Li-Fraumeni
CDH1 Cancer gastrique diffus héréditaire
STK11 Syndrome de Peutz-Jeghers Polypose hamartoptomatique gastro-intestinale Macules hyper-pigmentées
Hyperestrogénie 3.1.2. Gènes rares de susceptibilité à pénétrance modérée
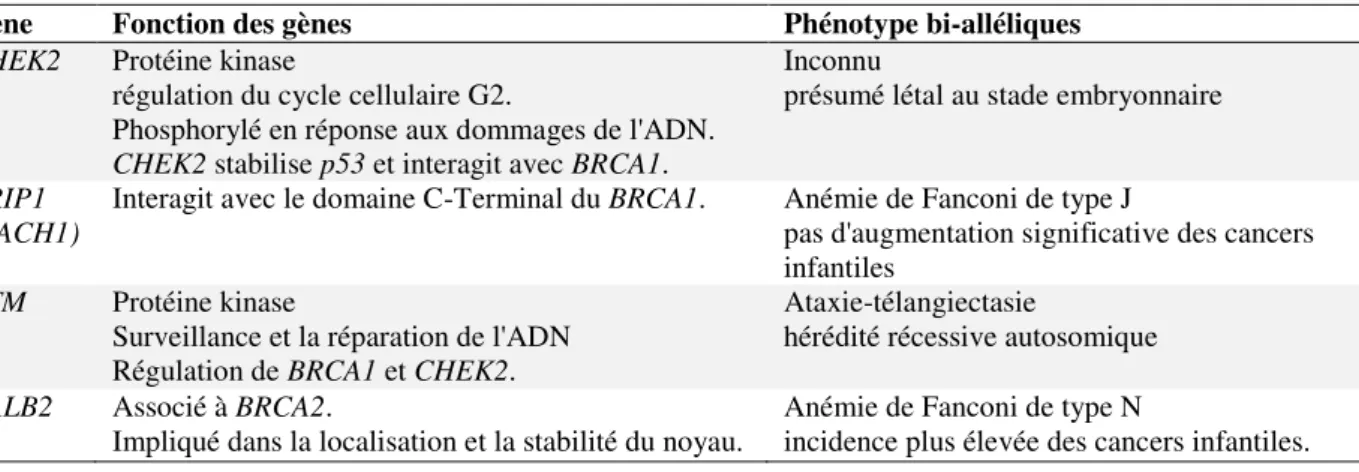
De nombreuses études de type « gène candidat » ont été effectuées dans des familles ayant des généalogies suggérant l’existence d’une prédisposition génétique au cancer du sein. Ces études ont identifié certains gènes de réparation de l'ADN qui interagissent avec BRCA1 et/ou BRCA2. En moyenne, les mutations mises en évidence augmentent de deux fois le risque de cancer du sein. Parmi ces gènes, on peut citer CHEK2 (Meijers-Heijboer et al. 2002), BRIP1 (BACH1) (Seal et al. 2006), ATM (Renwick et al. 2006), et PALB2 (Rahman et al. 2007). Ces gènes et leurs fonctions sont énumérés dans le Tableau 2 ci-dessous.
Tableau 2 : les gènes de pénétrance modérée du cancer du sein, leurs fonctions et leurs
phénotypes connus
Gène Fonction des gènes Phénotype bi-alléliques
CHEK2 Protéine kinase
régulation du cycle cellulaire G2.
Phosphorylé en réponse aux dommages de l'ADN.
CHEK2 stabilise p53 et interagit avec BRCA1.
Inconnu
présumé létal au stade embryonnaire
BRIP1
(BACH1) Interagit avec le domaine C-Terminal du BRCA1. Anémie de Fanconi de type J pas d'augmentation significative des cancers infantiles
ATM Protéine kinase
Surveillance et la réparation de l'ADN Régulation de BRCA1 et CHEK2.
Ataxie-télangiectasie
hérédité récessive autosomique
PALB2 Associé à BRCA2.
23
3.1.3. Allèles communs de susceptibilité à faible pénétrance
Ces allèles de susceptibilité sont fréquents dans la population générale (fréquence de l’allèle mineur > 5 %) et sont associés à une augmentation modeste du risque de cancer du sein (risque relatif <1,5 ; aucun allèle présentant un risque relatif supérieur à 1,5 n'a été identifié).
Les études d'association pan-génomique (GWAS) ont permis d'identifier de nombreuses régions (locus) génétiques associés au risque de cancer du sein (Ghoussaini et al. 2013, Michailidou et al. 2015, Milne et al. 2017). À ce jour, 182 SNP (réparti sur146 locus) ont été identifiés pour le cancer du sein, ce qui permet d’expliquer jusqu'à 18 % d'héritabilité du cancer du sein. L’ensemble des connaissances accumulées montre que le cancer du sein est une pathologie polygénique complexe (Lilyquist et al. 2018). La majorité des SNP (single
nucleotide polymorphisms) associés au cancer du sein sont localisés dans des gènes impliqués dans la réparation de l'ADN, le contrôle du cycle cellulaire, l'apoptose, la croissance cellulaire et la division cellulaire.
3.2. Facteurs non génétiques
3.2.1. Facteurs hormonaux et reproductifs Age à la ménarche et âge à la ménopause
La ménarche et la ménopause sont des marqueurs de début et de fin, respectivement, de l'activité ovarienne et de l'activité endocrinienne associée à la reproduction. Pendant la période de reproduction, l'ovaire produit des hormones stéroïdiennes qui affectent directement le développement et la fonction de la glande mammaire. Il est établi que la ménarche précoce et la ménopause tardive augmentent le risque de cancer du sein (Kapil et al. 2014) du fait d’une durée d’exposition prolongée aux œstrogènes.
Parité
Dans une analyse poolée regroupant 20 études (Clavel-Chapelon et al. 2002), les auteurs ont montré que pour chaque grossesse à terme le risque de cancer du sein diminuait de 3% et 12% respectivement chez les femmes pré et post-ménopausées. Cet effet protecteur est expliqué par la différenciation des cellules de la glande mammaire en réponse aux changements hormonaux induits par la grossesse ce qui les rendent moins sensibles aux effets des cancérogènes.
24
Âge à la première grossesse à terme
Concernant l'âge à la première grossesse à terme, les mêmes auteurs (Clavel-Chapelon et al. 2002) ont démontré que le risque de cancer du sein pour chaque année de retard de la première grossesse à terme est augmenté de 5% et de 3% respectivement chez les femmes pré- et post-ménopausées.
Allaitement
Indépendamment de la parité, l'effet de l`allaitement a été évalué dans une revue de 47 études épidémiologiques (Collaborative Group on Hormonal Factors in Breast 2002). Les résultats ont montré que le risque de cancer du sein a diminué de 4,3 % pour chaque période de 12 mois d'allaitement. Cet effet protecteur peut être expliqué par l’existence d’une différenciation plus complète des cellules mammaires lors de l’allaitement (Russo et al. 2001), et par le retard de retour des menstruations entraînant une durée d’exposition réduite aux hormones ovariennes (Kelsey et al. 1993).
Traitements hormonaux de la ménopause (THM)
Une revue de 51 études épidémiologiques (Collaborative Group on Hormonal Factors in Breast Cancer 1997) et l’étude « Million Women Study » (Chlebowski et al. 2003) initiée en 1996 ont fourni des preuves convaincantes que l'utilisation de THM augmente le risque de cancer du sein . Dans l'ensemble, le risque de cancer du sein est plus élevé pour les THM à base d'une combinaison d’œstrogènes et de progestatifs. Le risque est lié également à la durée d'utilisation et à la durée écoulée depuis l’arrêt d'utilisation (Cordina-Duverger et al. 2013).
Une revue récente de la littérature a rapporté un RR de 1,2 avec IC à 95 % 1,0 - 1,4 associé à l'utilisation actuelle d'œstrogènes seuls et un RR de 1,7 avec IC à 95 % 1,4 - 2,2 associé avec l'utilisation actuelle combiné d'œstrogènes et de progestatif (Collins et al. 2005). L'utilisation de THM a considérablement diminué au cours des dernières années. Cette diminution est vraisemblablement responsable de la baisse observée de l'incidence du cancer du sein (Ravdin et al. 2007, Molinie et al. 2014).
25
Contraceptifs oraux
L'association entre l'utilisation de contraceptifs oraux et le cancer du sein a été largement étudiée. Une analyse groupée de 54 études épidémiologiques effectuée en 1996 suggère une augmentation du risque associé à l'utilisation actuelle ou récente des contraceptifs oraux. L’association avec la prise de contraceptifs oraux n’était plus apparente 10 ans après l'arrêt d'utilisation (Collaborative Group on Hormonal Factors in Breast Cancer 1996). Depuis la publication de cette analyse, les résultats d'autres études sur l’utilisation de contraceptifs oraux montrent des résultats inconsistants, allant de l'absence d’effet à une augmentation modérée du risque de 20 à 30% (Van Hoften et al. 2000, Marchbanks et al. 2002, Dumeaux et al. 2003, Hunter et al. 2010, Marchbanks et al. 2012, Beaber et al. 2014).
3.2.2. Facteurs anthropométriques Taille
La taille est associée à une augmentation du risque de cancer du sein et cette association présente un effet dose-réponse linéaire (Friedenreich 2001, Baer et al. 2006, Green et al. 2011, Kabat et al. 2013). Les résultats issus d’une récente méta-analyse de 159 cohortes prospectives combinée à une étude de randomisation mendélienne ont fourni des preuves supplémentaires que le risque de cancer du sein est corrélé positivement avec la taille à l’âge adulte (Zhang et al. 2015). Les mécanismes qui peuvent expliquer cette association ne sont pas entièrement élucidés car la taille est un caractère complexe déterminé par de multiples facteurs génétiques et environnementaux. Parmi les pistes envisagées l'apport énergétique durant l’enfance pourrait jouer un rôle.
Poids et indice de masse corporelle (IMC)
L’association avec le poids et l’IMC dépend du statut ménopausique. L’obésité à l’âge adulte, définie par un indice de masse corporelle (IMC) supérieur à 30, est positivement associée au risque de cancer du sein chez les femmes post-ménopausées, alors qu’une association inverse a été observée chez les femmes pré-ménopausées (Michels et al. 2006, Renehan et al. 2008, Berstad et al. 2010, Harris et al. 2011, White et al. 2015, Cordina-Duverger et al. 2016). Par ailleurs, le gain de poids au début de l'âge adulte a été associé à un risque accru de cancer du sein chez les femmes post-ménopausées, mais pas chez les femmes pré-ménopausées (Keum et al. 2015). La conversion des androgènes en œstrogènes dans le tissu adipeux par les enzymes aromatases augmente le taux d'œstrogènes circulants, et
26 pourrait augmenter le risque de cancer du sein chez les femmes post-ménopausées (Picon-Ruiz et al. 2017). A l’inverse, les femmes obèses en pré-ménopause ont un taux sanguin d'estradiol réduit (Thomas et al. 1997), pouvant expliquer l'effet protecteur de l’obésité en pré-ménopause.
3.2.3. Facteurs liés au mode de vie Alimentation
Le rôle de facteurs alimentaires dans l’étiologie de cancer du sein, comprenant la consommation de graisses, de fruits et de légumes, de vitamines (A, C, E et ß-carotène), de glucides, de produits laitiers et de soja, ont fait l’objet de nombreuses études (Smith-Warner et al. 2001, Trock et al. 2006). Cependant, aucun de ces facteurs n'a été clairement établi comme étant associé au risque de cancer du sein (Michels et al. 2007). Par ailleurs d’autres études s’intéressant au potentiel inflammatoire ou anti-inflammatoire de l’alimentation ont suggéré qu’une alimentation de type inflammatoire était associée à un risque accru de cancer du sein (Tabung et al. 2016).
Consommation d’alcool
De nombreuses études observationnelles ont examiné le lien entre la consommation d'alcool et le cancer du sein. Dans l'ensemble, la consommation d'alcool a été clairement associée à une augmentation modérée du risque de cancer du sein (Hamajima et al. 2002, Tjonneland et al. 2007). Une analyse poolée de 53 études a montré une augmentation du risque de 7% pour chaque consommation additionnelle de 10 g d'alcool par jour (Hamajima et al. 2002).
Plusieurs mécanismes ont été évoqués, parmi lesquels l’augmentation de la concentration d'œstrogènes liés à la consommation d'alcool (Lachenmeier et al. 2012), la diminution de l'efficacité de la réparation de l'ADN (Purohit 2000), la stimulation du métabolisme de substances cancérogènes comme l'acétaldéhyde induisant des dommages à l’ADN (Singletary et al. 2001).
Activité physique
Plusieurs études ont suggéré que l’activité physique à l'âge adulte diminuait le risque de cancer du sein (Frova et al. 1991, Kobayashi et al. 2013). La majorité des études qui ont examiné cette association ont également mis en évidence un effet dose-réponse. Une méta-analyse de 31 études prospectives a montré que l'activité physique régulière était associée à
27 une réduction du risque de cancer du sein avec un effet dose-réponse (Wu et al. 2013). Les mécanismes par lesquels l'activité physique peut prévenir le cancer du sein ne sont pas clairs. L'activité physique a une influence sur la longueur du cycle menstruelle, sur le poids et sur les concentrations hormonales dans le sang (Sternfeld et al. 2002). L'activité physique pourrait réduire le risque de cancer du sein en agissant sur les niveaux d'œstrogènes, d'insuline et des facteurs de croissance (Friedenreich 2010).
Travail de nuit
Le travail de nuit entraînant une perturbation du rythme circadien a été classé comme cancérogène probable (groupe 2A) par le CIRC en 2007 sur la base de preuves suffisantes chez l’animal et de preuves limitées chez l'homme (IARC 2010). Depuis, plusieurs études ont évalué le risque de cancer du sein lié au travail de nuit, avec des résultats contradictoires (Fritschi et al. 2013, Koppes et al. 2014, Akerstedt et al. 2015, Papantoniou et al. 2016). Une analyse poolée récente de 5 grandes études cas-témoins en population générale permettant d’évaluer l’exposition au travail de nuit de façon homogène sur l’ensemble de la vie professionnelle à partir d’une définition commune, montre l’existence d’un risque accru de cancer du sein chez les femmes en pré-ménopause travaillant de nuit plus de trois fois par semaine (Cordina-Duverger et al. 2018). Cette analyse a montré également que le risque diminue après l’arrêt de l’exposition pendant plus de 2 années. Parmi les mécanismes d’action, on a évoqué la suppression du pic nocturne de mélatonine causée par l'exposition à la lumière durant la nuit, les perturbations de l’horloge circadienne ayant un impact sur le cycle cellulaire, l’apoptose et la réparation de l’ADN, certains facteurs liés au mode de vie (ex, régimes alimentaires de mauvaise qualité, moins d'activité physique chez les femmes travaillant de nuit) et la diminution de la vitamine D par manque d’exposition au soleil (Fritschi et al. 2011).
3.2.4. Facteurs environnementaux Rayonnement ionisants
Les radiations ionisantes, y compris d’origine médicale, constituent le seul facteur de risque environnemental bien établi de cancer du sein (Preston et al. 2002, Land et al. 2003, Travis et al. 2005). Il a été rapporté l’existence d’une relation dose-réponse linéaire entre l'exposition et le risque de cancer du sein (Ronckers et al. 2005). Toutefois le nombre de cas attribuable à cette exposition dans la population est très faible.
28
4. Facteurs de risque suspectés étudiés dans le cadre de la thèse
4.1. Facteurs de risque environnementaux suspectés
Les facteurs de risque bien établis de cancer du sein liés aux hormones, à la reproduction ou à l'obésité (Kluttig et al. 2009) ne permettent d’expliquer qu'une minorité de diagnostics de cancers du sein (Tamimi et al. 2016). L'exposition à des produits chimiques environnementaux tels que les PCB, les pesticides organochlorés, les dioxines, les hydrocarbures aromatiques cycliques (HAP), les solvants organiques ou les polluants atmosphériques sont également suspectés de jouer un rôle (Andersen et al. 2017). Certains composés comme les HAP, les arylamines et les N-nitrosamines sont métabolisés et activés dans les cellules de la glande mammaire, et sont à l’origine de tumeurs mammaires chez l’animal (Terry et al. 2002, Collishaw et al. 2009). Toutefois, les études épidémiologiques sont loin d’être concluantes, du fait des difficultés d’évaluation des expositions environnementales sur le long terme parmi les sujets. En raison de ces difficultés, le niveau de preuve d’un lien entre ces expositions et le cancer du sein est faible (Rodgers et al. 2018).
4.2. Gènes du métabolisme des xénobiotiques (MX)
4.2.1. Métabolisme des xénobiotiques
Les polluants environnementaux qui ont pénétré dans l’organisme, ou xénobiotiques, sont métabolisés puis éliminés par des enzymes de phase I ou II (Figure 5) encodés par les gènes dits du métabolisme des xénobiotiques (MX) (Parkinson 2013). La phase I correspond aux réactions de fonctionnalisation, catalysées principalement par les cytochromes mono-oxygénases P450 (CYPs) et d'autres enzymes comprenant les ADH, AKR1C, ALDH, ALDH,
DHDH, EPHX, NQO1 et SOD. La phase II correspond à des réactions de conjugaison. Les enzymes qui interviennent dans la phase II sont principalement des transférases telles que les aryl-amine N-acétyltransférases (NATs), Glutathion S-transférases (GSTs), les UDP-glucuronyl-transferases (UGTs), les sulfo-transférases (SULTs) et le catéchol-O-méthyl-transférase (COMT) (Parkinson 2013). De manière générale, les réactions des phases I et II entraînent la formation de métabolites inactifs facilement éliminés de l'organisme. Cependant, certains métabolites produits au cours des deux phases peuvent être plus toxiques que les xénobiotiques d'origine et peuvent induire des altérations de l’ADN ayant un effet cancérogène (Deloménie et al. 1998).
29 Figure 5 : les phases I et II du métabolisme des xénobiotiques
30
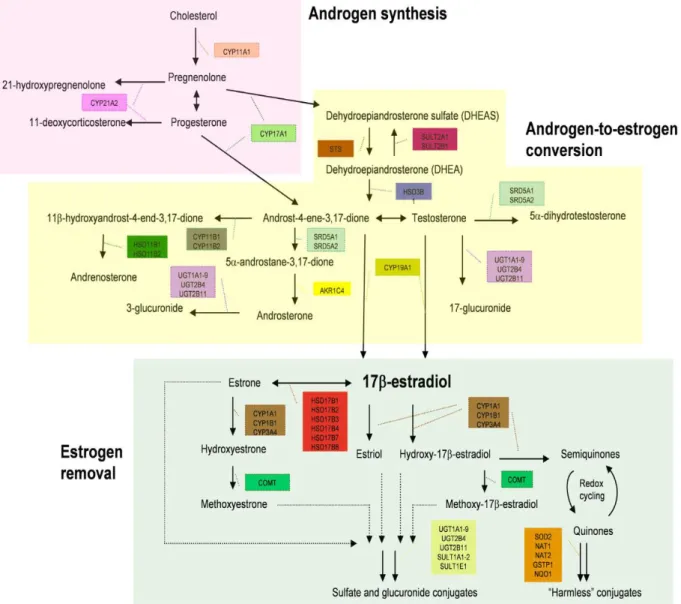
4.2.2. Rôle des gènes MX dans le métabolisme des hormones
Le métabolisme des hormones stéroïdes, qui jouent un grand rôle dans le risque de cancer du sein, implique également les enzymes de phase I et de phase II (Figure 6). Le déséquilibre dans la biosynthèse et/ou l'activation des hormones stéroïdes peut conduire au développement de cancers hormono-dépendants. Les enzymes du métabolisme des stéroïdes de phase I comprennent les mono-oxygénases de la superfamille des cytochromes P450 (CYPs), les oxydoréductases appartenant aux déshydrogénases à chaîne courte (SDR) et la superfamille des aldo-kéto-réductases (AKRs). Les enzymes de conjugaison de phase II comprennent les sulfo-transférases (SULTs), les glucuronosyl-transférases (UDPs) et le catéchol-O-méthyl-transférase (COMT).
Figure 6 : les étapes de la biosynthèse des hormones stéroïdiennes et les gènes MX impliqués
dans chacune des phases.
31
4.2.3. Relation entre les gènes MX et le cancer du sein Approche gène candidat
Les cytochromes P450 (CYP)
Les enzymes CYP sont nécessaires au développement normal des mammifères (McKinnon et al. 1998). Ils ont une large spécificité de substrat et jouent un rôle important dans la synthèse des hormones endogènes et dans le métabolisme des xénobiotiques (Blackburn et al. 2015).
CYP1A1, CYP1A2, and CYP1B1
Les substrats de la famille des enzymes CYP1 incluent les HAP (Larsen et al. 1998, Luch et al. 1999) et les amines hétérocycliques (Crofts et al. 1998, Williams et al. 1998). Le
CYP1A1 catalyse également l'hydroxylation de l'œstrogène (Blackburn et al. 2015). CYP1B1
hydroxyle également 17β-estradiol en métabolite pro-cancérogène (Blackburn et al. 2015). Les associations entre le cancer du sein et quatre polymorphismes du gène CYP1A1 (rs4646903, rs1800031, rs1048943 et rs1799814) ont été étudiées. Une méta-analyse (Sergentanis et al. 2010) a conclu que l'allèle rs1048943 était associé à un risque accru de cancer du sein chez les femmes d’origine caucasienne. A l’inverse, les variants rs4646903, rs1800031 et rs1799814 n'étaient pas associés au cancer du sein (Sergentanis et al. 2010, Wu et al. 2017).
En ce qui concerne le CYP1A2, une méta-analyse a indiqué que le polymorphisme rs762551 dans le gène CYP1A2 était associé au cancer du sein dans les populations caucasiennes (Tian et al. 2013).
Plusieurs méta-analyses portant sur des milliers de cas et de témoins n'ont pas mis en évidence d’association entre les variants rs1056827, rs10012, rs1056836 et rs1800440 du gène CYP1B1 et le cancer du sein (Paracchini et al. 2007, Economopoulos et al. 2010, Yao et al. 2010).
CYP2C, CYP2E, CYP3A
Il a été démontré que les variants fonctionnels du gène CYP2C19 sont associés au cancer du sein. Le variant CYP2C19*3 (rs57081121) lié à une diminution de l'activité de l’enzyme CYP2C19 était associé à un risque accru chez les femmes Asiatiques (Gan et al. 2011). A l’inverse le variant CYP2C19*17 (rs12248560) lié au phénotype de métaboliseur ultra rapide était associé avec une diminution du risque chez les femmes européennes utilisatrices de THM (Justenhoven et al. 2012).
32 Le CYP2E1 métabolise l'éthanol et des cancérogènes de faible poids moléculaire comme les N-nitrosamines présents dans la fumée de cigarette. Le principal produit issu de ces réactions est l'acétaldéhyde, un métabolite réactif et toxique, ainsi que des radicaux libres d’oxygène et des pro-cancérogènes. Il a été rapporté que les sujets présentant des polymorphismes du gène CYP2E1 et qui consomment de grandes quantités d'alcool avaient un risque accru de développer un cancer de la cavité buccale (Marichalar-Mendia et al. 2010). La relation entre les polymorphismes du gène CYP2E1 et le cancer du sein a été explorée dans plusieurs études avec des résultats contradictoires. Une récente méta-analyse basée sur quatre études a conclu que le variant rs6413432 (CYP2E1*6) était associé à une augmentation du risque de cancer du sein (Lu et al. 2017).
Le gène CYP3A4 fait partie d'un groupe de gènes du cytochrome P450 (CYP3A5,
CYP3A7 et CYP3A43) impliqués dans l'oxydation des stéroïdes, des lipides, des cancérogènes et des médicaments. Parmi les nombreux polymorphismes identifiés dans le gène CYP3A4, le variant rs2740574 (CYP3A4*1B) est l'un des polymorphismes les plus étudiés. Le variant
CYP3A4*1B, situé dans la région du promoteur, est associé à la réduction de l'expression et de l'activité catalytique enzymatique du CYP3A4 (Dally et al. 2003).
Une méta-analyse a montré que le variant CYP3A4*1B était associé à un risque accru de cancer en général, mais n'a trouvé qu'une augmentation modérée et non significative du risque de cancer du sein (Zhou et al. 2013). Un autre polymorphisme rs10235235 situé dans la région non codante du locus CYP3A a été associé au risque de cancer du sein chez les femmes pré-ménopausées (Johnson et al. 2012). Dans une autre étude de grande envergure, d'autres polymorphismes génétiques localisés dans les gènes CYP 3A4, 3A5, 3A7 et 3A43 n'ont montré aucune association avec le cancer du sein (Marie Genica Consortium 2010).
Le Catéchol-O-méthyl-transférase (COMT)
L’enzyme COMT conjugue et inactive les catéchol-estrogènes. Cette enzyme est exprimée à des niveaux élevés dans le foie et les reins, mais aussi dans le tissu mammaire, les globules rouges et l'endomètre (Mannisto et al. 1992). L'enzyme existe à la fois sous forme soluble et sous forme membranaire (Tenhunen et al. 1999).
Un polymorphisme génétique rs4680 à l’origine d’une substitution ValineMéthionine au codon 158 (COMT/Val158Met) est associé à une diminution de l'activité enzymatique (Dawling et al. 2001) qui suggère que les porteurs (environ 25% des Caucasiens), pourraient présenter un risque accru de cancer du sein du fait d’une moindre
33 capacité à conjuguer les catéchol-œstrogènes. Une méta-analyse exhaustive de 56 études, 34 358 cas de cancer du sein et 45 429 témoins, a toutefois conclu à l’absence d’association entre ce variant et le risque de cancer du sein (Qin et al. 2012).
Les N-acétyltransférases (NAT)
Les gènes NATs sont situés sur deux locus sur le chromosome 8p22 (Matas et al. 1997). Les enzymes NATs exprimées au niveau hépatique et les enzymes NATs exprimées au niveau mammaire peuvent avoir des effets opposés sur la carcinogenèse mammaire, notamment une détoxification hépatique et une excrétion accrue des cancérogènes mammaires potentiels et l'activation métabolique des amines hétérocycliques et Amines aromatiques par O-acétylation dans le sein (DeBruin et al. 1999). NAT1 active les amino-biphényles via l'O-acétylation, tandis que NAT1 et NAT2 activent par O-acétylation les métabolites N-hydroxy des amines hétérocycliques (Grant et al. 1997). Les polymorphismes du gène NAT2, ainsi que leur haplotype qui détermine le phénotype acétyleur lent, intermédiaire ou rapide, n'ont pas été associés au cancer du sein lorsqu’ils ont été étudiés indépendamment de l’exposition à la fumée de tabac (Ochs-Balcom et al. 2007, Ambrosone et al. 2008, Zhang et al. 2010, Anderson et al. 2012, Wang et al. 2016).
Les Glutathion S-Transférases (GST)
Les GST jouent un rôle important dans la détoxification des médicaments, des cancérogènes et des espèces réactives de l'oxygène et agissent à la fois comme peroxydases et comme catalyseurs du transfert du groupe glutathion vers les électrophiles hydrophobes. Il existe six grandes familles de gènes (-A, -M, -P, -S, -T et -Z), codant six familles d'enzymes (α, μ, π, σ, θ et ζ) respectivement, avec des spécificités aux substrats qui se chevauchent (Whalen et al. 1998).
Il a été a rapporté que la délétion des gènes GSTM1 et GSTT1 ainsi que le polymorphisme rs1695 localisé dans le gène GSTP1 sont associés avec le risque global de cancer du sein (Steck et al. 2007, Marie Genica Consortium 2010, Hashemi et al. 2012). De plus, la délétion du gène GSTT1 est associée au risque de cancer du sein chez les femmes pré-ménopausées (Van Emburgh et al. 2008). Ces effets des variants GST dans l’étiologie de cancer du sein peuvent être expliqués par une conjugaison plus faible des œstrogènes-quinones qui peuvent induire des dommages à l'ADN (Strange et al. 2001, Hachey et al. 2003). Les méta-analyses les plus récentes ont montré que le génotype nul de GSTT1 était associé avec l’augmentation du risque de cancer du sein (Sergentanis et al. 2010, Song et al.
34 2016, Hussain et al. 2018). Concernant le génotype GSTM1-nul, une association positive avec le cancer du sein a été rapportée par les méta-analyses de la dernière décennie (Qiu et al. 2010, Hussain et al. 2018). L'association entre le GSTO et le risque de cancer du sein a été étudiée dans certaines études. Marahatta et al ont démontré que le polymorphisme rs4925 du gène GSTO1 pourrait jouer un rôle important dans le développement du cancer du sein (Marahatta et al. 2006). Au contraire, les variants des gènes GSTO1 et GSTO2 n'étaient pas associées au risque de cancer du sein dans certaines études (Chariyalertsak et al. 2009).
Les Sulfo-transférases (SULT)
Les SULT peuvent être classés en deux grandes catégories : les SULT1 qui métabolisent les phénols, et les SULT2 qui métabolisent les hydroxy-stéroïdes. La conjugaison avec le sulfate entraîne l'inactivation des œstrogènes. La sulfatation joue également un rôle important dans l'activation et la détoxification des cancérogènes. Il a été démontré que les SULT activent certains métabolites d’HAP (Chou et al. 1998) et les dérivés N-hydroxylés d'amines aromatiques (Windmill et al. 1997) et d'amines hétérocycliques (Lewis et al. 1998) .
L'enzyme codée par le gène SULT1A1 joue un rôle important dans le métabolisme des xénobiotiques. Le polymorphisme rs9282861 (Arg213His) réduit l'activité de l’enzyme. Une méta-analyse, incluant 3902 cas et 5703 témoins de 12 études cas-témoins, a exploré l'association entre le polymorphisme Arg213His et le risque de cancer du sein. Cependant, cette étude a conclu l’absence d’association (Xiao et al. 2014).
Les UDP-glucuronyl-transférases (UGT)
La glucuronidation catalysée par les UGT est une voie majeure du métabolisme des œstrogènes (Zhu et al. 1998) et des androgènes (Belanger et al. 1998) dans le sein. La glucuronidation est également une voie majeure du métabolisme de détoxification pour les HAP (Strickland et al. 1994), les amines hétérocycliques (Malfatti et al. 1999) et les amines aromatiques (Ciotti et al. 1999).
Les polymorphismes liés à une faible activité des UGT peuvent accroître le risque de cancer du sein. Le rôle dans le cancer du sein de plusieurs variants des gènes UGT (1A1, 1A3,
1A8, 1A9, 1A10, 2B7, 2B17) ont fait l'objet d'études épidémiologiques (Hu et al. 2016).
Le rs8175347 désigne un polymorphisme de répétition d'un di-nucléotide ‘TA’ (5 à 8 répétitions) dans le promoteur du gène UGT1A1 (région TATA Box). L'activité du promoteur UGT1A1 diminue avec l'augmentation du nombre de répétitions (Beutler et al. 1998).
35 Les résultats des études évaluant l’effet du variant rs8175347 étaient contradictoires (Adegoke et al. 2004, Sparks et al. 2004, Cheng et al. 2005, Shatalova et al. 2005, Tsezou et al. 2007, Huo et al. 2008, Justenhoven et al. 2010, Risk 2010, Clendenen et al. 2013). Ces divergences pourraient être dues en partie aux différences ethniques et à la taille des échantillons utilisés dans chaque étude. En 2010, Yao et al. ont effectué une méta-analyse de sept études cas-témoins, incluant 5746 cas et 8365 cas (Yao et al. 2010). Ils ont montré une association significative entre la diminution du risque de cancer du sein et le génotype « Wild-Type » (6 répétition TA) par rapport au génotype muté (7 répétition TA).
Trois variants génétiques fonctionnels rs6759892, rs2070959 situés dans le gène
UGT1A6 et rs386656364 situé dans le gène UGT1A7 ont été suggérés comme étant associés au risque de cancer du sein (Justenhoven et al. 2010, Marie Genica Consortium 2010). L'association du variant rs6759892 avec le cancer du sein a été confirmée par une analyse poolée de 7148 cas de cancer du sein et de 8720 témoins provenant de six études indépendantes (Justenhoven et al. 2013). Le variant rs386656364 a été rapporté comme ayant un effet différencié selon l'âge (Ralph et al. 2007), une association positive avec le risque de cancer du sein chez les jeunes femmes (30-44 ans) ainsi qu'une association négative avec le cancer du sein chez les femmes plus âgées (55-69 ans). Comme UGT1A6 et UGT1A7 ne sont pas impliqués dans le métabolisme des œstrogènes et leurs métabolites (Lepine et al. 2004, Hu et al. 2014), cet effet de risque peut être attribuable à l'activité des UGT1A6 et UGT1A7 dans le métabolisme des cancérogènes exogènes (Hu et al. 2014).
Les œstrogènes (ex : estradiol et estriol) et les catéchol-estrogènes (ex : 4-OH-estrone et 4-OH-estradiol) sont des substrats de l'UGT2B4 et de l'UGT2B7 (Turgeon et al. 2001, Lepine et al. 2004). En utilisant un tag-SNP rs13129471 (UGT2B4), une étude cas-témoins dans la population d'ascendance africaine a indiqué que ce variant était significativement associé au cancer du sein (Sun et al. 2011). L'association entre rs7439366 (UGT2B7) et le risque de cancer du sein a été également évaluée mais aucune association n'a été observée (Marie Genica Consortium 2010).
Approche GWAS (Genome Wide Association Studies)
Les études d’association entre le risque de cancer du sein et les variants des gènes du MX dans le cadre des études pan-génomiques n’ont pas mis en évidence d’association avec les gènes MX. Aucun des 182 SNP de susceptibilité au cancer du sein identifiés dans les études GWAS n'a été localisé dans les gènes du MX (Lilyquist et al. 2018).