MINISTERE DE L’ENSEIGNEMENT SUPERIEUR ET DE LA RECHERCHE SCIENTIFIQUE UNIVERSITE AKLI MOHAND OULHADJ – BOUIRA
FACULTE DES SCIENCES DE LA NATURE ET DE LA VIE ET DES SCIENCES DE LA TERRE DEPARTEMENT DE BIOLOGIE
Réf : ……./UAMOB/F.SNV.ST/DEP.BIO/2019
MEMOIRE DE FIN D’ETUDES
EN VUE DE L’OBTENTION DU DIPLOME MASTER
Domaine : SNV Filière : Sciences Biologiques
Spécialité : Biochimie Appliquée
Présenté par :
BANOUH Hicham et MAIZ Mohamed Yacine
Thème
Evaluation in vitro de l’activité antilithiasique des extraits
des feuilles et des fleurs de Paronychia argentea , plante
utilisée en médecine traditionnelle en Algérie.
Soutenu le : 08/07/2019
Devant le jury composé de :
Nom et Prénom Grade
M. MOUNI Lotfi Professeur Univ. de Bouira Président
M. IMESSAOUDENE Ali MAA Univ. de Bouira Promoteur
Mme.BENZITOUNE Nour el Imane Doctorante Univ. de Bouira Co-Promotrice
M. CHERGUI Achour MAA Univ. de Bouira Examinateur
Remerciements
Nous commençons par remercier ALLAH le tout puissant de nous avoir donné la
volonté, l’amour du savoir et surtout le courage et la patience pour effectuer ce
modeste travail.
Nous commençons par exprimer notre profonde reconnaissance et nos vifs
remerciements à monsieur IMESSAOUDENE Ali, qui nous a honorés de
proposer et diriger ce travail, pour ses encouragements, ses conseils, sa
disponibilité et surtout pour sa patience dans la correction de ce mémoire. Nous
étions satisfaits de votre bon enseignant, merci de nous avoir guidés avec
patience et d’avoir consacré autant d’heures pour les corrections de ce
manuscrit ; nous ne pouvons, monsieur , que sincèrement vous exprimer notre
respect et notre gratitude.
Nos remerciements les plus cordiaux et toutes nos pensées de gratitude à notre
Co-promotrice BENZITOUNE Imane qui a codirigé notre projet avec plein de
sagesse, de générosité et de gentillesse pendant toute la période du stage.
Nos vifs remerciements s'adressent également à Monsieur Moussa
Hamza qui nous a aidés
dans notre projet avec plein de sagesse, de générosité
et de gentillesse pendant toute la période du stage. Toutes nos reconnaissances,
nos gratitudes et nos sentiments les plus distingués pour son aide, ses critiques,
son soutient, ses conseils.
Nos vifs remerciements vont également aux membres du jury « Monsieur
MOUNI et Monsieur CHERGUI pour l’intérêt qu’ils
ont porté à nos travaux en acceptant de l’examiner et de l’enrichir par
leurs propositions, malgré leurs compétences nous ont soutenus dans la
poursuite de nos études.
Enfin nos remerciements s’adressent plus particulièrement à nos familles, amis
et toutes personnes qui ont participé de près ou de loin à l’élaboration de ce
Dédicace
Je dédie ce mémoire à
Mes parents
Ma mère FATIHA, qui a œuvré pour ma réussite, de par son amour,
son soutien, tous les sacrifices consentis et ses précieux conseils, pour
toute son assistance et sa présence dans ma vie, reçois à travers ce
travail aussi modeste soit-il, l'expression de mes sentiments et de mon
éternelle gratitude.
Mon père Mohamed, qui peut être fier et trouver ici le résultat de
longues années de sacrifices et de privations pour m'aider à avancer
dans la vie. Puisse Dieu faire en sorte que ce travail porte son fruit ;
Merci pour les valeurs nobles, l'éducation et le soutient permanent
venu de toi.
A mes frères : Ahmed, Slimane, abderezak, Noureddine
Merci de m’avoir soutenu et témoigné votre affection durant tout ce
temps. J’ai toujours pu compter sur vous quel que soit le moment.
Restons unis et soyons à la hauteur de nos parents. Que DIEU vous
bénisse.
A mon binôme et ami Yacine avec qui j’ai partagé tous les moments
de stress de fatigue, mais aussi de fous rires.
A mes amis(es) qui m’ont aidé de réaliser ce travail : Mustapha,
Moumène, Azeddine, Nacer, massi et nassima….Merci beaucoup
mes amis(es)
Je dédie ce mémoire
A la plus belle créature que Dieu a créer sur terre, à la source de
tendresse, de patience et de générosité, ma mère « Fatiha » . Qui a
œuvré pour ma réussite de par son amour, son soutien, tous les
sacrifices consentis et ses précieux conseils, pour toute son assistance
et sa présence dans ma vie, reçois à travers ce travail aussi modeste
soit-il, l’expression de mes sentiments et de mon éternelle gratitude.
Puisse dieu, le tout puissant, te préserver et t’accorder santé, longue
vie et bonheur.
A mon père « Boualem », aucune dédicace ne saurait exprimer
l’amour, l’estime, le dévouement et le respect que j’ai toujours pour
toi.
A mon frère et ma soeur : Omar et Sabrina
Merci de m’avoir soutenu et témoigné votre affection durant tout ce
temps. J’ai toujours pu compter sur vous quel que soit le moment.
Restons unis et soyons à la hauteur de nos parents. Que DIEU vous
bénisse.
A mon binôme et ami Hicham avec qui j’ai partagé tous les moments
de stress et de fatigue, mais aussi de fous rires.
A mes amis(es) qui m’ont aidé de réaliser ce travail : Nassime,
Samia, Hamza, Taous, Amel, Farida,…Merci beaucoup mes
amis(es).
Table des matières
Table des matières
Liste des abréviations
Liste des figures
Liste des tableaux
Introduction
... 1Chapitre I : Synthèse bibliographique
I.1. Lithiase rénale ... 3I.1.1. Définition ... 3
I.1.2. La lithogénèse ... 3
I.1.2.1. Les étapes de la lithogénèse ... 3
I.1.3. Les différents types de calculs ... 6
I.1.3.1. Calculs d’oxalate de calcium ... 6
I.1.3.2. Calculs d'acide urique ... 7
I.1.3.3. Calculs de Struvite ... 7
I.1.3.4. Calculs de Cystine... 8
I.1.4. Inhibiteurs et Promoteurs ... 8
I.1.5. Facteurs de la lithogenèse ... 9
I.2. Les plantes médicinales ... 10
I.2.1. Paronychia argentea ... 10
I.2.1.1. Description botanique ... 10
I.2.1.2. Taxonomie et systématique... 11
I.2.1.3. Composition chimique ... 11
I.2.1.4. Répartition géographique ... 12
I.2.1.5. Propriétés thérapeutiques ... 12
Chapitre II : Matériels et méthodes
II.1. Matériels... 13II.1.1. Matériels végétales ... 13
II.1.2. Réactifs et produits chimiques ... 13
Table des matières
II.2.1. Préparation de la poudre végétale ... 13
II.2.2. Identification botanique ... 13
II.2.3. Préparation de l’extrait éthanolique ... 13
II.2.3.1. Extraction par (Sonication/ Maceration) ... 13
II.2.4. Evaluation des taux des composés phénoliques ... 14
II.2.4.1. Dosage des polyphénols totaux ... 14
II.2.4.2. Dosage des flavonoïdes ... 15
II.2.5. Evaluation de l’activité antilithiasique ... 16
II.2.5.1. Model expérimental d’étude de la cinétique de cristallisation de l’oxalate de calcium ... 16
II.2.5.2. Cinétique de la cristallisation d’oxalate de calcium en absence des extraits de la plante ... 18
II.2.5.3. Cinétique de la cristallisation d’oxalate de calcium en présence des extraits de la plante ... 18
II.2.5.4. Cinétique de la cristallisation d’oxalate de calcium en présence d’acide citrique (contrôle positif) ... 19
II.2.6. Etude de la cristallisation par microscope optique ... 19
Chapitre III : Résultats et discussion
III.1. Rendement d’extraction ... 20III.2. Teneur en polyphénols et flavonoïdes ... 21
III.2.1.Teneurs en polyphénols ... 21
III.2.2. Teneurs en flavonoïdes... 23
III.3. Evaluation de l’activité antilithiasique ... 24
III.3.1. En absence des extrait de la plante (contrôle négatif) ... 24
III.3.2. En présence des extraits de la plante ... 25
III.2.3.1. Extrait des feuilles ... 25
III.2.3.1. Extrait des Fleurs ... 28
III.3.3. Control positive (Acide citrique)... 32
III.4. Etude de la cristallisation par microscope optique... 34
Conclusion ... 38 Références bibliographiques
Liste des abréviations
Liste des abréviations
Do : Densité optique
ENSA : École nationale supérieure agronomique d'Alger I% : Pourcentage d’inhibition
Kps : Produit de solubilité
mgEq AG/g : Milligramme d’équivalent d’acide gallique par gramme mgEq Q/g : Milligrammes d’équivalent de quercétine par gramme min : Minute MS : Spectroscopie de masse P : Pente turbidimétrique pH : potentiel d’hydrogène THF : Protéines Tam-Horsfall Ti : Temps d’induction
Liste des figures
Liste des figures
Figure 01 : Étapes de la formation des cristaux oxalocalciques et niveau d’action des
principaux inhibiteurs de cristallisation ………...………..5
Figure 02 : Oxalate de calcium...………..………6
Figure 03: Les différent types d’oxalate de calcium…....………..………....7
Figure 04 : Calculs de Struvite……….………..7
Figure 05 : Calculs de Cystine………...……….………...8
Figure 06: Photographies originales de Paronychia argentea………...………. 11
Figure 7: Réaction de réduction du folin avec les polyphenols………...….……...…………14
Figure 8: Réaction du chlorure d’Aluminium avec les flavonoïdes……….…15
Figure 09 : Allure générale de la courbe turbidimétrique………17
Figure 10 : Model expérimental d’étude de la cristallisation oxalocalcique (originale)…..…17
Figure 11 : Variations des teneurs en polyphénols totaux au niveau des extraits éthanoliques foliaires et floraux de Paronchiya argentea………...22
Figure 12 : Variations des teneurs en flavonoïdes au niveau des extraits éthanoliques foliaires et floraux de Paronchiya argentia………23
Figure 13 : Evolution de la cristallisation oxalocalcique en absence d’extrait de la plante………...24
Figure 14: Courbe de cristallisation oxalocalcique en présence d’extrait des feuilles 0.1mg/ml………...25
Figure 15: Courbe de cristallisation oxalocalcique en présence d’extrait des feuilles 0.2mg/ml...……….25
Figure 16: Courbe de cristallisation oxalocalcique en présence d’extrait des feuilles 0.5mg/ml……...………26
Figure 17: Courbe de cristallisation oxalocalcique en présence d’extrait des feuilles 1mg/ml………..26
Figure 18: Courbe de cristallisation oxalocalcique en présence d’extrait des feuilles 2mg/ml………..27
Figure 19: Courbe de cristallisation oxalocalcique en présence d’extrait des feuilles 5mg/ml………..………27
Figure 20: Courbe de cristallisation oxalocalcique en présence d’extrait des fleurs 0.1mg/ml………...…28
Liste des figures
Figure 21: Courbe de cristallisation oxalocalcique en présence d’extrait des fleurs
0.2mg/ml……….……..29
Figure 22: Courbe de cristallisation oxalocalcique en présence d’extrait des fleurs
0.5mg/ml……….…..29
Figure 23: Courbe de cristallisation oxalocalcique en présence d’extrait des fleurs
1mg/ml………..………30
Figure 24: Courbe de cristallisation oxalocalcique en présence d’extrait des fleurs
2mg/ml………..………..…..30
Figure 25: Courbe de cristallisation oxalocalcique en présence d’extrait des fleurs
5mg/ml………..………31
Figure 26 : Courbe de cristallisation oxalocalcique en présence d’acide citrique……...…....32 Figure 27 : photo des cristaux oxalocalcique d’une solution sans inhibiteur prise avec
microscope optique (G× 40)………..………..34
Figure 28: Photos d’inhibition de cristallisation oxalocalcique par des concentrations
différentes d’extrait des feuilles………..………...………..35
Figure 29 : Photos d’inhibition de cristallisation oxalocalcique par des concentrations
Liste des tableaux
Liste des tableaux
Tableau I : Les différents types de calculs urinaires………...…………...………..…………8 Tableau II : Principaux promoteurs et inhibiteurs de la lithogenèse…….…..………..9 Tableau III : Poids d’extraits secs et rendements d’extractions à partir des feuilles et DES
fleurs de Paronychia argantea………..……...20
Tableau IV : Paramètre turbidimetrique de la cristallisation oxalocalcique en absence
d’extrait……….24
Tableau V: Paramètre turbidimetrique de la cristallisation oxalocalcique en présence d’extrait
des feuilles……….28
Tableau VI : Paramètre turbidimetrique de la cristallisation oxalocalcique en présence
d’extrait des fleurs……….31
Tableau VII : Paramètre turbidimetrique de la cristallisation oxalocalcique en présence
Introduction
Introduction
La lithiase oxalocalcique est la forme la plus courante des calculs urinaires (Hesse et al., 2003 ; Daudon et al., 2004) présente dans plus de 80% des calculs sous forme d'oxalate de calcium monohydraté (whewellite) et/ou dihydratée (weddellite). L'oxalate de calcium est le constituant principal d'environ 50% des calculs chez les femmes et 75% chez les hommes
(Charafi et al., 2012). La formation des calculs urinaires est due au déséquilibre entre les
promoteurs de la cristallisation comme l’oxalate de calcium et les inhibiteurs tels que le citrate, le magnésium ou les macromolécules urinaires.
Diverses approches thérapeutiques ont été explorées dans le traitement des calculs urinaire: les médicaments conventionnels, la chirurgie et la lithotripsie. Ces méthodes sont coûteuses et ne sont pas à la portée de la population. En plus de ces procédures qui s'avèrent inefficaces, le taux de récidive augmente, cependant les méthodes de prévention sont donc le moyen le plus efficace de traiter cette maladie et sa récurrence (Charafi et al., 2012). En effet, les médicaments à base des plantes constituent un patrimoine précieux pour l’humanité et en particulier pour la plupart des pays pauvres qui dépendent d’eux pour assurer leurs soins de santé.
L’Algérie, par sa position biogéographique, offre une grande variété de flore, mais une forte tradition ethno-médicinale est toujours en vigueur.
Paronychia argentea est traditionnellement prescrite par les herboristes pour traiter les
calculs urinaires, c’est une plante originaire du bas Maroc, de l’Égypte et du bassin méditerranéen. La plante était utilisée en Egypte ancienne pour traiter l'asthme, les calculs rénaux et la colique rénale. Elle appartient à la famille de Caryophyllaceae et elle est communément appelé thé arabe. L’utilisation médicinales de ses parties aériennes sont utilisées dans la médecine populaire algérienne pour le traitement des maladies rénales (Afifi, et al., 2005 ; Beloued, 1998 ; Zama et al., 2007) et le diabète (Al-Bakri., 2007). Cette plante est également utilisée pour traiter les ulcères d'estomac, l'anorexie, la vessie et la maladie de prostate (Ferreira et al., 2006 ; Bouanani et al., 2010), ainsi que des calculs rénaux
(Bouanani et al., 2010) et des douleurs cardiaques (Dafni., 1984 ; Braca., 2008).
Le but de cette étude est de tester in vitro l’effet inhibiteur des extraits éthanoliques des fleurs et des feuilles de Paronychia argentea, sur la cristallisation oxalocalcique par le model turbidimétrique et par microscope optique.
Introduction
Notre travail s’insère dans le cadre du programme destiné à la valorisation de la flore algérienne, par la recherche de nouveaux composés ou principes actifs à débouchés thérapeutiques. La sélection des espèces est basée essentiellement sur l’endémisme et l’utilisation éventuelle en médecine traditionnelle en vue d’une investigation phyto-chimique et biologique.
Ainsi, le présent mémoire s'articulera en trois grandes parties :
Dans la première partie, nous avons commencé par une étude bibliographique qui est consacré à la description botanique de la plante et aux propriétés biologiques de
Paronychia argentea et quelque généralité sur les lithiases rénales.
La deuxième partie traitera la description du matériel et des méthodes utilisés, d’où nous nous sommes fixés plusieurs objectifs, à savoir :
• L’étude phyto-chimique basée principalement sur la préparation d’extrait éthanoliques.
• La quantification des composés phénoliques et les flavonoïdes à partir des feuilles et des fleurs de Paronychia argentea.
• L’évaluation de l'activité antilithiasique des extraits des fleurs et des feuilles de
Paronychia argentea par la méthode turbidimétrique et microscope optique.
Enfin, dans la troisième partie, nous avons rapporté les résultats obtenus entre autre les rendements, les teneurs des composés phénoliques et l’étude de l’activité antilithiasique des extrais des fleurs et des feuilles de Paronychia argentea.
Chapitre I : Synthèse
bibliographique
Chapitre I Synthèse bibliographique
Chapitre I : Synthèse bibliographique
I.1. Lithiase rénale
I.1.1. Définition
La lithiase rénale est une maladie métabolique multifactorielle non infectieuse dont le nom du grec « lithos » qui signifie pierre (Slimani., 2008). Le calcul est une agglomération de cristaux liés par une matrice organique (Daudon et al., 2008). Ces cristaux seront dans la majorité des cas spontanément éliminés sans qu’aucun symptôme ne les relève.
La lithiase rénale est une pathologie fréquente qui touche selon les pays de 4 à 20 % de la population générale (Doré., 2004), avec un taux de récidive qui avoisine les 50% sur cinq ans (Khouchlaa et al., 2018). Elle touche deux fois plus l’homme que la femme (Oussama et al ., 2000).
I.1.2. La lithogénèse
La lithogenèse regroupe l’ensemble des processus qui conduisent à la formation d’un calcul dans les voies urinaires (Daudon et al., 2012 ; Khan et al., 1993).
I.1.2.1. Les étapes de la lithogénèse
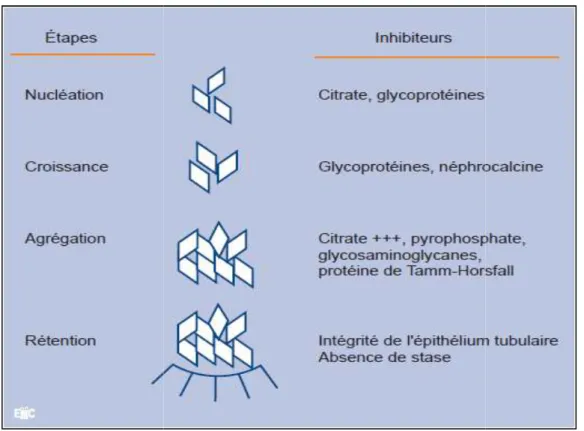
Le processus de la lithogenèse peut être décomposé en sept étapes qui se succèdent ou s’entremêlent au cours de la formation d’un calcul (Figure 01). Ces étapes sont les suivantes :
a) La sursaturation des urines
La sursaturation des urines c’est le mécanisme fondamental de l’apparition des germes cristallins. C’est la première étape du processus lithogène (Daudon et al., 2000 ; Daudon et al., 2012).
La sursaturation se définit comme étant la concentration maximale (produit de solubilité Kps) d’un ou de plusieurs solutés au-delà de laquelle toute fraction supplémentaire de la substance considérée reste insoluble dans l’urine (Daudon., 2004 ; Herbert., 1978 ;
Boistelle., 1992).
b) La Nucléation cristalline
Lorsque le niveau de sursaturation est suffisant, les molécules dissoutes non dissociées qui se sont formées à partir des ions en solution se rassemblent pour constituer des germes cristallins (Daudon et al., 2012). La nucléation est la formation d'une phase cristalline solide dans une solution. C'est une étape essentielle dans la formation des calcules rénales.
Chapitre I Synthèse bibliographique
c) La croissance des cristaux
Cette étape assure la transformation des germes cristallins initiaux mesurant quelques centaines d’angströms en cristaux de plusieurs microns. Les cristaux possèdent au niveau de la couche externe des électrons libres qui peuvent attirer des cations présents dans l’urine. Il en résulte des sites de croissance à la surface de chaque face du cristal ou s’effectue l’incorporation de nouvelles entités. Cette croissance peut être stoppée par le blocage par des substances présentes dans le milieu (inhibiteur) (Basavaraj et al., 2007).
d) L’agrégation des cristaux
Contrairement à la croissance, l’agrégation cristalline, qui met en jeu des phénomènes d’attraction électrostatique en fonction de la charge superficielle des cristaux, est un processus rapide. Elle peut, de ce fait, engendrer des particules volumineuses dans un délai très court, inferieur au temps de transit de l’urine à travers le rein.
A cause de leur taille, mais aussi de leur forme très irrégulière et de la présence de nombreuses aspérités (cristaux anguleux), les agrégats ainsi formés sont susceptibles d’être retenus dans les segments terminaux des néphrons, sur l’épithélium papillaire ou dans les cavités excrétrices du rein. L’agrégation cristalline est considérée aujourd’hui comme une étape importante de la lithogenèse et plusieurs travaux ont montré que les urines des sujets lithiasiques avaient une moindre aptitude à réduire l’agrégation des cristaux que les urines des sujets normaux (Kok et al., 1990 ; Basavaraj et al ., 2007).
Parfois, l’accumulation des cristaux plus petits en amont d’un agrégat retenu dans le tube collecteur en raison de sa grande taille peut entrainer une obstruction qui peut, lui aussi, être le point de départ d’un processus lithiasique
(Laube et al., 2004).
e) L’agglomération cristalline
Elle implique des macromolécules urinaires qui, par leurs nombreuses charges
négatives, peuvent se fixer à la surface des cristaux et favoriser secondairement la fixation de nouveaux cristaux sur les premiers en les organisant les uns par rapport aux autres contribuant ainsi à l’architecture du calcul (Daudon et al., 2012).
Les macromolécules impliquées dans ce processus sont essentiellement des protéines comme Tam-Horsfall (THF), l’Albumine et l’Uropontine.
Chapitre I
f) La rétention des particules crista
Les particules cristallines formées au cours des vont être retenues dans le rein ou les voies
formation des cristaux est principalement dépend de la
composition de la surface des cellules épithéliales tubulaires rénales
g) La croissance du calcul
Le calcul peut grossir dans l’appareil urinaire initié par la rétention cristalline et ensuite très variable différents facteurs, souvent associés au
- Augmentation de la concentration des substances lithogènes. - Diminution du pouvoir solvant des urines.
- pH : l’acidité favorise la sursaturation en acide urique et en cyst phosphates.
- Existence d’un obstacle, anatomique ou fonctionnel sur les voies urinaires
1997).
Figure 01 : Étapes de la formation des cristaux oxalocalciques
inhibiteurs de cristallisation
I Synthèse bibliographique
a rétention des particules cristallines
particules cristallines formées au cours des différentes phases de la cristallogenèse vont être retenues dans le rein ou les voies urinaires et vont croitre pour former un calcul
principalement dépend de la composition du fluide tubulaire, composition de la surface des cellules épithéliales tubulaires rénales (Basavaraj
calcul
ossir dans l’appareil urinaire. La vitesse de cette croissance du calcul initié par la rétention cristalline et ensuite très variable (Alsheyab et al., 2007)
différents facteurs, souvent associés au :
Augmentation de la concentration des substances lithogènes. Diminution du pouvoir solvant des urines.
ise la sursaturation en acide urique et en cystine, l’alcalinité
, anatomique ou fonctionnel sur les voies urinaires
: Étapes de la formation des cristaux oxalocalciques et niveau d’action des principaux inhibiteurs de cristallisation (Jungers., 2006).
Synthèse bibliographique
différentes phases de la cristallogenèse urinaires et vont croitre pour former un calcul. La composition du fluide tubulaire, de la
(Basavaraj et al., 2007).
. La vitesse de cette croissance du calcul
2007), dépendant des
, l’alcalinité celle des
, anatomique ou fonctionnel sur les voies urinaires (Low et al.,
Chapitre I Synthèse bibliographique
I.1.3. Les différents types de calculs
Les calculs présentent une composition hétérogène dans 90 à 95% des cas. Ainsi, et pour des raisons de simplification, plusieurs publications limitent l’expression de la composition cristalline à l’espèce majoritaire (Daudon et al., 2005). L’observation de 45 320 calculs a montré que la plupart des espèces cristallines pouvaient être reconnues par leurs caractéristiques structurales complétée par une technique de caractérisation par spectroscopie infrarouge à transformée de Fourier (Daudon et al., 2012). De ces observations, ils ont pu déterminer plusieurs types de calculs (Tableau I).
I.1.3.1. Calculs d’oxalate de calcium
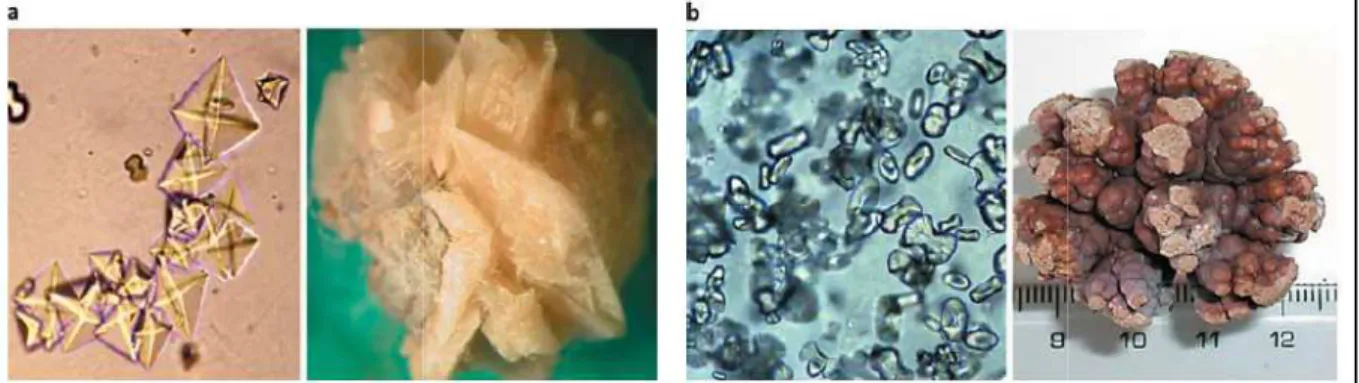
Ce sont les calculs rénaux les plus courants (représente 80% des calculs) (Ramet et al., 2016). Ils sont constitués de calcium, associé à de l'oxalate (Figure 02).
Figure 02 : Oxalate de calcium (Khouchlaa., 2017).
La lithiase oxalocalcique se présente sous deux principales formes cristallines (figure 3) à savoir :
a) Oxalate de calcium dihydraté (COD) : Connue sous le nom minéralogique de
weddellite (C2) de formule chimique Ca(COO)2 2H2O (Prien et al., 1968).
b) Oxalate de calcium monohydrate (COM) : Connu sous le nom minéralogique de
whewellite (C1) de formule chimique Ca(COO)2H2O (Prien et al., 1968). C’est la
forme cristalline la plus couramment observé (77,98%). Elle a pour principale étiologie une hyperoxalurie (Prien et al., 1968).
Chapitre I
Figure 03: Différent types d’oxalate de calcium
de calcium monohydrate (COM)
I.1.3.2. Calculs d'acide urique
L'acide urique est un déchet engendré par des fonctions corporelles normales. Cependant, une quantité excessive d'acide urique peut causer la formation des calculs d'acide urique (Saita et al., 2007). Les calculs d'acide urique n'affectent que 8% de la
sont de couleur jaune, la surface est lisse.
sont la coexistence d’un pH régulièrement inférieur à 5,5 et de la le fait qu'il réagisse au traitement chimiolithique (Saita
I.1.3.3. Calculs de Struvite
N’affectent que 4 a 6 % de la population, ces calculs se forme suite à une infection urinaire. Une infection urinaire peut
et al., 2007).
Figure 04
I Synthèse bibliographique
Différent types d’oxalate de calcium : (a) Oxalate de calcium dihydraté de calcium monohydrate (COM) (Saita et al., 2007).
Calculs d'acide urique
'acide urique est un déchet engendré par des fonctions corporelles normales. Cependant, une quantité excessive d'acide urique peut causer la formation des calculs d'acide
Les calculs d'acide urique n'affectent que 8% de la
sont de couleur jaune, la surface est lisse. Les principales caractéristiques de ce type de calcul sont la coexistence d’un pH régulièrement inférieur à 5,5 et de la le fait qu'il réagisse au
(Saita et al., 2007). truvite
N’affectent que 4 a 6 % de la population, ces calculs se forme suite à une infection urinaire. Une infection urinaire peut affecter l'équilibre chimique de l'urine
Figure 04 : Calculs de Struvite (Saita et al., 2007).
Synthèse bibliographique
(a) Oxalate de calcium dihydraté (COD). (b) Oxalate
'acide urique est un déchet engendré par des fonctions corporelles normales. Cependant, une quantité excessive d'acide urique peut causer la formation des calculs d'acide Les calculs d'acide urique n'affectent que 8% de la population; ils Les principales caractéristiques de ce type de calcul sont la coexistence d’un pH régulièrement inférieur à 5,5 et de la le fait qu'il réagisse au
N’affectent que 4 a 6 % de la population, ces calculs se forme suite à une infection affecter l'équilibre chimique de l'urine (Figure 04) (Saita
Chapitre I
I.1.3.4. Calculs de Cystine
Est assez rare et ne se produit que dans 2% des cas. Elle est causée par un autosomal récessif liée à un défaut de transport des acides aminés
05). Il s'agit d'une maladie rare qui nécessite des soins et des traitements à vie 2007).
Figure 05
Tableau I: Les différents types de Composant
Calcium oxalate monohydrate Calcium oxalate dehydrate Magnesium ammonium
phosphate Carbonate-apatite
Hydroxyl-apatite
Calcium hydrogen phosphate dehydrate
Uric acid Cystine
Sodium acid urate Ammonium acid urate Tricalcium phosphate Xanthine
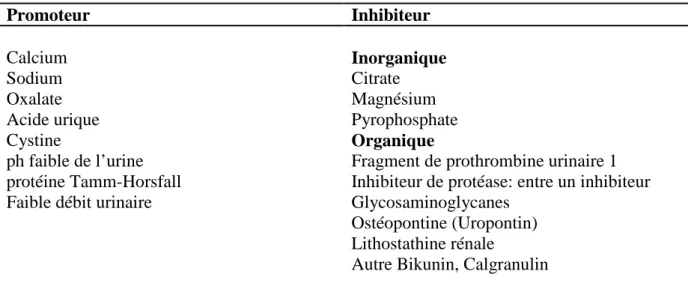
I.1.4. Inhibiteurs et Promoteurs
Les ions qui participent à la formation des espèces insolubles sont appelés de la cristallisation. Au nombre d’une dizaine, ils s’associent très
trois pour former une substance cristallisable qui espèces cristallines (Tableau II)
I Synthèse bibliographique
ystine
st assez rare et ne se produit que dans 2% des cas. Elle est causée par un liée à un défaut de transport des acides aminés comme la cystine . Il s'agit d'une maladie rare qui nécessite des soins et des traitements à vie
Figure 05 : Calculs de Cystine (Saita et al., 2007).
Les différents types de calculs urinaires (Prien & Prien Jr.
Formule Nom minéralogique Calcium oxalate monohydrate
Calcium hydrogen phosphate
CaC204.H2O
CaC204.2H2O
MgNH4PO4. 6H20
Ca10(POn4,CO2OH)6(OH2)
Ca10(PO4)6(OH)2 CaHP04.2H2O C6H4N4O2 [-SCH2H(NH2)COOH]2 NaH C6H203N4. H20 NH4H. C6H203N4. H20 Ca3(P04)2 GH4N4Oz Whewellite Weddellite Struvite Carbonate Hydroxyl Brushite Whiteclockite I.1.4. Inhibiteurs et Promoteurs
Les ions qui participent à la formation des espèces insolubles sont appelés
Au nombre d’une dizaine, ils s’associent très souvent par deux ou par ne substance cristallisable qui elle même peut se présenter sous
(Tableau II) (Basavaraj et al., 2007).
Synthèse bibliographique
st assez rare et ne se produit que dans 2% des cas. Elle est causée par une anomalie comme la cystine (Figure . Il s'agit d'une maladie rare qui nécessite des soins et des traitements à vie (Saita et al.,
Prien & Prien Jr., 1968). Nom minéralogique Whewellite Weddellite Carbonate –apatite Hydroxyl-apatite Brushite Whiteclockite
Les ions qui participent à la formation des espèces insolubles sont appelés promoteurs souvent par deux ou par peut se présenter sous plusieurs
Chapitre I Synthèse bibliographique
Pour s’opposer aux effets des promoteurs différentes substances de l’urine également ionisées sont capables de former des espèces chimiques solubles qui vont réduire le risque de cristallisation ou vont se fixer à la surface des germes cristallins pour les empêcher de grossir ou de s’agréger et sont appelés inhibiteurs de la cristallisation (Tableau II) (Basavaraj et al.,
2007).
Tableau II : Principaux promoteurs et inhibiteurs de la lithogenèse (Basavaraj et al.,2007)
Promoteur Inhibiteur Calcium Sodium Oxalate Acide urique Cystine ph faible de l’urine protéine Tamm-Horsfall Faible débit urinaire
Inorganique
Citrate Magnésium Pyrophosphate
Organique
Fragment de prothrombine urinaire 1 Inhibiteur de protéase: entre un inhibiteur Glycosaminoglycanes
Ostéopontine (Uropontin) Lithostathine rénale
Autre Bikunin, Calgranulin
I.1.5. Facteurs de la lithogenèse
La formation et la croissance des calculs sont favorisées par plusieurs facteurs, qui peuvent être éventuellement associés :
Une augmentation de la concentration des sels lithogènes dans les urines. Celle-ci peut être due à une augmentation de leur excrétion urinaire (hypercalciurie, hyperoxalurie, hyper-uricurie), ou à une diurèse trop faible par suite d’apports hydriques insuffisants (Kourilsky.,
2014).
Des modifications physicochimiques de l’urine aboutissant à une diminution du pouvoir solvant de l’urine. Un pH acide favorise la sursaturation en acide urique ou en cystine, un pH alcalin favorise la sursaturation en phosphates. L’infection urinaire notamment à germes uréasiques peut entraîner une croissance très rapide des calculs. L’activité des inhibiteurs de la cristallisation pourrait être diminuée chez les lithiasiques par rapport aux sujets normaux, et favoriser la formation des calculs pour un même degré de sursaturation des urines. Ces inhibiteurs sont nombreux mais ne sont pas tous identifiés (citrate, pyrophosphates, magnésium, polyanions, certaines glycoprotéines telles que la néphrocalcine)
Chapitre I Synthèse bibliographique
Les apports élevés en protéines animales diminuent l’acide citrique urinaire, puissant agent antilithiasique et augmentent la calciurie et l’uricurie qui précipitent facilement en cristaux à pH acide (Docti., 2013).
Les apports élevés en graisses, les aliments riches en oxalate (rhubarbe, chocolat noire …) favorisent l’oxalurie (Docti., 2013).
Il faut éviter la vitamine C en complément alimentaire car l'acide ascorbique se convertit en oxalate. Pour un patient lithiasique les apports en vitamine C ne devraient pas dépasser 500 mg par jour que l'on trouve aisément dans l'alimentation. De même, il faut éviter le thé et le chocolat qui sont riches en oxalate (Mignon et Fichet., 2015).
• Une anomalie des voies excrétrices responsable de stase et d’infection.
• Des facteurs génétiques (cystinurie congénitale) ou liés à l’environnement (pays
chauds) peuvent intervenir. La lithiase atteint plus fréquemment l’homme que la femme
(Kourilsky., 2014).
I.2. Les plantes médicinales
Les plantes étaient autrefois la principale source des médicaments dans le monde. Elles continuent de fournir aux humains de nouveaux remèdes. Dans le monde 50% des médicaments en usage clinique sont dérivés des produits naturels.
Les plantes médicinales jouent un rôle essentiel dans les soins de santé de base dans nombreux pays en développement, y compris l'Afrique du Sud et du nord. Dans les pays en développement environ 80% de la population utilise des médicaments en raison de son prix abordable et de son acceptabilité culturelle (van Wyk et Prinsloo., 2012).
I.2.1. Paronychia argentea I.2.1.1. Description botanique
Paronychia argentea, appartenant à la famille des Caryophyllaceae, est une plante
vivace largement distribuée en Algérie, elle est généralement connue par le nom (thé arabe, fetate lahjar) (Sait et al ., 2015). Est une plante vivace, sa longueur est de 30–50 cm, les feuille de 2 mm jusqu'à 5mm de large, ne sont pas poilus, elles sont lancéolées linéaires et parfois ovales avec des pointes aiguës.
Les lobes du calice sont de forme oblongue avec des marges membraneuses à capuchon et se terminant par une arête aiguës à la pointe. Les fleurs sont blanches-argentées et denses, mélangées avec les feuilles, en têtes latérales et terminales (Figure 06) (afifi et al .,
Chapitre I Synthèse bibliographique
Figure 06: photographies originales de Paronychia argentea (Originale).
I.2.1.2. Taxonomie et systématique (Benoît Bock et al., 2018) Embranchement : Spermatophytes
Sous embranchement : Angiospermes Classe : Dicotylédones
Ordre : Caryophyllales Famille : Caryophyllaceae Genre : Paronychia
Espèce : Paronychia argentea Noms vernaculaires
Nom français : Paronyque argenté, Thé Algérien, Thé arabe, Herbe-aupanaris. Nom anglais: Silvery, Whittle-Wart, Mountain-knot-grass, Algerian Tea. Nom arabe : Fersch n’dah, B’sat el moulouk, Thai el arab, ftate lahjare.
I.2.1.3. Composition chimique
L’analyse phytochimique de la partie aérienne de Paronychia argentea a révélé la présence de plusieurs composés, ces composés ont non seulement un grand rôle fonctionnel dans les plantes, mais également un rôle très important en pharmacologie (Luthar., 1992)
Chapitre I Synthèse bibliographique
Parmi ces composés, Les polyphénols qui sont divisés en plusieurs catégories et les plus connus sont les acides phénoliques, les flavonoïdes, les tanins et les saponines (Abou
El-khair et al., 2010).
Des composants chimiques des flavonoïdes identifiés, appartenant aux flavones et aux flavonols sur une base des données UV / DAD, MS et MSn .Onze composés phénoliques ont été détectés dans cette étude sur des extraits de P. argentea et certaines d’entre elles ont déjà été décrites dans la littérature, telle que la quercétine -3-O- (glucosyl) galactoside, quercétine-3-O - [(2 - acétyle) glucosyl] galactoside, quercétine-quercétine-3-O-galactoside, isorhamnetin-quercétine-3-O- isorhamnetin-3-O-glucoside et jaceosidin-7-O-isorhamnetin-3-O-glucoside (Sait et al., 2015).
I.2.1.4. Répartition géographique
Cette plante est distribuée dans l’Amérique, l'Europe, l'Asie et le Nord de l'Afrique
(Ocana et al., 1997). Paronychia Argentea est largement distribuée à l’est de l’Algérie (Zama et al ., 2007), elle est rencontrée dans les pâturages, les lieux arides, les plaines et les
montagnes (Beloued., 2001). Elle marque une préférence pour les sols sablo-argileux mais elle peut également se rencontrer dans les sables calcaires mobiles ou consolides de la dune littorale (Alcaraz., 1991).
I.2.1.5. Propriétés thérapeutiques
P. argentea est utilisée en médecine traditionnelle pour traiter ou prévenir plusieurs
maladies, ses parties aériennes sont utilisées dans la médecine populaire algérienne pour le traitement des maladies rénales et le diabète (Gonçalves et al., 2013 ;Nawash et al., 2013;
Sait et al., 2015). Autre traitement comme les infections respiratoires, les douleurs
abdominales et l’infection des voies urinaires (Abu irmaileh et al., 2003 ; Bouanani et al.,2010).
En Jordanie ainsi qu’en Palestine, elle est utilisée pour traiter le diabète, les maladies cardiaques et les calculs rénaux (Hamdan., 2004 ;Afifi et al., 2005 ;Carmona et al., 2005). Au Portugal, Paronychia argentea est utilisée comme un analgésique, en ulcère de l'estomac, l'anorexie et la flatulence (Ferreira et al., 2006). Les espagnoles l’utilisent pour traiter les troubles digestifs, l’eczéma et comme agent fébrifuge (De Santaya et al., 2005).
Chapitre II : Matériels et
méthodes
Chapitre II Matériels et méthodes
Chapitre II : Matériels et méthodes
II.1. Matériels
II.1.1. Matériels végétales
Les organes (feuilles, fleurs) du Paronychia argentea ont été fraichement récoltés au mois de mars 2019 dans la région Tikdjda (Bouira)
.
II.1.2. Réactifs et produits chimiques
Les réactifs et les produits chimique utilisés sont : Bicarbonate de sodium (NaCO3) de
Sigma, le trichlorure d’aluminium (AlCl3) ont été fournis par (Sigma), le Folin-Ciocalteu
(FCR) par Biochem, l’éthanol a été fournis par (Emsure) ; Chlorure de calcium (CaCl2) Biochem ; Oxalate de sodium (Na2C2O4) (sigma); Tris (sigma); chlorure de sodium
(NaCl) (scharlau).
II.2. Méthodes
II.2.1. Préparation de la poudre végétale
Les parties étudiées (feuilles et fleurs) ont été lavées plusieurs fois à l’eau distillée pour les débarrasser de la poussière, ensuite séchées à l’air libre pendant 7 jours. Après séchage, les fleures et les feuilles ont été broyés séparément en poudre à l’aide d’un broyeur électrique. La poudre ainsi obtenue a été tamisée à l’aide d’un tamiseur. Une poudre très fine de diamètre inférieur à 250 μm a été récupérée à la fin du tamisage, et conservée dans des flacons en verre, à l’abri de la lumière et de l’humidité.
II.2.2. Identification botanique
Le matériel végétal a été identifié dans la salle herbier du département botanique, École nationale supérieure agronomique d'Alger (ENSA).
II.2.3. Préparation de l’extrait éthanolique
II.2.3.1. Extraction par (Sonication/ Maceration) Protocole expérimentale
Le protocole a été décrit par Ellington et al., (2003) en y apportant quelques modifications. Une masse de 6g de poudre de la plante (feuilles, fleurs) séchée a été dissous dans 300 ml d’éthanol (70%). La solution obtenue a ensuite subi une sonication pendant 30 minutes suivies d’une macération pendant 24 heures, le mélange hétérogène est été filtré sur papier Whatman N° 1. Le filtrat obtenu a été soumis à une évaporation sous vide à 60°C pour
Chapitre II
éliminer l’éthanol puis à une lyophilisation pour d’extraction a été calculé suivant la formule
R (%) =
Avec :
R (%) : Rendement en %. M0 : Masse du bécher vide (g).
M1 : Masse du bécher après évaporation
M : Masse de matière sèche (g)
II.2.4. Evaluation des taux des composés phénoliques II.2.4.1. Dosage des polyphénols
Le réactif de Folin-Ciocalteu est constitué par un mélange d’acide phosphotungstique (H3PW12O40) et d’acide phosphomolybdique
des phénols en un mélange d’oxyde bleu tungungstène et de molybdène
1968). La coloration produite
quantité des polyphénols présents dans les extraits obtenus
Charpentier., 2006).
Figure 07
Mode opératoire
La teneur en composés phénoliques est déterminée selon la méthode décrite par
Georgé et al., (2005). Un volume de 500
de réactif de Folin ciocalteu dilué à 1/10. ambiante, et 2 mL de carbonate de sodium (7
pendant 15 min à 50 °C dans un bain mari. L’absorbance est lue à 765
Chapitre II Matériels et méthodes
puis à une lyophilisation pour obtenir une poudre. d’extraction a été calculé suivant la formule (1) :
R (%) = (M1-M0 /M) x 100 (1)
: Masse du bécher vide (g).
: Masse du bécher après évaporation (g). (g).
. Evaluation des taux des composés phénoliques polyphénols totaux
Ciocalteu est constitué par un mélange d’acide phosphotungstique ) et d’acide phosphomolybdique (H3PMo12O40). Il est réduit
en un mélange d’oxyde bleu tungungstène et de molybdène (Ribéreau
. La coloration produite dont l’absorption maximum à 765 nm est proportionnelle à la présents dans les extraits obtenus (figure 07)
07 : Réaction du Folin-Ciocalteu avec les polyphenols.
La teneur en composés phénoliques est déterminée selon la méthode décrite par Un volume de 500 μl de l’extrait éthanolique est mélangé avec 2,5 ml de réactif de Folin ciocalteu dilué à 1/10. Le mélange est incubé pendant 2
mL de carbonate de sodium (75 g/l) a été ajouté. Le mélange
dans un bain mari. L’absorbance est lue à 765 nm contre un blanc à
Matériels et méthodes
une poudre. Le rendement
Ciocalteu est constitué par un mélange d’acide phosphotungstique lors de l’oxydation
(Ribéreau-Gayon.,
est proportionnelle à la
(figure 07) (Boizot et
avec les polyphenols.
La teneur en composés phénoliques est déterminée selon la méthode décrite par éthanolique est mélangé avec 2,5 ml
pendant 2 min à température Le mélange a été incubé nm contre un blanc à
Chapitre II Matériels et méthodes
l’aide d’un spectrophotomètre (SpectroScan UV Visible). La concentration en composés phénoliques totaux est exprimée en mg équivalent de l’acide gallique par g (mg EAG/g) en se référant à la courbe d’étalonnage obtenue avec l’acide gallique [annexe 1].
Les essais sont reproduits trois fois. La teneur en composés phénoliques des échantillons analysés est calculée par la formule (2) :
TCP = C. V / m (2) C: Concentration de l’extrait (mg EAG/g) ;
V: Volume de solvant utilisé pour l’extraction (ml) ; m: Masse en grammes de la prise d’essai (g).
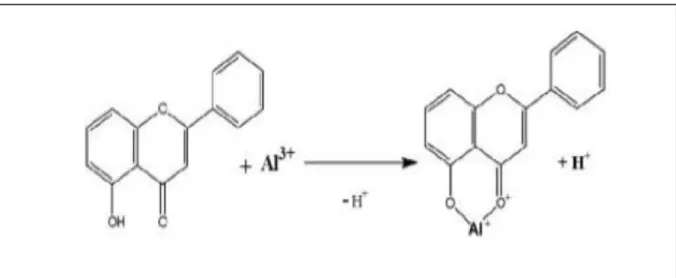
II.2.4.2. Dosage des flavonoïdes Principe
Le dosage des flavonoïdes totaux est basé sur un test colorimétrique utilisant le trichlorure d’aluminium AlCl3 avec lequel ils forment des complexes acides stables soit avec
le carbonyle (C=O) en position C-4, soit avec le groupe hydroxyle en C-3 ou C-5 des flavones et des flavonols. Par ailleurs, AlCl3 peut également former des complexes acides labiles avec
les groupements orthodihydroxyles éventuellement présents sur le noyau A et/ou B des flavonoïdes (figure 08) (Chang et al., 2002).
Figure 08: Réaction du chlorure d’Aluminium avec les flavonoïdes (Ribéreau-Gayon et Gautheret., 1968).
Mode opératoire
La quantification des flavonoïdes a été effectuée par la méthode de Djeridane et al
.,(2006) avec le trichlorure d’aluminium (AlCl3). Un volume de 1 ml d’extrait est mélangé avec 1 ml de la solution de trichlorure d’aluminium (AlCl3) à 2 %. Après 10 minutes
Chapitre II Matériels et méthodes
d’incubation à la température ambiante, l’absorbance est mesurée à 430 nm. La teneur en flavonoïdes est exprimée en mg équivalent de quercétine par g de matière sèche, en se référant à la courbe d’étalonnage de la quercétine [annexe 2].
L’expérience a été faite en triple, les résultats ont été présentés par la moyenne avec son écart type. La teneur en flavonoïdes des échantillons analysés est calculée par la formule (2) :
TF = C. V / m (2) C: Concentration de l’extrait (mg EQ/ g)
V: Volume de solvant utilisé pour l’extraction (ml); m: Masse en grammes de la prise d’essai (g). II.2.5. Evaluation de l’activité antilithiasique
II.2.5.1. Model expérimental d’étude de la cinétique de cristallisation de l’oxalate de calcium
Le modèle d’étude de l’inhibition de la cristallisation oxalocalcique que nous avons adopté est basé sur le principe de la turbidimétrie en se référant sur la croissance cristalline (Addou., 2001). La turbidimétrie est une méthode voisine de l’absorptiométrie classique (Kavanagh., 2000). Elle s’applique aux solutions contenant des précipités sous forme de suspension stable. Elle présente plus d’avantages puisqu’elle assure un suivie cinétique de la cristallisation d’une façon continue en plus de la simplicité à mettre en œuvre et la bonne productivité (Djaoud-Harrachi., 2004).
Cette méthode optique qui mesure le trouble existant dans une solution, s’agit exactement de la mesure d’intensité lumineuse reçue par une cellule photo-électrique après le passage d’un rayon lumineux monochromatique à travers une cuve contenant le milieu à étudié (Boistelle.,
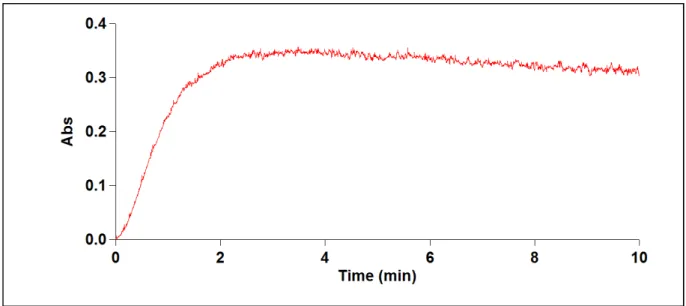
1985 ; Weaver et al., 2007). L’allure générale des courbes turbidimétrique obtenues
(absorbance en fonction du temps) de profil triphasique (nucléation, croissance et agrégation) (figure 09) est caractérisée par les paramètres turbidimétriques suivants :
• Un temps de latence correspondant à la phase de nucléation ou l’absorbance est pratiquement nul qui est caractérisée par un temps d’induction (ti).
• La pente turbidimétrique (P) correspondant à une forte croissance ou décroissance de l’absorbance apparente (phase de croissance cristalline). Elle est déterminée sur la partie linéaire de la courbe.
• Une lente décroissance de l’absorbance après un passage par un maximum traduisant l’étape d’agrégation (figure 09).
Chapitre II
Figure 09 : Allure générale de la courbe turbidimétrique
La cristallisation oxalocalcique a été étudiée dans un model turbidimétrique à l’aide d’un spectrophotomètre UV/VIS Agilent technologies cary 60 uv
peltier qui assure une température
Figure 10 : Model expérimental d’étude de la cristallisation oxalocalcique (originale).
Chapitre II Matériels et méthodes
: Allure générale de la courbe turbidimétrique de la cristallisation oxalocalcique al., 2001).
La cristallisation oxalocalcique a été étudiée dans un model turbidimétrique à l’aide d’un spectrophotomètre UV/VIS Agilent technologies cary 60 uv
température de 37°C et une agitation constante (figure
Model expérimental d’étude de la cristallisation oxalocalcique (originale).
Matériels et méthodes
de la cristallisation oxalocalcique (Addou et
La cristallisation oxalocalcique a été étudiée dans un model turbidimétrique à l’aide d’un spectrophotomètre UV/VIS Agilent technologies cary 60 uv-vis couplé a un
(figure 10).
Chapitre II Matériels et méthodes
II.2.5.2. Cinétique de la cristallisation d’oxalate de calcium en absence des extraits de la plante
Nous avons choisi une méthode proposée par Sasikala et al.,(2013), avec quelques
modifications. Pour cela :
Une solution de chlorure de calcium et d’oxalate de sodium ont été préparés aux concentrations finales de 5 mmol / L et 7,5 mmol / L respectivement dans un tampon contenant du Tris 0,05 mol / L et du NaCl 0,15 mol / L à pH 6.5. 1 mL de solution de chlorure de calcium est mélangé avec 1ml d’eau distillé dans une cuve pour lire le blanc. La cristallisation a été démarrée en ajoutant 1 ml de solution d'oxalate de sodium. La température était maintenue à 37 °C avec une agitation constante. La densité optique de la solution a été mesurée à 620 nm pendant une durée de 10 min. Nous obtenons une courbe de variation de la densité optique en fonction du temps (t), puis nous calculons la pente turbidimétrique de la partie de croissance. Dans tous nos essais et dans les mêmes conditions expérimentales, les mesures ont été répétées trois fois pour calculer la moyenne des pentes turbidimétriques, le temps d’induction et l’écart type.
II.2.5.3. Cinétique de la cristallisation d’oxalate de calcium en présence des extraits de la plante
L’étude a été poursuivie pour connaître l’effet d’extrait de la plante contre la formation des calculs (formation d'oxalate de calcium) in vitro. Dans cette expérimentation l'effet de l'extrait sur l'inhibition était effectué dans des concentrations de l'extrait (5mg/ml, 2mg/ml ,1mg/ml, 0,5mg/ml ,0.2mg/ml, 0,1 mg/ml).
Pour cela 1 mL de solution de chlorure de calcium est mélangé avec 1 mL d’extrait aux différentes concentrations (5mg/ml, 2mg/l ,1mg/ml, 0,5mg/ml ,0.2mg/ml, 0,1 mg/ml). La cristallisation a été démarrée en ajoutant 1 ml de solution d'oxalate de sodium, la température était maintenue à 37 °C. La densité optique de la solution a été mesurée à 620 nm. Le taux de nucléation a été estimé en comparant le temps d’induction en présence de l'extrait avec celui de contrôle.
Le pourcentage d’inhibition (I%) est calculé par la formule (3) :
Chapitre II Matériels et méthodes
• Pai : la pente turbidimétrique en présence d’extrait de plante.
• Psi : la pente turbidimétrique en absence d’extrait de plante.
II.2.5.4. Cinétique de la cristallisation d’oxalate de calcium en présence d’acide citrique (contrôle positif)
1 mL de solution de chlorure de calcium mélangée avec 1 mL d’acide citrique 6 mM. La cristallisation a été démarrée en ajoutant 1 ml de solution d'oxalate de sodium. La température était maintenue à 37 °C. La densité optique de la solution a été mesurée à 620 nm (Addou et al., 2011).
II.2.6. Etude de la cristallisation par microscope optique
Nous avons choisi une méthode proposée par (Bensatal et Ouahrani., 2008) avec quelques modifications. Pour cela :
Les photographies ont été prises avec un microscope optique (G×40) à l’aide d’un appareil photo numérique. Au temps correspond au stade de croissance (t = 2 min) une goutte du mélange d’une solution cristallisable ou une solution inhibitrice est placée dans la cellule de Mallassez, qui est immédiatement placée sous l’objectif du microscope (G ×40).
Chapitre III : Résultats et
discussion
Chapitre III Résultats et discussion
Chapitre III : Résultats et discussion
III.1. Rendement d’extraction
Dans cette étude, le rendement (l’extrait sec, obtenu après évaporation, contenant les composés phénoliques) a été déterminé par rapport à 6 g de la matière végétale (feuilles, fleurs).
Le poids de l’extrait sec a été déterminé par la différence entre le poids du ballon plein (après évaporation) et le poids du ballon vide (avant évaporation).
Les résultats de cette manipulation sont représentés dans le Tableau III.
Tableau III : Poids d’extraits secs et rendement d’extraction à partir des parties florales et foliaires de
Paronychia argantea.
Organe Poids d’extrait sec (g) Rendements (%)
Fleurs 0,83 13,83
Feuilles 0,80 13,41
Il ressort à travers l’observation des rendements d’extraction du Tableau III que les fleurs donnent le meilleur rendement d’extraction soit un pourcentage de 13,83%, alors que les feuilles donnent le rendement (13,41 %).
Les résultats rapportés par Adjadj et al.,(2016) sur Paronychia argentea concernant le rendement d’extraction par une macération méthanolique sont de 10,97%. Ces résultats sont proches à ceux obtenus dans la présente étude.
Wang et al.,(2008) rapportent dans leur étude sur des herbes chinoises que le
rendement d’extraction dépend du processus utilisé, car les constituants des cellules se libèrent par rupture des parois cellulaires vers le solvant organique, un phénomène qui s’intensifié par l’usage d’un solvant polaire (Li et al., 2012). La taille des particules végétales joue un rôle important dans l’extraction des composés phénoliques. Il est généralement admis que sous une forme broyée, la matière végétale présentera une plus grande surface de contact avec le solvant, permettant ainsi d’accélérer sa solubilité (Escribano-Bailon et
Santos-Buelga., 2003 ; Bonnaillie et al., 2012). D’après Bruneton., (1999), la variation des résultats
d’un extrait à l’autre est due principalement aux solvants d’extraction utilisés, dont les solvants polaires montrent un meilleur rendement d’extraction par rapport aux solvants moins polaires. La différence de polarité des solvants utilisés permet l’extraction d’une large gamme de métabolites secondaires (Green., 2004). Ainsi, le pH, la température, le temps d'extraction et la composition phytochimique de l'échantillon (Do et al ., 2013).
Chapitre III Résultats et discussion
III.2. Teneur en polyphénols et flavonoïdes
Parmi tous les constituants chimiques des végétaux, les composés phénoliques, s’ils n’occupent qu’une place quantitative modeste, ont de multiples propriétés qui ont de tout temps, été recherchées par les êtres humains, (Macheix et al., 2005). Les polyphénols et les flavonoïdes des plantes pourraient effectivement inhiber la formation des calculs de CaOx in
vitro et in vivo, en corrélation avec leurs propriétés diurétiques, antioxydantes, propriétés
anti-inflammatoires, antibactériennes et autres effets protecteurs (Zeng et Jiang., 2018). Pour cette raison, ils sont utilisés dans de nombreux domaines incluant, par exemple, la médecine, la nutrition, les teintures et les produits cosmétiques. À ce sujet, la détermination des composés phénoliques des feuilles et fleurs de Paronychia argentea et l’étude de leur capacité antilithiasique ont été abordées afin d’évaluer la capacité de cette plante à synthétiser ces composés et apprécier leur pouvoir antilithiasique.
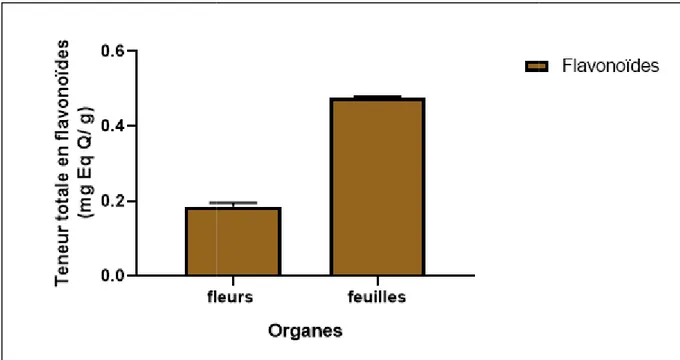
Toutes les valeurs illustrées aux niveaux des figures 11 et 12 sont la moyenne de 3 répétitions pour chaque partie de la plante étudiée.
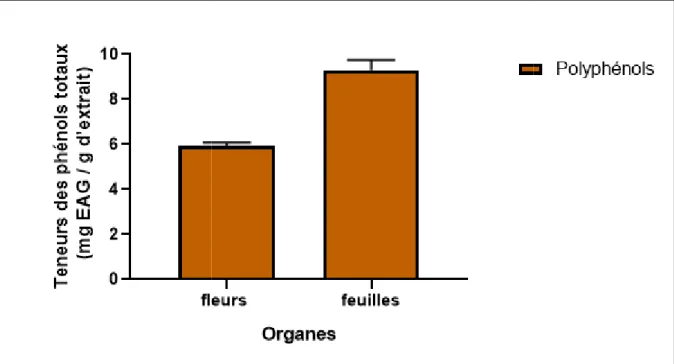
III.2.1.Teneurs en polyphénols
La figure 11 illustre les résultats des teneurs en polyphénols totaux dans les extraits éthanoliques foliaires et floraux de Paronychia argentia. Ces résultats sont exprimés en mg d’équivalent d’acide gallique par gramme de matière sèche (mg EAG/g MS) en utilisant l’équation de la régression linéaire de la courbe d’étalonnage d’acide gallique.
Après exploration de cette figure, on constate que les teneurs en polyphenols totaux au niveau de l’extrait des feuilles de Paronychia argentia se révèlent nettement proche de celles déterminées au niveau de l’extrait des fleurs, sauf que la partie foliaire présente la teneur la plus élevée estimée à 9,29±0.45 mg EAG/g MS, par contre la partie florale présente 5,92±0.14 mg EAG/g MS.
Chapitre III
Figure 11 : Variations des teneurs en polyphénols totaux au niveau des extraits éthanoliques foliaires
Les protocoles d’extractions des composés phénoliques par solvants sont très divers, le rendement de cette extraction dépend fortement de la nature du solvant, et de la méthode d’extraction, mais aussi du matériel végétal et ses composés bioactifs. Le solv
permettre une extraction maximale des polyphénols sans modifier leurs structures al., 2008).
La comparaison de nos résultats avec ceux de la littérature, montre que les teneurs en polyphénols de nos extraits sont plus
(71,39±1,13 mg/g avec des extraits éthanolique de sont supérieurs avec ceux obtenus par
méthanolique de Paronychia argonte
Plusieurs facteurs peuvent influencer la teneur en composés phénoliques. Des études récentes ont montré que les facteurs extrinsèques (tels que les facteurs géographiques et climatiques), les facteurs génétiques, mais également le degré de maturation de la
durée de stockage ont une forte influence sur le contenu en polyphénols
Pedneault et al., 2001; Fiorucci
Chapitre III Résultats et discussion
: Variations des teneurs en polyphénols totaux au niveau des extraits éthanoliques foliaires et floraux de Paronychia argentea.
Les protocoles d’extractions des composés phénoliques par solvants sont très divers, le rendement de cette extraction dépend fortement de la nature du solvant, et de la méthode d’extraction, mais aussi du matériel végétal et ses composés bioactifs. Le solv
permettre une extraction maximale des polyphénols sans modifier leurs structures
La comparaison de nos résultats avec ceux de la littérature, montre que les teneurs en polyphénols de nos extraits sont plus inférieurs à celle obtenue par
mg/g avec des extraits éthanolique de Herniaria hirsuta). Par contre nos résultats avec ceux obtenus par Moufida et al., (2015) (0.56±0.25 mg/g
argontea).
Plusieurs facteurs peuvent influencer la teneur en composés phénoliques. Des études récentes ont montré que les facteurs extrinsèques (tels que les facteurs géographiques et climatiques), les facteurs génétiques, mais également le degré de maturation de la
durée de stockage ont une forte influence sur le contenu en polyphénols
2001; Fiorucci et al., 2006).
Résultats et discussion
: Variations des teneurs en polyphénols totaux au niveau des extraits éthanoliques foliaires
Les protocoles d’extractions des composés phénoliques par solvants sont très divers, le rendement de cette extraction dépend fortement de la nature du solvant, et de la méthode d’extraction, mais aussi du matériel végétal et ses composés bioactifs. Le solvant doit permettre une extraction maximale des polyphénols sans modifier leurs structures (Contini et
La comparaison de nos résultats avec ceux de la littérature, montre que les teneurs en à celle obtenue par Ammor., (2018) ). Par contre nos résultats 0.25 mg/g avec extraits
Plusieurs facteurs peuvent influencer la teneur en composés phénoliques. Des études récentes ont montré que les facteurs extrinsèques (tels que les facteurs géographiques et climatiques), les facteurs génétiques, mais également le degré de maturation de la plante et la durée de stockage ont une forte influence sur le contenu en polyphénols (Aganga., 2001;