UNIVERSITÉ
DU QUÉBEC
À
MONTRÉAL
SYNTHÈSE DE L'ER YSOTRAMIDINE
ET
FORMATION DE SYSTÈMES POL Y
CYCLIQUES TENDUS
MÉMOIRE
PRÉSENTÉ
COMME EXIGENCE
PARTIELLE
DE LA MAÎTRISE
EN CH
IMIE
PAR
CHLOÉ
L'HOMME
UNIVERSITÉ DU QUÉBEC À MONTRÉAL
Service des bibliothèques
Avertissement
La diffusion de ce mémoire se fait dans le respect des droits de son auteur, qui a signé
le
formulaire
Autorisation de reproduire et de diffuser un travail de recherche de cycles
supérieurs
(SDU-522
-
Rév.01-2006).
Cette autorisation stipule que
«conformément
à
l'article 11 du Règlement no 8 des études de cycles supérieurs
, [l'auteur] concède
à
l'Université du Québec
à
Montréal une licence non exclusive d'utilisation et de
publication de la totalité ou d'une partie importante de [son]
travail
de recherche pour
des fins pédagogiques et non commerciales.
Plus précisément, [l
'auteur] autorise
l'
Université du Québec à
Montréal à
reproduire, diffuser, prêter, distribuer ou vendre des
copies de [son] travail de recherche
à
des fins non commerciales sur quelque support
que ce soit, y compris l'Internet. Cette licence et cette autorisation n'entraînent pas une
renonciation de [la] part [de l'auteur]
à
[ses] droits moraux ni
à
[ses] droits de propriété
intellectuelle.
Sauf entente contraire, [l'auteur] conserve la liberté de diffuser et de
commercialiser ou non ce travail dont [il] possède un exemplaire
.»
REM
ERCIEM
ENTS
J'
aimerais tout d
'abord adresser mes
plus sincères
remerciements a
u Pr.
Sylvain
Canesi pour
m
'avoir
accue
illi dans son laboratoire.
Je
le
remercie également
pour
ses conna
issances
scientifiques
qui
so
nt impressionn
antes, sa
di
sponibilité et surtout son
souti
en. Les
diffé
rents
proj
ets qu
'
il rn 'a confi
é
ont permis
d
'approfondir
énorm
ément mes connaissa
nces et de fa
ire
aboutir cette
maîtrise
.
Ce fut un grand pla
isir de
travailler à ses côtés.
Je souhaite auss
i remercier tous mes collèg
ues de
laboratoire avec
les
quels j
'
ai eu le pl
aisir de
travailler. M
ar
c-André
Beaulieu,
Chanta
l Kimi
aka G
uérard
,
Guill
aume
Jacquemot,
M
arc-André
Ménard
, Gaëtan Mae
rtens et
Vi
ncent H
amel,
j
'a
i passé
d'agréabl
es
moments
à
part
ager,
discuter
et rigoler
avec
vo
us tous
,
qu
e ce soit
au
sein du laboratoire comme
à
1
' ex
térieur.
Je
ti
ens à remercier le
département de chimi
e,
le
Pr. Li
va
in Breau, direc
teur du département,
le
Pr. Huu
Yan Tra e
n tant que
directeur du programm
e
de
chimi
e, et Mme So
nia
Lachance
pour toute so
n aide, ses conseils et le
trava
il réali
sé
durant ces deux a
nnées.
Je
remercie auss
i
Al
exandre Arnold pour
son travail remarquable avec
la
RMN, Leanne Ohlund pour les
analyses
HRM
S, ainsi qu
e
tous
les membres et
amis
des
laboratoires
du départe
ment de
chimie qu
e j
'ai eu le
plaisir de
rencontrer.
Un
grand merci
aux organismes sub
ventionnaires
pour les
bourses
de
recherche et les
donateurs de
la
fondation
UQAM pour les
bourses
d
'excell
ence qui m'
ont été attribué
durant
mes études. Ce so
utien fi
nancier a été reç
u avec bea
ucoup de gratitude.
Je souh
aite également remercier le
Pr. Denis G
iguère et le
Pr. D
aniel Chapd
ela
ine
d'
avoir
accepté
d'
être
les membres du jury de ce mémoire.
Enfin, j
e
remercie
du fond du cœur ma famill
e et mes ami
s qui m
'
ont sout
enu
et
encouragé
durant ma
maîtrise, et plus particulièrement Franço
is
pour
son
amour
et
son
soutien
quotidien.
TABLE DES MATIÈRES
Page
R
EMERCIEMENTS ....
.
...
..
..
...
..
..
...
...
.
....
.
....
...
.
...
...
...
...
.
.
...
...
.
.
...
.. ii
TABLE DES MATIÈ
RES
.
...
...
..
.
...
...
.
...
....
...
...
.
.
..
..
.
...
.
..
..
..
.
...
...
.
...
iii
LISTE DES SCHÉMAS ...
...
...
...
...
..
....
...
...
.
...
.
....
.
....
...
..
.
.
.
...
.
.
...
.
..
.
...
.
..
v
LISTE DES ABRÉVIATIONS
, SIGLES
ET ACRONYMES
...
...
..
.
.
...
..
...
.
.
vi
RÉSUMÉ
...
.
..
...
.
...
.
...
...
..
..
..
....
...
...
...
....
..
...
.
..
.
....
..
...
....
vii
i
ABSTRACT
..
...
.
..
...
..
...
...
..
...
..
..
...
...
..
..
....
.
...
...
.
...
...
.
...
i
x
INTRODUCTION ...
.
....
..
.
.
...
..
....
.
...
.
....
..
.
...
.
....
..
...
...
.
...
.
...
.
..
...
... 1
0.1
I
ode
hyp
ervale
nt ...
...
.
..
..
.
..
...
...
....
...
...
.
.
.
.. 1
0.2
Exemp
l
es
de transformation
s impliquant des réactifs à base d'
iode h
ypervalent
....
.
3
0
.
3
Concept
d
e
l
'
umpolung ..
...
.
...
..
...
...
...
..
..
.
....
.
....
..
.
.
....
....
.
.
..
.
...
.
..
....
.
5
0.3.1 Umpolung
c
l
assiq
u
e .
..
...
....
...
.
...
.
...
....
..
..
...
...
...
..
....
...
..
...
...
...
.
..
5
0.3.2
Umpo
lun
g a
rom
atique
...
.
....
...
.
...
....
.
...
.
...
...
...
...
.
.
.
..
...
.
...
...
...
...
....
6
CHAP
ITR
E
I
....
.
.
...
.
.
.
...
.
.
.
..
.
...
.
...
..
...
..
....
.
...
....
...
..
...
..
...
.
...
.
..
.
...
9
SYNTHÈSE RACÉMIQUE DE L'ERYSOTRAM!DINE ...
...
...
..
..
...
.
...
....
...
...
...
....
9
1.
1
.
Synt
hèse de
l'erysotramidine
.
.
..
.
...
.
.
.
.
.
.
...
...
...
..
..
.
...
.
..
.
9
1.
2.
In
formations su
ppl
é
m
entaires ...
....
...
...
...
...
...
...
...
..
...
....
...
.
....
l3
1.
3. Co
nclu
s
i
on
..
...
.
.
.
...
.
...
...
....
.
...
...
....
.
....
...
.
.
..
...
..
...
..
...
.
...
...
l3
CHAPITRE Il
...
..
.
.
..
...
...
...
..
...
.
..
..
...
.
.
...
.
.
.
.
....
.
...
14
FORMATION DE SYSTÈMES POLYCYCLIQUES
TENDUS
...
...
....
..
.
..
..
...
.
.
..
....
..
..
.
.
14
2.
1. Intr
oduction
..
.
.
...
...
.
...
.
...
...
..
...
...
.
...
.
...
...
.
.
...
..
..
...
.
14
2.2.
Développement des
conditions
réactionnelles
...
.
.
.
...
...
...
..
...
15
2.3.
Résultats
et
discussion ...
..
.
..
.
...
...
....
...
..
....
....
..
.
..
...
...
.
..
....
..
....
...
.
... 16
2.4.
Concl
u
sion et
p
e
rspect
ives
...
.
...
...
...
....
...
..
...
.
...
.
.
.
...
..
..
.
..
...
.
...
20
CONCLUSION ...
.
...
..
.
...
...
..
.
...
...
...
...
..
...
.
.
...
...
.
.
.
....
...
.
...
...
....
...
.
. 21
ANNEXE A ..
...
...
....
...
....
....
...
...
.
.
...
.
..
.
.
.
..
.
..
...
...
.
.
....
..
...
...
.
...
...
..
.
..
.
22
"SYNTHESIS OF THE
E
RYTHRINA
ALKALOID ERYSOTRAMIDfNE"
ARTICLE
...
22
lV
"SYNTHESIS OF THE ERYTHRINA ALKALOID ERYSOTRAMIDINE" DOCUMENT
WORD ...
..
...
..
...
...
...
...
....
...
...
...
28
ANNEXE C ...
..
...
...
...
...
...
..
...
..
...
..
.
.45
"SYNTHESIS OF
THE ERYTHRINA ALKALOID ERYSOTRAMIDrNE" SUPPO
RT/
HG
I
NFO
RMA TJO
N. ...
..
....
..
...
..
...
...
...
...
...
...
...
.
.
.
...
.45
ANNEXE
D ...
...
...
...
...
...
...
...
...
...
... 69
"FORMATION DE SYSTÈMES POLYCYCLIQ
UES TENDUS" SUPPORT
I
NG
INFORMA T!ON.
...
..
..
... ...
...
.
.
.
..
...
...
..
....
...
.
.
...
...
...
..
..
.
69
RÉFÉRENCES
...
...
....
....
...
...
...
...
...
...
...
...
..
...
...
...
....
... 98
- -- -
-
---LISTE DES SCHÉ
MAS
Schéma
0
.
1:
RÉACTIFS
À BASE D'IOD
E HYPERVALENT
D'
OXY
DATION
III
...
.
...
.
...
2
0
.
2:
R
ÉACT
IFS
À BAS
E D'IOD
E HYP
ERVA
LENT D'OXYDAT
I
ON
V ET
VII
...
....
...
....
...
2
0
.3: RÉACT
I
ON UMPOLUNG DE CO REY
ET
SEEBACH ..
...
..
...
...
...
...
... 5
0.4
: R
ÉACTION
DE CON
DENSATION
BENZOÏNE ...
...
...
...
...
...
...
6
0
.
5:
M
ÉCAN
ISM
E DE L'UMPOLUNG AROMATIQUE
PA~
TRANSFERT D'ÉLECTRONS ...
?
0
.
6:
ATTAQU
E PR
ÉFÉRENTIELL
E DÉPENDEMMENT DE LA
NATURE DU
NUCLÉOPH
ILE ...
8
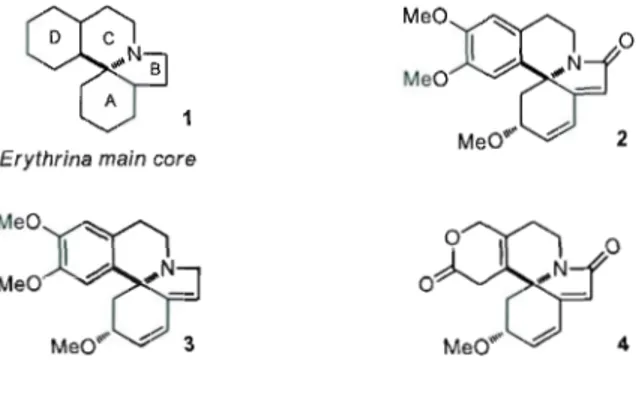
1.1
: ALCALOÏDES
DE LA FAM
ILL
E DES
ERYTHRINA ..
....
...
...
....
....
..
...
...
....
.
....
....
.... 9
1
.
2:
R
ÉTROSYNTHÈSE
DE L'ERYSOTRAMID
I
NE ....
...
....
....
...
...
....
...
...
..
...
..
1
0
1
.3: Ü
ÉAROMATISAT
I
ON OXYDANTE DU
PHÉNOL
...
...
..
...
...
..
...
..
...
...
..
.
10
1.4:
S
ECONDE DÉAROMATI
SATION OXYDANTE DU PHÉNOL ...
..
..
...
...
...
...
...
....
..
...
11
1.5:
FORM
AT
ION DU SQUELETTE TÉTRACYCLIQUE ...
..
...
...
...
...
...
...
....
...
...
12
1
.6: ÉLIM
I
NAT
I
ON D'UNE CONCAV
I
TÉ ....
....
..
...
...
..
..
...
..
..
..
..
...
..
...
....
..
...
..
.
12
1
.7
:
SYNT
HÈSE DE
L'ERYSOTRAM
IDINE ...
....
...
.
...
.
...
.
...
.
..
I2
2
.
1
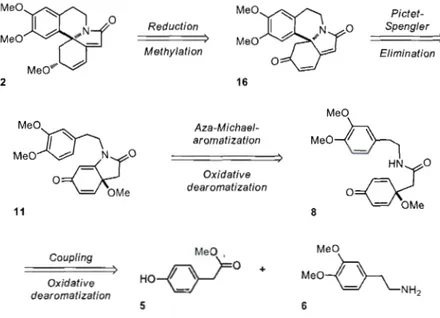
: M
ÉCAN
ISM
E RÉACTIONNEL DE
LA RÉACTION DE FORMATION
D'
UN CYCLE
À
3 MEMBRES
...
.
...
...
...
.
...
...
.
...
...
...
.
.
.
...
..
..
..
...
..
...
...
...
..
...
.
....
.
15
2.2:
SYNTHÈSE DU PR
ÉCURSEU
R POL
YCYCLIQUE 2.6
...
.
..
...
..
...
...
....
..
.
..
.
!?
2
.3: FORMATION D'UN
CYCLE
À
3 MEMBRES ..
....
....
..
...
...
.
...
...
...
...
.
...
..
!?
2.4:
SYNTHÈSE DU
PRÉCU
RSEUR
POLYCYC
LIQ
UE 2.10 ....
..
....
...
..
...
...
...
...
..
..
..
...
1
8
2.5: FORMATION D'UN
CYC
LE À 4
MEMBRES ...
...
...
.
....
...
..
...
..
....
1
8
2
.6: SYNTHÈSE DU PRÉCURSEUR POLYCYC
LIQ
UE 2.13
..
..
....
...
...
..
....
...
..
..
..
...
...
.
19
Ac
ACN
Aco-AcOH
AcOEt
Ag
2
0
aq.
BF
3•0Et
(bmin)BF4
Cat.
CeCI
Cs
2
C0
3
CDCb
CHCb
DCM
DIB
DIBAI-H
DMF
DMP
eq
Et
3
N
H
2
0
H
3
P0
4
HgO
Hz
IBX
J
LISTE DES
ABRÉVIATIONS
,
SIGLES ET ACRONYMES
Acétyle
Acétonitrile
Ion
acétate
Acide acétique
Acétate
d'éthyle
Oxyde
d'argent
Aqueux
Trifluorure
de bore
éthérat
e
1-Butyl-3-methylimida
z
olium t
e
trafluoroborate
Catalytique
Chlorure
de
cérium
Carbonate
de
césium
Chloroforme
deutéré
Chloroforme
Dichlorométhane
Diacétoxyiodoben
z
ène
Hydrure de diisobutylaluminium
Diméthylformamide
Dess-Martin périodinane
Électrophile
Équivalent
Triéthylamine
Eau
Acide
phosphorique
Oxyde
de mercure
Hertz
Acide 2-iodoxybenzoïque
Constante
de
couplage
KHMDS
M
Me
MeCN
Me
OH
MeOD
mg
MHz
Min
NaBH
4NaCN
n-Bu
Li
Na Cl
Nal04
Na2S
0
4
NH4
Cl
Nu (Nu-)
Ph
Phi(OAch
PIFA
PMB
RMN
sat.
TBS
TBS-OTf
T
ES-OTf
TM
S
TMS-OTf
THF
Ts
Potassium bis(triméthylsi
ly
l)amide
Co
ncentration en mol.L-
1Méthyle
Acétonitrile
Méthanol
Méthanol deutéré
Millig
ramme
Mégahertz
Minute
Borohydrure de sodium
Cyanure de sodium
Butyllithium lin
éaire
Chl
orure
de sodium
Periodate de sodium
Sulfa
te de sodium
Chlorure d'amm
onium
N
ucléophile
Phényle
Diacétoxyiodobenzène (D
TB)
Bis(trifluoracéto
xy)
iodobenzène
Paraméthoxy
benzyle
Résonance Mag
nétique Nucléa
ire
Saturée
Tert-bu
ty
ldiméth
y
!s
i! y
le
Tert-bu
ty
ldiméth
y
!s
i
!y 1
tri
f1
uo
rométhanes
ul
fo
n
a te
Triéthylsilyltriflu
orométhanes
ulfo
nate
Triméthylsil
yle
Triméthylsilyltrifluo
rométhanesul
fonate
T
étr
ahydrofurane
Tosyle
RÉSUMÉ
La
déaromatisati
on oxydante
de
phénols sub
stitu
és
par un
réactif à
base
d'
iode
hypervalent
permet
l'obtention rapide
d'
intermé
di
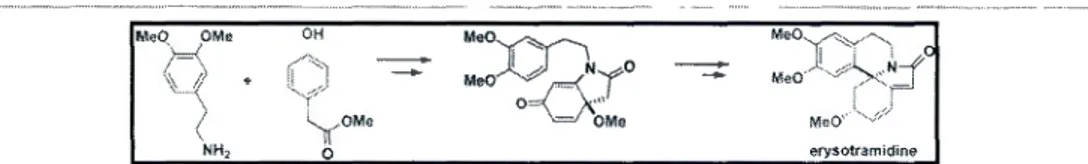
aires
foncti
onnalisés. Cette
méthode a été appliquée
à
deux
reprises
à
la
synthèse
de
l'
alcaloïd
e erysotramidine
permettant de co
nstruire son
squelette principal azaspiranique,
motif central
de
cette
mol
écule.
L'e
nj
eu
de cette
synthèse
est de
former quatre
cycles conti
gus
tout
en
co
ntrô
lant
ses
de
ux ce
ntres asymétriqu
es.
La
chimie
de
l'
iode
hypervalent a également
été
utili
sée comm
e outi
l de synthèse pour
la
mise
en place
d'
une
méthodologie
basée sur la formation
de sys
tèmes
polycyc
liques
fonctionnalisés. Cette
nouvelle
méth
odologie
repose sur
une addition de
Michae
l
intramolécula
ire
permettant
la
formation de cycles
tendus sur des squelettes
bicy
cliques.
L
'accès à ces sys
tèmes
polycycliques
pourrait
tro
uve
r une appl
icatio
n dans
la synthèse
de
produits naturels.
Mots
clés:
Iode
hypervalent,
Déaroma
tisation
oxyda
nte, Ery
sotramidine, A
lcaloïd
e
,
Produit
naturel, Système
polycycliques, Additi
on de Mi
chael
ABSTRA
CT
The oxidative
dearomatization process
of substituted phenols in th
e
presence o
f hypervalent
iodine
reagents allows the rapid form
ation
of function
alize
d intermediates
. This
method was
applied twice
in the
synthesis of the alkaloid
erysotramidine enabling
to
produce
its
azaspirannic s
keleton, which is a central pattern of thi
s mol
ecule. Th
e iss
ue of th
e synth
es
is is
to form four contigu rings and to
stereocontrol two
asymmetric
cent
ers. The
hypervalent
iodine
chemistry
has also been used
as a synthetic tool for the es
tabli
shment
of
a
new
methodology enabling
the
formation
of fun
ctionalized polycycles.
Thi
s new
meth
odology
is
based
on
an intramolecular Michae
l addition
a
llow
ing
the
formation
of stra
ined rings.
The
acces
s to such polycyclic systems could find
applications
in the synthes
is of natural products.
Keyword
: Hyperv
alent Iodine,
Oxidative dearomatization
, Erysotramidine, Alka
loid
, Natural
product, Po
lycyclic systems
, Michae
l addition
INTRODUCTION
Avec
l'
expansion de
la consommati
on m
ondiale
de
médicaments,
l'
utilisation de
moléc
ules
naturelles
pour
so
igner les
maladies es
t devenue
plus
restrei
nte et
très coüteuse
.
Afi
n de
fo
urnir aux scie
ntifiques
un m
ax
imum d'outils pour la sy
nthèse de
molécul
es
biologiquement
actives,
le
développ
ement de nouvelles
méth
odolog
ies e
st indispensable.
Auj
ourd
'
hui les
domaines
de
la
rec
herche et d
e
l'
indu
strie
mette
nt l'emph
ase sur la chim
ie verte, c'est
à
dire
la valorisati
on des
déchets pour limiter le
rejet de substances
toxiques
dans 1
'environnement
tout en minimi
sant les
coftts de
production. Cependant
,
malgré
l'
importance
de
l
'
écologie,
le
déve
lopp
ement de
nouvelles
méthodolog
ies et de synthèses
totales effi
caces
res
tent
primordiales.
D
'autre
part
,
nombre
de
molécul
es
bi
oac
tives
possèdent une structure co
mplexe et compacte
qui
a
ugmente
1 'enje
u des voies
de synthèse
. Il
y a
quelques années,
1
'
utilisation de
métaux
lourds
tels
que
le
Palladium,
le
Plomb
ou le
Mercure
,
était une
méth
ode
très
populaire
notamment pour l
'
élaboration de
liaisons carbone-carbone
,
rendant
ainsi les
métaux
indis
pensables
pour les chimi
stes. En
revanche
,
du point de vue environnementa
l
,
leur
to
xicité a commencé à
poser problème, encourageant
certains chercheurs à
développer de
nouv
elles
méthodes
plus
respectueuses co
mme
1
'
utilisation de
réacti
fs
à
base
d
'
iode
hypervalent
,
qui
ont la
particul
arité
d'avoir des
propriétés chimiques
proches
des
métaux
lourds.
0.1 Iode
hypervalent
L'iode es
t
connu
et couramment utilisé sou
s forme
monovalente avec
un degré
d
'
oxydation
de
-1
;
pourtant il peut adopter des degrés d'oxy
dat
ion supérieurs (III
,
V
et
VIl).
Dans ce cas
les
réactifs sont appelés
des iodes
hyperva
lents ou du terme anglais
iodane. Ce co
ncept d
'
iode
hyperva
lent fut déve
lopp
é
par J.J. Musher
à
la fin des années
1960 alors que
la toute
première
sy
nthèse fut reportée en 1886 par Willgerodt.[ l]
2
Parmi les
réactifs à
base
d'
iode
hypervalent
(III
)
le
s
plus connus, fig
urent le
diacétoxy
i
odobenzene (DIB)
,
bis(trifluoroace
tate)iodobenze
ne (PI
FA) ou l
e
ré
a
ctif de
Koser.
(Schéma 0
.1
) Leurs réacti
vités dépendent du
contre-ion relâch
é
dans
l
e
milieu
,
par exe
mple
, l
e
DIB
ser
a
moins
réac
tif que
l
e
PIFA
.
E
n
effet
,
le contre-ion relâché
par
l
e
DIB
est
1
'
acid
e
acétique tandis que celui du PIF
A est
1
'
ac
ide trifluoroacétique.
DIB
PIFA
R
é
acti
f de Koser
Sch
é
ma 0.1:
Réactif
s
à
b
ase
d'iode h
y
p
e
rval
e
nt d
'
ox
y
dation Ill
Ces co
mposés sont utilisés
pour des désarom
a
tisations oxydantes
[2] d
'aromatiques
riches en
é
lectr
ons
tels
que
l
e
phénol,
et éga
l
ement
dan
s
de
nombreuses
réactions
de
réarrangements
,
telles
que
le
réarrangement d
'
H
ofma
nn
,
[3] d
e
Favo
rskii
,
[4] de Curtius[S]
ou des
réarrangements radi
calaires
.
[
6]
Les
réactifs à base
d
'
iode
hypervalent
(V)
p
e
rm
e
ttent notamment
d
'
oxyd
e
r d
e
manière do
u
ce
des alcoo
l
s en
cétones
ou
a
ld
éhyde
s.
Parmi
c
e
s
réactifs on
y trouv
e
l
'
acide
2
-iodoxybenzoïque (IB
X) et le per
iodinane de
De
s
s-M
artin (
OMP)
.
Quant a
u
x co
mposés à base
d
'
iode
hyp
erva
l
ent
(VII)
,
comme
l
e
periodate
de sodium
(Nai0
4),ce
u
x-c
i permettent de
réa
li
ser des clivages oxydatifs de dio
i
s v
i
c
ina
ux
.
(Schéma
0.2)
o
,,
OH
1
/
~
'o
0
IBX
(V)
AcO OAc
'
{
-
OA
c
'o
~0
DMP
(V)
0
11e œ
O
=
l
-
0
Na
Il0
Nal0
4(VIl)
Schéma 0
.
2: Réactifs à bas
e
d'iod
e
h
y
pervalent d
'
ox
y
dation
V et VII
T
ous ces composés à
base
d
'
iode
hyperva
l
ent sont des solides sta
bles à
temp
é
ra
ture et
pression
ambiante
.
Cependant
,
l
orsqu 'i
l
s seront placés en prése
nce
d
'
un
e
fonction
c
himiqu
e
---- ---- ----
- -
- -
- -
--
---
--
---
--
--
---3
facilement oxydable,
ils deviendront instables, donc très réactifs
,
l
'
iode cherchant à retrouver
ses électrons et sa valence de 1.
0.2
Exemples de transformations impliquant d
es
r
éac
tifs à b
ase
d
'
iod
e
hyp
e
r
va
l
e
nt
Les
réactifs
à
b
ase
d'iode hypervalent d
'oxy
d
a
tion III
sont
principal
e
m
e
nt utili
sés
pour la
déaromatisation
oxydante de ph
é
nols.
Un
d
es exe
mpl
es
d
éve
lopp
és a
u
sei
n du l
a
bor
a
toire est
une
déaromatisation oxydante
d
e
ph
é
nol
e
n pr
ése
nc
e
de
DIB
,
impliquant un
e
r
éac
tion d
e
transposition.
[7]
OH
0
~
DI
B
R
HFIP
1
CH2CI2
?"
0~0H
50%
0
0
""""
LJ
Canesi.
Org.
Let!
.
200
9
,
11
, 4 756.
D
'a
utr
es
ré
act
if
s
comme IBX
,
un iode h
y
p
erva
l
e
nt
d'oxydation V, peut
éga
l
e
m
e
nt oxyder d
e
manièr
e
régiosél
ect
ive des phénols
e
n o-quinone. [
8]
OH
A
Y
R'
R
DMF
lB
X
20-99%
Pettus.
Org
. L
ett
. 2002
,
4, 285.
L
'oxy
d
a
tion d
'alcoo
l
en aldéhyde
p
e
u
t êt
re r
éalisée en
pr
ése
nc
e
de
p
e
riodin
a
n
e
d
e
Dess-M
a
rtin. Dév
e
lopp
é
en
1983
,
ce réactif a
l
a
particularit
é
d
'oxy
d
e
r l
es a
lcools d
a
ns de
s
Periodinane de Dess-Martin
[bmim]BF
490%
Yadav. Tetrahedron. 2004,
60,
2131
.
4
Quant
au
periodate de
sodium (Na
i0
4),il
peut par
exemple se
r
vir
à
réali
se
r des clivage
s
oxydatifs de diois
vicina
u
x et d'obtenir
l
a fo
rm
at
i
on
d
'
un
e céto
n
e ou d'un a
ld
éhyde.[
lü]
MeO
H
: H
20
(2:1)
11T~l
J
PMB
H.
l
"'-/
---1H
1
T
~l
J
PMB
H
O
,,,r
l
~
---93%
Rudolph. J. Org. Chem
. 2009, 74
, 7220.
Le Pr. Ki ta,
un des pionniers dans le domaine d
e
l
'iode
hyp
e
rval
en
t,
a
d
éve
l
oppé
un iod
e
hypervalent
chiral. Celu
i-
ci
permet d
'
effect
u
e
r
des réactions
stéréo-sélectives,
comme
l
a
déaromatisation de phénol avec
un
e attaque intramoléculaire
du
nucléophile.[
11]
OH
OH
~0
vy
R
AcO
H
OAc
W
'
i
(
h
-
(0
.5
5
eq)
'81-86%
80-86%
ee
~~
vy
~
R
Kita. Angew. Chem.
/nt. Ed
.
2008, 3787.
D'autre
s
ré
actifs
à
base d
'
iode hyper
va
l
e
nt p
e
rmettent la
fonctionnalisation en a
l
pha
d'un
e
cétone
.
Par
exemp
l
e,
l
e
réactif de Koser
permet
de réaliser une
r
éaction
de
tosy
l
oxy
l
ation,
c'est à dire de
greffer un tosyle sur
un
carbo
n
e
normalement nucléoph
il
e.
Réactif de Koser (cal.)
MeCN
88%
- - -
--
---
--
--
--
--
--
--
--
--
--
--
---
--
----
---5
L
es
r
éac
ti
o
n
s
é
num
é
r
ées a
u d
e
ssu
s
n
e so
nt qu
'
un p
e
ti
t é
v
e
nt
a
il
d
es
tr
a
n
sfo
rm
a
ti
o
n
s
p
e
rmi
ses
p
a
r l
es réac
ti
fs
à
b
ase
d
'
i
o
d
e
h
y
p
e
r
va
l
e
n
t,
p
ro
u
va
nt ain
s
i 1
'
ut
i
li
té e
t 1
'ef
fi
caci
t
é
d
e ces
co
mp
osés
d
ans
l
'é
l
a
b
o
r
at
i
o
n d
e
p
ro
duit
s
n
a
tur
e
l
s.
[l
2]
,
[1
3
]
0
.
3
C
on
ce
pt d
e
1
'
umpolun
g
0.3
.1 U
mp
o
lun
g class
iqu
e
U
n
exe
mpl
e
du
co
nc
e
pt d
e
1
'
ump
o
lun
g, est
l
a sy
n
t
h
èse
d
e céto
n
es à
p
a
rti
r
d
'
a
ld
é
h
y
d
es
qu
i f
ut
d
éve
l
o
pp
é da
n
s
l
es a
nn
ées
19
7
0 p
a
r
Corey et See
b
ac
h
.
[l
4
]
,
[1
5
]
Cette
r
éact
i
o
n
es
t p
e
rmi
se
p
a
r la pr
o
t
ect
i
o
n d
e
l
a
fon
c
tion
a
ld
é
h
y
d
e
0.1
so
u
s fo
rm
e
d
e
di
t
hi
a
n
e
0.2
,
gé
n
é
r
a
nt
a
in
s
i un
pr
o
ton
ac
id
e.
Du
fa
it d
e s
on
ac
idit
é
,
l
e
pr
oto
n p
e
u
t e
n
s
uit
e ê
tr
e a
rr
ac
h
e
r p
a
r un
t
r
a
it
e
m
e
nt
avec
la b
ase fo
rt
e n
-but
y
llithium
. E
n pr
ése
nc
e
d
'
un
é
l
ec
t
ro
phil
e,
1
'a
n
io
n 0.3
va
r
éag
ir
avec ce
d
e
rni
e
r
, e
t
a
p
rès
d
é
pr
o
t
ec
ti
o
n d
e
l
a fo
n
c
ti
o
n dithi
a
n
e
,
l
a cé
t
o
n
e
r
és
ul
ta
nt
e
0.5
est o
bt
e
nu
e
(Sc
h
é
m
a 0
.
3)
.
Ce
tt
e
m
o
dific
a
ti
o
n
a
p
e
rmi
s
à
1
'
a
ld
é
h
y
d
e
0.1
,
n
o
rm
a
l
e
m
e
nt
é
l
ec
t
ro
phil
e,
d
e
d
eve
nir un nucl
éo
phil
e ce
qui r
és
ul
te
d
o
n
c d'
un
e i
n
ve
r
s
i
o
n d
e
p
o
l
a
ri
té
d
'
un
gro
up
e
m
e
nt
fo
n
c
ti
o
nn
e
l.
0
( l
( l
[
9
]
<±l
( l
0
S
H
SH
n
-
Buli
E
HgO
R
A
H
A
c
id
e
d
e
sx
R
H
s
-
R
s
x
s
E
H
20
1
THF
R
A
E
L
ew
i
s (ca
t
.)
0.1
0.
2
0.3
0
.4
0.5
Sch
é
ma
0
.
3:
R
é
action
umpolun
g
de
C
or
ey
et
Se
ebach
P
a
r l
a s
uit
e
,
d
'
a
u
t
r
es réa
c
t
ion
s ac
tu
e
ll
e
m
e
nt tr
ès co
nnu
es o
nt
é
t
é
d
éve
l
o
pp
ées
c
o
mm
e
l
a
c
o
nd
e
n
sa
ti
o
n b
e
n
zo
ïn
e
(S
c
h
é
m
a
0.4
)
ou
e
n
co
r
e
l
a sy
n
t
h
èse
d
es
r
éac
tif
s
d
e G
ri
g
n
a
rd qui p
e
rm
et
par
1
'
in
se
rtion d
'
un
m
ag
n
é
sium dan
s
l
a
li
a
i
so
n c
a
rb
o
n
e
-halo
gè
n
e,
d
'
inv
e
r
se
r l
a
p
o
l
a
ri
té
du
c
a
rb
o
n
e
.
6
0
~
H
N
aC
N
(cat.)
0.6
0.7
Schéma 0.4: R
é
action d
e
conden
s
ation benzoïn
e
Ce
tt
e
m
é
th
o
d
o
l
og
i
e
b
asée
sur 1
'
ump
o
lun
g a é
t
é
é
toffée
p
a
r d
e
n
o
mbreu
x c
h
e
r
c
h
e
ur
s
, d
o
nn
a
nt
a
cc
ès à
d
e
n
o
u
ve
ll
es
p
o
s
s
ibilité
s
d
e
r
éact
i
o
n p
o
ur l
a sy
n
t
h
èse
d
e
pr
o
duit
s
n
at
ur
e
l
s
. D
e
plu
s, ce
co
n
ce
pt
a été é
t
e
ndu
a
u
x a
r
o
m
a
tiqu
es
ri
c
h
es e
n
é
l
ec
tr
o
n
s,
in
ve
r
sa
n
t éga
l
e
m
e
n
t
l
e
ur p
o
l
a
rit
é
d
a
n
s
l
e
but d
e
tr
a
n
s
p
ose
r d
es
r
éact
i
o
n
s
d
e c
himi
e c
l
ass
iqu
e
à l
a c
h
i
mi
e
d
e
s
a
r
o
m
at
iqu
es.
0
.
3
.
2
U
mp
o
lun
g aro
m
a
tiqu
e
T
o
ut d
'a
b
o
rd,
d
e
m
a
n
iè
r
e gé
n
é
r
a
l
e
un
a
r
o
ma
ti
qu
e
r
ic
h
e
en
é
l
ect
r
o
n
s
,
co
m
me
un phén
o
l,
va
r
éag
i
r en ta
nt qu
e
nu
c
l
éo
phile
e
n pr
ése
n
ce d'
un
é
le
ct
r
o
ph
i
l
e,
d
onna
n
t a
pr
ès
r
éaro
m
at
i
sat
i
o
n
1
'
aro
m
ati
qu
e s
ub
s
titu
é co
rr
es
p
o
nd
a
nt
,
co
mm
e c
'e
st
l
e cas
dan
s la
ré
actio
n d
'
acy
l
at
i
o
n
de
Fri
e
d
e
l-
C
r
afts. [
1
6]
T
o
ut
e
f
o
i
s
,
un
e oxy
d
a
ti
o
n d
e ces a
r
o
m
at
iqu
es avec
un r
éactif
à
b
ase d
'
i
o
d
e
h
y
p
e
r
va
l
e
nt
va
p
e
rm
et
tr
e
d
e
tr
a
n
s
f
o
rm
e
r ces nucl
éo
phil
es e
n
é
l
ec
trophil
es
h
a
ut
e
m
e
n
t
r
éact
i
fs
.
D
'
a
pr
ès
l
es
r
ec
h
e
r
c
h
es
publi
ées
p
a
r l
e
pr
o
f
esse
ur K
i ta
,
[
1
7
] l
e
m
éca
ni
s
m
e
d
e
l
a
r
éactio
n
sera
i
t
ba
sé s
ur
d
e
u
x
tr
ansfert
s
s
u
cces
si
fs
d
'
él
e
ctron
s
c
é
l
ib
at
a
ire
s
. (S
chéma
0
.5
) En pr
és
ence
du
di
acé
t
oxy
i
o
d
o
b
e
n
ze
n
e (
DIB
)
,
l
e
ph
é
n
o
l
0.8
v
a
tr
a
n
sfé
r
e
r p
a
r 1
'
ato
m
e d
'
oxy
g
è
n
e
un pr
e
m
ie
r
é
l
ect
r
o
n
à l'
i
o
d
e, gé
n
é
r
a
nt l
e
r
a
di
ca
l
ca
ti
o
n
0
.
9
.
C
e
l
u
i-
c
i
va êt
r
e
dépr
o
t
o
nn
é
p
a
r une
m
o
l
éc
u
le
d
'acé
t
ate
lib
é
r
ée
d
a
n
s
l
e
mili
e
u,
fo
rm
a
n
t
l
e
r
a
di
ca
l
0.10
. U
n
seco
nd
é
l
ectro
n
es
t
e
n
s
uit
e
tr
a
n
s
mi
s
d
e
l'
a
t
o
m
e
d
'
oxy
g
è
n
e
à
l'
i
o
d
e
.
U
n
e c
h
a
r
ge
p
os
iti
ve es
t
gé
n
é
r
ée
,
l
oca
li
sée
d
a
n
s
un
pr
e
mi
e
r t
e
mp
s s
ur l'
a
t
o
m
e
d
'
o
xygè
n
e
(
0.11
)
,
pu
is
r
a
pid
e
m
e
nt d
é
l
oca
li
sée
p
a
r r
éso
nn
a
n
ce e
n
p
os
iti
o
n
o
rth
o o
u p
a
r
a
du c
y
cl
e
, bri
sa
nt
a
in
si
l'
a
r
o
m
atici
t
é
p
o
ur
fo
rm
e
r un i
o
n ph
é
n
oxo
nium
(
0.12
o
u
0
.
13
)
plu
s s
t
a
bl
e
. On con
s
t
a
t
e
qu
e
l
'oxy
d
a
ti
o
n du ph
é
n
o
l d
o
nn
e
li
e
u
à
l
a
f
o
rm
a
ti
o
n
du i
o
d
o
b
e
n
zè
n
e e
t d
e
1
'
ac
id
e acé
tiqu
e
, d
e
ux
so
u
s
pr
o
du
i
t
s
b
é
nin
s
p
o
ur l'
e
n
v
ir
o
nn
e
m
e
n
t.
-H.~
'
o:
y
)
.:_
rh
A
®®
Y
8
oAc
R
8
oAc
0.8
Tran
s
fert d'
é
le
c
tr
o
n
cé
libatair
e
HFIP
/
D
C
M
:
Ô
+~
:·r::.
r
h
Transfert
d'éle
c
tron
~
9
®
8
0Ac
célibatair
e
Ph-I:
R
R
0.10
0.11
~-~
~
..
•
+
,
1
-
Ph
. O).®
9
.
e
8
oA
c
OAc
~A
c
O
H
R
0.9
0
0
®
y
-
v
R
R
0.12
0
.
13
Schéma
0
.
5: Mécanisme
de l'umpolung
aromatique
par transfert d'électrons
7
8
0Ac
Après
l'acti
vation
oxydante,
le
cycle
pe
u
t
dorénavant réag
ir
comme
un
é
lectrophile.
Se
l
on la
nature
du nucléophile
placé
dans
l
e
mili
eu
,
une attaqu
e
préférentie
lle en position
ortho ou
para a
ur
a
li
eu.
Dans
un premi
er temp
s si
l
e
nu
cléophile
utili
sé est un nuc
l
éophile encombré
(nucl
éophil
e carboné)
,
il
choisira
la
position
l
a
plus access
ibl
e
,
c
'
es
t
à
dire
le ca
rbocation
seconda
ire
0.12
gé
n
é
r
é en po
sition
orth
o.
De ce fait
,
l
a
réaction se fe
ra so
u
s contrô
l
e stérique
pour
donn
er
,
après
réaromatisation
,
l
e
phénol
0.14
.
En
r
evanche, si
l
e
nucl
éophile
utili
sé est
peu
encombré (
h
étéroatome nucléophile ),
il
optera
po
ur
une attaque en positio
n
pa
r
a s
ur
le
carbocation tertia
ire
0.13
,
l
a
form
e
de
résonnance
la
plus stable
.
La
diénone
proc
hira
l
e
0
.
15
sera obtenue
,
tra
nsformant
ains
i les
in
sat
urations
dormantes du ph
é
nol en in
sat
ur
at
ions
plus
réac
tives.
(Sc
h
é
m
a
0.6)
8
01-l
0
.
8
0.12
~
~
7
"
"
R
J
-
0
0
.
13
Q
0
.
14
A
~lB
~
<±)
y
y
R
R
0
.1
5
R N
u
Sc
h
éma
0.6:
Attaq
u
e
préférentielle dépendemment de
l
a
n
ature
du nucléophile
L
es synthèses
eff
e
ctu
ées au
labor
a
toir
e
du pr
o
f
esse
ur
Sy
l
va
in
Ca
n
es
i p
ossè
d
e
nt
f
r
é
qu
e
mm
e
n
t
une é
t
a
p
e
cl
é
d'
ac
ti
va
tion oxyd
a
nt
e
d
e
ph
énol
(o
u
équi
valent)
p
a
r l
'e
mpl
o
i d
e
r
éac
tif
à
b
ase
d'
iode hy
p
e
rv
a
lent.[l
8
]
-
[21
]
--- ---~