HNO 2014 · 62:100–105 DOI 10.1007/s00106-013-2806-0 Online publiziert: 14. Februar 2014 © Springer-Verlag Berlin Heidelberg 2014
C. Meerwein1 · D. Vital1 · M. Greutmann2 · C. Schmid3 · G.F. Huber1 1 Klinik für Ohren-, Nasen-, Hals- und Gesichtschirurgie, Universitätsspital Zürich 2 Klinik für Kardiologie, Universitätsspital Zürich 3 Klinik Endokrinologie und Diabetologie, Universitätsspital Zürich
Totale Thyreoidektomie
bei amiodaroninduzierter
Hyperthyreose
Wann übersteigt das Risiko der
konservativen Therapie das Risiko
der chirurgischen Behandlung?
Amiodaron hat sich in den letzten Jahrzehnten als wichtige medika-mentöse Option zurBitte Behand-lung verschiedener Arrhythmien eta-bliert. Neben der überlegenen Wir-kung bei ventrikulären Arrhythmien stellt Amiodaron auch bei vielen Pa-tienten mit Vorhofflattern/Vorhof-flimmern auf dem Boden einer vor-bestehenden Herzerkrankungen die einzige sichere und wirksame phar-makologische Option zur Rhythmus-kontrolle dar. Aufgrund der zuneh-menden Prävalenz von Patienten mit entsprechenden kardiologischen In-dikationen und damit dem vermehr-ten Einsatz von Amiodaron trevermehr-ten auch die mit der Amiodaroneinnah-me verbundenen Nebenwirkungen im klinischen Alltag zusehends häu-figer auf. Die amiodaroninduzierte Schilddrüsendysfunktion gehört da-bei zu den häufigsten Nebenwirkun-gen und insbesondere die amioda-roninduzierte Hyperthyreose (AIH) ist eine gefürchtete Komplikation, die ein interdisziplinäres Manage-ment mit sorgfältigem Abwägen al-ler Therapieoptionen erfordert.
Der Begriff der AIH ist unscharf definiert und umfasst ein breites Spektrum an kli-nischen Manifestationen, das von der leichten oligosymptomatischen Hyper-thyreose bis zur lebensbedrohlichen thy-reotoxischen Krise reicht. Da Amioda-ron oft bei Patienten mit vorbestehen-den Herzerkrankungen mit entsprechend eingeschränkter kardialer Reserve einge-setzt wird, können insbesondere bei älte-ren Patienten stark erhöhte Schilddrüsen-hormonspiegel rasch zu einer lebensbe-drohlichen Dekompensation führen und erfordern daher zwingend ein zeitnahes und effizientes therapeutisches Handeln.
Gelegentlich gibt es Herzpatienten, die eine Hyperthyreose über längere Zeit gut tolerieren und bei denen die Hyper-thyreose auch unter fortgesetzter Amio-darontherapie – spontan und ohne The-rapie – wieder verschwindet. Bei stabi-len Patienten kann deshalb nach Diag-nose einer AIH ein abwartendes Verhal-ten unter engmaschiger Nachkontrolle ge-rechtfertigt sein. Zeigt sich allerdings eine klinische Verschlechterung, ist rasches Handeln gefordert. Das alleinige Abset-zen der Amiodarontherapie vermag das Problem meist nicht zu lösen, sondern ist im Gegenteil oft mit einer transienten Verschlechterung der klinischen Situation
verbunden [1, 5]. Die Therapie der AIH gestaltet sich daher individuell und rich-tet sich nach AIH-Subtyp, dem Schwere-grad der kardialen Grunderkrankung und der klinischen Einschätzung der Perspek-tiven des Krankheitsverlaufs (Allgemein-zustand, Nierenfunktion, vorbestehende Schilddrüsenpathologien). Da unter allei-niger medikamentöser Therapie oft länge-re Phasen einer thylänge-reotoxischen Belastung antizipiert werden müssen, soll bei Patien-ten mit entsprechendem Risiko frühzeitig eine totale Thyreoidektomie als definitive und rasch wirksame Behandlungsoption in Betracht gezogen werden [13].
Effekte von Amiodaron
auf die Schilddrüse
Pharmakologische Grundlagen
Amiodaron zeigt in seiner molekularen Struktur Ähnlichkeit mit Tetrajodthyro-nin (Thyroxin, T4) und TriojodthyroTetrajodthyro-nin (T3) und ist eine äußerst lipophile Sub- stanz mit großem Verteilungsvolumen [15]. Die Halbwertszeit beträgt 40–56 Ta-ge für Amiodaron und bis zu 130 TaTa-ge für Desethylamiodaron, den Hauptme-taboliten des Amiodaron [15]. Amioda-ron enthält in Gewichtsanteilen etwa 37%
Redaktion
P.K. Plinkert, Heidelberg B. Wollenberg, Lübeck
Jod, was bei üblichen Dosierungen von 200–600 mg/Tag eine Freisetzung von bis zu 21 mg freiem Jod bewirkt. Zum Ver-gleich: Der Tagesbedarf an Jod beträgt et-wa 0,2 mg und wird damit unter Thera-pie mit Amiodaron um bis das 100-Fache überstiegen [27]. Bei längerdauernder Einnahme von Amiodaron kommt es so zu einer extremen Zunahme des Körper-Jod-Pools, was sich konsekutiv in mona-telang erhöhten Jodwerten im 24-h-Urin respektive intrathyreoidal niederschlägt [15, 27].
Hyper- vs. Hypothyreose
Die Effekte von Amiodaron auf die Schilddrüse sind vielfältig und lassen sich grundsätzlich in obligate und nichtobli-gate Effekte einteilen. Obligat kommt es durch eine amiodaronassoziierte Hem-mung der peripheren Typ-I-Jodothyro-nin-5’-Dejodase zu einem Absinken der fT3-Serumspiegel in den unteren Norm-bereich und zu einem Anstieg der fT4-Se-rumspiegel in den oberen Normbereich, während die TSH-Werte im Normbereich bleiben [9]. Eine weitere obligate Fol-ge der Amiodarontherapie ist der Jodid- exzess, welcher über lange Zeit andauert und durch das erwähnt hohe Verteilungs-volumen und die lange Halbwertszeit be-dingt ist. Die Halbwertszeit kann noch zu-sätzlich verlängert werden durch eine vor-bestehende Vergrößerung der Schilddrü-se (Struma) oder eine eingeschränkte Nie-renfunktion. Der Jodidexzess per se führt aber nicht zwingend zu einer Schilddrü-senfunktionsstörung und die Mehrheit der Patienten entwickelt unter Amioda-ron entsprechend keine Schilddrüsendys-funktion.
Nichtobligate Effekte von Amiodaron auf die Schilddrüse sind schwer antizipier-bar und führen entweder zu einer hypo- oder einer hyperthyreoten Stoffwechsel-lage. Insgesamt entwickeln etwa 20% al-ler Patienten, die längerfristig mit Amio-daron behandelt werden, eine Schilddrü-senfunktionsstörung [19]. Die Art der thy-reoidalen Dysfunktion wird beeinflusst durch vorbestehende Schilddrüsenpatho-logien, eine allfällige Jodmangelexposi-tion und durch das Geschlecht des Patien-ten. Eine vorbestehende chronische Auto-immunthyreoiditis (Hashimoto) führt
be-sonders bei Frauen gehäuft zu einer hy-pothyreoten Stoffwechsellage, während ein vorbestehender M. Basedow oder ein toxisches (autonomes) Adenom eher für eine hyperthyreote Stoffwechsellage prä-disponieren [15]. In endemischen Jod-mangelgebieten werden unter Amioda-ron zudem häufiger Hyperthyreosen be-obachtet, während in Regionen mit suf-fizienter Jodzufuhr häufiger hypothyreo-te Reaktionen beobachhypothyreo-tet werden [17, 21].
Amiodaroninduzierte
Hyperthyreose
Prinzipiell kann sich eine AIH zu jedem Zeitpunkt während der Therapie mit Amiodaron manifestieren, sie kann aber auch noch jahrelang nach Beendigung der Therapie auftreten [17]. In Gebieten mit suffizienter Jodversorgung entwickeln ungefähr 3–5% aller Amiodaronpatien-ten eine AIH, während es in Jodmangel-gebieten mit bis zu 10–12% deutlich mehr sind [3, 21, 29].
Pathophysiologie
Pathophysiologisch unterscheidet man 2 Typen der AIH: Die Typ-I-AIH be-trifft i. d. R. Patienten mit vorbestehen-den Schilddrüsenerkrankungen, insbe-sondere jene mit multinodöser Struma oder einem manifesten/latenten M. Base-dow. Ursache ist eine gesteigerte Synthe-se von SchilddrüSynthe-senhormonen aufgrund des erhöhten Jodangebots [1]. Die Typ-II-AIH tritt vorwiegend bei Patienten ohne vorbestehende Schilddrüsendysfunktion auf. Sie ist bedingt durch eine gesteigerte Freisetzung von Schilddrüsenhormonen aufgrund einer destruktiven Thyreoidi-tis und gleicht damit der ThyreoidiThyreoidi-tis de Quervain, die ebenfalls zu einer transien-ten Hyperthyreose führt [1].
Klinik
Die klinische Manifestation der AIH zeigt häufig nicht das klassische Spekt-rum der hyperthyreoten Stoffwechsella-ge, da typische Symptome wie Schwitzen, Muskelzittern oder Tachykardien auf-grund der antiadrenergen Eigenschaften des Amiodarons maskiert werden kön-nen [19]. Insbesondere das Fehlen einer
Tachykardie kann die klinische Diagno-se einer HyperthyreoDiagno-se erschweren. Ty-pische Hinweise für eine AIH sind das Neu- oder Wiederauftreten von kardia-len Rhythmusstörungen, vermehrte pek-tanginöse Beschwerden bei vorbestehen-der koronarer Herzkrankheit ovorbestehen-der die Verschlechterung der Symptome einer vorbestehenden Herzinsuffizienz. An-dere Symptome einer Hyperthyreose, wie ungewollter Gewichtsverlust, Mus-kelschwäche, Unruhe, Verwirrung oder subfebrile Temperaturen können eben-falls auftreten [2].
Diagnostik
Laborchemisch manifestiert sich die AIH durch ein vollständig supprimiertes ba-sales TSH (TSH <0,01 µU/ml) und deut-lich erhöhte fT4-Serumspiegel, während fT3- oder Gesamt-T3-Serumspiegel nor-mal oder erhöht sein können [2, 15]. Nach Diagnose einer Hyperthyreose unter Therapie mit Amiodaron ist für das wei-tere therapeutische Vorgehen die Unter-scheidung zwischen einer jodinduzierten Typ-I-AIH oder einer durch eine destru-ierende Thyreoiditis verursachte Typ-II-AIH von Bedeutung [1]. Zur Differen-zierung der beiden Formen spielen kon-ventionell-sonographische Kriterien, die Farbdopplersonographie, die 24-h-Ra-diojodaufnahme und ggf. vorbestehen-de Schilddrüsenerkrankungen eine Rol-le [7, 20]. Die Bestimmung von InterRol-leu- Interleu-kin-6 oder des C-reaktiven Proteins zur Unterscheidung der beiden AIH-Subty-pen wird aufgrund mangelnder Spezifität nicht empfohlen [12, 24]. Für eine Typ-I-AIH sprechen der – in der Praxis seltene – positive Nachweis eines Radiojod-Up-takes, eine erhöhte Vaskularisierung der Schilddrüse in der Farbdopplersonogra-phie und das Fehlen einer vorbestehen-den Schilddrüsenerkrankung.
Vice versa deuten das Fehlen eines Ra-diojod-Uptakes, eine kaum nachweisbare Vaskularisierung der Schilddrüse in der Farbdopplersonographie und der Nach-weis einer vorbestehenden Schilddrü-senerkrankung (z. B. positive TRAK-An-tikörper bei M. Basedow) eher auf eine Typ-II-AIH hin. Im praktischen Alltag lassen sich Patienten allerdings häufig weder der Typ-I- noch der Typ-II-AIH
eindeutig zuordnen, und die Diagnostik zur genauen Typisierung der AIH wird dementsprechend nur selten ausgereizt.
Therapie
Das therapeutische Vorgehen bei AIH richtet sich in erster Linie nach der Aus-prägung der Symptomatik und dem AIH-Subtyp. Daneben müssen vorbestehende Schilddrüsenerkrankungen und die kar-diale Gesamtsituation berücksichtigt wer-den. Die Indikation für die Amiodaront-herapie muss überprüft und etwaige alter-native antiarrhythmische Therapien eva-luiert werden. Dabei stellt sich im Ein-zelfall stets die schwierige Frage, ob die Amiodarontherapie weitergeführt werden kann und soll. Die Literatur liefert diesbe-züglich keine konklusiven Antworten und entsprechende Empfehlungen bleiben va-ge [5, 6, 11, 19]. Im günstigsten Fall kommt es unter fortgeführter Amiodaronmedika-tion (mit oder ohne medikamentöse The-rapie der Hyperthyreose) zu einer Nor-malisierung der Schilddrüsenfunktion. Im Einzelfall ist der Verlauf aber kaum vorherzusehen, und eine rasche Korrek-tur der Hyperthyreose unter medikamen-töser Behandlung lässt sich nicht erzwin-gen. Auch nach Absetzen des Amiodar-ons und unter thyreostatischer Therapie dauert es oft mehrere Monate, bis sich die Schilddrüsenfunktion normalisiert. Für die Entscheidung bezüglich des the-rapeutischen Vorgehens und der Thera-piemodalität sollte zudem in Betracht ge-zogen werden, dass für gewisse kardiolo-gische Patienten kaum antiarrhythmische Alternativen zu Amiodaron bestehen und dass Amiodaron gerade auch im Rahmen einer Hyperthyreose einen gewissen kar-dioprotektiven Effekt haben kann [19, 23]. Die Entscheidung zur Therapiemodalität soll deshalb immer multidisziplinär er-folgen, unter Einbezug von Endokrinolo-gen und KardioloEndokrinolo-gen. Die etwaiEndokrinolo-gen Kon-sequenzen der verschiedenen Therapie-optionen müssen individuell antizipiert werden.
Medikamentöser Ansatz
Die medikamentöse Therapie der Typ-I-AIH umfasst in erster Linie den Einsatz von hochdosierten Thionamiden (z. B. Methimazol, 30–40 mg/Tag), welche evtl.
mit Natriumperchlorat kombiniert wer-den können [5, 18]. Zu wer-den methimazol-assoziierten Nebenwirkungen gehört die aplastische Anämie, was eine regelmäßige Blutbildkontrolle erfordert [25]. Die Typ-II-AIH spricht oft gut auf eine Therapie mit mäßig dosierten Kortikosteroiden (z. B. Prednison, 40–60 mg/Tag) an [1, 8]. Die meisten Patienten mit einer Typ-II-AIH können bei moderater Ausprägung der Symptomatik auch während der Kor-tikosteroideinnahme die Amiodaronthe-rapie weiterführen, und es kommt bei der Mehrzahl der Patienten zu einem Wieder-erlangen der euthyreoten Stoffwechsellage innerhalb von 3–4 Monaten [30]. Wie be-reits erwähnt, lassen sich Patienten häufig weder eindeutig der I- noch der
Typ-II-AIH zuordnen. Oft wird deshalb eine Kombinationstherapie mit Prednison und Methimazol initiiert, wobei ein rasches Ansprechen auf den Kortikosteroideffekt und somit auf die destruierende Thyreoi-ditis (AIH vom Typ II) hindeutet. Prognostische Überlegungen. Bezüg-lich der mittel- bis langfristigen Progno-se hat eine retrospektive Studie am Uni-versitätsspital Basel kürzlich auf eine be-trächtliche Morbidität und Mortalität von AIH-Patienten hingewiesen [10]. Proble-matisch ist insbesondere die ungünsti-ge katabole Trias aus Herzinsuffizienz, Hyperthyreose und Prednisontherapie. So wurden nach medikamentös thera-pierten AIH-Episoden wiederholt
un-Zusammenfassung · Abstract
HNO 2014 · 62:100–105 DOI 10.1007/s00106-013-2806-0 © Springer-Verlag Berlin Heidelberg 2014
C. Meerwein · D. Vital · M. Greutmann · C. Schmid · G.F. Huber
Totale Thyreoidektomie bei amiodaroninduzierter
Hyperthyreose. Wann übersteigt das Risiko der konservativen
Therapie das Risiko der chirurgischen Behandlung?
Zusammenfassung Amiodaron ist eine wichtige medikamentöse Option zur Behandlung ventrikulärer und su-praventrikulärer Arrhythmien. Die amioda- roninduzierte Hyperthyreose (AIH) ist eine gefürchtete Komplikation, welche eine in- terdisziplinäre Behandlung und ein sorgfälti-ges Abwägen der Risiken einer konservativen Therapie gegen das Risiko einer totalen Thy- reoidektomie erfordert. In diesem Beitrag be- leuchten wir die pharmakologischen Grund-lagen des Amiodarons und seine vielfältigen Effekte auf die Schilddrüse. Neben Überle- gungen zur Diagnostik und zu den Therapie-optionen berichten wir anhand einer Fallserie von unseren positiven Erfahrungen mit der totalen Thyreoidektomie bei AIH. Insbeson-dere für Patienten, welche zwingend auf eine Weiterführung der Amiodarontherapie an-gewiesen sind, stellt die Thyreoidektomie bei gutem Timing eine rasche und zuverlässige Behandlung der AIH mit geringen Komplika-tionsraten und einer sofortigen Verbesserung der Symptomatik dar. Schlüsselwörter Amiodaron · Schilddrüse · Hyperthyreose · Behandlung · Thyreoidektomie
Total thyroidectomy in patients with amiodarone-induced
hyperthyroidism. When does the risk of conservative
treatment exceed the risk of surgery?
Abstract Amiodarone plays a pivotal role in the treat- ment of ventricular and supraventricular ar-rhythmias. However, amiodarone-induced hyperthyroidism (AIH) is one of the most feared complications, which necessitates in- terdisciplinary treatment and careful bal-ancing of the risks of conservative treatment against those of total thyroidectomy. In this article we discuss the pharmacological as-pects of amiodarone and its diverse effects on the thyroid. Furthermore, we present di- agnostic and therapeutic strategies and re- port our positive experiences with total thy-roidectomy in patients with AIH. Particularly in patients for whom continuation of amiod-arone treatment is compulsory, a well-timed total thyroidectomy is a reliable therapeutic option, with minimal complication rates and immediate amelioration of symptoms. Keywords Amiodarone · Thyroid gland · Hyperthyroidism · Treatment · Thyroidectomy
Übersichten
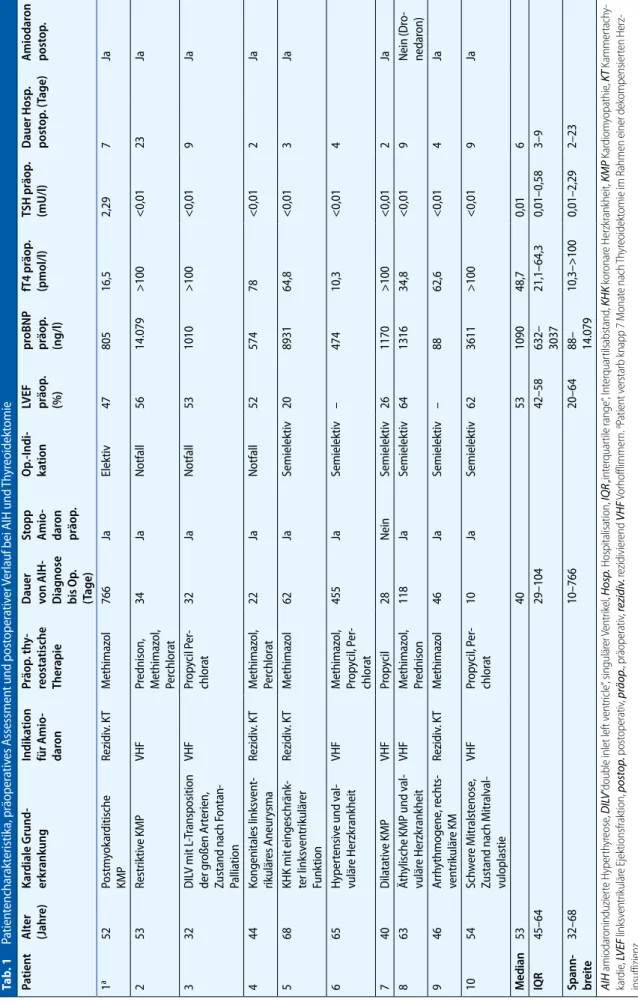
Ta b. 1 Pa tie nt en ch ar ak te ris tik a, p rä op er at iv es A ss es sm en t u nd p os to pe ra tiv er V er la uf b ei A IH u nd T hy re oi de kt om ie Pa tien t A lt er (Jahr e) Kar diale Grund- erk rankung Indik ation für A mio -dar on Pr äop . th y-reosta tische Ther apie Dauer von AIH-D iagnose bis O p. (T age) St opp A mio -dar on pr äop . O p.-I ndi -ka tion LVEF pr äop . (%) pr oBNP pr äop . (ng/l) fT4 pr äop . (pmol/l) TSH pr äop . (mU/l) Dauer Hosp . post op . ( Tage) A miodar on post op . 1 a 52 Po st m yo ka rd iti sc he KM P Re zi di v. K T M et hi m az ol 76 6 Ja El ek tiv 47 80 5 16 ,5 2, 29 7 Ja 2 53 Re st rik tiv e KM P VH F Pr ed ni so n, M et hi m az ol , Pe rc hl or at 34 Ja N ot fa ll 56 14 .0 79 > 10 0 < 0, 01 23 Ja 3 32 D IL V m it L-Tr an sp os iti on de r g ro ße n Ar te rie n, Zu st an d na ch F on ta n-Pa lli at io n VH F Pr op yc il Pe r-ch lo ra t 32 Ja N ot fa ll 53 10 10 > 10 0 < 0, 01 9 Ja 4 44 Ko ng en ita le s l in ks ve nt -rik ul är es A ne ur ys m a Re zi di v. K T M et hi m az ol , Pe rc hl or at 22 Ja N ot fa ll 52 57 4 78 < 0, 01 2 Ja 5 68 KH K m it ei ng es ch rä nk -te r l in ks ve nt rik ul är er Fu nk tio n Re zi di v. K T M et hi m az ol 62 Ja Se m ie le kt iv 20 89 31 64 ,8 < 0, 01 3 Ja 6 65 H yp er te ns iv e un d va l-vu lä re H er zk ra nk he it VH F M et hi m az ol , Pr op yc il, P er -ch lo ra t 45 5 Ja Se m ie le kt iv – 47 4 10 ,3 < 0, 01 4 7 40 D ila ta tiv e KM P VH F Pr op yc il 28 N ei n Se m ie le kt iv 26 11 70 > 10 0 < 0, 01 2 Ja 8 63 Ät hy lis ch e KM P un d va l-vu lä re H er zk ra nk he it VH F M et hi m az ol , Pr ed ni so n 11 8 Ja Se m ie le kt iv 64 13 16 34 ,8 < 0, 01 9 N ei n (D ro -ne da ro n) 9 46 Ar rh yt hm og en e, re ch ts -ve nt rik ul är e KM Re zi di v. K T M et hi m az ol 46 Ja Se m ie le kt iv – 88 62 ,6 < 0, 01 4 Ja 10 54 Sc hw er e Mi tr al st en os e, Zu st an d na ch Mi tr al va l-vu lo pl as tie VH F Pr op yc il, P er -ch lo ra t 10 Ja Se m ie le kt iv 62 36 11 > 10 0 < 0, 01 9 Ja M ed ia n 53 40 53 10 90 48 ,7 0, 01 6 IQ R 45 –6 4 29 –1 04 42 –5 8 63 2– 30 37 21 ,1 –6 4, 3 0, 01 –0 ,5 8 3– 9 Sp an n-br ei te 32 –6 8 10 –7 66 20 –6 4 88 – 14 .0 79 10 ,3 –> 10 0 0, 01 –2 ,2 9 2– 23 AI H a m io da ro ni nd uz ie rte Hy pe rth yr eo se , D ILV “d ou bl e in le t l ef t v en tri cl e”, si ng ul är er V en tri ke l, H os p. H os pi ta lis at io n, IQ R „ in te rq ua rti le ra ng e“ , In te rq ua rti lsa bs ta nd , K H K ko ro na re H erz kr an kh ei t, KM P Ka rd io m yo pa th ie , K T Ka m m er ta ch y-ka rd ie , L VE F lin ks ve nt rik ul är e Ej ek tio ns fra kt io n, p os to p. p os to pe ra tiv , p rä op ., p rä op er at iv, re zi di v. re zid iv ie re nd V H F V or ho ffl im m er n. aPa tie nt v er st ar b kn ap p 7 M on at e na ch Th yr eo id ek to m ie im R ah m en e in er d ek om pe ns ie rte n He rz -in su ffi zie nz .
günstige Verläufe beobachtet, bei denen es zu einem nicht mehr rehabilitierba-ren Verlust an Skelettmuskulatur gekom-men war. Es ist deshalb von entscheiden-der Bedeutung, Patienten mit Risikofak-toren für ein ungenügendes Therapiean-sprechen oder für das Auftreten substan-zieller medikamentenbedingter Neben-wirkungen zu erkennen und frühzeitig ein operatives Vorgehen zu evaluieren. Ande-rerseits kommt bei ambulanten Patienten mit vergleichsweise guter Herzfunktion, gutem Allgemeinzustand, kleiner Schild-drüse und normaler Nierenfunktion ein Abwarten der Therapieantwort durchaus in Betracht.
Chirurgische Behandlung
Bei Hochrisikopatienten mit imminenter kardialer Dekompensation ist ein exspek-tatives Vorgehen hinsichtlich der Frage, ob sie tatsächlich eine medikamentös-the-rapierefraktäre AIH entwickeln, beson-ders gefährlich. Bezüglich des optimalen Timings der Op. haben Studien gezeigt, dass das Ergebnis der absoluten Notfall-thyreoidektomie schlechter ist, als wenn der Eingriff am kardial noch stabilen Pa-tienten durchgeführt werden kann [14, 26]. Die Entscheidung zur Op. soll auf je-den Fall immer ein interdisziplinäres Ab-wägen der operativen Risiken gegenüber den Risiken einer monatelangen kardia-len Belastungssituation durch die hyper-thyreote Stoffwechsellage beinhalten. Das chirurgische Vorgehen besteht i. d. R. in der totalen Thyreoidektomie, da residuel-les Schilddrüsengewebe das Risiko eines Rezidivs birgt [22].
Bei Patienten, welche sich zum Zeit-punkt des Eingriffs in einer euthyreoten Stoffwechsellage befinden, ist die Op.-Technik unverändert zur elektiven Thy-reoidektomie. Bei hyperthyreoten Patien-ten wird präoperativ mittels Thyreostati-ka oder Schiller-Lösung („Plummerung“) versucht, den Patienten in Euthyreose zu bringen. Gerade bei Patienten mit AIH ist allerdings die präoperative „Plum-merung“ meist unwirksam, und es wird deshalb häufig auch unter Hyperthyreo-se operiert. Dabei soll die Op. schnell und durch einen routinierten Chirurgen erfol-gen. Die Op.-Technik wird insofern modi-fiziert, als dass alle zu- und v. a. abfließen-den Gefäße ligiert werabfließen-den (z. B.
Harmo-nic Focus®, Johnson and Johnson, USA), bevor eine Luxation der Schilddrüsen-lappen erfolgt. Auf diese Weise wird ver-hindert, dass unnötig viele Schilddrüsen-hormone in den Blutkreislauf gelangen und dadurch das Risiko für eine thyreo-toxische Krise minimiert. Der operati-ve Eingriff erfordert ein intensioperati-ves intra- und postoperatives Monitoring des Pa-tienten und eine interdisziplinäre Zusam-menarbeit von Chirurgen, Anästhesisten, Kardiologen und Endokrinologen. Insbe-sondere bei Anzeichen einer periopera-tiven thyreotoxischen Krise (Hyperther-mie, Tachykardie, Blutdruckschwankun-gen) ist eine intensivmedizinische Über-wachung unabdingbar.
Unbestrittene Vorteile der Thyreoidek-tomie liegen in der sofortigen Verbesse-rung der hyperthyreoten Stoffwechsellage und in der Möglichkeit, postoperativ die Amiodarontherapie bei entsprechender kardiologischer Notwendigkeit weiterzu-führen. Kürzlich erschienene Arbeiten zur perioperativen Mortalität und Morbidität haben ermutigende Resultate gezeigt, ins-besondere tolerierten auch schwer kran-ke Patienten mit deutlich eingeschränk-ter linksventrikulärer Auswurffraktion die Thyreoidektomie gut [13, 14, 28]. Auf-grund der kardialen Komorbiditäten der Patienten und je nach Dringlichkeit der Op. muss allerdings im Vergleich zur elek-tiven Thyreoidektomie bei Herzgesunden mit einem deutlich erhöhten perioperati-ven Risiko gerechnet werden [4, 16]. Erfahrungen am Universitätsspital Zü-rich. Zur Illustration des typischen Pa-tientenguts folgen an dieser Stelle unsere Erfahrungen mit 10 Patienten, bei denen am Universitätsspital Zürich eine totale Thyreoidektomie bei AIH erfolgte. Die In-dikation zur Amiodarontherapie bestand dabei bei 6/10 Patienten aufgrund eines Vorhofflimmerns und bei 4/10 Patienten aufgrund rezidivierender Kammertachy-kardien. Die mediane Dauer vom Zeit-punkt der Erstdiagnose einer AIH bis zur Thyreoidektomie betrug in unserem Kol-lektiv 40 Tage (Spannbreite: 10–766). Bei 9/10 Patienten wurde die Amiodaron- gabe nach Diagnose der AIH gestoppt und bei allen 10 Patienten wurde initial ein medikamentöser Therapieansatz versucht (. Tab. 1). Keiner der Patienten ließ sich
allerdings eindeutig einem Subtyp der AIH zuordnen. Vier Patienten wurden schließlich notfallmäßig bei kardialer De-kompensation und 5 Patienten semielek-tiv aufgrund ungenügenden Ansprechens auf die medikamentöse Therapie operiert. Bei einem Patienten entschloss man sich nach Erreichen einer euthyreoten Stoff-wechsellage unter medikamentöser The-rapie zu einer prophylaktischen Thyreoid-ektomie, da eine dringende Indikation zur Wiederaufnahme der Amiodarontherapie bestand.
Baseline-Charakteristika der Patien-tenkohorte inkl. Medianwerte sind in . Tab. 1 zusammengefasst. Echokardio-graphisch zeigten präoperativ 3/10 Patien-ten eine leichtgradig eingeschränkte und 2/10 Patienten eine schwer eingeschränk-te linksventrikuläre Auswurffraktion. La-borchemisch fanden sich bei 9/10 Patien-ten präoperativ ein erhöhter Pro-BNP-Wert und das klassische Bild der Hyper-thyreose mit erhöhten fT4- und suppri-mierten TSH-Werten. Perioperativ traten bei keinem Patienten relevante, chirurgie-assoziierte Komplikationen wie Rekur-rensparesen, revisionsbedürftige Nach-blutungen oder eine Tracheotomiebe-dürftigkeit auf. Im Fall des Patienten mit einer restriktiven Kardiomyopathie kam es während der ersten 2 postoperativen Tage zu einem transienten Hypoparathy-reoidismus, und beim Patienten mit uni-ventrikulärem Herzen nach Fontan-Pal-liation kam es perioperativ zu einem oli-gurischen Nierenversagen, das durch ein sorgfältiges Volumenmanagement ohne Notwendigkeit zum Nierenersatzverfah-ren im Verlauf rasch regredient war. Die mediane Hospitalisationsdauer postope-rativ betrug 6 Tage (Spannbreite: 2–23). Bei 8/10 Patienten wurde im Verlauf die Amiodarontherapie wieder etabliert, und bei allen Patienten kam es postoperativ zu einer deutlichen Stabilisierung der kardia-len Situation.
Fazit für die Praxis
F Die vorliegenden Daten unterstützen die Beobachtungen aus der Literatur, wonach die Thyreoidektomie bei gu- tem Timing eine rasche und zuverläs- sige Behandlung der AIH mit gerin-gen Komplikationsraten darstellt.
Übersichten
F In Einklang mit der Literatur schienen dabei in dieser kleinen Fallserie so-wohl Patienten im Notfallsetting bei akuter kardialer Dekompensation als auch bei semiselektiver Indikation aufgrund medikamentöser Therapie- refraktärität den Eingriff gut zu tole-rieren. F Die Möglichkeit der postoperativen Wiederaufnahme der Amiodaronthe-rapie ist für viele dieser Patienten die einzige Möglichkeit, ihre kardialen Ar-rhythmien zu kontrollieren. F Bedingung für ein gutes Gelingen der Op. ist eine optimale interdisziplinäre Zusammenarbeit zwischen Kardiolo-gen, Anästhesisten, Endokrinologen und Chirurgen und eine engmaschi-ge peri- und postoperative Betreuung der Patienten.