HAL Id: hal-02799471
https://hal.inrae.fr/hal-02799471
Submitted on 5 Jun 2020HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Effets d’une supplémentation nutritionnelle en cystéine
chez le rat âgé traité par cures au paracétamol
Charlène Pourpe
To cite this version:
Charlène Pourpe. Effets d’une supplémentation nutritionnelle en cystéine chez le rat âgé traité par cures au paracétamol. Alimentation et Nutrition. 2014. �hal-02799471�
49 Boulevard François Mitterrand INRA Site de Clermont-Ferrand/Theix 63000 CLERMONT-FERRAND 63122 SAINT-GENES-CHAMPANELLE
Master 2 « Sciences, Technologies, Santé » - Mention « Nutrition, Santé, Aliments » -
Spécialité Nutrition Humaine
Année universitaire 2013-2014
Effets d’une supplémentation nutritionnelle
en cystéine chez le rat
âgé traité par cures au paracétamol
Charlène POURPE
Responsable du Master : Didier ATTAIX
49 Boulevard François Mitterrand INRA Site de Clermont-Ferrand/Theix 63000 CLERMONT-FERRAND 63122 SAINT-GENES-CHAMPANELLE
Master 2 « Sciences, Technologies, Santé » - Mention « Nutrition, Santé, Aliments » -
Spécialité Nutrition Humaine
Année universitaire 2013-2014
Effets d’une supplémentation nutritionnelle
en cystéine chez le rat
âgé traité par cures au paracétamol
Charlène POURPE
Responsable du Master : Didier ATTAIXRemerciements
Mes remerciements s’adressent tout d’abord à Monsieur Yves BOIRIE, responsable de l’équipe de « Nutrition, Métabolisme et Masse Musculaire », pour m’avoir accueillie dans son équipe durant ces 6 mois de stage.
Je remercie particulièrement Madame Isabelle PAPET et Madame Carole MAST, de m’avoir encadrée et conseillée tout au long de ces 6 mois, et pour le temps qu’elles m’ont accordé dans la rédaction de ce rapport de stage.
Enfin, un grand merci à toutes les personnes de l’équipe, pour leur gentillesse, et l’aide qu’elles m’ont apportée.
Résumé
La sarcopénie se caractérise par une perte de la masse et de la force musculaire, et constitue, tout comme la médication, une composante majeure de la fragilité. Le paracétamol est l’antalgique le plus consommé par les personnes âgées. De plus, sa détoxification pourrait entrer en compétition avec les voies d’utilisation métabolique de la cystéine (synthèse des protéines et du glutathion (GSH)), et pourrait donc aggraver la sarcopénie. L’objectif est d’étudier l’effet d’une supplémentation en cystéine chez le rat âgé ayant subi un traitement chronique au paracétamol. L’expérience comprenait un lot paracétamol « P » (trois cures de deux semaines à 1% de paracétamol dans le régime, alternées de deux semaines de régime témoin), un lot contrôle « C » (régime témoin, pair-fed (PF) de « P »), et un lot supplémenté en cystéine « S » (traitement identique au lot « P » avec 0,5% de cystéine dans le régime de cure, PF de « P »). Le GSH hépatique et sanguin a été modifié par le traitement au paracétamol, ce qui n’a pas été le cas dans le muscle. Selon le muscle considéré, le traitement au paracétamol a eu peu ou pas d’effet sur la masse musculaire, et les protéines n’ont pas été modifiées dans le gastrocnemius. Les effets du traitement ont été peu importants, il est donc difficile de conclure quant à l’importance du rôle du paracétamol dans la sarcopénie. Cependant, la supplémentation en cystéine a été bénéfique puisqu’elle a permis de réduire tout ou partie des effets dus au paracétamol. L’intérêt de cette supplémentation reste donc à confirmer chez la personne âgée.
Mots-clé : sarcopénie, fragilité, paracétamol, cystéine, glutathion
Abstract
Sarcopenia is characterized by a loss of muscle mass and strength, and is, like medication, a major component of frailty. Acetaminophen (APAP) is the most consumed analgesic by elderly. In addition, its detoxification could compete with the metabolic pathways of cysteine (synthesis of proteins and glutathione (GSH)), and thus may exacerbate sarcopenia. The objective was to study the effect of cysteine supplementation in old rats chronically treated with APAP. Experiments were performed with an APAP group "P" (three cures of two weeks with 1 % of APAP in the diet, alternating with two weeks of control diet), a control group “C” (control diet pair-fed (PF) to "P "), and a group supplemented with cysteine "S" (the same treatment as “P” but the APAP diet was supplemented with 0.5% cysteine, PF to “P”). Blood and liver GSH have been modified by APAP treatment, but not muscle GSH. Depending on the muscle, APAP treatment had little or no effect on muscle mass, and proteins were not modified in gastrocnemius. Treatment effects were globally minor, so it is difficult to conclude on the importance of APAP in sarcopenia. However, cysteine supplementation was beneficial because it totally or partially reduced APAP’s effects. Thus, the potential benefit of cysteine supplementation remains to be confirmed in elderly.
Sommaire
INTRODUCTION ... 1
I) Etude bibliographique ... 2
I.1) Vieillissement et sarcopénie ... 2
I.1.1) Altérations de la composition corporelle au cours du vieillissement ... 2
I.1.2) Mécanismes impliqués dans la sarcopénie ... 2
I.1.3) Médication et statut nutritionnel ... 3
I.2) Le paracétamol ... 4
I.2.1) Généralités ... 4
I.2.2) Métabolisme du paracétamol ... 4
I.3) Cystéine et glutathion... 5
I.3.1) Sources alimentaires en cystéine ... 5
I.3.2) Synthèse endogène de cystéine... 5
I.3.3) Voies d’utilisation de la cystéine ... 6
I.3.4) Structure et fonction du glutathion ... 6
I.3.5) Synthèse, dégradation et homéostasie du glutathion ... 6
I.4) Etude précédente et objectif de travail ... 7
II) Matériel et méthodes ... 8
II.1) Expérimentation animale ... 8
II.1.1) Modèle murin ... 8
II.1.2) Période d’adaptation ... 8
II.1.3) Période expérimentale ... 9
II.1.3.1) Régimes administrés aux différents groupes ... 9
II.1.2.3) Prélèvements à l’euthanasie ... 10
II.2) Analyses biochimiques ... 10
II.2.1) Mesure des protéines de la réaction inflammatoire ... 10
II.2.1.1) α2-macroglobuline ... 10
II.2.1.2) Fibrinogène ... 11
II.2.2) Mesure des transaminases hépatiques ... 11
II.2.4) Dosage des protéines et des ARN totaux tissulaires et capacité ribosomale ... 12
II.2.4.1) Dosage des protéines tissulaires ... 12
II.2.4.2) Dosage des ARN totaux tissulaires-calcul de la capacité ribosomale . 13 II.2.5) Dosage des aminothiols totaux ... 13
II.2.5) Analyse statistique ... 14
III) Résultats et discussion ... 14
III.1) Survie des rats ... 14
III.2) Consommation alimentaire, poids et composition corporelle des rats ... 15
III.2.1) Consommation alimentaire ... 15
III.2.2) Poids des rats... 15
III.2.3) Composition corporelle des rats ... 16
III.3) Poids des organes ... 16
III.4) Inflammation et hépatotoxicité ... 17
III.4.1) Concentrations plasmatiques en α2-macroglobuline et fibrinogène ... 17
III.4.2) Concentrations plasmatiques des transaminases hépatiques ... 18
III.5) Glutathion total tissulaire ... 18
III.6) Protéines, ARN tissulaires et capacité ribosomale ... 19
III.7) Aminothiols plasmatiques totaux ... 20
CONCLUSION GENERALE ET PERSPECTIVES ... 21
Bibliographie ... 22 Annexe 1 ... I Annexe 2 ... II
Liste des abréviations
AA : acide aminé
AAS : acide aminé soufré ABC : acide bicinchoninique ADN : acide désoxyribonucléique α2M : alpha 2-macroglobuline ALT : alanine amino-transferase APC : acide perchlorique
ARN : acide ribonucléique
AST : aspartate amino-transferase ATC : acide trichloroacétique ATP : adénosine triphosphate « C » : lot contrôle
Cys : cystéine
Cys-Gly : cystéinyl-glycine
DTNB : acide 5,5’-dithio-bis -2-nitrobenzoïque EDL : extensor digitorum longus
ELISA : Enzyme-Linked Immuno-Sorbent Assay Hcy : homocystéine
CLHP : Chromatographie Liquide Haute Performance γ-GCS : γ-glutamyl-cystéine synthase
γ-Glu-Cys : γ-glutamyl-cystéine γ-GT : γ-glutamyltranspeptidase GS : glutathion synthase
GSH : glutathion
INRA : institut national de la recherche agronomique MG : masse grasse
MM : masse maigre
MPG : 2-mercaptopropionyl-glycine MRI : magnetic resonance imaging
NAD+ : nicotinamide adénine dinucléotide sous forme oxydée NADH, H+ : nicotinamide adénine dinucléotide sous forme réduite NAPQI : N-acétyl-p-benzoquinone-imine
“P” : lot soumis à trois cures de paracétamol à 1% dans le régime PF : pair-feed(ing)
“S” : lot soumis à trois cures de 1% de paracétamol dans le régime et supplémenté avec 0,5% de cystéine
SBD-F : ammonium-7-fluorobenzo-2-oxa-1,3-diazole-4-sulfonic acid SSA : acide sulfosalicylique
TCEP : tris-(2 carboxyethyl)-phosphine dihydrochloride TM : transméthylation
TNB : acide 5-thio-2-nitrobenzoïque TS : transsulfuration
Liste des tableaux
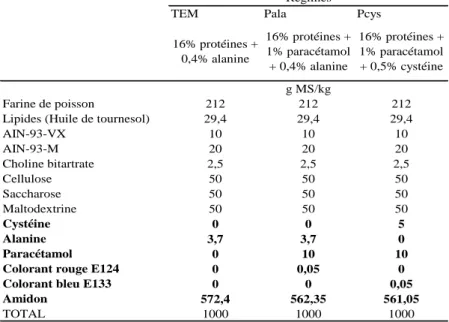
Tableau 1 : Composition détaillée des régimes expérimentaux
Tableau 2 : Concentrations des standards utilisés pour le dosage des aminothiols
plasmatiques totaux
Tableau 3 : Effet du paracétamol seul ou associé à la cystéine sur la consommation
alimentaire moyenne de chaque période
Tableau 4 : Effet du paracétamol seul ou associé à la cystéine sur le poids des rats à chaque
période
Tableau 5 : Effet du paracétamol seul ou associé à la cystéine sur la masse maigre (MM) et la
masse grasse (MG) des rats
Tableau 6 : Effet du paracétamol seul ou associé à la cystéine sur certains marqueurs de
l’inflammation (α2-macroglobuline et fibrinogène) et de l’hépatotoxicité (aspartate amino-transferase (AST) et alanine amino-amino-transferase (ALT))
Tableau 7 : Effet du paracétamol seul ou associé à la cystéine sur les concentrations et
quantités totales d’ARN hépatiques et musculaires, ainsi que sur la capacité ribosomale
Tableau 8 : Effet du paracétamol seul ou associé à la cystéine sur les aminothiols totaux
plasmatiques
Liste des figures
Figure 1 : Pyramides des âges en France métropolitaine au 1er janvier 2012 et projection 2060
Figure 2 : Imagerie par résonance magnétique à mi-cuisse d’un sujet jeune de 20 ans et d’un
sujet âgé de 64 ans
Figure 3 : Formule chimique du paracétamol Figure 4 : Métabolisme hépatique du paracétamol
Figure 5 : Structure des acides aminés soufrés protéinogènes (méthionine et cystéine) Figure 6 : Métabolisme de la cystéine
Figure 8 : Biosynthèse du glutathion
Figure 9 : Protocole de l’expérimentation animale Figure 10 : Principe du dosage ELISA
Figure 11 : Principe du dosage des transaminases hépatiques Aspartate amino-transferase
(AST) et alanine amino-transferase (ALT)
Figure 12 : Principe du dosage colorimétrique du glutathion avec recyclage enzymatique Figure 13 : Effet du paracétamol seul ou associé à la cystéine sur la consommation
alimentaire journalière des rats
Figure 14 : Effet du paracétamol seul ou associé à la cystéine sur le poids des muscles Figure 15 : Effet du paracétamol seul ou associé à la cystéine sur le poids du foie
Figure 16 : Effet du paracétamol seul ou associé à la cystéine sur les concentrations en GSH
sanguin, hépatique et musculaire et sur les quantités totales de GSH hépatique et musculaire
Figure 17 : Effet du paracétamol seul ou associé à la cystéine sur les concentrations en
protéines hépatiques et musculaires et sur les quantités totales de protéines hépatiques et musculaires
Liste des annexes
Annexe 1 : Effet du paracétamol seul ou associé à la cystéine sur l’évolution du poids
corporel des rats au cours du temps
Annexe 2 : Effet du paracétamol seul ou associé à la cystéine sur la masse maigre (MM) et la
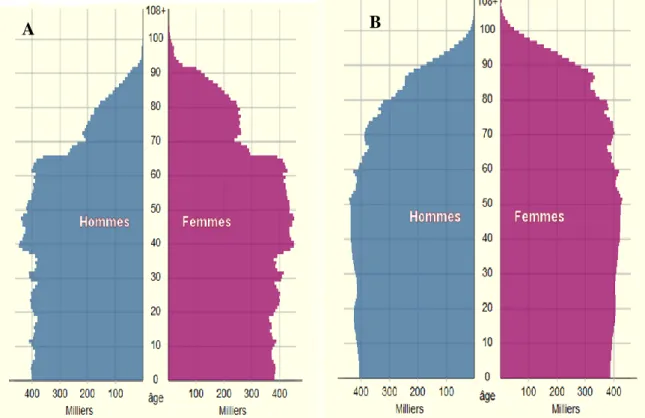
Figure 1 : Pyramide des âges en France métropolitaine au 1er janvier 2012 (A) et projection 2060 (B)
Source INSEE, Estimation de population, Projections de population 2007-2060 [2]
INTRODUCTION
En France, comme dans la plupart des pays occidentaux, le nombre de personnes âgées dans la population totale croît, et continuera d’augmenter fortement au cours des prochaines décennies : les 60 ans ou plus, qui représentent près d’un quart des habitants en 2012, constitueront un tiers de la population dans 50 ans [1] [2] (Figure 1). Les personnes âgées faibles et dépendantes sont donc de plus en plus nombreuses, c’est pourquoi le vieillissement de la population est communément présenté comme un facteur majeur de l’augmentation des dépenses de santé. La sarcopénie qui se caractérise par une perte de la masse, de la force et de la qualité musculaire constitue une composante majeure de la fragilité [3]. Il a été montré que la médication, fréquente chez les sujets âgés, pouvait contribuer à cette fragilité [4]. Toutefois, peu d’études ont ciblé l’interaction possible entre médicaments et sarcopénie.
Le paracétamol étant le médicament le plus prescrit contre les douleurs chroniques, chez les personnes âgées [5], cet antalgique constituerait un bon composé pour étudier cette interaction potentielle. En effet, sa détoxification pourrait entrer en compétition avec les voies d’utilisation métabolique de la cystéine (cys, acide aminé soufré (AAS) conditionnellement indispensable), à savoir, la synthèse protéique et la synthèse de glutathion (GSH) [6]. La consommation chronique de paracétamol pourrait donc être considérée comme un facteur important de l’altération musculaire rencontrée au cours du vieillissement.
Ce stage de deuxième année de Master s’est inscrit dans un projet de thèse qui avait pour premier objectif d’étudier les effets d’un traitement chronique au paracétamol sur la masse musculaire de rats adultes [6] et âgés [7]. Ces premières études ont permis de démontrer les effets délétères de ce composé qui semblent liés à une moindre disponibilité de la cys pour le muscle. Mes travaux de stage ont porté sur le deuxième objectif de la thèse qui consistait à déterminer si une supplémentation nutritionnelle en cys pouvait prévenir la perte de masse musculaire engendrée par le traitement au paracétamol.
Dans ce mémoire sera présentée une partie bibliographique incluant le lien entre paracétamol, cys et perte de masse musculaire. Le matériel et les méthodes utilisés seront détaillés par la suite. Enfin, les résultats seront présentés et discutés, et différentes perspectives seront envisagées sur cette étude.
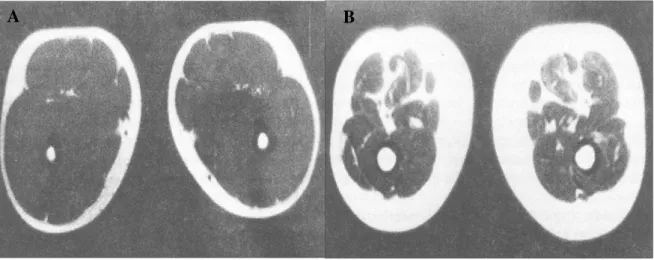
Figure 2 : Imagerie par résonance magnétique à mi-cuisse d’un sujet jeune de 20 ans (A) et
d’un sujet âgé de 64 ans (B)
(d’après Rosenberg, 1997 [9])
I) Etude bibliographique
I.1) Vieillissement et sarcopénie
I.1.1) Altérations de la composition corporelle au cours du vieillissement
Le vieillissement est associé à des changements importants de la composition corporelle qui ont une influence considérable sur les performances fonctionnelles et les capacités des personnes âgées à maintenir un style de vie sain. L’un des facteurs impliqué est la perte de masse maigre, et plus particulièrement de masse musculaire appelée sarcopénie. Ce syndrome se caractérise par une altération de la qualité du muscle et une diminution de la force et de la masse musculaire. Ainsi, alors que la musculature représente en moyenne 30 % du poids du corps entre 20 et 30 ans, elle ne constitue plus que 17 % à 70 ans [8] [9] (Figure
2). La sarcopénie est un facteur important de l’état de fragilité mais les mécanismes impliqués
ne sont pas encore clairement identifiés. En effet, de nombreux facteurs peuvent être en cause, mais nous n’aborderons dans ce mémoire que le stress oxydant, l’inflammation, l’état nutritionnel et l’altération du métabolisme musculaire.
I.1.2) Mécanismes impliqués dans la sarcopénie
La taille du compartiment musculaire dépend de la quantité de protéines totales du muscle qui résulte de l’équilibre entre synthèse et dégradation protéique [10]. Cet équilibre est sous la dépendance de nombreux facteurs qui peuvent être altérés au cours du vieillissement. La perte de masse musculaire résulte d’un déséquilibre entre synthèse et dégradation protéique, en faveur de la dégradation. Classiquement, cette perte est considérée comme progressive et de faible intensité [3]. Cependant, la sarcopénie pourrait aussi résulter d’épisodes cataboliques, qui entraineraient des pertes de masse musculaire beaucoup plus brutales, dont la récupération serait incomplète voire inexistante [11]. En effet, en cas de stress le muscle est l’organe dans lequel l’organisme vient puiser, puisqu’il constitue une réserve importante d’acides aminés (AA). De plus, l’extraction splanchnique de 1er
passage des AA est deux fois plus élevée chez des sujets âgés comparativement à des sujets jeunes [12], ce qui conduirait à une moins bonne disponibilité des AA pour les autres organes et en particulier pour le muscle. Par ailleurs, une résistance anabolique du muscle se met en place au cours du vieillissement et aboutit à une moindre réponse de la synthèse protéique à l’effet des nutriments [13]. L’altération du métabolisme protéique contribue donc au développement
de la sarcopénie. Ce syndrome peut également être mis en relation avec d’autres perturbations survenant avec l’avancée en âge.
Le vieillissement est en effet associé à une augmentation du stress oxydant conduisant à un risque élevé de développer des lésions oxydatives dans les muscles squelettiques [14]. Il a donc été suggéré que le stress oxydant pouvait avoir un rôle dans le développement de la sarcopénie [15]. Des données obtenues sur des muscles humains indiquent que certaines enzymes antioxydantes (catalase, glutathion transférase…) sont significativement diminuées dans les muscles de personnes âgées, comparativement à des muscles de sujets jeunes [15]. Cette diminution des défenses antioxydantes, associée à une augmentation des espèces oxydantes semble être à la base des maladies chroniques qui sont accompagnées d’une fonte musculaire au cours du vieillissement [16]. Il a été montré que des niveaux accrus d’inflammation chronique de bas grade induits par le stress oxydant, pouvaient agir au détriment du muscle squelettique aussi bien chez l’homme [14] que chez l’animal [17]. Chez le vieux rat, l’α2-macroglobuline (α2M) et le fibrinogène, deux protéines « positives » de la réaction inflammatoire, sont considérablement augmentées, et contribuent à la fragilité [18]. Pris ensemble, les effets du stress oxydant et de l’inflammation peuvent favoriser le catabolisme protéique musculaire, et fragiliser les personnes âgées, qui sont par ailleurs souvent fortement médicamentées et dénutries [4].
I.1.3) Médication et statut nutritionnel
Les personnes âgées consomment en moyenne de deux à cinq médicaments de manière régulière [19]. Cette prise de médicaments, associée à l’incidence élevée de pathologies au cours du vieillissement, peut avoir un impact considérable sur l’état nutritionnel, déjà diminué chez les personnes âgées, et sur la composition corporelle [4]. Les médicaments sont en effet fréquemment responsables d’une réduction de la prise alimentaire qui peut aboutir à une perte de poids importante, surtout en cas de traitement de longue durée. Une étude transversale réalisée chez des personnes âgées a révélé un risque trois fois plus important de subir une perte de poids (≥ 4,5 kg sur une période de 1 an) chez des personnes utilisant cinq médicaments ou plus comparativement à des personnes en consommant moins [20]. Chez les personnes âgées, dans un contexte d’apports protéiques faibles, la consommation de médicaments pourrait constituer un facteur supplémentaire impliqué dans la perte de masse musculaire. Les douleurs chroniques chez les personnes âgées sont classiquement traitées au paracétamol. Nous nous sommes donc particulièrement intéressés à
Figure 3 : Formule chimique du paracétamol
(http://www.theodora.com/drugs/ultracet_tablets_ortho_mcneil.html [21])
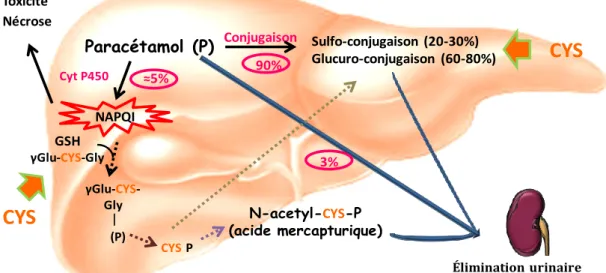
Figure 4 : Métabolisme hépatique du paracétamol
CYS : cystéine ; Cyt P450 : cytochrome P450 ; NAPQI : N-acétyl-p-benzoquinone-imine ; GSH : glutathion ; P : paracétamol
(d’après Manyike et al, 2000 [24]) Paracétamol (P) 3% Élimination urinaire Conjugaison 90% Sulfo-conjugaison (20-30%) Glucuro-conjugaison (60-80%) Cyt P450 NAPQI GSH
γGlu-CYS-Gly
CYS-P N-acetyl-CYS-P (acide mercapturique) Toxicité Nécrose
CYS
γGlu-CYS -Gly (P)CYS
≈5%ce composé très consommé, dont la détoxification pourrait réduire la disponibilité de la cys pour le muscle [6].
I.2) Le paracétamol I.2.1)Généralités
Le paracétamol (N-acétyl-para-aminophenol) (Figure 3) [21] est l’agent analgésique et antipyrétique le plus prescrit et consommé en France [5]. Ce composé est indiqué dans le traitement symptomatique des affections douloureuses et/ou fébriles en première intention [22]. Il est également fréquemment prescrit pour la thérapie à long terme pour les problèmes d’articulation comme la lombalgie [23]. Le paracétamol est très largement utilisé en raison de ses nombreux avantages : il agit rapidement et peut être obtenu sans prescription médicale et à faible coût. A doses thérapeutiques (0,5 à 4g/j en France), il est considéré comme un médicament sûr, qui présente peu d’effets secondaires et est majoritairement éliminé dans les urines [22].
I.2.2) Métabolisme du paracétamol
La détoxification du paracétamol est principalement réalisée dans le foie. A doses thérapeutiques, environ 3% du paracétamol est excrété dans l’urine inchangé, alors qu’environ 90% est métabolisé par conjugaison (Figure 4) [24]: soit par sulfo-conjugaison (20 à 30%), soit par glucuro-conjugaison (60 à 80%). Une faible proportion (moins de 5%) est transformée par le cytochome P450 en un composé intermédiaire toxique hautement réactif, le N-acétyl-p-benzoquinone imine (NAPQI). Ce composé est rapidement inactivé par liaison au résidu cys du GSH puis éliminé par voie urinaire, sous forme conjuguée à la cys ou à l’acide mercapturique [24]. Cependant, en cas de consommation excessive de paracétamol, les réactions de conjugaison deviennent saturées, provoquant ainsi une production excessive de NAPQI qui se lie alors aux protéines et aux structures subcellulaires. Cela induit une mort cellulaire rapide et une nécrose, pouvant conduire à des dommages hépatiques sévères [25], qui se manifestent par une élévation des enzymes hépatiques alanine amino-transférase (ALT) et aspartate-aminotransférase (AST) [26]. La cys étant un précurseur du sulfate et du GSH [27], sa disponibilité est indispensable pour assurer une bonne élimination du paracétamol.
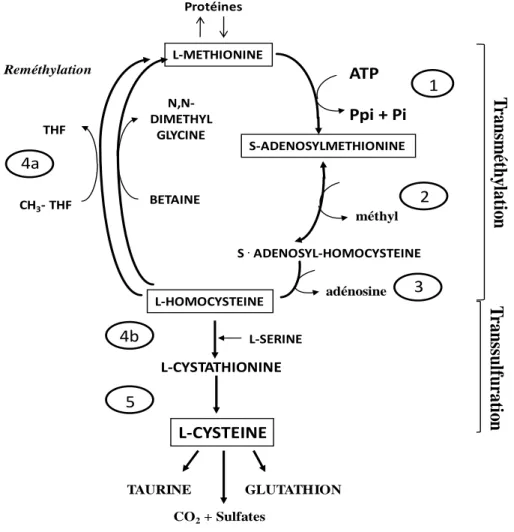
Figure 6 : Métabolisme de la cystéine
ATP : Adénosine triphosphate ; Ppi : phosphoinositol phosphate ; Pi : phosphate inorganique ; THF : tétrahydrofolate
1 : méthionine adénosyl transférase ; 2 et 4a: méthyltransférases ; 3: S-adénosylhomocystéine hydrolase ; 4b : cystathionine β-synthase ; 5 : cystathionine γ-lyase
(d’aprèsBrosnan et al, 2006 [31])
CH
3-
S
-CH
2-CH
2-CH-COO
-SH
-CH
2-CH-COO
-NH
3+NH
3+Méthionine
Cystéine
L-METHIONINE L-SERINE L-HOMOCYSTEINE L-CYSTATHIONINE L-CYSTEINE THF CH3- THF N,N-DIMETHYL GLYCINE BETAINE TAURINE GLUTATHION méthyl T ran sm ét h yl at io n T ran ss u lfu rat io n Reméthylation S .ADENOSYL-HOMOCYSTEINE CO2+ Sulfates Protéines 1 ATP Ppi + Pi S-ADENOSYLMETHIONINE adénosine 2 3 4a 4b 5I.3) Cystéine et glutathion
La biodisponibilité en cys repose sur son apport via l’alimentation, sa synthèse endogène par transsulfuration de la méthionine, ainsi que sa libération via la protéolyse ou la dégradation de GSH.
I.3.1) Sources alimentaires et besoins en cystéine
La cys est un AA conditionnellement indispensable. Elle peut donc provenir des apports directs en cet AA ou des apports en son principal précurseur, la méthionine, seul AAS indispensable (Figure 5). Ces deux AAS protéinogènes sont retrouvés dans les protéines alimentaires à des teneurs comprises entre 2 et 5%. Les protéines de céréales (riz, maïs, blé) et les protéines animales, sont plutôt riches en AAS (3,5 à 5%), à l’opposé des protéines de légumineuses qui ne contiennent que 2 à 3,5% de méthionine et cys. Certaines sources protéiques se distinguent cependant par leur richesse en cys : c’est le cas du blé (2,0 %), de l’œuf (2,2%), du colza (2,9) et de l’α-lactalbumine (6,9%) [28].
Les besoins alimentaires en AAS correspondent aux pertes oxydatives de ces AA qui sont en moyenne de 10,4 mg/kg/j pour la méthionine et de 4,1 mg/kg/j pour la cys. Cela représente donc un besoin journalier en AAS de 14,5 mg/kg [29]. Comme un apport en cys réduit le besoin en méthionine (effet d’épargne de la cys), le besoin en méthionine varie selon la richesse en cys de l’alimentation. Ainsi, le besoin moyen en méthionine en absence de cys alimentaire, est de 12,6 mg/kg/j, alors qu’il est seulement de 4,5 mg/kg/j, en présence d’un excès de cys alimentaire (21 mg/kg/j). Les recommandations en méthionine sont de 21 mg/kg/j en absence de cys alimentaire, et de 10,1 mg/kg/j en présence d’un excès de cys alimentaire (21 mg/kg/j) [30].
I.3.2) Synthèse endogène de cystéine
La synthèse de cys peut être réalisée au niveau hépatique à partir de la méthionine. Deux voies principales régulent le métabolisme de la cys: la transméthylation (TM) et la transsulfuration (TS) (Figure 6) [31]. La synthèse de cys passe par la formation d’un intermédiaire métabolique, l’homocystéine (Hcy), qui peut soit être reméthylée pour reformer de la méthionine, soit être orientée vers la synthèse de cys par TS. Le groupement thiol de l’Hcy est alors transféré sur la sérine pour former de la cystathionine, qui sera ensuite clivée en cys libre.
Figure 7 : Structure chimique du glutathion (GSH)
(d’après Bae et al, 1997 [34])
Figure 8 : Biosynthèse du glutathion (GSH)
γGCS : γ-Glutamylcysteine synthase ; GS : Glutathion synthase ; γGT : γ-Glutamyltranspeptidase (d’après Baudouin-Cornu et al, 2012 [36])
Glutamate
Cystéine
Glycine
Glutamate
γ-Glutamylcystéine
Cystéine
γ-Glutamylcystéinylglycine
(GSH)
Glycine
Glutamate
Cystéinylglycine
Glycine
1
2
3
4
I.3.3) Voies d’utilisation de la cystéine
La régulation du métabolisme de la cys a lieu principalement dans le foie, dans lequel elle est stockée et peut être distribuée aux autres organes sous forme de GSH, ou oxydée en cas d’apports excessifs [32]. La cys est indispensable dans la détoxification du paracétamol. Une étude réalisée chez le rat en croissance, a permis de mettre en évidence une inhibition de la croissance, suite à l’ajout de 1% de paracétamol dans le régime [33]. L’ajout de 0,5% de méthionine ou de cys permettait de rétablir la croissance. Ces données suggéraient que l’inhibition de la croissance était due à une déplétion en AAS au cours du métabolisme du paracétamol. La consommation de paracétamol semble donc représenter une utilisation non négligeable de cys, AA qui pourrait devenir limitant pour la synthèse protéique. La cys est également utilisée en tant que précurseur pour la synthèse de composés non protéiques essentiels à l’organisme, tels que la taurine, le sulfate inorganique ou encore le GSH [32].
I.3.4) Structure et fonctions du glutathion
Le glutathion (γ-glutamylcystéinylglycine) est un tripeptide composé de cys, glutamate et glycine (Figure 7) [34]. Il se présente sous deux formes : une forme réduite (GSH), qui est la forme prédominante (98% du GSH total), et une forme disulfure, lorsqu’il est oxydé (GSSG) [35]. Le GSH est impliqué dans de nombreuses fonctions biologiques puisqu’il joue un rôle important dans les défenses antioxydantes de l’organisme et la détoxification. Ainsi, il exerce un effet protecteur des cellules contre les radicaux libres, les espèces réactives de l’oxygène, et les métabolites réactifs du paracétamol ainsi que d’autres drogues [6] [35]. Le GSH peut également réaliser le stockage et le transport de cys, qui est très instable dans le milieu extracellulaire et s’oxyde spontanément et rapidement en cystine. Ainsi, le GSH permet l’approvisionnement en cys des tissus ne pouvant la synthétiser et il peut être mobilisé pour faire face aux besoins en cys [32].
I.3.5) Synthèse, dégradationet homéostasie du glutathion
La synthèse de GSH représente la principale utilisation non protéinogène de cys et peut avoir lieu dans toutes les cellules de l’organisme, le foie étant cependant, le site de production principal (Figure 8) [36]. La réaction de synthèse, consommatrice d’ATP, est catalysée par deux enzymes cytosoliques ubiquitaires, la γ-glutamylcystéinesynthase (γ-GCS) et la glutathion synthase (GS). La réaction catalysée par la γ-GCS permet, après réaction du
groupement carboxyle du glutamate avec le groupement aminé de la cys, la synthèse de γ-glutamylcystéine (γGlu-Cys). Ce composé réagit avec la glycine grâce à la GS, permettant ainsi la formation de GSH [35] [37]. La synthèse de GSH est fortement dépendante des concentrations en cys qui constitue l’AA limitant de la réaction. En effet, sa concentration intracellulaire hépatique est environ dix fois moins importante que celles de la glycine et du glutamate [38]. De plus, quand les concentrations en GSH deviennent trop importantes, le GSH lui-même peut exercer un rétrocontrôle négatif sur la γ-GCS [37].
Contrairement à sa synthèse, principalement réalisée au niveau intracellulaire, la dégradation du GSH se produit exclusivement dans l’espace extracellulaire. La γ-glutamyl-transpeptidase (γ-GT) catalyse la dégradation du GSH, qui implique le clivage et le transfert du groupement γ-glutamyl sur un autre AA accepteur (ou une hydrolyse pour libérer le glutamate). Cette enzyme permet également la libération de la cystéinyl-glycine (Cys-Gly) qui est ensuite clivée par une dipeptidase [36].
L’homéostasie du GSH résulte de sa synthèse et de son utilisation dans la cellule, ainsi que son export et sa dégradation. Les niveaux intracellulaires de GSH sont plutôt stables dans les organes extra-hépatiques mais peuvent varier de façon importante dans le foie en réponse à des modulations de l’apport en AAS, de l’état nutritionnel [39] ou dans des conditions de stress oxydant [40]. Ainsi, les concentrations hépatiques en GSH indiquent l’état des réserves en GSH de l’organisme, tandis que les concentrations plasmatiques reflètent le niveau d’export hépatique [41]. Le GSH hépatique a donc un rôle central dans l’homéostasie inter-organe du GSH et de la cys [42].
I.4) Etude précédente et objectif de travail
Le rôle du paracétamol dans l’aggravation de la sarcopénie a été mis en évidence chez le rat âgé, dans une étude précédemment conduite au laboratoire [7]. Dans cette étude, les rats âgés ont été soumis à trois cures de deux semaines à 1% de paracétamol dans le régime, alternées de deux semaines de récupération, sans paracétamol.
Ce traitement a induit une réduction de 11% de la masse musculaire, une diminution de 18% et 59% du GSH musculaire et hépatique respectivement, ainsi qu’une diminution de 30% de la cys libre, comparativement à un lot pair-fed (PF). Ces effets résulteraient de la diminution de la biodisponibilité en cys induite par la détoxification du paracétamol. En effet,
la diminution du GSH observée, pourrait contribuer à réduire son export ainsi que la disponibilité de cys au niveau périphérique.
Le but de la présente étude est donc de déterminer si une supplémentation nutritionnelle en cys chez le rat âgé pourrait augmenter la biodisponibilité de cet AA, afin de prévenir les pertes de masse musculaire et de GSH, induites par le traitement au paracétamol.
II) Matériel et méthodes
II.1) Expérimentation animale II.1.1) Modèle murin
Le protocole expérimental a été soumis au Comité d’Ethique en Matière d’Expérimentation Animale Auvergne et a reçu un avis favorable. Il a été enregistré sous le numéro CE 08-13 et a été réalisé dans l’Installation Expérimentale de Nutrition, animalerie de l’UNH, INRA de Theix.
La présente étude a été réalisée sur une cohorte de rats mâles Wistar âgés, fournis par Janvier (St Berthevin). Avant expérience, les rats ont été hébergés dans des cages collectives (3 rats par cage), dans des conditions contrôlées (température 20°C, 12h d’éclairement de 8h à 20h) et avec un accès libre à l’eau et à la nourriture, correspondant au régime standard A04 Scientific Animal Food and Engineering, composé de 16% de protéines, 3% de lipides, 60% de glucides, 12% d’eau, de fibres, de vitamines et de minéraux.
II.1.2) Période d’adaptation
Les animaux ont été placés en cages individuelles à l’âge de 20-21 mois (n= 144) dans un module avec cycle lumineux normal, et nourris avec un régime expérimental témoin (16% de protéines + 0,4% d’alanine) et de l’eau à volonté pendant quatre semaines. Au cours de cette période, les rats ainsi que leur consommation ont été pesés une fois par semaine. A la fin de la période d’adaptation, les rats ont été passés dans un analyseur de composition corporelle (Echo MRI) permettant de mesurer la masse maigre (MM) et la masse grasse (MG). Cinq rats présentant différentes pathologies ont été euthanasiés pendant la période d’adaptation. Les rats ont ensuite été divisés en trois groupes : un groupe contrôle noté « C » (n= 46), un groupe supplémenté en paracétamol noté « P » (n=46), et un groupe supplémenté en paracétamol et
Tableau 1 : Composition détaillée des régimes expérimentaux
Figure 9 : Protocole de l’expérimentation animale
Régime TEM : 16% protéines + 0,4% alanine
Régime Pala : 16% protéines + 1% paracétamol + 0,4% alanine
Régime Pcys : 16% protéines + 1% paracétamol + 0,5% cystéine
PF : pair-fed ; récup : récupération
TEM Pala Pcys
16% protéines + 0,4% alanine 16% protéines + 1% paracétamol + 0,4% alanine 16% protéines + 1% paracétamol + 0,5% cystéine Farine de poisson 212 212 212
Lipides (Huile de tournesol) 29,4 29,4 29,4
AIN-93-VX 10 10 10 AIN-93-M 20 20 20 Choline bitartrate 2,5 2,5 2,5 Cellulose 50 50 50 Saccharose 50 50 50 Maltodextrine 50 50 50 Cystéine 0 0 5 Alanine 3,7 3,7 0 Paracétamol 0 10 10
Colorant rouge E124 0 0,05 0
Colorant bleu E133 0 0 0,05
Amidon 572,4 562,35 561,05 TOTAL 1000 1000 1000 Régimes g MS/kg Contrôle « C » Paracétamol « P » Paracétamol + Cystéine « S » Régime TEM
Régime Pala Régime TEM Régime Pala Régime TEM Régime PAla
0 2 4 6 8 10 0 10
0 2 4 6 8 10
Régime PCys Régime TEM Régime PCys Régime TEM Régime PCys
Cure1 Cure2 Cure3
Cure1 Cure2 Cure3
semaines semaines semaines PF PF Récup 1 Récup 2 Récup 1 Récup 2
cys noté « S » (n=47). La mise en lot a été réalisée de façon à obtenir trois groupes semblables et homogènes pour la consommation alimentaire, le poids corporel et la composition corporelle.
II.1.3) Période expérimentale
II.1.3.1) Régimes administrés aux différents groupes
Les régimes expérimentaux contenaientde la farine de poisson comme source protéique, et ont été distribués sous forme de croquettes. Trois régimes différents ont été préparés par l’UPAE (Unité de Préparation des Aliments Expérimentaux de Jouy-en-Josas) (Tableau 1) :
Régime TEM : 16% de protéines + 0,4% d’alanine
Régime Pala : 16% de protéines + 1% de paracétamol + 0,4% d’alanine Régime PCys : 16% de protéines + 1% de paracétamol + 0,5% de cys
Les rats du lot « C » ont consommé le régime témoin standard durantles dix semaines d’expérimentation (TEM) (Figure 9). Les rats du lot « P » ont reçu trois cures de deux semaines au paracétamol (Régime PAla), chacune d’elles ayant été espacées de deux semaines de régime TEM. Les rats du lot « S » ont aussi été soumis aux trois cures de deux semaines au paracétamol, additionnées d’une supplémentation en cys (Régime PCys), cures également séparées de deux semaines de régime TEM. Le régime contenant 1% de paracétamol, correspond à la prise maximale autorisée chez l’homme de 4g/j, avec une alimentation quotidienne de 400g de matière sèche. La suppémentation avec 0,5% de cys, permet théoriquement de compenser les pertes engendrées par la détoxification du paracétamol à la dose utilisée [6]. Les régimes TEM et Pala ont été supplémentés en alanine afin d’être isoazotés avec le régime PCys. Les rats du lot « P » étaient limités à 23g de régime par jour, afin d’éviter des variations trop importantes de l’ingéré. Le paracétamol pouvant induire une baisse transitoire de l’ingéré, les consommations journalières des lots « C » et « S » ont été ajustées à celle du lot « P » (pair-feeding, ou PF) durant toute la période expérimentale. Pour cela, l’ingéré et les refus ont été mesurés quotidiennement. Le poids corporel a été mesuré deux fois par semaine et lacomposition corporelle a été évaluée par Echo MRI à chaque début et fin de cure, ainsi que le jour de l’euthanasie.
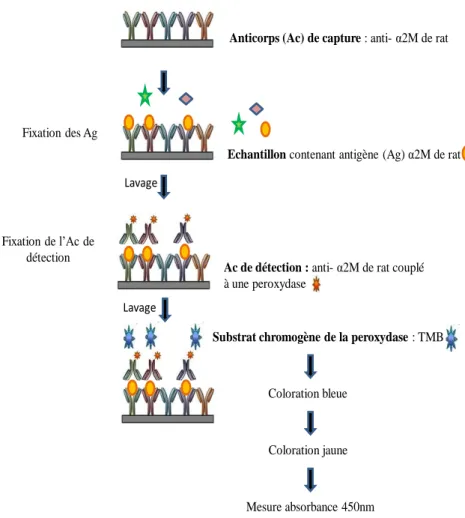
Figure 10 : Principe du dosage ELISA
α2M : α2-macroglobuline ; TMB : 3,3’5,5’-tetramethylbenzidine
Anticorps (Ac) de capture : anti- α2M de rat
Echantillon contenant antigène (Ag) α2M de rat Fixation des Ag
Lavage
Ac de détection : anti- α2M de rat couplé à une peroxydase
Fixation de l’Ac de détection
Lavage
Substrat chromogène de la peroxydase : TMB
Coloration bleue
Coloration jaune
II.1.2.3) Prélèvements à l’euthanasie
La veille de l’euthanasie, la consommation alimentaire a été limitée à 12 g, afin de s’assurer que chaque rat ait le même ingéré, et soit en phase post-absorptive lors de l’injection du traceur, pour la mesure de la synthèse protéique. Avant euthanasie, une partie des rats (n= 66) a donc reçu dans la veine de la queue, une large dose de Valine 13C (Euriso-top, 150µmol/100g de poids corporel ; enrichissement : 100% ; 60mg/mL sérum physiologique soit 0,3 mL/100g de poids vif).
L’euthanasie a été réalisée par exsanguination par ponction dans l’aorte abdominale, 20 mn après injection du traceur, après anesthésie au pentobartital sodique par voie intra-péritonéale (6mg ip/100g de poids corporel, 0,1 mL/100g de poids corporel).
Un aliquot de 1mL de sang, additionné d’EDTA (Ethylène Diamine TetraAcétique, 100µL EDTA tétrasodique 200mM dans sérum physiologique/mL sang) a été centrifugé 5mn à 12000 x g (4°C). Le reste du sang a été transféré dans un tube hépariné (50µL héparine Choay®, 25000 UI/5mL sang), une partie ayant été conservée, l’autre ayant été centrifugée 15mn à 2000 x g. Les échantillons de sang et de plasma ont été congelés dans l’azote liquide puis conservés à -80°C avant d’être analysés.
Le foie a été prélevé, rincé dans du sérum physiologique, pesé et congelé dans l’azote liquide. Les muscles gastrocnemius, EDL (Extensor Digitorum Longus), soleus et tibialis
anterior ont été disséqués de la patte arrière gauche et pesés. Le gastrocnemius a été congelé
dans l’azote liquide et stocké à -80°C avant d’être analysé.
II.2) Analyses biochimiques
II.2.1) Mesure des protéines de la réaction inflammatoire II.2.1.1) α-2 macroglobuline
Afin de mesurer le statut inflammatoire des animaux, l’α2M plasmatique a été dosée à l’aide d’un kit ELISA (Enzyme-Linked-ImmunoSorbentAssay) (Réf E-25A2M, Immunology Consultants Laboratory, Inc, USA) [18]. Ce test utilise la technique des « sandwichs » en phase solide (Figure 10). Un anticorps de capture anti-α2M de rat, est pré-appliqué à l’intérieur des puits d’une microplaque. Une gamme étalon (8 points de 0 à 400ng/mL), les échantillons (dilués au 1/100 et 1/300), ainsi qu’un contrôle de concentration
Figure 11 : Principe du dosage des transaminases hépatiques aspartate amino-transferase
(AST) et alanine amino-transferase (ALT)
L-Aspartate + 2-Oxoglutarate L-Glutamate + 2-Oxaloacétate
Oxaloacétate + NADH,H+ L-Malate + NAD+
Mesure de la décroissance de l’absorbance à 340 nm
L-Alanine + 2-Oxoglutarate L-Glutamate + Pyruvate Pyruvate + NADH, H+ D-Lactate + NAD+
Mesure de la décroissance de l’absorbance à 340 nm
AST MDH H
ALT LDH
connue, ont ensuite été mis en contact des anticorps de capture, qui réagissent avec leur épitope spécifique. Après lavage des éléments non liés, un anticorps de détection anti-α2M de rat couplé à une peroxydase, est introduit dans les puits. Le «sandwich» est alors constitué. Après élimination de l’anticorps superflu, le substrat chromogène est mis au contact de la peroxydase. Une coloration bleue se développe alors, et se transforme en jaune après ajout de la solution d’arrêt. L’intensité de la coloration est ainsi représentative de la quantité d’α2M fixée aux anticorps, et celle-ci est quantifiée par lecture de l’absorbance à 450nm grâce à un lecteur de microplaques.
II.2.1.2) Fibrinogène
Le fibrinogène a été dosé dans le plasma, par méthode turbidimétrique au sulfate d’ammonium [43]. Le trouble créé par la précipitation du fibrinogène est mesuré par absorbance à 340nm par l’automate Pentra 400 (ABX Pentra 400, Horiba, Montpellier, France). Un standard de référence (référence 00519, Stago) de concentration en fibrinogène connue (2,5 g/L), est utilisé pour la calibration de l’appareil. Un pool de plasma contrôle (concentration = 1,10g/L), obtenu chez le rat est dosé en même temps que les échantillons.
II.2.2) Mesure des transaminases hépatiques
Les mesures d’AST et d’ALT ont été réalisées sur des échantillons de plasma, grâce à l’automate Pentra 400 avec deux cassettes spécifiques au dosage des deux enzymes (Réf AST : A11A01629 ; Réf ALT : A11A01627, Horiba, Montpellier, France). L’AST catalyse la conversion de l’aspartate en glutamate et oxaloacétate (Figure 11). L’oxaloacétate est ensuite converti en malate par la malate déshydrogénase en présence de NADH,H+ qui est oxydé en NAD+. La disparition du NADH est mesurée à 340nm, et est proportionnelle à la quantité d’oxaloacétate formée, qui dépend de l’activité enzymatique de l’AST présente dans l’échantillon plasmatique. Le principe est le même pour le dosage de l’ALT, seuls l’enzyme additionnelle et les produits formés diffèrent du dosage de l’AST (Figure 11).
II.2.3) Dosage du glutathion total tissulaire
Le GSH tissulaire a été dosé sur le gastrocnemius et le foie, qui ont été broyés après refroidissement dans l’azote liquide. Le tissu refroidi a été introduit dans un pot contenant une
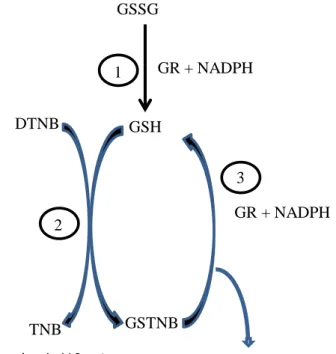
Réaction 1 : GSSG + NADPH + H+ 2GSH + NADP+ Réaction 2 : GSH + DTNB GS-TNB + TNB
Réaction 3 : GS-TNB + NADPH+H+ GSH + TNB + NADP+
Figure 12 : Principe du dosage colorimétrique du glutathion avec recyclage enzymatique
DTNB : acide 5,5’-dithio-bis -2-nitrobenzoïque ; TNB : acide 5-thio-2-nitrobenzoïque : GSSG : glutathion sous forme oxydée ; GSH : glutathion sous forme réduite ; GR : glutathion réductase ; NADPH : Nicotinamide adenine dinucleotide phosphate (forme réduite) ; GSTNB : produit de la réaction entre le GSH et le TNB
(d’après Tietze et al, 1969 [44]) GSSG GR + NADPH GSH GR + NADPH GSTNB TNB (absorption à 412nm) DTNB TNB (absorption à 412nm) 1 2 3
bille. Cet ensemble a permis l’obtention d’une poudre, après homogénéisation au broyeur à bille. Le GSH a également été mesuré sur le sang total.
Un échantillon de poudre (100-200 mg) a été homogénéisé dans un tampon d’extraction (acide perchlorique, APC 2% + 5mM EDTA), avec un broyeur Polytron. Après centrifugation (15 mn à 14000 x g), le GSH total a été mesuré dans le surnageant. Pour le sang total, les échantillons ont été soumis à une déprotéinisation, réalisée par ajout de 100µL d’acide sulfosalicylique (SSA 50%) à 1mL d’échantillon prélevé sur EDTA. Après homogénéisation au vortex et centrifugation, le GSH total a été mesuré sur le surnageant par technique colorimétique, sur l’automate Pentra 400 selon le principe suivant : après extraction acide du glutathion total (réduit (GSH) et oxydé (GSSG)), la glutathion réductase (GR) réduit le GSSG en présence de NADPH réduit (Figure 12) [44]. Le GSH réagit avec le DTNB (acide 5,5’-dithio-bis -2-nitrobenzoïque) pour produire un chromophore, le TNB (acide 5-thio-2-nitrobenzoïque, absorbance maximale à 412nm), ainsi que du GS-TNB. La régénération du GS-TNB par la glutathion réductase, permet la libération de GSH et de TNB. Ce cycle de régénération amplifie la réaction colorimétrique, la vitesse de formation du TNB étant dépendante de la quantité totale de GSH présente dans l’échantillon [44].
La calibration est réalisée avec une gamme d’étalonnage établie à partir d’une solution de GSH standard à 25µmol/L. L’automate réalise les dilutions des différents extraits : dilution d’un facteur trois pour le gastrocnemius, vingt pour le foie et cinquante pour le sang.
II.2.4) Dosage des protéines et des ARN totaux tissulaires et capacité ribosomale
A partir d’un échantillon de poudre de tissu (foie et muscle) (100-200 mg), les protéines et les acides nucléiques (ADN et ARN) sont séparés des acides aminés libres par précipitations successives à l’acide trichloroacétique (ATC). L’ajout de soude (0,3N) permet la solubilisation des protéines et l’hydrolyse des ARN, après 2h à 37°C, avec agitation régulière au vortex.
II.2.4.1) Dosage des protéines tissulaires
Les protéines ainsi extraites, sont dosées en micro-plaques selon la méthode de Smith [45]. Les protéines sont mélangées à une solution alcaline de couleur verte contenant de l’acide bicinchoninique (ABC) et des ions cuivriques Cu2+
. Les ions Cu2+ sont réduits en Cu+ par les liaisons peptidiques des protéines. L’ABC chélate les ions Cu+ pour former un
complexe soluble de couleur violette. L’intensité de la coloration mesurée à 562 nm est proportionnelle à la concentration en liaisons peptidiques de l’échantillon. Les échantillons ont été dilués d’un facteur 18 pour le gastrocnemius et d’un facteur 20 pour le foie. La concentration en protéines de l’échantillon a ensuite été calculée à l’aide d’une courbe standard obtenue avec de l’albumine de sérum bovin (8 points de 0 à 1 mg/L).
II.2.4.2) Dosage des ARN totaux tissulaires et calcul de la capacité ribosomale
L’extrait sodique obtenu à partir des tissus est traité à l’APC et centrifugé (20 mn à 8000 x g, 4°C), afin de précipiter les protéines et les ADN. Les ARN sont dosés dans le surnageant à l’aide d’un spectrophotomètre UV (UVIKON XS Bio-Tek P100S) après dilution des échantillons de muscle et de foie, d’un facteur 20 et 5 respectivement. Les liaisons des bases puriques et pyrimidiques, constituantes des acides nucléiques, ont un très fort pouvoir absorbant dans l’ultraviolet, avec un maximum d’absorption vers 260 nm et un minimum vers 232 nm. La mesure à 232 nm permet d’estimer la part de contaminants dans l’extrait.
Les concentrations en ARN du muscle ont été calculées à l’aide de la formule de Garlick ((10,53(3,124 A260 – 0,5802 A232))) [46] et celles du foie à l’aide de la formule de Munro et Fleck ((10,53 (3,4 A260 – 1,44 A232) [47].
La quantité d’ARN totaux rapportée à la quantité de protéines, exprime la capacité ribosomale dans la mesure où 80% des ARN totaux sont des ARN ribosomaux. Ce ratio représente le potentiel de synthèse protéique d’un tissu [48].
II.2.5) Dosage des aminothiols totaux
Les aminothiols plasmatiques totaux c’est-à-dire les formes libres ou liées aux protéines plasmatiques (cys, Glu-Cys, Hcy, Cys-Gly et GSH) ont été dosés par CLHP (Chromatographie Liquide Haute Performance) [49]. Les échantillons de plasma sont mélangés à du 2-mercaptopropionyl-glycine (MPG), qui constitue le standard interne. Les ponts disulfures des composés contenus dans l’échantillon sont ensuite réduits par action du Tris-(2-carboxyethyl)-phosphine dihydrochloride (TCEP). Les protéines sont ensuite précipitées par l’ATC. L’addition d’ammonium-7-fluorobenzo-2-oxa-1,3-diazole-4-sulfonic acid (SBD-F) conduit après 1h d’incubation à 60°C, à la formation d’un dérivé fluorescent
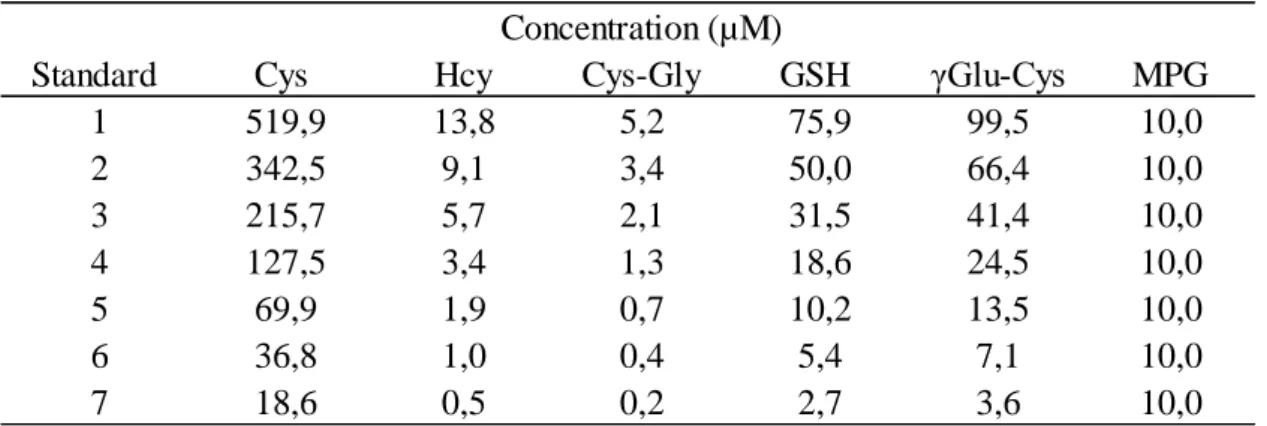
Tableau 2 : Concentrations des standards utilisés pour le dosage des aminothiols
plasmatiques totaux
Cys : cystéine ; Hcy : homocystéine ; Cys-Gly : cystéinyl-glycine ; GSH : glutathion ; γ Glu-Cys : γ-glutamyl-cystéine
Standard Cys Hcy Cys-Gly GSH γGlu-Cys MPG
1 519,9 13,8 5,2 75,9 99,5 10,0 2 342,5 9,1 3,4 50,0 66,4 10,0 3 215,7 5,7 2,1 31,5 41,4 10,0 4 127,5 3,4 1,3 18,6 24,5 10,0 5 69,9 1,9 0,7 10,2 13,5 10,0 6 36,8 1,0 0,4 5,4 7,1 10,0 7 18,6 0,5 0,2 2,7 3,6 10,0 Concentration (µM)
détectable par CLHP (λ excitation = 385 nm, λ émission = 515 nm). Les composés sont élués grâce à deux phases mobiles : phase A (tampon acétate 97%/méthanol 3%) et phase B (80% phase A/20% méthanol). La séparation a été réalisée dans une colonne chromatographique (Thermo Scientific Hypersil Gold, Réf 25003-154630) sur une chaine CLHP (Alliance Waters). Des gammes d’étalonnage pour chaque composé plasmatique ont été réalisés (Tableau 2) et permettent de calculer les concentrations des aminothiols plasmatiques.
II.2.6) Analyse statistique
Les résultats sont présentés sous forme de médianes avec les erreurs standards à la médiane (SE). Les différences inter-lots et intra-lots ont été analysées à l’aide de tests statistiques non paramétriques, car un grand nombre de variables ne suivait pas la loi de distribution normale (test de Shapiro Wilk, P < 0,05), ou les variances inter-lots étaient significativement différentes (test de Fischer, P < 0,05). Le test de Wilcoxon a été réalisé pour analyser l’effet temps sur l’ingéré, le poids et la composition corporelle (P < 0,05). Le test de Mann-Whitney Wilcoxon a été utilisé pour analyser les différences entre les lots pris deux à deux. L’estimateur de Hodges Lehman, qui estime la différence entre les médianes de deux lots, a été utilisé pour le calcul des pourcentages de variation. L’analyse statistique a été réalisée avec les logiciels Statview (version 5, SAS Institute, Cary NC, USA) et R 3.0.2. Les différences ont été considérées comme significatives pour une valeur de P < 0,05.
III)Résultats et discussion III.1) Survie des rats
Le nombre initial de rats était de 46 pour les lots « C » et « P », et de 47 pour le lot « S ». Neuf rats du lot « P » sont morts (naturellement ou euthanasiés pour cause de pathologies) au cours du traitement, ainsi que neuf rats du lot « C » et dix rats du lot « S ». Le pourcentage de survie était respectivement de 80% pour les rats des lots « P » et « C » et de 79% pour les rats du lot « S ». Le traitement au paracétamol seul ou associé à la cys n’a donc pas eu d’effet sur la mortalité des rats vieillissants. Par ailleurs, quatre rats ont été exclus après analyse des résultats. En effet, deux rats du lot « C » commençaient à développer une paralysie au niveau des pattes arrières, un rat du lot « P » avait un poids musculaire total (somme des quatre muscles étudiés) anormalement faible (1,6g vs 2,8g +/- 0,14), et un rat du
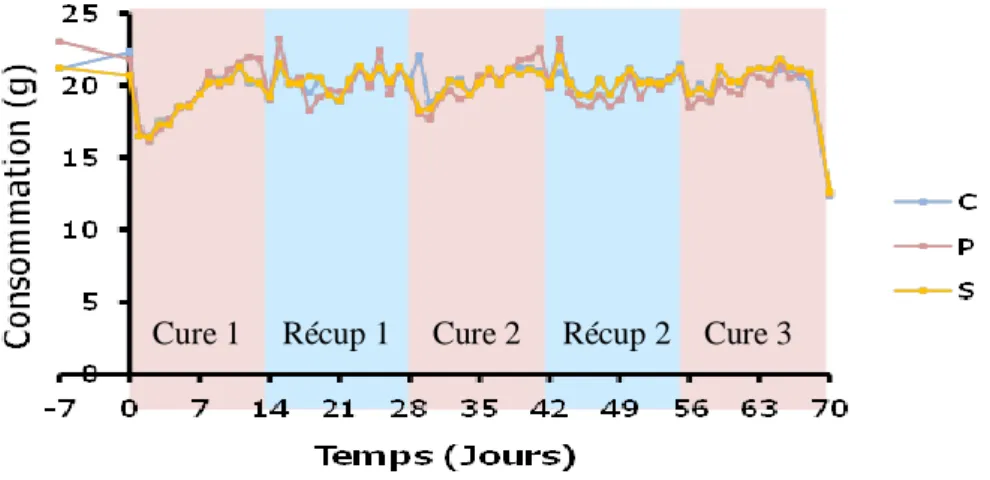
Figure 13 : Effet du paracétamol seul ou associé à la cystéine sur la consommation
alimentaire journalière des rats
« C » : lot contrôle ; « P » : lot soumis à 3 cures de paracétamol (1%) ; « S » : lot soumis à 3 cures de paracétamol (1%) + cystéine (0,5%) ; Récup : récupération. n = 35 « C » ; 36 « P » ; 36 « S »
Tableau 3 : Effet du paracétamol seul ou associé à la cystéine sur la consommation
alimentaire moyenne de chaque période
Tableau 4 : Effet du paracétamol seul ou associé à la cystéine sur le poids des rats à chaque
période
Tableaux 3 et 4 : Pas de différence significative entre les lots pour chaque période, test de Mann-Whitney Wilcoxon (P > 0,05). Pour le lot « P», les médianes qui n’ont aucune lettre en commun sont significativement différentes, test de Wilcoxon (P < 0,05). † « S » vs « P » (P < 0,05)
C » : lot contrôle ; « P » : lot soumis à 3 cures de paracétamol (1%) ; « S » : lot soumis à 3 cures de paracétamol + cystéine (0,5%). n = 35 « C » ; 36 « P » ; 36 « S »
LOTS
Médiane SE Médiane SE Médiane SE
J0 22,3 0,6 20,7a 0,5 21,9 0,5 Moy Cure 1 19,0 <0,1 19,5b 0,5 19,0† 0,1 Moy Récupération 1 20,2 0,2 20,2cd 0,4 20,3 0,2 Moy Cure 2 20,2 0,2 19,8c 0,4 19,7 0,2 Moy Récupération 2 20,2 0,1 19,7bc 0,4 20,1 0,1 Moy Cure 3 20,4 0,3 20,1d 0,4 20,4 0,2 Ingéré cumulé (g) 1354 8 1334 25 1346 9 "C" "P" "S" Consommation moyenne (g/j) LOTS
Médiane SE Médiane SE Médiane SE
J0 685 16 694a 15 683 17 Fin Cure 1 673 14 677b 16 664 13 Fin Récupération 1 664 13 674b 14 664 13 Fin Cure 2 667 13 663c 14 660 14 Fin Récupération 2 666 14 655c 14 655 13 Fin Cure 3 647 14 642d 14 640 12 "C" "P" "S" Poids corporel (g) Cure 1 Récup 1 Cure 2 Récup 2 Cure 3
lot « S » présentait des taux d’α2M (167 mg/L) et de fibrinogène (5,4 g/L) traduisant une inflammation aigue [18]. Les données qui suivent ont donc été analysées sur 35 rats du lot « C », 36 rats du lot « P » et 36 rats du lot « S ».
III.2) Consommation alimentaire, poids et composition corporelle des rats III.2.1) Consommation alimentaire
La consommation des rats traités au paracétamol a significativement varié au cours de l’expérimentation (Figure 13et Tableau 3). L’ingéré a diminué de 26% (P < 0,05) pour le lot « P », au cours des deux premiers jours de la première cure (Figure 13). Cette baisse transitoire de l’ingéré est fréquemment rencontrée chez le rat en début de traitement [33]. Cette baisse pourrait s’expliquer par le goût amer du paracétamol ou encore par une perturbation métabolique pour laquelle les rats mettraient plusieurs jours à s’adapter. En effet, l’ingéré a par la suite progressivement augmenté pour se stabiliser à un niveau inférieur à la consommation alimentaire avant traitement (Jour 0) (Tableau3). L’ingéré moyen de la cure 1 a été réduit de 16% (P < 0,05) par rapport au jour initial. L’ingéré n’a pas été réduit en cure 2 comparativement à celui de la phase de récupération précédente. En revanche, l’ingéré de la cure 3 était significativement plus élevé que la phase de récupération 2 (Tableau 3).
Les rats des lots « C » et « S » ont été mis en PF du lot « P » (Figure 13). Toutefois, au cours de la première cure, la consommation moyenne du lot « S » a été significativement plus faible de 4% (P< 0,05) que celle du lot « P » (Tableau 3).L’ingéré cumulé sur toute la période expérimentale n’a pas été significativement différent entre les trois lots. Le PF a donc été globalement de bonne qualité.
III.2.2) Poids des rats
Le poids des rats du lot « P » a été significativement diminué de 2% (P< 0,05) en fin de première cure, et de 4% et 8%(P< 0,05) au cours des cures 2 et 3 respectivement, par rapport au jour initial (Tableau 4 et Annexe 1). La perte de poids observée le dernier jour de l’expérimentation est artéfactuelle (Annexe 1) car les rats ont été restreints la veille de l’euthanasie (12g de régime au lieu de 23g). Aucune différence significative n’a été observée pendant les phases de récupération.
Tableau 5 : Effet du paracétamol seul ou associé à la cystéine sur la masse maigre (MM) et la
masse grasse (MG) des rats
Pas de différence significative entre les lots pour chaque temps, test de Mann-Whitney Wilcoxon (P > 0,05). Au sein du lot « P », les médianes qui n’ont aucune lettre en commun sont significativement différentes, test de Wilcoxon (P < 0,05)
« C » : lot contrôle ; « P » : lot soumis à 3 cures de paracétamol (1%) ; « S » : lot soumis à 3 cures de paracétamol (1%) + cystéine (0,5%). n = 35 « C » ; 36 « P » ; 36 « S »
Figure 14 : Effet du paracétamol seul ou associé à la cystéine sur le poids des muscles
Pour les différents muscles, les médianes qui n’ont aucune lettre en commun sont significativement différentes, test de Mann-Whitney Wilcoxon (P< 0,05)
« C » : lot contrôle ; « P » : lot soumis à 3 cures de paracétamol (1%) ; « S » : lot soumis à 3 cures de paracétamol (1%) + cystéine (0,5%). n = 35 « C » ; 36 « P » ; 36 « S »
LOTS
Médiane SE Médiane SE Médiane SE
MM (%) J0 68,9 1,2 69,5a 0,8 69,2 0,9 Fin de cure 3 67,9 1,2 69,3a 0,9 68,3 0,9 MG (%) J0 22,3 1,0 23,0a 0,8 23,6 1,1 Fin de cure 3 22,6 1,1 21,6a 0,9 21,7 1,0 "C" "P" "S" 0 0,05 0,1 0,15 0,2 0,25 0 0,5 1 1,5 2 2,5 3 3,5 1
Poi
ds
mu
scle
s
(g)
C P S x a b a ab b a a b a ab b a a a a a a a a a aAucune différence significative de poids corporel n’a été observée entre les lots quelle que soit la période considérée. Le traitement au paracétamol n’a donc pas eu d’effet sur la perte globale de poids corporel, ce qui est en accord avec les données de l’étude précédente. Par ailleurs, la supplémentation en cys n’a pas permis de limiter cette perte de poids corporel.
III.2.3) Composition corporelle des rats
La composition corporelle a peu varié au cours du temps (Tableau 5 et Annexe 2). Entre le jour initial et le dernier jour de la cure 3, les pourcentages de MM et de MG sont restés stables pour les rats du lot « P ». Il n’y a donc globalement pas eu d’effet du traitement sur la composition corporelle, malgré la perte de poids des rats. Aucune différence significative de composition corporelle n’a été observée entre les lots, quelle que soit la période considérée. Le traitement au paracétamol, ainsi que la supplémentation n’ont donc pas eu d’impact sur la composition corporelle. Ces résultats sont comparables à ceux de l’étude précédente, dans laquelle la composition corporelle été restée globalement stable. Seule une diminution de la MM chez le lot traité au paracétamol avait été observée en cure 2 comparativement à un lot PF (%, P < 0,01).
III.3) Poids des organes
Le poids du gastrocnemius, du tibialis anterior, du soleus et de la somme des quatre muscles n’a pas été modifié par le traitement au paracétamol (Figure 14). Seul le poids de l’EDL a été diminué de 9% (P=0,023) chez le lot « P » comparativement au lot « C ». La supplémentation en cys a permis de restaurer cette perte de poids, puisqu’une augmentation significative de 15% (P < 0,01) chez le lot « S » par rapport au lot « P » a été observée. Bien que l’effet du traitement au paracétamol sur le soleus ne soit pas significatif, la supplémentation en cys a augmenté le poids de ce muscle de 15% (P < 0,01) par rapport au lot « P ».
L’étude précédente conduite chez le rat âgé [7] avait également montré une diminution du poids de l’EDL (11%, P < 0,05), ainsi qu’une absence d’effet du traitement au paracétamol sur les poids du soleus et du tibialis anterior comparativement à un lot PF. Néanmoins, une tendance à la diminution avait pu être observée pour le poids du gastrocnemius (P = 0,07),
Figure 15 : Effet du paracétamol seul ou associé à la cystéine sur le poids du foie
Les médianes qui n’ont aucune lettre en commun sont significativement différentes, test de Mann-Whitney Wilcoxon (P < 0,05)
« C » : lot contrôle ; « P » : lot soumis à 3 cures de paracétamol (1%) ; « S » : lot soumis à 3 cures de paracétamol (1%) + cystéine (0,5%). n = 35 « C » ; 36 « P » ; 36 « S »
Tableau 6 : Effet du paracétamol seul ou associé à la cystéine sur certains marqueurs de
l’inflammation (α2-macroglobuline et fibrinogène) et de l’hépatotoxicité (aspartate aminotransferase (AST) et alanine aminotransferase (ALT)
* P < 0,01 vs lot « C », † P < 0,05vs lot « P », test de Mann-Whitney Wilcoxon
« C » : lot contrôle ; « P » : lot soumis à 3 cures de paracétamol (1%) ; « S » : lot soumis à 3 cures de paracétamol (1%) + cystéine (0,5%). n = 35 « C » ; 36 « P » ; 36 « S » 15 16 17 18 19 20 C P S
Po
id
s
f
o
ie
(
g
)
Foie
C P Sa
b
a
LOTSMédiane SE Médiane SE Médiane SE
α2-Macroglobuline (mg/L) 10,0 1,1 7,4 0,8 5,9*† 0,6
Fibrinogène(g/L) 3,1 0,1 2,8 0,1 2,6* 0,1
AST (UI/L) 85,2 4,4 88,0 4,8 87,3 3,5
ALT (UI/L) 40,9 1,8 50,6*† 3,7 43,4 1,6
ainsi qu’une diminution de 11% (P < 0,05) sur la somme des quatre muscles, qui n’ont pas pu être confirmées dans notre présente étude.
Le foie étant le site de détoxification principal du paracétamol, le poids de cet organe a été comparé entre les différents lots (Figure 15). Une augmentation significative de 15% (P < 0,01) a été observée chez le lot « P » comparativement au lot « C ». Ce résultat est en accord avec l’étude précédente dans laquelle une augmentation de 24% avait été observée chez le lot traité au paracétamol comparativement à un lot PF.
Le poids du foie est 8% inférieur (P < 0,01) pour le lot « S » comparativement au lot « P ». La supplémentation permet donc de rétablir le poids du foie qui n’est pas significativement différent du lot « C ». Après consommation, le paracétamol doit être éliminé de l’organisme. L’augmentation du poids du foie chez le lot « P », pourrait donc s’expliquer par la mise en place d’une réponse métabolique de cet organe, dans le but d’augmenter ses capacités de détoxification. A l’inverse, la supplémentation en cys augmenterait directement l’élimination du paracétamol, ce qui éviterait la réponse anabolique du foie.
III.4) Inflammation et hépatotoxicité
III.4.1) Concentrations plasmatiques en α2-macroglobuline et fibrinogène
Les concentrations en α2M et fibrinogène n’ont pas été significativement différentes entre les lots « C » et « P » (Tableau 6). Les rats du lot « S » avaient un taux d’α2M plus faible que ceux des lots « C » (P < 0,01) et « P » (P < 0,04) de 33% et 15% respectivement. Le taux de fibrinogène du lot « S » était également plus faible de 16% comparativement au lot « C » (P < 0,01). Pour les trois lots, les résultats montrent que les rats n’ont pas atteint des taux d’α2M et de fibrinogène susceptibles de traduire une inflammation à bas bruit, correspondant à des concentrations supérieures à 80 mg/L pour l’α2M, et 3,6 g/L pour le fibrinogène [18]. Cependant, malgré l’absence d’inflammation, la cys à elle seule aurait un effet de type anti-inflammatoire puisqu’elle contribue à réduire les taux circulants de ces deux protéines de la réaction inflammatoire.
![Figure 7 : Structure chimique du glutathion (GSH) (d’après Bae et al, 1997 [34])](https://thumb-eu.123doks.com/thumbv2/123doknet/14413508.704889/33.892.122.597.166.405/figure-structure-chimique-glutathion-gsh-bae-al.webp)