HAL Id: tel-01088491
https://tel.archives-ouvertes.fr/tel-01088491
Submitted on 28 Nov 2014
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Etude du cycle des vésicules synaptiques en microscopie
électronique sans fixateur
Suzel Horellou
To cite this version:
Suzel Horellou. Etude du cycle des vésicules synaptiques en microscopie électronique sans fixa-teur. Neurosciences [q-bio.NC]. Université Pierre et Marie Curie - Paris VI, 2014. Français. �NNT : 2014PA066250�. �tel-01088491�
Th se de Do to at de l’Université Pierre et Marie Curie
Ecole doctorale Cerveau, Cognition, Comportement
Présentée par Süzel Horellou
Pour obtenir le grade de Docteur de
l’Université Pierre Et Marie Curie
Etude du cycle des vésicules synaptiques
en microscopie électronique sans fixateur
Soutenue publiquement le 25 septembre 2014 devant un jury composé de :
Madame le Docteur Isabelle DUSART
Présidente
Madame le Docteur Hélène BOUDIN
Rapporteur
Monsieur le Docteur François DARCHEN
Rapporteur
Monsieur le Docteur Jean-Louis BESSEREAU
Examinateur
Monsieur le Docteur Antoine TRILLER
Examinateur
Monsieur le Docteur Serge MARTY
Directeur de thèse
Laboratoire de Biologie Cellulaire de la Synapse, Institut de Biologie de l’Ecole Normale Supérieure ue d’Ul , Pa is, France ; http://www.ibens.ens.fr/
3
5
7
Remerciements
En tout premier lieu je tiens à remercier Serge Marty, mon directeur de thèse, pour la qualité de son encadrement, sa pédagogie, sa patience, sa disponibilité. Merci pour les connaissances ue tu ’as appo t es, pou les dis ussio s, les igolades, pou to soutie , ta o p he sio , tes conseils… Je sais ue j’ai fait des e ieu , et à juste titre, e t’a a t pou di e teu de th se. Merci à Antoine Triller de ’a oi a ueillie da s so la o atoi e, de ’a oi e ou ag e, soutenue et conseillée tout au long de ces 4 ans de thèse.
Je remercie les membres de mon jury, Mesdames Hélène Boudin et Isabelle Dusart, et Messieurs François Darchen et Jean-Louis Bessereau d’a oi a ept d’ alue o a us it et de participer à ma soutenance.
Merci à Olivier Pas ual pou le t a ail d’ le t oph siologie et l’e pe tise appo t es à ce travail de thèse avec une patience immense et une constante bonne humeur. Merci à Philippe Rostaing pour les discussions, conseils techniques et encouragements ; je ’au ais pas pu e de meilleures ressources matérielles, intellectuelles et humaines pour me former en microscopie électronique. Merci à Benjamin Mathieu pou le p og a e La ie et l’aide a e les aspects informatiques du projet. Merci à Gérard Parésys pour la conception du générateur, pour les ressou es le t o i ues et pou l’a ueil toujou s haleu eu da s l’atelie e après les destructions malencontreuses de matériel…). Merci à Guillaume Dugué de nous avoir fourni les DELs qui ont été utilisées tout au long du projet de développement technique, ainsi u’à “t pha e “upplisso pou les dis ussio s su les aspe ts ph siologi ues de la te i aiso présynaptique. Je e se s p i il gi e d’a oi pu t a aille a e ous tous.
Merci à Xavier Heilige stei , G aça Raposo et Ilse Hu ai de l’I stitut Curie pour leur aide sur la préparation des échantillons pour la congélation sous haute pression. En particulier, merci Xavier pour les discussions, les conseils techniques et bien évidemment les CryoCapsules ; ç’a été un plaisir de collaborer avec toi (longue vie à CryoCapCell !).
Merci à Lili Wang, Pam Rodriguez, Yann Nadjar, Sabrina Colasse, Alai Bessis pou toute l’aide et les conseils apportés pour les dissections, cultures de neurones et autres PCR.
Un grand merci à Nadège D’A aujo et Sylvie Clain pour leur aide dans les méandres administratifs, pour leur réactivité et leur sympathie.
Me i à toute l’ uipe de Biologie Cellulai e de la “ apse ai si u’au th sa ds et aut es postdo s de l’IBEN“ ; je vous souhaite à tous le meilleur pour la suite.
8 Merci à Leo et son acolyte pour le dessin, merci à tous, copains, famille, enseignants, collègues, ui ’a ez soutenue, portée voire supportée, de près, de loin, et depuis l’aut e out du o de. Enfin, je souhaite également remercier ici Aud e De idal, l’encadrante de l’aut e olet de ma th se, elui ue j’ai pass da s les bureaux de la Direction de la Recherche et du Transfert de Technologie, tout en haut de la Tour de Jussieu mais les yeux rivés sur Roscoff. Merci de ’a oi fo e, de ’a oi fait o fiance ; merci pour les encouragements, les discussions, les o e ts de igolade et l’a e i p ofessio el ui s’ou e à oi.
9
Table des Matières
Remerciements ... 7
Table des Matières ... 9
Résumé ... 13
Résumé en anglais ... 14
Liste des abréviations ... 15
Liste des figures ... 19
Introduction ... 21
I. Structure de la terminaison présynaptique ... 26
A. Structure et fonction de la synapse : tou d’ho izo histo i ue ... 26
B. Structure des terminaisons présynaptiques ... 32
1. Organisation du bouton axonal ... 32
2. Les vésicules synaptiques ... 37
3. Organisation de la zone active ... 39
II. Fonctionnement de la zone active ... 43
A. Mécanisme de libération du neurotransmetteur... 43
1. Fusion des vésicules à la zone active ... 43
2. Probabilité de libération du neurotransmetteur ... 44
3. Assemblage du complexe SNARE et rôle dans la fusion ... 46
4. Rôle de RIM... 49
B. M a is es d’a age et d’a o çage des si ules à la zo e a ti e ... 52
1. Rôle du o ple e “NARE da s l’a age et l’a o çage des V“s ... 52
2. Rôle de RIM da s l’a age et l’a o çage des V“s ... 54
III. Plasticité à long terme de la libération du neurotransmetteur... 55
10
B. Homéostasie de la terminaison présynaptique ... 57
C. M a is e de l’ho ostasie des te i aiso s p s apti ues ... 58
D. Etude du mécanisme de régulation du nombre de vésicules synaptiques ancrées ... 60
1. Intérêt du modèle de lo age h o i ue de l’a ti it eu o ale da s des tranches d’hippo a pe ... 61
2. I t t de l’i o ilisatio pa o g latio sous haute pression ... 63
IV. Mode d’e do tose des V“s ... 65
A. M a is es d’e do tose ... 65
1. Te h i ues d’ tude de l’e do tose ... 65
2. Endocytose dépendante de la Clathrine ... 67
3. Endocytose de type « kiss a d u ... 71
4. E do tose de t pe ulk ... 73
B. D eloppe e t d’u e ou elle app o he pou l’o se atio du ou des a is es d’e do tose « en aigü » ... 75
1. “ti ulatio opti ue de eu o es pa des thodes d’optog ti ue ... 77
2. « Capture » d’i ages d’e do tose g â e au ouplage d’u e sti ulatio opti ue a e l’i o ilisatio apide pa o g latio sous haute p essio ... 79
Résultats ... 81
I. Etude de la gulatio de l’a
age des si ules s apti ues e i os opie
électronique sans fixateur ... 83
A. Introduction ... 83
B. Article : Adaptive and non adaptive changes in activity deprived synapses ... 87
II. Couplage d’u e sti ulatio opti ue et de la o g latio de eu o es pou
l’ tude du
le des si ules s apti ues ... 101
A. Mises au point de la stimulation optogénétique ... 103
1. Matériel et méthodes ... 103
2. Résultats ... 108
B. Modifications de la machine et des supports de congélation sous haute pression ... 110
11 2. I t g atio d’u s st e de sti ulatio da s l’HPM ... 111 3. Commandes du couplage stimulation – congélation ... 111 C. Utilisation des CryoCapsules pour le couplage stimulation-congélation des neurones .... 114 1. Matériel et méthodes ... 116 2. Résultats préliminaires ... 118
Discussion ... 119
I. Régulation de la taille de la jonction synaptique et du nombre de vésicules
ancrées ... 121
II. Régulation de la probabilité de libération du neurotransmetteur ... 123
III. D eloppe e ts
essai es pou l’o se atio du
le des si ules
synaptiques après stimulation et congélation ... 125
13
Résumé
Les synapses chimiques sont des structures spécialisées permettant une transmission d'i fo atio u idi e tio elle, d’u l e t p s apti ue e s u l e t posts apti ue. L’o ga isatio des te i aiso s p s apti ues pe et la o e sio d’u pote tiel d’a tio e sig al chimique. Elles se présentent sous la forme de varicosités axonales contenant des vésicules synaptiques (VSs) qui concentrent le neurotransmetteur (NT). Une partie des VSs sont apposées (ancrées) à une région de la membrane plasmique, la zone active (ZA ; Bennett et al. 1992, Siksou et al. 2009). La ZA est situ e fa e à l’a u ulatio posts apti ue des epteu s au NT. La d pola isatio d’u e te i aiso pa u pote tiel d’a tio a ti e des a au al i ues d pe da ts du oltage. L’influx de calcium qui en sulte e t aî e la fusio d’u e f a tio des V“s a es a e la e a e plas i ue e oi s d’u e milliseconde, permettant la libération de NT (Sabatini et Regehr 1996, Lisman et al. 2007). Une endocytose compensatoire permet ensuite la reformation de VSs (Rizzoli et Betz, 2005). Des questions se pose t e o e ua t à e t afi gul . Nous a o s tudi la gulatio de l’a age des V“s et développé un outil pour analyser le cycle des VSs en microscopie électronique (ME).
La première partie de mon travail de thèse a porté sur la régulation du nombre de VSs ancrées à la )A. Not e o je tif tait de sa oi si l’a age tait gul sp ifi ue e t ou e oo di atio a e les autres paramètres morphologiques du bouton, et de déterminer le rôle de Rab3-Interacting Molecules RIMs , p ot i es e t ales de la )A, da s ette gulatio . La gulatio de l’a age a t tudi e su u od le de ultu es o ga ot pi ues de t a hes d’hippo a pe do t l’a ti it est lo u e jou s pa l’appli ation de tétrodotoxine. Ces tranches ont été immobilisées par congélation sous haute pression (CHP) pour être observées en ME sans les artefacts induits par les fixations aldéhydiques. Le blocage d’a ti it e t aî e u e aug e tatio du o e de V“s a es, de la taille de la ZA, et du nombre de récepteurs postsynaptiques au glutamate de type GluA2. Le nombre de VSs total dans le bouton et la taille du outo e ha ge t pas. E i u o to hi ie Nous ’a o s pas o se de odifi atio de la quantité moyenne de protéines RIM / da s les te i aiso s p s apti ues sous l’effet du lo age d’a ti it . E fi , les e egist e e ts le t oph siologi ues e le t pas de odifi atio de f ue e des ou a ts e itateu s i iatu es alg l’aug e tatio du o e de VSs ancrées. Ces sultats o t e t u e gulatio sp ifi ue de la taille de la jo tio s apti ue pa l’a ti it eu o ale et i di ue t ue le o e de V“s a es ’est pa gul pa la ua tit de RIM.
La deuxième partie de mon travail a consisté à d eloppe u outil d’ tude du le des V“s. E effet, la ME e pe et pas d’o se e des e e ts d a i ues, ta dis ue la solutio spatiale des microscopes optiques est insuffisante pour observer directement les VSs. Nous avons voulu associer une stimulation optogénétique de neurones avec leur immobilisation rapide par CHP, afin de pouvoir observer en ME les VSs à des temps précis après la stimulation. Nous avons travaillé sur des cultures disso i es de eu o es d’hippo a pe de at. Ces eu o es ont été infectés avec un Adeno-Associated Virus exprimant une protéine, la ChannelRhodopsine2, pour les rendre activables par des stimulations lu i euses. U e olla o atio a e Lei a Mi os ste s a pe is de odifie l’appa eil de o g latio (HPM) pour i sti ule les eu o es da s l’HPM, et ii s h o ise ette sti ulatio a e la congélation. Ce nouvel outil devrait permettre dans le futur une analyse du trafic des VSs à très haute résolution temporelle et spatiale.
14
Résumé en anglais
Chemical synapses are highly specialized structures that convey information unidirectionnally, from a presynaptic to a postsynaptic element. Presynaptic terminals convert action potentials into chemical signals. These axonal varicosities contain synaptic vesicles (SVs) filled with neurotransmitter (NT) molecules. A fraction of the SVs are apposed (docked) to a part of the plasma membrane called the active zone (AZ; Bennett et al. 1992, Siksou et al. 2009b). The AZ is located in front of the postsynaptic accumulation of NT receptors. Depolarization of a terminal by an AP activates voltage dependent calcium channels. The resulting calcium influx induces the fusion of a fraction of the docked SVs in less than a millisecond, which release their NT content (Sabatini & Regehr 1996, Lisman et al. 2007). New SVs are then produced through a process of compensatory endocytosis (Rizzoli & Betz, 2005). Unanswered questions remain about the mechanism of this regulated traffic of SVs. We studied the regulation of SVs docking and developed a tool to analyze the cycle of SVs with electron microscopy (EM).
The first part of my PhD work was focused on the regulation of the number of docked SVs at the AZ. Our objective was to determine whether SVs docking was regulated specifically or together with other morphological parameters of the bouton. We also investigated the role of Rab3-Interacting Molecules (RIMs), central proteins of the AZ, in this regulation. We worked on organotypic culture of hippocampal slices in which we blocked neuronal activity with tetrodotoxin for 3 days. Slices were immobilized using high pressure freezing (HPF) to avoid artifacts due to chemical fixation, and studied with EM. Activity blockade induced an increase in the number of docked SVs, in the size of the AZ and in the number of GluA2 postsynaptic glutamate receptors. However, the total number of SVs in the bouton and the size of the bouton did not change. With immunocytochemistry we did not detect any change in the mean amount of RIM in presynaptic terminals after chronic activity blockade. Furthermore, electrophysiology recordings showed no increase of the mean frequency of mEPSCs despite the increase in the number of docked SVs. Together these results show a specific regulation of the size of the presynaptic junction by neuronal activity, and indicate that the amount of RIMs does not regulate the number of docked SVs.
The second part of my work consisted in the development of a new tool to study the cycle of SVs. Indeed, EM does not allow the visualization of dynamic phenomenon, whereas optical microscopes do not have a sufficient spatial resolution to observe SVs with the required precision. We wanted to associate optogenetic stimulations of neurons with their rapid immobilization by HPF, in order to visualize SVs at precise moments after stimulation. We worked on rats hippocampal dissociated neurons cultures. These neurons were infected with an Adeno-Associated Virus encoding a light sensitive protein channel, the ChannelRhodopsin2, in order to be able to activate them with light stimulations. We collaborated with Leica Microsystems to modify our high pressure machine (HPM), so that we can (i) stimulate the neurons within the HPM, and (ii) synchronize this stimulation with the freezing. In the future, this new tool this system should allow us to analyze the traffic SVs with high temporal and spatial resolution.
15
Liste des abréviations
A : Ampère
ACSF : Artificial CerebroSpinal Fluid
AMPA : α-Amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid ARN : Acide Ribonucléique
ATP : Adénosine triphosphate BAR : Bin–Amphiphysin–Rvs
BDNF : Brain-Derived Neurotrophic Factor C.elegans : Caenorhabiditis elegans C1 : Domaine de liaison au diacylglycérol C2 : Domaine pouvant lier deux ions calcium CA1 : Cornu Ammonis 1
Ca2+ : Calcium
CA3 : Cornu Ammonis 3
CamKII : Protéine kinase calcium-calmoduline dépendante CaV : Canal calcique dépendant du voltage
CDK55 : Cyclin-dependent kinase 5 CHP : Congélation sous Haute Pression CLEM : Correlative Light Electron Microscopy C-terminal : domaine carboxy-terminal DEL : Diode Electro-Luminescente DLT : Dépression à Long Terme DPS : Densité postsynaptique
EPSC : Excitatory PostSynaptic Current
F-BAR : FCH-BAR, ou EFC pour Extended FCH Homology FCHo : Fer/Cip4 homology domain only proteins
GABA : γ-aminobutyric acid GFP : Green Fluorescent Protein GSK3 : Glycogen Synthase Kinase 3
16 GTP : Guanosine Triphosphate
GTPase : Guanosine Triphosphate (GTP) hydrolase enzyme h : Heure
HPM : High-Pressure freezing Machine Hsc70 : Heat-Shock Cognate protein 70 Hz : Hertz
K+ : Potassium
KCl : Chlorure de potassium kDa : Kilo Dalton
KO : Knock-Out M : Molaire
ME : Microscopie Electronique
mEPSC : Miniature Excitatory PostSynaptic Current mL : Millilitre
mM : Milli Molaire mOs : MilliOsmole ms : milliseconde
Munc13 : Munc-13 mammalian homologue of C.elegans UNC-13 (uncoordinated) protein Munc18 : Munc-13 mammalian homologue of C.elegans UNC-18 (uncoordinated) protein NeuN : Neuronal Nuclei
nm : Nanomètre
NMDA : N-Methyl-D-aspartic acid NSF : N-ethylmaleimide-sensitive factor NT : Neurotransmetteur
N-terminal : NH2 terminal PA : Pote tiel d’A tio
PBS : Phosphate Buffer Solution
pH : Potential for hydrogen ion concentration PKA : Protein Kinase A
PKC : Protein Kinase C
Pl : Probabilité de Libération du neurotransmetteur PLT : Potentialisation à Long Terme
17 PPMm : Potentiel de Plaque Motrice miniature
Rab : Member of the RAS oncogene family RIM : Rab3 interacting molecule
RIM-BP : RIM Binding Protein RRP : Readily Releasable Pool s : seconde
SH3 : Src 3 Homology.
SNAP-25 : Soluble N-ethylmaleimide-sensitive factor Attachment Protein 25
SNARE : Soluble N-ethylmaleimide-sensitive factor Attachment protein (SNAP) Receptor SNC : Système Nerveux Central
SV2 : Synaptic Vesicle protein 2 TrKB : Tropomyosin related kinase B TTX : Tétrodotoxine
V : Volt
VAMP : Vesicle Associated Membrane Protein V-ATPase : Vacuolar type H+-ATPase
VGLUT : Vesicular Glutamate Transporter VS : Vésicule Synaptique
W : Watt
YFP : Yellow Fluorescent Protein ZA : Zone Active Zn : Zinc μL : Microlitre μm : Micromètre μM : Micro Molaire μs : Microseconde
19
Liste des figures
Figure 1 : Schéma du fonctionnement de la transmission synaptique ... 24
Figure 2 : Dessi s de “a tiago Ra o Cajal da s l’Histologie du s st e e eu de l’Ho e et des Vertébrés ... 27
Figure 3 : Mi og aphie d’u e jo tio eu o us ulai e de eptile ... 29
Figure 4 : Mise en évidence du recyclage des VSs ... 31
Figure 5 : Mise en évidence et modèle du réseau de filaments du bouton présynaptique. ... 33
Figure 6 : Co pa aiso de la o phologie de s apses e itat i e d’hippo a pe ap s fi atio chimique et après CHP ... 34
Figure 7 : Description du réseau de filaments du bouton présynaptique... 36
Figure 8 : Modélisation d'une VS et des protéines associées ... 38
Figure 9 : Etude en tomographie du matériel dense de la ZA ... 41
Figure 10 : Corrélation de la taille de la ZA au nombre de VSs ancrées et au nombre de CaV.... 42
Figure 11 : Visualisatio de l’e o tose à la jonction neuromusculaire de grenouille en ME ... 44
Figure 12 : Corrélations de la Pl à la taille de la ZA et au nombre de VSs ancrées à la ZA ... 46
Figure 13 : “ h a de l’asse lage du omplexe SNARE ... 47
Figure 14 : Rep se tatio s h ati ue des do ai es d’i te a tio de la p ot i e RIM et de leurs fonctions potentielles ... 50
Figure 15 : Rôle de RIM da s l’asse lage du o ple e “NARE ... 51
Figure 16 : Mise en é ide e du ôle de Mu da s l’a age des V“s à la )A ... 53
Figure 17 : Représentation schématique des interactions de RIM avec les protéines de la ZA .. 54
Figure 18 : Augmentation spécifique de la quantité de RIM aux terminaisons présynaptiques après un blocage chronique d'activité ... 60
Figure 19 : Organisation des synapses établies par les collatérales de Schaffer dans une coupe transversale d'hippocampe... 63
Figure 20 : Co pa aiso des effets de l’i o ilisatio pa fi atio hi i ue et de l’i o ilisatio pa CHP su le outo s apti ue ... 64
Figure 21 : Etude e ME de l’e do tose d pe da te de la Clath i e ... 68
Figure 22 : Mise en évidence du rôle de la Clathrine dans la reformation des VSs à la jonction neuromusculaire de Drosophile ... 70
Figure 23 : Etude en ME du mécanisme de « kiss and run » ... 71
20
Figure 25 : Etude e ME du a is e d’e do tose de t pe « bulk » ... 74
Figure 26 : Illustration du dispositif de stimulation-congélation mis au point par John Heuser et Tom Reese ... 76
Figure 27 : Co t ôle de l’a ti it eu o ale pa app o he optog ti ue )ha g et al. .. 79
Figure 28 : Principe expérimental du dispositif du couplage de stimulations lumineuses de neurones ChR2 positifs avec leur immobilisation rapide par CHP ... 80
Figure 29 : P i ipe de l’a ti atio de la Cha elRhodopsi e e p i e à la e a e d’u neurone ... 102
Figure 30 : Séque e de l’AAV-ChR2 utilisé... 105
Figure 31 : DEL Kingbright APA 1606 et circuit assemblé pour réaliser les premiers tests de stimulation ... 107
Figure 32 : Neu o es i fe t s pa l’AAV-ChannelRhodopsine2 observés au microscope en fluorescence ... 108
Figure 33 : Enregistrements électrophysiologiques effectués par Olivier Pascual ... 109
Figure 34 : Schéma et photo du support de congélation lumineux ... 110
Figure 35 : “ st e de sti ulatio à l’i t ieu de l’HPM ... 111
Figure 36 : Schéma et photo du dispositif assemblé ... 112
Figure 37 : Programme Labview permettant la synchronisation de la stimulation et de la congélation ... 113
Figure 38 : Description des CryoCapsules ... 115
Figure 39 : Micrographies de neurones cultivés et congelés dans des CryoCapsules avec à droite une vue de synapse à fort grossissement ... 118
Figure 40 : Etude de l’e do tose et de l’e o tose ap s sti ulatio et o g latio de neurones exprimant une ChannelRhodopsine2 ... 127
21
23
Introduction
Les synapses chimiques sont des structures cellulaires extrêmement spécialisées permettant de t a s ett e l’information neuronale de façon unidirectionnelle. Elles représentent la majorité des synapses des systèmes nerveux central et périphérique. Elles se o pose t d’u élément présynaptique et d’u l e t posts apti ue Fig. . L’ l e t présynaptique, aussi appelé terminaison ou bouton présynaptique, est une varicosité membranaire contenant des vésicules appelées Vésicules Synaptiques (VSs). Ces VSs renferment des molécules de neurotransmetteur. Une partie des VSs est apposée à la e a e plas i ue, fa e à l’ l e t posts aptique. Cette portion de membrane est appel e zo e a ti e )A . L’ l e t posts apti ue p se te à sa e a e, fa e à la terminaison présynaptique, des récepteurs canaux au neurotransmetteur. Lo s u’u potentiel d’a tio d pola ise la te i aiso , il i duit u e e t e de al iu . L’aug e tatio de la o e t atio de al iu p o o ue l’e o tose d’u e f a tio des V“s a es au i eau de la ZA, qui libèrent leur contenu en neurotransmetteur. Les molécules de neurotransmetteur vont alors pouvoir se fixer sur les récepteurs postsynaptiques et déclencher leur ouverture. Cette ouverture initie un courant ionique dans le compartiment postsynaptique. Si la somme des courants provenant des synapses établies sur le neurone postsynaptique est supérieure au seuil, un ou eau pote tiel d’a tio est d le h . Ap s la li atio de eu ot a s etteu , des VSs sont reformées par endocytose et rechargées en neurotransmetteur, évitant ainsi la déplétion de la terminaison. La s apse est do l’ l e t l de la transmission de l’i fo atio e euse et la continuité du cycle des VSs est indispensable à son bon fonctionnement.
24 Figure 1 : Schéma du fonctionnement de la transmission synaptique (Purves et al. 2001).
Durant mon travail de thèse je e suis i t ess e au le des V“s et à sa gulatio . D’u e pa t, ous ous so es fo alis s su la gulatio de l’a age des V“s à la )A. Nous a o s tudi ette gulatio da s des t a hes d’hippo a pe de sou is e i os opie le t o i ue après o g latio sous haute p essio . D’aut e pa t, ous a o s d elopp u s st e combinant stimulation optique et immobilisation par congélation afin de pouvoir visualiser les
25 e e ts d’e do tose e i os opie le t o i ue. Avant de présenter les résultats de ces travaux, je détaillerai en introduction la structure de la terminaison présynaptique et les techniques qui ont permis sa description. Je décrirai ensuite le fonctionnement de la terminaison et sa plasticité, en me focalisant sur le mécanisme de l’a age des V“s à la )A et so i po ta e da s la eu ot a s issio . E fi , je d i ai les a is es d’e do tose p opos s à e jou et les diffi ult s li es à l’ tude du e lage des V“s.
26
I. Structure de la terminaison présynaptique
La structure du s st e e eu et les eu o es e pa ti ulie o t fait l’o jet de nombreux travaux tout au long des 19ème et 20ème siècles. Il faut cependant attendre les
premières observations en microscopie électronique, autour de 1950, pour obtenir une o fi atio isuelle de l’e iste e des s apses. La o phologie et les ult ast u tu es synaptiques ont alors pu être décrites en détail. Ces travaux ont apporté de précieuses i fo atio s su la t a s issio de l’i fo ation nerveuse. Le développement ultérieur de techniques de microscopie électronique a permis une description fine de la structure et de l’o ga isatio de la te i aiso p s apti ue.
A. Structure et fonction de la synapse : tour d’horizon historique
La o aissa e du s st e e eu a p og ess au fil d’a a es te h i ues, e pa ti ulie du d eloppe e t des te h i ues de i os opie. E , l’ajout d’o je tifs a h o ati ues aux microscopes existants permet une amélioration du grossissement et de la netteté des images observées. Pour la première fois, les corps cellulaires des cellules nerveuses ainsi que leurs prolongements peuvent être observés. Les prolongements sont décrits par Dieters et Schultze (Finger 1994), qui distinguent un prolongement p i ipal, l’a o e, et de ultiples petits prolongements qui seront désignés ensuite par le terme « dendrite ». En 1873, nouvelle avancée majeure ; Camillo de Golgi met au point une nouvelle technique de coloration à base de it ate d’a ge t. Cette te h i ue a pou a a tage de e a ue u’u e pa tie des ellules au sei d’u tissu, et de marquer complètement ces cellules. Elle permet à Golgi de visualiser nettement la morphologie des neurones, et en particulier de décrire les relations entre le soma et les prolongements.
En 1880, Ramon y Cajal utilise la technique de Golgi sur du tissu nerveux et décrit de façon remarquablement précise la circuiterie de différentes structures, en particulier celle de l’hippo a pe (Fig. 2). A cette période subsiste encore une controverse entre les partisans de la continuité et ceux de la contiguïté des cellules nerveuses. En effet, un certain nombre de
27 biologistes, dont Golgi, pensent que le tissu nerveux est constitué de cellules formant un réseau continu dont les prolongeme ts so t fusio s e t e eu . A l’i e se, Cajal et d’aut es de ses oll gues d fe de t l’h poth se d’u e dis o ti uit o phologi ue des ellules e euses ; la ellule e euse est alo s d fi ie o e u e e tit i di iduelle et l’u it a ato i ue et physiologique de base du tissu nerveux. Waldeyer, biologiste influent, donne le nom de neurones à ces cellules et formule la « doctrine du neurone » en 1891. Les points de contacts entre neurones sont appelés synapses par Sherrington en 1897, qui postule que la communication inter- eu o ale se fait au i eau de es poi ts de o ta t. D’aut e pa t, su la ase de ses o se atio s des i uits se so iels, Cajal fait l’h poth se de la t a s issio de l’i fo atio sous fo e d’u i flu u idi e tio el, a o e e s de d ite, u’il appelle « polarisation dynamique du neurone ». Les concepts de discontinuité des neurones, de s apses et de pola it fo tio elle o t este à l’ tat de th o ie jus u’au ilieu du ème
siècle.
Figure 2 : Dessi s de Sa tiago Ra o Cajal da s l’Histologie du s st e e veu de l’Ho e et des Ve t s.
A. Dessi d’u eu o e p a idal : (e) Axone principal, (b) Ramifications dendritiques.
B. Illustration de la polarité de la tra s issio e veuse au iveau des eu o es d’hippo a pe les fl hes i di ue t le se s de l’i flu e veu .
28 Il faut attendre les travaux de René Couteaux (Couteaux 1944) sur la jonction eu o us ulai e pou ue l’e iste e o phologi ue des s apses, et par conséquent la discontinuité des neurones, soit démontrée. En utilisant un colorant appelé Janus Green B, Couteaux parvient à observer un espace, appelé « gouttière synaptique » entre la terminaison e euse et l’ « appareil subneural », qui correspond à la structure post-synaptique du myocyte.
Le premier microscope électronique construit par Ernst Ruska en 1931 et développé i dust ielle e t pa la suite pe et apide e t d’o server des échantillons avec une meilleure solutio u’avec les microscopes optiques disponibles à cette époque. Les microscopes optiques utilisent le rayonnement de photons de lumière visible. Leur pouvoir de résolution est donc li it pa la lo gueu d’o de de e t pe de a o e e t. La lo gueu d’o de d’u électron étant beaucoup plus petite ue elle d’u photo , les i os opes le t o i ues pe ette t d’o te i u e solutio ie eilleu e, pa ti uli e e t adapt e à l’ tude de structures subcellulaires telles que les synapses. La mise au point de méthodes de coloration des tissus biologiques, utilisant des particules denses aux électrons qui se fixent aux composants cellulaires, ainsi que de te h i ues d’i lusio des ha tillo s et de oupe fi e permet aux biologistes de tirer avantage de cette technique. Ainsi, pour la première fois les synapses du système nerveux central peuvent être observées (De Robertis & Bennett 1955, Robertson 1956, Palay & Palade, 1954). La microscopie électronique (ME) permet alors de d i e la o phologie des s apses et d’e d taille les ult ast u tu es (Fig. 3). La synapse apparaît comme une jonction serrée comparable par certaines caractéristiques aux jonctions ue l’o t ou e e t e d’aut es t pes ellulai es. Elle appose deu e a es plas i ues, reliées entre elles par des protéines de liaison, et séparées par une fente synaptique contenant du matériel dense organisé en plaque. La spécificité principale des synapses en tant que jonctions adh e tes est leu pola it . Elles se o pose t d’u l e t p s apti ue et d’u élément postsynaptique morphologiquement distincts. Dans le système nerveux central (SNC), l’ l e t p s apti ue est e g al u a o e et l’ l e t posts apti ue, u de d ite.
29 Figure 3 : Mi og aphie d’u e jo tio eu o us ulai e de eptile ; (v) vésicules synaptiques, (m) mitochondries, (j.f.) replis de la membrane postsynaptique (Robertson 1956).
La terminaison présynaptique présente un élargissement appelé bouton présynaptique. On distingue deux types de boutons sui a t leu positio su l’a o e : les outo s te i au , lo s ue l’a o e ta lit u e s apse à so e t it distale, et les outo s e passa t ui se p se te t sous la fo e de a i osit s le lo g de l’a o e Pete s et al 1991). Ces boutons renferme t uel ues ito ho d ies ai si u’u g a d nombre de vésicules (Palay & Palade 1954, De Robertis & Bennet 1955, Robertson 1956). Or quelques années auparavant, en 1952, Katz e egist e au o e d’ le t odes i t a ellulai es le pote tiel de e a e de l’ l e t postsynaptique à la jonction neuromusculaire, appelé plaque motrice (Del Castillo & Katz 1954a, Del Castillo & Katz 1954b). Il enregistre des variations du potentiel de membrane de la plaque motrice (PPM) en réponse à une stimulation, et des variations de même forme mais d’a plitude duite e l’a se e de sti ulation, appelées PPM miniatures (PPMm). Lorsque l’a plitude de la po se à u e sti ulatio est duite à so i i u e a aissa t la o e t atio e t a ellulai e de al iu , Il o se e ue l’a plitude d’u PPM o espo d à un
30 ultiple de l’a plitude du PPM . Il e d duit ue ha ue PPM o espo d à l’additio de plusieu s PPM et fait l’h poth se d’u e li atio de eu ot a s etteu sous fo e de paquets ou quanta, chaque paquet correspondant en postsynaptique à un PPMm. Les vésicules synaptiques (VSs) visualisées en ME aux terminaisons présynaptiques apparaissent comme le o lat st u tu al de l’h poth se de li atio ua tale de eu ot a s etteu et leur découverte vient corroborer les travaux de Katz. Les VSs sont alors définies comme les unités de t a s issio d’u e ua tit de eu ot a s etteu fi ie. Les t a au de Whittake da s les années 60 permettent ensuite de confirmer formellement la présence de neurotransmetteur dans les VSs (Whittaker 1971).
Le mécanisme de libération de neurotransmetteur par les vésicules est en partie élucidé en 1973 par les t a au de Heuse et Reese d’u e pa t, et Ce a elli d’aut e pa t (Ceccarelli et al. 1973, Heuser & Reese 1973). Leurs travaux respectifs, couplant stimulation électrique de préparation nerf-muscle de grenouille et observation en ME de la jonction neuromusculaire, leu pe ette t d’o se e la te i aiso s apti ue à diff e ts te ps ap s sa sti ulatio . Ils proposent alors deux modèles relativement similaires du fonctionnement de la terminaison présynaptique. Dans les deux modèles, la stimulation déclenche la fusio d’u e pa tie des vésicules avec la membrane du bouton. Les vésicules libèrent ainsi leur contenu en neurotransmetteur, puis se reforment à partir de cette même membrane et sont rechargées en neurotransmetteur. La reformation des VSs à partir de la membrane plasmique a pu être mise e ide e pa la aptu e d’u t a eu ajout au ilieu e t a ellulai e Fig. . Pou Heuse et Reese, cette reformation se produit à distance de la ZA après fusion complète de la VS avec
celle-ci. Pou Ce a elli et oll gues, la efo atio a lieu à la )A ap s la fo atio d’u po e de fusion transitoire entre les membranes de la VS et de la ZA.
31
Figure 4 : Mise en évidence du recyclage des VSs (Heuser & Reese 1973).
A. Micrographies de jonctions neuromusculaires de grenouille après stimulation en présence des marqueurs denses aux électrons ; les VSs reformées après une stimulation apparaissent marquées. B. Modèle du cycle des VSs proposé par Heuser et Reese.
En face post-synaptique, du côté cytoplasmique de la membrane, apparaît un amas de particules appelé densité post-synaptique (DPS). Cette densité correspond à un échafaudage protéique permettant l’a u ulatio de epteurs au neurotransmetteur. Les travaux en ME, en particulier ceux de Gray à partir de 1959, permettent de caractériser de plus en plus finement les synapses de diverses structures du système nerveux central (Gray, 1964). Il caractérise en particulier, dans le cortex cérébral, deux grandes classes de synapses selon l’aspe t de leu DP“. Il distingue des synapses symétriques, présentant une DPS très fine. Ces s apses s’ ta lisse t su tout su les t o s de d iti ues et les so as, et la plupart sont inhibitrices et libèrent du GABA ou de la glycine. Les synapses asymétriques possèdent une DPS p o i e te, et s’ ta lisse t e ajo it su des st u tu es e fo e d’ pi es issues des troncs dendritiques. Ce sont des synapses excitatrices, qui libèrent principalement du glutamate.
Les synapses ont ainsi été identifiées comme les éléments clés de la transmission de l’i fo atio e euse. E pa ti ulie , ’est l’o ga isatio st u tu ale et ol ulai e des terminaisons présynaptiques qui per et la o e sio d’u pote tiel d’a tio en un signal chimique.
B
A
32
B. Structure des terminaisons présynaptiques
1. Organisation du bouton axonal
La ME est à la base des premières descriptions dans les années 50 de la structure des terminaisons présynaptiques, et de la découverte des VSs. Classi ue e t, l’o se atio de st u tu es iologi ues e ME e uie t u e tape de fi atio hi i ue de l’ ha tillo , u e incubation dans un colorant dense aux électrons et un enrobage dans une résine. Lorsque la résine est pol is e, l’ ha tillo peut t e oup fi e e t pou t e o se . Les te h i ues de oupe e pe ette t d’a o d pas d’o te i des se tio s suffisa e t fi es pou o se e e d tail les st u tu es p se tes à l’i t ieu du outo . Le développement d’ult a i oto es asso i s à l’utilisatio de outeau de dia a t e d possi le la p pa atio de section de 100 à 200 nm (Fernandez-Moran 1953, Porter & Blum 1953, Gay & Anderson 1954, Sjostrand 1958). L’a lio atio o sta te de ette te h i ue pe et aujou d’hui d’o te i des se tio s de d’ paisseu .
La p pa atio de se tio s d’ ha tillo s e ult a i oto ie a aussi pe is d’i age e ME des séries consécutives de sections (sections sériées) pour étudier en trois dimensions (3D) les structures cellulaires et subcellulaires. E Neu os ie es, ette te h i ue a t d’u e importance majeure pour décrire la connectivité des neurones et la morphologie des structures subneuronales (Harris & Stevens 1988, Harris & Stevens 1989). Cependant, elle permet d’o te i au ieu u e solutio de e z l’ paisseu de la oupe , e ui este insuffisant pour caractériser les structures moléculaires de la terminaison (Grimm et al. 1997). De plus, les fixateurs aldéhydiques utilisés pour immobiliser les structures tendent à agréger les filaments protéiques et à déformer les membranes, ce qui pose problème pour décrire les structures les plus fines de la terminaison (Rostaing et al. 2006).
Différentes méthodes de préparation des échantillons ont alors été progressivement mises au poi t afi de p se e les d tails de la te i aiso a a t de l’o se e e ME. Le « slam-freezing » est u e des p e i es thodes d’i o ilisation par congélation. Il consiste à appli ue à l’ ha tillo u i pa t su u lo de tal efroidi à -270°C (Heuser, Reese et al. 1979). L’asso iatio du ef oidisse e t apide et de la p essio e pa l’i pa t pe et
33 d’i o ilise apide e t les st u tu es. La o i aiso asse te p atu e/haute p essio pe et à l’eau o te ue da s la pa tie supe fi ielle des ha tillo s d’atteindre un stade de it ifi atio , plutôt ue d’ t e istallis e sous fo e de gla e. E effet, la fo atio de istau de glace altère les structures par son action mécanique. Les échantillons sont ensuite of a tu s pou e pose l’i t ieu des te inaisons. Pour observer les assemblages ol ulai es, l’eau est e suite eti e su à de p ofo deu pa su li atio supe fi ielle. Ap s u e tape d’o age a e u alliage de tau , o o tie t u e pli ue métallique de la structure de la terminaison, qui peut être observée en ME. Cette technique a pe is pou la p e i e fois d’o se e le seau de fila e ts st u tu a t la pa titio des vésicules dans le bouton (Landis et al. 1988, Hirokawa et al. 1989). Les vésicules apparaissent ete ues da s u seau de fila e ts d’a ti e et de i otu ules et atta h es les unes aux aut es pa des fila e ts fi s d’e i o de lo g (Fig. 5). La nature de ces filaments a été pa tielle e t lu id e g â e à l’ tude des te i aisons présynaptiques de souris Synapsine simple et triple KO (Takei et al. 1995, Gitler et al. 2004). On observe dans ces terminaisons une perte de 50% des VSs. Ces résultats, associés à la présence de Synapsine aux terminaisons et sa capacité à se lier aux VSs indiquent que la S apsi e pa ti ipe la ge e t à l’a u ulatio des VSs dans le bouton (De Camilli et al. 1983).
Figure 5 : Mise en évidence et modèle du réseau de filaments du bouton présynaptique. Les flèches indiquent des filaments liant les VSs entre elles (Hirokawa et al. 1989).
A. Mi og aphie d’u outo s apti ue de fi e oussue de e velet de rat après congélation rapide et cryofracture (Flèches : fila e ts elia t les VSs e t e elles . Ba e d’ helle : 100 nm.
B. Mod le d’o ga isatio des fila e ts du outo p s apti ue t : microtubules, a : filament
d’a ti e, si : Synapsine, sv : vésicule synaptique).
34 La congélation sous haute pression (CHP) utilise le même principe que le slam-freezing : une o g latio apide pa u jet d’azote sous t s haute p essio appli u da s u appa eil spécifique (High Pressure Machine, HPM). Cependant la pression de 2100 bars appliquée à l’ ha tillo da s l’HPM pe et de dui e e o e da a tage la fo atio de istau de gla e, et ainsi de it ifie l’ ha tillo , ais su u e paisseu plus g a de, d’au oi s μ (Siksou et al. 2009). L’ ha tillo peut e suite t e d sh d at , fixé au t t o de d’os iu à très basse température puis être enrobé dans une résine et coupé très finement (30 nm) pour être a al s e ME. Cette te h i ue pe et d’o se e les s apses sa s les a t fa ts i duits pa les fixateurs aldéhydiques, avec une résolution de 30 nm en z (Fig. 6).
Figure 6 : Comparaison de la morphologie de synapses excitatrices d’hippo a pe ap s fi atio chimique et
après CHP. Ba e d’ helle : 200 nm.
A. Mi og aphie d’u e s apse i o ilis e pa fi atio ald h di ue.
B. Mi og aphie d’u e synapse immobilisée par CHP.
Noter que le bouton synaptique a une forme plus arrondie et que les VSs apparaissent moins agrégées après CHP.
L’ tude des te i aiso s p s apti ues, e D et à u e solutio suffisa te pou observer les structures moléculaires a nécessité de nouveaux développements techniques. La to og aphie le t o i ue a t adapt e à l’ tude de sp i e s iologi ues da s les a es . Elle o siste à a u i e ME des i og aphies d’u ha tillo i lus da s u e se tio de résine de à d’ paisseu sous u e su essio p og essi e d’a gles d’i li aiso
35 (Baumeister et al. 1999, Fernandez-Busnadiego et al. 2010). Les images ainsi acquises sont ensuite réalignées et traitées informatiquement pour obtenir une reconstruction 3D de la st u tu e d’i t t. Cette te h i ue d’i age ie pe et d’o te i u e solutio d’e i o en z (Siksou et al. 2009).
Ap s i o ilisatio pa o g latio , l’ ha tillo peut gale e t t e ai te u à t s basse température (-140°C) dans un état hydraté pour être observé directement en oto og aphie to og aphie à t s asse te p atu e . Cette te h i ue pe et d’ iter les artéfacts éventuels induits par les étapes de déshydratation et de coloration, mais nécessite de travailler sur des échantillons très fins (moi s de , e ui e lut l’ tude de tissus.
Ces deu te h i ues de to og aphie o t pe is d’a al se l’o ga isatio du seau des filaments et des VSs dans les terminaisons (Fig. 7 ; Siksou et al. 2007, Fernandez-Busnadiego et al. 2010). Les VSs apparaissent interconnectées entre elles par des filaments de 30 nm de longueur, composés pour partie de Synapsine. Chaque VS est reliée en moyenne à 1 à 3 autres VSs. D’aut es t pes de fila e ts d’u e lo gueu de et de atu e o ide tifi e elie t également certaines VSs à la membrane plasmique au niveau du site de libération du neurotransmetteur. La terminaison présynaptique contient donc un réseau de filaments dense et o ple e ui pa ti ipe au e ute e t, au ai tie et à l’o ga isatio des V“s dans le bouton.
36 Figure 7 : Description du réseau de filaments du bouton présynaptique (A, B : Siksou et al. 2007 ; C : Fernandez-Busnadiego et al. 2010).
A. Se tio vi tuelle issue d’u to og a e d’u outo s apti ue d’u e s apse e itat i e
d’hippo a pe de sou is T te de fl he : filament, Flèche : VS a e à la )A . Ba e d’ helle : 200 nm.
B. Reconstruction du contenu du bouton à partir du tomogramme (Rose : filaments, Sphères jaunes : VSs, Sphères bleues : VSs ancrées à la ZA).
C. Re o stitutio du o te u d’u outo ap s oto og aphie Rouge : filaments, Sphères jaunes :
VSs . Ba e d’échelle : 50 nm.
A
37
2. Les vésicules synaptiques
Les vésicules synaptiques sont les organelles renfermant le neurotransmetteur, du glutamate dans le cas d’u e ajo it des synapses excitatrices du SNC (Purves et al. 2004). Elles o t d’a o d t d ites o e ayant une morphologie variable suivant le type de synapse observée (Peters et al. 1991) : sphériques aux synapses excitatrices et pléiomorphiques (mélange de vésicules sphériques et aplaties) aux synapses inhibitrices. Cependant, il a été montré que les V“s des te i aiso s e itat i es ou i hi it i es s’aplatisse t à esu e ue la tonicité de la solution de fixation augmente (Valdivia 1971). D’aut e pa t, ap s i o ilisatio par congélation rapide sans fixateur aldéhydique, toutes les VSs des synapses apparaissent sph i ues et d’u dia t e o p is e t e et (Nakajima & Reese 1983, Tatsuoka & Reese 1989). Ces sultats i di ue t ue l’effet os oti ue des fi ateu s ald h di ues i duit u e d fo atio e a ai e des V“s. L’i o ilisatio pa o g latio appa aît do nécessaire pour étudier la morphologie des VSs.
D’u poi t de ue io hi i ue, la membrane des VSs présente un ratio protéine/lipide extrêmement élevé (60/40 en termes de masse ; Poudel & Bai 2014). On comptabilise 600 domaines transmembranaires par vésicule, ce qui suggère que la majorité de la surface membranaire est couverte de protéines. Ces protéines sont de plus très diverses ; 80 protéines différentes ont pu être identifiées par des approches de protéomique à partir de fractions de VSs purifiées (Fig. 8 ; Takamori et al. 2006). Une partie de ces protéines (protéines SNARE, S aptotag i e, Ra … est i pli u e da s les tapes du t afi des V“s ; elles seront décrites en détail dans les paragraphes suivants. Une autre partie des protéines vésiculaires permet la capture et le stockage du neurotransmetteur : aux synapses glutamatergiques, ces protéines sont les transporteurs du glutamate V-GluT 1 et 2, alimentés par un gradient électrochimique. Ce gradient est entretenu par une ATPase de type V, une pompe à proton dépenda te de l’ATP. Cet équipement protéique permet aux VSs d’assu e la o ti uit du le de li atio -recyclage.
38 Figure 8 : Modélisation d'une VS et des protéines associées à partir de données morphologiques, protéomiques et structurales (Takamori et al. 2006)
39
3. Organisation de la zone active
La zone active est une structure spécialisée du bouton présynaptique, caractérisée en détail grâce à différentes études en ME (Palay 1956, Birks et al. 1960, Couteaux & Pecot-Dechavassine 1970). C’est u e po tion de membrane de 200 à 500 nm de diamètre en général pour les petites synapses excitatrices établies sur des épines. Cette membrane est associée à un réseau de macromolécules sur sa face cytoplasmique et est située en directe opposition à la DPS. Une partie des vésicules du bouton (10% pour ce type de synapse) se trouve en contact avec cette membrane, en rapport étroit avec le réseau de macromolécules. Ces vésicules associées à la membrane de la ZA sont dites « ancrées » à la ZA (Fig. 9A, B). La nature du contact entre ces si ules et la e a e a fait l’o jet d’u e o t o e se. E effet, plusieu s tudes ioph si ues p opose t u od le d’i te diai e d’h ifusio e t e la e a e vésiculaire et la membrane de la ZA, pour expliquer les aspects énergétiques du mécanisme de fusio o pl te des e a es lo s de l’e o tose (Kesavan et al. 2007, Chernomordik & Kozlov 2008). En outre, une étude réalisée en tomographie électronique montre des figures d’h ifusio à la )A de s apses o ti ales (Zampighi et al. 2006). Cependant, les synapses et synaptosomes immobilisés par congélation, sans fixateur aldéhydique, et observés en tomographie montrent clairement une apposition de la membrane des vésicules en contact avec la ZA, et non une hémifusion (Siksou et al. 2009, Fernandez-Busnadiego et al. 2010). L’utilisatio de fi ateu ald h di ue peut e pli ue les figu es d’h ifusio o se es. E effet, il a été montré que les aldéhydes induisent la fusion de vésicules avec la membrane plasmique (Smith & Reese 1980), et induisent des déformations membranaires (Rostaing et al. 2006). Les h ifusio s pou aie t do sulte de l’a ti it du fi ateu su les e anes des VSs et de la ZA.
Le réseau de macromolécules sur la fa e toplas i ue de la )A a d’a o d t d it g â e à l’utilisatio de olo atio s à l’a ide phosphotu gsti ue ou au is uth iodide a a t l’ tape d’e o age (Gray 1963, Bloom & Aghajanian 1966, Pfenninger et al. 1969, Triller &Korn 1985). Ces colorants, denses aux électrons, se fixent uniquement au matériel protéique et permettent do d’ tudie e ME la pa titio du at iel p ot i ue de la )A. E utilisa t es te h i ues, le réseau de macromolécules de la ZA apparaît comme une structure hexagonale d’a as de
40 matériel dense, appelée grille présynaptique, attachée à la membrane. Les vésicules ancrées sont disposées régulièrement entre ces amas (Peters et al. 1991, Triller & Korn 1985). Cepe da t, ette o ga isatio ’est pas isi le su les ha tillons immobilisés sans fixateur aldéhydiquepar des méthodes de congélation rapide. Les échantillons de cortex cerebelleux observés en ME après congélation rapide et cryofracture montrent que les molécules associées à la )A se p se te t sous la fo e d’u réseau de filaments fins connectés au VSs proches de la ZA La dis et al. , Hi oka a et al. . La dis et Reese fo t alo s l’h poth se ue l’utilisatio de fi ateu hi i ue ag ge les fila e ts e t e eu et i duit la fo atio d’a as autour des vésicules ancrées.
L’o ga isatio du at iel de se de la )A o se e pa La dis, Reese et Hi oka a a t o fi e et a a t is e fi e e t pa l’ tude de outo s s apti ues de t a hes d’hippo a pe e tomographie électronique après CHP et cryosubstitution (Siksou et al. 2007, Siksou et al. 2009). Les tomogrammes ainsi que les reconstructions en 3D du bouton montrent que les vésicules ancrées sont regroupées à proximité d’a as de matériel dense, et reliées à ces structures par de courts filaments (Fig. 9). Une étude ultérieure réalisée en cryotomographie sur des préparations de synaptosomes a confirmé la présence de ces fila e ts et l’a se e d’o ga isatio guli e du at iel de se de la )A (Fernandez Busnadiego et al. 2010).
41 Figure 9 : Etude en tomographie du matériel dense de la ZA (Siksou et al. 2009).
A. Deu se tio s vi tuelles de to og a e de )A d’u e s apse e itat i e d’hippo a pe Etoiles :
VSs ancrées).
B. et C. Deux sections virtuelles issues d’u e tomogramme (Etoile : VS ancrée, Flèches longues :
filaments reliant les VSs au matériel dense de la ZA, Têtes de flèches : petits filaments entre une VS ancrée et la membrane plasmique).
C. Reconstitution de la ZA, vues oblique et de face (Bleu : VSs ancrées, Jaune : filaments, Vert : membrane).
Ba es d’ helle : 50 nm.
De plus, la taille de la ZA est positivement corrélée au nombre de VSs ancrées (Fig. 10 ; Murthy et al. 2001, Holderith et al. 2012). Une étude réalisée en cryofracture et
A
42 immunohistochimie a également mis en évidence une corrélation positive entre la taille de la ZA et le nombre de CaV de type 2.1 à la terminaison (Fig. 10 ; Holderith et al. 2012). Ces canaux sont de plus exclusivement localisés à la ZA. Les CaV présents à la membrane de la ZA permettent une augmentation locale et rapide de la concentration de calcium à proximité des V“s a es lo s de l’a i e d’u pote tiel d’a tio à la te i aiso . Ils so t les ga a ts d’u e transmission rapide et fiable, et la ZA pourrait donc être impliquée dans leur organisation. Enfin, la taille de la ZA est corrélée à la taille de la DPS (Harris & Stevens 1989). La taille de la DPS est elle-même corrélée au nombre de récepteurs au glutamate de type AMPA (Takumi et al. 1999). Ainsi, la taille de la jonction synaptique (ZA et DPS) semble être un facteur d te i a t de l’effi a it de la t a s issio synaptique.
Figure 10 : Corrélation de la taille de la ZA au nombre de VSs ancrées et au nombre de CaV (Holderith et al. 2012).
A : Corrélation du nombre de VSs ancrées à la taille de la ZA.
B : I u olo alisatio des CaV ap s of a tu e d’u e s apse de la ou he CA de l’hippo a pe t :
te i aiso p s apti ue ; a e d’ helle : .
C : Corrélation du nombre de CaV à la terminaison à la taille de la ZA (Noir : animal 1, Rouge : animal 2).
43
II. Fonctionnement de la zone active
Le réseau de macromolécules complexe de la zone active organise et régule la libération de neurotransmetteur dans la fente synaptique. Il assure différentes fonctions cruciales pour la
transmission nerveuse : ’est le lieu de l’a age des si ules s aptique face à la DPS, ancrage p e uis pou la fusio d’u e si ule et la li atio de eu ot a s etteu . “o o ga isatio pe et de ouple l’e t e de al iu da s le outo , suite à l’a i e d’u pote tiel d’a tio , à la fusio d’u e pa tie des V“s ancrées. Enfin, les molécules de la ZA participent également à la plasti it à ou t et lo g te e de la te i aiso p s apti ue. La )A pe et do d’assu e une transmission fiable, efficace et régulable (Sudhof 2012). Nous allo s d’a o d p se te le mécanisme de fusion des VSs avec la membrane plasmique à la ZA, puis le mécanisme de recrutement des VSs à la ZA, préalablement à la fusion.
A. Mécanisme de libération du neurotransmetteur
1. Fusion des vésicules à la zone active
L’a i e d’u pote tiel d’a tio à la te i aiso p s apti ue i duit u e d pola isatio de la e a e du outo . Cette d pola isatio p o o ue l’ou e tu e de a au al i ues d pe da ts du oltage p se ts da s la e a e plas i ue. L’aug e tation locale de al iu i t a ellulai e e t aî e des e e ts de fusio s h o is s a e l’a i e du pote tiel d’a tio , et l’e o tose est alo s dite o u e. Des e e ts de fusio peu e t gale e t se p odui e sto hasti ue e t, e l’a se e de pote tiel d’a tio ; on parle dans ce cas de libération spontanée.
La fusion des vésicules à la ZA été visualisée en ME à la jonction neuromusculaire de grenouille (Heuser & Reese 1981) ainsi que plus récemment sur des synapses de neurones hippocampaux de rat en culture (Watanabe et al. 2013). Dans ces deux études, les auteurs appli ue t u e sti ulatio à la p pa atio a a t de l’i o ilise pa o g latio afi de « capturer » des images de fusion à la ZA. Ils observent des figures en Omega correspondant à des VSs en fusion avec la membrane plasmique, dans un délai de quelques ms après la
44 stimulation (Fig. 11). Ce délai est probablement dû aux conditions expérimentales. En effet, des do es le t oph siologi ues i di ue t ue le d lai e t e l’a i e du pote tiel d’a tio et la fusion des VSs est inférieur à 1ms (Sabatini & Regehr 1996).
Figure 11 : Visualisatio de l’e o tose à la jonction neuromusculaire de grenouille en ME (Heuser & Reese 1981).
1. Mi og aphie d’u e te i aiso o sti ul e.
2. Mi og aphie d’u e te i aiso sti ul e ; la membrane plasmique présente des déformations
correspondant à des figures de fusion et la terminaison contient un nombre réduit de VSs comparativement à la figure 1.
2. Probabilité de libération du neurotransmetteur
La p o a ilit de li atio Pl à l’ helle d’u e te i aison présynaptique est définie o e la p o a ilit de fusio d’u e ou plusieu s V“s à la zo e a ti e e po se à u pote tiel d’a tio . C’est u des pa a t es d te i a ts de l’effi a it de la t a s issio . Elle peut être évaluée grâce à des techniques de i os opie opti ue à l’aide de diff e ts
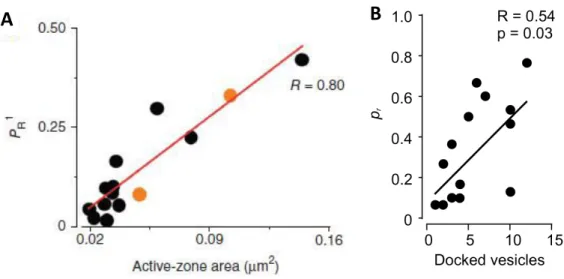
45 colorants fluorescents, ajoutés au milieu extracellulaire et ha g s à l’i t ieu des V“s pa u e première série de stimulations (Betz & Bewick 1992, Granseth et al. 2006, Yang & Calakos 2013). Les sti ulatio s sui a tes i duise t des e e ts d’e o tose ui peu e t t e visualisés grâce à la libération du colorant contenu dans les VSs. Le niveau de fluorescence do e a s à u e i di atio du o e d’ e e ts de li atio . On peut ainsi en déduire la p o a ilit d’ e e ts de li atio pa pote tiel d’a tio . U e aut e thode s’appuie sur les évènements calciques induits par la libération de neurotransmetteur au niveau des épines postsynaptiques (Emptage et al. 1999). Elle consiste à stimuler à basse fréquence des eu o es e plis d’u i di ateu al i ue fluo es e t. Les aug e tatio s de fluo es e e détectées au niveau des épines dendritiques traduisent une augmentation de la concentration posts apti ue de al iu . Cha ue l atio de al iu e po se à u pote tiel d’a tio reflète un ou plusieurs évènements de libération évoquée de neurotransmetteur. Le nombre d’aug e tatio de la fluorescence par stimulation indique alors directement la Pl de la synapse observée. En ME on peut évaluer la Pl en stimulant un neurone en présence de colorant dans le milieu extracellulaire (Murthy et al. 1997). On peut ainsi compter le nombre de VSs reformées pour un nombre donné de stimulations. Ces thodes o t pe is d’ alue u’il a e t e 0.3 et . V“s li es pa pote tiel d’a tio aux synapses e itat i es d’hippo a pe. D’u poi t de vue structural, la Pl est corrélée positivement à la taille de la ZA et au nombre de VSs ancrées (Fig. 12 ; Murthy et al. 2001, Branco et al. 2010, Holderith et al. 2012).
46 Figure 12 : Corrélations positives de la Pl à la taille de la ZA (A, Holderith et al. 2012) et au nombre de VSs ancrées à la ZA (B, Branco et al. 2010).
3. Assemblage du complexe SNARE et rôle dans la fusion
Les protéines SNARE (pour « soluble N-ethylmaleimide-sensitive factor attachment protein receptor ») sont nécessaires à différents processus de fusion de vésicules dans les cellules eucaryotes (Rothman 1994). Ces protéines ont pour particularité de posséder un ou plusieurs
domaines SNARE, des domaines « coiled-coil » fo a t des h li es alpha ui peu e t s’asso ie entre elles.
Le ôle esse tiel des p ot i es “NARE da s l’e o tose des V“s a t d ou e t grâce à l’ tude de l’effet des eu oto i es otuli ue et t ta i ue su le fo tio e e t s apti ue. Différents sous-types de ces toxines clivent spécifiquement la Synaptobrévine2, SNAP25 ou la Syntaxine1, trois protéines des terminaisons présynaptiques du SNC, tout en bloquant les évènements de fusion (Link et al. 1992, Blasi et al. 1993a, Blasi et al. 1993b). Ces protéines ont ensuite été identifiées comme des protéines de la famille SNARE (Sollner et al. 1993). La Syntaxine1 et SNAP-25 sont associées à la membrane plasmique, tandis que la Synaptobrévine2 ou « vesicle-associated membrane protein 2» (VAMP2) est une protéine de la membrane
47 vésiculaire (Fig. 13). Ces trois protéines interagissent pour former un complexe à 4 hélices qui maintient la VS en contact étroit avec la membrane plasmique au niveau de la ZA, dans une conformation favorisant la fusion ultérieure des membranes.
Figure 13 : S h a de l’asse lage du o ple e SNARE (Tang et al. 2006).
D’aut es ol ules de la )A so t i pli u es da s le a is e de fusio des V“s. Les protéines Munc et Mu so t i dispe sa les à l’e o tose et agi aie t e pe etta t l’assemblage du complexe SNARE (Sudhof 2012). Le gène unc18 et son rôle dans le fonctionnement de la terminaison présynaptique ont été identifiés chez le nématode
Caenorhabditis elegans. L’ho ologue de la p ot i e U hez la sou is, Munc18, est
indispensable à la libération du neurotransmetteur (Verhage et al. 2000). Paradoxalement, il a t o t u’elle i te agit a e la “ ta i e, e ai te a t elle-ci dans une configuration fermée ne pouvant pas interagir avec SNAP25 et la Synaptobrévine (Hata et al. 1993, Jahn & Fasshauer 2012). Son rôle reste encore mal compris ; en effet, la délétion du gène munc18 est létale y compris pour des neurones en culture, e ui e d l’ tude de sa fo tio particulièrement compliquée (Heeroma et al. 2004).
Comme pour Munc18, le gène unc13 a été identifié dans un premier temps chez
Caenorhabditis elegans (Brenner 1974). Trois gènes homologues ont ensuite été mis en
évidence chez les mammifères, munc13-1, 13-2 et 13-3 (Brose et al. 1995). La famille de protéines Munc13 est exprimée aux terminaisons nerveuses et est essentielle à la libération de neurotransmetteur. Le rôle de Munc da s l’e o tose a fait l’o jet d’u e s ie d’ tudes
48 réalisées sur différents modèles : Caenorhabditis elegans (Richmond et al. 1999), Drosophila
melanogaster (Aravamudan et al. 1999) et la souris (Varoqueaux et al. 2002). Chez ces 3
espèces, la délétion de unc13, Dunc13 et Munc13, respectivement, provoque un blocage total de l’e o tose o u e et spo ta e. Ces tudes o t pe is de o lu e au ôle esse tiel de Munc13 et ses homologues dans la fusion des VSs à la )A. Le a is e d’a tio de Mu reste pour le moment à l’ tat de od le h poth ti ue. Les protéines Munc13 ont pour particularité de posséder un domaine MUN et un domaine C2A indépendant du calcium. La ise e ide e d’interactions de Munc13 avec Munc18, et du domaine MUN avec la forme fermée de la Syntaxine1, suggère que Munc13 permet à la Syntaxine1 de passer de sa conformation fermée à u e fo e ou e te, pe etta t l’asse lage du o ple e “NARE (Sudhof 2013). Ai si, les effets d’u e i a ti atio de u hez Caenorhabditis elegans sont a olis pa l’e p essio d’u e fo e constitutivement ouverte de la Syntaxine (Richmond et al. 2001).
La Synaptotagmine1 est une protéine transmembranaire des VSs (Matthew et al. 1981). En face cytoplasmique, elle contient deux domaines C2 qui interagissent avec les ions calcium. Cette interaction permet à la Synaptotagmine1 de se lier aux phospholipides membranaires (Brose et al. 1992). Elle interagit également avec le complexe SNARE en se liant à la Syntaxine1 (Sollner et al. 1993). Des études de la transmission chez des animaux KO pour la “ aptotag i e o t pe is de o t e ue ette p ot i e est essai e à l’e o tose d pe da te du al iu . D’aut e pa t, la du tio de l’affi it de la “ aptotag i e au calcium par des manipulations génétiques entraîne une diminution des évènements de fusion
dépendant du calcium (Fernandez-Chacon et al. 2001). L’e se le de es do es sugg e ue la Synaptotagmine1 joue le ôle de se seu al i ue da s l’e o tose o u e (Rizo et al. 2006).
La Complexine a été identifiée en raison de son affinité pour le complexe SNARE (McMahon et al. 1995). Elle agi ait o e u ofa teu de l’a ti it de la “ aptotag i e dans l’e o tose o u e. E effet, les a i au KO pou la Co ple i e p se te t u e di i utio de l’e o tose o u e et u e aug e tatio de l’e o tose spo ta e (Reim et al. 2001). La
49 Complexine interviendrait en amont de la Synaptotagmine : en se liant au complexe SNARE, elle stabiliserait celui-ci dans une forme métastable qui ne peut pas engager la fusion de la VS à la membrane de la ZA. La liaison de calcium à la Synaptotagmine libèrerait la Complexine du complexe SNARE (Giraudo et al. 2006, Tang et al. 2006). L’i te a tio entre la Synaptotagmine et la Co ple i e pe ett ait ai si de ouple la li atio des V“s à l’e t e de al iu da s la te i aiso et d’i hi e les e e ts de li atio as h o e.
Le mécanisme exact de la fusion des membranes de la ZA et des VSs reste encore mal o p is. L’assemblage du complexe SNARE et des protéines associées exercerait une tension mécanique suffisante pour entraîner la fusion des membranes (Kesavan et al. 2007, Bretou et al. 2008). Il e sulte ait l’ou e tu e d’u po e de fusio ui pou ait s’ la gi pa la suite. Ap s la fusio , le o ple e “NARE est d sasse l pa la liaiso d’u e ATPase, la N“F, a e SNAP25 (Rizo & Rosenmund 2008). L’e se le des p ot i es i pli u es da s la fusio peut alors à nouveau participer à l’e o tose des V“s.
4. Rôle de RIM
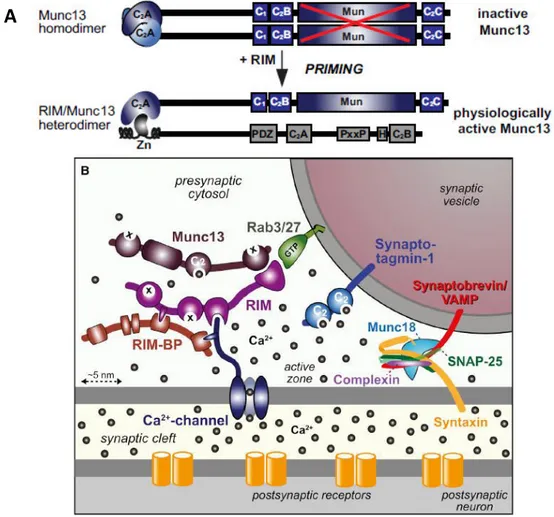
Les protéines RIM (Rab3 Interacting Molecule) sont des protéines multi-domaines identifiées comme des protéines de la ZA grâce à leur interaction avec la protéine vésiculaire Rab3 (Wang et al. 1997). Le génome des Vertébrés comporte 4 gènes codant pour des protéines RIM, chacune pouvant être exprimé sous 1 à 3 isoformes différentes : α, β et γ (Wang & Sudhof 2003, Kaeser 2011). A la terminaison présynaptique, seule la protéine RIM1, forme ajo itai e, et la p ot i e RIM so t e p i es. “ous leu isofo e α, elles poss de t u g a d o e de do ai es d’i te a tio a e les p ot i es de la )A (Fig. 14 ; Coppola et al. 2001, Kaeser et al. 2011) :
- une hélice alpha, do ai e d’i te a tio a e Ra
- un domaine en doigt de zinc N-terminal qui interagit avec le domaine C2A de Munc13 - un domaine PDZ qui se lie aux canaux calciques dépendant du voltage (CaV) de type N, P