MINISTERE DE L’ENSEIGNEMENT SUPERIEUR ET DE LA RECHERCHE SCIENTIFIQUE UNIVERSITE AKLI MOHAND OULHADJ – BOUIRA
FACULTE DES SCIENCES DE LA NATURE ET DE LA VIE ET DES SCIENCES DE LA TERRE DEPARTEMENT D’AGRONOMIE
Réf : ……./UAMOB/F.SNV.ST/DEP.AGR/2017
MEMOIRE DE FIN D’ETUDES
EN VUE DE L’OBTENTION DU DIPLOME MASTER
Domaine : SNV Filière : Sciences Agronomiques
Spécialité : Santé des plantes
Présenté par :
HANSALI Hanane & BELKESSAM Salma
Thème
Contribution à l’étude de la biosystématique des araignées
dans
deux stations de cultures maraichères à Bouira.
Soutenu le :
21 / 06 / 2017Devant le jury composé de :
Nom et Prénom Grade
Mme. BOUBEKA Nabila MCB Univ. de Bouira Présidente
Mme. MAHDI Khadidja MCA Univ. de Bouira Promoteur M. BENCHIKH Chafie
MAA Univ. de Bouira Examinateur
Remerciements
Nous remercions DIEU tout puissant de nous avoir donnée la bonne santé, la
patience, la volonté et le courage pour réaliser ce modeste travail.
Nous tenons à remercier notre promotrice Mme. MAHDI Khadidja de nous
avoir encadrés, pour son aide et ces précieux conseils, son suivi rigoureux et
même pour sa disponibilité derrière nous jusqu’à la fin de ce travail.
Nous tenons à remercier également Mme. BOUBEKKA Nabila qui nous a
enseignés et d’avoir accepté de présider le jury.
Nos remerciements vont aussi à M. BENCHIKHE Chafie. qui nous a
enseignés, et qui a accepté de juger notre travail.
Nous tenons à remercier aussi M. LAMINE Salim qui nous a aidés dans la
réalisation de l’analyse statistique pour cette étude.
Nos remerciements vont aussi à Mme. HADIOUCHE Houria technicienne du
laboratoire de protection des végétaux pour son aide et patience au laboratoire
tout au long de ce travail.
Un grand merci à tous nos enseignants qui ont contribués à notre formation
durant notre cursus universitaire en particulier : M
r. BENCHIKH C., M
me.
MAHDI K., Mme.DOUMANDJI , SAYAH S., Mme. MEBDOUA S.,
Mme .BOUBEKKA. M. LAMINE S., M. .DAHMOUNE F., Mme. CHOUIH
S., Pr. CHIBAN M., Pr. LOUARGIOUI, Mr. ZOUGHAGHE F., Mme.
CHEKROUN, Mme. OUTTAR F., M. MOUNI L.
Nos remercieront chaleureusement le secrétariat de département agronomie à
notre faculté.
En fin nous remercions tous ceux qui ont contribuée de prés ou de loin à la
réalisation de ce travail.
Dédicaces
A mes très chers parents. Aucune dédicace ne saurait être
assez éloquente pour exprimer ce que vous méritez pour
tous les sacrifices que vous n’avais pas cessé de me donner
depuis ma naissance, durant mon enfance et même à l’âge
adulte. Que DIEU vous protège.
A mes très chères frères Khalef et Mouh et ma sœur
Malkhir et son mari et toute la famille Kharoub.
A la mémoire de ma sœur Kahina, je prie ALLAH de
l’accepter avec sa miséricorde dans son vaste paradis.
A D
r.BOUAQLIN M. qui m’a aidé à la réalisation de ce
travail.
A ma chère copine Salma que je remercie vivement pour
son aidé et soutien avant, durant et après la réalisation de
ce travail.
A mes chères copines GRIMME Latifa et
BOUTARENE Imane
A toutes les personnes qui m’ont apporté leur soutien tant
moral que physique et qui de loin ou de près ont contribué à
la réalisation de ce travail
Je dédié ce travail
Dédicaces
A mes très chères parents qui ont veillé sur moi le long de
mes études, que DIEU me les protège.
A mes très chères frères et sœurs surtout Houria
A ma chère copine Hanane que je remercie vraiment pour
son aide et soutien avant, durant et après la réalisation de
ce travail.
A ma chère cousine et sœur Imane
A toutes les personnes qui m’ont apporté leur soutien tant
moral que physique et qui de loin ou de près ont contribué à
la réalisation de ce travail
…
Je dedie ce travail
Salma
Table de matière
Remerciements
Liste des Figures ………...A Liste des tableaux………...C
Introduction……….…1
Chapitre I – Etude bibliographique des araignées I.1 – Généralités sur les araignées………...3
I.1.1 – Morphologie générale des araignées ………...3
I.1.2 – Organisation du corps des araignées ………...3
I.2.1.1 - Le prosoma ou le céphalothorax ………..3
I.2.1.2 - L’opistosoma ou l’abdomen………...6
I.2 – Position systématique des araignées………...7
I.2.1 – La classe des arachnides ……….7
I.2.2 – L’ordre des aranéides ………...8
I.3 – Bioécologie des araignées………...8
I.3.1 – Habitas des araignées ………...8
I.3.2 – Régime alimentaire des araignées………....8
I.3.3 – Reproduction chez les araignées ……….9
I.3.3.1 – Accouplement et ponte ………9
I.3.3.2 – Cycle de développement des araignées ………...9
I.3.4 – L’hivernation chez les araignées ………...10
I.4 – Intérêts des araignées ………...11
Chapitre II – Présentation de la région de Bouira II.1 – Situation géographique de la région d’étude ………...13
II.2 – Climat de la région de Bouira ……….13
II.1.1 – Température………...14
II.1.2 – Les précipitations……….14
II.1.3 – Les vents………...15
II.1.4 – Humidité relative (Hr)………..15
II.3 – Synthèse climatique de la région d’étude………15
II.3.1 – Diagramme Ombrothérmique de BAGNOULS et GAUSSEN………16
Table de matière
Chapitre III – Matériels et méthodes
III.1 – Choix des stations………...18
III.1.1 – Station de la Crête Rouge (Bechloul)……….18
III.1.2 – Station d’El-Asnam……….19
III.2 – Méthodes d’échantillonnage………..19
III.2.1 – Les pots Barber………...20
III.2.1.1 – Description de la méthode………....20
III.2.1.2 – Avantages de la méthode……….20
III.2.1.3 – Inconvénients de la méthode………20
III.2.2 – La chasse à vue ou la capture à main………...21
III.2.2.1 – Description de la méthode………21
III.2.2.2 – Avantages de la méthode……….21
III.2.2.3 – Inconvénients de la méthode………....21
III.3 – Conservation et détermination………...22
III.4 – Exploitation des résultats………...23
III.4.1 – Qualité d’échantillonnage………...23
III.4.2 – Les indices écologiques de composition……….23
III.4.2.1 – La richesse totale (S)………23
III.4.2.2 – La richesse moyenne (Sm)………23
III.4.2.3 – L’abondance relative (A.R%)………...24
III.4.2.4 – Fréquence d’occurrence (F.O%)………24
III.4.3 – Les indices écologiques de structure………...24
III.4.3.1 – Indice de diversité de Shannon-Weaver (H’)………...24
III.4.3.2 – Diversité maximale (H’max)………...25
III.4.3.3 – Equitabilité (E)……….25
III.4.4 – Exploitation des résultats par des méthodes statistiques……….25
III.4.4.1 – Analyse factorielle des correspondances (A.F.C)………25
Chapitre IV : Résultats IV.1 –Biosystématique et description des familles d’araignées inventoriées dans deux stations de cultures maraichères à Bouira ………...26
Table de matière
IV.1.1 – La famille des Lycosidaes ou les araignées loups (SUNDEVALL, 1833)…………26
IV.1.2 – La famille des Gnaphosidaes (POCOCK, 1898)………...26
IV.1.3 – La famille des Salticidaes ou les araignées sauteuses (BLACKWALL, 1841)……..29
IV.1.4 – La famille des Clubionidaes (WAGNER, 1887)………...29
IV.1.5 – La familles des Pisauridaes (SIMON, 1890)………..29
IV.1.6 – La familles des Linyphiidaes (BLACKWALL, 1859)………..29
IV.1.7 – La famille des Theridiideas (SUNDEVALL, 1833)……….34
IV.1.8 – La famille des Thomisidaes ou araignées-crabes (SUNDEVALL, 1833)………...34
IV.1.9 – La famille des Agelenidaes (KOCH, 1837)………...34
IV.1.10 – La famille des Dictynidaes (Pickard-Cambridge, 1871)………...34
IV.1.11 – La famille des Palpimanidaes (THORELL, 1870)………...39
IV.1.12 – La famille des Oxyopidaes ou les araignées Lynx (THORELL, 1870)………39
IV.1.13 – La famille des Lexoscelidaes………39
IV.1.14 – La famille des Filistatidaes (AUSSERER, 1867)………39
IV.1.15 – La famille des Dysderidaes (C. L. KOCH, 1837)……….45
IV.1.16 – La famille des Prodidomidaes (SIMON, 1884)………....45
IV.1.17 – La famille des Sparasidaes (BERTKAU, 1872)……….45
IV.1.18 – La famille des Philodromidae (THORELL, 1870)………...45
IV.1.19 – La famille des Amaurobiidaes(THORELL, 1870)………..49
IV.1.20 – La famille des Zoropsidaes (BERTKAU, 1882) ……….49
IV.2 – Exploitation des résultats obtenus………...51
IV.2.1 – Inventaire de l’Araneofaune dans les stations de la crête Rouge et d’El Asnam………...51
IV.2.2 – L’exploitation des résultats sur l’Araneofaune dans la station de la Crête rouge………..52
IV.2.2.1 – Qualité d’échantillonnage des araignées capturées par la méthode des potsBarber et la capture à main………..52
V.2.2.2 – L’exploitation des résultats obtenus par les indices écologiques de composition………...53
IV.2.2.2.1 – La richesse totale (S) et moyenne (Sm)……….53
IV.2.2.2.2 – Abondance relative des araignées capturées par les deux méthodes à la Crête rouge………..54
Table de matière
IV.2.2.2.3 – Fréquence d’occurrence (F.O. %) des espèces piégées dans la Crête rouge ...56 IV.2.2.3 – L’exploitation des résultats obtenus à la Crête rouge par les indices écologiques de structure ………....60 IV.2.2.3 – Indice de diversité de Shannon-Weaver (H’) et l’équitabilité……….60 IV.2.3 – L’exploitation des résultats sur l’Araneofaune dans la station de d’El-Asnam par lespots Barber et la capture à main………...61 IV.2.3.1 – La qualité d’échantillonnage………...61 IV.2.3.2 – L’éxploitation des résultats obtenus par les indices écologiques de Composition………..61 IV.2.3.2.1 – La richesse totale (S) et moyenne (Sm)……….61 IV.2.3.2.2 – Abondance relative des araignées capturées par les deux méthodes à El-Asnam ...62 IV.2.3.2.2 – Facteur d’occurrence (F.O. %)………..64 IV.2.3.3 – L’exploitation des résultats obtenus à l’El-Asnam par les indices écologiques de structure ...67 IV.2.3.3.1 – Indice de diversité de Shannon-Weaver (H’) et l’équitabilité...67 IV-2-3-4 Exploitation des résultats obtenues dans les deux stations par l’analyse factorielle des correspondances………..68 IV.3 – Discussion des résultats obtenus sur la diversité des araignées dans les stations de la Crête Rouge et celle d’El Asnam par les pots Barber et la capture à la main ………..69 IV.3.1 – Discussion sur l'aranéofaune échantillonnée dans les deux stations d’étude………..69 IV.3.2 – Discussion sur les effectifs des familles d’araignées capturées dans les stations de la Crête Rouge et d’El Asnam………..70 IV.3.3 – Discussion sur les abondances relative des familles d’araignées capturées dans les stations de la Crête Rouge et d’El Asnam………...71 IV.3.4 – Discussion des résultats de la qualité d’échantillonnage de l'aranéofaune capturées dans les stations de la Crête Rouge et d’El Asnam………...72 IV.3.5 – Discussion des résultats exploités par les indices écologiques de composition et de structure………...72 Conclusion………74 Références Bibliographique………..76 Annexes
Liste des figures
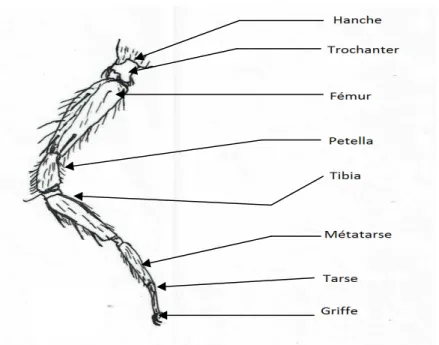
Figure 1 : Les deux types d’orientation des chélicères (originale)………..5
Figure 2 : Les articles d’une patte postérieure d’araignée (Originale)……….6
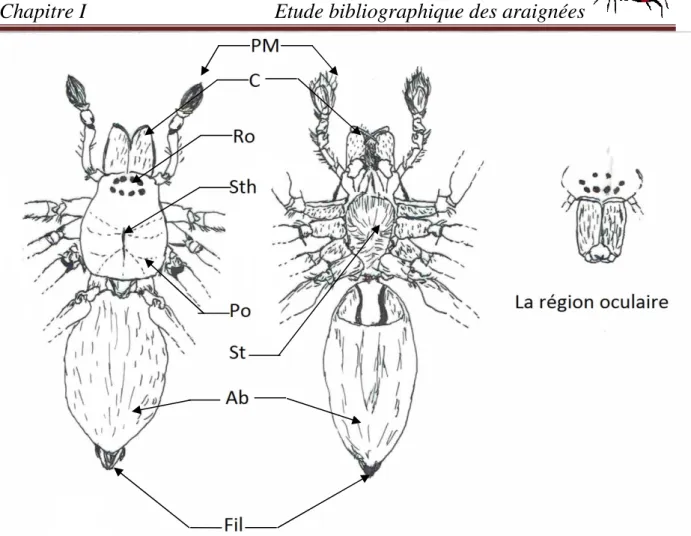
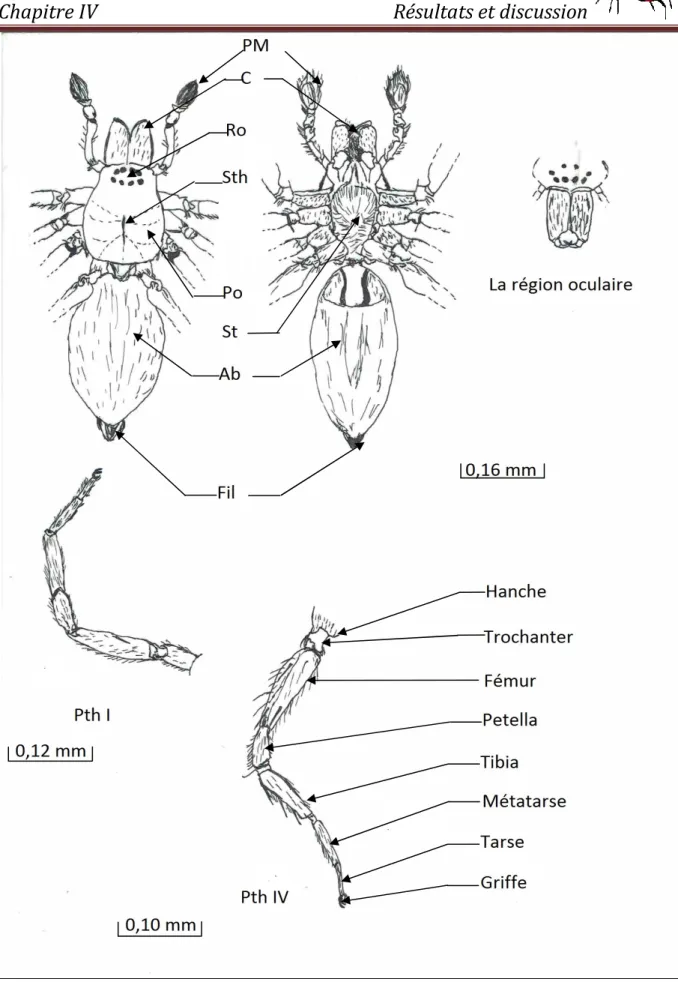
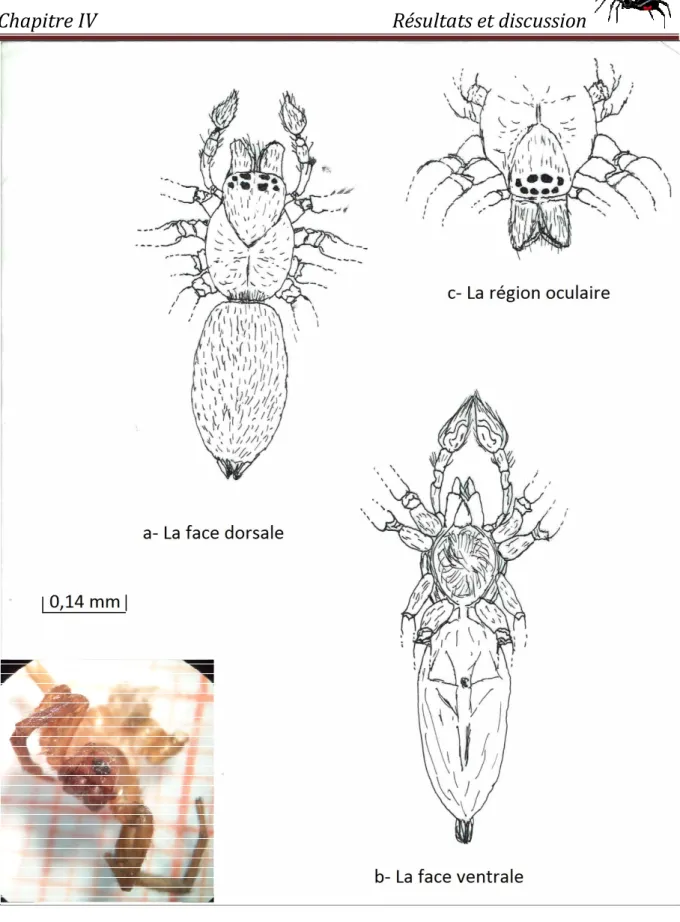
Figure 3 :-a- La face dorsale , -b- La face ventrale : PM.Patte -Machoire,C.Chélicère,Ro.Région oculaire,Sth.Strie thoracique,Po.Prosoma,Ab.Abdomen,Fil.Filières (Originale)……….….7
Figure 4: Situation géographique de la région de Bouira (DPAT ,2010)………...13
Figure 5 : diagramme ombrothermique de Bouira 2016……….16
Figure 6 : Climagramme pluviothermique d’Emberger de la région de Bouira (2002-2012)…....17
Figure 7 : la station de crête rouge (originale)………....18
Figure 8 : la station d’El Asnam (originale)………...…19
Figure 9 : (A) Méthode de pot Barber et (B) méthode de la capture à main………..22
Figure10 : La conservation (A) et la détermination des araignées collectées (B)………..22
Figure 11 : Schéma de la face dorsale et la région oculaire d’un Lycosidae (Originale)………...27
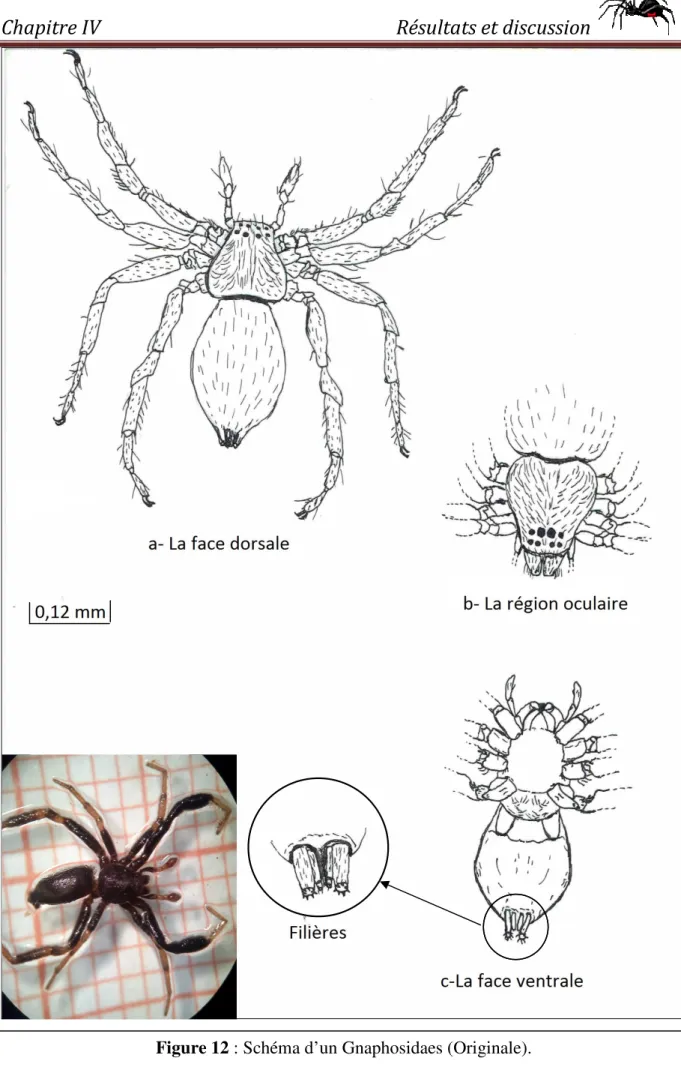
Figure 12 : Schéma d’un Gnaphosidaes (Originale)………...28
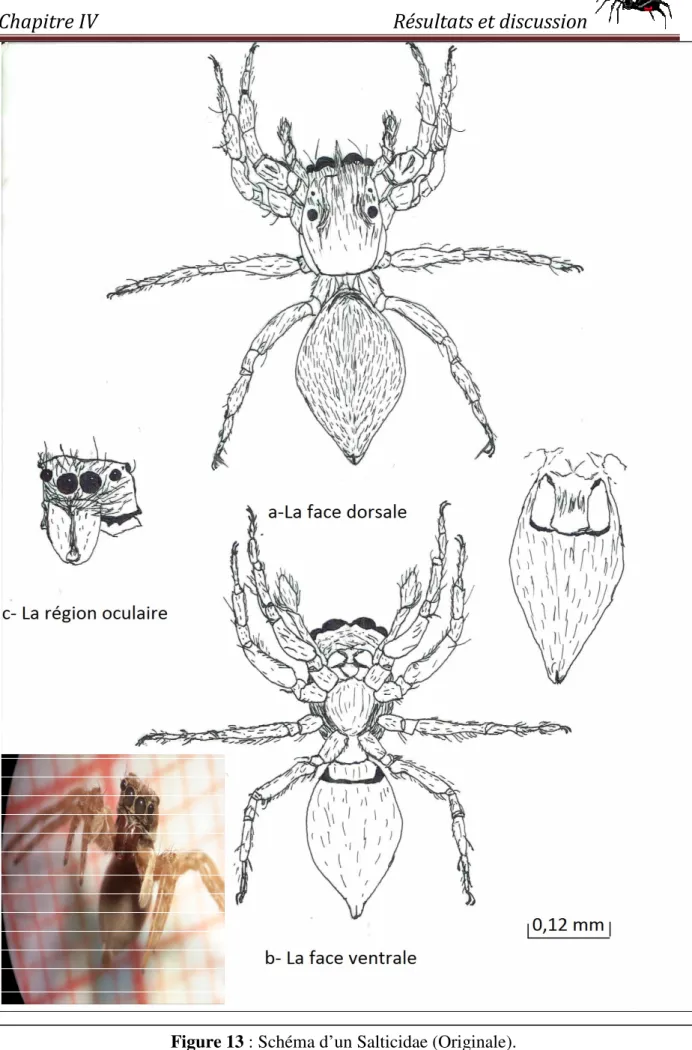
Figure 13 : Schéma d’un Salticidae (Originale)………..30
Figure 14 : Schéma d’un Clubionidae(Originale) ………..31
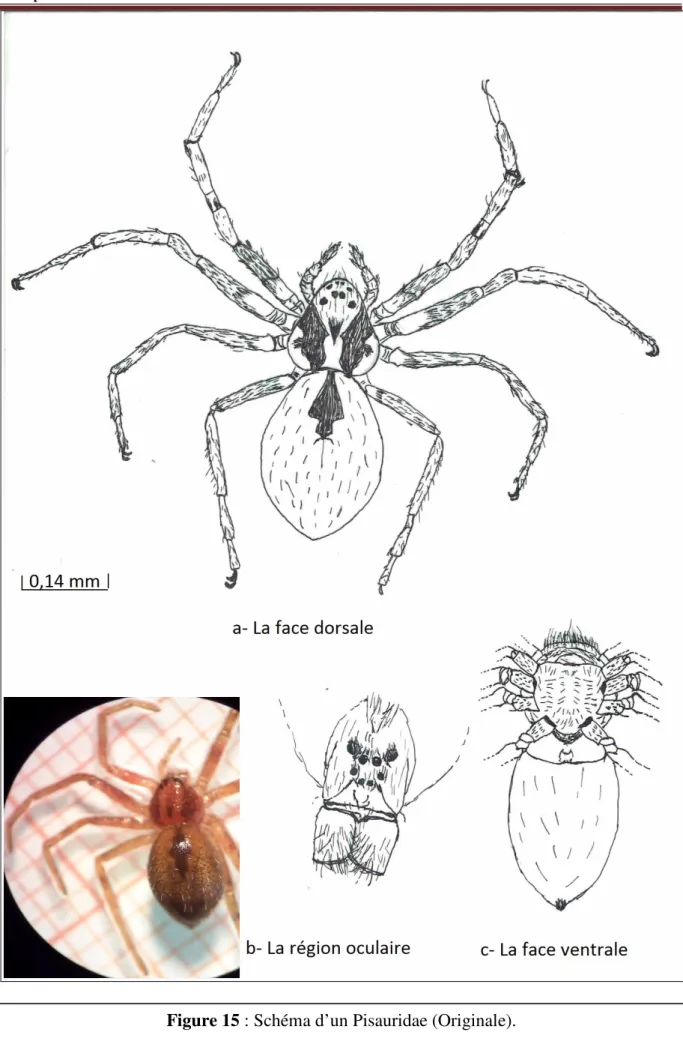
Figure 15 : Schéma d’un Pisauridae (Originale)……….32
Figure 16 : Schéma d’un Linyphiidae (Originale)………..33
Figure 17: Schéma d’un Theridiidae (Originale)………...35
Figure 18 : Schéma d’un Thomisidae (Originale)………..36
Figure 19 : Schéma d’un Agelenidae (Originale)………...37
Figure 20: Schéma d’un Dictynidae(Originale)………..38
Figure 21 : Schéma d’un Palpimaniddae (Originale)………..40
B
Figure 23 : Schéma de La face dorsale et la région oculaire d’un Lexoscelidae (Lexosceles sp)
(Originale)………....42
Figure 24: Schéma d’un Filistatidae (Originale) ………43
Figure 25 : Schéma d’un Filistatidae (Originale)………44
Figure 26 : Schéma d’un Dysderidae (Dysdera Sp.) (Originale)………46
Figure 27: Schéma d’un Prodidomidae (Originale)………47
Figure 28: Schéma d’un Sparasidae avec la région oculaire d’un Philodromidae (Originale)…...48
Figure 29:Schéma d’un Amaurobiidae (Originale)………49
Figure 30: Schéma d’un Zoropsidae (Originale)………50
Figure 31 : L’abondance relative des familles d’araignées capturées à la Crète rouge par les deux méthodes d’échantillonnage……….56
Figure 32 : Fréquence d’occurrence et les constances des familles capturées par les pots Barber (crête rouge)……….58
Figure 33 : Fréquence d’occurrence et les constances des familles capturées par la capture a la main (la crête rouge)………....59
Figure 34: L’abondance relative des familles d’araignées capturées à l’El-Asnam par les deux méthodes d’échantillonnage……….…64
Figure 35 : Fréquence d’occurrence et les constances des familles capturées par les pots Barber (El- Asnam)………..65
Figure 36 :Les fréquences d’occurrence et les constances des familles d’araignées capturées par la capture à main (El-Asnam)………..67
Liste des tableaux
Tableau 1 : Moyennes des températures mensuelles enregistrées dans la région de Bouira
(2016)………..14
Tableau 2 :Précipitations mensuelles enregistrées dans la région de Bouira (2016)…………14
Tableau 3 :Vitesses moyennes des vents enregistrées dans la région de Bouira (2016)……...15
Tableau 4 : Valeurs mensuelles de l'humidité relative moyenne exprimées en % notées à Bouira (2016)………..15
Tableau 5 : Les familles d’araignées recensées dans les deux stations d’étude……….51
Tableau 6 : Qualité d’échantillonnage des familles d’araignées capturées dans la station de la Crète rouge par les méthodes d’échantillonnage……….53
Tableau 7 : La richesse totale (S) et moyenne (Sm) à la Crête rouge……….53
Tableau 8 : L’effectif et l’abondance relative (%) des familles d’araignées trouvées à la Crête
rouge………54
Tableau 8 : L’effectif et l’abondance relative (%) des familles d’araignées trouvées à la Crête
rouge………56
Tableau 10 : Les fréquences d’occurrence et les constances des familles d’araignées capturées
par la capture à main………58
Tableau 11 : H’, H’max et E des familles d’araignées capturées durant les 11 mois d’étude à la
Crête rouge………..…60
Tableau 12 : Qualité d’échantillonnage des familles d’araignées capturées dans la station
d’El-Asnam par les deux méthodes d’échantillonnage………...61
Tableau 13 : La richesse totale et moyenne des individus d’araignées capturés à
l’El-Asnam………..61
Tableau 14 : Les effectifs et l’abondance relative ce chaque familles d’araignées capturées à
l’El-Asnam………..62
Tableau 15: Les fréquences d’occurrence et les constances des familles d’araignées capturées à
l’aide des pots Barber………..64
Tableau 16 : Les fréquences d’occurrence et les constances des familles d’araignées capturées
par la capture à main………66
Tableau 17 : H’, H’max et E des familles d’araignées capturées durant les 11 mois d’étude
Introduction
Introduction
Les araignées constituent un univers très vaste et présentent une extraordinaire variété, environ 50,000 espèces d’araignées ont été décrites et resterait autant à décrire (JENSEN et
al, 2014). Au muséum d’histoire naturelle à Paris ROLLARD et CANARD (2015) les
considèrent comme des animaux pleins de surprises. Ces merveilleuses bêtes se retrouvent dans tous les écosystèmes et effectuent une fonction écologique à grande échelle (FILHO et RINALDI, 2011 ; SOUALAH-ALILA et al. 2013, JAMES, 2014 CANARD et ROLLARD ,2015 et LECOMTE, 2015). Elles ont la réputation d'être de redoutables
prédatrices, elles se nourrissent principalement d’insectes. Elles sont pourtant elles-mêmes les proies, à tous les stades de leur vie, d'une grande diversité d'animaux (ROLLARD ,1992).
D’après LEE et KIM (2001) elles aident à réguler la densité des populations d’insectes nuisible. De nos jours un important intérêt est porté à l’araignée et à sa soie du fait des caractéristiques très intéressantes découvertes chez cette dernière, cette toile représente l’unique instrument de chasse des araignées tisseuses, leur seul moyen de survie (DARRIGRAND et al, 2008). En raison de leurs extraordinaire caractéristiques et secrets , elles ont fait l’objet de plusieurs recherches dans le monde. Parmi les travaux les plus anciens en ce sujet ceux de SIMON (1899, 1914, 1926,1929, 1932, 1937), un peu plus récemment nombreuses études ont été réalisées sur la systématique, l’écologie, lutte biologique , la soie est ces caractéristiques , nous citons les travaux de: ALDERWEIRELD (1989) aux Pays-Bas, YEN (1995) en Australie, CHEN (1999) en Taiwan, JAGER et ONO (2000) et SU et al
( 2011 ) au Japon, LEE et KIM (2001), HO (2012) et LEE et al (2014) en Corée du sud, HUBER (2003) en Afrique de sud; PENG et LI (2003) au Vietnam, PENG et al (2004 ) en
Chine, AMBALAPARAMBIL et al (2005) et SANKAR et THIYAGESAN (2010) en Inde,
TAYLOR et PERSONS (2005) et HOEBEKE et al (2015) aux États-Unis, GILLESPIE et RIVERA (2007) à Hawaii, MADDISON (2015) au Canada et ANTON et al (2016) en
Russie.
En Algérie, quelques travaux sur les araignées ont été réalisés dans divers écosystèmes comme les travaux de KHERBOUCH-ABROUS (2006) dans le Djurdjura ;
BRAGUE-BOURAGBA (2007) dans la région semi-aride de Djelfa et ALIOUA et al (2012) et BERRETIMA (2016) ces deux derniers travaux sont les seuls réalisés au Sahara dans les
palmeraies la région d’Ouargla et de Biskra et Touggourt. Il est à noter que les araignées de la région de Bouira sont très mal connues surtout de point de vue systématique ce qui justifie l’objectif de notre étude qui est d’établir un inventaire des araignées présente dans la région d’étude.
Introduction
2
La présente étude s’articule en quatre chapitres, dont le premier traite les données bibliographiques sur les araignées, le deuxième est consacré à la présentation de la région d’étude, les matériels et les méthodologies adoptées sont rassemblés dans troisième chapitre. Le dernier chapitre comporte les résultats obtenus et leurs illustrations ainsi que leur discussion et en fin une conclusion générale avec les perspectives.
Chapitre I Etude bibliographique des araignées
3
Chapitre I – Etude bibliographique des araignées
Ce premier chapitre traite des généralités concernant la morphologie et de la postions systématique de ce groupe puis la bioécolgie des araignées et enfin l’intérêt des araignées dans les écosystèmes.
I.1 – Généralités sur les araignées
I.1.1 – Morphologie générale des araignées
Les araignées sont des invertébrés dépourvus de squelette interne. les araignées se distinguent au sein de l’embranchement des arthropodes par leur corps constitué de deux masses bien distinctes reliées par un pédicule (DARRIGRAND et al, 2008), le céphalothorax ou prosoma à l’avant (fusion entre la tête et le thorax) et l’abdomen ou l’opistosoma à l’arrière (ROLLARD et CANARD, 2015) Elle reposent sur quatre paires de pattes. Et ne présentent ni ailes ni antennes. Leurs yeux sont simple (ocelles) et non composés (RICARD
et al, 2012). L’une des caractéristiques importante des araignées et la production de la soie :
c’est l’animal de soie (HO, 2012). Selon LUBIN et HENCHEL (1990) et MOIROUX et al
(2014), les araignées sont des organismes poïkilotherme c’est-à-dire elles peuvent ajuster leur
comportement pour maintenir leur température corporelle supérieure ou inférieure à la température de l’environnement. La plupart des araignées adultes vivent de 1 à 2 ans
(HUBERT, 1980).
I.1.2 – Organisation du corps des araignées
Le corps des araignées est divisé en deux parties : le prosoma et l’opistisoma, la première partie composée de céphalus et le thorax qui sont fusionnés. La deuxième partie contient les organes reproducteurs et les filières (BARRION et LITSINGER ,1995).
I.2.1.1 - Le prosoma ou le céphalothorax
Le bouclier céphalothoracique porte les yeux (ROLLARD et CANARD ,2015), les pièces buccales ainsi que six paires d’appendices articulés (une paire de chélicères, une paire de pédipalpes et quatre paires de pattes).
a – Les yeux
D’après BONFOND et al (2005), les araignées portent des yeux simples et non composés de facettes, le plus souvent au nombre de 8 ; bien que certaines espèces n’en possèdent que 6 voire 4 ou 2. Ils arrivent même qu’ils disparaissent complètement chez
Chapitre I Etude bibliographique des araignées
certaines espèces cavernicoles (ALIOUA, 2012). Ils sont placés à l’avant du céphalothorax en 2 lignes de 4 yeux ou selon une autre disposition (BONFOND et al, 2005). L’arrangement des yeux sur le céphalothorax selon HUTCHINSON (2003), est variable selon les groupes les familles et les genres. La taille et la disposition des yeux sont des caractères fréquemment utilisés en systématique principalement pour distinguer les familles (HUBERT, 1980). D’après ROLLARD et CANARD (2015), les araignées qui chassent peuvent avoir une bonne vision alors que les araignées tisseuses de toiles ont une vision relativement mauvaise, elles ne perçoivent que des vibrations de luminosité. Seule la paire des yeux située au milieu et à l’avent permet une vision directe, les yeux latéraux ne détectent que les mouvements et les vibrations, mais ont un excellent sens du toucher grâce aux setaes qui sont des organes sensoriels qui permettent la détection des vibrations sur la toile (HUBERT, 1980).
b – Les pièces buccales
Sous la bouche, un labium ventral est flanqué d'une paire de lames maxillaires. Situés à côté des chélicères, les pédipalpes ou "pattes-mâchoires" servent à l'examen sensoriel des proies et à leur manipulation. Chez les araignées adultes mâles, l'extrémité du pédipalpe porte le bulbe copulateur, organe d'accouplement mâle (BONFOND et al, 2005).
- Les maxilles
Elle s’agit d’une croisance de la hanche de la patte –mâchoire, toujours présente chez les Aranéomorphes rarement chez les Mygalomorphes (LEDOUX et CANARD,1981).
- Le labium ou lèvre inférieure
Elle est flanquée d’une paire de lames maxillaires située à coté des chélicères (BARRION
et LITSINGER, 1995).
c – Les appendices articulés - Les chélicères
Autour de la bouche sont diposé 2 chélicères, selon BONFOND et al (2005) , ces appendices antérieurs sont constitués d’un article basal appelé : le gros stipe et d’un crochet mobile au bout du quel débouche le canal à venin. Ils empoisonner et immobiliser , mordent les proies. Pour ce faire les chélicères sont constitués d’une partie distale portant un aiguillon relié à un canal qui à son tour débouche à une glande à venin.Cette dernière souvent située dans chaque chélicère(BONFOND et al ,2005). La forme des chélicères et la présence de dents, de denticules ou d’autre excroissance sur leur surface peuvent servir en taxonomie des araignées (HUTCHINSON, 2003). De plus la principale distinction visible entre les mygales
Chapitre I Etude bibliographique des araignées
5
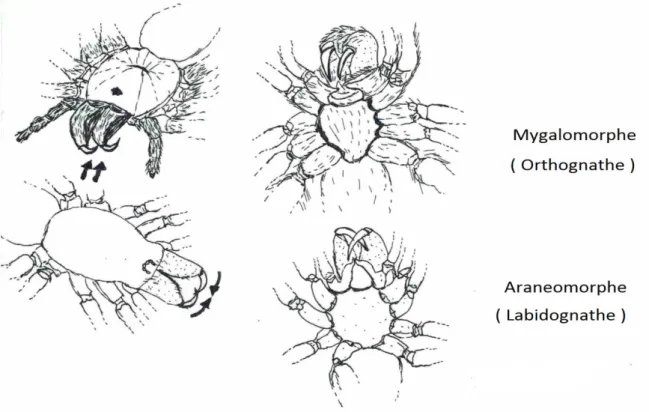
(Mygalomorphes) et les autres araignées (Aranéomorphes) est l’orientation de stipe et de crochet d’où le fait que les mygales piquent et les autres araignées piquent et mordent
(LEDOUX et CANARD,1981; ROLLARD et CANARD ,2015) (Figure 1).
- Les pédipalpes
Souvent appelés :palpes ou pattes-machoires, elles se situent devant la tête. La connaisance de ces structures est capitale pour la détermination à l’espèce mâle
(HTCHINSON, 2003). Selon BARRION et LITSINGER (1995) ils sont différents chez le
mâle et la femelle Ils sont simple d’une forme homogène sans renflement à l’extrémité chez les femelles et les males immatures ,alors que chez les mâles adultes la partie antérieure renflée comme « un gant de box » ou le bulbe copulateure. Ce dérnier porte dans une cavité des structures complèxes qui servent à l’intoduction du sperme dans l’organe génitales femelle :l’épigyne (HUTCHINSON,2003). Les palpes chez les araignées jouent un autre rôle essentielle tactile c’est l’examen et la manipulation des proies (ROLLAND et
CANARD,2015).
Chapitre I Etude bibliographique des araignées
- Les pattes
En 2015, ROLLAND et CANARD signalent que le corps des araignées porte 4 paires de pattes locomotrices articulées, disposées autour du sternum dans la face ventrale du céphalothorax. Chaque patte est composée de 6 articles de la base vers l’apex (Figure 2): les griffes intrviennet dans la manipulation de la soie et dans le déplacement sur les réseaux de fils de la toille (BONFOND et al,2005). Les pattes des araignées portent diverse structures étroitement liées au mode vie particulier de chaque araignée : des organes sensoriels (épins,crins et poils), des structures de stridulations (sons souvent inaudible pour l’oreille humaine) et également pourvues d’organes trasal, trichobotues, lyriforme et fissures
(HUBERT, 1980 et BONFOND et al, 2005).
I.2.1.2 - L’opistosoma ou l’abdomen
Selon CHARLES et al (1990), l’abdomen a une forme ovoïde chez la plupart des araignées, dorsalement il apparait non segmenter, cette partie est relié au céphalothorax par un pédicelle mince .En vue ventrale 2 organes sont importants pour l’arachnologue : les filières
sont en nombre de 3 paires, sont des organes particuliers permettent aux araignées de filer la soie et l’épigyne qui est l’organe reproducteur femelle, on note aussi l’existence de stigmates respiratoires(JENSEN et al , 2014) (Figure 3).Le corps des araignées est recouvert de poils de diverse sorte (chimiorécepteurs, mécanorécepteurs, trichobotries ou autre) ces poils sont des organes sensitifs qui permettent à l’araignée de repérer les vibrations (DARRIGRAND et
al, 2008).
Chapitre I Etude bibliographique des araignées
7
I.2 – Position systématique des araignées
D’après MILLEUR et HARLEY (1999); ROLLARD et CANARD (2015), les araignées (Aranéides) appartiennent à l’embranchement des Arthropodes, cet ensemble comprend des groupes uniquement fossiles, comme les Trilobites et des espèces actuelles rassemblées dans le groupe des Euarthropodes.
I.2.1 – La classe des arachnides
Selon DARRIGRAND et al (2008), l’ordre des araignées, ou les aranéides, fait partie de la classe des arachnides. Ainsi la classe des arachnides comporte onze ordres différents dont les principaux sont : Les scorpions, Les pseudoscorpions, Les acariens et tiques, Les opilions (les faucheux) et les araignées. Les arachnides comptent environ 65 000 espèces connues de par le monde, les Araignées, à elles seules, totalisent 40 000 espèces (DARRIGRAND et al,
2008).
Figure 3 :-a- La face dorsale , -b- La face ventrale : PM.Patte Mâchoire,C.Chélicère,Ro.Région
Chapitre I Etude bibliographique des araignées
I.2.2 – L’ordre des aranéides
D’après (DARRIGRAND et al, 2008), toutes les araignées sont de redoutables prédatrices d’insectes mais également de leur propre ordre, celui des aranéides. Cet ordre des aranéides compte à peu prés 40 000 espèces et 110 familles, dont seul 10 d’entres elles sont capables de créer des toiles orbiculaires. De nombreuses différenciations existent chez les aranéides, ainsi il existe le sous-ordre des mygalomorphes et celui des aranéomorphes. d’après ROLLARD et CANARD ,2015 la principale distinction visible entre les mygales (Mygalomorphes) et les autres araignées (Aranéomorphes) est l’orientation de stipe et de crochet des chélicères d’où le fait que les mygales piquent et les autres araignées piquent et mordent.
I.3 – Bioécologie des araignées
I.3.1 – Habitas des araignées
Selon LEE et KIM (2001), les araignées se retrouvent dans presque tous les habitats, depuis les zones marines jusqu’à la toundra et les pics rocheux. Elles sont adaptées presque à tout les milieux (BORGES et BROWN, 2004). Certaines espèces aveugles vivent recluses dans les grottes et les milieux saharien ; on peut les trouvées même dans les cavités creusées par les pics on parle alors d’araignées arboricoles, seul les eaux salées, les très hautes altitudes et les milieux très froids n’ont pas été colonisés par les Araneas (REBER et al, 2015). RICARD et al (2012) signalent que selon la variété de mode de chasse on peut trouver les
araignées dans toutes les strates et toutes les zones de la végétation, sur les arbres : au niveau du tronc, des branches, des rameaux et du feuillage, Sur le sol : au niveau de la strate herbacée et à la surface ou dans le sol. SAADI et al (2013) qui étudient la distribution des peuplements d’aranéides en fonction de la végétation dans la réserve naturelle de Réghaia confirment que les milieux fermés sont les plus diversifiés, alors que les milieux peu ouverts et ouverts sont plus soumis aux changements du climat offrant ainsi moins de conditions favorables à l’installation d’une faune diversifiée, donc la physionomie végétale conditionne l’existence des communautés d’araignées.
I.3.2 – Régime alimentaire des araignées
Plusieurs auteurs comme (SHEPARD et al, 1987 et FILHO et RINALDI, 2011 et
KOEHLER et ANDRERUS, 2013) confirment que les araignées sont des prédateurs surtouts
des insectes. Ce sont des excellents insectivores dans divers écosystèmes. Elles se nourrissent exclusivement de proies très mobiles qu’elles capturant le plus souvent à l’aide de leur toile,
Chapitre I Etude bibliographique des araignées
9
bien que de très nombreuses espèces préfèrent la chasse à l’affût. Selon RICARD et al, 2012 les araignées peuvent être classées en 2 catégories selon le mode de chasse :
- Les araignées qui ne tissent pas de toile pour capturer leurs proies : on trouve des araignées qui chassent ’’à courre’’ nocturnes ou diurnes et des araignées qui chassent ’’à l’affût’’ c’est-à-dire en embuscade.
- Les araignées qui constituent des toiles pour capturer leurs proies : on trouve des familles qui construisent des toiles tubulaires, irrégulières et encore bien entendu, des toiles géométriques plan.
Toutes les araignées pré-digèrent leurs proies par l’injection des sucs digestifs, après elles consomment le repas liquéfié. Les araignées peuvent survivre pendant de longues périodes sans alimentation, certaines araignées ont été maintenus en vie pendant plus de deux ans sans alimentation (KOEHLER et ANDRERUS, 2013).
I.3.3 – Reproduction chez les araignées 1.3.3.1 – Accouplement et ponte
Selon RICARD et al (2012) la plupart des arachnides sont ovipares et les sexes sont généralement séparés donc il y a un dimorphisme sexuel chez les araignées. Les femelles se distinguent par leur taille supérieure avec un abdomen plus gros (JENSEN et al, 2014). Chez
les araignées adultes mâles, l'extrémité du pédipalpe porte le bulbe copulateur, organe d'accouplement mâle (BONFOND et al, 2005). .Une fois mature les mâles d’araignées cessent de s’alimenter et partent à la recherche d’une femelle réceptrice pour s’accoupler. Ils arrivent dans l’environnement en pistant les traces odorantes (les phéromones) laissées par les femelles sur leur fil de déplacement (ALIOUA, 2012).
D’après BONFOND et al (2005), l'accouplement ne survient qu'après une période préliminaire; la parade nuptiale; au cours de laquelle le mâle est reconnu comme n'étant pas une proie et apaise le tempérament prédateur de la femelle. Il n'est pas rare, en effet, qu'il se fasse dévorer par la femelle. Les lycoses et les Salticides pratiquent une sorte de danse très visuelle au cours de laquelle des mouvements de pattes et de palpes caractéristiques sont effectués. Enfin, d'autres espèces émettent des signaux sonores produits par un organe stridulatoire. Une fois la femelle séduite; le mâle s’approche avec précaution et introduit le sperme à l’aide de ses bulbes copulateurs dans l’orifice génitale femelle : l’épigyne
(NOVAES RAMIRES et al ,2012). La femelle peut stockée le sperme dans son
Chapitre I Etude bibliographique des araignées
De printemps à l’été les araignées femelles pondent entre une centaine et des milliers d’œufs à l’intérieur d’un cocon soyeux plus ou moins complexe et imperméable suspendu ou fixé sur la végétation (HUBERT, 1980 et KRAFFT, 2002). Ce dernier offre une protection
aux œufs jusqu’à l’éclosion (FOELIX, 2011)
.
Beaucoup d’araignées meurent juste après la ponte, elles prennent donc la précaution de mettre leurs cocon à l’abri (sous des pierres, des feuilles), alors que certaines espèces restent près de celui-ci jusqu’à l’éclosion des œufs. Certaines espèces s’occupent encore des jeunes (ROLLARD, 1992 et LEBORGNE et PASQUET, 1995).I.3.3.2 – Cycle de développement des araignées
Généralement le cycle de vie de l’araignée se réalise sur un an en 3 étapes à savoir : la période embryonnaire, larvaire et nympho-imaginale comme le modèle d’une métamorphose incomplète (HAWKESWOOD, 2003). Chez la plupart des espèces les œufs éclosent à l’automne, mais restent en hivernation dans le cocon jusqu’au printemps, les jeunes araignées qui sortent des œufs ressemblent aux adultes, mais en diffère par la taille. Pour atteindre la taille adulte une araignée doit subir entre 6 et 12 mues tout au long de leur vie (BUISSET et FEREY, 2014 ) .Le nombre de mues varie en fonction de la taille du corps final, les petites
araignées n’ont besoin que de quelques mues (environ 5) ,tandis que les grosses araignées passent à travers environ 10 mues pour atteindre le stade adulte (BONNET,1930) .Au cour de la mue les structure du corps deviennent différenciés (HARIVELO RAVAOMANARIVO,
2014). Les intervalles entre mues sont en fonction des conditions nutritionnelles (HOMANN, 1949). Peu de temps après ils seront capable de produire de la soie. Les araignées jeunes errent lentement ou dispersent par une méthode connue sous le non ’’Baloning’’ durant laquelle les petites se déplacent vers le bord d’une feuille ou un rameau et avec l’abdomen placé très haut, elles sortent un long et fin fil de soie qui leurs permet de voler avec le vent
(ALIOUA, 2012). Ce phénomène favorise la dispersion des espèces et la colonisation des
espaces nouveaux (LEBORGNE et PASQUET, 1995). Les araignées deviennent donc solitaires après une courte phase grégaire (KREFFT, 2002). Il est à noter que les petits mâles atteignent la maturité plus vite que la femelle (DEEVEY, 1949).
I.3.4 – L’hivernation chez les araignées
Selon BUISSET et FEREY (2014), les araignées ont développées plusieurs adaptations pour survivre à des conditions défavorables comme le froid, la forte humidité et le manque de nourriture. Elles relèvent ces défis en colonisant des microhabitats appropriés, en augmentant
Chapitre I Etude bibliographique des araignées
11
leur résistance au froid et en réduisant leur taux métabolique .En hiver certaines araignées se réfugient dans des habitats pérennes (bois, praires et accotement) où les perturbations sont moindres et les ressources alimentaires sont garanties (BUISSET et FEREY, 2014). Environ
85% de la faune des araignées hivernent dans le sol, principalement dans la litière qui est un bon isolant contre le froid (ALIOUA, 2012). De plus EDGAR et LOENEN (1974) signalent que le microhabitat de la litière protège les araignées non seulement des fluctuations extrêmes de température, mais aussi de la dessiccation.
1.4 – Intérêts des araignées
Les araignées sont des animaux omniprésents dans les écosystèmes terrestres, elles constituent une patrie essentielle des arthropodes prédateur (TURNBULL, 1973 et
PLAGENS ,1983). RIECHERT et LOCKLEY, 1984 supposent que les araignées jouent un
rôle majeur dans la régulation des populations de plusieurs ravageurs .En particulier d’insectes nuisibles (LEE et KIM, 2001). D’après YAN, 1995, les araignées en 3 rôles principaux :
a- Assurent le contrôle biologique
Ce sont de redoutable prédatrices généralistes et semblent être des auxiliaires, elles figurent parmi les premières prédateurs en début de saison à pouvoir consommer les ravageurs dès leur émergence (RICARD et al ,2012) ,en raison de cette activité prédatrice elle contribue à la limitation de la croissance exponentielle des populations de ravageurs dans divers écosystèmes (KAWAHARA et al,1972),de plus HUMPHYREYS ,1988 les considère comme les meilleurs invertébrés carnivores en milieu naturel ,agricole et urbain, alors que
JAGER et ONO,2000 signalent que les araignées jouent un rôle important dans les zones
tropicales, subtropicales et les agro-écosystèmes , elles capturent un grand nombre d’insectes volumineux. Si on considère que chaque espèce capture environ 10 insectes par jours, durant 50 jours elles peuvent détruire 3×107 insectes (NYFFELER et BENZG, 1987).
b- Source de produits utiles
Les araignées sont connues par la production de 2 produits à savoir la soie et le venin
(HANSELL, 1992). La soie des araignées est utilisé par l’homme, par exemple des orbites
sont collectées pour être utilisés comme filets de pêche en Nouvelle-Guinée (îles en Indonésie), de même elle est utilisée par l’armée Américaine pour la fabrication des gilets
Chapitre I Etude bibliographique des araignées
pare-balles ou des fils chirurgicaux (FAULLS ,1991). Plus récemment, des chercheurs ont aussi tenté de synthétiser la soie à partir de plusieurs organismes depuis des bactéries jusqu’aux chèvres (ROLLARD et CANARD, 2015). La soie est également prise par certaines espèces comme les oiseaux qui l’utilisent pour tapisser l’intérieur de leur nid
(STORER et HANSELL, 1992),c’est en particulier le cas du colibri dans les régions
équatoriales qui prélève des lambeaux de soie sèche non gluante de l’araignée sociale Anelosimus eximius de Guyane en Amérique du sud (KRAFFT,2002).
La plupart des recherches sur le venin d’araignées concernent des espèces médicalement importantes et connues par leurs dangers vis-à-vis des hommes (QUICK, 1988). Plus
récemment des recherches sont en cours pour le développement de nouveaux insecticides à base de venin d’araignées (QUISTAD et al, 1992).
c- Indicateurs environnementaux
En tant que groupe les araignées ont quelques caractéristiques comme des bio-indicatrices, YEN, 1995 signale que la présence d’araignées mygalomorphes mêles sur la surface de sol est une mesure d’activité biologique. 2 familles d’araignées sont particulièrement intéressantes, les Lycosidaes représentées essentiellement par Pardosa agrestis et Alopecosa cuneata et les Linyphiidaes avec comme espèces Oedothorax apicatus et Erigone atra se révèlent comme bio-indicatrices des parcelles enherbées (KONATE,
2004). Elles sont aussi considéréés comme des bio-indicatrices dans les réserves natureles (GUY, 1992).
Chapitre II Présentation de la région d’étude
Chapitre II – Présentation de la région de Bouira
Dans ce chapitre nous allons présenter la région de notre étude : sa situation géographique, son climat (température, précipitations, vent et humidité relative), synthèse climatique de la région par le diagramme ombrothérmique de BAGNOULS et GAUSSEN et le pluviothermique pluviothérmique d’Emberger.
II.1 – Situation géographique de la région de Bouira
La région de Bouira se situe dans la région centre nord de l’Algérie, Elle s’étend sur une superficie de 4456,26 km² représentant 0,19% du territoire national. Le chef-lieu de wilaya est situé à près de 120 km de la capitale Alger (DPAT, 2010). La région de Bouira situe à une altitude de 555 m , (36°22’15.98’’N.3°54’05.63’’E) de 114,94 Km d’altitude . La région de Bouira est délimitée (figure 4) au nord par de Tizi-Ouzou, à l'est par Bordj Bou Arreridj, au sud par la région de M'Silla et à l’ouest par les Médéa et Blida.
Chapitre II Présentation de la région d’étude
14
II.2 – Climat de la région de Bouira
D’après DPAT ,2010 le climat de la région de Bouira est chaud et sec en été, froid et pluvieux en hiver. Cependant, les araignées vivent dans des environnements strictement définis, la limitation est assurée par des conditions physiques, comme la température, l’humidité, le vent, l’intensité lumineuse, et aussi par des facteurs biologiques, comme le type de végétation, l’approvisionnement alimentaire, la compétition alimentaire et les ennemies
(FOELIX, 2011). II.1.1 – Température
A Bouira, la température moyenne annuelle est de 16,8°c (Tableau 1) avec une température mensuelle moyenne du mois le plus froid (décembre 2016) est de 10.8° C et la moyenne du mois le plus chaud (Août 2016) est de 27° C (Station météorologique d’Ain
Bassem de 2016). Selon DAJOZ (1996) et RAMADE (1984), le facteur thermique agit
directement sur la vitesse de réaction des individus, sur leur croissance. Ce facteur est important pour la détermination des activités d’une araignée (FOELIX, 2011).
Tableau 1 : Moyennes des températures mensuelles enregistrées dans la région de Bouira
(2015) ((Station météorologique d’Ain Bassem de 2016).
(T : température ; Tm : température minimale ; TM : température maximale).
II.1.2 – Les précipitations
La région de Bouira se caractérise par une pluviométrie favorable Le cumul est d’environ 124,5 mm (Tableau 2) (Station météorologique d’Ain Bassem de 2016).
Tableau2 : Précipitations mensuelles enregistrées dans la région de Bouira en 2016.
Juin Juil Août Sep Oct Nov Déc Jan Fév Mar Avr Mai Cumul P ( mm) 2,7 3,4 0,3 0 23 9,7 27,6 15 4,5 10 5 3,3 124,5
(P : précipitations exprimé en millimètre). (Station météorologique d’Ain Bassem de 2016). Jan Fév Mar Avr Mai Juin Juil Aoû Sep Oct Nov Déc T 11,4 11,4 13,9 4,7 16,7 17,8 22,9 27 25,3 21,6 20,2 10,8
T m 1,2 1,2 2 2,4 3,5 6 8 10,3 13,3 12 8,2 3
Chapitre II Présentation de la région d’étude
II.1.3 – Les vents
Les vents d’Est et d’Ouest prédominent et présentent des vitesses peu importantes. Avec une vitesse moyenne annuelle est de 14,94 Km/h (Tableau 3) (Station météorologique
d’Ain Bassem de 2016).
Tableau 3 :Vitesses moyennes des vents enregistrées dans la région de Bouira (2016).
Juin Juil Août Sep Oct Nov Déc Jan Fév Mar Avr Mai V M V
(km/h) 12,6 11,52 12,96 11,52 10,08 11,52 13,68 22,5 23,5 15,5 17 17 14,94 (V : vent moyen ; VM : vent moyen annuel.)
Ce facteur est très important chez plusieurs famille d’araignées, il assure le transport aéronautique des juvéniles (Ballooning) (FERNANE, 2009)
II.1.4 – Humidité relative (Hr)
L’Humidité relative présente une moyenne annuelle de 60,08% dans la région de Bouira(Station météorologique d’Ain Bassem de 2016).Comme les araignées peuvent réguler leurs températures, l’humidité intervient fortement dans ce processus. Il semble cependant que la plupart des araignées peuvent prendre l’eau du sol humide, à condition que l’humidité du substrat soit supérieure à 12 % (FOELIX, 2011).
Tableau 4 : Valeurs mensuelles de l'humidité relative moyenne exprimées en % notées à
Bouira (2016).
Juin Juil Août Sep Oct Nov Déc Jan Fév Mar Avr Mai H m H R
(%) 57,5 41,5 46,5 51,5 59 68 78,5 78,5 60 65 61,5 53,5 60,08
(H R : humidité relative exprimé en % ; Hm : humidité moyenne annuelle) (Station météorologique d’Ain Bassem de 2016).
II.3 – Synthèse climatique de la région d’étude
La synthèse climatique s’effectue de deux manières, elle implique la construction du diagramme ombrothermique de Bgnouls et Gaussen et du climagrame d’Emberger.
Chapitre II
II.3.1 – Diagramme Ombrot
Le diagramme ombroth d’une région donnée. On obtie en ordonnées les températures l’échelle des précipitations com
Le diagramme ombro périodes, l’une humide qui s’ sèche dure près de 4 mois. Elle
II.3.1 – Climagramme pluv
Selon DAJOZ (1996) climats méditerranéens. Il précipitations et se calcule par
Q
2=
Avec : - P : précipitat - M: moyenne d - m: moyenne d 0 10 20 30 40 50 60 70 80 90 100 I II III IV P ré ci pi ta ti ons m m Figure 5: - Diagr PPrésentation de la région d
16othérmique de BAGNOULS et GAUSSEN
othérmique permet de déterminer les périodes tient ce diagramme en portant en abscisse les res d’un côté et les précipitations de l’autre, t omme étant le double de celle des températures
rothermique de la région de Bouira montre l s’étale sur 6 mois de septembre jusqu’à la m
lle va de la fin mars jusqu’à la fin du mois d’ao
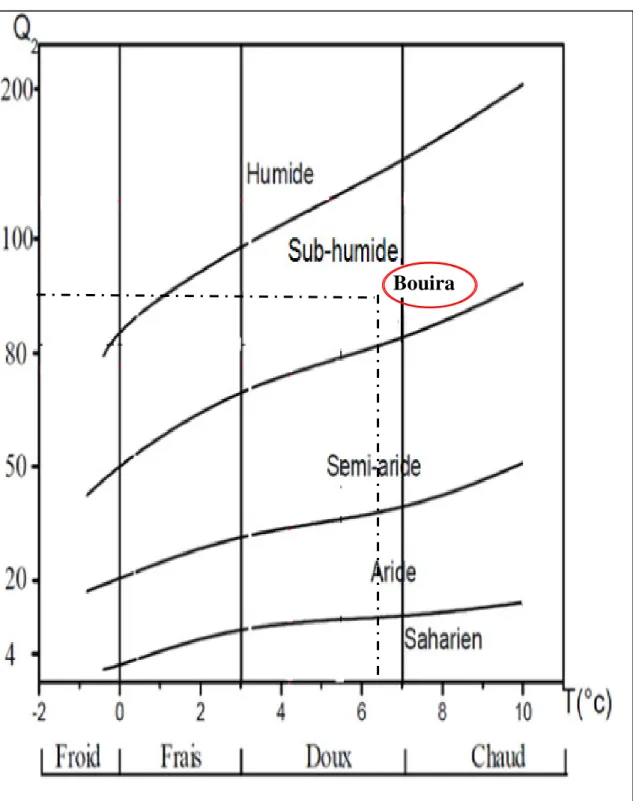
uviothermique d’Emberger
96) le climagramme d’Emberger permet de
l dépend des températures minimale et ar la formule suivante STEWART (1969).
.
ations moyennes annuelles en mm.
e des maxima du mois le plus chaud en °C. des minima du mois le plus froid en °C.
V VI VII VIII IX X XI
agramme ombrothermique de Bouira en 2016
Précipitation Température Période humide Période sèche
d’étude
es sèches et humides es mois de l’année et , tout en considérant res (p≤ 2t). l’existence de deux mi-mars. La saison aout. (Figure 5).e classer les divers t maximale et des 0 5 10 15 20 25 30 35 40 45 50 XII T em pé ra tur es °C . 2016
Chapitre II Présentation de la région d’étude
La région de Bouira présente un Q2 de 56,86. En rapportant les valeurs de Q3 et la température minimale du mois le plus froid (1,2°C) sur le climagramme d’Emberger, on situe la région de Bouira dans l’étage climatique sub-humide à hiver doux (Figure 6).
Bouira
Chapitre III Matériels et Méthodes
Chapitre III – Matériels et méthodes
Dans ce chapitre les stations d’étude sont présentées en premier, ils sont suivis par les méthodes d’échantillonnage utilisées et en fin l’exploitation des résultats par des indices écologiques de composition et de structure et par des analyses statistiques.
III.1 – Choix des stations
Pour l’étude de l’araneofaune dans la région de Bouira deux stations sont choisis pour la réalisation de ce travail : la station de La Crête Rouge (Bechloul) et la station d’El-Asnam.
III.1.1 – Station de la Crête Rouge (Bechloul)
La station de la Crête Rouge (Bechloul) (36°21’37 .11’’N. 4°06’56.01’’E) est située dans la région de Bouira. Elle est délimitée à l’ouest par El-Asnam, le parc national de Tikdja et Haizer. Au sud par Ahl-El Kasr et à l’est par Al-Adjiba et le Djurdjura et au nord par le parc national de Djurdjura. Elle se situe à une altitude de 438m (Google earth ,2017).La station est Caractérisé par des terres agricoles fertiles et par la présence de barrage Tilesdit comme une ressource hydrique importante avec un stock de 167 millions de m3 dans une superficie de près de 7 000 ha. Notre échantillonnage a été réalisé dans un champ de 1 ha, cultivé par des cultures de piment durant la période estivale et par le haricot vert durant l’automne. Tout au long des périodes hivernale et printanière la fève et le petit pois (Figure 7).
Chapitre III Matériels et Méthodes
19
III.1.2 – Station d’El-Asnam
El-Asnam fait partie de la grande tribu kabyle des Ath Yaala, délimité à l’ouest par Taghzout et Haizer, au sud par Oued El Berdi et Ahl-El Kasr, à l’est par Bechloul et Al-Adjiba et au nord par le parc national de Djurdjura. Elle se situe à une altitude de 539m ; (36°21’27 .66’’N.4°02’19.90’’E) (Google earth ,2017). Cette station est caractérisée par des terres agricoles qui s’étendent sur une superficie de 2.300 hectares. L’échantillonnage a été réalisé dans une parcelle cultivée par la tomate durant la période estivale, et par l’haricot vert durant la période automnale et pendant les périodes hivernale et printanière a été cultivée par la fève et les petits pois (Figure 8).
III.2 – Méthodes d’échantillonnage
Les araignées sont présent partout mais souvent discrètes bien cachet ou inaccessibles, leurs étude impose donc l’utilisation d’un certain nombre de techniques de capture afin d’obtenir des échantillons représentatifs (MARECHAL, 2011). Différentes méthodes de capture et d’observation doivent être combinées, si l’on souhaite étudier l’ensemble de la diversité de la communauté des araignées d’un milieu (RICARD et al ,2012 et LECOMTE
,2015). D’après BENKHELIL, 1991 ; SCHARFF et al, 2003; MARECHAL, 2011 ; ALIOUA ,2012 ; RICARD et al ,2012 et LECOMTE ,2015 plusieurs méthodes sont
utilisées pour la collecte des araignées, souvent similaires à celles mise en œuvre pour Figure 8 : La station d’El Asnam (originale).
Chapitre III Matériels et Méthodes
capturer les insectes : tamisage ou extraction de la litière, battage de la végétation, le fauchage, les pots Barber et la capture à main. Pour cette étude deux méthodes de capture sont utilisées : les pots Barber et la capture à main, dans chaque station.
III.2.1 – Les pots Barber
III.2.1.1 – Description de la méthode
Méthode inventée par H.S Barber dans les années 1930 (MARECHAL, 2011). D’après BENKHELIL (1991) c’est l’une des méthodes absolues qui sont d’excellents moyens permettant un véritable échantillonnage de la faune terrestre. Les pièges sont placés dans le sol avec leur ouverture au ras du sol. Les araignées mobiles chutent dans le récipient qui contient un liquide conservateur ou un détergeant (CANARD, 1981 ; LECOMTE, 2015). L’échantillonnage a été réalisé durant une période d’une année, qui s’échelonne de Juillet 2016 à Mai 2017 dans les deux stations choisies. Les pots Barber utilisés sont des boites de conserve métallique de 12 cm de hauteur et 8 cm de diamètre à raison de 8 pots par station 2 fois par mois. Le contenu de chaque pot est récupéré après 48 heures et conservé directement dans de l’alcool (Figure 9-A).
III.2.1.2 – Avantages de la méthode
Cette technique est facile à l’utilisation et peu coûteuse, le piège d’interception capture les araignées marcheuses au sol au hasard de leur déplacement sans agir sur leurs comportements. Ce genre de piège permet surtout la capture de divers arthropodes marcheurs parmi eux les araignées (BENKHELIL, 1991) de même elle permet la capture des espèces diurnes et nocturnes, elle permet capturer 36 % espèces d’aranéides.
(MIDOUNE et SLIMANI, 2009).
III.2.1.3 – Inconvénients de la méthode
La méthode permet la capture d’autres espèces utiles (les auxiliaires) tel que les polinisateurs, de plus elle ne permet de piéger que les espèces présentes sur l’air échantillon
(IMINE, 2011). Aussi ces pièges sont facilement détruits par les mammifères ongulés,
sauvages et domestiques (ZAGATTI et PESNEAUD, 2001). En effet l’excès d’eau en cas de forte pluie peut inonder les boites dont le contenu déborde entrainant vers l’extérieure les arthropodes capturés auparavant (IMINE, 2011).
Chapitre III Matériels et Méthodes
21
III.2.2 – La chasse à vue ou la capture à main III.2.2.1 – Description de la méthode
Selon HUBERT ,1979 ; ROLLARD et CANARD, 2015 c’est une méthode simple consiste à noter ou à capturer tous les individus sur une surface délimitée, elle s’effectue au gré des déplacements de l'observateur sur un site, dans un milieu précis, ou bien se voulant exhaustive, elle a lieu sur une surface limitée par un cadre de surface connue; sur cette surface les toiles peuvent être mises en év1dence par pulvérisation d'eau (CANARD, 1981). Elle est praticable que dans certains cas particuliers lorsque les individus sont peu mobile (LECOMTE ,2015), elle est plus compliquée à développer pour les espèces errantes, si ce n’est dans des milieux à végétation rare (ROLLARD et CANARD, 2015). Elle est particulièrement adaptée pour les espèces du sol ou vivent dans la végétation herbacée, les arbustes et les arbres ou espèces frondicoles (LECOMTE ,2015). Durant les mois d’étude nous avons effectués deux sorties par mois au niveau de chaque station (Figure9 -B).
III.2.2.2 – Avantages de la méthode
D’après LECOMTE (2015), la méthode permet de récolter de nombreux insectes rares (et d'autres animaux) dans un délai court. Avec cette méthode on peut prélever que la faune à étudier (BERITIMA, 2016). Les spécimens récoltés ne perdent pas leurs cratères comme la coloration par exemple par ce qu’ils sont directement congelés.
Cette méthode simple et efficace ne nécessite pas l’emploi de produits chimiques. Il faut laisser les spécimens au moins plusieurs heures, voire plusieurs jours, dans le congélateur. Il est possible de conserver les échantillons au congélateur pendant plusieurs mois et même plusieurs années sans aucun problème (FRANCK, 2008).
III.2.2.3 – Inconvénients de la méthode
Quelle que soit la méthode d'échantillonnage, le milieu sera endommagé, ne serait-ce que par le passage de l’opérateur (BERITIMA, 2016). Il y a possibilité de ne pas trouver des araignées dans un milieu durant de longs périodes d’échantillonnage.
Chapitre III Matériels et Méthodes
III.3 – Conservation et détermination
Après récolte, les araignées sont mises directement dans l’alcool 70° dans des tubes étiquetés, chaque étiquette porte : la date de récolte, le nombre d’individus et le numéro de pots (pour les pots Barber) (Figure 10). La détermination des spécimens d’araignées est faite au laboratoire de protection des végétaux de la faculté SNVST de l’U.A.M.O. Pour se faire nous avons utilisés un stéréo-loupe et divers clés d’identification de LEDOUX et CANARD
(1981), CANARD et ROLLARD (2015).
A B
Figure 9 : (A) Méthode de pot Barber et (B) méthode de la capture à main (Originale).
B A
Chapitre III Matériels et Méthodes
23
III.4 – Exploitation des résultats
Les résultats obtenus dans cette étude sont soumise en premier à la qualité d’échantillonnage, les indices écologiques de composition, puis les indices de écologique de structure en fin les méthodes statistique.
III.4.1 – Qualité d’échantillonnage
La qualité de l’échantillonnage est le rapport du nombre des espèces contactées une seule fois au nombre total de relevés (BLONDEL, 1979).Le quotient a/N représente une pente entre N et N-1 relevés .Elle se calcule par la formule suivante (BLONDEL, 1979):
. . = a N Avec : a est le nombre des espèces vues une seule fois ;
N est nombre total des pots relevés durant toute la période de l’expérimentation. Plus la valeur de Q.e. tend vers 0, plus la qualité d’échantillonnage est grande. (BLONDEL, 1979 et
RAMADE, 1984). Dans notre cas la qualité d’échantillonnage est calculée pour l’ensemble
des araignées piégées par les pots Barber et la capture à la main.
III.4.2 – Les indices écologiques de composition III.4.2.1 – La richesse totale (S)
La richesse totale d’un peuplement est le nombre total d’espèces (S) rencontrées dans la région d’étude. La richesse totale d’une biocénose présente ainsi la totalité des espèces qui la composent (RAMADE, 1984). Dans notre cas la richesse totale est calculée pour l’ensemble des espèces d'Araignées piégées dans les pots Barber et par la capturées à la main.
III.4.2.2 – La richesse moyenne (Sm)
C’est le rapport entre le nombre total d’espèces recensées lors de chaque relevé sur le nombre total de relevés réalisés. Elle est le nombre moyen d’espèces présents dans un échantillon (RAMADE, 2009). La richesse spécifique moyenne (Sm) est utile dans l’étude de la structure des peuplements. Elle exprime le nombre moyen d’espèces présentes dans un échantillon (RAMADE, 2009).
Chapitre III Matériels et Méthodes
III.4.2.3 – L’abondance relative (A.R%)
D’après ALIOUA, 2012, l’abondance relative d’une espèce est le nombre d’individus de cette espèce par rapport au nombre total d’individus du peuplement. La valeur de l’abondance relative est donnée en pourcentage par la formule suivante:
=
× 100
Avec ni : nombre d’individus d’une espèce. N : nombre total d’individus récoltés.
III.4.2.4 – Fréquence d’occurrence (F.O%)
D’après DAJOZ, 2006 ce facteur représente le rapport du nombre de relevés contenant l’espèce étudiée (Pi) au nombre total de relevés (P) exprimée en pourcentage selon la formule suivante :
. (%) =pi
p × 100
Pour déterminer le nombre de classes de constance (N.c.), on utilise l’indice de Sturge
(SCHERRER, 1984).
N.c. = 1+ (3,3 log 10 N3)
N3 représente le nombre total des individus capturés grâce à la technique des pots pièges ou celle de la capture à la main. L’intervalle de classe est déterminé en divisant 100 par le nombre de classes obtenu par l’équation de Sturge. La constance est l’interprétation de la fréquence d’occurrence.
III.4.3 – Les indices écologiques de structure
3.4.3.1 – Indice de diversité de Shannon-Weaver (H’)
Selon PEET, 1974 cet indice permettant de mesurer la biodiversité et de quantifier son hétérogénéité dans un milieu d’étude et donc d’observer une évolution au cours du temps, il s’exprime en bits. Il est considéré comme le meilleur moyen pour traduire la diversité
(BLONDEL et al, 1973). L’indice de diversité de Shannon-Weaver prend en compte la
Chapitre III Matériels et Méthodes
25
(VIAUX et RAMEIL, 2004). La formule qui exprime cet indice est donnée par RAMADE, 1984 :
H’ (bits) = - ∑ (ni / N) Log2 (ni / N)
Avec : ni est le nombre des individus de l’espèce i.
N est le nombre total des individus de toutes les espèces confondues trouvées.
III.4.3.2 – Diversité maximale (H’max)
D’après BLONDEL, 1979 et PONEL ,1983 la diversité maximale est représentée par la formule suivante :
H’ max. = Log2 S
Avec : H’ max.est la diversité maximale. S est la richesse totale.
III.4.3.3 – Equitabilité (E)
C’est le rapport de la diversité observée à la diversité maximale (BLONDEL, 1979), il est calculé par la formule suivante :
E = H’ / H’max. Avec : E : Equitabilité
H’ : Indice de diversité de Shannon-Weaver H’ max. : Diversité maximale
III.4.4 – Exploitation des résultats par des méthodes statistiques 3.4.4.1 – Analyse factorielle des correspondances (A.F.C)
L’A.F.C est une méthode qui permet de traiter des tableaux à double entrecroisement des ensembles. Les données initiales sont les n espèces représentées dans P relevés. Il est obtenu un nuage de n points dans un espace à p dimension (DAJOZ, 1982). De son côté
RAMADE (1984) signale que l’A.F.C permet d’individualiser de façon plus objective et