Royaume du Maroc Université Mohammed V
Faculté de Médecine et de Pharmacie de Rabat
MEMOIRE
En vue de l’obtention du Diplôme National de Spécialité Médicale
Option :
Anesthésie-Réanimation
Présenté par :
Dr. Achraf MOUDEN
Sous la direction :
Professeur Ahmed EL HIJRI
Année universitaire 2020
Enquête sur la thromboprophylaxie
périopératoire en chirurgie digestive
carcinologique
A monsieur le professeur BENSOUDA Adil
Chef de l’unité pédagogique et de recherche d’anesthésie-réanimation
de Rabat
Service de réanimation de la chirurgie cardiovasculaire B
L’honneur que vous nous faites en président de notre jury est pour nous
l'occasion de vous exprimer notre grande reconnaissance. Nous sommes fiers de
vous compter parmi nos juges.
Nulle dédicace ne saurait exprimer notre profonde admiration et
remerciements pour vos efforts pour nous assurer une formation de qualité et
pour promouvoir cette belle spécialité, fleuron de la médecine nationale.
Veuillez trouver ici l’expression de notre haute considération.
A Monsieur le professeur Abdelouahed El Baite
Chef du pôle d’anesthésie-réanimation de l’hôpital militaire d’instruction
Mohammed V
Nous vous remercions du grand honneur que vous nous faites en siégeant dans
ce jury.
Vos qualités humaines et votre simplicité exemplaire ne peuvent que vous
valoir l’estime de tous.
A Monsieur le professeur ELHIJRI Ahmed
Chef de Service d’anesthésie-réanimation chirurgicale de l’hôpital Avicenne de
Rabat
Nous vous remercions du grand honneur que vous nous faites en siégeant dans
ce jury. Aussi pour la sympathie, la spontanéité et l’aimabilité avec lesquelles
vous nous avez formés.
Vos qualités humaines et votre simplicité exemplaire ne peuvent que vous
valoir l’estime de tous.
Veuillez accepter, cher Maitre, l’expression de notre profond respect.
Veuillez accepter, cher Maitre, l’expression de mon profond respect.
A Monsieur le professeur ZAKARIA BELKHADIR
Chef de Service d’anesthésie-réanimation de l’institut national d’oncologie
RABAT
Nous vous remercions du grand honneur que vous nous faites en siégeant dans
ce jury.
Vos qualités humaines et votre simplicité exemplaire ne peuvent que vous
valoir l’estime de tous.
A Monsieur le professeur Saad Zidouh
Chef de Service des urgences médico-chirurgicales de l’hôpital militaire
d’instruction
Mohammed V
Maitre, votre image a toujours reflété à nos yeux l’excellence et la
détermination de votre pratique et de votre enseignement de l’anesthésie et de
la réanimation.
C’est un honneur d’être soumis à votre œil acerbe et avide de rigueur.
A Monsieur le professeur JAWAD TADILI
Professeur d’anesthésie réanimation
Service d’anesthésie-réanimation des urgences chirurgicales de l’hôpital
Avicenne de Rabat
Nous vous remercions du grand honneur que vous nous faites en siégeant dans
ce jury.
Vos qualités humaines et votre simplicité exemplaire ne peuvent que vous
valoir l’estime de tous.
ADP : Adénosine diphosphate
AT : Antithrombine
AVK : Anti vitamines K
CPA : Cancer procoagulant A
CPI : Compression pneumatique intermittente
EP : Embolie pulmonaire
EPO : Erythropoïétine recombinante
F4P : Chémokines plaquettaire
FT : Facteur tissulaire
HBPM : Héparine de bas poids moléculaire
HNF : Héparine non fractionnée
IL1 : Interleukines 1
IL-1β : Interleukines 1 β
MVTE : Maladie veineuse thromboembolique
PAI 1 : Plasminogenactivator inhibitor-1
PC : Protéine C
PL : Pospholipides
PS : Protéine S
TCA : Temps de céphaline avec activateur TFPI : Tissue factor pathway inhibitor
TNF :Tissue necrosis factor
TVP : Thrombose veineuse profonde
VEGF : Vascular endothélial growth
Listes des figures
Figure 1: Les principaux mécanismes impliqués dans la survenue des thromboses. ... 5
Figure 2 : Schéma simplifié de l'hémostase ... 6
Figure 3 : La triade de Virchow appliquée au cancer ... 9
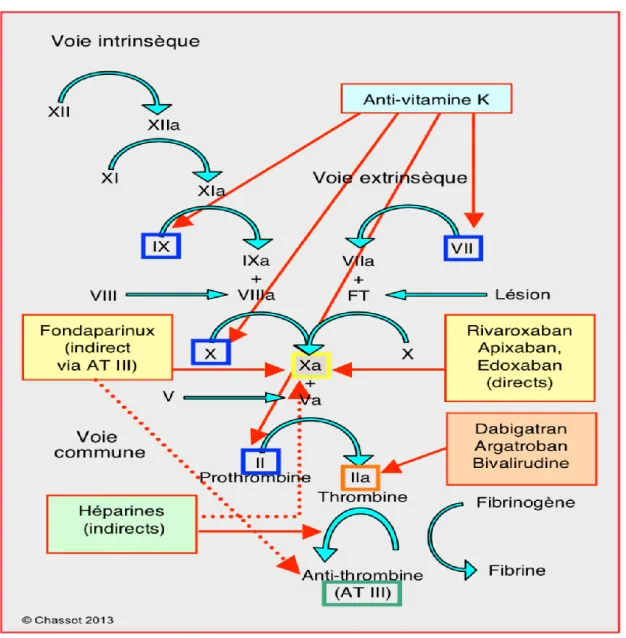
Figure 4 : Points d'impact des différents anticoagulants sur la cascade de la coagulation. ... 10
Figure 5 : Compression pneumatique intermittente ... 11
Figure 6 : Répartition des patients selon le sexe. ... 17
Figure 7 : Nombre de patients en fonction des services. ... 18
Figure 8 : Répartition des patients en fonction du score ASA. ... 19
Figure 9 : Répartition en fonction du site de la tumeur primitive ... 20
Figure 10 : Taux de chimiothérapie néo-adjuvante. ... 21
Liste des tableaux
Tableau I: Score de Caprini ... 15 Tableau II: Répartition des patients en fonction des tranches d'âge ... 17 Tableau III: Caractéristiques associées à une augmentation du risque thromboembolique chez les patients atteints du cancer. ... 28 Tableau IV: Facteurs de risque de thrombose propres au patient. ... 31 Tableau V: Modes d’administration de l’héparines calcique et des HBPM en chirurgie ... 32
Tableau VI: Schémas de thromboprophylaxie périopératoire recommandés, dans le cas
général de chirurgie digestive ... 33 Tableau VII: Thromboprophylaxie en chirurgie digestive. ... 35 Tableau VIII: Thromboprophylaxie dans différents groupes de risque. ... 36
Tableau IX: Les dernières recommandations relatives à la thromboprophylaxie périopératoire ... 38
Introduction ... 1
Rappel Théorique ... 4
I. Histoire naturelle de la MVTE ... 5
1. Stase veineuse ... 5
2. Anomalies de la coagulation ... 6
3. Lésions endothéliales ... 8
II. Cancer et maladie veineuse thromboembolique ... 9
III. Moyens de prévention de la maladie veineuse thromboembolique ... 10
1. Moyens pharmacologiques ... 10
2. Moyens mécaniques ou physiques ... 11
2.1. Surélévation des membres inférieurs et lever précoce ... 11
2.2. La contention élastique ... 11
2.3. La compression pneumatique intermittente (CPI)... 11
2.4. Compression plantaire ... 11
2.5. La stimulation électrique ... 12
Matériel d’étude et méthodes ... 13
Résultats ... 16
Discussion ... 24
I. Données épidémiologiques ... 25
II. MVTE et chirurgie digestive carcinologique ... 29
III. Schémas de thromboprophylaxie périopératoire ... 30
1. Recommandations de la SFAR (société française d’anesthésie réanimation) ... 30
2. Recommandations de l’ACCP (American College of Chest Physicians):... 36
3. Recommandations internationales spécifiques aux patients atteints de cancer ... 37
Conclusion ... 39
Résumés ... 39
1
2
La maladie thromboembolique veineuse (MTEV) est une entité nosologique regroupant deux présentations cliniques : la thrombose veineuse profonde (TVP) et l’embolie pulmonaire (EP). C’est une pathologie fréquente dont l’incidence est estimée entre 5 et 20 cas pour 10.000 habitants/ an dans la population générale (1).
La MTEV est reconnue sur le plan international pour être un problème sérieux de santé, grevée d’une mortalité propre et responsable de complications chroniques invalidantes dont la maladie post-thrombotique (40 %) et l’hypertension artérielle pulmonaire (4%) (2) (3).
Les conditions responsables de la thrombogénèse veineuse sont connues par la célèbre triade de Virchow, associant la stase sanguine, la lésion de la paroi endothéliale et l’altération de l’équilibre hémostatique (4) . Ces éléments expliquent que certains facteurs dont le cancer et la période périopératoire soient à risque très élevé de complications thromboemboliques. On estime en moyenne que 15 à 20 % des patients présentant un cancer ont ou auront un épisode thromboembolique au décours de leur maladie, avec une incidence de 4 à 6 fois plus importante dans cette population que dans la population non atteinte de cancer (3). Par ailleurs, la MTEV représente la deuxième cause de mortalité en oncologie, avec près de 10% des décès, représentant un facteur pronostique défavorable (5).
La période périopératoire majore, de son côté, le risque thromboembolique, à fortiori chez les patients présentant un cancer. À type d’intervention chirurgicale égale, l’existence d’un cancer double approximativement le risque de thrombose postopératoire par rapport à une population sans cancer. En l’absence de thromboprophylaxie périopératoire, le risque global d’événements thromboemboliques observés en chirurgie digestive carcinologique est de l’ordre de 30 % (6).
En raison des donnés citées plus haut, des recommandations relatives à la thromoprophylaxie en chirurgie carcinologique ont été éditées par diverses sociétés savantes, dans le but de réduire le risque d’événements thromboemboliques périopératoires.
Dans ce travail nous nous sommes proposés d’évaluer sous nos cieux, les aspects de la thromboprophylaxie périopératoire en chirurgie digestive carcinologique et leurs adéquations avec les recommandations en la matière.
3
L’objectif est bien entendu d’optimiser la prise en charge des patients opérés d’une chirurgie digestive carcinologique, notamment en matière de réduction du risque d’événements thromboemboliques.
Avant d’étayer notre étude, nous allons rappeler quelques notions relatives à la pathogénie de la MVTE et aux différents moyens de prévention en périopératoire.
4
5
I. Histoire naturelle de la MVTE
Rudolph Virchow réalise en 1855 la première description de la thrombose et de l’embolie. Les principaux mécanismes impliqués dans la survenue des thromboses font intervenir la stase veineuse, la lésion de l’endothélium et l’activation de la coagulation réunies dans la triade de Virchow (Figure 1). Ces trois composants agissent souvent en conjonction pour expliquer une thrombose, mais inversement aucun de ces éléments, pris séparément, n’entraînera systématiquement une thrombose (7)(8).
Figure 1: Les principaux mécanismes impliqués dans la survenue des thromboses.
1. Stase veineuse
L’écoulement du sang dans les vaisseaux est en flux laminaire. Deux types de perturbations peuvent favoriser l’apparition de thromboses. Il s’agit de la stase et de la rupture du flux laminaire. Il est connu depuis l’expérimentation animale que la stase, à elle seule, ne peut pas induire de thrombose. Elle en constitue par contre, un facteur favorisant. La stase peut être liée à un état d’hyperviscosité sanguine, comme elle peut résulter d’une compression pariétale d’origine extravasculaire ou à l’occasion d’une altération majeure de l’endothélium des grandes insuffisances veineuses.
6
2. Anomalies de la coagulation
L’hémostase physiologique est classiquement décomposée en trois temps : l’hémostase primaire, la coagulation et la fibrinolyse.
L’hémostase primaire permet l’obturation d’une brèche vasculaire par les plaquettes.
La coagulation consolide ce thrombus blanc en créant un réseau de fibrine polymérisée qui participe, avec les globules rouges et les plaquettes, à la formation du thrombus dit rouge.
La fibrinolyse permet la destruction enzymatique du caillot et la restitution complète de la paroi vasculaire ( Figure 2) (9).
7
La thrombose survient lorsque le système se déséquilibre au profit de la phase de coagulation.
La physiologie de la coagulation fait appel, pour l’activation initiale, à l’interaction entre un composant cellulaire, le facteur tissulaire, et un composant plasmatique, le facteur XII. La liaison [facteur tissulaire - facteur VII] induit une activation du facteur VII. Il s’en suit une 1chaîne de réactions, appelée cascade de la coagulation, qui aboutit à la formation du facteur X activé à partir de sa proenzyme, le facteur X. Le facteur X activé permet la transformation de la prothrombine en thrombine, enzyme clé de la coagulation. Elle permet la transformation du fibrinogène en fibrine et est capable de catalyser sa propre génération. Après l’apparition des premières traces de thrombine, survient à la surface plaquettaire, une production massive de thrombine qui active brutalement toute la coagulation et génère le caillot. Ce système d’activation en chaîne est régulé par la présence d’inhibiteurs. Il s’agit essentiellement de l’antithrombine, du système protéine C – protéine S et de l’inhibiteur de la voie du facteur tissulaire (TFPI : tissue factor pathway inhibitor). Ces inhibiteurs permettent de localiser l’activation de la coagulation au niveau de la brèche vasculaire.
L’activation de la coagulation est un évènement capital dans le processus thrombotique. Elle peut être liée à une expression exagérée de facteur tissulaire à la surface des cellules, telles qu’elle est réalisée dans les états inflammatoires et infectieux ou au contact des lésions tumorales, comme elle peut être liée à l’expression d’une activité de type facteur tissulaire, simulant l’action du facteur tissulaire physiologique (10). Ce phénomène est observé dans les leucémies et les néoplasies.
L’activation de la coagulation permet généralement de n’obturer que la brèche vasculaire. Elle pourra toutefois être à l’origine d’une thrombose si les systèmes inhibiteurs sont en défaut, ne permettant pas d’empêcher l’activation de la coagulation au-delà de la brèche, soit in situ à l’origine d’une thrombose, soit diffuse à l’origine d’une coagulation intravasculaires disséminée.
Il est à noter que des voies d’activation de la coagulation indépendantes du facteur tissulaire peuvent intervenir. C’est le cas des activités procoagulantes tumorales agissant au niveau de différents points du système d’hémostase et des voies passant par le système contact (11).
8
Enfin, l’altération des systèmes inhibiteurs (déficit en antithrombine, déficit en protéine C, déficit en protéine S, mutation congénitale responsable de gain d’activité ) peut être à l’origine de thromboses veineuses (11).
3. Lésions endothéliales
À l’état de repos, l’endothélium est antithrombotique. Il s’oppose à l’activation plaquettaire par la production de prostacycline et à l’activation de la coagulation par l’expression à la surface des cellules endothéliales de la thro<mbomoduline, élément régulateur du système inhibiteur protéine C - protéine S. L’endothélium participe aussi à la régulation de la fibrinolyse puisqu’il est le lieu de synthèse exclusif de l’activateur tissulaire du plasminogène (t-pa) et un des sites producteurs de son inhibiteur principal, le PAI1 (Plasminogen activator inhibitor-1). Aussi, toute altération de la fonction endothéliale est-elle susceptible de favoriser les événements thrombotiques. Cela peut se produire à l’occasion de lésions endothéliales telles que celles observées par exemple en périopératoire, ou au cours des cathétérismes vasculaires ou à l’occasion de dysfonctions endothéliales telles que celles observées au cours des maladies systémiques ou auto-immunes (Behçet, lupus érythémateux disséminé…).
9
II. Cancer et maladie veineuse thromboembolique
L’association cancer et thrombose est connue depuis de longues dates. Au cours du XIX siècle, l’association entre la MVTE et le cancer a été décrite par S.Bouillaud en 1823, puis par A.Trousseau en 1865 (12). Plusieurs années plus tard, en 1878, T. Billroth retrouve même des cellules cancéreuses au sein de thrombi, laissant suggérer une relation étroite entre le système de la coagulation et la formation de métastases à distance (13).
Le cancer est un facteur de risque indépendant de MVTE, avec un odds ratio de plus de 5.
Après la chirurgie, le cancer représente un des facteurs de risque élevées de MVTE (14). La physiopathologie des thromboses veineuses associées au cancer est d’ordre multifactoriel, intégrant généralement une augmentation de l’activité prothrombotique et/ou une diminution des mécanismes antithrombotiques. Tous les éléments de la triade de Virchow peuvent en effet être perturbés chez le patient atteint de cancer, avec anomalies du flux sanguin et de la paroi vasculaire et troubles de l’hémostase (Figure 3) (15).
10
III. Moyens de prévention de la maladie veineuse
thromboembolique
Actuellement nous disposons de deux principaux moyens, pharmacologiques et mécaniques, fréquemment associés ensemble. Avant d’aborder ces deux outils, nous allons rappeler quelques notions relatives à la physiologie de l’hémostase.
1. Moyens pharmacologiques
Les moyens pharmacologiques font appel principalement aux anticoagulants administrés par voie parentérale (héparines non fractionnées ou de bas poids moléculaire, fondaparinux et danaparoïde sodique……) ou orale (antivitamines K, anticoagulants oraux directs). Ils sont classés en différentes catégories en fonction de leurs sites d’action (27).
11
2.
Moyens mécaniques ou physiques
2.1. Surélévation des membres inférieurs et lever précoce
La surélévation des membres inférieurs au cours de l’alitement permet une accélération des flux sanguins veineux des membres inférieurs.
2.2. La contention élastique
La contention élastique permet de suppléer à la fonction « pompe » du mollet et de la voûte plantaire en cas d’alitement. La pression exercée doit être de 18 mm Hg à la cheville puis 14 mm Hg au mollet et 8 mm Hg sous le genou.
2.3. La compression pneumatique intermittente (CPI)
Cette méthode a une efficacité prouvée dans la réduction de l’apparition d’une TVP. Elle consiste en une compression pneumatique au niveau du mollet ou de la cuisse pendant dix secondes toutes les minutes.
Figure 5 : Compression pneumatique intermittente
2.4. Compression plantaire
Il s’agit d’une « semelle » qui va se gonfler et étirer la voûte plantaire à intervalles réguliers (toutes les 20 secondes) afin de favoriser la chasse veineuse (« foot pump »).
En chirurgie orthopédique, la compression plantaire associée aux bas de contention permet une réduction nette du risque de TVP, en particulier du risque de thrombose proximale. Ce système, mieux toléré que la CPI, semble prometteur (56)(57).
12
2.5. La stimulation électrique
Il s’agit d’un stimulateur électrique portable, relié au patient par des électrodes stérilisables appliquées sur le mollet, la tension étant réglée grâce à un potentiomètre (58).
Les courants de très basse fréquence stimulent les muscles striés (triceps sural) et provoquent des fasciculations musculaires par effet de pompe. Ils accélèrent le retour veineux et réduisent le volume du mollet. La stimulation électrique intermittente pourrait également augmenter l’activité fibrinolytique de l’endothélium veineux.
Les moyens physiques de prévention contre la MTEV, cités plus haut, ne sont pas toujours prescrits avec la même conviction qu’une médication essentielle. Ils pourraient constituer, toutefois, les principaux modes de prévention pour les malades à risque faible ou ayant une contre-indication aux traitements anticoagulants.
13
Matériel d’étude
et méthodes
14
Il s’agit d’une étude rétrospective à propos de 100 cas consécutifs de cancers digestifs opérés au bloc opératoire central de l’hôpital Avicenne, durant la période 01 Octobre 2018 – 31 Décembre 2019.
Ont été inclus dans l’étude, tous les patients de plus de 18 ans, opérés pour tumeurs malignes du tube digestif.
Ont été exclus de l’étude :
Les patients âgés de moins de 18 ans ;
Les patients sous antithrombotiques au long cours ; Les patients porteurs de troubles de l’hémostase ;
Les patients chez lesquels les dossiers n’étaient pas exploitables.
Pour chaque patient inclus dans l’étude, nous avons recueilli les données suivantes : Les données démographiques (Âge, sexe) ;
Les services référents de chirurgie ;
Les comorbidités et classe ASA (American society of Anesthesiologist) ; Le site de la pathologie néoplasique ayant justifié la chirurgie ;
Chimiothérapie néo-adjuvante éventuelle ; La nature de l’intervention chirurgicale ; Abord par cœlioscopie ou par laparotomie ; La durée de chirurgie ;
Le type histologique de la tumeur en question ; Les patients avec un score de Caprini ≥ 5 (59)(60)
15
Tableau I: Score de Caprini
Nous avons par la suite recueilli les données relatives à la thromboprophylaxie périopératoire :
Recours ou non à la thromboprophylaxie; Thromboprophylaxie pré ou postopératoire;
Moyens utilisés pour la thromboprophylaxie (mécanique, pharmacologique, type de médications) ;
Durée de la thromboprophylaxie. Nous avons analysé également :
La durée de séjour hospitalier postopératoire ;
La survenue éventuelle de complications thromboemboliques ; Le taux de décès.
Les données quantitatives ont été exprimées en moyennes et les variables qualitatives ont été exprimées en pourcentages.
16
17
Cent patients ont été enrôlés dans l’étude. L’âge moyen des patients était de 59 ans, avec des extrêmes allant de 21 à 89 ans.
13% des patients avaient un âge supérieur ou égal à 75 ans, et seulement 9% des patients étaient âgés de moins de 40 ans. 91% des patients avait un âge ≥ 40ans.
Tableau II: Répartition des patients en fonction des tranches d'âge Les tranches d’âge Pourcentage des patients (%)
Inférieur à 40 ansj 9
Entre 40 à 60 ans 44
Entre 61 et 74 ans 34
Supérieur ou égal à 75ans 13
Le sex-ratio H/F était de 1,04 avec 51 patients de sexe masculin et 49 patients de sexe féminin (Figure 11).
18
La répartition des patients en fonction des services référents de chirurgie était comme suit :
Service de chirurgie A : 50% Service de chirurgie B : 13% Service de chirurgie C : 37%
Figure 7 : Nombre de patients en fonction des services.
19
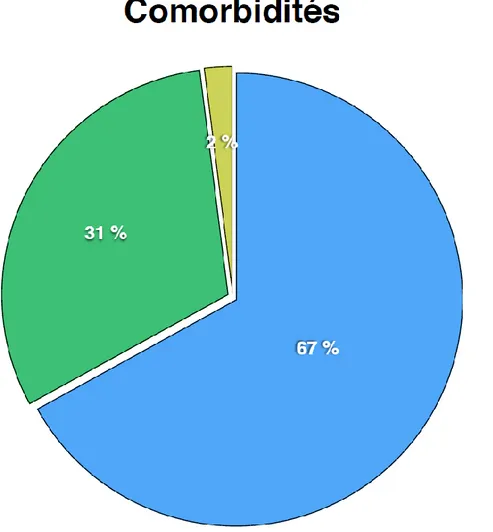
L’analyse des patients selon les comorbidités retrouvait que 2/3 des patients (67%) étaient de classe ASA1. 31% des patients étaient classés ASA 2 et 2% classés ASA 3 (Figure 13).
20
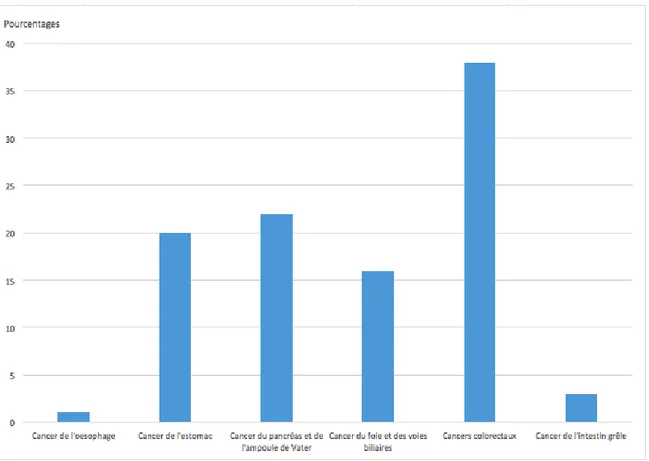
Pour ce qui est du siège de la pathologie néoplasique, il est représenté sur la figure 14. On notait une prédominance des cancers colorectaux (38%), du cancer du pancréas et de l’ampullome de Vater (22%) et du cancer de l’estomac (20%). Le cancer du foie et des voies biliaires représentait 16% des cas. Les tumeurs du grêle représentaientt 3% des cas. Seulement 1% des patients ont été opérés pour cancer de l’œsophage.
21
Parmi les 100 cas opérés, l’adénocarcinome était le type histologique prépondérant (80%).
Seulement 8% des malades de notre étude avaient bénéficié de séances de chimiothérapie préalablement à l’intervention chirurgicale (Figure 15).
Figure 10 : Taux de chimiothérapie néo-adjuvante.
22
Pour ce qui est des données relatives à la chirurgie, toutes les interventions réalisées chez les malades inclus dans l’étude étaient de type curatif, avec cinq cas de CHIP (chimiothérapie hyperthermique intrapéritonéale).
La plupart des interventions (93%) étaient réalisées sous laparotomie. Les 7% restants ont été réalisées sous laparoscopie (Figure 16).
23
La durée des interventions chirurgicales était en moyenne de 6 heures, avec des extrêmes allant de 3 à 12 heures.
En tenant compte de certaines composantes du score de Caprini (notamment, l’âge, la pathologie néoplasique, la durée de la chirurgie et l’alitement périopératoire), tous les patients inclus dans l’étude avaient un score de Caprini ≥ 5.
Pour ce qui est des données relatives à la thromboprophylaxie périopératoire, nous avons retrouvé les éléments suivants :
Tous les patients ont reçu une thromboprophylaxie périopératoire ;
La thromboprophylaxie a été démarrée chez tous les patients en postopératoire ;
Elle était médicamenteuse à base d’enoxaparine (à raison de 40 mg/j en sous cutané) chez la majorité des patients (99%). Dans un cas, on a eu recours aux moyens mécaniques (bas de contention) en raison de complications hémorragiques postopératoires. Chez un patient, on a dû arrêter l’héparinothérapie, en raison d’une TIH (thrombopénie induite par l’héparine), le malade ayant été mis sous bas de contention.
La durée de la thromboprophylaxie était en moyenne de neuf jours, avec des extrêmes allant de quatre à 29 jours.
Pour ce qui est de la durée de séjour hospitalier postopératoire, elle était en moyenne de 6 jours, avec des extrêmes allant de quatre à 44 jours.
Aucun patient inclus dans l’étude n’a présenté des complications thromboemboliques postopératoires, durant la période d’hospitalisation.
24
25
I. Données épidémiologiques
Comme mentionné plus haut (Cf. cancer et MVTE), le cancer est un facteur de risque indépendant de MVTE. Comparés aux patients ne présentant pas de cancer, ceux qui sont suivis pour cancer ont quatre fois plus de risque de développer une MVTE (61)(62). Ce risque augmente à 6,5 en cas de chimiothérapie associée (61)(62).
L’incidence des thromboses veineuses profondes et embolies pulmonaires au cours des cancers est très variable allant de 0,5 à 20 %(63). Cette variabilité s’explique par le caractère très hétérogène des différentes études. Les populations d’étude peuvent varier généralement selon :
La nature des cancers développés et leur localisation ;
Le potentiel invasif des cancers et leur stade (métastatique ou non) ;
Le choix des critères de jugement (types de MVTE retenus, moyens de diagnostic) ; Les traitements proposés (chirurgie, chimiothérapie, radiothérapie…) ;
Les comorbidités des patients.
Dans l’étude de Khorana et al. (64) à propos de plus d’un million de patients hospitalisés en oncologie, l’incidence de la MVTE était de 4,1%, avec 3,4% de TVP et 1,1%, d’embolie pulmonaire.
Parmi les principaux facteurs de risque de MVTE retrouvés par les auteurs en analyse multivariée, on peut citer :
L’âge avancé ≥ 65 ans ; Le sexe féminin ;
Le recours à la chimiothérapie ; La présence de comorbidités ; Le siège du cancer (64).
26
Le risque de MVTE était particulièrement élevé en présence d’un cancer du pancréas (8,1%) (64). Ce risque était estimé à 4,9 % en cas de cancer gastrique (64).
Ces résultats corroborent ceux d’autres études, dont celle de Chew et al. (63) évaluant l’incidence de MVTE chez les patients cancéreux selon le type de cancer et le stade de leur maladie. Ainsi, les cancers à plus haut potentiel thrombotique regroupent :
Les néoplasies hématologiques ; Les néoplasies pulmonaires ;
Les néoplasies pancréatiques et gastro-intestinales ; Les lymphomes ;
Les localisations cérébrales et hépatiques ; Les leucémies ;
Les cancers ovariens et rénaux (63).
Les différentes thérapeutiques proposées aux patient représentent, dans la plupart des études, des facteurs de risque de MVTE chez les patients cancéreux.
La chimiothérapie présente un rôle indéniable dans la survenue de MVTE, surtout quand elle est administrée au stade de métastases. Elle semble augmenter de deux à six fois le risque de MVTE (65)(66).
Parmi les traitements anti-angiogéniques, le thalidomide® et le lenalidomide® utilisés dans le myélome, surtout s’ils sont associés à la dexaméthasone® ou la doxorubicine®, peuvent augmenter le taux de MVTE de 20 à 40 % (67).
Pour ce qui est de la radiothérapie, elle est habituellement considérée comme augmentant le risque de MVTE même s’il n y a pas d’étude d’envergure le démontrant.
On reconnait par ailleurs le rôle de certains traitements associés tels que l’érythropoïétine ou tout autre facteur de stimulation des lignées hématopoïétiques, ou encore les fortes doses de corticostéroïdes qui augmentent le risque de MVTE (68).
27
C’est également le cas des thérapeutiques hormonales associés ( en particulier dans le cas du cancer de sein), qui augmentent considérablement le risque de MVTE .
L’usage de longs cathéters veineux centraux ou la présence de chambre implantable sont associés à une majoration du risque de MVTE, en particulier au décours de chimiothérapie. Ce risque était estimé à 8,5 %, dans l’étude menée par Piran et al. (69), à propos de patients cancéreux porteurs d’une chambre implantable.
Enfin, la chirurgie dans le cadre d’un néoplasie représente sans nul doute le facteur de risque le mieux connu comme augmentant significativement le risque de MVTE. Ce risque est en effet multiplié par deux et perdure de façon substantielle durant les sept semaines qui suivent l’intervention (70)(71).
Le risque élevé de MVTE à l’occasion de la chirurgie pour cancer s’explique par la contribution de divers facteurs dont :
L’âge souvent avancé des patients ;
La durée des procédures chirurgicales qui sont souvent difficiles et plus délicate ; et L’immobilisation postopératoire qui est souvent plus prolongée.
Ce risque lié à la chirurgie serait particulièrement élevé quand il s’agit d’une intervention pour cancer digestif (Cf. Infra).
Des scores ont été établis pour évaluer le risque de MVTE chez les patients atteints de cancer. C’est le cas en particulier du score proposé par Khorana et al. (72), basé sur l’analyse de certaines variables cliniques et biologiques (Tableau X). Le risque de MVTE est :
Inférieur à 1% pour une valeur de score de 0 ;
De l’ordre de 2% pour une valeur de score de 1 ou 2 ; de l’ordre de 7% pour une valeur de score ≥ 3 (72).
28
Tableau III: Caractéristiques associées à une augmentation du risque thromboembolique chez les patients atteints du cancer.
29
II. MVTE et chirurgie digestive carcinologique
Comme mentionnée plus haut, le cancer du tube digestif est associé à un risque élevé de complications thromboemboliques. Ce risque est évalué aux alentours de 25% en l’absence de thromboprophylaxie (5)(73).
Diverses études avaient mis l’accent sur le risque de MVTE associé aux cancers digestifs, notamment pancréatique et gastrique(74)(75)(76). Dans une méta-analyse, Horsted et al. (77) ont évalué le risque de MVTE pour huit types de cancer. Les auteurs ont retrouvé que l’incidence la plus élevée de MVTE était observée en présence de cancer pancréatique(77). Ces résultats corroborent ceux de l’étude menée par Chew et Al (76) à propos de 235 149 cas de cancers. Les auteurs avaient en effet retrouvé que le risque de MVTE était particulièrement élevé en présence de cancer avancé, métastatique. L’incidence de MVTE par patient/ année était la plus élevée en présence de cancer pancréatique (20%) suivi du cancer gastrique (10,7%) (76).
L’étude rétrospective menée par Hassine et al. (78), à propos de 252 patients, confirme la fréquence des complications thromboemboliques au cours des cancers digestifs. Une complication thromboembolique a été objectivée chez 16 patients (6,3 %), dont 11 hommes et 5 femmes, d’âge moyen de 62,2 ans. Il s’agissait d’une embolie pulmonaire dans 9 cas, d’une thrombose du tronc porte dans 3 cas, et d’une thrombose de la veine mésentérique inférieure et du tronc spléno-mesaraique chacune dans un cas. Les tumeurs étaient respectivement : gastrique (n = 6), pancréatique (n = 4), colique (n = 3), cholangiocarcinome, tumeur de l’œsophage et du grêle (n = 1).
Le risque de la MVTE lié au cancer digestif est aggravé par la chirurgie (61)(79). L’incidence de MVTE atteindrait en effet 20 à 40 % en l’absence de thromboprophylaxie et 40 à 60% en présence de facteurs de risque de MVTE associés (61) (80).
Samantha et al. (81) ont analysé les facteurs de risque de développer une MVTE dans les 30 jours d’une chirurgie pour cancer. Les auteurs ont retrouvé parmi les facteurs de risque, une chirurgie pour cancer digestif de type pancréatique ou gastrique (81).
30
En raison du risque particulièrement élevé de la MVTE à l’occasion d’une chirurgie pour cancer digestif, une thromboprophylaxie périopératoire s’avère indispensable. Dans ce qui va suivre, nous allons revoir quelques aspects de thromboprophylaxie tels que décrits par certaines sociétés savantes.
III. Schémas de thromboprophylaxie périopératoire
Sachant que le risque thromboembolique est particulièrement élevé en présence d’une pathologie néoplasique, à fortiori quand une intervention chirurgicale est requise, la prévention de ces complications thromboemboliques passerait par une thromboprophylaxie périopératoire efficace. Divers protocoles de thromboprophylaxie périopératoire en matière de chirurgie carcinologique sont proposés dans la littérature. Dans ce qui va suivre nous allons axer sur les protocoles de thromboprophylaxie périopératoire en chirurgie digestive carcinologique, tels que proposés par certaines sociétés savantes.
1. Recommandations de la SFAR (société française d’anesthésie réanimation)
En 2005, des recommandations pour la pratique clinique, relatives à la prévention de la maladie thromboembolique veineuse périopératoire et obstétricale ont été proposées par la SFAR (société française d’anesthésie réanimation) (6). Et l’on rappelle que l’on a défini quatre grades de recommandations A, B, C et D selon le niveau de preuves scientifiques. Les grades A, B, C et D étaient associés respectivement à une preuve scientifique établie, une présomption scientifique, un niveau de preuve faible et à un accord professionnel (6). Outre les facteurs de risque liés à l’intervention chirurgicale, on distinguait des facteurs de risque de thrombose, liés au patient .
31
Tableau IV: Facteurs de risque de thrombose propres au patient.
Indépendamment de la nature de l’intervention chirurgicale, il importe de remarquer que le cancer et le traitement du cancer (hormonothérapie, chimiothérapie, radiothérapie) font partie des facteurs de risque de thrombose liés au patient. Si l’on exclut le risque lié au patient, le risque thromboembolique chirurgical est considéré comme élevé pour la chirurgie abdominale majeure. Celle-ci englobe, entre autres, la chirurgie pour pathologie cancéreuse du tube digestif (6). En effet, le risque global d’événements thromboemboliques objectivés par des examens complémentaires en chirurgie carcinologique est de 30% en l’absence de prophylaxie (6). Dans le cas particulier de la chirurgie colorectale, ce risque atteint 35%, avec 3% de cas d’embolies pulmonaires mortelles. En chirurgie œsophagienne, l’incidence des embolies pulmonaires serait de 2.5%, dont 25% de cas d’embolies mortelles.
Pour la prévention du risque thromboembolique, il était recommandé de prescrire les HBPM en première intention (en l’absence d’insuffisance rénale) à des posologies pour risque élevé (Recommandation de grade A) (6)
32
Tableau V: Modes d’administration de l’héparines calcique et des HBPM en chirurgie (6).
Ces recommandations étaient basées sur les résultats d’études ayant montré une réduction de l’incidence des événements thromboemboliques phlébographiques et cliniques de 72% chez les patients traités par HBPM comparés au placebo (6). Par ailleurs, comparés à l’HNF, les résultats relatifs à la réduction du risque de thromboses veineuses profondes paracliniques et cliniques et du risque hémorragique étaient tous en faveur des HBPM (6).
En cas de contre-indication aux HBPM ou à l’HNF, il était recommandé d’utiliser le
danaparoïde sodique (Orgaran ®) comme alternative (recommandation de grade B).
Pour ce qui est des moyens mécaniques, la contention élastique semblait réduire l’incidence des évènements thromboemboliques paracliniques de 66%. Cette incidence était réduite de 72% quand la contention élastique était associée au traitement médical, comparée au seul traitement médical (6). Ainsi, il était recommandé d’utiliser la contention élastique en cas de contre-indication aux traitements anticoagulants (recommandation de grade A) et en association avec le traitement médical (recommandation de grade B). La compression pneumatique intermittente seule ou en complément d’une prophylaxie médicamenteuse ne semblait pas faire la preuve de son efficacité en matière de chirurgie digestive (6).
33
Pour ce qui est de l´heure de l’administration de la thromboprophylaxie, il n’y avait pas d’argument pour privilégier le début de la prophylaxie avant ou après l’intervention chirurgicale. Quant à la durée de thromboprophylaxie en chirurgie digestive carcinologique, il était proposé de recommander une prophylaxie prolongée ( recommandation de grade A ) (6).
La prolongation de la durée de la thromboprophylaxie à un mois après la chirurgie semblait réduire de 50% les évènements thromboemboliques paracliniques, sans majoration du risque hémorragique (6).
Dans le tableau V11, sont résumés les schémas de thromboprophylaxie périopératoire recommandés, dans le cas général de chirurgie digestive (6).
Tableau VI: Schémas de thromboprophylaxie périopératoire recommandés, dans le cas général de chirurgie digestive
34
En 2011, la même société savante (SFAR) a émis une actualisation des recommandations en matière de prévention de la maladie thromboembolique veineuse postopératoire (82). Les recommandations étaient basées sur la méthode GRADE :
Grade 1+ (recommandation forte positive) : il est recommandé de prescrire ; Grade 2+ (recommandation optionnelle positive) : il faut probablement prescrire ; Grade 1- (recommandation forte négative) : il est recommandé de ne pas prescrire ; Grade 2- (recommandation optionnelle négative) : il faut probablement ne pas
prescrire.
Comme en 2005, les recommandations concernant le type et la durée de la thromboprophylaxie pharmacologique s’appliquaient à un groupe de patients sur la base d’une chirurgie. Lorsque le risque de MVTE lié à la chirurgie est élevé, la recommandation de prévenir la MVTE s’applique quels que soient les facteurs de risque de MVTE liés au patient. Quand le risque lié à la chirurgie est faible, une stratégie personnalisée est appliquée en tenant compte des facteurs de risque de MVTE liés au patient. Et là aussi, on remarquera que la présence d’une pathologie néoplasique fait partie des facteurs qui augmentent significativement le risque de MVTE, indépendamment de la chirurgie (82).
Comme en 2005, quel que soit le facteur de risque de MVTE lié au patient, il est recommandé de réaliser une thromboprophylaxie après une chirurgie abdominale carcinologique (recommandation de grade 1+ ) (82).
Pour ce qui est des moyens de thromboprophylaxie pharmacologique, il est recommandé de prescrire des HBPM à dose élevée (AMM) ou du fondaparinux à la dose de 2,5 mg/j (recommandation de grade 1+ ) (82).
Il est par ailleurs recommandé de prolonger la durée de la thromboprophylaxie pendant un mois après une chirurgie majeure abdomino-pelvienne (recommandation de grade 1+) (82).
Dans le tableau V111, sont résumés les schémas de thromboprophylaxie périopératoire recommandés dans le cas général de chirurgie digestive(82).
35
36
2. Recommandations de l’ACCP (American College of Chest Physicians):
Les aspects de thromboprophylaxie recommandés par l’ACCP reposent sur la nature de l’intervention chirurgicale et sur l’évaluation du risque thrombotique, par le score de Caprini (83).
Dans le cas particulier de la chirurgie générale et de la chirurgie abdomino-pelvienne, avec un risque élevé de complications thrombotiques (score de Caprini ≥ 5), il est recommandé d’utiliser une thromboprophylaxie pharmacologique à base d’HBPM (Grade 1B) ou d’HNF (grade 1B) (83) . Il est également suggéré d’y associer des moyens mécaniques à type de contention élastique ou de compression mécanique intermittente (grade 2C ) (83).
En cas de contre-indication à l’usage de l’HBPM ou d’HNF, il est recommandé d’utiliser de faibles doses d’aspirine (grade 2 C) , le fondaparinux ( grade 2 C ), ou des moyens mécaniques ( de préférence la compression pneumatique intermittente) (grade 2 C ) (83).
Enfin, pour ce qui est de la durée de thromboprophylaxie en cas de chirurgie abdomino-pelvienne pour cancer, il est recommandé d’utiliser une HBPM durant 4 semaines (83).
Dans le tableau 1X, sont résumées les recommandations proposées par l’ACCP en matière de thromboprophylaxie dans différents groupes de risques, notamment en cas de chirurgie pour cancer.(83)
Tableau VIII: Thromboprophylaxie dans différents groupes de risque.
Abbreviation: ES=elastic stockings; IPC = intermittent pneumatic compression; LDUH = low-dose unfractionated heparin; LMWH=low-molecular-weight heparin; VTE= venous thromboembolism
37
3. Recommandations internationales spécifiques aux patients atteints de
cancer
Il s’agit de recommandations de pratiques cliniques pour le traitement et la prévention de la MVTE chez les patients présentant une pathologie néoplasique, établies par le groupe ITAC (The international Initiative on Thrombosis and Cancer) et approuvées par l’ISTH (International Society on Thrombosis and Haemostasis ).
Les premières recommandations ont été établie en 2013 et les dernières en 2019 (84)(85). Les dernières recommandations relatives à la thromboprophylaxie périopératoire sont représentés dans le tableau 1X (84).
Et l’on peut remarquer que ces recommandations rejoignent celles établies par l’ACCP en matière de la nature et de la durée de la thromboprophylaxie périopératoire. Les scores d’évaluation du risque thrombotique sont toutefois spécifiques, dans ce cas, dérivant pour la plupart du score de khorana
Par ailleurs, il est recommandé par le groupe ITAC de démarrer la thromboprophylaxie 2 à 12 h avant la chirurgie, et de la prolonger durant 4 semaine en cas de chirurgie abdominale majeure pour cancer (84).
38
Tableau IX: Les dernières recommandations relatives à la thromboprophylaxie périopératoire
39
Dans notre étude, 100 patients opérés pour pathologie carcinologique digestive ont été enrôlés. L’âge moyen des patients était de 59 ans. La majorité des patients (2/3) étaient de classe ASA1. Les cancers digestifs ayant requis l’intervention dans notre étude étaient dominés par les cancers colorectaux (38%), suivis par le cancer du pancréas et de l’ampullome vatérien (22%) et par le cancer gastrique (20%). Le reste des cancers digestifs étaient repartis comme suit :
Cancer du foie et des voies biliaires (16%) ; Cancer du grêle (3%) ;
Cancer de l’œsophage (1%).
La durée des interventions chirurgicales était en moyenne de six heures.
Par ailleurs, sachant que tous les malades ont été opérés pour cancer (digestif), le risque de MVTE périopératoire étaient élevé. De même, tous les patients avaient un score de Caprini ≥ 5. Par conséquent, l’indication de la thromboprophylaxie périopératoire était formelle.
Conformément aux recommandations en la matière, tous les patients ont bénéficié d’une thromboprophylaxie périopératoire, à l’exception d’un patient ayant présenté des complications hémorragiques postopératoires. Dans tous les cas, c’était une thromboprophylaxie pharmacologique à base d’enoxaparine à dose élevée (40 mg/j). Cette attitude semble en adéquation avec les recommandations internationales, même si la thromboprophylaxie pharmacologique n’a pas été associée aux moyens mécaniques.
Par ailleurs, chez le patient ayant presenté des complications hémorragiques, le choix avait porté sur l’usage de moyens mécaniques à type de contention élastique, alors qu’il est plutôt recommandé d’utiliser la compression pneumatique intermittente (CPI).
Pour ce qui est de l’heure d’administration de la thromboprophylaxie, tous les patients, inclus dans l’étude ont reçu une thromboprophylaxie en postopératoire. Si cette attitude semble en adéquation avec les recommandations émises par certaines sociétés savantes, notamment la SFAR, elle ne semble pas être en conformité avec celles émises par le groupe ITAC, qui propose une thromboprophylaxie préopératoire.
Pour ce qui est de la durée de la thromboprophylaxie, on peut remarquer qu’elle était limitée à neuf jours ( en moyenne) dans notre étude, alors qu’elle devait être prolongée à un mois. Cela représente une inadéquation totale avec les recommandations en matière de thromboprophylaxie chez les patients opérés d’une chirurgie digestive carcinologique.
40
Au total, les résultats de notre étude ont montré que s’il y a une concordance de nos pratiques de thromboprophylaxie chez les patients opérés d’une chirurgie digestive carcinologique avec les recommandations internationales 150 en matière d’indication et de choix des moyens de thromboprophylaxie (dose et molécule), il y a une inadéquation totale en matière de la durée de la thromboprophylaxie périopératoire. Cette attitude est de nature à ne pas réduire le risque de complications thromboembolique postopératoires, qui pour rappel, représentait la première cause de mortalité durant les 30 premiers jours qui suivent une chirurgie carcinologique (86)(71).
Les recommandations du groupe ITAC en matière de durée de thromboprophylaxie (se devant d’être prolongé à 4 semaines) étaient basées sur les résultats de diverses méta-analyses qui avaient montré une réduction significative du risque de complications thromboemboliques après quatre semaine de prophylaxie (87)(88)(89)(90), sans majoration du risque hémorragique.
Diverses études qui se sont intéressés aux respect des recommandations en matière de thromboprophylaxie ont montré des résultats très contradictoires, décevant pour la plupart d’entre eux.
Dans l’étude ENDORSE (91), les auteurs ont mené une étude multinationale pour évaluer le degré d’adéquation de la thromboprophylaxie avec les recommandations émises par l’ACCP. Cette étude avait porté sur 68 183 patients, répartis en milieu chirurgical (45%) et médical (55%). Cette étude a montré un pourcentage d’adhésion aux recommandations de 58,5% dans le milieu chirurgical et de 39,5% dans le milieu médical (91).
Dans une étude prospective à propos de 120 cas de chirurgie abdominopelvienne pour cancer, Vasquez et al. (92) ont analysé la durée de la thromboprophylaxie périopératoire. Les auteurs ont analysé deux groupes de 60 patient chacun, avant et après l’implémentation d’un protocole de thromboprophylaxie élargissant la durée de la thromboprophylaxie à 28 jours. Parmi les 60 patients opérés avant l’implémentation du protocole de thromboprophylaxie, aucun patient n’a reçu de thromboprophylaxie prolongée (28jours). Parmi les patient opérés après l’implémentation du protocole de thromboprophylaxie, seulement 13 patients, soit 21,6% ont reçu une thromboprophylaxie prolongée (28 jours), tous opérés d’un cancer colorectal.
Dans une étude multicentrique à propos de 2 967 cas de chirurgie digestive pour cancer, Krell et al. (93) ont évalué les aspect de la thromboprophylaxie périopératoire et leurs
41
adéquations avec les recommandations en la matière. Les auteurs ont montré que seulement 40,4% des patients ont bénéficié d’une thromboprophylaxie périopératoire et que dans 25,3% des cas, la thromboprophylaxie était inadéquate, soit en raison d’une dose insuffisante de la molécule utilisée, soit en raison d’une durée insuffisante de la thromboprophylaxie (93).
Récemment Zipple et al. (94) ont analysé le degré d’adhésion aux recommandations de l’ACCP en matière de thromboprophylaxie chez les patients ayant bénéficié d’une chirurgie abdomino-pelvienne pour cancer. Les auteurs ont retrouvés un taux de prescription de thromboprophylaxie périopératoire de 93,7%. La durée de la thromboprophylaxie était cependant prolongée que dans 4,5% des cas (94).
Les résultats des enquêtes sus-citées montrent bien, à l’instar de nos résultats, que les pourcentages d’adhésion aux recommandations internationales en matière de thromboprophylaxie périopératoire de façon générale et chez les malades opérés pour cancer digestif en particulier demeurent très faibles. Cela dénote d’une très mauvaise appréhension du risque thromboembolique périopératoire.1 Par conséquent, dans la perspective de mieux appréhender le risque thrombotique en milieu chirurgical, notamment en chirurgie digestive carcinologique, on pourrait proposer les éléments suivants :
Sensibiliser davantage le corps médical et paramédical quant au risque thromboembolique périopératoire ;
Sensibiliser le corps soignant quant à la nécessité d’adhérer aux recommandations émises par les sociétés savantes en matière de thromboprophylaxie périopératoire ;
Rappeler l’intérêt des moyens mécaniques de thromboprophylaxie en association avec les moyens pharmacologiques ;
Sensibiliser le corps médical à la stricte nécessité de prolonger la durée de la thromboprophylaxie périopératoire notamment en cas de chirurgie digestive carcinologique ;
Implémenter des protocoles de thromboprophylaxie consensuels, pour qu’ils soient suivis à large échelle.
42
43
Le risque thromboembolique est particulièrement élevé en périopératoire, à fortiori quand il s’agit d’une intervention pour cancer, notamment digestif.
Dans l’objectif d’appréhender le risque thromboembolique dans cette populations de patients, les sociétés savantes internationales ont émis des recommandations en matière de thrombpoprophylaxie périopératoire. L’adhésion à ces recommandations demeure toutefois très faible.
Cela est corroboré par des résultats de notre étude qui ont montré une totale inadéquation avec les recommandations émises, spécialement en matière de la durée de la thromboprophylaxie périopératoire qui se trouve très limitée dans notre contexte.
44
45 Résumé
Titre : Enquête sur la thromboprophylaxie en chirurgie digestive carcinologique (Étude
rétrospective à propos de 100 cas).
Auteur : achraf moudden
Directeur de thèse : Professeur El Hijri Ahmed.
Mots-clés : Thromboprophylaxie – Cancer– Chirurgie digestive.
Objectif : Analyse et évaluation de la thromboprophylaxie périopératoire en chirurgie
digestive carcinologique et vérification de son adéquation avec les recommandations internationales.
Introduction : La chirurgie digestive carcinologique représente un risque élevé de
maladie thromboembolique veineuse, responsable d’une morbi-mortalité élevée. Les sociétés savantes ont contribué à l’élaboration de guides pratiques. Cependant, ces derniers demeurent insuffisamment utilisés.
Matériels et méthodes : Il s’agit d’une étude rétrospective portant sur 100 cas étalée
sur une période de quatorze mois (1 Octobre 2018 - 31 Décembre 2019). L’étude a intéressé les patients hospitalisés dans le service de réanimation chirurgicale et les services de chirurgies viscérales au CHU Avicenne de Rabat.
Résultats : Cent patients ont été inclus dans notre étude, dont 51 hommes et 49
femmes. Leur âge moyen était de 59 ans.
Le cancer colorectal est le plus représenté (38 cas) suivi du cancer du pancréas et de l’ampoule de Vater (22 cas) et du cancer de l’estomac (20 cas).
L’adénocarcinome était le type histologique prépondérant (80 cas). Sept patients seulement ont bénéficié d’une chimiothérapie néoadjuvante.
La thromboprophylaxie médicamenteuse a intéressé 99 patients. Elle a été démarrée chez tous les patients en postopératoire.
La molécule utilisée était l’Enoxaparine (99 patients).
La durée moyenne de la thromboprophylaxie était de neuf jours.
Discussion-Conclusion : Notre étude a mis en évidence l’inadéquation de la
thromboprophylaxie périopératoire en chirurgie digestive carcinologique avec les recommandations internationales, essentiellement en matière de la durée de la thromboprophylaxie qui est très raccourcie.
Une sensibilisation du corps médical quant à l’observation stricte des recommandations et à l’élaboration de protocoles s’avère primordiale dans notre contexte.
46
Abstract
Title: Evaluation of thromboprophylaxis in oncologic digestive surgery patients
(Retrospective study of 100 cases).
Author: achraf moudden
Thesis Director: Professor El Hijri Ahmed.
Keywords: Thromboprophylaxis – Cancer – Digestive surgery.
Objective: Analysis and evaluation of perioperative thromboprophylaxis in oncologic
digestive surgery and assessment of its adequacy with the latest international recommendations.
Introduction: Oncologic digestive surgery is a risk factor for venous
thromboembolism, responsible for high morbidity and mortality rates. Scientific professional societies have established practical guidelines in order to prevent thrombophlebitis. However, many physicians and healthcare facilities still do not follow them.
Materials and methods: This is a retrospective study including 100 patients
hospitalized in the surgical intensive care unit and visceral surgery services at the Ibn Sina University Hospital in Rabat over a 14-month period (from October 1, 2018 to December 31, 2019).
Results: 51 men and 49 women were included. Their average age was 59 years.
Colorectal cancer is the most represented (38 cases) followed by pancreatic and ampulla of Vater cancer (22 cases) and stomach cancer (20 cases).
Adenocarcinoma was the predominant histological type (80 cases). Only seven patients received neo-adjuvant chemotherapy.
Pharmacological thromboprophylaxis was used in 99 patients. It was started post-operatively in all of them.
The molecule used was Enoxaparin (99 patients). The average duration of administration was 9 days.
Discussion-Conclusion: Our study highlighted the inadequacy of perioperative
thromboprophylaxis in oncologic digestive surgery regarding international recommendations, especially concerning the duration of treatment that was very short.
Raising the awareness of the healthcare committees as to the strict observance of recommendations and the development of protocols proves to be of paramount importance in our context.
47
Références
bibliographiques
48
[1]. Buller HR, Sohne M, Middeldorp S. Treatment of venous thromboembolism. J Thromb Haemost . 2005 Aug; 3(8):1554–1560
[2]. Sevestre MA, Labarere J, Brin S, et al. Optimisation de l’interrogatoire dans
l’évaluation du risque de maladie thromboembolique veineuse : l’étude OPTIMEV. J Mal Vasc . 2005 Sep; 30(4):217–227.
[3]. Scarvelis D, Wells PS. Diagnosis and treatment of deep-vein thrombosis. CMAJ. 2006 Oct 24;175(9):1087–1092.
[4]. Kraytman M. Mecanismes De La Thrombose Arterielle Et Veineuse. Acta Clin Belg. 1975 Jan 21;30(3):167–173.
[5]. Mastoraki A, Mastoraki S, Schizas D, et al. Facing the challenge of venous thromboembolism prevention in patients undergoing major abdominal surgical procedures for gastrointestinal cancer. World J Gastrointest Oncol. 2018 Oct 15;10(10):328–335.
[6]. SFAR. Prévention de la maladie thromboembolique veineuse périopératoire et obstétricale. Recommandation pour la pratique clinique (RPC). 2005.
[7]. Kappelle LJ. Preventing deep vein thrombosis after stroke: strategies and recommendations. Curr Treat Options Neurol. 2011 Dec;13(6):629–635.
[8]. Kumar R, McKinney WP, Raj G. Perioperative prophylaxis of venous thromboembolism. Am J Med Sci. 1993 Nov;306(5):336–344.
[9]. Schved JF. Maladies hémorragiques constitutionnelles. Rev du Prat. 2015;5:613 – 617.
[10]. Falanga A, Schieppati F, Russo D. Cancer Tissue Procoagulant Mechanisms and the
Hypercoagulable State of Patients with Cancer. Semin Thromb Hemost. 2015 Oct;41(7):756–764.
[11]. Long AT, Kenne E, Jung R, et al. Contact system revisited: an interface between
inflammation, coagulation, and innate immunity. J Thromb Haemost. 2016 Mar;14(3):427–437.
49
[12]. Buller HR, van Doormaal FF, van Sluis GL, et al. Cancer and thrombosis: from
molecular mechanisms to clinical presentations. J Thromb Haemost. 2007 Jul;5 Suppl 1:246–254.
[13]. Billroth T. Historical Studies on the Nature and Treatment of Gunshot Wounds from
the Fifteenth Century to the Present Time. Yale J Biol Med. 1931 Dec;4(2):118–148.
[14]. Heit JA, Silverstein MD, Mohr DN, et al. Risk factors for deep vein thrombosis and
pulmonary embolism: a population-based case-control study. Arch Intern Med. 2000 Mar;160(6):809–815.
[15]. Elalamy I, Verdy E, Gerotziafas G, et al. Physiopathogénie de la maladie
thromboembolique veineuse au cours du cancer. Pathol Biol. 2008 Jun;56(4):184–194.
[16]. Pierre-Guy C, Carlo M. Coagulation et hémostase. In 2017.
[17]. Fordyce MJ, Ling RS. A venous foot pump reduces thrombosis after total hip
replacement. J Bone Joint Surg Br. 1992 Jan;74(1):45–49.
[18]. Warwick D, Harrison J, Whitehouse S, et al. A randomised comparison of a foot pump
and low-molecular-weight heparin in the prevention of deep-vein thrombosis after total knee replacement. J Bone Joint Surg Br. 2002 Apr;84(3):344–3450.
[19]. Hajibandeh S, Hajibandeh S, Antoniou GA, et al. Neuromuscular electrical
stimulation for the prevention of venous thromboembolism. Cochrane database Syst Rev [Internet]. 2017;11:CD011764.
[20]. Caprini JA. Thrombosis risk assessment as a guide to quality patient care. Dis Mon.
51(2–3):70–78.
[21]. Caprini JA, Arcelus JI, Hasty JH, Tamhane AC, Fabrega F. Clinical assessment of
venous thromboembolic risk in surgical patients. Semin Thromb Hemost. 1991;17 Suppl 3:304–312.
[22]. Bergqvist D. Risk of venous thromboembolism in patients undergoing cancer surgery
50
[23]. Heit JA, Silverstein MD, Mohr DN, et al. Risk factors for deep vein thrombosis and
pulmonary embolism: a population-based case-control study. Arch Intern Med. 2000 Mar 27;160(6):809–815.
[24]. Chew HK, Wun T, Harvey D, et al. Incidence of venous thromboembolism and its
effect on survival among patients with common cancers. Arch Intern Med. 2006 Feb 27;166(4):458–464.
[25]. Khorana AA, Francis CW, Culakova E, et al. Frequency, risk factors, and trends for
venous thromboembolism among hospitalized cancer patients. Cancer. 2007 Nov 15;110(10):2339–2346.
[26]. Otten H-MMB, Mathijssen J, ten Cate H, et al. Symptomatic venous
thromboembolism in cancer patients treated with chemotherapy: an underestimated phenomenon. Arch Intern Med. 2004 Jan 26;164(2):190–194.
[27]. Blom JW, Vanderschoot JPM, Oostindiër MJ, et al. Incidence of venous thrombosis in
a large cohort of 66,329 cancer patients: results of a record linkage study. J Thromb Haemost. 2006 Mar;4(3):529–535.
[28]. Haddad TC, Greeno EW. Chemotherapy-induced thrombosis. Thromb Res.
2006;118(5):555–568.
[29]. Bennett CL, Silver SM, Djulbegovic B, et al. Venous thromboembolism and mortality
associated with recombinant erythropoietin and darbepoetin administration for the treatment of cancer-associated anemia. JAMA. 2008 Feb 27;299(8):914–924.
[30]. Piran S, Ngo V, McDiarmid S, et al. Incidence and risk factors of symptomatic venous
thromboembolism related to implanted ports in cancer patients. Thromb Res. 2014 Jan;133(1):30–33.
[31]. White RH, Zhou H, Romano PS. Incidence of symptomatic venous thromboembolism
after different elective or urgent surgical procedures. Thromb Haemost. 2003 Sep;90(3):446–455.
51
[32]. Agnelli G, Bolis G, Capussotti L, et al. A clinical outcome-based prospective study on
venous thromboembolism after cancer surgery: the @RISTOS project. Ann Surg. 2006 Jan;243(1):89–95.
[33]. Khorana AA, Kuderer NM, Culakova E, et al. Development and validation of a
predictive model for chemotherapy-associated thrombosis. Blood. 2008 May 15;111(10):4902–4907.
[34]. Larsen AC, Frøkjær JB, Fisker RV, et al. Treatment-related frequency of venous
thrombosis in lower esophageal, gastro-esophageal and gastric cancer--a clinical prospective study of outcome and prognostic factors. Thromb Res. 2015 May;135(5):802–808.
[35]. Timp JF, Braekkan SK, Versteeg HH, Cannegieter SC. Epidemiology of
cancer-associated venous thrombosis. Blood. 2013 Sep 5;122(10):1712–1723.
[36]. Cronin-Fenton DP, Søndergaard F, Pedersen LA, et al. Hospitalisation for venous
thromboembolism in cancer patients and the general population: a population-based cohort study in Denmark, 1997-2006. Br J Cancer. 2010 Sep 28;103(7):947–953.
[37]. Chew HK, Wun T, Harvey D, et al. Incidence of Venous Thromboembolism and Its
Effect on Survival Among Patients With Common Cancers. Arch Intern Med. 2006 Feb 27;166(4):458.
[38]. Horsted F, West J, Grainge MJ. Risk of venous thromboembolism in patients with
cancer: a systematic review and meta-analysis. PLoS Med. 2012;9(7):e1001275.
[39]. Hassine H, Labidi A, Ben Mustapha N, et al. Les complications thromboemboliques
au cours des cancers digestifs. La Rev Médecine Interne. 2017 Jun;38:A118.
[40]. Rickles FR, Levine MN. Epidemiology of thrombosis in cancer. Acta Haematol.
2001;106(1–2):6–12.
[41]. eerts WH, Pineo GF, Heit JA, et al. Prevention of venous thromboembolism: the
Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest. 2004 Sep;126(3 Suppl):338S-400S.
52
[42]. Ruff SM, Weber KT, Khader A, et al. Venous thromboembolism in patients with
cancer undergoing surgical exploration. J Thromb Thrombolysis. 2019 Feb;47(2):316– 323.
[43]. Samama C-M, Gafsou B, Jeandel T, et al. Prévention de la maladie thromboembolique
veineuse postopératoire. Actualisation 2011. Texte court. Ann Fr Anesth Reanim. 2011 Dec;30(12):947–951.
[44]. Gould MK, Garcia DA, Wren SM, et al. Prevention of VTE in nonorthopedic surgical
patients: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012 Feb;141(2 Suppl):e227S-e277S.
[45]. Farge D, Frere C, Connors JM, et al. 2019 international clinical practice guidelines for
the treatment and prophylaxis of venous thromboembolism in patients with cancer. Lancet Oncol. 2019 Oct;20(10):e566–581.
[46]. Farge D, Debourdeau P, Beckers M, et al. International clinical practice guidelines for
the treatment and prophylaxis of venous thromboembolism in patients with cancer. J Thromb Haemost. 2013 Jan;11(1):56–70.
[47]. Bradley CT, Brasel KJ, Miller JJ, et al. Cost-effectiveness of prolonged
thromboprophylaxis after cancer surgery. Ann Surg Oncol. 2010 Jan;17(1):31–39.
[48]. Fagarasanu A, Alotaibi GS, Hrimiuc R, et al. Role of Extended Thromboprophylaxis
After Abdominal and Pelvic Surgery in Cancer Patients: A Systematic Review and Meta-Analysis. Ann Surg Oncol. 2016 May;23(5):1422–1430.
[49]. Guo Q, Huang B, Zhao J, et al. Perioperative Pharmacological Thromboprophylaxis in
Patients With Cancer: A Systematic Review and Meta-analysis. Ann Surg. 2017;265(6):1087–1093.
[50]. Felder S, Rasmussen MS, King R, et al. Prolonged thromboprophylaxis with low
molecular weight heparin for abdominal or pelvic surgery. Cochrane database Syst Rev. 2018;11:CD004318.