ANNEE 2009 THESE 38
L'HEPATITE VIRALE CHRONIQUE C
THESE
PRESENTEE ET SOUTENUE PUBLIQUEMENT LE .…/…/2009
PAR
Mlle.
Lalla Meryam ABOUAMRANE
Née le 27/06/1983 à Essaouira
POUR L'OBTENTION DU DOCTORAT EN MEDECINE
MOTS CLES
Virus de l’hépatite C – Epidémiologie - Hépatite modérée ou sévère Fibrose – Cirrhose - Evolution - Traitement.
JURY
Mr. M. HARIF Professeur d’Hématologie Mme. K. KRATI Professeur de Gastro-Entérologie Mme. L. ESSAADOUNIProfesseur agrégée de Médecine Interne
Mr. S. AMAL
Professeur agrégé de Dermatologie
Mme. L. CHABAA
Professeur agrégée de Biochimie
UNIVERSITE CADI AYYAD
FACULTE DE MEDECINE ET DE PHARMACIE
RAPPORTEUR
JUGES JUGES PRESIDENT
Serment
Au moment d’être admis à devenir membre de la profession médicale, je m’engage
solennellement à consacrer ma vie au service de l’humanité.
Je traiterai mes maîtres avec le respect et la reconnaissance qui leur sont dus.
Je pratiquerai ma profession avec conscience et dignité. La santé de mes malades
sera mon premier but.
Je ne trahirai pas les secrets qui me seront confiés.
Je maintiendrai par tous les moyens en mon pouvoir l’honneur et les nobles
traditions de la profession médicale.
Les médecins seront mes frères.
Aucune considération de religion, de nationalité, de race, aucune considération
politique et sociale, ne s’interposera entre mon devoir et mon patient.
Je maintiendrai strictement le respect de la vie humaine dés sa conception.
Même sous la menace, je n’userai pas mes connaissances médicales d’une façon
contraire aux lois de l’humanité.
Je m’y engage librement et sur mon honneur.
UNIVERSITE CADI AYYAD
FACULTE DE MEDECINE ET DE PHARMACIE
MARRAKECH
DOYEN HONORAIRE : Pr. MEHADJI Badie-azzamann
VICE DOYENS HONORAIRES : Pr. FEDOUACH Sabah
: Pr. AIT BEN ALI Said : Pr. BOURAS Najib
ADMINISTRATION
DOYEN : Pr. Abdelhaq ALAOUI YAZIDI
VICE DOYEN A LA RECHERCHE ET COOPERATION
VICE DOYEN AUX AFFAIRES PEDAGOGIQUES
: Pr. Ahmed OUSEHAL
: Pr. Abdelmounaim ABOUSSAD
PROFESSEURS D’ENSEIGNEMENT SUPERIEUR
Pr. ABBASSI Hassan Gynécologie-Obstétrique A
Pr. ALAOUI YAZIDI Abdelhaq Pneumo-phtisiologie
Pr. ABOUSSAD Abdelmounaim Néonatologie
Pr. BELAABIDIA Badia Anatomie-Pathologique
Pr. BOUSKRAOUI Mohammed Pédiatrie A
Pr. EL HASSANI Selma Rhumatologie
Pr. EL IDRISSI DAFALI My abdelhamid Chirurgie Générale
Pr. ESSADKI Omar Radiologie
Pr. FIKRI Tarik Traumatologie- Orthopédie A
Pr. KISSANI Najib Neurologie
Pr. KRATI Khadija Gastro-Entérologie
Pr. LATIFI Mohamed Traumato – Orthopédie B
Pr. MOUTAOUAKIL Abdeljalil Ophtalmologie
Pr. OUSEHAL Ahmed Radiologie
Pr. RAJI Abdelaziz Oto-Rhino-Laryngologie
Pr. SARF Ismail Urologie
Pr. SBIHI Mohamed Pédiatrie B
Pr. SOUMMANI Abderraouf Gynécologie-Obstétrique B
PROFESSEURS AGREGES
Pr. ABOULFALAH Abderrahim Gynécologie – Obstétrique A
Pr. AMAL Said Dermatologie
Pr. AIT SAB Imane Pédiatrie B
Pr. ASRI Fatima Psychiatrie
Pr. ASMOUKI Hamid Gynécologie – Obstétrique B
Pr. AKHDARI Nadia Dermatologie
Pr. BEN ELKHAIAT BEN OMAR Ridouan Chirurgie – Générale
Pr. BOUMZEBRA Drissi Chirurgie Cardiovasculaire
Pr. CHABAA Leila Biochimie
Pr. ESSAADOUNI Lamiaa Médecine Interne
Pr. FINECH Benasser Chirurgie – Générale
Pr. GHANNANE Houssine Neurochirurgie
Pr. GUENNOUN Nezha Gastro – Entérologie
Pr. LOUZI Abdelouahed Chirurgie générale
Pr. MAHMAL Lahoucine Hématologie clinique
Pr. MANSOURI Nadia Chirurgie maxillo-faciale Et stomatologie
Pr. MOUDOUNI Said mohammed Urologie
Pr. NAJEB Youssef Traumato - Orthopédie B
Pr. SAMKAOUI Mohamed
Abdenasser Anesthésie- Réanimation
Pr. YOUNOUS Saïd Anesthésie-Réanimation
Pr. TAHRI JOUTEH HASSANI Ali Radiothérapie
PROFESSEURS ASSISTANTS
ABOUSSAIR Nisrine Génétique
Pr. ADERDOUR Lahcen Oto-Rhino-Laryngologie
Pr. ADMOU Brahim Immunologie
Pr. ALAOUI Mustapha Chirurgie Vasculaire périphérique
Pr. AMINE Mohamed Epidémiologie - Clinique
Pr. ARSALANE Lamiae Microbiologie- Virologie
Pr. ATMANE El Mehdi Radiologie
Pr. BAHA ALI Tarik Ophtalmologie
Pr. BOURROUS Monir Pédiatrie A
Pr. CHAFIK Aziz Chirurgie Thoracique
Pr. CHAIB ALI Cardiologie
Pr. CHERIF IDRISSI EL GANOUNI Najat Radiologie
Pr. DAHAMI Zakaria Urologie
Pr. DIOURI AYAD Afaf Endocrinologie et maladies
métaboliques
Pr. Drissi Mohamed Anesthésie -Réanimation
Pr. EL ATTAR Hicham Anatomie - Pathologique
Pr. EL FEZZAZI Redouane Chirurgie Pédiatrique
Pr. EL HATTAOUI Mustapha Cardiologie
Pr. EL HOUDZI Jamila Pédiatrie (Néonatologie)
Pr. EL JASTIMI Said Gastro-Entérologie
Pr. ETTALBI Saloua Chirurgie – Réparatrice et plastique
Pr. HERRAG Mohamed Pneumo-Phtisiologie
Pr. KHALLOUKI Mohammed Anesthésie-Réanimation
Pr. KHOULALI IDRISSI Khalid Traumatologie-orthopédie
Pr. LAOUAD Inas Néphrologie
Pr. LMEJJATTI Mohamed Neurochirurgie
Pr. MAHMAL Aziz Pneumo - Phtisiologie
Pr. MANOUDI Fatiha Psychiatrie
Pr. MOUFID Kamal Urologie
Pr. NEJMI Hicham Anesthésie - Réanimation
Pr. OULAD SAIAD Mohamed Chirurgie pédiatrique
Pr. QACIF Hassan Médecine Interne
Pr. TASSI Nora Maladies Infectieuses
Toutes les lettres ne sauraient trouver les mots qu’il faut…
tous les mots ne sauraient exprimer ma gratitude, mon respect, mon amour,
ma reconnaissance…
C’est, ainsi, tout simplement que…
A
Mes très chers parents
Aujourd’hui je crois avoir réalisé un de vos rêves
Aucune dédicace, aucun mot ne saurait exprimer tout le respect, toute l’affection et tout l’amour que je vous porte.
Merci de m’avoir soutenu tant moralement que matériellement pour que je puisse atteindre mon but.
Que ce travail, qui représente le couronnement de vos sacrifices généreusement consentis, de vos encouragements incessants et de votre patience, soit de mon
immense gratitude et de mon éternelle reconnaissance qui si grande qu’elle puisse être ne sera à la hauteur de vos sacrifices et vos prières pour moi. Je prie Dieu, le tout puissant, de vous protéger et de vous procurer santé,
bonheur et longue vie…
A
mes très chers frères et très aimable sœur : Mehdi, Mounia, Youssef
Vous avez toujours été présents à mes cotés pour me consoler quand il fallait,
jamais je ne l’oublierais.
Restons Unis et Faisons la Fierté de nos Parents.
A
la mémoire de mes grands parents paternels
Que dieu le tout puissant vous accueille dans son éternel paradis et vous accorde
sa clémence et ses miséricorde.
A
mes grands parents maternels
A
tous mes oncles, tantes, cousins, cousines et leurs familles
Je vous dédie ce travail en témoignage de mes sentiments les plus sincères. Puisse Dieu vous garde en bonne santé et vous prête une longue vie pleine de
bonheur, santé et de prospérité.
A
Mes chers amis :
Ghizlane,Bouchra,Bouchra,Nissrine,Wafae,Farah,Abdessamad,Yacine,Rachida, Madiha,Ilham,Karima, Widad, Asmae.
Merci d’avoir toujours été à mes côtés pour partager des instants parfois difficiles, souvent merveilleux.
Je me félicite pour notre amitié.
À
ces personnes qui comptent beaucoup pour moi, s'ajoutent quelques autres que je
tiens à remercier pour leur aide amicale, et que je cite dans le désordre :
Afaf, Meryem, Naima, Mr Ziad, Mohamde amine, Mohcine, Othmane, Souhail Bouchtili, Khalid Chaker.
A
Notre maître et président de thèse
Monsieur le professeur HARIF MHAMED
Professeur d’hématologie
En présidant ce jury, vous nous faites un grand honneur.
Veuillez trouver ici l’expression de notre respectueuse considération et notre profonde admiration pour toutes vos qualités scientifiques et humaines. Ce travail est pour nous l’occasion de vous témoigner notre profonde gratitude.
A
Notre maître, rapporteur de thèse
Madame le professeur KRATI KHADIJA
Professeur de gastroentérologie et d’hépatologie
Je vous remercie pour la spontanéité avec laquelle vous avez bien voulu m’encadrer et l’amabilité avec laquelle vous m’accorder une partie de votre
temps précieux.
Votre gentillesse, votre compétence, votre sagesse, et votre sympathie inspirent une grande estime.
En choisissant de travailler sous votre direction, je rends hommage à votre savoir, à votre loyauté et à votre admirable humanisme.
Veuillez croire, cher maître, en l’expression de ma profonde gratitude et de ma très sincère considération.
A
Notre maître et juge de thèse
Madame le professeurs ESSAADOUNI LAMIAA
Professeur agrégée de médecine interne
Vous me faite un grand honneur en voulant bien siéger dans ce jury de thèse. Je salue en vous les grandes qualités techniques et humaines que j’ai eu l’occasion
Veuillez croire, cher maître, en l’expression de ma reconnaissance et de ma haute considération.
A
Notre maître et juge de thèse
Monsieur AMAL SAID
Professeur agrégé de dermatologie
C’est pour nous un grand honneur que vous acceptez de siéger parmi cet honorable jury.
Votre compétence, votre rigueur et vos qualités humaines exemplaires ont toujours suscité notre admiration.
Veuillez croire à l’expression de notre grande admiration et notre profond respect.
A
Notre maître et juge de thèse
Madame le professeur CHABAA LAILA
Professeur agrégée de biochimie
Nous vous sommes très reconnaissants de l’honneur que vous nous faites en
acceptant de juger ce travail.
Vos qualités humaines et professionnelles jointes à votre compétence et votre
disponibilité seront pour nous un
exemple à suivre dans l’exercice de notre profession.
Veuillez accepter, cher Maître, l’assurance de notre estime et profond respect.
A tout le personnel du laboratoire d’épidémiologie :
Pr. M. AMINE, Dr. ADERMOUCH
Nous vous remercions de l’aide et le soutien que vous nous avez apporté pour la
réalisation de ce travail.
A Mme BOUJROUF, Mr EL IDRISSI, Mr HAJRI et
Au personnel de la faculté de médecine et de pharmacie de Marrakech.Veuillez accepter, mes expressions de gratitude et de remerciements
Au personnel du service de Gastroentérologie et d’hépatologie.
Liste des abréviations
ADN : Acide désoxyribonucléique
AFP : Alfa foetoprotéine
ALAT : Alanines aminotransférases
ARN : L'Acide ribonucléique
ASAT : Aspartates aminotransférases CHC : Carcinome hépatocellulaire
CTL : Cellule T cytotoxique EIA : Enzyme Immunoassay
ELISA : Enzyme-Linked Immunosorbent Assay FOGD : Fibroscopie œsogastroduodénale HLA : Human Leucocyte Antigens
HTP : Hypertension portale
IFN : interferon
IFN-PEG : Interferon pegylé LDL : low density lipoprotein
MCS : Mental Component Summary
NC : Non codante
OMS : Organisation mondiale de la santé
ORF : Open reading frame
PBH : Ponction biopsie hépatique
PCR : Polymérase chaine réaction
PCS : Physical Component Summary
PKR : RNA protein kinase
RIBA : Recombinant immunoblot assay
RVP : Réponse virologique prolongée
RVS : Réponse virologique soutenue
Th : Cellule T helper
TNF : Tumor necrosis factor
TP : Taux de prothrombine VHB : Virus de l’hépatite B
VHC : Virus de l’hépatite C
VIH : Virus de l’immunodéficience humaine VO : Varices œsophagiennes
INTRODUCTION………. 1
PATIENTS ET METHODES……… 4
I- Critères d’inclusion ………. 5
II- Critères d’exclusion ……….. 5
III- Origine et analyse des informations ……….. 5
RESULTATS……… 7 I- Epidémiologie ……….. 8 1- Fréquence ………. 8 2- Sexe ……… 8 3- Age ……….. 9 4- Origine géographique ……… 10 5- Facteurs de risque ……… 10 6- Antécédents ………. 12
II- Données cliniques ………. 12
1- Délai entre le diagnostic et la consultation ……….. 12
2- Circonstances de découverte ……….. 12 3- Signes cliniques ……….. 13 III-Données paracliniques ……… 14 1- Bilan biologique ……….. 14 1-1- Tests hépatiques ……… 14 a- Enzymes hépatiques ……… 14 b- Bilirubinémie ………. 15 c- Bilan d’hémostase ……… 15
d- Electrophorèse des protides ……… 15
e- Alphafoetoproteine ……….. 15
1-2- Marqueurs virologiques de VHC ……… 16
b- Tests directs……… 16
c- Génotypage………. 16
1-3- Marqueurs virologiques de VHB et de VIH……… 17
2- Echographie abdominale ………. 17
3- Fibroscopie œsogastroduodénale……….. 18
4- Ponction biopsie hépatique ………. 18
5- Fibrotest……….. 20
6- Fibroscan……… 20
IV- Diagnostic ………... 20
1- Hépatite virale minime……….. 20
2- Hépatite virale modérée ou sévère non compliquée……… 21
3- Complications ………... 22 3-1- Cirrhose ……… 22 3-2- Hypertension portale ……… 24 3-3- Carcinome hépatocellulaire ……… 24 V- Infections associées au VHC ……….. 24 1- Hépatite virale C et VHB ……… 24
2- Hépatite virale C et VIH ……… 24
VI- Prise en charge ……….. 25
1- Objectifs ……… 25
2- Moyens ……….. 25
3- Indications ………. 28
4- Résultats ……… 29
4-1- Patients non traités………. 29
4-2- Patients traités ……… 29
VII- Evolution ………. 29
I- Le virus de l’hépatite C ………. 32 1- Virologie ……… 32 2- Epidémiologie ……….. 40 2-1- Prévalence ………. 40 a) Sexe ……… 41 b) Age………. 42 2-2- Modes de transmission ……….. 43 a- Transmission parentérale ……….. 44 b- Transmission sexuelle ……… 48
c- Transmission périnatale ou verticale ………. 49
d- Transmission horizontale……… 49
e- Autres modes de contamination ………. 50
3- Pathogénie ……… 53
4- Histoire naturelle de l’infection par le VHC ……… 55
4-1- Hépatite aigue……….. 56
4-2- Hépatite chronique ……… 57
4-3- Fibrose ………... 59
4-4- Cirrhose………. 64
4-5- Carcinome hépatocellulaire ……… 65
II- Etude clinique ………. 65
1- Circonstances de découverte ……….. 65
2- Examen clinique ……….. 67
III- Etude paraclinique ……… 68
1- Bilan biologique ………. 68
2- Marqueurs virologiques du VHC ……… 69
2-1- Tests indirects ………. 69
2-2- Tests directs ………. 70
4- Fibroscopie œsogastroduodénale ………. 73
5- Evaluation des lésions histologiques ……… 74
5-1- Ponction biopsie hépatique ………. 74
5-2- Fibrotest ……….. 76
5-3- Fibroscan ……….. 77
6- Recherche d’une coïnfection VHC/VHB……… 78
7- Recherche d’une coïnfection VHC/VIH ………... 79
IV- Diagnostic positif ………. 80
1- Hépatites virales minimes ……….. 80
2- Hépatites virales modérées ou sévères non compliquées………. 80
3- Hépatites virales C avec des manifestations extrahépatiques……….. 81
V- Evolution et complications de l’hépatite chronique C ……… 86
1- Cirrhose ………. 86
2- Hypertension portale ………. 87
3- Carcinome hépatocellulaire ……….. 88
VI- Diagnostics différentiels ………. 89
1- Hépatites virales non C ………. 89
2- Hépatite auto-immune ………. 89
3- Hépatites médicamenteuses ……… 91
4- Hépatite alcoolique ……….... 91
VII- Traitement de l’hépatite virale chronique C ……… 92
1- Objectifs thérapeutiques ……….. 92
1-1- Objectifs généraux ………. 92
1-2- Différents types de réponse ……… 92
1-3- Facteurs prédictifs de la réponse virale ……….. 93
2- Moyens thérapeutiques ………. 95
2-1- Interféron alpha ……….. 95
b- Différents types d’interféron ……… 95 c- Modalités thérapeutiques ………... 96 d- Contre indications ……… 96 e- Effets secondaires ……… 96 2-2- Ribavirine ………. 97 a) Mode d’action ………. 97 b) Modalités thérapeutiques ………... 98 c) Contre indications ………. 98 d) Effets secondaires ………... 98 2-3- Autres ………. 99 2-5- Transplantation hépatique ……….. 102
3- Indications du traitement de l’hépatite chronique C ……….. 103
3-1- Traitement des patients naïfs ………. 103
3-2- Traitement des patients répondeurs-rechuteurs ………. 104 3-3- Traitement des patients non répondeurs ……….. 104
3-4- Formes particulières ……….. 105
4- Surveillance ……….. 110
4-1- Surveillance des patients non traités……… 110 4-2- Surveillance des patients traités ……… 111
5- Résultats ………... 113
VIII- Aspects psychosociaux de l’hépatite chronique C……… 115
IX- Perspectives d’avenir………... 118
CONCLUSION……… 121
ANNEXES……… 123
RESUMES BIBLIOGRAPHIE
L’infection par le virus de l’hépatite C (VHC) est considérée comme un problème majeur de santé publique à l’échelle mondiale [1], en raison de sa fréquence et sa gravité liée au risque important d’évolution vers la cirrhose.
L’OMS estimait qu’environ 3% de la population générale était infectée par ce virus [2]. Cette prévalence est toutefois variable avec trois zones géographiques : zone de haute prévalence supérieure de 1,5% à 6%, de moyenne prévalence de 1% et de faible prévalence inférieure à 0,5% [1].
Le Maroc se situe dans la zone d’endémie moyenne, une étude préliminaire a été publiée en 1996 et a estimé à 1,1% la prévalence des anti-VHC chez les donneurs du sang marocains [2]. En revanche, nous nous disposons d’aucune étude récente qui concerne la population générale marocaine [1].
Le portage chronique du VHC est défini par la persistance de l'Acide ribonucléique (ARN) du VHC dans le sérum, 6 mois après la date de contamination [3].
Selon l’OMS, plus de 200 millions de personnes sont porteurs chroniques du VHC. Ces personnes sont exposées au risque de passage de l’infection à VHC à la chronicité avec des risques survenue de complications tel que la cirrhose et le carcinome hépatocellulaire (CHC) [1].
En France, l’hépatite C est la deuxième cause de cirrhose et de CHC après la consommation excessive d’alcool. Le nombre de décès liés à l’hépatite C a été estimé en 2004 à environ 3300 par an en France [4].
A la lumière de ces données, il s’avère donc impératif d’établir le diagnostic de l’infection par le VHC à un stade précoce et d’instaurer une thérapie efficace et adaptée, permettant de prévenir l’évolution vers ses complications (la cirrhose et le CHC).
Le traitement de l’hépatite chronique C a en effet déjà vécu une importante révolution, avec l’introduction de la ribavirine et celle des interférons alpha pégylés qui ont permis de passer en 15 ans d’un taux de guérison de l’ordre de 6% à un taux de guérison actuel de l’ordre de 50% [5].
Le but de notre travail est d’analyser le profil épidémiologique, ainsi de déterminer, à travers l’étude d’une série d’observations de malades porteurs chroniques du VHC, les aspects épidémiologiques, cliniques et évolutifs de cette maladie dans notre contexte.
PATIENTS
ET
C’est une étude rétrospective, épidémiologique et analytique réalisée au service de Gastroentérologie et d’hépatologie du CHU Mohamed VI de Marrakech du Juin 2003 au Décembre 2007, ayant porté sur 100 patients suivis en consultation pendant cette période.
I- Critères d’inclusion:
Tous les malades ayant un portage chronique de l’Ac antiVHC, 6 mois après la date de contamination, avec une charge virale positive, qui étaient hospitalisés ou qui ont consulté durant la période Juin 2003–Décembre 2007.
II- Critères d’exclusion:
Nous avons exclu de notre étude :
- Les patients ayant été perdus de vue avant la réalisation du bilan pour confirmer le portage chronique du VHC.
- Les patients ayant un portage du VHC et n’ayant pas bénéficié de bilan pour préciser le profil évolutif de la maladie.
- Les patients guéris en gardant un Ac anti-VHC positif avec une charge virale négative.
III- Origine et analyse des informations:
Les informations sont recueillies à partir de l’étude de dossiers des patients, exploités selon une fiche préétablie (voir annexe 1).
L’analyse statistique a été réalisée au laboratoire d’épidémiologie à la faculté de médecine et de pharmacie de Marrakeche, le logiciel utilisé au cours de l’étude est Epi Info 6.04.
Nos patients ont bénéficié d’un bilan initial comportant systématiquement :
- Une sérologie de l’hépatite C : Ac anti-VHC, la recherche de l’ARN du VHC (PCR). - Le génotype et la charge virale pour les malades proposés au traitement.
- Une étude de la réplication virale de VHB (AgHBe - Ac anti HBe – ADN sérique virale) en cas de portage de l’Ag HBs.
- Une sérologie VIH.
- Un bilan hépatique comportant le dosage des enzymes hépatiques, un taux de prothrombine (TP), une albuminémie.
- Une numération formule sanguine. - Une échographie abdominale.
- Un dosage de l’alphafoetoprotéine (AFP). Ainsi, en fonction du contexte, nous avons fait :
- Une fibroscopie digestive haute (FOGD). - Une ponction biopsie hépatique (PBH). - Un fibroscan, un fibrotest.
- Une tomodensitométrie abdominale. - Une imagerie par résonnance magnétique.
L’évaluation des lésions histologiques est faite selon la classification Métavir (voir annexe2).
Pour évaluer la gravité de la cirrhose nous avons utilisé le score Child modifié par Pugh (voir annexe 3).
I- Epidémiologie :
1- Fréquence :
Durant la période de l'étude, 106 dossiers de patients suivis pour hépatite chronique C ont été colligés. Six dossiers ne répondant pas aux critères d’inclusion ont été écartés, et 100 dossiers ont été retenus pour l'étude.
La répartition des cas selon l'année de consultation ou d’hospitalisation est schématisée dans le tableau I.
Tableau I : Répartition par rapport aux années
2 - Sexe :
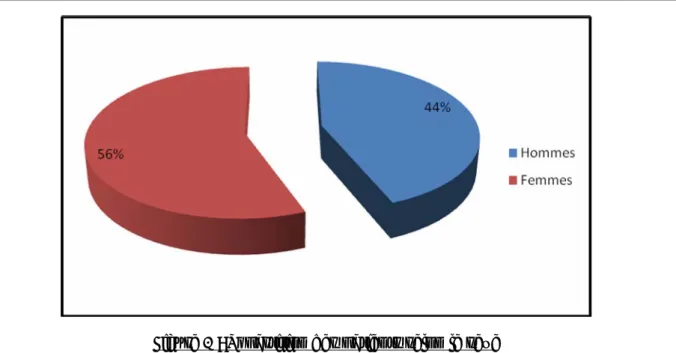
Sur les 100 patients de notre série, nous avons retrouvé: - 56 cas de sexe féminin (soit 56%).
- 44 cas de sexe masculin (soit 44%). - sexe ratio : 0,78 (Figure 1)
Années Nombre de cas Pourcentage (%)
2003 25 25 2004 28 28 2005 16 16 2006 21 21 2007 10 10
Figure 1 : Répartition des patients selon le sexe
3- Age :
La moyenne d'âge au moment du diagnostic était de 57,19 +/- 11,969 ans, avec des extrêmes de 26 et 90 ans.
La tranche d’âge la plus touchée était celle des 51-60 ans (40 patients soit 40%). (Figure2)
4-
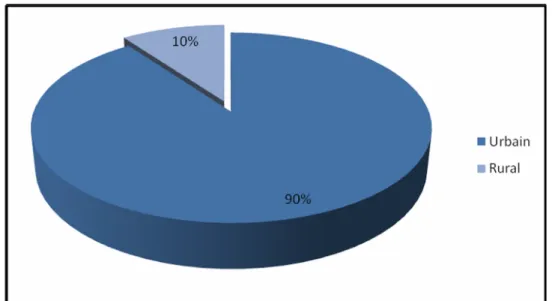
Origine géographique
:
(Figure 3) - 90 patients sont d’origine urbaine (soit 90%). - 10 patients sont d’origine rurale (soit 10%).Figure 3 : Répartition selon l’origine géographique.
5- Facteurs de risque :
L’anamnèse à la recherche d’un facteur de risque dans notre série a montré que les deux facteurs de risque largement majoritaires, ont été les soins dentaires informels (38%) et l’antécédent de chirurgie (32%).
Au moins deux facteurs présumés de contaminations ont été retrouvés chez 40 patients soit 40%.
Aucun facteur de risque n’a été noté chez 23 patients (23%).
Tableau II : Différents facteurs de risque.
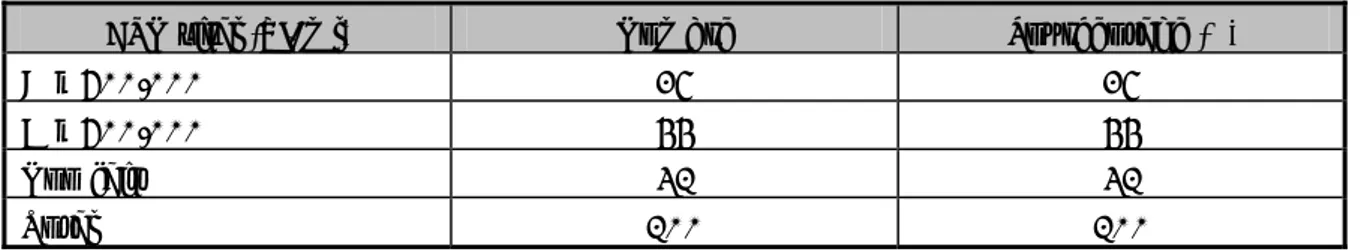
Parmi les patients chez lesquels un facteur de risque a été identifié : (Tableau III) - 47 cas (47%) avaient un délai d’évolution présumé supérieur à 20 ans - 17 cas (17%) avaient un délai d’évolution présumé entre 10 et 20 ans Le délai moyen d’évolution était de 20,37± 9,66 années.
Tableau III : Délai d’évolution présumé
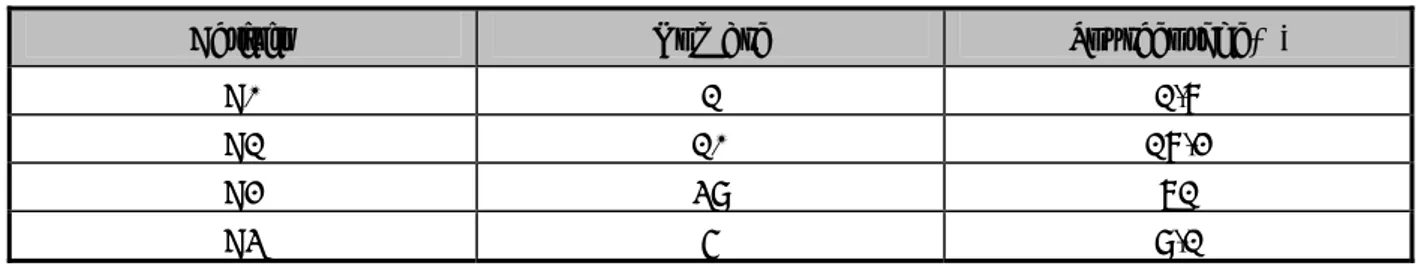
Facteurs de risque Nombre Pourcentage(%)
Soins dentaires informels 38 38
Chirurgie 32 32
Transfusion sanguine 13 13
Rapports sexuels non protégés 10 10
Professions à risque 8 8
Plaie suturée 5 5
Tatouage 5 5
Cas de VHC dans la famille 4 4
Hémodialyse 3 3 Acupuncture 2 2 Rasage collectif 2 2 Toxicomanie IV 2 2 Fibroscopie 1 1 Curetages à répétition 1 1 Indéterminés 23 23
Délai d’évolution Nombre Pourcentage (%)
Entre 0 et 2 ans 4 4 Entre 2 et 5 ans 5 5 Entre 5 et 10 ans 4 4 Entre 10 et 20 ans 17 17 Supérieur à 20 ans 47 47 Non précisé 23 23
6- Antécédents :
Nous avons recherché les antécédents de nos patients : - 9 cas (9%) avaient un antécédent d’ictère.
- 2 cas (2%) avaient un antécédent d’hématémèse. - 7 cas (7%) étaient diabétiques.
- 2 cas (2%) d’hépatite chronique B.
- 14 cas (14%) avaient des habitudes toxiques : éthylisme chronique. - 72 cas (72%) n’avaient pas d’antécédents pathologiques particuliers.
II. Données cliniques :
1- Délai entre le diagnostic et la consultation :
Le délai entre le diagnostic et la consultation était dans 92% des cas inferieur à 1 an. Tableau IV : Délai entre le diagnostic et la consultation.
2- Circonstances de découverte
: (Tableau V)La découverte était fortuite chez 39 patients (39%), à l’occasion d’un don volontaire de sang chez 22 patients (22%) et suite à un bilan chez 17 personnes (17%).
Par ailleurs l’affection a été découverte à l’ occasion d’une asthénie chez 30 malades (30%).
Délai entre diagnostic et la consultation nombre Pourcentage (%)
<1an 92 92
≥ 1an - <2ans 1 1
≥ 2ans - <5ans 2 2
Tableau V : Circonstances de découverte de VHC
Circonstances de découverte Nombre Pourcentage (%)
39 39 22 22 Fortuite : Don de sang Bilan 17 17 Asthénie 30 30 Distension abdominale 12 12 Douleur abdominale 7 7 Hématémèses 6 6 Ictère 2 2 Lichen plan 2 2 Méléna 1 1 Amaigrissement 1 1 Total 100 100
3- Signes cliniques
: (Tableau VI)- L’examen clinique était normal dans 64 cas (64%). - L’ascite a été retrouvée dans 18 cas (18%).
- Un lichen plan a été noté dans 2 cas (2%).
Tableau VI : Répartition des cas selon les signes cliniques
Signes cliniques Nombre de cas Pourcentage (%)
Ascite 18 18
Splénomégalie 10 10
Hépatomégalie 9 9
Œdème des membres inferieurs 6 6
Circulation collatérale 5 5 Insuffisance hépatocellulaire 5 5 Hémorragie digestive 4 4 Ictère 2 2 Lichen plan 2 2 Gougerot-Sjôgren 1 1
III- Données paracliniques :
1- Bilan biologique :
1-1 Tests hépatiques :
a- Enzymes hépatiques :
a-1 Transaminases
Le dosage des transaminases a été réalisé chez tous les patients, les alanines aminotransférases (ALAT) étaient à 2N dans 44 cas (44%), et les aspartates amino transferases (ASAT) étaient à 2N dans 42 cas (Figure 4) :
Figure 4 : Valeurs des transaminases.
a-2 Gamma glutamyl transférase
- 68 (68%) malades avaient un taux de Gamma glutamyl transfèrase normal. - 32 (32%) malades avaient un taux de Gamma glutamyl transfèrase élevé.
a-3 Phosphatases alcalines
- 61 (61%) malades avaient un taux normal. - 39 (39%) malades avaient un taux élevé.
b- Bilirubinémie :
Le dosage de la bilirubinémie a été effectué chez tous les patients, l’hyperbilirubinémie totale a été observée chez 22 patients (22%).
Figure 5 : Valeurs des bilirubines
c- Bilan d’hémostase :
- Le taux de TP était normal dans 91 cas (91%) et bas dans 9 cas (9%).
d- Electrophorèse des protides :
- Elle a révélé une hypoalbuminémie dans 25 cas (25%) et une hypergammaglobulinemie dans 26 cas (26%).
- Elle n’a pas noté d’anomalie dans 74 des cas (74%).
e- Alphafoetoproteine :
1-2 Marqueurs virologiques de VHC :
a- Tests indirects :
Tous nos patients ont bénéficié d’un test de dépistage Elisa (Ensyme-Linked immunosorbent assay) de troisième génération, qui était positif dans tous les cas.
b- Tests directs :
b-1 Test qualitatif :
Tous les patients (100% des cas) ont bénéficié d’une recherche qualitative de l’ARN virale, qui était positive.
b-2 Test quantitatif :
Le dosage de l’ARN viral a été fait chez 69 malades (Tableau VII) :
- 44 malades (63,8%) avaient une charge virale supérieure à 600000 UI/ml. -25 malades (36,2%) avaient une charge virale inferieure à 600000 UI/ml.
Tableau VII: Charge virale
c- Génotypage :
Le génotypage a été réalisé chez 73 patients soit 73% : -26 malades soit 35,6% étaient porteurs de génotype 1. -43 malades soit 58,9% étaient porteurs de génotype 2. -2 malades soit 2,73% étaient porteurs de génotype 3. -2 malades soit 2,73% étaient porteurs de génotype 4.
ARN viral (UI/ml) Nombre Pourcentage (%)
< à 600.000 25 25
> à 600.000 44 44
Non fait 31 31
1-3 Marqueurs virologiques de VHB et de VIH :
a- Marqueurs de VHB :
La recherche de l’antigène HBs et de l’anticorps anti HBc a été effectuée chez tous les malades :
- 5 malades avaient un antigène HBs positif soit 5% des cas.
-14 malades avaient un anticorps anti HBc positif, soit 14% des cas.
La recherche de l’ADN virale a été effectuée chez les patients ayant un AgHBs et/ou des AC anti HBc positifs avec des ALAT élevées, c’était le cas de 7 patients, et la charge virale de VHB a été inferieure à 104 copies/ml.
b- Sérologie VIH :
Elle était négative dans 100 cas (100%).
2 – Echographie abdominale :
L’échographie abdominale, réalisée dans tous les cas, avait objectivé : - Un aspect normal dans 59 cas (59%).
- Un aspect pathologique du fois dans 38 cas (38%).
Tableau VIII : Résultats de l’échographie abdominale
Echographie Nombre Pourcentage(%)
Foie hétérogène 25 25 Foie dysmorphique 13 13 Hépatomégalie 6 6 Foie steatosique 7 7 Foie atrophique 5 5 Calcifications 0 0 Nodule hépatique 0 0 Ascite 20 20 Splénomégalie 19 19
Tronc porte dilaté 18 18
Circulation collatérale 1 1
Normale 59 59
3– Fibroscopie œsogastroduodénale :
Faite chez 49 patients soit 49%, revenait anormale dans 33 cas (67,34%), ainsi 16 patients seulement avaient une fibroscopie normale (32,65%).
Les anomalies retrouvées étaient :
- Les varices œsophagiennes (VO) dans 33 cas (67,34%). - La gastroraphie d’HTP dans 5 cas (10,20%).
- Les varices cardio-tubérositaires dans 2 cas (4,08%).
4– Ponction biopsie hépatique :
Dans le but de réaliser une PBH, tous nos patients ont bénéficié d’un bilan préliminaire comportant une numération formule sanguine, un taux de plaquettes, un bilan d’hémostase ainsi qu’une échographie abdominale.
La PBH du foie a été réalisée chez 55 patients, le résultat de l’étude histologique a permis d’évaluer le degré de l’activité et la fibrose selon la grille de Métavir (Tableaux IX, X, XI) :
Tableau IX : Répartition des malades en fonction de l’activité :
Activité Nombre Pourcentage(%)
A0 1 1,8 A1 10 18,2 A2 39 71 A3 5 9,1 Tableau X : Répartition des malades en fonction de degré de la fibrose :
Fibrose Nombre Pourcentage (%)
F0 6 10,9 F1 9 16,4 F2 24 43,6 F3 12 21,8 F4 4 7,3 Tableau XI : Répartition des malades en fonction du degré d’activité et de fibrose
Activité Fibrose Nombre Pourcentage (%)
A0 F3 1 1,8 F0 2 3,6 F1 2 3,6 F2 4 7,3 A1 F3 2 3,6 F0 4 7,3 F1 7 12,7 F2 17 30,9 F3 8 14,5 A2 F4 3 5,4 F2 3 5,4 F3 1 1,8 A3 F4 1 1,8 Stéatose 21 38,2
5- Fibrotest :
Le fibrotest a été réalisé chez 15 malades, le score F4 a été noté dans 5 cas (33,3%). (Tableau XII)
Tableau XII : Répartition des malades en fonction du fibrotest
6- Fibroscan:
Le fibroscan a été demandé chez un seul malade, non fait par manque de moyen.
IV. Diagnostic:
1- Hépatite virale minime:
L’hépatite virale minime est caractérisée par un taux des transaminases normal ou modérément élevé avec un score d’activité de Métavir < A1 et < F1.
Neuf patients (9%) de notre série avaient une hépatite chronique minime. L’analyse de l’âge présumé de contamination a montré que :
- 4 malades étaient âgés de 20 à 30 ans. - 4 malades étaient âgés de 40 à 50 ans.
- On n’a pas pu calculer l’âge de contamination chez 1 seul malade par absence de facteurs de risque.
Fibrotest Nombre Pourcentage (%)
F0 1 6,7 F0F1 2 13,3 F2 3 20 F2F3 1 6,7 F3 2 13,3 F3F4 1 6,7 F4 5 33,3
Un délai présumé d’évolution a été évalué dans 8 cas, il a été estimé : - Entre 2 et 5 ans dans2 cas.
- Entre 10 et 20 ans dans 1 cas. - Plus de 20 ans dans 5 cas.
La recherche des facteurs associés à la progression de la fibrose a montré : - Le sexe ratio était de 0,12.
- L’âge moyen de contamination était de 39,25 ans. - La consommation d’alcool a été notée dans 1 cas. - La stéatose hépatique chez un seul malade.
- Le génotype était de type 2 chez 7 malades, et non fait dans 2 cas. - L’absence de diabète et de coïnfection avec le VHB dans tous les cas.
2 - Hépatite virale modérée ou sévère non compliquée :
Le diagnostic d’hépatite modérée ou sévère a été retenu sur la PBH du foie (un score de Métavir A > 2 et /ou F > 2) et l’augmentation du taux des ALAT.
Cinquante patients (50%) de notre série avaient une hépatite chronique modérée ou sévère.
L’analyse de l’âge présumé de contamination a montré que : -14 malades étaient âgés de 21 à 30 ans (28%).
-13 malades étaient âgés de 31 à 40 ans (26%). - 8 malades étaient âgés de 41 à 50 ans (16%). - 5 malades étaient âgés de plus de 51 ans (10%).
- Le calcul de ce paramètre n’a pas pu être effectué chez 10 malades (20%) par absence de facteur de risque.
Un délai présumé d’évolution a été évalué dans 40 cas, il a été estimé à : - Moins de 2 ans dans 4 cas (10%).
- Entre 5 et 10 ans dans 2 cas (5%). - Entre 10 et 20 ans dans 10 cas (25%). - Plus de 20 ans dans 22 cas (55%).
La recherche des facteurs associés à la progression de la fibrose a montré : - Le sexe ratio était de 1.
- L’âge moyen de contamination était de 37,37 ans.
- La consommation d’alcool a été notée chez 8 malades (16%). - Le diabète dans 4 cas (8%).
- La Stéatose hépatique dans 19 cas (38%).
- Le génotype était de type 1 dans 20 cas (40%) et type 3 dans un seul cas (2%), et non effectué dans 2 cas (4%).
- La coïnfection avec le VHB dans 1 cas (2%).
3- Complications :
3-1 Cirrhose :
Parmi les patients de notre série, 41 (41%) ont été diagnostiqués au stade de cirrhose, ce diagnostic a été fait en se basant sur :
- Des signes indirects dans 37 cas (90,24%), associant : * Signes HTP.
* Foie dysmorphique à l’échographie.
* Signes d’insuffisance hépatocellulaire cliniques et biologiques. * Fibrotest.
- Des signes histologiques dans 4 cas (9,75%).
L’âge moyen des malades cirrhotiques a été estimé à 62 ans, avec un minimum de 38 ans et un maximum de 90 ans.
L’analyse de l’âge présumé de contamination a noté : - 5 malades étaient âgés de moins de 20 ans (12,19%). - 11 malades étaient âgés de 21 à 30 ans (26,82%). - 4 malades étaient âgés de 31 à 40 ans (9,75%). - 3 malades étaient âgés de 41 à 50 ans (7,31%). - 6 malades étaient âgés de plus de 51 ans (14,63%).
- Le calcul de ce paramètre n’a pas pu être effectué chez 12 malades (29,26%) par absence de facteur de risque.
Un délai présumé d’évolution a été évalué dans 29 cas, il a été estimé à : - Entre 2 et 5 ans chez 1 seul malade (3,4%).
- Entre 5 et 10 ans chez 2 malades (6,9%). - Entre 10 et 20 ans chez 6 malades (20,7%). - Plus de 20 ans chez 20 malades (69%).
La recherche des facteurs associés à la progression de la fibrose a montré : - Le sexe ratio était de 0,78.
- L’âge moyen de contamination était de 33,62 ans.
- La consommation d’alcool a été notée dans 5 cas (12,19%). - Le diabète dans 3 cas (7,31%).
- La stéatose hépatique chez 1 seul malade (2,43%).
- Le génotype : type 1 dans 6 cas (14,63%), type 3 chez un seul malade (2,43%), et non fait dans 23 cas (56,09%).
- La coïnfection avec le VHB dans 4 cas (9,75%).
La stadification a été faite pour tous les malades de notre série selon le score de Child Pugh :
- Stade A : 19 cas (46,34 %). - Stade B : 15 cas (36,6 %).
- Stade C : 7 cas (17,07%).
Parmi ces patients, 22 cas (53,65%) avaient une cirrhose décompensée, 19 cas (46,3%) avaient une cirrhose compensée.
3-2 Hypertension portale :
33 patients de notre série (33%) ont présenté une HTP sur cirrhose.
3-3 Carcinome hépatocellulaire :
Dans notre série, on a diagnostiqué 4 cas (4%) de CHC survenant sur cirrhoses décompensées, le diagnostic a été posé sur l’aspect scannographique évocateur et le taux élevé des AFP.
Tous les malades ont été diagnostiqués au stade de CHC « évolué ».
Le délai entre la cirrhose et le CHC n’a pas pu être estimé (les malades ont consulté au stade de complication cirrhotique et carcinomateuse).
V- Infections associées au VHC:
1- Hépatite virale C et VHB :
Neuf malades porteurs d’hépatite chronique C avaient un contact ancien avec le VHB ( AgHBs négatif , anticorps HBc positifs).
Une coïnfection par l’hépatite virale B et C a été notée chez cinq patients, qui étaient tous des porteurs non répliquants, dont quatre sont cirrhotiques.
2- Hépatite virale C et VIH :
La coïnfection par le virus de l’hépatite C et le VIH n’a pas été retrouvée chez nos patients.
VI. Prise en charge :
1- Objectifs :
Nos objectifs thérapeutiques consistaient à : - L’obtention d’une réponse virologique durable.
- L’arrêt ou la réduction de la progression vers la cirrhose.
- En cas de cirrhose, la prévention ou le traitement des complications, et le retard de développement d’un CHC.
2- Moyens :
2-1 Surveillance :
La surveillance a comporté un examen clinique et un dosage semestriel des transaminases, une éventuelle PBH après 5 ans ou plus précocement en cas de facteurs de comorbidité ou d’augmentation des transaminases, le dépistage du CHC : dosage de l'AFP et échographie abdominale tous les 6 mois, la FOGD tous les 1 à 4 ans chez les malades en cirrhose.
Ainsi, l’abstinence a été indiquée chez 4 patients (4%).
2-2 Traitements médicamenteux antivirale :
Dans notre série 54 malades (54%) ont été traités selon un des trois schémas suivants : (Tableau XIII).
Les protocoles qui ont été utilisés :
- Interféron pegylé (IFN-PEG) α−2a (180 µg/sem) + Ribavirine (800 mg/j en dessous de 65 kg, 1 000 mg entre 65 et 85 kg et 1200 mg au-delà) chez 36 malades (66,66%). - INF-PEG α−2b (1,5 µg/kg/sem) + Ribavirine (800 mg/j en dessous de 65 kg, 1000 mg
- L’interféron standard (IFN) en monothérapie : 3 MU 3 fois par semaine chez 1 malade (1,85%) (1 malade hémodialysé).
Tableau XIII : Répartition des médicaments antiviraux utilisés chez les patients
La durée du traitement était déterminée en fonction du génotype :
- Les génotypes1 et 4 : 1an de traitement, c’était le cas de 15 patients (27,8%). - Les génotypes 2 et 3 : 6 mois de traitement, c’était le cas de 39 patients (72,2%).
Tous les patients traités ont bénéficié d’un bilan préthérapeutique comportant : une numération formule sanguine avec numération des plaquettes, un TP, une glycémie, une urée créatinine sanguines, acide urique, un dosage de la thyréostimuline, un électrocardiogramme, et un test de grossesse pour les femmes non ménopausées.
Vingt-deux malades (22%) ont présenté une contre indication au traitement antiviral lié à la décompensation oedematoascitique.
La surveillance du traitement était mensuelle, clinique et biologique comportant une numération formule sanguine avec taux de plaquettes, dosage des transaminases tous les mois, la thyréostimuline tous les 2 mois, PCR à 1 mois, 12 semaine et à la fin du traitement.
Dans notre série l’anémie était le principal effet secondaire noté (Tableau XIV). L’arrêt transitoire du traitement a été indiqué chez 9 malades (16,66%).
L’arrêt définitif du traitement était indiqué chez un seul malade cirrhotique suite à la survenue d’un cancer rectal (1,85%).
Médicaments antiviraux Nombre Pourcentage (%)
IFN 1 1,85
INF-PEG α-2a +Ribavirine 36 66,66
INF-PEG α-2b +Ribavirine 17 31,48
Tableau XIV : Effets secondaires de la thérapie chez nos patients.
Effets secondaires Nombre Pourcentage (%)
Syndrome pseudo grippal 16 29,6
Asthénie 13 24,1 Lésions cutanées 11 20,4 Trouble de sommeil 8 14,8 Dépression 4 7,4 Anorexie 4 7,4 Toux 3 5,6 Amaigrissement 2 3,7 Dysthyroidie 1 1,9 Alopécie 1 1,9 Goutte 1 1,9 Anémie 17 31,5 Thrombopénie 9 16,7 Leucopénie 6 11,1
Elévation des ALAT 3 5,5
2-3 Traitement des complications :
Autres traitement ont été utilisés en fonction du contexte :
- Diurétiques (furosémide + aldactone) ont été prescrits chez 22 patients. - Bêta bloquants chez 6 patients.
- Ponction d’ascite faite chez 10 patients. - Ligatures des VO chez 6 patients.
2-4 Transplantation hépatique :
Aucun de nos malades n’a bénéficié d’une transplantation.
2-5 Mesures d’accompagnement :
° Pour limiter les facteurs aggravant de la fibrose : - Sevrage complet de l’alcool.
- Perte de poids en cas d’obésité. - Equilibre du diabète.
° L’utilisation des moyens de contraception efficaces pendant le traitement, et les mois suivants : pendant 4 mois chez les femmes, et 6 mois chez les hommes.
Ces mesures ont été suggérées à tous les patients traités.
3- Indications :
- L’abstinence avec surveillance ont été envisagées chez 7 malades (7%) :
* 4 malades pour hépatite virale avec transaminases normales, lésions histologiques minimes.
* 3 malades par manque de moyens.
- 54 malades (54%) ont bénéficié d’un traitement antiviral : * Hépatite virale modérée ou sévère : 37 cas (68,51%). * Cirrhose compensée : 13 cas (24,07%).
* Elévation des ALAT, A1F1 à la PBH : 2 cas (3,70%). * Manifestation extra hépatique : 1cas (1,85%). * La forte demande du patient : 1cas (1,85%).
- 22 malades (22%) atteints de cirrhose avec décompensation oedématoascitique ont bénéficié d’un traitement à base de diurétiques (furosémide + aldactone) dont : * 10 patients (45,45%) ont bénéficié d’une ponction évacuatrice avec perfusion
d’albumine.
*6 patients (27,27%) présentant une hémorragie par rupture de VO ont bénéficié d’une ligature avec mise en route d’un traitement bétabloquants.
* 2 malades (9,09%) ont présenté une contre indication aux bétabloquants.
- Les malades atteints de CHC (4%) sur cirrhose décompensée étaient diagnostiqués au stade de CHC évolué, donc ils ont bénéficié d’un traitement symptomatique de la décompensation.
4- Résultats :
4-1 Patients non traités :
Sept patients (7%) de notre série ont bénéficié d’une surveillance :
- Cinq malades sont restés stables (71,42%) avec un taux de transaminases normal. - Deux malades ont gardé des transaminases élevées (28,57%).
4-2 Patients traités :
Cinquante trois patients (53%) de notre série ont pu compléter le traitement antiviral. Les résultats à la fin du traitement chez ces malades étaient :
- Une bonne réponse définit par l’absence de ARN viral à la fin du traitement, a été notée chez 50 patients (94,33%).
- Une non-réponse définit par la persistance de l‘ARN viral à la fin du traitement, a été notée chez 3 patients (5,66 %).
Parmi 38 cas (71,7%) traités porteurs de génotype 2, 37 cas avaient présenté une bonne réponse au traitement (97,36%) et seulement un cas n’a pas répondu (2,63%).
Parmi 15 cas (28,3%) traités porteurs de génotype 1,13 cas avaient présenté une bonne réponse au traitement (86,7%) et 2 cas n’ont pas répondu (13,3%).
Les vingt deux patients (22%) admis pour cirrhoses décompensées ont bien évolué sous traitement symptomatique (100%).
VII. EVOLUTION :
Nous avons pu suivre l’évolution de 69 patients, soit 69%, avec un recul moyen de 4,31ans+/- 1,43 et des extrêmes de 2 à 6 ans.
Chez les 7 patients non traités, l’évolution a été marquée par :
- Une stabilisation chez 5 patients (71,42%) avec un taux de transaminases normal lors du Suivi.
- La survenue de cirrhose chez un malade (14,28%) non traité par manque de moyen (délai de 6 ans).
- La survenue de trois décompensations oedematoascitiques chez un malade (14,28%) initialement cirrhotique non traité par manque de moyen.
Chez les 50 patients traités répondeurs, l'évolution s'est faite comme suit :
- Une réponse virologique prolongée (RVP), retenue sur la normalisation des transaminases et une charge virale non détectable 6 mois, 1 an et 2 ans après l'arrêt du traitement, était obtenue chez 44 patients (88%).
- La rechute après le traitement, définit par la réapparition de l’ARN viral dans les 2 ans qui suivent la fin du traitement, était notée chez 6 patients (12%).
- Selon le génotype :
* Génotype 2 : RVP dans 34 cas (91,9%) et rechute dans 3 cas (8,1%). * Génotype 1 : RVP dans 10 cas (76,9%) et rechute dans 3 cas (23,07%)
- L’indication de retraitement des malades rechuteurs a été proposée, 2 malades ont refusé, 1 malade n’avait pas les moyens et seulement 3 malades ont été retraités avec une réponse persistante.
- L’évolution vers un CHC n’a pas été notée chez aucun malade.
Chez les malades cirrhotiques, on a pas noté une résistance au traitement antivirale, la RVP a été notée dans 9 cas (75%) et seulement 3 cas (25%) ont rechuté.
On a pu suivre neuf patients admis initialement pour cirrhose décompensée, l’évolution s'est faite comme suit :
- Une décompensation oedematoascitique chez 6 patients.
- Deux décompensations oedematoascitiques chez 2 patients avec la survenue d’une encéphalopathie hépatique dans un seul cas.
I. Le virus de l’hépatite C :
1- Virologie :
1-1 Classification :
Le VHC, est un virus enveloppé à ARN, appartenant à la famille des Flaviviridae, comprenant les genres flavivirus, pestivirus et hepacivirus, il est le seul représentant du genre hepacivirus [6].
1-2 Structure :
Le VHC, tout comme les autres membres de la famille des Flaviviridae, se caractérise par un génome d’ARN, une nucléocapside icosaédrique ou sphérique et une enveloppe [7]. (Figure 6)
a- Enveloppe virale :
L’enveloppe virale est composée d’une bicouche lipidique (en vert) dans laquelle sont insérées les deux glycoprotéines d’enveloppe E1 et E2 [7].
Les glycoprotéines E1 (acides aminés 192 à 383) et E2 (acides aminés 384 à 746) sont les constituants majeurs de l’enveloppe du VHC, elles sont produites après clivage de la polyprotéine précurseur [6].
Les protéines d’enveloppe E1 et E2 ont des fonctions multiples et importantes : - Elles jouent un rôle important pour la morphogénèse des virions infectieux.
- Le complexe E1-E2 permettrait l’interaction avec le ou les récepteurs viraux et donc l’entrée du virus dans les hépatocytes [6].
- Il a par ailleurs été montré qu’E2 pouvait interférer avec la fonction de PKR, une kinase induite par les ARN double-brin qui participe à la mise en place de la réponse interféron [8].
Ainsi, E2 pourrait jouer un rôle important pour permettre un échappement du virus aux défenses de l’hôte [8].
b- Nucléocapside :
L’interaction entre l’ARN génomique et la protéine de capside aboutit à la formation de la nucléocapside par des mécanismes non encore élucidés, les nucléocapsides pourraient ensuite s’envelopper par bourgeonnement à l’intérieur du réticulum endoplasmique et les particules virales pourraient être excrétées par exocytose [9].
Protéine C est l’élément protéique de la nucléocapside virale, elle est très conservée et fortement antigénique.
Cette protéine peut exister sous différentes formes, d’abord, un clivage à son extrémité C terminale donne naissance à une forme « immature », de 23kDa et formée des 191 premiers acides aminés de la polyprotéine précurseur, ensuite, l’action d’une peptidase de peptide signal conduit à la forme dite « mature » d’environ 21kDa [10].
La protéine de capside pourrait intervenir dans la régulation de l’expression de certains gènes cellulaires, dans le métabolisme lipidique [11] et dans l’apoptose [12].
Elle est aussi impliquée dans la prolifération cellulaire et la carcinogenèse [13].
c- Génome :
Le génome du VHC est constitué d’un ARN simple brin de polarité positive de 9,6kb environ avec un cadre ouvert de lecture ORF (Open Reading Frame), encadré par deux extrémités non-codantes (5’ et 3’) [14]. L’ORF code une polyprotéine d’environ 3000 acides aminés [6].
c-1 Les extrémités non codantes :
- La région 5’ non codante (5’NC):
Ce segment génomique est essentiel à la traduction de la polyprotéine et à la réplication du génome [15]. Elle est constituée de 341 nucléotides [16], et comporte quatre domaines distincts, de I à IV [15].
La région 5’NC est une bonne cible pour le développement de nouvelles stratégies thérapeutiques. Des études d’inhibition de la traduction par des ARN interférents dirigés contre cette région ont en effet été publiées ces dernières années [14].
- La région 3’ non codante (3’ NC) :
La région 3’NC, de taille variable (environ 250 nucléotides), présente trois régions distinctes : une séquence peu conservée de 40 à 50 nucléotides, une zone poly-uracile/pyrimidine de longueur variable, et une séquence très conservée de 98 nucléotides. Celle-ci joue un rôle important dans l’initiation de la synthèse du brin d’ARN négatif au cours de la réplication [16].
c-2 Les protéines virales :
Le génome du VHC présente un ORF codant une polyprotéine d’environ 3000 acides aminés, qui est synthétisé au niveau du réticulum endoplasmique et subit différents clivages, ainsi, la traduction de l’ORF aboutit à la formation d’au moins dix protéines matures : C, E1, E2, p7, NS2, NS3, NS4A, NS4B, NS5A et NS5B. Les protéines C, E1 et E2 sont dites « structurales » car elles sont associées aux virions, tandis que les protéines non structurales joueraient un rôle dans le cycle viral [6,17].
- La protéine C :
- Les protéines d’enveloppe E1 et E2 : - La protéine p7 :
La protéine p7 est constituée de 63 acides aminés (747 à 809) et se situe à la jonction entre les protéines structurales et non structurales.
Il a en effet été montré que la protéine p7 est essentielle à l’assemblage et sécrétion efficace de virions infectieux [17].
- La protéine NS2 :
La protéine NS2 est constitué de 217 acides aminés, bien que le rôle de cette protéine ne soit pas connu [18], plusieurs fonctions lui ont été attribuées.
Elle serait impliquée dans le clivage de NS2A/NS3 [18] et pourrait participer à la morphogenèse du VHC [19].
- Les protéines NS3 – NS4A :
La protéine NS3 (631 acides aminés) possède une double fonction enzymatique, une fonction sérine protéinase et une activité hélicase et NTPase [18].
La protéine NS4A (54 acides aminés) [18], cofacteur de l’activité NS3 est essentielle pour clivage NS3/NS4A, NS4B/NS5A et également pour clivage NS4A/4B et 5A/5B.
La protéase NS3 est impliquée dans la multiplication virale et a été considérée comme une cible attirante pour des interventions thérapeutiques antivirales [20].
Récemment, il a été proposé que NS3 pourrait être impliquée dans la carcinogenèse [20]. - La protéine NS4B :
NS4B (261 acides aminés) est une protéine hydrophobe, associée aux membranes du reticulum endoplasmique [18].
NS4B induit des modifications membranaires, suggérant qu’une de ses fonctions serait la formation de structures membranaires impliquées dans la réplication de l’ARN viral [18].
- La protéine NS5A :
NS5A (447 acides aminés) est une protéine ancrée dans les membranes du reticulum endoplasmique grâce à son domaine membranaire N-terminal [18].
Elle est essentielle à la réplication du VHC [18], d’autres études ont montré que NS5A est capable d’inhiber l’induction de l’apoptose en interagissant avec certaines protéines cellulaires [12].
- La protéine NS5B :
NS5B (591 acides aminés) est une protéine membranaire qui joue un rôle prépondérant au sein du complexe de réplication du VHC, avec une activité ARN polymérase ARN dépendante [18].
Figure 6: Représentation schématique d’une particule du VHC [7].
Figure 8 : La microscopie électronique de virions VHC purifiés dans une culture de cellule [21].
1-3 Variabilité génétique du VHC :
La variabilité génomique est le résultat de l’accumulation de mutations dans le génome pendant le processus de réplication virale due à l’absence d’un système de correction proof-reading [22].
La distribution des mutations le long du génome viral n'est pas aléatoire et la comparaison des premières séquences complètes a permis de déterminer la variabilité de chaque région [22].
a- Classification en type et en sous type :
On distingue, selon la nomenclature de Simmonds, 6 génotypes ou types majeurs avec à l’intérieur de chaque type une multitude de sous types (a,b,c….) [23].
Schématiquement, on considère que deux souches virales appartiennent au même sous-type (a,b,c...) d'un même sous-type (1,2, ...6) lorsque I’ homologie de séquence nucléotidique entre elles est supérieure à 90%, lorsqu'elle est de I’ ordre de 80%, les souches appartiennent au même type mais à des sous-types différents, enfin, au-dessous de 70% d'homologie, les souches sont considérées comme appartenant à deux types différents [22].
b- Techniques d’identification du génotype :
La caractérisation des génotypes, sous-types et isolats repose essentiellement sur des études moléculaires, même si des tests sérologiques ont pu être mis au point, le séquençage complet du génome constitue la stratégie de référence pour le génotypage [24].
Le séquençage constitue une méthode d'analyse intégrale de la séquence du fragment en 5'NC et ne se limite pas, comme pour les autres techniques, à la recherche de variations de séquences détectées de manière ponctuelle, cependant la limite de cette technique est due au choix de la région ciblée (la 5'NC), laquelle est très conservée et ne permet pas une bonne caractérisation de certains sous-types viraux, la deuxième limite est d'ordre technique : le séquençage direct post-PCR ne permet pas la révélation des cas de coïnfections [24].
Les analyses phylogéniques des régions NS5b et E1 du génome viral constituent la meilleure alternative pour l'identification et la caractérisation des nouveaux sous-types du VHC [24]. Elles portent sur la comparaison des séquences d'acides nucléiques et le maniement de programmes informatiques, basés sur des modèles mathématiques complexes qui permettent de reconstituer des phylogénies à partir de ces séquences [22].
c- Implications pratiques du génotype :
Les génotypes du VHC sont associés de manière significative au mode de transmission, ainsi, le génotype 1b est plus souvent retrouvé chez les sujets ayant un antécédent de transfusion, alors que le génotype 3a est plus souvent observé chez les toxicomanes [22].
Le rôle des génotypes du VHC dans la progression de la maladie est particulièrement controversé [23].
Certaines études suggèrent que le génotype 1b pourrait être associé à une atteinte hépatique plus sévère et à une évolution plus agressive de la maladie que les autres génotypes, par contre, d’autres études réfutent ces associations.
Cependant, la stéatose hépatocytaire est induite directement par le VHC de génotype 3 [25].
L’importance du génotypage du VHC chez les patients chroniquement infectés vient du fait que, selon le génotype du virus, la durée et la réponse au traitement peuvent varier [23].
d- Distribution mondiale des génotypes :
Les génotypes du VHC se répartissent d’une façon variée entre les différentes régions géographiques du monde [22].
En Europe et l’Amérique du Nord les sous-types 1a, 1b, 2a, 2b et 3a sont les plus fréquents [23].
Le génotype 1b est présent au Japon chez 73% des cas d’infection de VHC, alors que le génotype 2c est prédominant en Italie du nord [23].
Le génotype 4 a été retrouvé en Afrique du nord et en Moyen orient, alors que les génotypes 5 et 6 sont présents en Afrique et en Hong Kong [23].
Une étude marocaine a analysé les différents génotypes du VHC présents chez 41 patients virémiques, deux génotypes apparaissaient majoritaires, le 1b (47%) et le 2a/2c (29%), données comparables aux distributions des génotypes aux Etats-Unis et en Europe de l’Ouest [26].
Dans notre étude 43 patients (58,9%) étaient porteurs de génotype 2, alors que le génotype 1 était présent chez 26 patients (35,6%) et seulement 4 malades étaient atteints d’autres génotypes (5,5%).
2- Epidémiologie :
2-1 Prévalence :
L’infection par le VHC est considérée comme un problème majeur de santé publique à l’échelle mondiale [1].
L'OMS estime que 170 millions de personnes environ, soit 3% de la population mondiale, sont infectées par le VHC [27].
Cette prévalence atteint parfois plus de 10% comme en Bolivie, Mongolie, et dans certains pays d'Afrique [28].
En Europe de l'Est, certains pays sont particulièrement touchés avec jusqu'à 4% de prévalence [28].
La prévalence de l’infection virale C en France a été estimée à 1,1% [27].
Le Maroc se situe dans la zone d’endémie moyenne avec une prévalence entre 1% et 2,4% [28].
Une étude marocaine publié en 2008 a trouvé que la prévalence des anti-VHC dans la population générale obtenu après confirmation par des tests sérologiques est de 1,2% [1].
La prévalence varie nettement en fonction des populations : 60% chez les usagers de drogues intraveineuses, 25% chez les sujets incarcérés, 25% des patients ayant une infection VIH [29].
Une étude réalisée entre 2003 et 2004 sur la prévalence des anticorps anti-VHC et incidence de séroconversion dans cinq centres d’hémodialyse au Maroc a estimé le taux global de séroprévalence à 68,3% [30].
Une étude prospective, publié en 2004, effectuée chez des patients hémodialysés adultes, pris de façon aléatoire parmi 308 centres de dialyse de France, Allemagne, Italie, Japon, Espagne, Royaume-Uni et Etats-Unis a montré une prévalence moyenne de l’infection à VHC de 13% [31].
Une étude préliminaire a été publiée en 1996 et a estimé à 1,1% la prévalence des anti-VHC chez les donneurs du sang marocains [2].
Figure 9 : Prévalence estimée de l’infection VHC dans le monde [28].
a- Sexe :
La majorité des études épidémiologiques réalisées retrouvent une prédominance masculine [32, 33, 34].
La répartition par sexe des patients de notre série a montré une légère prédominance féminine avec 56% de l’effectif de femmes contre 44% pour les hommes. Le sexe ratio est de 0,78.
Une étude réalisée par l’institue de veille sanitaire en France évaluant la répartition par classe d’âge et par sexe des personnes confirmées VHC positives (N=7588) par les 189 laboratoires ayant participé à l’étude entre 2000-2001 a montré que la proportion de l’ensemble des prélèvements positifs était plus importante chez les hommes (5,5%) que chez les femmes (3,5%) [35]. (Figure 10)
Une étude américaine faite entre 1999 et 2001 sur 1225 cas d’hépatite chronique C a montré une grande prédominance masculine : 790 hommes (43/100000) contre 435 femmes (22,81/100000) [33].
Dans un travail de thèse concernant 73 malades atteints d’hépatite C colligés au CHU de Casablanca entre 1994 et 1998, une prédominance féminine a été notée avec un sexe ratio de 1,28 [36].
Figure 10 : Répartition par classe d’âge et par sexe des personnes confirmées VHC positives (N =7 588) par les 189 laboratoires ayant participé de manière continue pendant huit trimestres
2000-2001[35].
b- Age :
Dans notre série la répartition par âge des patients montre que la tranche d’âge prédominante est représentée par les 51-60ans (40%), suivie par celle des 61-70ans (23%), la tranche d’âge 41-50 représente 17% alors que les classes d’âge 71-80ans et 31-40 ans représentent respectivement 8% et 7%.
La tranche d’âge prédominante notée pour notre série de malades (entre51-60) a été également rapportée dans la série casablancaise (40,09% des cas) [36].
Une étude marocaine a analysé la répartition des cas anti-VHC positifs selon les tranches d’âge, elle a montré que la majorité des patients anti-VHC positifs ont plus de 50 ans avec un maximum entre 70-87 ans [1].
Les estimations de la prévalence par classes d’âge entre les années 1990 et 2000 en USA indiquent une diminution globale des taux de prévalence et un déplacement du pic épidémiologique de 35 ans il y a 10 ans vers 45 ans aujourd’hui [32]. (Figure 11)
Dans notre contexte, la prévalence de cette classe d’âge peut être expliquée par le retard diagnostic et l’absence de dépistage systématique dans la population.
Figure 11: Estimation du taux de prévalence des anticorps anti-VHC en 1988-1994 et 1999-2002 dans la population américaine en fonction de l’âge [32].
2-2 Modes de transmission :
La transmission du VHC est essentiellement parentérale, la contamination résulte de la mise en contact du sang d’une personne infectée par le virus avec celui d’une personne susceptible d’être contaminée de manière directe (transfusion) ou indirecte (matériel d’injection contaminé par exemple) [37].
Dans les pays occidentaux, le risque de transmission du VHC par la transfusion est très faible depuis le milieu des années 1990 [37].
Les transmissions par voie périnatale, sexuelle ou familiale sont relativement peu fréquentes.
Il est à noter que pour 30% des personnes infectées, aucune voie de contamination n’a été identifiée [38].
a- Transmission parentérale :
La contamination parentérale a lieu avec des aiguilles souillées, des instruments mal stérilisés, la toxicomanie intraveineuse, la transfusion sanguine, le tatouage, le piercing, la mésothérapie, l’acupuncture et la scarification.
• Transmission transfusionnelle :
Dans les pays industrialisés, de nombreuses mesures ont été prises au cours des dernières années pour réduire le risque de transmission de ce virus par la transfusion.
En France, le dépistage systématique des dons du sang a été instauré en 1990 [37] et le dépistage génomique viral a été généralisé en 2001 [39].
Une étude française à propos de l’évolution du risque de transmission d’infections virales par transfusion entre 1992 et 2002 a montré qu’en 2003, avec le dépistage génomique viral, le risque d’hépatite post-transfusionnelle du VHC est estimé à 1 pour 6 650 000 dons [39]. (Figure 12)
Au Maroc, le dépistage des anticorps anti-VHC chez les donneurs de sang est devenu systématique depuis 1994 [40].
Cependant, la qualité et la sécurité du sang restent des préoccupations majeures globales, en particulier dans les pays en développement [41].
Dans notre série, 13% de malades avaient un antécédent de transfusion sanguine.
Figure 12: Évolution du risque résiduel estimé de transmission du VHC par transfusion en France entre 199 2 et 2002 [39].


![Figure 7 : Le génome et les protéines du VHC [16].](https://thumb-eu.123doks.com/thumbv2/123doknet/1965879.385/58.892.120.797.546.1005/figure-genome-proteines-vhc.webp)
![Figure 8 : La microscopie électronique de virions VHC purifiés dans une culture de cellule [21]](https://thumb-eu.123doks.com/thumbv2/123doknet/1965879.385/59.892.260.663.120.791/figure-microscopie-electronique-virions-vhc-purifies-culture-cellule.webp)