T
T
H
H
È
È
S
S
E
E
En vue de l'obtention du
D
D
O
O
C
C
T
T
O
O
R
R
A
A
T
T
D
D
E
E
L
L
’
’
U
U
N
N
I
I
V
V
E
E
R
R
S
S
I
I
T
T
É
É
D
D
E
E
T
T
O
O
U
U
L
L
O
O
U
U
S
S
E
E
Délivré par l'Université Toulouse III - Paul Sabatier
Discipline ou spécialité : Biologie moléculaire, cellulaire et du Développement
Présentée et soutenue par
Rami Makki
Le
11 Décembre 2008
Titre :
Hématopoïèse et réponse immunitaire cellulaire chez
Drosophila melanogaster
JURYProfesseur David Cribbs, Président Dr. Bruno Lemaitre, rapporteur Dr. Stéphane Noselli, rapporteur
Dr. Isabelle Godin, rapporteur Dr. Marie Meister, examinatrice Dr. Michèle Crozatier, directrice de thèse
Ecole doctorale : Biologie Santé Biotechnologie
Unité de recherche : Centre de Biologie du Développement, CNRS UMR5547 Directeur de Thèse : Dr. Michèle Crozatier
T
T
H
H
È
È
S
S
E
E
En vue de l'obtention du
D
D
O
O
C
C
T
T
O
O
R
R
A
A
T
T
D
D
E
E
L
L
’
’
U
U
N
N
I
I
V
V
E
E
R
R
S
S
I
I
T
T
É
É
D
D
E
E
T
T
O
O
U
U
L
L
O
O
U
U
S
S
E
E
Délivré par l'Université Toulouse III - Paul Sabatier
Discipline ou spécialité : Biologie moléculaire, cellulaire et du Développement
Présentée et soutenue par
Rami Makki
Le
11 Décembre 2008
Titre :
Hématopoïèse et réponse immunitaire cellulaire chez
Drosophila melanogaster
JURYProfesseur David Cribbs, Président Dr. Bruno Lemaitre, rapporteur Dr. Stéphane Noselli, rapporteur
Dr. Isabelle Godin, rapporteur Dr. Marie Meister, examinatrice Dr. Michèle Crozatier, directrice de thèse
Ecole doctorale : Biologie Santé Biotechnologie
Unité de recherche : Centre de Biologie du Développement, CNRS UMR5547 Directeur de Thèse : Dr. Michèle Crozatier
Remerciements
Je tiens à remercier Alain Vincent pour m’avoir accueilli au CBD et dans son équipe, dans laquelle j’ai trouvé les meilleures conditions de travail qu’on puisse espérer.
Mes plus sincères remerciements à Mr Bruno Lemaitre, Mr Stéphane Noselli, Mme Isabelle Godin et Mr David Cribbs pour le temps qu’ils ont pris pour juger mon travail.
Il n’y a pas de mot assez fort pour exprimer l’ampleur de ma gratitude à ma directrice de thèse, Michèle Crozatier. Je te remercie pour tout ce que tu m’as appris, pour ta patience, ton soutient, pour ta gentillesse sans faille, et pour tes tiramisus. En espérant y regoûter bientôt.
Merci à Marie Meister, dont la collaboration fut essentielle et enrichissante pour ce travail.
Merci à Joanna Krzemień avec qui nous avons fait nos thèses côte à côte. De collègues nous sommes rapidement devenus amis et tu es de ces amis que l’on souhaiterait garder prêt de soi toujours. Merci pour ces longues discussions, pour ces bons moments, pour m’avoir fait découvrir Cracovie.
Merci aux « musclés », Laurence et Jonathan. Laurence pour ce que tu m’as appris et ton amitié. A bientôt pour d’autres soirées jeu. Jon, et bien après une rencontre ratée à Paris, je suis heureux d’avoir eu une seconde chance car il y a des rencontres qu'on n'oublie pas.
Un grand merci à Bruno pour son regard critique sur mon travail, Delphine, heureux d’avoir pu lymph glander avec toi, Virginie pour ton aide inestimable et pour m’avoir appris a travailler proprement. Merci aux nouveaux : Hadi et Justine, puissiez vous apprécier cette équipe autant que moi.
Un merci particulier à ma « tutrice » Muriel. Pour m’avoir toujours fait voir le bon cote des choses, pour ton éternelle bonne humeur, pour tes sourires et tout le temps que tu m’as accordé.
J’aimerai remercier les étudiants du CBD pour avoir créé cette atmosphère familiale dans laquelle j’ai travaille ces cinq années de DEA et de thèse. Merci Gaëlle et a notre prochaine danse. Merci Nico, je me suis senti comme chez moi grâce à toi. Merci Alex pour ces bons moments. Merci Mohamad, Isabelle, Helene, Dani, Aurélie, Aïcha, Flo, Maeva, Chantale…
Merci à toi Julie, mieux que les antidépresseurs, plus agréable et sans effets secondaires, un café avec toi devrait être remboursé par la Sécu. Merci Cédric. Merci Mai, à bientôt j’espère en Australie.
Emilie, pour une fois, les mots me manquent. Merci, merci mille fois.
Merci à ma promo de DEA qui a fait que cette année fut une bonne année. Aux étudiants d’Alpha-T avec lesquels j’ai tant partage.
Merci a Brice et Aurélie pour le temps passe à m’apprendre à me servir d’un microscope, du confocal au champ large. Grace à vous je vois le coté artistique de nos images.
Merci Bruno alias Bigbrother. Promis la prochaine fois je vérifierai que l’ordi est branché. Merci aux Drôles de Dames du secrétariat toujours là pour moi
Merci aux préparateurs du milieu a mouches. Merci à Daniel, pour tout.
Merci aux organisateurs du festival Enormes et un grand merci aux Baleines pour tout ces souvenirs.
Un grand merci pour tous les membres du CBD qui m’ont fait profiter de leur savoirs et savoirs faires et n’ont pas hésité à me donner de leur temps.
Je remercie mes parents pour leur soutien. Merci frérot pour avoir toujours été la.
Résumé
La Drosophile, comme tous les métazoaires, possède un système immunitaire inné, l’immunité adaptative étant spécifique aux vertébrés. Depuis environ une dizaine d’année la Drosophile est utilisée comme un excellent modèle pour aborder l’étude de la réponse immunitaire innée. Deux types de réponse immunitaire sont mis en jeux à la suite d’une infection. a) Une réponse humorale qui consiste en la sécrétion de peptides antimicrobiens dans l’hémolymphe. b) Une réponse cellulaire qui fait appel à des cellules spécialisées appelés hémocytes. Trois types d’hémocytes ont été caractérisés : les plasmatocytes qui sont responsables de la phagocytose, les cellules à cristaux responsables de la mélanisation et les lamellocytes responsables de l’encapsulation de parasites trop gros pour être phagocytés. Les hémocytes sont formés au cours d’un processus appelé hématopoïèse. Comme chez les vertébrés il existe deux vagues d’hématopoïèse chez la Drosophile, une vague embryonnaire et une vague larvaire. Les mécanismes moléculaires contrôlant l’hématopoïèse embryonnaire sont bien décrits dans la littérature, alors que ceux contrôlant l’hématopoïèse larvaire sont peu connus.
Au cours de ma thèse, je me suis intéressé aux mécanismes régulant l’hématopoïèse larvaire. L’hématopoïèse larvaire a lieu dans un organe spécialisé appelé la glande lymphatique composée de deux lobes antérieurs et d’une série de lobes postérieurs dont le nombre peut varier. Les lobes antérieurs sont composés de trois zones distinctes : la Zone Médullaire (ZM) qui contient les précurseurs hémocytaires appelés prohémocytes, la Zone Corticale (ZC) qui contient les hémocytes différenciés et un groupe de cellules situées postérieurement dans les lobes antérieurs appelé Posterior Signalling Centre (PSC) qui est un centre signalisateur qui ne participe pas au lignage hémocytaire. Les plasmatocytes et les cellules à cristaux sont formés dans la glande lymphatique qui éclate au début de la métamorphose et relâche les hémocytes dans l’hémolymphe. Les lamellocytes ne se différencient pas dans des larves saines mais uniquement en réponse à un challenge immun tel qu’une infection par un parasitoïde. Un parasitoïde naturel de la Drosophile est la guêpe, Leptopilina boulardi, qui pond ses œufs dans les larves de Drosophile. Suite à cette infection, toutes les cellules de la glande lymphatique vont se différencier prématurément et majoritairement en lamellocytes. La glande lymphatique éclate prématurément et relâche les lamellocytes dans l’hémolymphe. Les lamellocytes vont s’agglutiner autour de l’œuf de guêpe pour former une capsule et neutraliser son développement.
Dans des mutants gain de fonction de certains composants des voies de signalisations JAT/STAT et Toll/NFκB on observe la formation de lamellocytes en absence d’infection par un parasitoïde. Ces résultats suggèrent que ces deux voies de signalisation sont impliquées dans l’hématopoïèse larvaire. Cependant les cascades moléculaires qui les mettent en jeu restent à ce jour non établies. Au cours de ma thèse je me suis plus particulièrement intéressé à l’étude du rôle de ses deux voies de signalisation dans le contrôle de l’hématopoïèse larvaire.
Dans un premier temps, en collaboration avec Joanna Krzemień, nous avons montré que : i) la voie de signalisation JAK/STAT est activée et nécessaire dans la ZM pour maintenir l’état prohémocyte de ces cellules. ii) le PSC est nécessaire pour maintenir la voie de signalisation JAK/STAT activée dans la ZM. iii) suite à une infection par des guêpes la voie de signalisation JAK/STAT est inactivée dans les prohémocytes qui se différencient massivement en lamellocytes. Ces résultats indiquent que le PSC joue le rôle d’une « niche » pour les précurseurs hématopoïétiques dans la glande lymphatique. Une « niche » est un microenvironnement qui contrôle la prolifération et la différenciation des cellules souches.
Cette étude a permis d’établir que la glande lymphatique est un système modèle de choix pour définir in vivo, à la fois d’un point de vue cellulaire et moléculaire, ce qu’est une niche (Krzemień et al., 2007).
Dans un deuxième temps, je me suis intéressé à la régulation de la voie de signalisation JAK/STAT. Cette voie de signalisation est médiée par les récepteurs des cytokines de classe I. Chez la Drosophile, Domeless (Dome) est le seul récepteur connu de la voie de signalisation JAK/STAT et il est exprimé dans les prohémocytes de la ZM dans la glande lymphatique. La séquence du génome de la Drosophile a permis d’identifier un autre gène que nous appelons latran, qui code pour une protéine qui possède une forte homologie de séquence avec domeless. Cependant, latran code pour une protéine transmembranaire tronquée suggérant qu’il pourrait agir comme un récepteur ne pouvant pas signaler. L’analyse du rôle de latran m’a permis de montrer qu’il antagonise la voie de signalisation JAK/STAT uniquement après infection par une guêpe, en formant des hétéromères inactifs avec Dome. Le contrôle spécifique de la voie de signalisation JAK/STAT par Latran lors de la réponse immunitaire cellulaire chez la Drosophile pose la question de savoir si ce mode de régulation nécessitant des récepteurs courts inactifs pourrait également être utilisé chez les vertébrés. En effet, certains aspects de la réponse immunitaire, telle que l’inflammation, nécessitent un contrôle strict et rapide de la voie de signalisation JAK/STAT (Makki et al., manuscrit)
Enfin, je me suis intéressé au rôle de toll4 qui code pour un des récepteurs Toll de la Drosophile. toll4 est spécifiquement exprimé dans le PSC suggérant qu’il pourrait jouer un rôle dans l’hématopoïèse larvaire. Pour tester cette hypothèse j’ai construit un mutant nul pour toll4 par recombinaison homologue. Le mutant toll4 ne présente aucun défaut ni morphologique, ni dans la réponse immunitaire. Ces résultats suggèrent que différents récepteurs Toll pourraient être impliqués de façon redondante dans l’hématopoïèse larvaire. Des analyses complémentaires visant à définir le rôle de la voie de signalisation Toll/NFκB dans l’immunité cellulaire chez la Drosophile sont donc nécessaires.
SOMMAIRE
INTRODUCTION ... 11
Le système immunitaire de la Drosophile ... 13
La réponse humorale... 15
Les hémocytes de Drosophila melanogaster et la réponse immunitaire cellulaire... 17
Les plasmatocytes... 17
Les cellules à cristaux... 19
Les lamellocytes ... 20
L’hématopoïèse chez la Drosophile... 23
Description... 23
L’hématopoïèse embryonnaire ... 25
Description... 25
Contrôles moléculaires ... 27
Hématopoïèse larvaire... 29
Ontogenèse de la glande lymphatique ... 29
Vous avez dit hémangioblaste ? ... 33
Zones Médullaire et Corticale : les hémocytes de la glande lymphatique ... 33
Cas particulier des lamellocytes et de la réponse au parasitisme ... 35
Collier ... 37
Le PSC et le contrôle de l’hématopoïèse larvaire... 37
Différenciation des lamellocytes et voies de signalisation. ... 39
La voie de signalisation JAK/STAT... 41
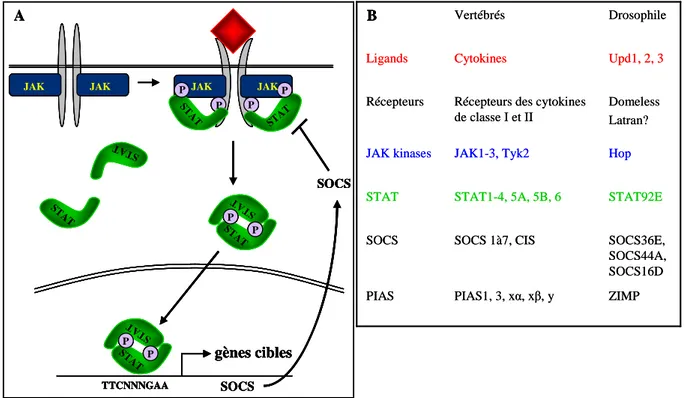
Description et régulation... 41
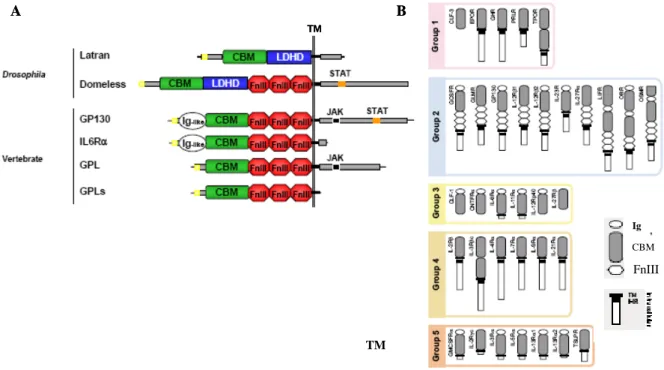
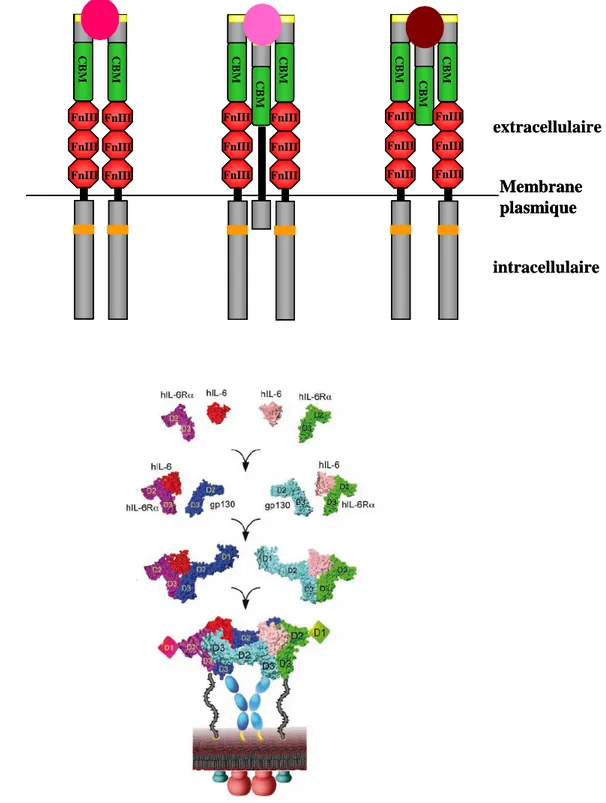
La famille des récepteurs des cytokines de classe I ... 45
Rôles de la voie de signalisation JAK/STAT ... 48
Les TLRs et la voie de signalisation Toll/NFκB... 51
Description... 51
Les TLRs chez la Drosophile ... 53
Rôles dans le développement... 53
Rôles dans la réponse immunitaire ... 55
Les TLRs chez les vertébrés... 55
La voie de signalisation Toll/NFκB et la réponse immunitaire cellulaire chez la Drosophile ... 56
Matériels et Méthodes ... 59
RESULTATS ... 65
Première partie : Rôle du PSC dans le contrôle de l’hématopoïèse larvaire ... 67
Introduction... 67
Résultats... 67
Le PSC est nécessaire pour maintenir un groupe de prohémocytes dans la glande lymphatique... 67
L’activation de la voie de signalisation JAK/STAT dans la Zone Médullaire est nécessaire pour maintenir les prohémocytes dans la glande lymphatique. ... 68
Les prohémocytes se différencient prématurément en lamellocytes suite à une infection par un parasitoïde ... 69
Article : Control of blood cell homeostasis in Drosophila larvae by the
Posterior Signalling Centre... 73
Deuxième partie : Rôle clef de latran dans le contrôle de la voie de signalisation JAK/STAT lors de la réponse immunitaire cellulaire... 79
Introduction... 79
Résultats... 79
latran est spécifiquement exprimé dans les prohémocytes de la glande lymphatique. ... 79
Les mutants latran sont immunodéficients... 80
Latran agit comme un dominant négatif de la voie de signalisation JAK/STAT ... 80
Latran forme des hétéromères avec Dome ... 81
L’infection par le parasitoïde Leptopilina boulardi modifie le rapport latran/domeless ... 81
latran est un interrupteur qui permet une réponse coordonnée de l’ensemble des prohémocytes... 81
upd3 est nécessaire pour l’activation de la voie de signalisation JAK/STAT dans la Zone Médullaire ... 82
Modèle proposé pour le contrôle de l’hématopoïèse larvaire... 82
Résultats supplémentaires... 83
Latran ne bloque pas l’endocytose du complexe Dome/Upd ... 83
Fonction non cellulaire autonome de latran... 85
Discussion ... 85
Manuscrit: A short receptor down-regulates JAK/STAT signalling to control the Drosophila cellular immune response. ... 91
Troisième Partie : La voie de signalisation Toll/NFkB : Caractérisation du récepteur Toll4... 123
Introduction... 123
Résultats... 123
Nouvelle annotation de la région génomique de toll4 ... 123
toll4 est spécifiquement exprimé dans le PSC... 125
Les mutants toll4 sont viables et ne présentent pas de défaut hématopoïétique. ... 125
Les mutants toll4 sont capables de produire des lamellocytes après infection par un parasitoïde... 127
Discussion ... 129
CONCLUSIONS GENERALES... 131
Liste des abréviations
Antp : Antennapedia ARE : AU Rich Element AUBP : AU Binding Protein BCL6 : B-cell lymphoma 6 CBM : Cytokine Binding Motif Ci : Cubitus interruptus
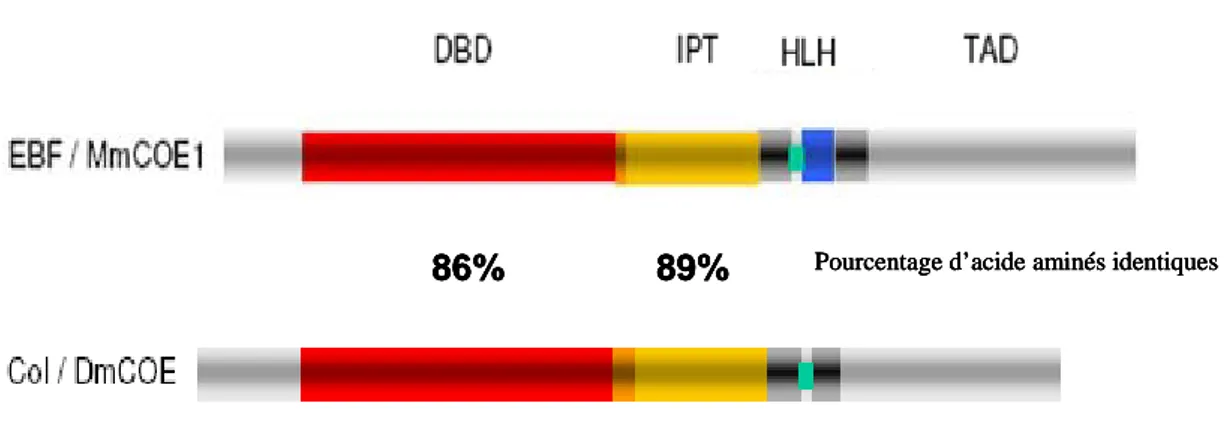
COE : Collier/Olfactory-1/EBF Col : Collier
CRM :Cis Regulatory Module CSF : Colony Stimulating Factor
CSH : Cellules Souches Hématopoïétiques Dome : Domeless
Dscam : Down syndrom cell adhesion molecule dsRNA : double strand Ribonucleic Acids EBF : Early B-cell Factor
FOG : Friend Of GATA Gcm : Glial cells missing
GNBP : Gram Negatif Binding Protein GPL : GP130 Like Receptor
Hh : Hedgehog
HLH : Helix Loop Helix Hop : Hopscotch
HS : Heat Shock IL : Interleukin
Imd : Immunedeficiency INF : Interferon
INFRα :Interferon Receptor α IκB : Inhibitor of NFκB JAK : Janus Kinase KEN : Ken and Barbie
LDHD : Latran Domeless Homologous Domain LRR : Leucine Rich Repeat
N : Notch
NFκB : Nuclear Factor kappa-light-chain-enhancer of activated B cells PCR : Polymerase Chain Reaction
PDGF : Platelet Derived Growth Factor PGRP : Peptidoglycan Recognition Protein PI3K : Phosphatidyl inositol 3 kinase PIAS :Protein Inhibitors of Activated STAT PO : phenoloxydase
proPO : prophenoloxydase
PRP : Pattern Recognition Protein PSC : Posterior Signalling Centre PVR : PDGF and VEGF Receptor S2NP : S2 cells Norbert Perrimon
Ser : Serrate
SOCS : Suppressors Of Cytokines Signalling Srp : Serpent
STAT : Signal Transducer and Activator of Transcription TIR : Toll Interleukin-1 Receptor
TLR : Toll Like Receptor TNF : Tumor Necrosis Factor Upd : Unpaired
VEGF : Vascular Endothelial Growth Factor VLP : Virus Like Protein
ZC : Zone Corticale ZM : Zone Médullaire
Le système immunitaire de la Drosophile
Le système immunitaire permet à un organisme de discriminer le « soi » du « non soi » (ou du « soi altéré ») afin de se défendre contre des agressions telles que des infections virales, bactériennes, par des champignons ou des parasites ou la présence de cellules cancéreuses. Il existe deux types d’immunité : l’immunité innée et l’immunité acquise. L’immunité acquise est spécifique des vertébrés.
L’immunité innée consiste en des barrières physiques telles que la peau et les muqueuses et des mécanismes biologiques non spécifiques, comme la phagocytose, capables d’éliminer les agents infectieux. L’immunité acquise est basée sur le remaniement génique dans les cellules somatiques. C’est une immunité spécifique, secondaire, clonale, faisant appel à des cellules spécialisées : les lymphocytes.
Les cascades moléculaires impliquées dans l’immunité innée étant phylogénétiquement conservées, la Drosophile, qui est un organisme modèle grâce aux techniques de génétique et de transgénèse est un modèle de choix pour l’étude de ces mécanismes.
La Drosophile possède des barrières physiques telles que les épithélia du tube digestif et des trachées. Ces épithélia produisent localement des peptides antimicrobiens et des radicaux libres, sécrètent des lysozymes créant un environnement hostile pour les agents infectieux avec lesquels ils sont continuellement en contact.
Pour les pathogènes qui ont réussi à passer les défenses épithéliales deux types de réponses immunitaires peuvent être mises en jeu : a) Une réponse humorale qui consiste en la sécrétion de peptides antimicrobiens dans l’hémolymphe par le corps gras (un organe qui remplit certaines fonctions équivalentes du foie des mammifères) et les hémocytes (cellules « sanguines ») circulants. b) Une réponse cellulaire qui met en jeu trois processus : la phagocytose, la mélanisation, et l’encapsulation (les deux derniers étant spécifiques des Arthropodes). Cette réponse fait appel à des cellules spécialisées appelés hémocytes.
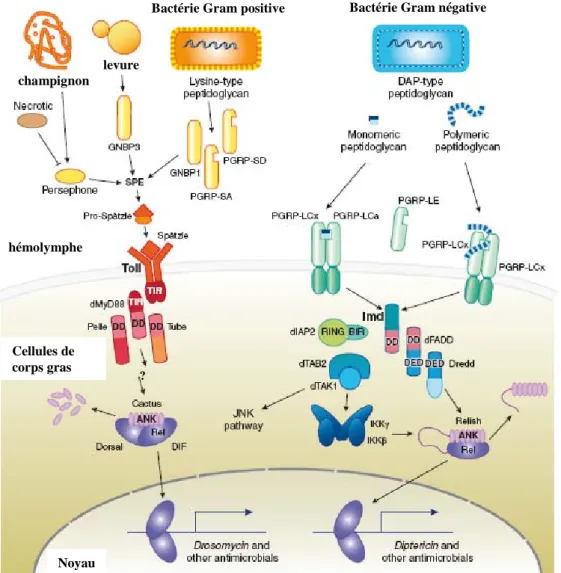
Figure 1. La réponse humorale chez la Drosophile
Deux voies de signalisation sont impliquées dans la synthèse de peptides antimicrobiens lors de la réponse humorale. La voie de signalisation Toll/NFκB activée par une infection par des bactérie Gram positives ou des champignons, et la voie Imd activée par une infection par des bactérie Gram négatives.
Les bactéries à Gram positif et les champignons sont reconnus par des molécules de reconnaissances secrétées (PGRP-SA, PGRP-SD, GNBP1, 3) qui vont activer des Sérine Protéase qui vont cliver Spätzle. Spätzle clivé va se lier à Toll qui est à la surface des cellules du corps gras. Toll recrute la protéine intracellulaire MyD88 qui possède un domaine TIR, pouvant interagir avec celui de Toll, et un domaine de mort (Death Domain: DD). Deux autres protéine à domaine de mort sont recrutées: Tube et la kinase Pelle. Par un mécanisme encore inconnu Cactus est clivé ce qui libère les facteurs de transcription Dorsal et Dif qui vont activer la transcription de gènes codant pour des peptides antimicrobiens.
Les bactéries à Gram négatif sont reconnues par des protéines solubles ou ancrées à la membrane des cellules du corps gras (PGRP-LC, PGRP-LE) qui vont recruter Imd. Imd interagit avec dFADD qui à son tour se lie avec la caspase Dredd qui s’associe avec Relish et le clivera une fois que Relish sera phosphotylé. Relish est le troisième facteur de transcription à domaine Rel de la Drosophile mais qui contrairement à Dorsal et Dif n’est pas séquestré par Cactus mais possède lui-même un domaine inhibiteur avec des motifs ankirines. Relish est phosphorylé par le complexe IKK. Comment IKK est activé et comment cette activation est liée à Imd restent des questions ouvertes. Cependant, il est proposé que IKK est activé par TAB2 et TAK1 qui est probablement activé par DIAP2. Une fois clivé Relish entre dans le noyau est active la transcription de gènes codant pour des peptides antimicrobiens. (d’après Lemaitre et Hoffmann, 2006)
Cellules de corps gras
Bactérie Gram positive Bactérie Gram négative
hémolymphe
levure champignon
Noyau
?
Figure 1. La réponse humorale chez la Drosophile
Deux voies de signalisation sont impliquées dans la synthèse de peptides antimicrobiens lors de la réponse humorale. La voie de signalisation Toll/NFκB activée par une infection par des bactérie Gram positives ou des champignons, et la voie Imd activée par une infection par des bactérie Gram négatives.
Les bactéries à Gram positif et les champignons sont reconnus par des molécules de reconnaissances secrétées (PGRP-SA, PGRP-SD, GNBP1, 3) qui vont activer des Sérine Protéase qui vont cliver Spätzle. Spätzle clivé va se lier à Toll qui est à la surface des cellules du corps gras. Toll recrute la protéine intracellulaire MyD88 qui possède un domaine TIR, pouvant interagir avec celui de Toll, et un domaine de mort (Death Domain: DD). Deux autres protéine à domaine de mort sont recrutées: Tube et la kinase Pelle. Par un mécanisme encore inconnu Cactus est clivé ce qui libère les facteurs de transcription Dorsal et Dif qui vont activer la transcription de gènes codant pour des peptides antimicrobiens.
Les bactéries à Gram négatif sont reconnues par des protéines solubles ou ancrées à la membrane des cellules du corps gras (PGRP-LC, PGRP-LE) qui vont recruter Imd. Imd interagit avec dFADD qui à son tour se lie avec la caspase Dredd qui s’associe avec Relish et le clivera une fois que Relish sera phosphotylé. Relish est le troisième facteur de transcription à domaine Rel de la Drosophile mais qui contrairement à Dorsal et Dif n’est pas séquestré par Cactus mais possède lui-même un domaine inhibiteur avec des motifs ankirines. Relish est phosphorylé par le complexe IKK. Comment IKK est activé et comment cette activation est liée à Imd restent des questions ouvertes. Cependant, il est proposé que IKK est activé par TAB2 et TAK1 qui est probablement activé par DIAP2. Une fois clivé Relish entre dans le noyau est active la transcription de gènes codant pour des peptides antimicrobiens. (d’après Lemaitre et Hoffmann, 2006)
Cellules de corps gras
Bactérie Gram positive Bactérie Gram négative
hémolymphe levure champignon Noyau ? Cellules de corps gras
Bactérie Gram positive Bactérie Gram négative
hémolymphe
levure champignon
Noyau
La réponse humorale
Suite à une infection, les cellules du corps gras et les hémocytes vont synthétiser et libérer dans l’hémolymphe des peptides antimicrobiens dont sept familles ont été caractérisées chez la Drosophile. Ces peptides peuvent êtres classés en trois groupes selon leur spectre d’action. Les Défensines sont actives contre les bactéries à Gram positif, alors que les peptides Diptéricine, Attacine, Cécropine et Drosocine sont principalement actifs contre les bactéries à Gram négatif et la Drosomycine et la Metchnikowine sont des peptides antifongiques. Ces peptides antimicrobiens agissent en synergie pour bloquer la croissance des pathogènes en lysant leur membrane. Selon le microorganisme impliqué dans l’infection, les peptides antimicrobiens seront différents et adaptés à l’infection. Ceci indique que la Drosophile possède un système de reconnaissance des pathogènes qui peut faire la différence entre les différents types de microorganismes. Les mécanismes de reconnaissance des pathogènes chez la Drosophile reposent sur des protéines reconnaissant des motifs spécifiques des microorganismes appelées les Pattern Recognition Proteins (PRP). Il existe deux familles de PRP, les Peptidoglycan Recognition Proteins (PGRP) et les Gram Negative Binding Proteins (GNBP). Ces PRP sont soit solubles dans l’hémolymphe soit ancrés à la membrane des cellules du corps gras ou des hémocytes. Ils reconnaissent de manière spécifique certains types de microorganismes (Gram positifs, négatifs ou champignon) et induisent en retour la production des peptides antimicrobiens adaptés à l’infection. La réponse humorale est médiée par deux voies de signalisation de type NFκB, les voies Toll et Imd (Figure 1). La voie de signalisation Toll/NFκB est activée en réponse soit à une infection fongique soit par des bactéries à Gram positif, alors que la voie Imd est activée par des bactéries à Gram négatif. La voie de signalisation Toll est relayée par les facteurs de transcription à domaine Rel appelés Dorsal et Dif, tandis que la voie de signalisation Imd est relayée par le facteur de transcription, lui aussi à domaine Rel appelé Relish (pour revue voir(Lemaitre and Hoffmann, 2007)).
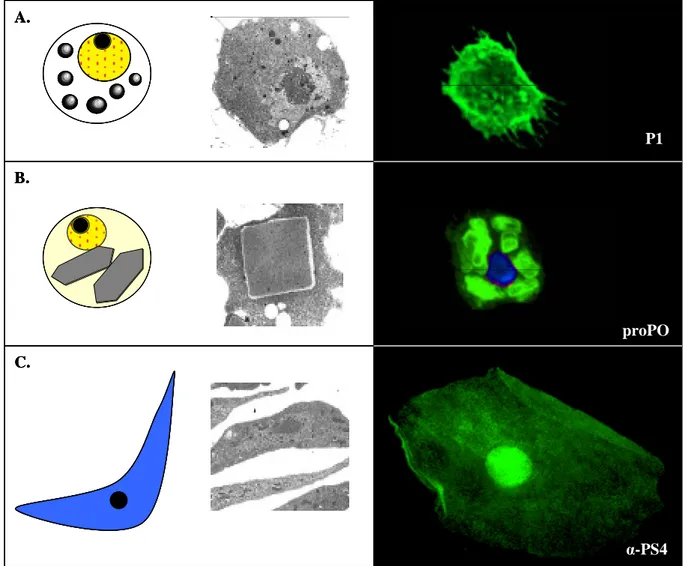
Figure 2. Les hémocytes de Drosophila melanogaster
A. Les plasmatocytes. Cellules de 8 à 10µm de diamètre. Ce sont les phagocytes professionnels de la Drosophile. B. les cellules à cristaux, cellules de 10 à 12µm de diamètre avec des inclusions cristallines de prophénoloxydase. C. les lamellocytes font environ 15 sur 40µm. Ce type cellulaire n’est produit que dans des larves en réponse à un stress immun tel qu’une infection par un parasitoïde. Ils ont pour fonction de former des capsules autour de parasites trop gros pour être phagocytés tel que l’œuf d’une guêpe parasitoïde.
Images en microscopie électronique à transmission Meister et Lagueux, 2003
Images confocales de Joanna Krzemień avec les anticorps P1 (plasmatocytes), proPO (cellules à cristaux) et α-PS4 (lamellocytes). A. B. C. P1 proPO α-PS4
Figure 2. Les hémocytes de Drosophila melanogaster
A. Les plasmatocytes. Cellules de 8 à 10µm de diamètre. Ce sont les phagocytes professionnels de la Drosophile. B. les cellules à cristaux, cellules de 10 à 12µm de diamètre avec des inclusions cristallines de prophénoloxydase. C. les lamellocytes font environ 15 sur 40µm. Ce type cellulaire n’est produit que dans des larves en réponse à un stress immun tel qu’une infection par un parasitoïde. Ils ont pour fonction de former des capsules autour de parasites trop gros pour être phagocytés tel que l’œuf d’une guêpe parasitoïde.
Images en microscopie électronique à transmission Meister et Lagueux, 2003
Images confocales de Joanna Krzemień avec les anticorps P1 (plasmatocytes), proPO (cellules à cristaux) et α-PS4 (lamellocytes). A. B. C. A. B. C. P1 proPO α-PS4
Les hémocytes de Drosophila melanogaster et la réponse immunitaire
cellulaire
Les hémocytes sont les « cellules sanguines » de la Drosophile. Trois types d’hémocytes ont été décrits chez la Drosophile, en se basant sur leurs structures et leurs fonctions (Figure 2). Ils sont impliqués dans la réponse immunitaire cellulaire et jouent également un rôle clef au cours du développement. Il n’existe pas de cellules « sanguines » impliquées dans le transport d’oxygène chez la Drosophile qui possède un système trachéal qui assure l’oxygénation de ses tissus.
Les plasmatocytes
Les plasmatocytes sont le type hémocytaire majoritaire (95% de la population d’hémocytes circulants)(Lanot, Zachary et al. 2001). Ce sont des cellules rondes de 8 à 10 µm de diamètre (Figure 2). Les plasmatocytes sont les phagocytes professionnels de la Drosophile. Ce sont les seules cellules responsables de la phagocytose des microorganismes et des corps apoptotiques (Wood and Jacinto, 2007). Ils sont les seuls à exprimer des récepteurs tels que Eater impliqué dans la phagocytose des microorganismes (Kocks et al., 2005), ou tels que Croquemort (qui appartient à la famille des récepteurs CD36 des vertébrés) impliqué dans la reconnaissance des corps apoptotiques (Franc et al., 1996). L’activité de phagocytose des corps apoptotiques fait des plasmatocytes des acteurs importants du développement comme, par exemple pour le remodelage de certains tissus comme le système nerveux central au cours de l’embryogenèse. Les plasmatocytes sont également impliqués dans la synthèse de la matrice extracellulaire qui recouvre toutes les surfaces cellulaires en contact avec l’hémolymphe (Fessler et al., 1994). Ils sécrètent notamment plusieurs protéines structurales de la matrice extracellulaire comme la Tiggrine (Fogerty et al., 1994), la Peroxydasine (Nelson et al., 1994), la Papiline (Kramerova et al., 2003) et deux molécules de type Collagène IV, Viking et Cg25C (Freeman et al., 2003 ; Paladi et Tepass, 2004). Cette activité de synthèse de matrice extracellulaire est également essentielle au cours du développement car elle participe au remodelage de certains tissus. Ainsi, la chaine nerveuse ventrale subit une phase de condensation, c'est-à-dire qu’elle diminue de taille mais augmente sa densité cellulaire. Ce processus est dépendant du dépôt de matrice extracellulaire par les plasmatocytes.
Figure. 3. Cycle de vie de Drosophila melanogaster et Leptopilina boulardi. Encapsulation d’un parasitoïde.
A. Une femelle parasitoïde pond un œuf dans une larve (au deuxième stade larvaire) de Drosophile. La larve peut répondre à l’infection en produisant des lamellocytes qui vont neutraliser l’œuf de la guêpe et permettre l’éclosion d’une mouche adulte (flèches bleues). Si l’œuf de guêpe n’est pas neutralisé il va se développer au détriment de l’hôte et donner naissance à une guêpe adulte (flèches rouges).
B. Oeuf de guêpe encapsulé dans une larve de Drosophile. La capsule est mélanisée d’où sa couleur noir (flèche blanche). C. Œuf de guêpe en cours d’encapsulation par des lamellocytes. Les lamellocytes forment une capsule constituée de plusieurs couches cellulaires (Carton et al. 2005).
B
C
A
Figure. 3. Cycle de vie de Drosophila melanogaster et Leptopilina boulardi. Encapsulation d’un parasitoïde.
A. Une femelle parasitoïde pond un œuf dans une larve (au deuxième stade larvaire) de Drosophile. La larve peut répondre à l’infection en produisant des lamellocytes qui vont neutraliser l’œuf de la guêpe et permettre l’éclosion d’une mouche adulte (flèches bleues). Si l’œuf de guêpe n’est pas neutralisé il va se développer au détriment de l’hôte et donner naissance à une guêpe adulte (flèches rouges).
B. Oeuf de guêpe encapsulé dans une larve de Drosophile. La capsule est mélanisée d’où sa couleur noir (flèche blanche). C. Œuf de guêpe en cours d’encapsulation par des lamellocytes. Les lamellocytes forment une capsule constituée de plusieurs couches cellulaires (Carton et al. 2005).
B
C
A
B
C
A
A
Les plasmatocytes sont également des senseurs de l’intégrité des tissus. En effet, ils peuvent répondre à des signaux les attirant vers les épithéliums endommagés, soit par une blessure soit par la présence de tumeurs, selon des mécanismes ressemblant à ceux impliqués dans l’inflammation chez les vertébrés (Babcock et al., 2008)
De façon très intéressante, les plasmatocytes pourraient également contribuer à une protection spécifique contre des pathogènes ressemblant à une « mémoire immune ». Des mouches infectées par des doses sub-létales de Streptococcus pneumoniae ou Beauveria bassiana, sont par la suite protégées contre toute autre infection secondaire même létale par le même pathogène. Les plasmatocytes sont des acteurs de cette « mémoire immunitaire » (Pham et al., 2007). Les mécanismes par lesquels cette « mémoire » est mise en place sont inconnus.
Down Syndrom cell adhesion (Dscam) est un récepteur à domaine immunoglobuline. Environ 18000 isoformes différentes de ce récepteur peuvent être obtenues par épissage alternatif. Watson et collaborateurs ont montré que les plasmatocytes expriment la plupart des isoformes de Dscam. De plus, la perte du gène dscam dans les plasmatocytes induit une réduction de leur capacité à phagocyter (Watson et al., 2005). Dscam joue donc un rôle dans la phagocytose et la diversité des ses isoformes pourrait apporter une grande diversité de reconnaissance aux plasmatocytes.
Les cellules à cristaux
Les cellules à cristaux sont des cellules de 10 à 12 µm de diamètre (Figure 2). Elles sont présentes dans l’embryon et la larve de Drosophile, alors que les adultes en sont dépourvus. Elles doivent leur nom aux cristaux de prophénoloxydase (proPO) qu’elles renferment en grande quantité dans leur cytoplasme. Elles sont responsables du processus de mélanisation qui est une réaction de défense spécifique des insectes. Les cellules à cristaux libèrent leur contenu dans l’hémolymphe, la proPO est alors clivée en phénoloxydase (PO), sa forme active, qui à son tour catalyse l’oxydation des phénols en quinones qui polymérisent en mélanine formant un dépôt noir (Ashida M., 1997; Meister, 2004; Rizki et al., 1985). Les réactions menant à la mélanisation libèrent des peroxydes et autres produits tels que des radicaux libres toxiques pour les microorganismes participant ainsi à leur destruction. La mélanisation est observée dans différents contextes immunitaires. Lors d’une infection par un parasitoïde (voir le paragraphe sur les lamellocytes) une capsule se forme autour de l’œuf du parasitoïde. Cette capsule est mélanisée. Les cellules à cristaux participent également au
processus de coagulation qui a lieu en plus de la formation de la barrière mélanique lors d’une blessure (Bidla et al., 2005; Scherfer et al., 2004). Ce processus permet de limiter la perte d’hémolymphe et de piéger les microorganismes.
Les lamellocytes
Les lamellocytes sont de grandes cellules plates et adhésives d’environ 15µm sur 40µm qui ne sont produites qu’au stade larvaire (Figure 2). Cependant, ils ne sont pas présents dans des larves saines et ne sont produits que suite à un stress immun particulier tel que la présence, dans la larve, d’un corps étranger trop gros pour être phagocyté par les plasmatocytes (Lanot, Zachary et al. 2001). Un des parasitoïdes naturels (voir définition plus loin) de la Drosophile est la guêpe Leptopilina boulardi, qui pond ses œufs dans les larves. Suite à cette infection, le parasitoïde est d’abord reconnu par les plasmatocytes circulants (Russo et al., 1996) puis, quelques heures plus tard, une grande quantité de lamellocytes est observée en circulation dans l’hémolymphe (Lanot et al., 2001; Sorrentino et al., 2002). Les lamellocytes vont former plusieurs couches cellulaires recouvrant l’œuf du parasitoïde et conduire à la formation d’une capsule. La capsule ainsi formée est mélanisée créant ainsi un environnement cytotoxique qui va probablement conduire à la destruction du corps étranger (Figure 3 et (Nappi et al., 1995; Nappi et al., 2000)).
Il existe environ une cinquantaine d’espèces de parasitoïdes naturels des Drosophiles, tous des hyménoptères appartenant notamment aux genres Leptopilina, Asobara et Ganapsis. Contrairement aux parasites les parasitoïdes tuent leurs hôtes. L’œuf qu’ils pondent va se développer aux dépens de la larve hôte et c’est un parasitoïde adulte qui sort de la pupe à la place de la mouche (Figure 3). Si la larve de Drosophile peut se défendre contre les parasitoïdes grâce à la production de lamellocytes, les parasitoïdes ont développé différentes stratégies pour contrecarrer les défenses de la Drosophile. Par exemple, certaines espèces de parasitoïdes co-injectent avec leurs œufs des particules ressemblant à des particules virales (VLP : Virus Like Particules) qui codent pour des protéines capables d’empêcher l’encapsulation en altérant les capacités d’adhérence des lamellocytes. D’autre part, il existe des espèces de Drosophile (tel que Drosophila pseudoobscura) qui sont incapables de produire des lamellocytes après une infection. On ne sait pas, à ce jour, quelle est la cause de cette immunodéficience ni si ces espèces ont d’autres moyens de défense.
Au cours de ma thèse je me suis particulièrement intéressé à la réponse immunitaire cellulaire et au contrôle de la différenciation des hémocytes. Je vais donc plus particulièrement développer l’étude de l’hématopoïèse, le processus conduisant à la formation des hémocytes. Puis je m’attarderai sur deux voies de signalisation, les voies JAK/STAT et Toll/NFκB, qui sont impliquées dans l’hématopoïèse et la réponse immunitaire.
L’hématopoïèse chez la Drosophile
Description
L’hématopoïèse chez la Drosophile est moins complexe que chez les vertébrés car il n’existe que trois types d’hémocytes : les plasmatocytes, les cellules à cristaux et les lamellocytes, décrits précédemment, qui sont généralement comparés au lignage myéloïde des vertébrés. Chez la Drosophile l’hématopoïèse se déroule en deux phases, une phase embryonnaire et une phase larvaire. L’hématopoïèse embryonnaire démarre dans le mésoderme antérieur et donne naissance à des plasmatocytes et des cellules à cristaux qui vont coloniser l’embryon et se retrouver, dans la larve, en circulation dans l’hémolymphe ou ancrés sur la face interne de l’épiderme. Ces derniers forment les îlots sessiles. Les plasmatocytes produits dans l’embryon sont retrouvés également en circulation dans l’hémolymphe de l’adulte après la métamorphose (Holz et al., 2003). L’hématopoïèse larvaire a lieu dans un organe spécialisé, appelé la glande lymphatique, qui est localisé dorsalement le long du tube cardiaque. La glande lymphatique dans l’embryon et dans la larve, aux deux premiers stades larvaires, contient des précurseurs hémocytaires appelés prohémocytes. Au troisième et dernier stade larvaire les prohémocytes se différencient en plasmatocytes et cellules à cristaux. Au début de la métamorphose, la glande lymphatique va éclater et libérer dans l’hémolymphe les prohémocytes et les hémocytes différenciés. Les hémocytes produits dans la glande lymphatique sont retrouvés par la suite dans l’hémolymphe de l’adulte. Aucun organe hématopoïétique n’a été identifié chez la mouche adulte et les seuls hémocytes différenciés identifiés à ce stade sont des plasmatocytes. On ne sait pas, à ce jour, comment se maintient cette population d’hémocytes chez l’adulte.
prohemocytes
Stade 11
Stade 17
plasmatocytes cellules à cristaux
Stage 5
cellules à cristaux
Figure. 4. L’hématopoïèse embryonnaire de Drosophila melanogaster.
A. Schéma d’un embryon au stade 5, en jaune le territoire du mésoderme. En rouge, la région située à 70-80% de la longueur de l’embryon qui est à l’origine des hémocytes embryonnaires. (d’après Holz et al., 2003) B. Embryon au stade 5. Visualisation du territoire d’apparition des prohémocytes par hybridation in situ contre gcm. C,E. Les plasmatocytes sont marqués par la peroxydasin. C. embryons au stade 11 les plasmatocytes commencent à migrer. E. au stade 17 les plasmatocytes sont dispersés dans tout l’embryon. D,F. Les cellules à cristaux sont marqués doxA3. D. embryons au stade 11 les cellules à cristaux se différencient dans la région antérieure. F. au stade 17 les cellules à cristaux restent localisées au niveau du proventricule. (B à F d’après le manuscrit de thèse de Laëtitia Bataillé)
Dans toutes les images les pôles antérieur (A) et postérieur (P) sont à gauche et à droite respectivement. Le dos (D) est en haut et le ventre (V) en bas.
A
plasmatocytes A D V P prohemocytes Stade 11 Stade 17plasmatocytes cellules à cristaux
Stage 5
cellules à cristaux
Figure. 4. L’hématopoïèse embryonnaire de Drosophila melanogaster.
A. Schéma d’un embryon au stade 5, en jaune le territoire du mésoderme. En rouge, la région située à 70-80% de la longueur de l’embryon qui est à l’origine des hémocytes embryonnaires. (d’après Holz et al., 2003) B. Embryon au stade 5. Visualisation du territoire d’apparition des prohémocytes par hybridation in situ contre gcm. C,E. Les plasmatocytes sont marqués par la peroxydasin. C. embryons au stade 11 les plasmatocytes commencent à migrer. E. au stade 17 les plasmatocytes sont dispersés dans tout l’embryon. D,F. Les cellules à cristaux sont marqués doxA3. D. embryons au stade 11 les cellules à cristaux se différencient dans la région antérieure. F. au stade 17 les cellules à cristaux restent localisées au niveau du proventricule. (B à F d’après le manuscrit de thèse de Laëtitia Bataillé)
Dans toutes les images les pôles antérieur (A) et postérieur (P) sont à gauche et à droite respectivement. Le dos (D) est en haut et le ventre (V) en bas.
A
plasmatocytes A D V P A D V PL’hématopoïèse embryonnaire
Description
La première vague d’hématopoïèse débute très tôt au cours du développement embryonnaire, au stade blastoderme (stade 5), où les précurseurs hématopoïétiques sont spécifiés au sein du mésoderme procéphalique (Figure 4A et (Holz et al., 2003)). Holz et collaborateurs ont montré, par des expériences de transplantation de cellules isolées, que les hémocytes embryonnaires sont spécifiés à partir du mésoderme dans un domaine restreint localisés entre 70 et 80% de la longueur de l’embryon (0% correspondant au pôle postérieur)(Figure 4A,B). Au stade blastoderme, les cellules de ce domaine mésodermique sont, contrairement aux autres cellules du mésoderme, déjà déterminées à devenir des hémocytes (Holz et al., 2003). Lors de la gastrulation les prohémocytes vont à la fois s’invaginer, migrer et se différencier en deux types d’hémocytes : plasmatocytes et cellules à cristaux. Au stade 11, alors que la bandelette germinative est étendue, les prohémocytes migrent et colonisent principalement la région postérieure du proencéphale et les segments gnathaux ainsi que le clypeolabrum. La migration vers le pôle postérieur amène les prohémocytes dans l’extrémité caudal de la bandelette germinative (segment abdominal 9). La rétraction de la bandelette germinative entraîne les hémocytes vers le pôle postérieur. Durant les stades suivant (13 et 14) les hémocytes migrent depuis les extrémités antérieure et postérieure le long de quatre voies différentes (Fig 4 B, C et E) (Tepass et al., 1994)).
i. ventralement entre l’épiderme et la chaîne nerveuse.
ii. entre la face dorsale de la chaîne nerveuse et le mésoderme. iii. le long de l’épiderme dorsal.
iv. le long du tube digestif.
A la fin du stade 14, tout l’embryon est colonisé par les hémocytes. Les plasmatocytes représentent 95% de la population hémocytaire embryonnaire, soit environ 700 cellules et les cellules à cristaux forment les 5% restant de la population hémocytaire, correspondant à environ 30 cellules (Figure 4D,F et (Tepass et al., 1994)). Seuls les plasmatocytes vont coloniser l’embryon alors que les cellules à cristaux migrent peu et forment deux groupes de cellules localisés au niveau du proventricule (Figure 4 B,D,F et(Lebestky et al., 2000)).
A B
Figure 5. Contrôle moléculaire de l’hématopoïèse embryonnaire.
A. srp est exprimé dans les prohémocytes et son expression est maintenue dans les hémocytes différenciés. gcm est nécessaire à la différenciation des plasmatocytes. lz est nécessaire à la différenciation de cellules à cristaux. Ush antagonise la différenciation des cellules à cristeaux.
B. Dans des embryons au stade 5 tous les prohémocytes expriment gcm. Au stade 7 la premières rangée de cellules va réprimer l’expression de gcm et commence à exprimer lz. 60% de ces cellules vont maintenir l’expression de lz, via une boucle d’autorégulation, et se différencier en cellules à cristaux. Dans les 40% restant la présence résiduelle de Gcm inhibe l’expression de lz et induit la différenciation des cellules en plasmatocytes. D’après Bataillé et al., 2005.
prohémocytes plasmatocytes cellules à cristaux
srp
lz
gcm
ush
srp
srp
A BFigure 5. Contrôle moléculaire de l’hématopoïèse embryonnaire.
A. srp est exprimé dans les prohémocytes et son expression est maintenue dans les hémocytes différenciés. gcm est nécessaire à la différenciation des plasmatocytes. lz est nécessaire à la différenciation de cellules à cristaux. Ush antagonise la différenciation des cellules à cristeaux.
B. Dans des embryons au stade 5 tous les prohémocytes expriment gcm. Au stade 7 la premières rangée de cellules va réprimer l’expression de gcm et commence à exprimer lz. 60% de ces cellules vont maintenir l’expression de lz, via une boucle d’autorégulation, et se différencier en cellules à cristaux. Dans les 40% restant la présence résiduelle de Gcm inhibe l’expression de lz et induit la différenciation des cellules en plasmatocytes. D’après Bataillé et al., 2005.
prohémocytes plasmatocytes cellules à cristaux
srp
lz
gcm
ush
srp
srp
Les hémocytes embryonnaires vont réaliser quatre cycles de mitose au cours de l’embryogenèse. Au cours des stades larvaires, cinq cycles de division seront accomplis (Holz et al., 2003) et vont conduire à la formation d’environ 3000 à 5000 hémocytes d’origine embryonnaire qui sont principalement composés de plasmatocytes. Les hémocytes d’origine embryonnaires sont également retrouvés chez l’adulte. La glande lymphatique ne contribue pas à la production des hémocytes présents dans l’hémolymphe de la larve car elle ne devient mature qu’à la fin du troisième stade larvaire et éclate au début de la métamorphose (Holz et al., 2003; Lanot et al., 2001). La population d’hémocytes circulants dans l’hémolymphe ou composants les îlots sessiles est donc entièrement composée d’hémocytes issus de l’hématopoïèse embryonnaire.
Contrôles moléculaires
Le facteur de transcription Serpent (Srp), qui appartient à la famille des facteurs de type GATA est nécessaire à la formation des hémocytes embryonnaires (Lebestky et al., 2000; Rehorn et al., 1996). Srp est requis tout au long de l’hématopoïèse embryonnaire (Lebestky et al., 2000) et il régule l’expression de différent gènes de lignage hémocytaire en coopération avec différents cofacteurs (Figure 5A et (Waltzer et al., 2002; Waltzer et al., 2003).
Trois autres facteurs de transcription jouent un rôle clef dans la spécification de l’identité des hémocytes (Figure5A). Glial Cell Missing (GCM) et GCM2 sont nécessaires à la spécification des plasmatocytes (Alfonso and Jones, 2002; Bernardoni et al., 1997; Lebestky et al., 2000). La différentiation des cellules à cristaux requiert l’expression du facteur de transcription Lozenge (Lz), une protéine à domaine Runt qui est l’homologue des protéines RUNX des mammifères (Lebestky et al., 2000; Waltzer et al., 2003), deBruijn et Speck 2004. Enfin, U-shaped (Ush), qui est une protéine à doigt de zinc de la famille des protéines Friend Of GATA (FOG) connus pour réguler l’activité des facteurs GATA chez les mammifères (pour revue (Cantor and Orkin, 2005)), antagonise la formation des cellules à cristaux (Fossett et al., 2001). Les facteurs de transcription appartenant à ces trois familles, GATA, FOG et Runx sont également impliqués chez les vertébrés dans la spécification de différents lignages myéloïdes (Evans and Banerjee, 2003). La succession des événements précoces amenant à la détermination du lignage hémocytaire et au choix entre les destins cellules à cristaux et plasmatocytes a été précisément décrite par Bataillé et collaborateurs (Bataille et al., 2005). Il apparaît que gcm est initialement exprimé dans tous les prohémocytes, mais il est rapidement réprimé dans la rangée de cellules la plus antérieure qui commencent alors à exprimer lz
(Figure 5B). La population de cellules exprimant lz est une population mixte. 60% d’entre elles vont maintenir, grâce à une boucle d’autorégulation, l’expression de lz et vont se différencier en cellules à cristaux. Dans les 40% des cellules restantes la présence résiduelle de GCM va interférer avec l’expression de lz ce qui induit leur différenciation en plasmatocytes. En absence de gcm/gcm2 la population de cellules exprimant lz augmente et toutes les cellules lz+ se différencient en cellules à cristaux. Ces résultats indiquent que les prohémocytes sont des progéniteurs bipotentiels et que la balance entre l’expression de lz et gcm/gcm2 est un point clef dans le contrôle de la spécification des cellules à cristaux.
Le récepteur tyrosine kinase PVR (PDGF et VEGF Receptor), et ses trois ligands (PDGF et VEGF related factor 1 PVF1, PVF2 et PVF3) jouent un rôle dans la survie de hémocytes embryonnaires et dans leur migration (Bruckner et al., 2004; Stramer et al., 2005; Wood and Jacinto, 2007). pvr est exprimé dans les plasmatocytes embryonnaires (Heino et al., 2001). Dans les embryons mutants pour pvr le nombre d’hémocytes est significativement réduit et un grand nombre d’hémocytes entrent en apoptose. Ce phénotype peut être sauvé en exprimant spécifiquement dans les hémocytes p35, l’inhibiteur des caspases, indiquant que PVR est requis pour la survie des plasmatocytes (Bruckner et al., 2004). Cependant, si les signaux impliqués dans leur survie sont connus, les signaux gouvernants leur prolifération restent encore inconnus.
PVR est également impliqué dans la migration des hémocytes embryonnaires. En effet, la migration ventrale des hémocytes le long de l’épiderme et de la chaîne nerveuse est dépendante de l’expression de pvr dans les hémocytes et de l’expression de pvf2 et pvf3 dans des domaines temporellement et spatialement différents dans la chaîne nerveuse. PVF2 et PVF3 fonctionnent comme des chémoatractants qui attirent les hémocytes le long du Système Nerveux Central (SNC) (Cho et al., 2002; Wood and Jacinto, 2007).
Les hémocytes peuvent également migrer vers une blessure selon des mécanismes rappelant ceux de l’inflammation chez les vertébrés. Les plasmatocytes changent alors de forme et émettent des extensions cytoplasmiques résultant du remodelage du réseau d’actine. Rac (appartenant à la famille des GTPases Rho) est requis pour la formation des extensions cellulaires nécessaire à leur migration (Stramer et al., 2005 ; Paladi, 2004). Il a également été montré que Rho, CDC42 et le Phosphatidyl-inositol 3-kinase (PI3K) sont spécifiquement requis pour la migration des plasmatocytes en réponse à une blessure, mais ils ne sont pas requis pour leur migration au cours du développement embryonnaire (Stramer et al., 2005). Ainsi, la migration des plasmatocytes soit vers une blessure soit le long des routes de
migration au cours de l’embryogenèse impliquent des mécanismes moléculaires clairement distincts.
Hématopoïèse larvaire
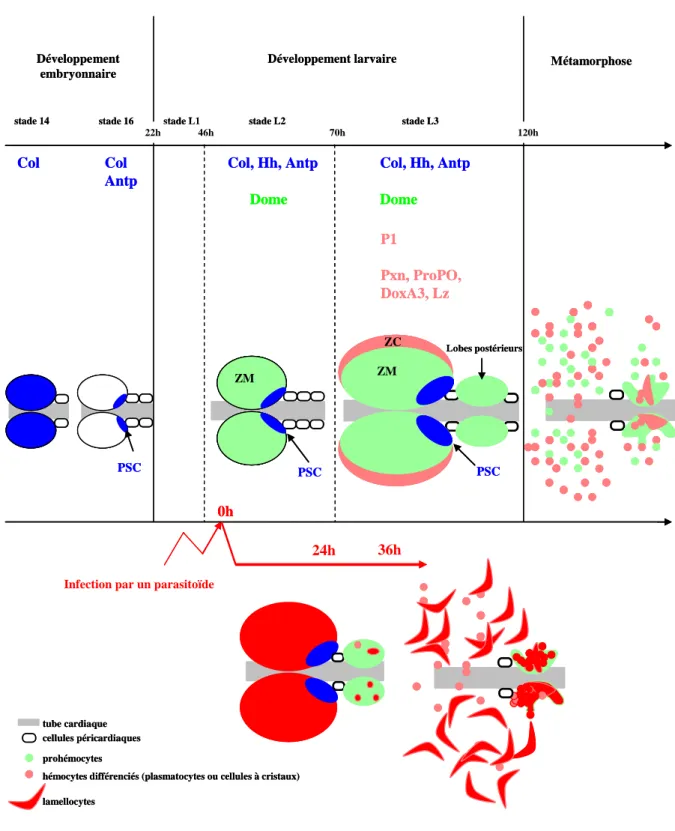
Ontogenèse de la glande lymphatique
L’hématopoïèse larvaire a lieu dans un organe spécialisé appelé la glande lymphatique localisée dorsalement le long de la partie antérieure du tube cardiaque (Figure 6B). La formation de la glande lymphatique commence au cours de l’embryogenèse. Elle n’est pas issue du mésoderme de tête comme les hémocytes embryonnaires, mais de quelques cellules mésodermiques se trouvant, au stade blastoderme, entre 50 et 53% (0% étant le pôle postérieur) de la longueur de l’embryon (Figure6A et (Holz et al., 2003)). Crozatier et collaborateurs ont montré qu’au stade 11 les cellules précurseurs de la glande lymphatique, correspondent à deux groupes de cellules mésodermiques localisés dorsalement au niveau des deuxième et troisième segments thoraciques (Figure 6C (Crozatier et al., 2004). Ces deux groupes de cellules expriment Collier (Col), un facteur transcription de la famille des facteurs COE, orthologue de Early B-cell Factor de vertébrés (Dubois and Vincent, 2001). Col est le marqueur le plus précoce connu à ce jour de la glande lymphatique. Par ailleurs, Mandal et collaborateurs ont montré, en suivant l’expression du facteur de transcription Odd-skipped (Odd), que les précurseurs de la glande lymphatique au stade 15 consistent en trois groupes de cellules dans les trois segments thoraciques, dont un groupe supplémentaire présent dans le premier segment thoracique qui n’est pas marqué par Collier (Mandal et al., 2004). Les trois groupes de cellules vont ensuite fusionner et former deux lobes localisés de part et d’autre du tube cardiaque qui sont appelés lobes primaires ou antérieurs (Figure 6 C-F). À la fin de l’embryogenèse, la glande lymphatique est donc composée de deux lobes ayant chacun environ vingt cellules. Toutes les cellules de la glande lymphatique expriment srp et maintiennent son expression au cours du développement larvaire (Jung et al., 2005). Par contre, l’expression de collier va s’éteindre dans la majorité des cellules de la glande lymphatique et ne va être maintenue que dans quelques cellules (deux ou trois par lobe) localisées le plus postérieurement, définissant ainsi une sous population de cellules qu’on
G H
Stade 11 Stade 12/13
Stade 14 Stade 16
Col
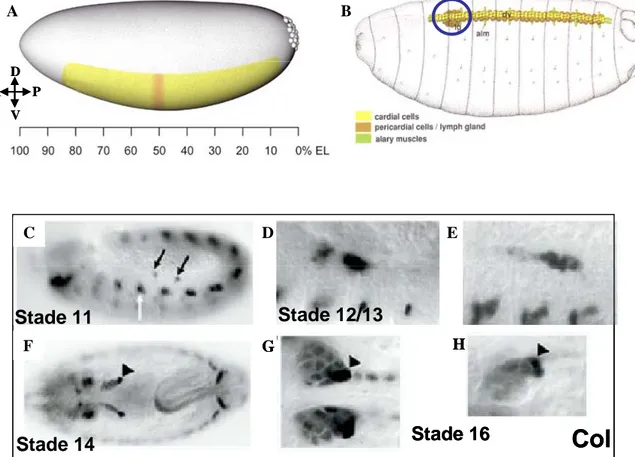
Figure 6. Ontogenèse de la glande lymphatique
A. Schéma d’un embryon au stade 5, en jaune le territoire du mésoderme. En rouge, la région située à
50-55% de la longueur de l’embryon qui est à l’origine de la glande lymphatique (d’après Holz et al., 2003)
B. Schéma d’un embryon à la fin de l’embryogenèse (stade 17). La glande lymphatique est localisée
(cercle bleu) dorsalement de part et d’autre du tube cardiaque. (d’après Bate et Martinez Aris, 1993) C-H. Expression de col dans la glande lymphatique. C. L’expression de col est détectée, à partir du stade 11, dans deux groupes de cellules dans le mésoderme dorsal des seqments thoraciques T2 et T3 (flèches noires). D, E. Entre les stades 12 et 13, les deux groupes de cellules, exprimant col, se rapprochent et fusionnent pour former les deux lobes de la glande lymphatique. F-H. Aux stades 14 à 16, l’expression de col se restreint progressivement et ne marque plus que le PSC (têtes de flèche noires). (Crozatier et al.. 2004). A B C F D E A D V P G H Stade 11 Stade 12/13
Stade 14 Stade 16
Col
Figure 6. Ontogenèse de la glande lymphatique
A. Schéma d’un embryon au stade 5, en jaune le territoire du mésoderme. En rouge, la région située à
50-55% de la longueur de l’embryon qui est à l’origine de la glande lymphatique (d’après Holz et al., 2003)
B. Schéma d’un embryon à la fin de l’embryogenèse (stade 17). La glande lymphatique est localisée
(cercle bleu) dorsalement de part et d’autre du tube cardiaque. (d’après Bate et Martinez Aris, 1993) C-H. Expression de col dans la glande lymphatique. C. L’expression de col est détectée, à partir du stade 11, dans deux groupes de cellules dans le mésoderme dorsal des seqments thoraciques T2 et T3 (flèches noires). D, E. Entre les stades 12 et 13, les deux groupes de cellules, exprimant col, se rapprochent et fusionnent pour former les deux lobes de la glande lymphatique. F-H. Aux stades 14 à 16, l’expression de col se restreint progressivement et ne marque plus que le PSC (têtes de flèche noires). (Crozatier et al.. 2004). A B C F D E A D V P A D V P
appelle Posterior Signalling Centre (PSC) (Figure 6F et (Lebestky et al., 2003)). Au cours du développement larvaire, les cellules de la glande lymphatique vont proliférer et au deuxième stade larvaire les deux lobes contiennent environ 200 cellules chacun. A la fin du deuxième stade larvaire des lobes secondaires ou postérieurs se forment et sont localisés plus postérieurement le long du tube cardiaque. Au troisième stade larvaire, la glande lymphatique est composée des deux lobes antérieurs ou primaires contenant chacun environ 2000 à 3000 cellules, et d’une série de paires de lobes postérieurs dont le nombre peut varier de trois à sept (Figure 7A,B). Le PSC uniquement présent dans chaque lobe antérieur est constitué de trente à quarante cellules (Figure 7D). La glande lymphatique est entourée par une couche de matrice extracellulaire qui au troisième stade larvaire forme un réseau complexe à travers les lobes antérieurs (Jung et al., 2005) Observées en Nomarsky, les cellules médullaires des lobes antérieurs ont un aspect lisse et établissent de nombreux contacts cellulaires entre elles, tandis que les cellules localisées à la périphérie de la glande lymphatique ont un aspect plus granuleux et les contacts cellulaires sont plus rares. Ainsi, en se basant sur leur morphologie, deux zones peuvent être distinguées dans les lobes antérieurs : une Zone Medullaire (ZM) et une Zone Corticale (ZC) (Figure 7C et (Jung et al., 2005)). Ces deux zones diffèrent également sur le plan de la prolifération. En effet, au troisième stade larvaire la prolifération est active dans la ZC mais pas dans la ZM où on trouve peu de cellules en division (Jung et al., 2005). Les lobes primaires sont donc composés de trois zones distinctes : la ZM, la ZC et le PSC qui est en contact avec la ZM (Figure 7D). En revanche, les lobes secondaires sont structurellement homogènes et la prolifération est toujours active dans l’ensemble des cellules les composant.
La glande lymphatique persiste jusqu’à la fin du développement larvaire. Cinq heures après la pupaison les lobes primaires commencent à relâcher des hémocytes dans l’hémolymphe. Douze heures après le début de la métamorphose les lobes antérieurs ne contiennent presque plus de cellules et les lobes postérieurs commencent à leur tour à éclater. Quinze heures après la pupaison la glande lymphatique a libéré tous les hémocytes dans l’hémolymphe. Les hémocytes de la glande lymphatique sont ensuite retrouvés en circulation dans l’hémolymphe de l’adulte.
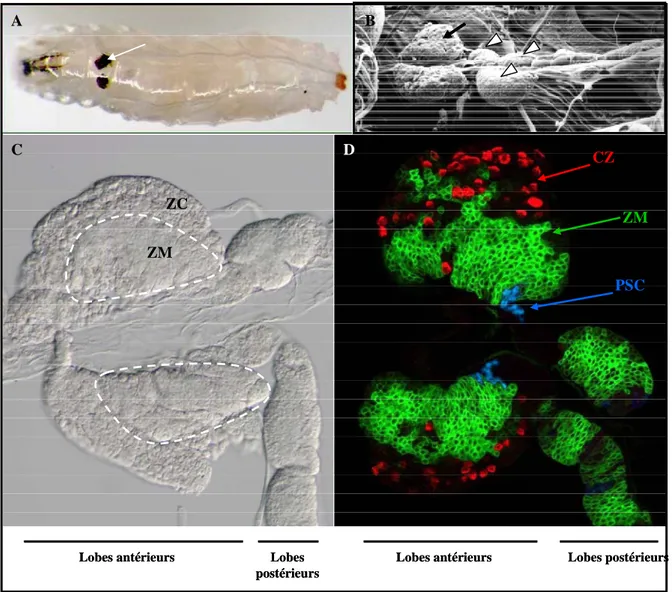
Figure 7. Morphologie de la glande lymphatique au troisième stade larvaire.
A. Localisation de la glande lymphatique dans la larve. Vue dorsale d’une larve au troisième stade. Les lobes antérieurs
sont nécrosés et apparaissent noirs (M. Crozatier, non publié) B. Glande lymphatique vue en microscopie électronique à balayage. La flèche noire montre un lobe antérieur, les têtes de flèches blanches montrent des lobes postérieurs. D’après Meister and Lagueux 2003. C. Glande lymphatique vue en Nomarsky. Les lobes antérieurs et postérieurs sont indiqués. Les pointillés blanc délimitent la zone médullaire (ZM) qui a un aspect lisse. La zone corticale (ZC) a un aspect rugueux. D. Image confocale d’une glande lymphatique (image de Joanna Krzemień) où la ZM est marquée par dome-gal4/UASmCD8GFP (vert), la ZC contient des cellules à cristaux marquées par à un anticorps contre proPO (cellules à cristaux, rouge), le PSC est marqué par Col (bleu).
ZM ZC
Lobes antérieurs Lobes Lobes antérieurs Lobes postérieurs postérieurs ZM CZ PSC A B C D
Figure 7. Morphologie de la glande lymphatique au troisième stade larvaire.
A. Localisation de la glande lymphatique dans la larve. Vue dorsale d’une larve au troisième stade. Les lobes antérieurs
sont nécrosés et apparaissent noirs (M. Crozatier, non publié) B. Glande lymphatique vue en microscopie électronique à balayage. La flèche noire montre un lobe antérieur, les têtes de flèches blanches montrent des lobes postérieurs. D’après Meister and Lagueux 2003. C. Glande lymphatique vue en Nomarsky. Les lobes antérieurs et postérieurs sont indiqués. Les pointillés blanc délimitent la zone médullaire (ZM) qui a un aspect lisse. La zone corticale (ZC) a un aspect rugueux. D. Image confocale d’une glande lymphatique (image de Joanna Krzemień) où la ZM est marquée par dome-gal4/UASmCD8GFP (vert), la ZC contient des cellules à cristaux marquées par à un anticorps contre proPO (cellules à cristaux, rouge), le PSC est marqué par Col (bleu).
ZM ZC
Lobes antérieurs Lobes Lobes antérieurs Lobes postérieurs postérieurs ZM PSC CZ A B C D
Vous avez dit hémangioblaste ?
Il a été proposé que, dans l’embryogenèse des vertébrés, les cellules sanguines et les cellules endothéliales partagent un précurseur commun appellé hémangioblaste (Medvinsky and Dzierzak, 1996), 1996 ; Kennedy et al., 1997 ; Huber et al., 2004). Toutefois, même s’il existe des relations évidentes entre les progéniteurs des cellules sanguines et des cellules endothéliales, l’existence de l’hémangioblaste reste très controversée (Jaffredo et al., 2005 ; Bollerot et al., 2005 ; Ueno and Weissman, 2006). Chez la Drosophile, une analyse clonale des étapes précoces de l’ontogenèse de la glande lymphatique indique que les cardioblastes composant le tube cardiaque et les cellules de la glande lymphatique pourraient résulter de la division d’un progéniteur commun que les auteurs ont proposé d’appeler hémangioblaste (Mandal et al., 2004) Ces résultats relancent le débat sur l’existence et la conservation au cours de l’évolution de l’hémangioblaste.
Zones Médullaire et Corticale : les hémocytes de la glande lymphatique
L’organisation structurale de la glande lymphatique, en trois zones distinctes, soulève la question de la signification fonctionnelle des différentes zones pour les hémocytes et leur différenciation. Les cellules de la ZM expriment domeless (dome) qui code pour le récepteur de la voie de signalisation JAK/STAT chez la Drosophile, ce qui peut être visualisé grâce au transgène pilote dome-Gal4 (pG125, Figure 7D (Bourbon et al., 2002; Jung et al., 2005)). Les cellules de la ZM sont des hémocytes indifférenciés ou prohémocytes, qui ont un diamètre de 4 à 6 µm, un ratio nucléoplasmique élevé et n’expriment aucun des marqueurs de différenciation des hémocytes. A l’inverse, les cellules de la ZC, correspondant aux hémocytes différenciés, n’expriment pas dome mais des marqueurs de différenciation (Jung et al., 2005). Jung et collaborateurs ont montré, par des expériences de lignage cellulaire, que les cellules de la ZC sont issues de la ZM. En effet, au deuxième stade larvaire la glande lymphatique est composée uniquement de précurseurs qui expriment dome. La ZC se forme progressivement, à partir du début du troisième stade larvaire, et est composée d’hémocytes différenciés (Figure 8 et (Jung et al., 2005)). Les mécanismes qui contrôlent la différenciation des hémocytes et leur sortie de la ZM reste encore à élucider.