NOTE TO USERS
This reproduction is the best copy available.
®
Implication du facteur Tpit dans la différenciation
hypophysaire et la pathogenèse du déficit corticotrope
par
Anne-Marie Pulichino
Département de biochimie
Université McGill, Montréal
Thèse présentée
à
la Faculté des études supérieures de l'Université McGili envue de l'obtention du grade de Ph.D. en Biochimie
Avril 2005
1+1
Library and Archives Canada Bibliothèque et Archives Canada Published Heritage Branch Direction du Patrimoine de l'édition 395 Wellington StreetOttawa ON K1A ON4 Canada
395, rue Wellington Ottawa ON K1A ON4 Canada
NOTICE:
The author has granted a
non-exclusive license allowing Library
and Archives Canada to reproduce,
publish, archive, preserve, conserve,
communicate to the public by
telecommunication or on the Internet,
loan, distribute and sell theses
worldwide, for commercial or
non-commercial purposes, in microform,
paper, electronic and/or any other
formats.
The author retains copyright
ownership and moral rights in
this thesis. Neither the thesis
nor substantial extracts from it
may be printed or otherwise
reproduced without the author's
permission.
ln compliance with the Canadian
Privacy Act some supporting
forms may have been removed
from this thesis.
While these forms may be included
in the document page cou nt,
their removal does not represent
any loss of content from the
thesis.
•
••
Canada
AVIS:
Your file Votre référence ISBN: 0-494-12930-1 Our file Notre référence ISBN: 0-494-12930-1
L'auteur a accordé une licence non exclusive
permettant
à
la Bibliothèque et Archives
Canada de reproduire, publier, archiver,
sauvegarder, conserver, transmettre au public
par télécommunication ou par l'Internet, prêter,
distribuer et vendre des thèses partout dans
le monde,
à
des fins commerciales ou autres,
sur support microforme, papier, électronique
et/ou autres formats.
L'auteur conserve la propriété du droit d'auteur
et des droits moraux qui protège cette thèse.
Ni la thèse ni des extraits substantiels de
celle-ci ne doivent être imprimés ou autrement
reproduits sans son autorisation.
Conformément
à
la loi canadienne
sur la protection de la vie privée,
quelques formulaires secondaires
ont été enlevés de cette thèse.
Bien que ces formulaires
aient inclus dans la pagination,
il n'y aura aucun contenu manquant.
•
•
•
RÉSUMÉ
L'hypophyse est un modèle très utile pour étudier les mécanismes impliqués dans la différenciation cellulaire. Cette glande endocrine est composée de six lignées cellulaires, chacune produisant une hormone différente: les cellules thyréotropes (TSH), somatotropes (GH), lactotropes (PRL), gonadotropes (LH, FSH), mélanotropes (a-MSH) et corticotropes (ACTH). L'ACTH et l'a-MSH sont toutes deux clivées à partir du même précurseur, la proopiomélanocortine (POMC). Les cellules hypophysaires se différencient séquentiellement à partir d'un épithélium commun, la poche de Rathke, sous l'influence combinée de facteurs de transcription histo-spécifiques. Dans les cellules corticotropes, Tpit et NeuroD1 sont importants pour la transcription du gène de la POMC. Leur expression précède de près celle de la POMC suggérant un rôle dans la différenciation de la lignée. Dans le but de mieux comprendre le rôle de Tpit dans la différenciation des cellules exprimant la POMC, nous avons généré des souris invalidées pour le gène de Tpit. Ces souris n'ont presque plus de cellules exprimant la POMC tandis que les autres lignées hypophysaires ne sont pas affectées. L'analyse d'autres marqueurs exprimés dans les corticotropes, tel NeuroD1, a permis de montrer que l'initiation de la différenciation est préservée en absence de Tpit. Dans le but de tester si NeuroD1 et Tpit pourraient être conjointement requis pour la détermination corticotrope, nous avons généré les souris Tpit-/-NeuroD1-/-, qui ont révélé que ces deux facteurs ne sont pas essentiels pour la détermination précoce des cellules corticotropes. Cela suggère des mécanismes de contrôle différents pour l'initiation de la différentiation par rapport à la transcription histo-spécifique du gène de la POMC et au maintien des celulles corticotropes et mélanotropes. D'autre part, une analyse plus approfondie des souris Tpit-/- a montré que Tpit est aussi un régulateur négatif des gonadotropes, révélant des relations inattendues entre les lignées hypophysaires. Ces travaux ont suggéré un modèle de différenciation séquentiel pour chacune des lignées hypophysaires. Dans ce modèle, une série de choix binaires peuvent expliquer tout le schéma de différenciation hypophysaire, suggérant l'existence d'un précurseur hypophysaire multipotent. Enfin, nous avons pu montrer que des mutations du gène de TPIT humain sont associées avec la déficience isolée en ACTH, une pathologie très similaire aux souris invalidées pour Tpit. Ces patients ont des niveaux plasmatiques indétectables en ACTH entraînant une insuffisance surrénalienne. En somme, ces résultats montrent que Tpit contrôle la différenciation terminale des lignées hypophysaires exprimant la POMC .
•
•
•
ABSTRACT
The pituitary gland is a very convenient model to study mechanisms implicated in cellular differentiation. This endocrine gland is composed of six cell lineages, each committed to the production of a different hormone: thyrotrophs (TSH), somatotrophs (GH), lactotrophs (PRL), gonadotrops (LH, FSH), melanotrophs (a-MSH) and corticotrophs (ACTH). ACTH and a-MSH are both processed from the sa me precursor, proopiomelanocortin (POMC). Pituitary hormone-producing cells differentiate sequentially from a common epithelial primordium, Rathke's pouch, under the combinatorial action of a subset of tissue- and cell-restricted transcription factors. In corticotrophs, Tpit and NeuroD1 are important for POMC transcription. Their expression closely precedes that of POMC, suggesting a role in the differentiation of this lineage. In order to better define the role of Tpit in POMC cell differentiation, we generated Tpit-null mice. These mice are deficient in POMC-expressing cells while other pituitary lineages are normal. Analysis of other corticotroph markers, such as NeuroD1, showed that lineage commitment was preserved in absence of Tpit. We next tested if Tpit and NeuroD1 could be jointly required for corticotroph determination by producing Tpit-/-NeuroD1-/- mice. This experiment revealed that these two factors are not essential for early determination of corticotroph cells, suggesting different levels of control for commitment of POMC lineages compared to cell survival or to cell-specific transcription of POMC. Further investigation of Tpit-/- mice has revealed that Tpit is a negative regulator of the gonadotroph fate. These studies suggest a binary model of cell fate decisions for pituitary ce Il differentiation, suggesting the presence of a pituitary pluripotent precursor. Finally we have shown that mutations in the coding sequence of human TPIT are associated with isolated ACTH deficiency, a pathology very similar to that found in Tpit-null mice. These patients have undetectable plasma ACTH levels and consequently exhibit adrenal insufficiency. Taken together, these results show that Tpit is a dual regulator of pituitary diffenrentiation, acting positively on POMC-expressing cells and negatively on gonadotrophs .
•
TABLE DES MATIÈRESRÉSUMÉ ... 1
ABSTRACT ... 11
TABLE DES MATIÈRES ... 111
LISTE DES FIGURES ... IX LISTE DES TABLEAUX ... X LISTE DES SIGLES ET ABRÉVIATIONS ... XI REMERCIEMENTS ... XIV CONTRIBUTIONS DES AUTEURS ... XV CHAPITRE 1 : INTRODUCTION ... 1
1. RÔLE DE L'HyPOPHySE ... 2
1.1 LE LOBE POSTÉRIEUR ... 2
1.2 LE LOBE INTERMÉDIAIRE ... 3
1.3 LE LOBE ANTÉRIEUR ... 3
1.3.1 Les cellules folliculo-stellaires ... .4
1.3.2 Les cellules thyréotropes ... .4
•
1.3.3 Les cellules gonadotropes ... 51.3.4 Les cellules somatotropes ... 5
1.3.5 Les cellules lactotropes ... 6
1.3.6 Les cellules corticotropes ... 6
1.3.6.1 Effets des glucocorticoïdes sur le métabolisme ... 7
1.3.6.1.1 Effets sur le système immunitaire ... 7
1.3.6.1.2 Effets sur les fluides et la pression sanguine ... 8
1.3.6.1.3 Autres effets ... 8
1.3.6.1.4 Symptomes associés aux excès et déficits en glucocorticoïdes ... 8
1.3.6.1.5 Modèles murins de déficit en glucocorticoïdes ... 9
La souris GR-/- ... 9
La souris CRH-/-... ... 9
Les souris CRHr-/-... ... 10
La souris POMC-/-... 10
1.3.6.1.6 Mécanisme d'action des Gc ... 11
La transrépression par les récepteurs nucléaires ... 11
2. ONTOGENÈSE HYPOPHYSAIRE ... 13
2.1 ORIGINE EMBRYONNAIRE ET INDUCTION DE LA POCHE DE RATHKE .13 2.2 LES MOLÉCULES DE SIGNALISATION ... 17
2.2.1 Les BMPs (BONE MORPHOGENIC PROTEINS) ... 17
2.2.2 LES FGFs (FIBROBLAST GROWTH FACTORS) ... 18
2.2.3 Sonic hedgehog ... 19
2.2.4 Autres signaux ... 20
2.3 FORMATION DE LA POCHE RUDIMENTAIRE ... 21
•
2.3.1 Pitx1/2 ... 21 2.3.2 Isl1 ... 22 2.3.3 Hesx1/rpx ... 22 2.4 LA POCHE DÉFINITIVE ... 23 2.4.1 Lhx3 et Lhx4 ... 23 2.4.2 PROP1 ... 242.5 DIFFÉRENCIATION DES LIGNÉES HYPOPHYSAIRES ... 25
2.5.1 Thyréotropes, somatotropes et lactotropes ... 25
2.5.1.1 Pit-1 ... 25 2.5.2 Gonadotropes ... 26 2.5.2.1 SF1 ... 26 2.5.2.2 GATA-2 ... 27 2.5.3 Corticotropes et mélanotropes ... 28 2.5.3.1 NeuroD1/Beta2 ... 28 2.5.3.2 Tpit. ... '" ... 28
3. DÉFICITS HORMONAUX HYPOPHYSAIRES CONGÉNITAUX ... 31
3.1 DÉFICITS MULTiPLES ... 31
3.2 DÉFICITS ISOLÉS ... 32
3.2.1 Déficit somatotrope isolé ... 32
3.2.2 Déficit thyréotrope isolé ... 32
3.2.3 Déficit gonadotrope isolé ... 32
3.2.4 Déficit corticotrope isolé ... 33
3.3 LA DÉGRADATION MÉDIÉE PAR LES MUTATIONS NON-SENS ... 33
4. LA PRO-OPIOMÉLANOCORTINE ... 36
4.1 LA POMC HYPOPHYSAIRE ... 37
•
4.2 LA POMC HyPOTHALAMIQUE ... 384.3 LA POMC CUTANÉE ... 41
4.4 RÔLES DES AUTRES PEPTIDES POMC ... 42
4.5 MODÈLE MURIN DE DÉFICIENCE EN POMC ... 43
4.6 MUTATIONS DE LA POMC CHEZ L'HOMME ... .45
4.7 RÉGULATION TRANSCRIPTIONNELLE DE LA POMC ... .46
4.7.1 Mécanismes de transcription basale et histo-spécifique ... 46
4. 7.1.1 Pitx1 ... 47
4.7.1.2 NeuroD1 ... 48
4.7.1.3 Tpit. ... 49
4.7.2 La régulation hormonale ... 50
4.7.2.1 La régulation positive par le CRH ... 50
4.7.2.2 La répression par les glucocorticoïdes ... 52
5. LES FACTEURS DE TRANSCRIPTION À BOÎTE T ... 55
5.1 BRACHYURY (T) ... 56 5.2 TBX1 ... 57 5.3 TBX2 ... 58 5.4 TBX3 ... 58 5.5 TBX4 ... 59 5.6 TBX5 ... 60 5.7 TBX6 ... 60 5.8 TBX10 ... 61 5.9 TBX15 ... 61
•
iv•
•
•
5.10 TBX18 ... 62 5.11 TPIT (TBX19) ... 62 5.12 TBX20 ... 62 5.13 TBX21 ... 63 5.14 TBX22 ... 63 5.15 TBR1 ... 64 5.16 TBR2 ... 64 6. OBJECTIFS DE TRAVAIL ... 66CHAPITRE 2: A PITUITARY CELL-RESTRICTED T-BOX FACTOR, TPIT, ACTIVATES POMC TRANSCRIPTION IN COOPERATION WITH PITX HOMEOPROTEINS ... 67
1. AVANT-PROPOS ... 68
2. SUMMARY ... 69
3. INTRODUCTION ... 69
4. RESULTS ... 71
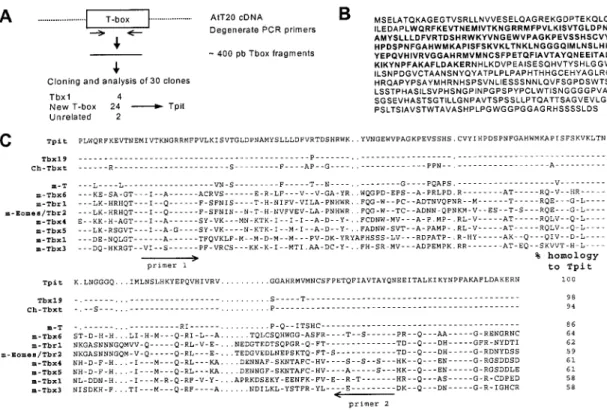
4.1 TPIT IS A T-BOX FACTOR CLOSELY RELATED TO BRACHYURY (T) ... 71
4.2 TPIT IS ONLY PRESENT IN PITUITARY POMC-EXPRESSING CELLS ... 72
4.3 TPIT AND PITX1 ARE JOINTL
y
REQUIRED FOR ACTIVATION OF POMC TRANSCRiPTION ... 734.4 SPECIFICITY OF COOPERATION BETWEEN PITX AND T-BOX FACTORS ... 74
4.5 TPIT BINDS THE T-BOX ELEMENT ... 74
4.6 TPIT INITIATES POMC CELL DIFFERENTIATION ... 74
4.7 TPIT GENE MUTATIONS IN PATIENTS WITH ISOLATED ACTH DEFICIENCY ... 75
5. DISCUSSION ... 76
5.1 T-BOX GENES, TPIT AND CELL DIFFERENTIATION ... 76
5.2 COOPERATION BETWEEN TPIT AND PITX1 ... 78
5.3 DEVELOPMENTAL SIGNIFICANCE OF INTERACTION BETWEEN PITX AND T-BOX TRANSCRIPTION FACTORS ... 79
6. EXPERIMENTAL PROCEDURES ... 79
6.1 CELL CULTURE AND TRANSIENT TRANSFECTION ASSAYS ... 79
6.2 PLASMIDS AND OLiGONUCLEOTIDES ... 80
6.3 RNA ANALYSIS, DEGENERATE PCR AND CDNA LlBRARY SCREENING80 6.4 GEL RETARDATION ASSAY ... 80
6.5 PREPARATION AND CHARACTERIZATION OF AFFINITY-PURIFIED ANTI-TPIT ANTIBODIES ... 81
6.6 IMMUNOHISTOCHEMISTRY, SECTION AND WHOLEMOUNT IN SITU HYBRIDIZATION ... 81
6.7 GENERATION OF TRANSGENIC MICE ... 81
6.8 ANALYSIS OF HUMAN TPIT GENE ... 81
•
CHAPITRE 3 : TPIT DETERMINES AL TERNATE FATES DURING PITUITARY CELL DIFFERENTIATION ... 90 1. AVANT-PROPOS ... 91 2. SUMMARY ... 92 3. INTRODUCTION ... 93 4. RESULTS ... 954.1 TPIT IS REQUIRED FOR LATE POMC LlNEAGE DIFFERENTIATION BUT NOT FOR LlNEAGE COMMITMENT ... 95
4.2 ALTERNATE PITUITARY CELL FATES IN ABSENCE OF TPIT ... 96
4.3 TPIT IS A REPRESSOR OF THE GONADOTROPH LlNEAGE ... 97
4.4 TRANSREPRESSION OF TPIT AND SF1 ACTIVITY ... 98
5. DISCUSSION ... 99
5.1 TPIT IS A POSITIVE REGULATOR IN POMC-EXPRESSING CELLS ... 99
5.2 TPIT IS A NEGATIVE REGULATOR OF GONADOTROPH DIFFERENTIATION ... 100
5.3 A BINARY MODEL OF PITUITARY CELL DIFFERENTIATION ... 101
6. MATE RIALS AND METHODS ... 103
6.1 GENE TARGETING, TRANSGENICS AND GENOTYPING ... 1 03
•
6.2 SECTIONS AND LACZ STAINING ... 1036.3 CELLS AND TRANSFECTIONS ... 103
6.4 PULL-DOWN ASSAYS ... 103
6.5 IMMUNOHISTOCHEMISTRY AND IMMUNOFLUORESCENCE ... 104
7. ACKNOWLEDGEMENTS ... 111
CHAPITRE 4 : HUMAN AND MOUSE TPIT GENE MUTATIONS CAUSE EARL Y ONSET PITUITARY ACTH DEFICIENCY ... 112
1. AVANT-PROPOS ... 113
2. SUMMARY ... 114
3. INTRODUCTION ... 114
4. RESULTS AND DISCUSSION ... 116
4.1 TPIT MUTANT MICE HAVE IMPAIRED ADRENAL FUNCTION ... 116
4.2 EARL Y ONSET ISOLATED ACTH DEFICIENCY (lAD) PATIENTS HAVE TPIT MUTATIONS ... 117
4.3 TPIT GENE MUTATIONS CAUSE LOSS-OF-FUNCTION AND RECESSIVE TRANSMISSION OF lAD ... 118
5. MATERIALS AND METHODS ... 120
•
5.1 MOUSE STUDIES ... 1205.2 PATIENTS ... 120
•
•
•
5.3 GENOMIC ANAL YSIS OF THE TPIT GENE ... 120
5.4 CELL CULTURE, TRANSFECTION AND PLASMIDS ... 121
5.5 GEL RETARDATION ASSAYS AND WESTERN BLOTTING ... 121
6. ACKNOWLEDGEMENTS ... 126
CHAPITRE 5: POSITIVE AND NEGATIVE ROLES OF NEUROD1 DURING PITUITARY CELL DIFFERENTIATION ... 127
1. AVANT-PROPOS ... 128
2. SUMMARY ... 129
3. INTRODUCTION ... 130
4. MATERIALS AND METHODS ... 131
4.1 MICE, ANTIBODIES AND IMMUNOHISTOCHEMISTRY ... 131
4.2 PLASMIDS AND TRANSFECTION ASSAYS ... 131
4.3 NUCLEAR EXTRACTS AND WESTERN BLOTS ... 131
5. RESUL TS AND DISCUSSION ... 132
5.1 TPIT-/- MICE AND TPIT-/-NEUROD1-/- MICE HAVE THE SAME PHENOTyPE ... 132
5.2 NEUROD1 EXPRESSION IN PITUITARY ... 133
5.3 TRANSREPRESSION MECHANISMS WITH NEUROD1 ... 134
6. ACKNOWLEDGEMENTS ... 140
CHAPITRE 6: DiSCUSSiON ... 141
1. DIFFÉRENCIATION HYPOPHYSAIRE ... 141
1.1 ANTAGONISME ENTRE LES CORTICO/MÉLANOTROPES ET LES GONADOTROPES ... 141
1.2 RELATIONS ENTRE LES DIFFÉRENTES LIGNÉES HYPOPHYSAIRES .. 143
1.3 DIFFÉRENCIATION HYPOPHYSAIRE ET RÔLES DES FACTEURS HyPOTHALAMIQUES ... 145
1.4 DIFFÉRENCE ENTRE MÉLANOTROPES ET CORTICOTROPES ... 146
1.4.1 Rôle potentiel de l'hypothalamus ... 146
1.4.2 Rôle de NeuroD1 ... 147
1.5 RÔLE POTENTIEL DE NEUROD1 DANS D'AUTRES LIGNÉES HYPOPHYSAIRES ... 148
1.6 LE DOMAINE DE L'HYPOPHYSE EN LENTE ÉVOLUTION ... 149
1.6.1 Les facteurs de transcription ... 149
1.6.2 Les promoteurs hypophysaires ... 149
1.6.3 Les signaux extracellulaires ... 150
2. RÔLES PÉRIPHÉRIQUES DE TPIT ... 151
2.1 EXPRESSION DE TPIT DANS LE CERVEAU ... 151
2.2 RÔLE INDIRECT DE TPIT DANS LA RÉGULATION DE LA GLYCÉMIE ... 151
•
4. CONCLUSIONS GÉNÉRALES ... 153 DÉCLARATION D'ORIGINALITÉ ... 156 ANNEXE ... 157 RÉFÉRENCES ... 159•
•
viii•
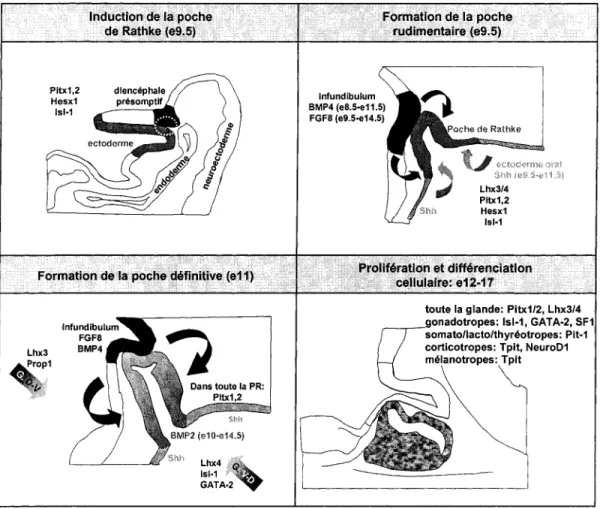
LISTE DES FIGURESFigure 1.1 : Origine hypophysaire chez les vertébrés ... 15
Figure 1.2 : Représentation schématique du développement hypophysaire ... 16
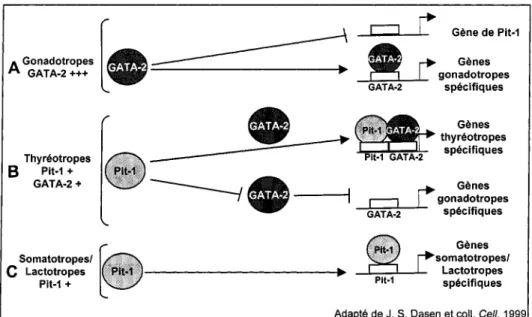
Figure 1.3 : Modèle de spécificité cellulaire de l'expression du gène de la GH ... 30
Figure 1.4 : Modèle de détermination cellulaire par Pit-1 et GATA-2 ... 30
Figure 1.5 : Représentation schématique de la dégradation médiée par les mutations non-sens (NMD) ... 35
Figure 1.6 : Clivage de la PO MC ... .40
Figure 1.7 : POMC et obésité ... 40
Figure 1.8 : Représentation schématique du promoteur de la POMC ... 54
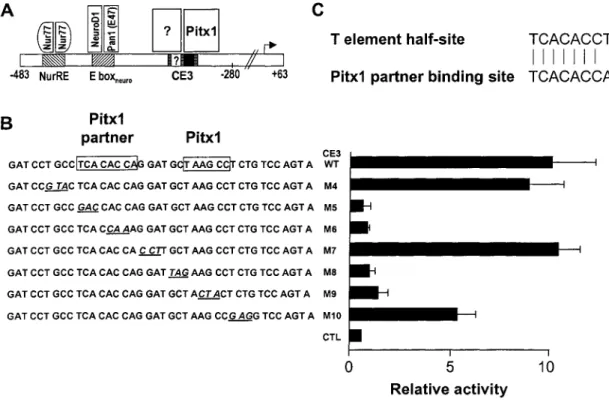
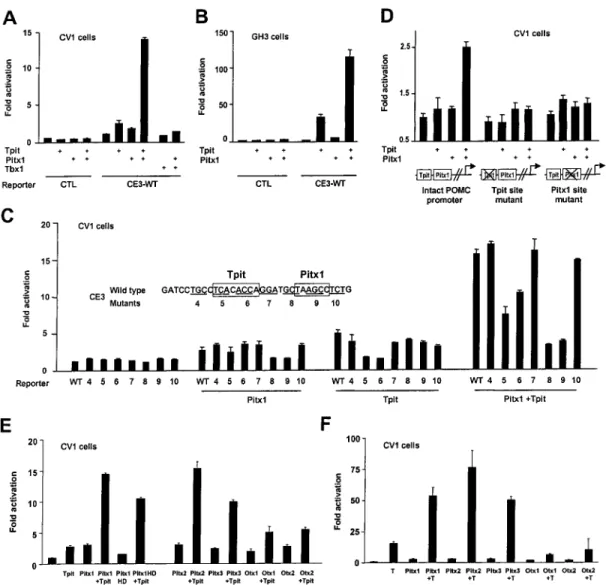
Figure 2.1: AT-box binding site is required for Pitx1 activation of POMC transcription .. 82
Figure 2.2: Cloning of Tpit, a New T-Box Factor ... 83
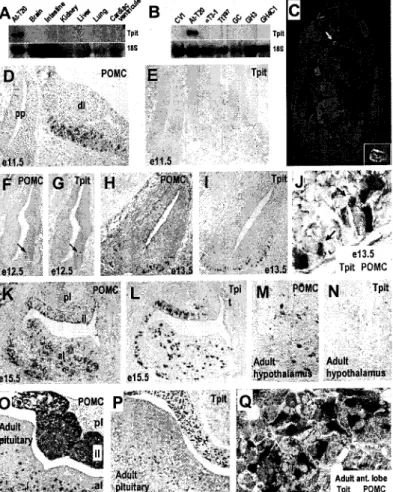
Figure 2.3 : Tpit Is only expressed in POMC-expressing cells of the pituitary gland ... 84
Figure 2.4: Tpit and Pitx1 activate POMC transcription synergistically in heterologous cells ... 85
Figure 2.5: Tpit binds to the T-Box element.. ... 86
Figure 2.6: POMC cell differentiation induced by Tpit in vivo ... 87
Figure 2.7: Human TPIT gene mutations in isolated pituitary ACTH deficiency ... 88
Figure 3.1: Targeted disruption of the mouse Tpit gene ... 1 05 Figure 3.2: Tpit is required for late POMC lineage differentiation but not for lineage
•
commitment ... 106Figure 3.3: Alternate pituitary cell fates in absence of Tpit.. ... 107
Figure 3.4: Repression of gonadotroph differentiation in transgenic mice expressing Tpit under control of aGSU promoter ... 1 08 Figure 3.5: Trans-repression between Tpit and SF1 as a mechanism for antagonism between the two factors ... 1 09 Figure 3.6: A binary model of pituitary cell differentiation ... 110
Figure 4.1: Tpit-/- mice are a model of isolated ACTH deficiency (lAD) ... 122
Figure 4.2: Human TPIT gene mutations in early onset isolated ACTH deficiency (lAD) ... 124
Figure 4.3: TPIT missense mutations cause loss-of-function for DNA binding ... 125
Figure 5.1: The double mutant Tpit-/-NeuroD 1-/- mice have the same phenotype as the Tpit-/- mice ... 136
Figure 5.2: The use of a new and highly sensitive antibody shows that NeuroD1 has wider expression than previously thought in the pituitary ... 137
Figure 5.3: NeuroD 1 can inhibit the activity of SF1 and Pit-1 transcription factors ... 138
Figure 5.4: NeuroD1 is required for inhibition and activation of hormone gene transcription ... 139
Figure 6.1: Colocalisation de b-galactosidase et SF1 dans l'hypophyse adulte ... 154
Figure 6.2: Expression hypophysaire de SF1 et Pit-1 à e14.5 chez la souris ... 154
Figure 6.3: Phénotype des souris NeuroD1-/- dans le fond génétique 129/sv pur ... 155
Figure 6.4: Expression de Tpit dans l'hypophyse et le diencéphale en développement ... 155
•
LISTE DES TABLEAUXTableau 1.1: Types cellulaires hormonaux du lobe antérieur hypophysaire ... 7 Tableau 1.2 : Facteurs de transcription impliqués dans le développement hypohysaire 29 Tableau 1.3: Résumé des facteurs de transcription à boîtes T ... 65 Table 4.1 : Clinical presentation of early onset isolated ACTH deficiency (lAD) patients
carrying TPIT mutations ... 123
•
•
•
•
•
LISTE DES SIGLES ET ABRÉVIATIONS aGSU : Sous-unité glycoprotéique a
a-MSH: Hormone mélano-stimuline a I3-MSH: Hormone mélano-stimuline 13
y-MSH: Hormone mélano-stimuline y
A
ACTH: Adrenocortical-stimulating hormone (corticotropine) ADH: Hormone antidiurétique
ADN ou DNA: Acide désoxyribonucléique
ADNc: Acide désoxyribonucléique complémentaire AGRP: Agouti related protein
AMPc: Adénosine monophosphate cyclique ANF: Peptide atrionutriurétique
ANR: Calotte ectodermique (anterior neural ridge) AP-1: Activator Protein 1
AR: Récepteur des androgènes ARC: Noyau arqué de l'hypothalamus ARN : Acide ribonucléique
ARNm : Acide ribonucléique messager
B
bHLH: Hélice-boucle-hélice basique BMP: Bone morphogenic protein
C
C-: Carboxy
CASK: Calcium/calmodulin-dependent serine protein kinase CE: Central element
CFS : Cellules folliculo-stellaires
CLIP: Corticotropin-like intermediate lobe protein
COUP-TF: Chicken ovalbumin upstream promoter-transcription factor CREB: cAMP-response element binding protein
CRH: Corticotropin releasing hormone CRHr-1/2: Récepteur du CRH 1/2 CSP : Codon stop prématuré
CUTE: Corticotroph upstream transcription element
o
DBD: DNA binding domain DE: Distal element
E
e: Jour embryonnaire (embryonic day) eGFP: Enhanced green fluorescent protein Egr-1: Early growth response gene-1 ER: Récepteur des oestrogènes
•
•
•
F
FGF: Fibroblast growth factor
FSH: Follitropine (follicule-stimulating hormone) G
Gc: Glucocorticoïde
GH: Growth hormone (hormone de croissance) GHRH: Growth hormone releasing hormone
GHRHr: Growth hormone releasing hormone receptor GR : Récepteur des glucocorticoïdes
GRE: Élément de réponse à GR (GR response element) GST: Glutathione sépharose transférase
H
HO: Homéodomaine
HIP: Hedgehod inhibitory factor
HPA (axe): Axe hypothalamo-hypophyso-surrénalien (hypothalamic-pituitary-adrenal)
lAD: Déficience isolée en ACTH (isolated ACTH deficiency) IGF-I: insulin-like growth hormone 1
IL-4 : Interleukine 4 IL-6: Interleukine 6 Is11: Islet 1 K Kb : Kilopaire de bases L
LA (ou AL) : Lobe antérieur
LH: Lutropine (Iuteinizing hormone) Lhx: LlM homeobox
LI (ou IL): Lobe intermédiaire LlF: Leukimia inhibitory factor LP (ou PL): Lobe postérieur
M
MAPK: Mitogen acivated protein kinase MBP: Maltose binding protein
MC(1 ,2,3,4 ou 5)R: Récepteurs des mélanocortine (Melanocortine receptor) MR: Récepteur des minéralocorticoïdes
N
N-: Amino
NBRE: NGFI-B response element
NGFI-B: Nerve Growth Factor Inducible-clone B
nGRE: Élément de réponse negative à GR (Negative GR Response Element) NMD: Nonsense-mediated decay
NOR-1: Neuron-derived orphan receptor nt: Nucléotide
NTS: Noyau du tractus solitaire
•
•
•
Nurr1: Nur-related factor 1
NurRE : Élément de réponse à aux facteurs Nur (Nur Response Element)
p
Pax: Paired-box pb : Paire de base
PC: Prohormone convertase PCR : Polymerase chain reaction PE: Proximal element
Pitx1/2: Pituitary homeobox 1/2 PKA: Protéine kinase A
PNMT: Phényléthanolamine-H-méthyltransférase POMC: Pro-opiomélanocortine
PP1: Putative pituitary POMC 1
PPAR: Proliferating peroxisome activating receptor PR: Récepteur de la progestérone
PRL: Prolactine
Prop1: Prophet of Pit-1 R
RAR: Récepteur
à
l'acide rétinoïque tout-trans RIA: RadioimmunoassayRpx: Rathke's pouch homeobox RSV: Rous sarcoma virus RT : Transcriptase inverse
RXR: Récepteur de l'acide 9cis-rétinoïque
5
SDG: Syndrome de DiGeorge SF1: Steroidogenic factor 1 SHO: Syndrome de Holt-Oram Shh: Sonic hedgehog
SRC: Steroid receptor coactivator SRM: Syndrome radio-mammaire SV40: Simian Virus 40 SVCF: Syndrome vélocardiofacial T T: tail T3 : Triiodothyronine T 4 : Thyroxine Tbr1: T -brain-1 Tbx: T-box factor TH: Thyrosine hydroxylase
TR: Récepteur de l'hormone thyroïdienne TRH: Thyrotropin releasing hormone
TRHr : Thyrotropine releasing hormone receptor TSH: Thyrotropine (thyroid-stimulating hormone)
V
•
•
•
REMERCIEMENTS Je remercie ...
... Tout d'abord ma famille, qui a toujours cru en moi et m'a supportée moralement et financièrement, me donnant l'opportunité de faire des études. Sans mes parents et ma soeur, je ne serais pas où je suis aujourd'hui.
... Mon directeur de thèse, Jacques Drouin. Sa disponibilité, sa générosité et ses connaissances scientifiques furent précieuses tout au long de mon doctorat.
... Tous les membres du laboratoire présents et passés qui m'ont aidée et ont rendu mon séjour agréable, particulièrement Christine Martens, Catherine Couture, Mario Maira, Sophie Vallette-Kasic et Steve Bilodeau .
... Toutes les personnes œuvrant dans les services offerts à !'IReM, plus particulièrement Annie Vallée au service d'histologie, Jacques Lavigne et Marco Raposo au service de biologie moléculaire, Qinzhang Zhu et Michel Robillard au service de transgenèse et Julie D'amours qui a veillé au bien-être de mes précieuses souris .
... Maureen Caron au département de biochimie de l'Université McGili qui m'a grandement aidée à franchir les difféntes étapes administratives .
... Le CRSNG et le CIHR pour leur soutien financier .
•
•
•
CONTRIBUTIONS DES AUTEURS
Chapitre 2 :
J'ai réalisé les expériences présentées aux figures 2.6 et 2.7.
Thomas Lamonerie a réalisé les expériences présentées à la figure 2.1. Bruno Lamolet a réalisé les expériences présentées aux figures 2.2, 2.3 et 2.4. Yves Gauthier a réalisé les expériences présentées à la figure 2.5.
L'ADN des patients a été fourni par nos collaborateurs.
Le travail a été réalisé sous la supervision de Jacques Drouin. Chapitre 3 :
J'ai réalisé toutes les expériences sauf:
Figure 3.3 : Mise au point de l'immunohistochimie PRL réalisée par Judy Ping Tsai lors de son stage d'été sous ma supervision.
Figure 3.5 A, B, C, E : tranfections réalisées conjointement avec Sophie Vallette-Kasic. Figure 3.5 D : Pull-down réalisé par Catherine Couture.
Yves Gauthier a fourni de l'aide technique.
Le travail a été réalisé sous la supervision de Jacques Drouin . Chapitre 4 :
J'ai réalisé toutes les expériences sauf:
Table 4.1 : Données cliniques fournies par nos collaborateurs cliniciens.
Figure 4.3 G : transfections réalisées conjointement avec Sophie Vallette-Kasic. Figure 4.3 B : Retard sur gel réalisé avec Catherine lors de son stage d'été sous ma supervision.
L'ADN des patients a été fourni par nos différents collaborateurs. Yves Gauthier a fait des expériences de retard sur gel non montrées.
Les séquences des patients sans mutations Tpit ont été faites par Sophie Vallette-Kasic. Le travail a été réalisé sous la supervision de Jacques Drouin.
Chapitre 5:
J'ai réalisé toutes les expériences sauf:
Figure 5.2 A, B : transfections réalisées conjointement avec Sophie Vallette-Kasic. L'anticorps NeuroD1 a été généré par Yves Gauthier.
•
•
•
CHAPITRE 1 : INTRODUCTION
L'endocrinologie (du grec endon=dedans, krinein=sécréter) est une science relativement récente qui a pris son essor au 1ge siècle. Bien avant que ne soit connu le rôle des hormones, les médecins et chirurgiens ont pressenti le rôle des glandes à sécrétion interne. Ils confrontaient les symptomes de la maladie et les altérations anatomiques révélées après autopsie. Un certain nombre de maladies endocriniennes furent ainsi identifiées entre 1825 et 1932, malgré l'absence d'une connaissance du rôle physiologique de ces organes. Les premières expériences d'endocrinologie effectuées étaient des ablations d'organes sur des animaux afin d'en caractériser les effets physiologiques. On a ensuite observé que de remettre l'organe en place ou d'injecter un extrait de cet organe restaurait les fonctions altérées. C'est à partir de ces expériences qu'est née la notion d'hormone, qui vient du grec "hormân" qui signifie exciter. À partir du début du XXe siècle, on a commencé à isoler ces hormones et à définir leurs fonctions précises, ce qui a donné lieu à de nombreux prix Nobel.
Le système endocrinien est maintenant très bien caractérisé et comprend plusieurs glandes endocrines:
• La thyroïde, produisant les hormones thyroïdiennes régulant le métabolisme à de mutliples niveaux, ainsi que la calcitonine qui régule le calcium sanguin.
• La parathyroïde qui produit la parathormone régissant la concentration de calcium de concert avec la calcitonine.
• La glande surrénale composée de la médullo-surrénale, produisant les catécholamines, et la corticosurrénale synthétisant les glucocorticoïdes, les minéralocorticoïdes ainsi que des androgènes.
• Le pancréas endocrine produisant l'insuline et le glucagon nécessaires à
l'homéostasie du glucose. Il produit aussi la somatostatine qui exerce diverses actions inhibitrices, notamment sur la relâche des hormones pancréatiques.
• La glande pinéale qui régule le rythme circadien par la sécrétion de mélatonine. • Les ovaires et les testicules, organes sexuels qui produisent respectivement les
oestrogènes et la testostérone.
• L'hypothalamus, qui relie le système nerveux somatique, le système nerveux autonome et le système endocrinien .
•
•
•
1. RÔLE DE L'HYPOPHYSE
L'hypophyse, aussi appelée glande pituitaire, a longtemps été un organe mystérieux. Hippocrate (-460-377 av. J.-C.), Claude Galien (-131-201) et André Vésale (1514-1564) lui attribuèrent tous un rôle d'évacuation du mucus provenant du cerveau. D'ailleurs, pituite (du latin pituita) signifie "mucosité". Des expériences de la fin du 1ge et du début du 20e siècle ont permis de faire la lumière sur les rôles de l'hypophyse. En 1887, Minkowski fut le premier à associer une expansion de l'hypophyse à des symptomes cliniques. En 1892, Vassale et Sacchi font l'ablation de l'hypophyse et observent que le métabolisme de l'eau et des minéraux sont affectés. La même année, Massalongo attribue l'acromégalie à un hyperfonctionnement de la glande. En 1909, Ascher montre que l'hypophysiectomie chez un animal en croissance cause le nanisme. Le rapprochement entre les organes reproducteurs et l'hypophyse est fait en 1910 par le groupe de Harvey Williams Cushing. Toutes ces expériences et de nombreuses autres ont amené les chercheurs à considérer l'hypophyse comme la glande maîtresse, puisqu'elle est située juste en dessous du cerveau et contrôle de multiples organes cibles .
Nous savons aujourd'hui que l'hypophyse est composée de trois lobes d'origine embryonnaire distincte. Le lobe antérieur (pars distalis) et intermédiaire (pars intermedia) sont d'origine ectodermique, tandis que le lobe postérieur (pars nervosa) a une origine neurale (161). Le lobe antérieur produit et sécrète six hormones: l'ACTH, la LH/FSH, la GH, la PRL et la TSH, alors que le lobe intermédiaire produit l'a-MSH. Le lobe postérieur sécrète la vasopressine et l'ocytocine. Ces hormones régulent les processus vitaux tels le métabolisme, la croissance, le comportement et la reproduction.
1.1 LE LOBE POSTÉRIEUR
Le lobe postérieur de l'hypophyse est composé principalement de cellules gliales et de fibres neuronales. Le noyau de ces neurones se situe dans les noyaux supraoptiques et paraventriculaires de l'hypothalamus. Les hormones du lobe postérieur, la vasopressine, ou ADH (hormone anti-diurétique), et l'ocytocine, sont toutes deux produites au niveau de l'hypothalamus, mais relâchées au niveau du lobe postérieur (212,308). Le lobe postérieur est donc un site de stockage plutôt qu'une glande endocrine .
•
•
•
Le rôle principal de la vasopressine est de contrôler l'osmolarité sanguine . L'hyperosmolarité et l'augmentation du volume sanguin sont détectées par des osmorécepteurs et barorécepteurs, cellules sensorielles qui surveillent respectivement les changements de concentration sanguine (ions inorganiques et solutés organiques) et de pression. En réponse à ces stimuli, la vasopressine est relâchée et agit via trois récepteurs membranaires. Le récepteur V1 dans les vaisseaux sanguins amène une contraction des muscles lisses pour augmenter la pression sanguine. Dans les tubules rénaux, la vasopressine se lie au récepteur V2 permettant la réabsorption de l'eau, concentrant ainsi l'urine. Enfin, le récepteur V3, dans l'hypophyse, entraîne une augmentation de la production d'ACTH, particulièrement dans les cellules corticotropes adénomateuses (136). L'ocytocine stimule les contractions des muscles lisses de l'utérus lors de l'accouchement. Elle facilite aussi le transport du sperme pour favoriser la fécondation, ainsi que les contractions des cellules myoépithéliales autour des alvéoles mammaires pour éjecter le lait lors de l'allaitement (42).
1.2
LE LOBE INTERMÉDIAIRELes cellules du lobe intermédiaire produisent principalement l'a-MSH qui régule la pigmentation. L'a-MSH stimule les mélanocytes pour la production de la mélanine, un pigment brun qui est responsable de la coloration de la peau et du poil. Le lobe intermédiaire n'est pas présent chez tous les vertébrés. \1 est présent chez la souris, mais chez l'homme il disparaît à la 16e semaine de gestation (161). Les animaux qui peuvent changer de couleur pour se camoufler dans leur environnement ont un lobe intermédiaire très développé (42).
1.3
LE LOBE ANTÉRIEURLe lobe antérieur est composé de cinq types cellulaires produisant chacune une hormone différente. La production des hormones hypophysaires est stimulée par divers
peptides hypothalamiques, formant un axe hypothalamo-hypophysaire
(209,217,492,493). La tige pituitaire (pars tuberalis) connecte l'hypophyse à
l'hypothalamus via le système porte hypothalamo-hypophysaire. La neuro-endocrinologie est née de la découverte de cette relation directe entre les fonctions neurales et le système endocrinien de l'hypophyse. Les hormones hypophysaires stimulent ensuite leur tissu cible pour la production d'une hormone, qui exerce ses actions biologiques et effectue un rétro-contrôle négatif au niveau hypothalamique et
•
•
•
hypophysaire (42,212). Un résumé des différents types cellulaires hormonaux hypophysaire est présenté au tableau 1.1. L'hypophyse contient aussi un type cellulaire non-endocrinien, les cellules folliculo-stellaires.
1.3.1 LES CELLULES FOLLICULO-STELLAIRES
Les cellules follicullo-stellaires (CFS), constituant 5 à 10% de l'hypophyse antérieure, sont caractérisées par leur forme étoilée et leur capacité à former des follicules, d'où leur nom. Les CFS ne produisant pas d'hormones, elles sont souvent considérées uniquement comme des cellules de soutien. Toutefois, puisqu'elles sécrètent plusieurs facteurs de croissance tels FGF, VEGF et IL-6 et qu'elles entourent les cellules endocriniennes avec leurs longues extensions cytoplasmiques, plusieurs font l'hypothèse qu'elles régulent de façon paracrine les cellules endocriniennes, formant un réseau cellulaire qui coordonne les activités de cellules distantes (16,177,248). D'autres études ont proposé qu'elles pourraient avoir un rôle immunitaire de phagocytose au niveau hypophysaire (234). D'autre part, les CFS expriment le facteur de transcription Pitx1 (voir section 2.3.1), semblant indiquer qu'elles se différencient à partir du même primordium que les cellules hormonales. De plus, on a montré que les CFS peuvent se différencier en muscle squelettique, suggérant un caractère multipotent à ce type cellulaire. Ces observations ont amené certains auteurs à considérer les CFS comme des cellules souches hypophysaires (234,249). Ces spéculations restent toutefois à
démontrer.
1.3.2 LES CELLULES THYRÉOTROPES
Les cellules thyréotropes sont les plus petites de l'hypophyse et contiennent de petits granules de sécrétion. Elles sont responsables de la production de la TSH (thyroid-stimulating hormone), stimulée par la TRH (thyrotropin releasing hormone) provenant des noyaux paraventriculaires et dorsomédians hypothalamiques. La TSH est une hormone glycoprotéique constituée de deux sous-unités. La sous-unité a des hormones glycoprotéiques (aGSU) est commune aux hormones TSH, LH et FSH, tandis que la sous-unité ~ confère la spécificité de l'hormone. La TSH stimule la production des hormones thyroïdiennes: la thyroxine (T4) et la triiodothyronine (T3). Les hormones thyroïdiennes ont de nombreux rôles physiologiques. Elles sont requises pour la croissance, la maturation des os et la différenciation du système nerveux et elles accentuent l'effet de la GH sur la croissance. De plus, elles régulent la thermogenèse en
•
•
•
accélérant le métabolisme basal par l'augmentation de la phosphorylation oxydative mitochondriale (42,212). Chez l'adulte, l'hypothyro·idie se manifeste entre autre par un ralentissement du métabolisme basal, une hypothermie, une léthargie et une diminution des aptitudes mentales. Les signes cliniques de l'hypothyroïdie congénitale, appelée crétinisme, sont une petite taille disproportionnée et une arriération mentale. L'hyperthyroïdie est caractérisée par une accélération du métabolisme, une tachycardie, une perte pondérale et de la nervosité (308).
1.3.3 LES CELLULES GONADOTROPES
Les cellules gonadotropes sont une population hétérogène. La plupart des cellules gonadotropes produisent les gonadotropines soient LH et FSH. Toutefois, certaines cellules ne produisent qu'une seule des deux hormones. La production hormonale des cellules gonadotropes est stimulée par la GnRH (gonadotropin releasing-hormone) produite dans les noyaux préoptique et arqué de l'hypothalamus. La LH et la FSH agissent sur les gonades, soient les ovaires et les testicules.
Chez l'homme, la LH stimule la production de testostérone par les cellules de Leydig. La testostérone exerce un rétro-contrôle négatif au niveau de l'hypothalamus et de l'hypophyse. Dans les cellules de Sertoli, la FSH contribue à la spermatogenèse de concert avec la testostérone. Chez la femme, la sécrétion de FSH et de LH varie en fonction d'un cycle de 28 jours. En début de cycle, la FSH provoque la maturation du follicule ovarien (le follicule de De Graaf), tandis que la LH est nécessaire à la rupture du follicule lors de l'ovulation ainsi qu'au maintien des fonctions du corps jaune, synthétisant la progestérone. La LH et la FSH stimulent toutes deux la production des œstrogènes qui, comme la testostérone, exercent un rétro-contrôle négatif hypothalamique et hypophysaire. La relâche hypophysaire de FSH est aussi inhibée par l'inhibine, produite par les ovaires et les testicules. Une hyposécrétion de LH ou de FSH entraîne une absence de maturation sexuelle (308).
1.3.4 LES CELLULES SOMATOTROPES
Les cellules somatotropes produisent l'hormone de croissance (GH). Cette production hormonale est stimulée par la GHRH (Growth hormone releasing hormone) produite par le noyau arqué de l'hypothalamus. La production de la GH est aussi stimulée par la ghréline, produite par les tissus périphériques. La somatostatine, produite par
•
•
•
l'hypothalamus, inhibe la sécrétion de la GH (42). La GH exerce un rôle sur la croissance des os et des muscles squelettiques via les somatomédines, principalement IGF-I, produites par le foie (308). Chez l'enfant, l'hypersécrétion entraîne le gigantisme et l'hyposécrétion cause le nanisme. Chez l'adulte, une augmentation de la GH cause l'acromégalie, caractérisée par l'hypertrophie des régions osseuses qui demeurent sensibles à la GH, notamment les os des mains, des pieds et du visage. L'hypersécrétion est le plus souvent causée par une tumeur hypophysaire.
1.3.5 LES CELLULES LACTOTROPES
Les cellules lactotropes produisent la PRL, importante pour la lactation. D'ailleurs, chez la femme enceinte, le nombre de cellules lactotropes augmente considérablement et demeure élevé durant la période de l'allaitement. La PRL retarde aussi le retour de l'ovulation après l'accouchement. En effet, l'hyperprolactinémie inhibe l'axe gonadotrope. Chez l'homme, il a été montré que la PRL joue un rôle dans le contrôle du nombre de récepteurs à LH dans les cellules de Leydig. La dopamine produite par l'hypothalamus inhibe la sécrétion de PRL, tandis que la TRH stimule sa production. Les œstrogènes ainsi que la tétée du nourrisson ont une action positive sur la sécrétion de la PRL (42,308).
1.3.6 LES CELLULES CORTICOTROPES
Les cellules corticotropes sécrètent l'ACTH, clivée à partir de la pro-opiomélanocortine (POMC). La transcription du gène de la POMC ainsi que la sécrétion d'ACTH sont stimulées par le CRH (corticotropin releasing hormone) produit par le noyau paraventriculaire antérieur de l'hypothalamus. La vasopressine a aussi un rôle positif sur
la production d'ACTH (353,413). L'ACTH contrôle la production des Gc
(glucocorticoïdes) par la zone fasciculée de la glande surrénale. Chez l'homme, le principal Gc produit est le cortisol, tandis que chez la souris, il s'agit de la corticostérone. Les Gc ont de nombreuses actions biologiques et exercent un rétro-contrôle négatif au niveau de l'hypothalamus et de l'hypophyse (42,212,308) .
•
•
•
Tableau 1.1: Types cellulaires hormonaux du lobe antérieur hypophysaire.
Thyréotropes -5% TSH Croissance et activité de la thyroïde TRH
Croissance du follicule ovarien FSH
Spermatogenèse
Gonadotropes -15-20% GnRH
Ovulation
LH Développement des testicules Synthèse de testostérone
Somatotropes -50% GH Développement des tissus Croissance des os longs
GHRH Somatostatine -10% (mâles) Développement mammaire Lactotropes -30% PRL (femelle Lactation Dopamine gestante)
Corticotropes -10% ACTH Activité de la glande surrénale CRH
1.3.6.1 Effets des glucocorticoïdes sur le métabolisme
Les Gc augmentent le glucose sanguin par leur action sur le glycogène et sur le métabolisme du glucose, des lipides et des protéines. Dans le foie, ils stimulent la synthèse et le stockage de glycogène en augmentant l'activité de l'enzyme glycogène synthase et inhibent la glycogène phosphorylase, qui dégrade le glycogène. Ils régulent le métabolisme du glucose en activant la glucose-6-phosphatase et la
phosphoenolpyruvate carboxykinase, enzymes hépatiques nécessaires à la
néoglucogenèse. De plus, ils diminuent l'utilisation du glucose par les cellules musculaires et adipeuses, ce qui entraîne la protéolyse musculaire et la lipolyse des gras. Les acides gras libres et les acides aminés circulant pourront alors servir de substrats pour la néoglucogenèse. De cette façon, une résistance à l'insuline est entraînée contribuant aussi à l'augmentation du glucose sanguin.
1.3.6.1.1 Effets sur le système immunitaire
Les Gc inhibent la réponse immunitaire à de multiples niveaux. Ils réduisent le nombre de lymphocytes et d'éosinophiles et mobilisent les neutrophiles de la paroi vasculaire
•
•
•
vers la circulation sanguine. Ils inhibent aussi la différenciation des monocytes en macrophages, ainsi que l'activité des macrophages. Enfin, ils réduisent l'inflammation locale en inhibant l'action des histamines et de l'activateur du plasminogène ainsi que la synthèse des prostaglandines.
1.3.6.1.2 Effets sur les fluides et la pression sanguine
Les Gc augmentent la pression sanguine par plusieurs mécanismes. Ils ont une action minéralocorticoïde discrète mais réelle, favorisant la rétention d'eau et de sodium et la fuite de potassium. Dans les vaisseaux sanguins, ils augmentent la sensibilité aux agents vasopresseurs tels les catécholamines et l'angiotensine Il, tout en réduisant la dilatation endothéliale entraînée par l'oxyde nitrique (NO). De plus, ils sont requis pour le bon fonctionnement du système sympatho-surrénalien. Chez l'homme, l'absence de Gc peut entraîner un collapsus vasculaire qui peut être léthal.
1.3.6.1.3 Autres effets
Les Gc ont de multiples autres rôles. Dans la peau, ils inhibent la division cellulaire au niveau de l'épiderme et réduisent la production de collagène. Au niveau osseux, ils empêchent la fonction des ostéoblastes entraînant une résorption du squelette. Ils inhibent aussi l'absorption et augmentent l'excrétion du calcium. Ils ont aussi de nombreux rôles sur d'autres systèmes hormonaux. En effet, ils stimulent la production de GH, ils sont nécessaires pour la synthèse des catécholamines et sont requis conjointement avec la PRL pour la lactation. Ils sont aussi essentiels pendant le développement embryonnaire lors de la maturation des poumons pour la synthèse du surfactant pulmonaire. Enfin, dans le cerveau, le récepteur des Gc est exprimé dans l'hippocampe, l'hypothalamus, le cervelet et le cortex. Son rôle dans ces tissus n'est toutefois pas bien connu. Cependant, les observations cliniques de patients en excès ou déficience en Gc montrent bien un rôle important au niveau cérébral.
1.3.6.1.4 Symptomes associés aux excès et déficits en glucocorticoïdes
Les Gc ayant de multiples rôles, un déficit ou un excès ont par conséquent des effets importants. Une hypersécrétion (syndrome de Cushing) peut entraîner l'apparition d'un diabète, une redistribution de la masse graisseuse, une hypertension artérielle, une rétention d'eau, une fragilité cutanée, un déficit musculaire par hyper-catabolisme, une ostéoporose et divers problèmes psychiatriques. Les raisons de l'apparition du
•
•
•
syndrome de Cushing peuvent être une tumeur de la glande corticosurrénale, une tumeur hypophysaire ou une tumeur ectopique sécrétant de l'ACTH. Le déficit en Gc (comme par exemple la maladie d'Addison) entraîne une diminution des taux plasmatiques de sodium et une augmentation du potassium, une hypoglycémie, une déshydratation, une asthénie et une hypotension artérielle.
1.3.6.1.5 Modèles murins de déficit en glucocorticoïdes
La souris
GR-I-Les souris dont le gène du récepteur des Gc est invalidé meurent peu après la naissance par insuffisance respiratoire causée par une atélectasie pulmonaire. Le foie des nouveaux-nés a une capacité réduite d'activation des enzymes de la néoglucogenèse. La rétro-action au niveau de l'hypothalamus et de l'hypophyse étant impossible, les niveaux d'ACTH et de corticostérone sont très élevés, entraînant une hyperplasie surrénalienne. On retrouve aussi différents défauts du système immunitaire tels une absence d'apoptose des thymocytes ainsi qu'un défaut de prolifération des précurseurs érythroïdes (115) .
La souris
CRH-I-Le CRH est un peptide de 41 acides aminés clivé à partir d'une préprohormone de 191 acides aminés. Le CRH n'est pas seulement produit par l'hypothalamus, mais aussi dans des tissus périphériques comme les lymphocytes T et le placenta (168,206,460). L'ablation génique du CRH a permis de confirmer son rôle essentiel dans la réponse au stress de l'axe HPA (387). Dans les souris CRH-/-, on observe une immunoréactivité normale pour l'ACTH, montrant que le développement des cellules corticotropes ne dépend pas de la présence du CRH. Toutefois, les souris CRH-/- présentent une hypoplasie de la zone fasciculée ainsi que des niveaux trois fois plus bas de Gc que dans les souris de type sauvage. De plus, elles ne démontrent pas d'augmentation des Gc lors d'un test de réponse au stress.
Lors d'une épreuve de jeûne, les souris contrôles ne démontrent pas de diminution du glucose sanguin tandis que les souris CRH-/- développent une hypoglycémie après 24h, démontrant le rôle essentiel de l'axe HPA dans la régulation du métabolisme du glucose . Enfin, des croisements homozygotes entraînent une mort rapide des nouveaux-nés à
•
•
•
cause d'une dysplasie pulmonaire, causée par la diminution des Gc. La supplémentation en corticostérone chez la mère homozygote permet toutefois d'obtenir des portées viables, montrant que les Gc maternels peuvent compenser le manque chez les embryons.
Les souris
CRHr-/-Le récepteur du CRH est un récepteur couplé aux protéines G (331,387). Il existe deux récepteurs du CRH encodés par deux gènes différents, CRHr-1 et CRHr-2. Ils ont chacun des affinités différentes pour le CRH ainsi que des patrons d'expression distincts. Les deux sont exprimés dans le cerveau, mais CRHr-1 est préférentiellement exprimé dans le cerveau tandis que CRHr-2 est principalement exprimé dans les tissus périphériques (84,87,95,278,347,348,429,588). Chez le rat, CRHr-1 est le seul exprimé dans l'hypophyse, tandis que chez le singe, les deux récepteurs sont présents (485). Par ailleurs, une étude chez la souris a montré que les deux récepteurs sont exprimés dans l'hypophyse, mais que seul CRHr-1 médie la réponse au CRH. Les auteurs suggèrent que l'expression hypophysaire de CRHr-2 est vasculaire et non hypopophysaire (389). Cependant, même si les souris CRHr-2-1- ont une fonction de l'axe HPA relativement normale, elles présentent une interruption précoce de la relâche d'ACTH, suggérant un rôle du CRHr-2 dans le maintien de l'axe HPA (23,123).
L'analyse des souris CRHr-1-1- a montré que ce récepteur était le plus important dans la régulation de l'axe HPA. En effet, les souris CRHr-1-1- subissant un test de réponse au stress n'ont pas d'augmentation de l'ACTH ou des Gc sanguins. La fasciculée de la surrénale est hypoplasique. Comme pour les souris CRH-I-, les croisements homozygotes entraînent la mort des nouveaux-nés causée par une dysplasie du poumon, engendrée par une réduction des niveaux de Gc. Ces souris ont aussi un comportement moins anxieux. L'invalidation génique conditionnelle a montré que cette diminution d'anxiété était due à l'expression au niveau du cerveau du CRHr-1 (390,516,522,566).
La souris
•
•
•
1.3.6.1.6 Mécanisme d'action des Gc
Les effets biologiques des Gc sont exercés par leur liaison à un récepteur cytoplasmique, GR (glucocorticoid receptor). GR appartient à la famille des récepteurs des hormones stéroïdiennes comprenant le récepteur de la progestérone (PR), des minéralocoticoïdes (MR), des androgènes (AR) et des œstrogènes (ER). Tous ces facteurs font partie de la superfamille des récepteurs nucléaires comprenant les récepteurs de l'acide rétinoïque (RAR et RXR), des hormones thyroïdiennes (TR), ainsi que les récepteurs nucléaires orphelins qui n'ont pas de ligand (461). De façon générale, les récepteurs nucléaires sont constitués d'un domaine de transactivation en N-terminal et d'une région centrale liant l'ADN et médiant la dimérisation avec d'autres récepteurs nucléaires. La partie C-terminale est la moins conservée et contient un domaine de liaison au ligand ainsi qu'un autre domaine de transactivation (362). GR peut moduler l'expression des gènes de plusieurs façons: il peut se lier en homodimère sur l'élément GRE (GR response element) pour activer la transcription ou sur l'élément nGRE (negative GR response element) pour réprimer activement la transcription. Il agit aussi en monomère avec d'autres facteurs de transcription pour réprimer certains gènes cibles par un mécanisme appelé transrépression (134) .
La transrépression par les récepteurs nucléaires
Les facteurs de transcription NF-kB et AP-1 sont connus depuis longtemps pour leur rôle dans l'induction de gènes médiant la réponse inflammatoire. Ils sont d'ailleurs impliqués dans de multiples pathologies provenant d'une activation chronique du système immunitaire comme l'asthme, l'athérosclérose, les maladies intestinales inflammatoires et les maladies auto-immunes telles la sclérose en plaques et la polyarthrite rhumatoïde. Plusieurs gènes immuno-régulateurs contiennent des éléments de réponse à NF-kB eVou AP-1, notamment, des cytokines et leurs récepteurs, des protéines chemoattractrices et des molécules d'adhésion (134).
Le facteur de transcription AP-1, composé d'homodimères ou d'hétérodimères des membres de la famille Jun et Fos, régule plusieurs aspects de la prolifération cellulaire (510). NF-kB est un facteur de transcription hétérodimérique composé des sous-unités p50/p105 (NF-kB1), p65/RelA, p52/100 (NF-kB2), c-Rel et ReIB. NF-kB est localisé dans le cytoplasme par son association à la protéine inhibitrice IkB. L'activation de la voie NF-kB entraîne une phosphorylation de INF-kB par IKK, la dirigeant vers la dégradation par le
•
•
•
protéasome. NF-kS peut alors être transloqué au noyau et activer ses gènes cibles (265). La voie NF-kS peut être stimulée par des cytokines pro-inflammatoires (IL-1 et TNF), des sous-produits d'organismes pathogènes ou des stimuli pro-apoptotiques et nécrotiques (265). NF-kS et AP-1 peuvent interagir avec certains membres de la famille des récepteurs nucléaires, notamment GR, ce qui résulte en un antagonisme mutuel appelé transrépression (72,261,494,496,609). Les mécanismes de transrépression médiés par GR jouent un rôle primordial dans le rôle immunosuppresseur et anti-inflammatoire des glucocorticoïdes.
Le modèle initial de transrépression impliquait le titrage de facteurs, c'est-à-dire le déplacement d'une protéine liée à l'ADN par l'interaction physique avec une autre protéine. Toutefois, les travaux récents sur la transrépression semblent suggérer que le mécanisme est plus complexe. En effet, des études d'immunoprécipitation de la chromatine ont montré que GR n'empêchait pas la liaison à l'ADN de NF-kB. Les auteurs ont montré que GR interférait plutôt avec la phosphorylation de l'ARN polymérase Il, nécessaire à son activation, la mettant ainsi dans un état de pause (407). Une hypothèse controversée a aussi suggéré que la compétition pour les coactivateurs pourrait être responsable de la transrépression (134). Enfin, d'autres travaux ont suggéré que le mécanisme de transrépression pourrait reposer sur l'action de coactivateurs (463). Il a été démontré que la transrépression entre AP-1 et GR sur l'élément de réponse col3A impliquait la liaison à TIF2/GRIP1, un coactivateur, et potentialisait la répression (463). En somme, tous ces résultats suggèrent qu'il existe probablement plus d'un mécanisme moléculaire pour le phénomène de transrépression, dépendant du contexte du promoteur.
Depuis la découverte des mécanismes de transrépression entre GR/AP-1 et GR/NF-kS, des phénomènes similaires ont pu être observés avec d'autres récepteurs nucléaires et facteurs de transcription: GR et Nur77, GR et smad3/4, PPARa et NF-kS, PPARa et AP-1, ER13 et NF-kS n'en sont que quelques exemples (103,143,262,432,529) .
•
•
•
2.
ONTOGENÈSE HYPOPHYSAIRE2.1
ORIGINE EMBRYONNAIRE ET INDUCTION DE LA POCHE DE RATHKEMartin Rathke, en 1838, a suggéré que l'hypophyse provenait d'une invagination dorsale de la portion stomodéale du tractus digestif au niveau de la plaque orale. Ceci avait toutefois été extrapolé à partir d'observations. Il a fallu attendre plusieurs années avant que ces observations ne soient prouvées. En effet, les expériences des vingt dernières années ont permis de démontrer l'origine hypophysaire dans plusieurs espèces, et ainsi de confirmer ce qui avait été suggéré plus de cent ans auparavant. De plus, les approches de biologie moléculaire ont permis de montrer que l'hypophyse est présente chez tous les vertébrés et que des tissus semblables à l'hypophyse existent même chez certains invertébrés marins. En effet, le "Hatschek's pit" présent chez l'amphioxus possède des cellules immunoréactives pour les gonadotropines ainsi que pour Pit-1, un facteur de transcription spécifique à l'hypophyse. Chez le tunicier, des cellules immunoréactives pour l'ACTH, PC1, PC2, la PRL et le GnRH on été détectées (270).
Au début des années 80, les premières expériences dévoilant l'origine hypophysaire ont été réalisées. Gérard Couly et Nicole Le Douarin ont effectué des expériences de transplantation caille-poulet et ont pu montrer que l'adénohypophyse provenait de la calotte ectodermique (anterior neural ridge, ANR) (124). L'ANR est un bourrelet qui apparaît comme un épaississement sur le périmètre antérieur de la plaque neurale (figure 1.1). Durant le développement, les cellules de l'ANR sont déplacées ventralement lors du repliement de la région de la tête et deviendront le stomodéum, qui formera les structures précoces de la bouche. Une invagination apparaîtra ensuite dans l'ectoderme oral pour former la poche de Rathke, structure précoce de l'hypophyse.
L'origine développementale de l'hypophyse chez la grenouille Xénopus a été étudiée par des transplantations de tissus radio-marqués dans des tissus non-marqués et à l'aide du mutant albino bufo. Les œufs de ce mutant ne possèdent pas de granules de mélanine, ce qui permet de le différencier de l'œuf hôte (165,268,269). Ces expériences de transplantation ont permis de montrer que l'ANR était l'exclusive source de cellules hypophysaires chez le Xénopus. Les cellules dérivées de l'ANR vont aussi former une structure similaire à la poche de Rathke (Figure 1.1) (269) .
•
•
•
Chez les mammifères, des expériences ont permis de tracer l'origine hypophysaire dans l'embryon de rat en utilisant un colorant, la carbocyanine dye Dil (288). Les auteurs ont montré que le primordium hypophysaire est localisé dans l'ectoderme extraneural, près de la partie rostrale de la plaque neurale. Dans ces expériences, l'épithélium du palais a aussi été marqué, montrant que les deux tissus sont associés, confirmant l'hypothèse que l'hypophyse est d'origine stomodéale chez le mammifère, comme chez le poulet (Figure 1.1). Toutefois, chez les mammifères plus évolués comme le rat et la souris, l'ANR est très peu visible et n'est pas exactement situé au même endroit que chez la grenouille et le poulet. D'ailleurs, si du Dil est appliqué sur la structure décrite comme l'ANR chez le poulet et la grenouille, la poche de Rathke est très peu marquée.
Chez la souris, le développement de l'hypophyse se fait en trois étapes. D'abord, il yale développement de la poche de Rathke rudimentaire (e9), la formation de la poche de Rathke définitive (e10.5) puis la différenciation terminale des six types cellulaires (e12.5-e17). Pendant que la poche de Rathke se développe, la partie postérieure du diencéphale s'évagine pour former l'infundibulum. Durant tout le développement de la glande, cet épithélium neural reste en contact étroit avec les cellules de la poche de Rathke et de l'hypophyse, ce qui est très différent du reste de l'ectoderme oral qui est séparé du tissu neural par des dérivés du mésoderme et de la crête neurale. C'est cette invasion cellulaire qui donne lieu à une structure en forme de poche qui ressemble à une invagination de l'ectoderme oral. Le contact infundibulum-hypophyse est essentiel pour le développement de la glande. En effet, l'infundibulum produit de nombreuses molécules de signalisation importantes pour le développement hypophysaire (170,569). Des signaux provenant du mésenchyme ventral entourant la glande seront aussi nécessaires au développement hypophysaire. Je discuterai d'abord du patron d'expression de ces signaux ainsi que leurs différents rôles, pour ensuite aborder les facteurs de transcription essentiels au développement de la glande à travers les différentes étapes du développement (Figure 1.2) .
•
•
•
A Calotte ectodermique Plaque neural somitesB
Grenouille 3 somites plan dorsal e5.5 • Primordium hypothalamique ~ Primordium hypophysaire 10 somites plan ventral StomodeumAdapté de Couly et LeDouarin
poulet rat
Adapté de K. Kawamura et coll, Gen Comp Endocrinol, 2002
Figure 1.1. Origine hypophysaire chez les vertébrés. (A) Développement de l'hypophyse chez le poulet. (8) Diagramme comparant les primordium hypophysaire et hypothalamique chez la grenouille, le poulet et la rat. L'hypophyse dérive du bourrelet neural antérieur (en noir), structure très peu visible chez le rat. L'hypothalamus dérive de la plaque neural (en hachuré) .
•
•
•
Pltxl,2 Hesxl 151·1 Induction de la poche de Rathke (eg.5)Formation de la poche définitive (e11)
LhX4j~j· 151-1' .. GATA·2 ~ Formation de la poche rudimentaire (e9.S) Infundibulum BMP4 (e8.5·ell.5) FGF8 (e9.5·eI4.5) de Rathke Lhx3/4 Pltxl,2 Hesx1 151-1 . Prolifér~tion
et
différenciation cellulaire: e12-17toute la glande: Pitxl/2, Lhx3/4
,----,-_goncldolt~o~)e~: Isl-l, GATA-2, SFI
somato/lacto/thyréotropes: Pit-l corticotropes: Tpit, NeuroDl mélanotropes: Tpit
Figure 1.2. Représentation schématique du développement hypophysaire. Morphogenèse, molécules de signalisation et facteurs de transcription impliqués. G. 0-V: gradient dorso-ventral, G. V-D: gradient ventro-dorsal, PR: poche de Rathke .
•
•
••
2.2 LES MOLÉCULES DE SIGNALISATION
2.2.1 LES BMPS (BONE MORPHOGENie PROTEINS)
BMP4 est exprimé à partir de e8.5 dans l'infundibulum et s'éteint au jour e11.5
(170,569). Cette expression très précoce suggère qu'il serait un des premiers facteurs à
influencer la morphogenèse de la glande (170,569). Le rôle de ce facteur a d'abord été étudié dans des souris transgéniques où noggin, un antagoniste de BMP2/4, a été ectopiquement exprimé dans toutes les cellules hypophysaires sous le contrôle du promoteur de Pitx1, exprimé dans toute la glande. Dans ces souris, le développement hypophysaire s'arrête au jour e10. Tous les types cellulaires hypophysaires sont absents, sauf quelques cellules exprimant la POMC (569). Ce phénotype est très similaire à celui obtenu dans l'ablation génique de Lhx3, un régulateur précoce du développement hypophysaire (voir section 2.4.1). Les auteurs ont donc suggéré que BMP4 puisse être un facteur essentiel dans les phases initiales de l'induction hypophysaire (569). Dans les souris BMP4-1-, le développement de la glande est arrêté au stade de poche rudimentaire (553,602). Toutefois, puisque les souris BMP4-1-meurent à e10, soit au stade de la poche rudimentaire, une ablation génique conditionnelle sera nécessaire pour prouver hors de tous doutes le rôle de BMP4 dans le développement hypophysaire.
BMP2 est exprimé dans le mésenchyme ventral entourant la poche de Rathke à partir de e1 0, ce qui génère un gradient ventro-dorsal dans la glande. À partir de e12.5, BMP2 est aussi exprimé de façon intrinsèque dans l'hypophyse (170,569). Afin de tester le rôle de BMP2, un dominant négatif de BMP2/4, BMPR1A, a été exprimé dans l'hypophyse sous le contrôle du promoteur aGSU. aGSU est exprimé dans toute la glande à partir de e9 pour ensuite être restreinte à la partie rostrale, vers e12.5 (271). La présence de ce dominant négatif bloque la différenciation des cellules somatotropes, lactotropes et thyréotropes, tandis que les marqueurs des corticotropes et gonadotropes sont toujours exprimés (569). Ces résultats sont toutefois difficiles à interpréter puisque les effets observés pourraient être dus au blocage additionnel de l'activité de BMP4.
L'atténuation du signal BMP2 est aussi essentielle à la différenciation terminale des lignées. Lorsque l'expression de BMP2/4 est maintenue dans la glande sous le contrôle du promoteur aGSU, la différenciation des gonadotropes, des thyréotropes, des