Abondance et diversité des rotifères dans les mares de
thermokarst subarctiques
Mémoire
Paschale Noël Bégin
Maîtrise en biologie
Maître ès sciences (M.Sc.)
Québec, Canada
Résumé
Les mares de thermokarst, issues de la fonte du pergélisol, sont très abondantes dans le Nord et émettent des gaz à effet de serre par leur activité biogéochimique intense. Elles contiennent d’abondantes communautés de rotifères dont la diversité et le rôle écologique sont méconnus. Cette étude présente les résultats d’un échantillonnage réalisé dans les mares de thermokarst subarctiques en comparaison avec des plans d’eau sur des bassins rocheux avoisinants. Les analyses ont révélé la présence d’un total de 24 espèces de rotifères. Les rotifères étaient plus abondants dans les mares de thermokarst que dans les bassins rocheux, alors que la diversité n’y était pas différente. Les taux de filtration estimés par des expériences de broutage étaient de moins de 0.05% de la colonne d’eau par jour à l’échelle de la communauté, ce qui implique que les rotifères n’étaient pas limités par la disponibilité de la nourriture dans ces mares.
Abstract
Thermokarst ponds, which are the result of permafrost thawing and erosion, occur in high abundance throughout the North. These ecosystems play a key role as greenhouse gases emitters due to their intense biogeochemical activity. These ecosystems contain a high abundance of rotifers, but little is known about the diversity and ecological role of these microzooplankton in thermokarst waters. In the present study, sampling was conducted in subarctic thermokarst ponds (Nunavik, Canada), and compared with nearby rock-based lakes. The analyses revealed a total of 24 rotifer species. The abundance of rotifers was higher in thermokarst waters than in the rock-based lakes, while diversity was not significantly different. Grazing experiments gave estimates of total community clearance rates of <0.05% of the water column per day, implying that picoplankton growth rates would readily keep pace with this grazing pressure, and that rotifer populations are unlikely to be bottom-up limited by food availability.
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des figures ... ix
Liste des tableaux ... xi
Liste des abréviations et des sigles ... xiii
Remerciements ... xvii
Avant-propos ... xix
Contexte de l’étude ... xix
Contributions ... xix
1 Introduction générale ... 1
1.1 Problématique ... 3
1.2 Le réseau alimentaire microbien ... 6
1.3 Les rotifères ... 7
1.4 Abondance et diversité des rotifères ... 11
1.5 Facteurs influençant l’abondance et la diversité des rotifères ... 12
1.6 Objectifs et hypothèses ... 14
1.7 Méthodologie générale ... 15
1.7.1 Approche ... 15
1.7.2 Description de la région d’étude ... 15
1.7.3 Sites d’étude ... 17 1.7.4 Relevés de terrain ... 19 1.7.5 Échantillonnage ... 19 1.7.6 Analyses en laboratoire ... 19 1.7.7 Expériences ... 20 1.8 Plan du mémoire ... 22
2 Rotifer abundance, biodiversity and controlling variables in subarctic thermokarst lakes and ponds ... 23
Résumé ... 23
Abstract ... 23
2.1 Introduction ... 24
2.2 Material and methods ... 26
2.2.1 Study area and sites ... 26
2.2.2 Physico-chemical measurements ... 29
2.2.4 Zooplankton sampling ... 30
2.2.5 Grazing experiments ... 31
2.2.6 Statistical analysis ... 32
2.3 Results ... 33
2.3.1 Zooplankton community structure and abundance ... 33
2.3.2 Zooplankton diversity ... 37
2.3.3 Top-down versus bottom-up control ... 43
2.4 Discussion ... 46
2.4.1 Zooplankton community structure and abundance ... 46
2.4.2 Zooplankton diversity ... 48
2.4.3 Grazing rates and size dependency ... 50
2.4.4 Bottom-up versus top-down controls ... 51
2.5 Conclusions... 54
3 Conclusion générale ... 55
Bibliographie ... 61
Liste des figures
Figure 1.1 Schéma latéral d'un rotifère type. Figure et traduction intégrale du sous-titre
tirées de Wallace et Snell (2010), avec l'autorisation d'Elsevier Ltd. ... 1
Figure 1.2 Processus de formation des mares de thermokarst sises sur une butte minérale cryogène (lithalse). Figure adaptée de Calmels et al. (2008), avec l'autorisation
d'Elsevier Ltd. ... 3
Figure 1.3 Superficie occupée par des lacs en fonction de la latitude. La ligne noire représente les lacs dont le bassin versant est caractérisé par le pergélisol alors que la ligne grise représente les lacs des bassins versants où le pergélisol est absent. Données
extraites de la Figure 8 dans Grosse et al. (2013). ... 4
Figure 1.4 Relations entre le réseau alimentaire microbien et la chaîne alimentaire
classique. Figure inspirée de Kalff (2002). ... 6 Figure 1.5 Rotifères représentatifs de différents genres. Monogonontes: (A) Asplanchna,
(B) Euchlanis, (C) Keratella (position latérale), (D) Polyarthra, (E) Synchaeta; Bdelloides: (F) Philodina, (G) Rotaria. Figure et traduction intégrale du sous-titre
tirées de Wallace et Snell (2010), avec l'autorisation d'Elsevier Ltd. ... 8
Figure 1.6 Cycle de reproduction des Monogonontes. Figure tirée de Campillo et al.
(2011), avec l'autorisation de Springer. ... 10
Figure 2.1 Map of the study area, eastern Hudson Bay. ... 27 Figure 2.2 Photographs of the subarctic sampling sites. Two sites were located in the
vicinity of the Inuit community of Umiujaq: a) Nastapoka River valley (NAS) and b) Bundesanstalt für Geowissenchaften und Rohstoffe site in the Sheldrake river valley (BGR). Three additional sites were located in the vicinity of the Cree and Inuit
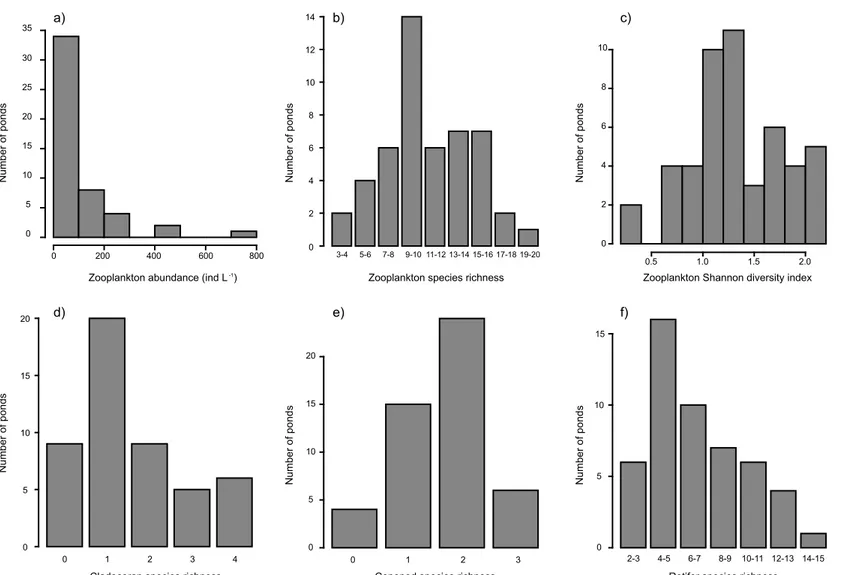
community of Whapmagoostui-Kuujjuarapik: c) Kwakwatanikapistikw River valley (KWK), d) Sasapimakwananisikw River vakket (SAS) and e) the rock-basin reference lakes (RBL). ... 28 Figure 2.3 Distribution of zooplankton in the 50 surveyed ponds. a) total zooplankton
abundance; b) total zooplankton species richness; c) total zooplankton Shannon diversity; d) cladoceran species richness; e) copepod species richness; and f) rotifer species richness. ... 35 Figure 2.4 Analyses of variance of the rotifer data with the different sites as factors.
a) abundance (the boxplots with different letters show significant differences between sites); b) species richness; c) Shannon diversity index; d) Simpson diversity index; e) Hellinger mean distance between ponds (beta diversity) . ... 36 Figure 2.5 Heat map of the rotifer community composition and their clustering according to
the Unweighted Pair-Group Method using arithmetic Averages (UPGMA) performed on a chord distance matrix (Borcard et al., 2011). The darker shading represents the dominant species. ... 38
Figure 2.6 Redundancy analysis of rotifer species and the Shannon diversity index (dashed grey lines) constrained by environmental variables (solid black lines) in 33 thermokarst ponds. ... 40 Figure 2.7 Vertical distribution of zooplankton and associated temperature (black) and
oxygen (red) profiles in four thermokarst ponds and the reference rock-basin
waterbody Iqalussiuvik Lake. ... 42 Figure 2.8 Zooplankton diurnal vertical profiles from 18h00 August 2nd to 12h00 August
3rd 2013, in SAS2A pond. The band widths are proportional to the percentage of
biomass found at the discrete depths.. ... 44 Figure A1.1 a) Rotifer absolute abundance (ind L-1) b) Zooplankton relative abundance
(% concentration) c) Zooplankton community composition (% biomass). Color key: grey, rotifers; green, cladocerans; orange, copepods; blue, Chaoborus sp. ... 69 Figure A1.2 a) Cladeoceran absolute abundance (ind L-1) b) Copepod absolute abundance
(ind L-1) c) Chaoborus absolute abundance (ind L-1). Color key: green, cladocerans;
orange, copepods; blue, Chaoborus sp. ... 70 Figure A3.1 Photomicrographies d’espèces de rotifères: a) Philodina sp. dans RBL4KM;
b) Collotheca sp. dans RBLOL; c) Conochilus unicornis dans RBLOL; d) colonie de
Conochilus unicornis dans RBLIQ; e) Pompholyx sp. dans RBLOL; f) Anuraeopsis fissa dans KWK06. ... 72
Figure A3.2 Photomicrographies d’espèces de rotifères: a) Ascomorpha sp. dans RBLOL; b) Asplanchna sp. dans RBLOL; c) Colurella sp. dans RBLOL; d) Gastropus stylifer dans SAS2C; e) Kellicottia longispina dans RBLIQ. ... 73 Figure A3.3 Photomicrographies d’espèces de rotifères du genre Keratella: a) K. cochlearis
dans RBLOL; b) K. serrulata dans SAS1B; c) K. tecta dans RBLCA; d) K. testudo dans SAS2A. ... 74 Figure A3.4 Photomicrographies d’espèces de rotifères: a) Lecane sp. dans RBLOL;
b) Lepadella sp. dans RBLWP1; c) Monommata sp. dans SAS1B; d) Monostyla copeis dans RBLPOOL2; e) Ploesoma sp. dans SAS1E. ... 75 Figure A3.5 Photomicrographies d’espèces de rotifères: a) Polyarthra euryptera dans
SAS1A; b) Polyarthra remata dans RBLOL; c) Synchaeta sp. dans RBLOL;
d) Trichocerca sp. dans RBLOL; e) Trichotria sp. dans SAS1B. ... 76 Figure A3.6 Photomicrographies de cladocères: a) Bosmina longirostris dans RBLIQ;
b) Chydorus sphaericus dans SAS1B; c) Holopedium gibberum dans RBLOL;
d) Polyphemus pediculus dans RBLPA; e) Daphnia pulex dans SAS1C. ... 77 Figure A3.7 Photomicrographies de copépodes: a) Calanoïde dans RBLIQ; b) Cyclopoïde
dans RBLOL; c) Nauplii dans SAS2A. ... 78 Figure A3.8 Photomicrographies de rotifères ayant ingéré des microsphères fluorescentes:
Liste des tableaux
Tableau 1.1 Sites d'étude et coordonnées géographiques des 50 mares échantillonnées. .... 18 Tableau 2.1 Rotifer taxa identified at the surface of lakes and ponds at the 5 subarctic sites,
and their potential food sources as indicated by the literature (Pourriot, 1977; Sanders
et al., 1989; Walz, 1995). ... 34
Tableau 2.2 Median and range of the physical and biological variables for the surface waters of 50 ponds sampled in August 2012. ... 39 Tableau 2.3 Mean clearance rates (nL ind-1 h-1) determined with microspheres (0.5 to
6.0 µm diameter) for four rotifer species in samples from thermokarst pond KWK12, August 2013. ... 45 Tableau 2.4 Mean clearance rates (nL ind-1 h-1) determined with microspheres (0.5 to
6.0 µm diameter) for four rotifer species in reference rock basin lake RBROL, August 2013. ... 45 Tableau 2.5 Maximum filtering rate, density and daily filtration as a percentage of the water column in thermokarst pond KWK12.. ... 47 Tableau 2.6 Maximum filtering rate, density and daily filtration as a percentage of the water column in the reference rock basin lake. ... 47 Annexe 2 Physical and biological variables for the 50 ponds sampled in August 2012. .... 71
Liste des abréviations et des sigles
Chl a: Chlorophyll a (Chlorophylle a)
CDOM: Chromophoric dissolved organic matter (Matière organique dissoute colorée) DOC: Dissolved organic carbon (Carbone organique dissous)
CR: Clearance rate (Taux de filtration)
CTD: Conductivity-temperature-depth (Conductivité-température-profondeur) GHG: Greenhouse gases (GES, Gaz à effet de serre)
HNF: Heterotrophic nanoflagellates (Nanoflagellés hétérotrophes)
HPLC: High pressure liquid chromatography (Chromatographie liquide à haute pression) RDA: Redundancy analysis (Analyse de redondance)
TN: Total nitrogen (Azote total) TP: Total phosphorus (Phosphore total)
It has long been an axiom of mine that the little things are infinitely the most important.
Remerciements
Je souhaiterais tout d’abord remercier mon directeur, Dr Warwick F. Vincent, de m’avoir confié ce projet. Votre passion et votre dévouement pour la science font de vous un chercheur ainsi qu’un pédagogue d’exception. C’est un réel plaisir d’évoluer au sein de votre équipe.
J’aimerais également exprimer ma gratitude envers le Dr Louis Fortier (Chaire de recherche du Canada sur la Réponse des écosystèmes marins arctiques au réchauffement climatique, Professeur titulaire au Département de biologie de l’Université Laval) et la Dre Milla Rautio (Chaire de recherche du Canada en écologie aquatique boréale, Professeure au Département des sciences fondamentales de l’Université du Québec à Chicoutimi) d'avoir participé à mon comité d’encadrement et d’évaluation. Vos précieux conseils tout au long de ce projet ont été grandement appréciés.
Un grand merci aux membres de l’équipe ADAPT qui m’ont apporté un appui crucial et enthousiaste sur le terrain et au laboratoire: Jérôme Comte, Anna Przytulska-Bartosiewicz, Maciej Bartosiewicz, Bethany Deshpande, Sophie Crevecoeur et Alex Matveev. Le groupe de recherche du professeur Warwick F. Vincent fait partie du Centre d’études nordiques (CEN) dont les infrastructures et le réseau rendent possible le déroulement d’activités de recherche concertées sur le terrain. Cette étude s’inscrit dans le cadre du projet Arctique en Développement et Adaptation au Pergélisol en Transition (ADAPT) qui bénéficie du financement du programme Frontières de la découverte du Conseil de recherches en sciences naturelles et en génie du Canada (CRSNG). Une bourse de maîtrise en recherche du Fonds de recherche du Québec - Nature et technologies (FRQNT) et du soutien de recherche (incluant la logistique) du Réseau de centres d’excellence ArcticNet ont aussi contribué au succès de ce projet. Le Programme de formation scientifique dans le Nord (PFSN) a contribué à la logistique sur le terrain.
Merci à Marie-Josée Martineau pour son aide précieuse avec les analyses HPLC et à Jérôme Comte pour ses conseils judicieux sur les analyses statistiques, de diversité et de cytométrie. J’aimerais également remercier Isabelle Laurion de nous avoir permis d’utiliser
ses laboratoires à l’INRS où nous avons réalisé les analyses de cytométrie en flux et la microscopie.
Enfin, je souhaite remercier ma famille qui m’apporte un soutien indéfectible. Je suis particulièrement reconnaissante envers mes parents qui m’ont transmis très tôt cette passion qui m’attire graduellement vers le Nord. Par un heureux concours de circonstances, nous avons tous les trois exécuté nos travaux de maîtrise dans la région de Whapmagoostui-Kuujjuarapik dans différents domaines (sociologie, géographie et biologie). Finalement, le plus chaleureux des mercis à Pierre-Paul Dion avec qui j’ai l’immense privilège de partager quotidiennement les hauts et les bas des études universitaires depuis le début.
Avant-propos
Contexte de l’étude
Les mares de thermokarst sont de jeunes écosystèmes dont la formation est associée à la dégradation du pergélisol. Elles sont très abondantes dans les régions arctiques et subarctiques et leur nombre est appelé à croître par l’effet accéléré du réchauffement climatique sur la fonte du pergélisol. La matière organique jadis piégée dans le pergélisol est maintenant accessible à la dégradation par les décomposeurs dont l’activité croissante libère du carbone atmosphérique sous forme de gaz à effet de serre (GES). Les mares de thermokarst pourraient ainsi constituer une rétroaction positive au réchauffement climatique. Il est donc primordial d’acquérir une compréhension globale de ces milieux, en particulier la connaissance des processus biologiques qui s’y déroulent. Les relations trophiques, qui sont le fondement du transfert d’énergie entre les organismes et de la respiration qui émet des GES, sont au centre de ce besoin de connaissances. Parmi les organismes résidents, les rotifères sont un groupe abondant, mais peu connu. Ils représentent une composante clé du zooplancton puisqu’ils sont généralement nombreux et qu'ils effectuent le transfert d’énergie entre les producteurs primaires et le zooplancton de plus grande taille. Par contre, les rotifères des régions nordiques n’ont reçu jusqu’à présent que très peu d’attention et leur rôle écologique est méconnu.
Ce mémoire présente les résultats d’une analyse des communautés de rotifères des mares de thermokarst du Nunavik. Il se divise en trois chapitres. Le premier chapitre constitue une introduction générale sur l’état des connaissances sur les rotifères, ainsi qu’une introduction aux mares de thermokarst et le rôle qu’elles peuvent jouer dans l’émission de GES. Le deuxième chapitre présente l’analyse détaillée des communautés de rotifères des mares de thermokarst ainsi que des facteurs qui les contrôlent. Ce chapitre est rédigé sous forme d’article scientifique qui sera soumis pour publication. Le troisième chapitre dresse la conclusion générale de cette étude.
Contributions
Dans le cadre de ce projet, j’ai bénéficié de l’encadrement et de l’expertise de mon superviseur, le Professeur Warwick F. Vincent. À titre de première auteure de cet ouvrage,
j’ai élaboré les plans d’échantillonnage et d’expérience, effectué la collecte des échantillons de zooplancton sur le terrain en août 2012, ainsi que réalisé des expériences de broutage en août 2012 et 2013 au laboratoire de la Station de recherche du Centre d’études nordiques à Whapmagoostui-Kuujjuarapik. J’ai ensuite effectué l’analyse des données, ainsi que la rédaction des trois chapitres de ce mémoire. Jérôme Comte a agi à titre de coauteur pour l’article du deuxième chapitre en participant aux analyses statistiques et de diversité.
Dans le cadre du projet ADAPT, j’ai contribué à l’élaboration d’une banque de données des paramètres limnologiques des 50 mares que j’ai analysées pour cette étude. L’échantillonnage et la compilation de la banque de données ont été réalisés en collaboration avec Anna Przytulska-Bartosiewicz, Jérôme Comte, Sophie Crevecoeur, Bethany Deshpande, Alex Matveev et Maciej Bartosiewicz. Les analyses de pigments à l’aide du HPLC («high pressure liquid chromatography») ont été réalisées sous la supervision de Marie-Josée Martineau. Les rapports d’analyses chimiques pour le TN et le DOC ont été réalisés par le personnel des laboratoires de services communs du Centre Eau Terre Environnement de l’Institut National de la Recherche Scientifique.
La présente étude a fait l’objet de présentations par affiche et de présentations orales aux congrès et colloques suivants:
Bégin, P.N., Przytulska-Bartosiewicz, A., Bartosiewicz, M., Vincent, W.F. 2013. Les rotifères dans les mares thermokarstiques: Une diversité étonnante. 81e congrès de l’ACFAS, Université Laval, Québec, QC, Canada 8 mai 2013 (affiche en français).
Bégin, P.N.,Vincent, W.F. 2013. High biodiversity of rotifers in the permafrost thaw lakes of Nunavik and their potential role in the aquatic food web. ArcticNet Annual Scientific Meeting, Halifax, NS, Canada, 10-11 décembre 2013 (affiche en anglais).
Bégin, P.N., Vincent W.F. 2014. Diversité des rotifères dans les mares de thermokarst du Nunavik et leur rôle potentiel dans le réseau alimentaire microbien. Colloque du Département de Biologie, Université Laval, Québec, QC, Canada, 11 mars 2014 (présentation orale en français).
Bégin, P.N., Vincent, W.F. 2014. Biodiversity of rotifers in the permafrost thaw lakes of Nunavik and their potential role in food webs and greenhouse gas emissions. Genomes to Biomes Conference, Montréal, QC, Canada, 27 mai 2014 (présentation orale en anglais).
À l’été 2013, grâce à une bourse du Fonds de formation d’ArcticNet, j’ai eu l’opportunité de discuter de mon projet de recherche dans le cadre d’un atelier intitulé «Arctic Water: Challenges and Opportunities of the North». Cet atelier, qui s'est déroulé à Iqaluit, a été
organisé par le Réseau canadien de l’eau. Nous nous sommes entretenus sur les défis de la gestion des eaux usées, l’évaluation des risques environnementaux, la sécurité liée à l’eau potable dans les communautés arctiques ainsi que l’écologie et l’environnement reliés aux écosystèmes aquatiques. Cet atelier m’a permis de rencontrer des acteurs du domaine de la gestion des ressources en eau, de prendre connaissance des défis relatifs à la gestion de l’eau dans les régions arctiques et de discuter de mes travaux de maîtrise dans un contexte multidisciplinaire (économie, droit, administration, biologie, hydrologie et géographie).
1 Introduction générale
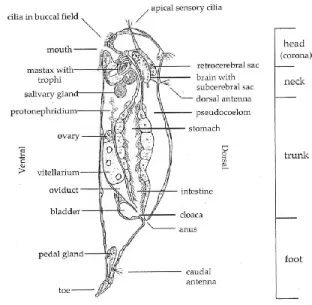
Depuis leur découverte, les rotifères (organismes multicellulaires microscopiques appartenant au zooplancton), fascinent l’observateur avec leur structure buccale singulière. En effet, le mouvement de la couronne ciliée des rotifères, qui aspire l’eau à l’intérieur de l’appareil buccal, rappelle celui d’une roue. Ainsi, ils doivent leur nom aux locutions latines rota (roue) et ferre (porter) (Wallace & Snell, 2010; Figure 1.1). Ces métazoaires de l’embranchement invertébré Rotifera comprennent environ 2000 espèces et sont retrouvés dans tous les milieux d’eau douce.
Figure 1.1 Schéma latéral d'un rotifère type. Figure et traduction intégrale du sous-titre tirés de Wallace et Snell (2010), avec l'autorisation d'Elsevier Ltd.
La plupart des rotifères sont planctoniques et quelques espèces sont capables de se déplacer activement. Certains rotifères sont benthiques, s’attachant au fond des plans d’eau ou sur des plantes aquatiques (Wallace & Snell, 2010). Les différentes espèces de rotifères se distinguent aussi par leur alimentation, dont la taille des particules qu’ils ingèrent (Arndt, 1993). Cette diversité taxonomique et fonctionnelle leur confère un rôle écologique particulier dans les milieux aquatiques où ils présentent un éventail de comportements qui influencent de façon variable le réseau alimentaire microbien. Ce groupe de métazoaires occupe une position clé, puisqu’il est en mesure de transférer le carbone organique du
réseau alimentaire microbien vers la chaîne alimentaire dite classique en étant consommé par des invertébrés et des poissons. Les crustacés ont fait l’objet de multiples études puisque leur manipulation est aisée et que leur biomasse domine généralement le zooplancton. Quant aux rotifères, bien qu’ils en soient d’importants compétiteurs grâce à leur capacité à coloniser rapidement les milieux et qu’ils soient abondants, ont reçu beaucoup moins d’attention (Herzig, 1983; Wallace & Snell, 2010). Toutefois, leur écologie est d’un intérêt particulier, puisque leur abondance influencer les processus trophiques et biogéochimiques des plans d’eau.
Le présent projet de maîtrise s’inscrit dans le cadre du programme Arctique en Développement et Adaptation au Pergélisol en Transition (ADAPT) qui a notamment pour objectif de comprendre les processus biologiques dans les milieux aquatiques qui sont affectés par la dégradation du pergélisol. Les mares de thermokarst sont formées par la fonte du pergélisol riche en glace et l’affaissement subséquent du sol où l’eau s’accumule (Harris et al., 1988). Le réchauffement climatique, qui entraîne une accélération de la dégradation du pergélisol (GIEC, 2007), a intensifié la formation de ces mares. Les mares nouvellement formées sont colonisées par une succession d’organismes aquatiques qui, selon les conditions limnologiques locales, régissent les processus photosynthétiques et détritiques (respiration) qui s’y produisent. Généralement, les mares de thermokarst sont des milieux émetteurs de dioxyde de carbone (CO2) et de méthane (CH4), deux gaz à effet
de serre, ce qui constitue une rétroaction positive au réchauffement climatique. Les rotifères sont généralement présents dans les mares de thermokarst du nord du Québec (Rautio & Vincent, 2006) et la forte activité microbienne de ces milieux pourrait être le corolaire d’une forte abondance de ces métazoaires. Ainsi, les rotifères pourraient jouer un rôle clé dans le réseau alimentaire. Leur étude apporte des informations sur les facteurs qui ont un effet sur les émissions de GES des milieux aquatiques. L’objectif principal de cette recherche est de déterminer les facteurs qui influencent l’abondance et la diversité des rotifères retrouvés dans les mares de thermokarst afin de mieux comprendre leur rôle au sein du réseau alimentaire.
1.1 Problématique
L’augmentation des températures de l’air observée à l’échelle du globe devrait stimuler l’activité microbienne dans les milieux aquatiques et accélérer conséquemment la libération de carbone sous forme gazeuse (CO2 et CH4). Cette émission gazeuse a le potentiel de
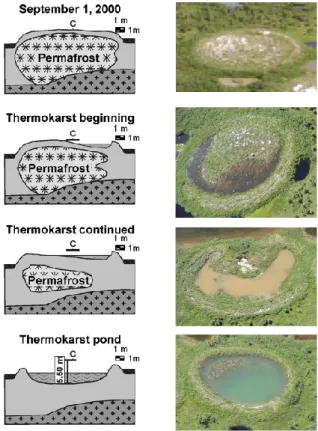
contribuer significativement à l’effet de serre terrestre. Les milieux arctiques et subarctiques sont particulièrement sensibles à ce changement climatique. Dans l’Arctique, la hausse de la température atmosphérique annuelle équivaut à presque deux fois l’augmentation moyenne planétaire (GIEC, 2007). La dégradation du pergélisol riche en glace, surtout aux marges maritimes et méridionales des terres pergelées, a comme conséquence d’accélérer la formation de mares. Le relief qui en résulte est appelé «thermokarst», par analogie au «karst» qui désigne la morphologie des formations de calcaire érodées par l’eau (Figure 1.2). En somme, la formation des mares de thermokarst
Figure 1.2 Processus de formation des mares de thermokarst
sises sur une butte minérale cryogène (lithalse). Figure
adaptée de Calmels et al. (2008), avec l'autorisation d'Elsevier Ltd.
transforme des milieux terrestres en habitats aquatiques (Payette et al., 2004). Une quantité considérable de GES serait relâchée annuellement dans les régions arctiques et subarctiques, étant donnée l’abondance des mares formées dans des environnements qui ont accumulé d’immenses réserves de carbone organique (Downing et al., 2006; Kortelainen et
al., 2006; Schuur et al., 2008; Vincent et al., 2008). En effet, l’abondance des plans d’eau
de petite taille s’est avérée sous-estimée par les analyses d’images satellitaires précédentes puisque leur résolution ne permettait pas de détecter des plans d’eau de moins de 0,1 km2
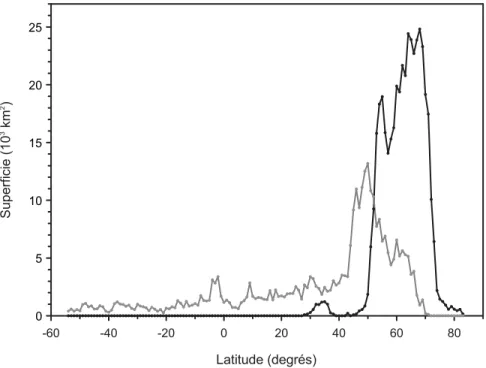
(Downing et al., 2006). Grosse et al. (2013) estiment que la majorité des lacs enregistrés au moyen de l’imagerie satellitaire se trouvent à de hautes latitudes (Figure 1.3) et qu'il s'agit principalement de plans d’eau situés dans des régions pergelées. De plus, qu’il s’agisse de milieux minéraux (buttes minérales cryogènes selon Payette et Rochefort [2001] ou lithalses selon Calmels et al. [2008]) ou de milieux organiques (tourbières à palses selon Payette et Rochefort [2001]), ce sont des environnements humides propices à l’accumulation de la matière organique végétale. L’activité microbienne dans les mares
Figure 1.3 Superficie occupée par des lacs en fonction de la
latitude. La ligne noire représente les lacs dont le bassin versant est caractérisé par le pergélisol alors que la ligne grise représente les lacs des bassins versants où le pergélisol est absent. Données
extraites de la Figure 8 dans Grosse et al. (2013).
Latitude (degrés) -60 -40 -20 0 20 40 60 80 S up e rf ic ie ( 1 0 3 k m 2 ) 25 20 15 10 5 0
formées par la dégradation du pergélisol pourrait ainsi jouer un rôle important dans le cycle global du carbone, dans la mesure où la biomasse remise en circulation est imposante. Le carbone organique était séquestré par le gel depuis des millénaires et il alimente aujourd’hui la chaîne détritique dont l’activité est stimulée par la hausse des températures. Une étude de Walter et al. (2007) suggère que les mares de thermokarst ont contribué à l’augmentation des concentrations atmosphériques de CH4 lors de la dernière déglaciation.
Par contre, l’accélération de la croissance végétale dans les tourbières due à une augmentation de la température pourrait avoir un effet de rétroaction négative aux changements climatiques (Yu et al., 2011). Les émissions de GES dans les mares de thermokarst sont influencées à la fois par les propriétés physiques et chimiques, mais aussi par l’assemblage microbien qui caractérise chaque plan d’eau (Breton et al., 2009; Laurion
et al., 2010). En vue d’une bonne estimation du potentiel d’émission de GES par ces
environnements, une compréhension détaillée des processus en cause est nécessaire. Cela en fait un sujet complexe interpelant différentes disciplines, chacune se penchant sur des facettes complémentaires du système (programme ADAPT).
Ce projet de maîtrise porte sur un aspect de l’écologie microbienne dans les mares de thermokarst et en particulier sur les communautés de zooplancton qui les colonisent et broutent les micro-organismes. Ces milieux aquatiques de petite superficie et peu profonds représentent des systèmes susceptibles de répondre plus rapidement aux changements thermiques que d’autres plans d’eau plus profonds avec une stratification plus stable. L’étude des différents assemblages trophiques et des facteurs qui influencent leur structure peut apporter des informations sur les conditions qui influencent les émissions de GES. Alors que les producteurs primaires fixent le carbone atmosphérique, les producteurs secondaires en émettent. Ainsi, les milieux où le zooplancton est abondant et où il exerce une forte pression sur le phytoplancton sont susceptibles d’être des sources de carbone. Les rotifères sont un groupe diversifié et sont généralement présents dans les mares de thermokarst du nord du Québec (Rautio & Vincent, 2006). Ce projet examine de façon attentive ce groupe de métazoaires dans ces milieux et leur rôle dans le réseau alimentaire microbien.
1.2 Le réseau alimentaire microbien
La production de GES associée aux mares de fonte est influencée par les assemblages microbiens qui s’y trouvent (Laurion et al., 2010) et, en conséquence, par les interactions entre les différentes composantes de ces assemblages, dont les relations trophiques. On parle de réseau alimentaire microbien plutôt que de chaîne alimentaire, puisque les différentes composantes interagissent entre elles, sans nécessairement respecter un patron linéaire comme dans les représentations traditionnelles des chaînes alimentaires (Figure 1.4). Les mares de fonte du pergélisol sont des milieux productifs puisqu’elles bénéficient de nutriments et de matière organique dissoute provenant de l’érosion de leur marge (Laurion et al., 2010). Ces nutriments influencent à leur tour la production primaire par le phytoplancton. Ce dernier comprend plusieurs groupes d’algues et de cyanobactéries (Kalff, 2002). Les bactéries ne font pas toutes partie du phytoplancton, puisque certaines sont hétérotrophes et d’autres sont mixotrophes. Elles pourraient néanmoins être une composante importante du réseau alimentaire microbien dans les mares de thermokarst, car
Figure 1.4 Relations entre le réseau alimentaire microbien et la chaîne alimentaire classique. Figure inspirée de Kalff (2002).
Picoplancton autotrophe Protistes Nanoflagellés hétérotrophes Bactéries Protistes Bactéries Phytoplancton Zooplancton herbivore Zooplancton carnivore Poissons et oiseaux Réseau alimentaire microbien Chaîne alimentaire classique
elles y sont abondantes (Breton et al., 2009). Elles peuvent être consommées par le zooplancton et permettre un transfert de carbone vers les niveaux supérieurs du réseau alimentaire. Les organismes autotrophes, par la fixation de carbone inorganique, constituent un puits de carbone.
Le zooplancton, qui comporte les protozoaires (protistes hétérotrophes), les crustacés et les rotifères, se nourrit de bactéries, de phytoplancton et d’autres composantes du zooplancton (Kalff, 2002). Les protozoaires sont des organismes unicellulaires ubiquistes. Ils regroupent les ciliés, les nanoflagellés hétérotrophes (HNF), les amibes et les héliozoaires. Ils se nourrissent principalement de bactéries et d’algues. Certains groupes de ciliés sont omnivores et peuvent consommer des tissus de métazoaires, alors que certains groupes de protozoaires se nourrissent d’autres groupes de protozoaires (Taylor & Sanders, 2010). Le zooplancton comporte aussi les crustacés, groupe d’arthropodes qui comprend deux sous-groupes principaux: les cladocères et les copépodes. Le groupe des cladocères comprend le genre Daphnia qui a été abondamment étudié puisque sa culture et sa manipulation sont relativement aisées. Les copépodes sont très abondants à la fois en milieu aquatique et terrestre, bien qu'ils soient peu diversifiés dans les plans d’eau du nord du Québec (Swadling et al., 2001). Les rotifères sont des métazoaires abondants dans les milieux aquatiques peu profonds (Wallace et al., 2005) dont le rôle dans le réseau alimentaire microbien n’a pas encore été étudié dans les lacs et mares issus de la fonte du pergélisol.
1.3 Les rotifères
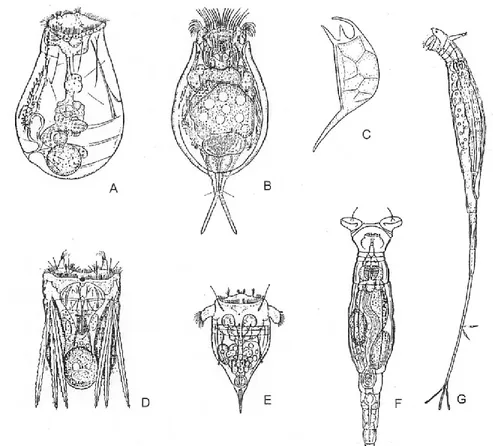
Les rotifères sont un phylum diversifié de métazoaires vivant pour la plupart en eau douce. Leur taille varie de 50 à 2000 µm. La couronne, bien qu’elle ne soit pas ciliée chez toutes les espèces, peut servir à la locomotion en plus d'attirer des particules dans la structure buccale de l’animal (Kalff, 2002). La morphologie des différentes espèces de rotifères est diversifiée: leur corps peut être cylindrique, en forme de sac ou avoir l’allure d’un ver (Figure 1.5). Le pied, qui caractérise les rotifères benthiques, est généralement absent chez les rotifères pélagiques. Les rotifères possèdent un tube digestif qui fait toute la longueur du corps. Ils ont un mastax, un organe chitineux s’apparentant à un pharynx et qui contient les
Figure 1.5 Rotifères représentatifs de différents genres. Monogonontes:
(A) Asplanchna, (B) Euchlanis, (C) Keratella (position latérale), (D) Polyarthra, (E) Synchaeta; Bdelloides: (F) Philodina, (G) Rotaria.
Figure et traduction intégrale du sous-titre tirés de Wallace et Snell (2010).
L’analyse du détail des trophi est utilisée pour l’identification au niveau de l’espèce, bien qu’elle nécessite une dissection méticuleuse (Wallace & Snell, 2010). La plupart des espèces de rotifères sont solitaires, mais environ 25 espèces coloniales ont été répertoriées. Quelques rotifères sont des parasites d’algues, d’éponges, d’autres rotifères, d’oligochètes, d’œufs d’escargots, de crustacés et de poissons. D’autres sont sessiles et se fixent à diverses surfaces à l’aide d’une substance adhésive sécrétée par des glandes dans le pied (Wallace & Snell, 2010). Les rotifères étudiés dans le cadre de ce projet de maîtrise sont ceux qui vivent dans la colonne d’eau.
Les avis sont partagés au sujet de la classification phylogénétique des rotifères. Alors que la classification européenne inclut la classe des rotifères dans le phylum Aschelminthes, la classification nord-américaine les considère comme un phylum propre (Rotifera). De façon
générale, les rotifères sont divisés en trois groupes: les Seisonides (2 genres, 3 espèces), les Bdelloides (19 genres et un peu plus de 460 espèces) et les Monogonontes. Les Seisonides ne vivent qu’en eau salée. Les Monogonontes forment le groupe le plus diversifié avec plus de 100 genres et 1570 espèces (Wallace & Snell, 2010).
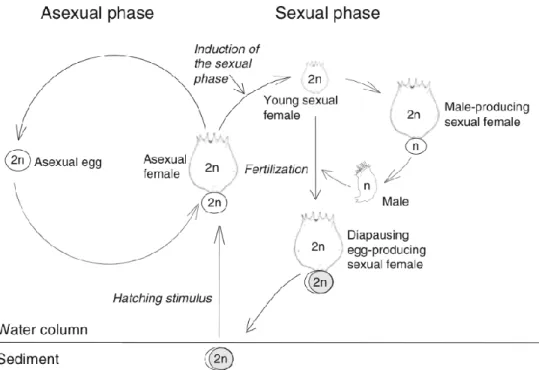
Les rotifères observent différents types de reproduction selon les groupes. Les Seisonides, bien qu’ils ne seront vraisemblablement pas observés dans les mares de thermokarst puisqu’ils vivent seulement en eau salée, observent une reproduction exclusivement sexuée, alors que les Bdelloides sont tous parthénogénétiques. L’absence de reproduction sexuée chez les Bdelloides bouscule un des principes de base de l’évolution pour lequel la perte de la reproduction sexuée chez une espèce la voue à une extinction rapide. Pourtant, ce groupe de rotifères persiste asexuellement depuis des millions d’années et pourrait donc détenir des informations sur les raisons pour lesquelles la majorité des espèces se reproduisent sexuellement (Judson & Normark, 1996; Welch & Meselson, 2000). En effet, aucune trace d’organes sexuels mâles, d’hermaphrodites ou de méiose n’a été rapportée chez ces organismes. Récemment, il a été observé que le génome des Bdelloides ne permet pas le pairage des chromosomes homologues, donc qu’il est incompatible avec la méiose dite conventionnelle (Flot et al., 2013). Les taux de conversion génique et de transfert de gène horizontal sont de l’ordre de 10 fois plus élevés chez les Bdelloides que chez les Monogonontes (Flot et al., 2013). Les Bdelloides sont des organismes particulièrement résistants à la dessiccation, qui segmente les brins d’ADN. Les mécanismes de brassage génétique prendraient place lorsque l’ADN est reconstruit par de puissants mécanismes de réparation lors de la réhydratation (Hespeels et al., 2014).
Les Monogonontes, quant à eux, alternent entre les deux types de reproduction, selon les conditions du milieu (Figure 1.6). Lorsque les conditions sont favorables, seulement des femelles diploïdes sont présentes. Elles se reproduisent de façon parthénogénétique, produisant des femelles amictiques, c’est-à-dire des femelles qui ne produisent que des femelles. Lorsque les conditions deviennent défavorables, les femelles amictiques donnent naissance à des femelles diploïdes mictiques qui, à leur tour, produisent des œufs haploïdes. Si l’œuf n’est pas fécondé, il donnera naissance à un mâle haploïde apte à féconder des œufs. Un œuf fécondé produira une femelle amictique, mais l’œuf s’enkystera et n’éclora
Figure 1.6 Cycle de reproduction des Monogonontes. Figure tirée de Campillo et al. (2011), avec l'autorisation de Springer.
pas avant un retour des conditions favorables. Les kystes peuvent survivre à la dessiccation en diapause durant plusieurs décennies. Ils peuvent aussi coloniser de nouveaux plans d’eau en voyageant dans le tube digestif d’animaux (zoochorie) ou simplement par l’action du vent (aérochorie). Les mâles ne sont retrouvés que lorsqu’il y a reproduction sexuée. Pour certaines espèces, les mâles n’ont tout simplement pas encore été observés. Des différences morphologiques sont observées entre les mâles et les femelles, les mâles étant généralement plus petits. Si les conditions sont favorables (température, photopériode, nourriture abondante), le cycle de vie des rotifères peut s’avérer très court. Une femelle peut survivre d'une à trois semaines et produire environ vingt-quatre œufs (Kalff, 2002; Wallace & Snell, 2010). Dans un contexte de changements climatiques, la température pourrait avoir une influence sur la durée de vie des rotifères. Une étude de Hutchinson (1967) a démontré que le développement des œufs pouvait passer de trois à un jour lorsque la température passe de 10 à 25°C.
Les rotifères jouent un rôle particulier dans la chaîne alimentaire microbienne puisqu’ils permettent le transfert de carbone des bactéries et du phytoplancton vers les prédateurs. Ils effectuent donc un lien entre le réseau alimentaire microbien et la chaîne alimentaire dite classique. La plupart des rotifères sont omnivores et se nourrissent essentiellement de picoplancton ainsi que de petits flagellés et ciliés de moins de 20 µm, alors que certains sont des prédateurs ingérant des particules pouvant atteindre une taille de 40 µm (Arndt, 1993). Dans les milieux aquatiques colonisés par les poissons, ceux-ci exercent une pression de prédation sur le zooplancton, ce qui a pour effet de libérer le phytoplancton de la pression exercée par le zooplancton. Les mares de fonte qui nous intéressent ne contiennent pas de poisson, ce qui implique que le zooplancton se retrouve à la tête de la chaîne alimentaire.
1.4 Abondance et diversité des rotifères
Afin de bien comprendre la structure des communautés de rotifères, il importe d’en connaître l’abondance et la diversité. Alors que l’abondance totale donne des informations sur la contribution d’un groupe en nombre d’individus ou en termes de biomasse, elle ne mesure pas la composition spécifique de la communauté en tant que telle. Connaître la composition spécifique d'une communauté apporte des informations pertinentes sur le fonctionnement de l’écosystème.
La diversité d’un écosystème peut être évaluée à plusieurs échelles. La diversité alpha (α) fait référence à la diversité à l’intérieur d’un échantillon ou d’un plan d’eau en particulier (Whittaker, 1972). Il existe plusieurs indices permettant d’estimer la diversité spécifique d’un milieu. L’indice le plus simple est la richesse spécifique, qui correspond au nombre de taxons répertoriés. Toutefois, le nombre de taxons identifiés dans un échantillon dépend de sa taille. La richesse spécifique est donc dépendante de l’effort d’échantillonnage puisque plus l’échantillon est grand, plus on détecte de taxons rares. De plus, la richesse spécifique ne prend pas en considération les différences d’abondance entre les taxons, ce qui lui confère une précision moindre. Ainsi, les taxons qui ne comportent qu’un nombre limité d’individus ont le même poids dans cet indice que les taxons les plus abondants. L’utilisation d’indices qui prennent en compte le nombre de taxons et l’équilibre entre les
taxons offrent une information plus précise sur la composition des communautés. L’indice le plus utilisé est l’indice de diversité de Shannon (Legendre & Legendre, 2012):
où pi correspond à la proportion de l’assemblage occupée par le taxon i (pi =Ni/N) et s
correspond au nombre total de taxons dans l’échantillon. L’indice de Shannon considère à la fois le nombre de taxons et l’hétérogénéité du nombre d’individus appartenant à chaque taxon. Par contre, tout comme la richesse spécifique, l’indice de Shannon est sensible à la taille de l’échantillon, ce qui lui confère une performance statistique discutable dans certaines situations (Gotelli & Ellison, 2013).
Alors que la diversité alpha (α) fait référence à la diversité à l’intérieur d’un échantillon particulier, la diversité bêta (β) fait référence à la mesure du changement de diversité entre plusieurs échantillons, le long d’un gradient environnemental ou de façon non directionnelle (Anderson et al., 2011). La diversité gamma (γ) fait référence à la diversité totale d’une région et est liée à la fois à la diversité alpha et la diversité bêta (γ = α + β). La diversité d’un milieu peut être évaluée à plusieurs niveaux: la diversité spécifique fait référence aux taxons alors que la diversité fonctionnelle fait référence à la fonction qu’occupent les organismes dans leur milieu (Petchey & Gaston, 2002). Ainsi, les organismes sont séparés en catégories de traits (e.g: taille, préférences alimentaires) pour évaluer la diversité des processus biologiques dans un milieu. Dans le cadre de cette étude, nous nous sommes concentrés sur la diversité taxonomique des rotifères puisque très peu d’informations relatives à leurs préférences alimentaires sont disponibles.
1.5 Facteurs influençant l’abondance et la diversité des rotifères
La présence des rotifères dans un plan d’eau peut être influencée par divers facteurs, physico-chimiques et biologiques. La lumière est un de ces facteurs. Il a été observé que le zooplancton présente un cycle diurne dans ses déplacements: il migre vers le fond des mares durant le jour et vers la surface la nuit. Ainsi, il peut se nourrir de phytoplancton en surface la nuit alors que les prédateurs visuels ont moins de chances de le détecter. De tels
cycles diurnes ont été observés chez de petits rotifères, bien qu’ils soient moins marqués que chez les autres groupes appartenant au zooplancton (Karabin & Ejsmont-Karabin, 2005). La quantité de lumière traversant la colonne d’eau peut aussi influencer la présence de rotifères puisqu’il s’agit d’un facteur limitant la production primaire, donc limitant la quantité de nourriture. À cet effet, la quantité de matière organique dissoute peut exercer une influence, puisqu’elle a la propriété d’absorber les rayons lumineux. Elle est aussi une source de carbone pour plusieurs organismes dont les bactéries. Les concentrations de phosphore et d’azote influencent aussi la production primaire puisque ce sont des éléments qui limitent leur croissance.
L’assemblage des différentes espèces de rotifères dans un plan d’eau dépend grandement de la température puisqu'il s'agit d'organismes ectothermes (dont le maintien de la température corporelle et des processus métaboliques dépend de sources de chaleur externes; Herzig, 1987). Les espèces vivant en eau froide se distinguent donc de celles vivant en eau chaude (Herzig, 1983). Une plus haute température peut indiquer un plus haut taux de reproduction, donc une capacité accrue à coloniser rapidement un milieu. Elle peut aussi avoir un effet sur leur métabolisme, ce qui influence leurs interactions avec les autres organismes. Les rencontres plus fréquentes avec les proies permettent un taux de broutage plus élevé et donc un contrôle accru sur les communautés de proies. La température influence aussi la quantité d’oxygène dissout dans l’eau, ce qui affecte les populations de rotifères (Mikschi, 1989). La température a aussi un effet sur la croissance du phytoplancton et des autres organismes qui constituent l’alimentation des rotifères.
La présence des rotifères dans un plan d’eau dépend de la présence d’autres organismes appartenant au zooplancton. En effet, les rotifères sont consommés par divers invertébrés et larves de poissons. Certains ciliés sont même aptes à se nourrir de rotifères. Certains rotifères, tels que ceux appartenant au genre Asplanchna, sont carnivores et se nourrissent d’autres rotifères (Williamson, 1983). Les daphnies peuvent aussi avoir un effet sur l’abondance de rotifères puisqu’elles ont un avantage compétitif sur certaines espèces de rotifères qui peuvent se retrouver dans leur appareil buccal et être endommagés, ce qui diminue leur taux de survie (Gilbert, 1988b; Gilbert, 1988a). Toutefois, selon Kirk et Gilbert (1990), les rotifères ont un avantage compétitif sur les daphnies dans les eaux
turbides: les daphnies sont inhibées par une forte charge sédimentaire puisque le taux de particules de phytoplancton qu’elles ingèrent est diminué par la présence de particules non comestibles, alors que les rotifères y sont tolérants.
Enfin, on observe généralement que la diversité d’un écosystème est positivement liée à sa productivité primaire, que ce soit en milieu terrestre ou aquatique (Cardinale et al., 2006; Ptacnik et al., 2008). L’observation d’une plus grande diversité taxonomique et fonctionnelle dans un milieu où la production primaire est plus forte serait donc cohérente avec ces observations. Les milieux situés à de hautes latitudes sont généralement des milieux moins diversifiés et productifs qu’à des latitudes plus tempérées (Rahbek, 1995; Falge et al., 2002). Toutefois, d’abondantes communautés de zooplancton ont été observées dans les mares de thermokarst par rapport aux plans d’eau de même latitude, soutenues par une forte abondance bactérienne et de tapis microbiens (Rautio & Vincent, 2006).
1.6 Objectifs et hypothèses
L’objectif principal de ce projet est de déterminer la diversité, la structure des communautés et l’abondance des rotifères dans un large éventail de mares de thermokarst à travers un gradient de dégradation du pergélisol. Puisque les mares de thermokarst sont des milieux riches en matière organique et qu’elles abritent potentiellement une forte production bactérienne (Breton et al., 2009; Laurion et al., 2010), nous avons formulé l’hypothèse qu’elles contiendraient de fortes concentrations de rotifères s’alimentant de picoplancton. Nous avons aussi émis l’hypothèse que puisque la productivité et la biodiversité sont souvent positivement corrélées dans différents écosystèmes (Tilman et al., 1996; Cardinale et al., 2006; Ptacnik et al., 2008), et qu'il existe une grande variabilité limnologique entre les mares et les lacs de thermokarst (Watanabe et al., 2011), les diversités α et β devraient être élevées par rapport à d’autres écosystèmes comme les bassins rocheux. Finalement, nous avons cherché à déterminer si les communautés de rotifères des mares de thermokarst sont contrôlées par le bas (bottom-up) ou par le haut (top-down). Un contrôle par le bas indiquerait que les rotifères sont limités par la disponibilité de la nourriture et que leur broutage serait en mesure de contrôler les populations microbiennes par le haut. Par contre, un contrôle par le haut indiquerait que la
prédation par le zooplancton carnivore serait considérable dans les mares de thermokarst et serait en mesure de contrôler les communautés de rotifères.
Pour répondre à ces hypothèses, trois questions ont été étudiées:
1) Quelles sont l’abondance et la diversité des rotifères dans les mares de thermokarst durant la période estivale où l’eau est libre du gel?
2) Quels sont les facteurs environnementaux qui influencent l’abondance et la diversité des rotifères?
3) Quels sont le taux d’ingestion et le spectre de taille des particules ingérées par les rotifères des mares de thermokarst?
1.7 Méthodologie générale
1.7.1 ApprocheL’approche utilisée pour répondre aux hypothèses de ce projet de recherche est celle d’une étude comparative qui permet d’évaluer la variabilité intra- et inter-sites. Le travail a été fondé sur des observations de terrain et sur un échantillonnage dirigé afin de détailler un ensemble de variables limnologiques et d’effectuer des comparaisons entre les milieux. 1.7.2 Description de la région d’étude
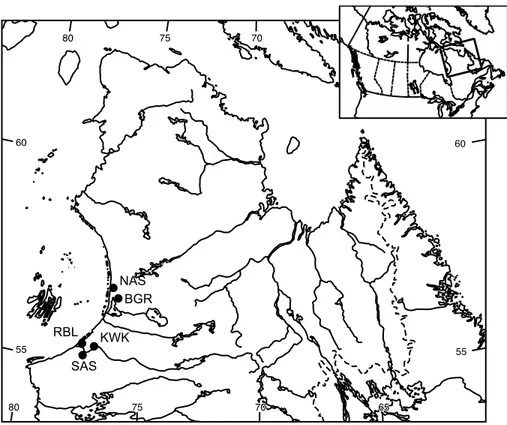
L’étude s’est déroulée dans la région de Whapmagoostui-Kuujjuarapik et d’Umiujaq sur la côte est de la baie d’Hudson (voir Figure 2.1). Cette région est caractérisée par le pergélisol dominant les dépôts de limons. Elle a un intérêt particulier puisque le pergélisol qu’on y trouve est en transition (Payette et al., 2004). En effet, l’augmentation de la température atmosphérique de cette région implique une dégradation du pergélisol qui est appelé à éventuellement disparaître. La région est soumise à un climat subarctique caractérisé par un hiver froid et sec de type arctique (température moyenne en janvier de -23,4°C de 1971 à 2000 à Kuujjuarapik, 40% des précipitations annuelles sous forme de neige) et un été frais et humide fortement influencé par la baie d’Hudson (température moyenne en juillet de 10,6°C de 1971 à 2000, précipitations annuelles de 660 mm). La saison sans gel dure en moyenne 126 jours (nombre de jours avec une température minimale au-dessus de 0°C de 1971 à 2000) et la saison glacielle s’étale de la mi-novembre au début de mai
(Environnement Canada, 2002a; Environnement Canada, 2002b). Enfin, la région se situe dans l’écozone de la toundra forestière qui fait la transition entre la forêt boréale continue et la toundra. Plus spécifiquement, la région d’étude se situe dans la sous-zone forestière qui est caractérisée, sur plus de 50% de sa surface, par la forêt coniférienne ouverte versus par la toundra. La zone côtière (zone d’invasion marine) est dominée par l’épinette blanche (Picea glauca [Moench.] Voss), alors que l’hinterland est dominé par l’épinette noire (Picea mariana Mill. BSP; Payette, 1983).
En marge de la baie d’Hudson, lorsque le front de l’inlandsis a quitté la côte actuelle, l’enfoncement isostatique des terres a permis l’invasion de la mer de Tyrrell, qui a immergé l’ensemble du territoire jusqu’aux altitudes actuelles de 185 m près de Kuujjuarapik et 228 m près d’Umiujaq (Allard & Seguin, 1985) et laissé sur place d’importantes quantités de limons. Ces limons se sont maintenus dans les zones déprimées ou protégées des vagues durant l’émersion des terres qui a suivi la déglaciation. Exposés à l’atmosphère, ces dépôts, qui contenaient beaucoup d’eau, ont rapidement gelé et le sont demeurés depuis plusieurs millénaires. Encore aujourd’hui, dans la région étudiée, le pergélisol se forme dans les dépôts qui retiennent l’eau et qui sont exposés au vent, où la neige n’a pas tendance à s’accumuler. Il s’agit de la zone de pergélisol discontinu (Allard & Seguin, 1987). Ainsi, les surfaces les plus exposées au vent conservent une température plus basse que les surfaces situées dans des dépressions où la neige s’accumule davantage. Il peut y avoir jusqu’à 70% de glace dans les dépôts de sédiments marins. Les dépôts ainsi chargés de lentilles de glace se gonflent et forment des buttes minérales cryogènes (Payette et al., 1976), appelées lithalses par Harris (1993). En présence de tourbe, ces formes sont appelées des palses (Payette et al., 1976).
La partie du sol qui dégèle en saison estivale est désignée par le terme «mollisol» ou par l’anglicisme «couche active» (active layer). Le réchauffement des températures atmosphériques a pour effet d’augmenter la température du pergélisol et ainsi d’accroître l’épaisseur du mollisol d’année en année (Smith et al., 2005). Les milieux où le pergélisol se dégrade le plus rapidement sont les dépressions et les environnements où la forêt et les arbustaies se densifient (Bégin et al., 1993). De plus, les dépôts qui contiennent des volumes non gelés au sein du pergélisol (talik) sont plus susceptibles à la dégradation. La
fonte du pergélisol dépend donc du régime thermique local qui est sous l’influence de différents facteurs tels que l’exposition au vent, l’accumulation de la neige, le régime hydrologique local et la distribution du couvert végétal (Payette & Rochefort, 2001). Les sols riches en glace ont tendance à s’affaisser lors de la fonte du pergélisol et à former des bassins qui retiennent l’eau, ce qui forme des mares de fonte (mares de thermokarst). L’eau contenue dans ces dépressions accumule la chaleur et provoque l’accélération de la fonte du pergélisol. Les mares de thermokarst peuvent donc être des plans d’eau relativement jeunes. Dans certaines régions de pergélisol discontinu, la production végétale est optimale et les contours des mares sont riches en matière organique. L’érosion rend cette matière organique disponible pour les organismes détritivores et contribue à la turbidité du plan d’eau. Se juxtaposent alors des mares dont la couleur varie selon leur turbidité.
1.7.3 Sites d’étude
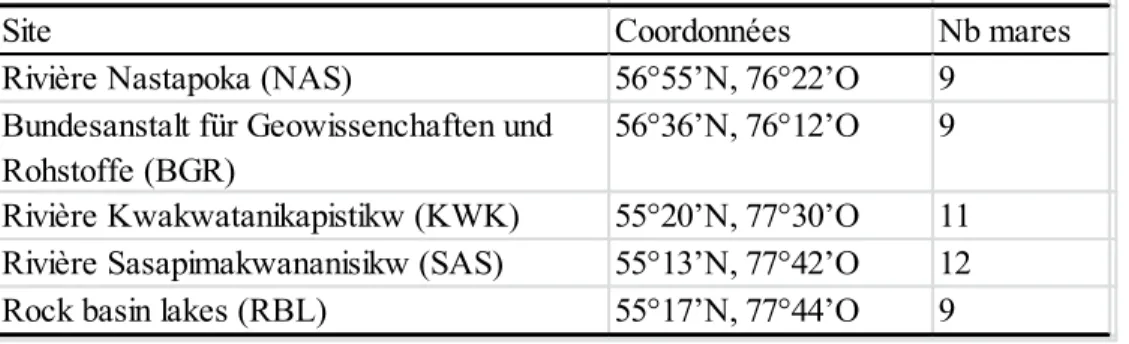
L’étude a été réalisée sur cinq sites: deux sites dans la zone de pergélisol discontinu (NAS et BGR) au sud-est d’Umiujaq, ainsi que deux sites dans la zone de pergélisol sporadique (SAS et KWK) et un site de référence contenant des plans d’eau non issus de la fonte du pergélisol (RBL) dans la région de Whapmagoostui-Kuujjuarapik (voir Figure 2.2). Cinquante mares réparties dans ces cinq sites ont été échantillonnées (Tableau 1.1; liste des mares dans l’Annexe 2). Les mares situées dans les sites d’étude ont été choisies pour couvrir le plus grand gradient limnologique retrouvé dans chaque site. Le choix a reposé sur la turbidité et la matière organique qui se traduit par le large spectre de couleur des mares (Watanabe et al., 2011). Nous avons choisi des mares de taille généralement uniforme. Les mares comportent donc des conditions limnologiques différentes qui sont liées à leur origine et à la composition végétale qui les entoure. Leurs caractéristiques physico-chimiques et biologiques sont susceptibles d’influencer les assemblages de zooplancton qui s’y trouvent. Nous avons utilisé une approche comparative pour déterminer l’influence des variables environnementales indépendantes (biotiques et abiotiques) sur les assemblages de rotifères. Cette approche a permis de faire des comparaisons intra-mares, inter-mares et inter-sites.
Tableau 1.1 Sites d'étude et coordonnées géographiques des 50 mares
échantillonnées.
Site Coordonnées Nb mares
Rivière Nastapoka (NAS) 56°55’N, 76°22’O 9 Bundesanstalt für Geowissenchaften und
Rohstoffe (BGR)
56°36’N, 76°12’O 9 Rivière Kwakwatanikapistikw (KWK) 55°20’N, 77°30’O 11 Rivière Sasapimakwananisikw (SAS) 55°13’N, 77°42’O 12 Rock basin lakes (RBL) 55°17’N, 77°44’O 9
Le site de la rivière Nastapoka (NAS; 56°55’N, 76°22’O; Figure 2.2a) se trouve à 40 km au nord d’Umiujaq et repose sur du limon marin très fin. Certaines mares montrent une couleur blanche laiteuse due à ces particules fines qui confèrent une très faible transparence à l’eau. Le site Bundesanstalt für Geowissenchaften und Rohstoffe (BGR; 56°36’N, 76°12’O; Figure 2.2b), dont le nom fait référence à un groupe de recherche allemand qui y a conduit des études en lien avec une équipe de recherche du Québec, est situé à 20 km au nord-est d’Umiujaq. Les mares sont issues de lithales dégradées à divers degrés.
Le site de la rivière Kwakwatanikapistikw (KWK; 55°20’N, 77°30’O; Figure 2.2c) se trouve à environ 20 km au nord-est de Whapmagoostui-Kuujjuarapik. Il s’agit d’une tourbière de petite taille dont la topographie est influencée par la dégradation avancée du pergélisol. Les mares ainsi formées par la fonte des buttes minérales (lithalses) sont bordées d’épaisses bandes d’arbustes. Le site de la rivière Sasapimakwananisikw (SAS; 55°13’N, 77°42’O; Figure 2.2d) est à 7 km au sud de Whapmagoostui-Kuujjuarapik et est caractérisé par une couche de tourbe de deux à trois mètres d’épaisseur qui forme un plateau bombé par la présence de lentilles de glace pouvant atteindre deux mètres d’épaisseur entre les lits de tourbe. Le tout forme ce qu’on appelle un plateau palsique qui s’est transformé en palses isolées par des mares suite à la fonte des lentilles de glace. Situé sur la rive sud de la Grande rivière de la Baleine, ce site a été visité par les chercheurs du Centre d’études nordiques, qui ont constaté l’absence de mares à la fin des années 1970. Les jeunes mares qui s’y sont formées sont d’un grand intérêt, puisqu’elles sont chargées d’une grande quantité de matériel tourbeux en dégradation. Enfin, les lacs de référence (Rock Basin
Lakes; RBL; 55°17’N, 77°44’O; Figure 2.2e) sont situés dans la localité de
sorte que leur formation n’est pas liée au thermokarst. Les cinq sites se trouvent dans la zone d’invasion marine et le substrat des sites de mares de thermokarst est constitué de limons marins pergelés.
1.7.4 Relevés de terrain
Les 50 plans d’eau répartis dans les cinq sites ont été visités en 2012 afin d’effectuer des relevés de terrain ainsi que la collecte d’échantillons. Les relevés de terrain consistaient en la collecte d’informations sur les conditions physiques et chimiques de chaque mare en collaboration avec les autres membres de l’équipe ADAPT. La température, le pH, la concentration d’oxygène dissout, la conductivité et le potentiel d’oxydoréduction ont été mesurés à l’aide d’une sonde multiparamétrique Hydrolab DS5X (Loveland, CO, USA). Des profils verticaux fins de température et de conductivité ont été mesurés à l’aide d’une sonde de conductivité, température et profondeur (CTD) RBR XR620 (Richard Branker Research Ltd.). La couleur et la taille des mares ont également été relevées.
1.7.5 Échantillonnage
La mission de terrain de l’été 2012 a permis de réaliser une collecte du zooplancton à la surface des 50 mares sélectionnées à l’aide d’un filet à zooplancton (diamètre de 20 cm, maille de 35 µm). La collecte a été réalisée en projetant le filet du bord des plans d’eau vers le centre de façon à échantillonner un rayon du centre vers le bord. Pour quelques-unes de ces mares, des échantillons de zooplancton à différentes profondeurs ont été récoltés à l’aide une trappe Schindler-Patalas de 30 litres afin d’obtenir une distribution verticale des organismes. En 2013, un échantillonnage à différentes profondeurs dans une mare a été réalisé sur une période de 24 heures afin d’évaluer la migration verticale du zooplancton. Les échantillons ont été fixés avec de l’éthanol (concentration finale de 75%) et du Lugol (concentration finale de 4%). Les échantillons d’eau pour les analyses chimiques ont été récoltés à l’aide d’une bouteille de type Van Dorn.
1.7.6 Analyses en laboratoire
De retour au laboratoire, les échantillons de zooplancton ont été énumérés et identifiés en utilisant la méthode de sédimentation Utermöhl (1958) avec un microscope inversé (Zeiss Axiovert, 40-400X). Nous avons arrêté notre choix sur cette technique puisqu’elle permet
de concentrer les organismes tout en préservant leur structure intacte. Les rotifères et les cladocères ont été identifiés au niveau de l’espèce, lorsque possible, sinon au genre. Les copépodes ont été identifiés selon leur groupe (calanoïde ou cyclopoïde) ou simplement
nauplii lorsqu’observés à ce stade larvaire.
L’azote total (TN) et le phosphore total (TP) ont été estimés à partir d’eau filtrée sur 0.2 µm et fixée avec de l’acide sulfurique (concentration finale 2%) avant de mesurer l’absorbance à l’aide d’un spectrophotomètre suivant le protocole de Stainton et al. (1977). La concentration de particules solides en suspension (TSS) a été mesurée en collectant les particules sur un filtre de fibre de verre (Advantec MFS, GF/F, diamètre: 47 mm, porosité: 0.7 µm) préalablement brûlé à 500°C et pesé à l’aide d’une balance de précision. L’échantillon collecté sur le filtre a ensuite été séché à 60°C pour 4 heures et pesé de nouveau (Breton et al., 2009). La différence entre les deux masses correspond à la quantité de matière s’étant déposée sur le filtre qui est ensuite transformé en concentration selon le volume d’eau filtré. La concentration de carbone organique dissout (DOC) a été mesurée à partir d’eau filtrée sur un filtre d’acétate de cellulose de 0.2 µm de porosité. Les échantillons ont ensuite été mesurés par les techniciens des laboratoires de l’INRS-ETE à l’aide d’un analyseur de carbone Shimadzu TOC-5000A. La concentration en chlorophylle
a a été estimée par chromatographie en phase liquide à haute performance (HPLC) suivant
le protocole de Bonilla et al. (2005). L’échantillon d’eau prélevé pour l’estimation des concentrations de picoplancton (picocyanobactéries et bactéries hétérotrophes) a été fixé à l’aide de glutaraldéhyde (concentration finale 1%) et a été conservé à -80°C jusqu’au moment de l’analyse à l’aide d’un cytomètre en flux (FACScalibur) selon le protocole de Rossi et al. (2013).
1.7.7 Expériences
Le deuxième volet du projet vise à estimer le taux de filtration des différentes espèces de rotifères relativement au spectre de taille des proies qu’ils ingèrent. Deux expériences de broutage ont été réalisées en 2012 et en 2013. L’expérience de 2012 a été réalisée avec l’eau d’un lac de référence (RBLOL) récoltée dans des contenants de type Cubitainer de 4L, rapportée au laboratoire et laissée à reposer 12h pour permettre au zooplancton de s’acclimater. Nous avons choisi d’inclure tout le zooplancton présent dans la colonne d’eau
afin d’estimer le taux net de filtration des rotifères, n’eut égard des interactions de compétition ou de prédation avec le zooplancton de plus grande taille. Des microsphères fluorescentes de trois tailles différentes (1.75, 3 et 6 µm) ont ensuite été ajoutées à l’eau pour une incubation de 20 minutes, qui correspond à une durée moindre que le temps de résidence des particules dans l’appareil digestif des rotifères. Chaque échantillon a ensuite été concentré à l'aide d’un filet à zooplancton de 35 µm. Le zooplancton a ensuite été anesthésié à l’aide d’eau carbonatée (Alka-Seltzer) avant d’être fixé à l’aide d’un mélange de paraformaldéhyde (concentration finale: 0.06%) et de glutaraldéhyde (concentration finale: 0.75%). L’anesthésie par l'eau carbonatée permet d’éviter l’expulsion des microsphères au moment où l’agent de fixation est administré. L’expérience a été réalisée en triplicat et inclut un traitement contrôle (T0) qui a consisté en la fixation suivant immédiatement l’ajout des microsphères. Ainsi, nous avons pu calculer un taux de filtration (clearance rate, CR) à partir de l’équation de Ooms-Wilms (1997; voir section 2.2.5). L’expérience de 2013 s’est déroulée selon le même protocole, mais avec l’eau provenant d’une mare de thermokarst et dans des contenants de 500 mL, puisque la concentration des rotifères nous permettait d’obtenir une quantité suffisante d’individus dans un plus petit volume d'eau, ce qui permet de transporter une moins grande quantité d’eau du site vers le laboratoire et facilite grandement la logistique.
Plusieurs autres techniques sont utilisées pour l’estimation du taux de filtration du zooplancton, dont l’utilisation d’organismes marqués avec des isotopes (p. ex., picoplancton ou cyanobactéries filamenteuses marqués au 14C, bactéries marquées au 3H)
avec lesquels est nourri le zooplancton. La concentration de bactéries marquées est subséquemment détectée en mesurant la radioactivité du zooplancton (Rautio & Vincent, 2006). Les expériences de dilution originairement introduites par Landry et Hassett (1982), qui consistent à mesurer la concentration du phytoplancton à au moins deux temps au cours de l’incubation afin de déterminer la croissance du phytoplancton et le taux de filtration du zooplancton sont aussi largement répandues.
Nous avons choisi d’utiliser des microsphères fluorescentes pour réaliser nos expériences de broutage puisque le signal clair des microsphères fluorescentes facilite le comptage. De plus, la concentration initiale des billes peut être facilement mesurée à l’aide d’un