Évaluation chez le porcelet de l’effet des probiotiques
Pediococcus acidilactici et Saccharomyces cerevisiae
ssp. boulardii sur le microbiote intestinal et sur les
réponses innées et acquises lors d’une infection à
Salmonella Typhimurium DT104
Mémoire
Jean-Philippe Brousseau
Maîtrise en Microbiologie agroalimentaire
Maître ès sciences (M. Sc.)
Québec, Canada
Résumé
Les suppléments antibiotiques dans l'alimentation animale sont sévèrement critiqués. Les probiotiques sont une alternative prometteuse, mais la caractérisation de leurs effets demeure nécessaire. Ce mémoire décrit l'influence de Pediococcus acidilactici (PA) et Saccharomyces cerevisiae ssp. boulardii (SCB) sur 1) le microbiote intestinal avant et après le sevrage et, 2) l'immunité et la colonisation intestinale lors d'une infection à Salmonella Typhimurium DT104. Nos résultats montrent que suite au sevrage PA module le microbiote iléal de façon similaire aux antibiotiques tandis que SCB influence le microbiote colique. De plus, SCB seul ou avec PA module certaines populations de cellules immunitaires du sang avant et après l'infection à S. Typhimurium. Cependant, aucun effet n'a été observé sur les autres paramètres évalués. Même si nous approfondissons la compréhension entourant les effets de PA et SCB sur l'hôte, d'autres études sont nécessaires pour optimiser l'utilisation des probiotiques comme alternative aux suppléments d'antibiotiques dans l'élevage.
Abstract
Antibiotics as growth promoters in pig feed are severely criticized. Probiotics are a promising alternative, but characterization of their effects on the intestinal microbiota and immunity is still necessary. In this study, the influences of Pediococcus acidilactici (PA) and Saccharomyces cerevisiae ssp. boulardii (SCB) on 1) intestinal microbiota before and after weaning and, on 2) immunity and intestinal colonization during a Salmonella Typhimurium DT104 infection were evaluated. Our results show that following weaning PA modulated ileal microbiota similarly to in-feed antibiotic while SCB influenced the colonic microbiota. Moreover, SCB alone or with PA modulate some immune blood cell populations before and after the S. Typhimurium infection. However, no effects were observed on the other parameters assessed. Although we deepened the understanding surrounding the effects of PA and SCB on the host, further studies are needed to fully optimize the use of probiotics as alternatives to antibiotic supplements in animal husbandry.
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... xi
Liste des figures ... xiii
Liste des abréviations... xv
Remerciements ... xix
Avant-propos ... xxi
Introduction générale ... 1
Revue de la littérature ... 3
1. Le microbiote intestinal du porcelet... 3
1.1. Établissement et développement du microbiote intestinal porcin ... 3
1.1.1. La colonisation primaire ... 3
1.1.2. De la fin de la 1ere semaine au sevrage ... 4
1.1.3. Le sevrage et l’adaptation à l’alimentation solide ... 4
1.1.3.1. Le sevrage commercial des porcelets ... 4
1.1.3.2. L’utilisation d’antibiotiques comme facteurs de croissance ... 5
1.1.4. Perturbation puis stabilisation du microbiote suite au sevrage ... 6
1.2. Effets bénéfiques du microbiote sur l’hôte ... 8
2. Le système immunitaire intestinal ... 10
2.1. Développement du système immunitaire intestinal du porcelet ... 10
2.2. Voies d’entrées et reconnaissance des antigènes intestinaux ... 11
2.3. Présentation des antigènes et activation des lymphocytes ... 15
2.3.1. Les lymphocytes T CD4+ et la réponse immunitaire intestinale ... 15
3. Salmonella ... 20
3.1. Classification du genre Salmonella ... 20
3.2. Caractéristiques générales des salmonelles ... 20
3.2.1. Salmonella enterica sous-espèce enterica serovar Typhimurium ... 22
3.3. Facteurs de virulence et pathogenèse moléculaire de Salmonella enterica ... 22
3.3.1. Mode d’infection ... 22
3.3.2. Facteurs de virulence ... 24
3.3.2.1. Système de sécrétion de type III ... 24
3.4. Réponse immunitaire contre Salmonella enterica ... 25
3.5. Moyens utilisés pour prévenir les infections à la Salmonella chez le porcelet ... 27
3.5.1. Les antibiotiques ... 27
3.5.2. La vaccination ... 27
3.5.3. Les probiotiques ... 28
4. Les probiotiques ... 29
4.1. Définitions et caractéristiques des probiotiques ... 29
4.2. Propriétés bénéfiques des probiotiques chez le porc ... 29
4.2.1. Effets positifs sur la performance des porcelets ... 31
4.2.2.1. Techniques moléculaires employées pour évaluer l’effet des probiotiques sur le microbiote
intestinal ... 32
4.2.2.1.1. Contraintes des techniques de culture des microorganismes ... 32
4.2.2.1.2. Méthodes moléculaires d’analyse des écosystèmes bactériens ... 33
4.2.2.1.2.1. Le clonage et le séquençage ... 33
4.2.2.1.2.2. L’électrophorèse sur gel en gradient dénaturant ou DGGE ... 34
4.2.2.1.2.3. Le polymorphisme de longueur des fragments terminaux ou T-RFLP ... 34
4.2.3. Effets sur la muqueuse et l’épithélium intestinal ... 35
4.2.3.1. Effets sur les jonctions serrées et sur la morphologie de la muqueuse ... 35
4.2.3.1.1. Effets sur la perméabilité ... 35
4.2.3.1.2. Effets sur la morphologie de l’intestin ... 36
4.2.3.2. Effets sur la production de mucines et de défensines ... 36
4.2.3.3. Effets sur la translocation bactérienne ... 37
4.2.4. Effets sur l’immunité ... 39
4.2.4.1. Effet sur l’immunité innée ... 39
4.2.4.2. Effet sur l’immunité adaptative ... 40
4.3. Pediococcus acidilactici ... 40
4.4. Saccharomyces cerevisiae ssp. boulardii ... 41
5. Le but, les hypothèses et les objectifs du projet de recherche ... 42
5.1. But ... 42
5.2. Hypothèses ... 42
5.3. Objectifs ... 42
Chapitre 1 : Analyse par T-RFLP des effets chez le porcelet de Pediococcus acidilactici et Saccharomyces cerevisiae ssp. boulardii sur le microbiote fécal lors de la lactation et sur le microbiote fécal, iléal et du côlon suite au sevrage ... 45
Résumé ... 45
Abstract ... 47
Introduction ... 47
Materials & methods ... 49
Animals and treatments ... 49
Sampling of fecal, ileal and colonic samples ... 51
Microbiological analysis of feces and intestinal contents ... 51
DNA extraction and PCR conditions ... 52
T-RFLP ... 53
Data analysis of T-RFLP profiles ... 53
Clone library construction ... 55
DNA sequencing ... 56
Results & discussion... 57
Probiotic effects on fecal microbiota during lactation ... 60
Probiotic effects on fecal microbiota one week post-weaning ... 64
Probiotic effects on ileal microbiota two weeks post-weaning ... 71
Probiotic effects on colonic microbiota two weeks post-weaning ... 73
Acknowledgments ... 76
Chapitre 2 : Effets de Pediococcus acidilactici et Saccharomyces cerevisiae ssp. boulardii sur l’immunité intestinale et systémique du porc suite à une infection expérimentale à Salmonella Typhimurium DT104 ... 77
Résumé ... 77
Introduction... 80
Materials & methods ... 81
Animals and treatments ... 81
Salmonella Typhimurium strain and experimental challenge ... 83
Microbiological analysis of intestinal contents and MLN ... 83
Measurement of secretory IgA in ileal mucosa ... 84
Isolation of leukocytes from blood and MLN ... 84
Flow Cytometry Analysis ... 85
RNA extraction and cDNA synthesis ... 86
Quantification of cytokine gene expression by real-time PCR... 87
Statistical analysis ... 89
Results ... 89
Probiotic counts and clinical signs ... 89
Effect on leukocyte populations ... 90
Gene expression of cytokines ... 93
Discussion ... 94
Acknowledgements ... 103
Chapitre 3 : Discussion, perspectives et conclusions ... 105
Liste des tableaux
Tableau 1. Types bactériens cultivables provenant du tractus gastro-intestinal porcin. ... 7
Tableau 2. Principales lignées phylogénétiques associées aux phylotypes identifiés dans le tractus gastro-intestinal du porc. ... 7
Tableau 3. Caractéristiques des animaux axéniques lorsque comparés aux animaux de la même espèce possédants un microbiote intestinal typique. ... 9
Tableau 4. Stades de développement du système immunitaire mucosal du porcelet nouveau-né... 11
Tableau 5. Ligands des différents récepteurs de type Toll (TLR) présents dans l’intestin. ... 14
Tableau 6. Exemples de sérovars de Salmonella enterica; leurs hôtes et leur maladie. ... 21
Chapitre 1 : Analyse par T-RFLP des effets chez le porcelet de Pediococcus acidilactici et Saccharomyces cerevisiae ssp. boulardii sur le microbiote fécal lors de la lactation et sur le microbiote fécal, iléal et du côlon suite au sevrage Table 1. Nutrient composition of the weaning diet (d21 to d37). ... 51
Table 2. Influence of probiotic treatments on microbial diversity indices in feces of piglets at day 10 of lactation and one week post weaning (d28) and in the ileum and colon digesta of two week weaned piglets (d37)1. ... 61
Table 3. Relative percentage of each bacterial Phylum identified from T-RFLP fingerprints of piglets feces during lactation (d10) and one week post-weaning (d28), and of the ileum and colon contents two weeks post-weaning (d37)1. ... 63
Table 4. Multi-response permutation procedure (MRPP) testing for differences in the composition of the microbial communities of feces collected during lactation (d10) and one week post-weaning (d28), and of the ileum and colon contents two weeks post-weaning (d37)1. ... 68
Table 5. Indicator species analysis (ISA) and phylogenic identification of modulated phylotypes obtained from T-RFLP fingerprints in piglets feces during lactation (d10) and one week post-weaning (d28), and in the ileum and colon digesta two weeks post-post-weaning (d37)1. ... 70
Chapitre 2 : Effets de Pediococcus acidilactici et Saccharomyces cerevisiae ssp. boulardii sur l’immunité intestinale et systémique du porc suite à une infection expérimentale à Salmonella Typhimurium DT104 Table 1. Nutrient composition of the weaning diet (d21 to d44) ... 82
Table 2. Swine-specific antibodies used to characterize different populations of leukocytes isolated from blood and mesenteric lymph nodes. ... 86
Table 3. List of genes and sequences of the primers used for real-time PCR*. ... 88
Table 4. Influence of probiotic and antibiotic treatments on S. Typhimurium DT104 counts in intestinal contents and MLN and concentration of IgA in ileal mucosa of pigs1. ... 90
Table 5. Proportion (%) of blood leukocyte populations before (d39) and after S. Typhimurium challenge (d44) in pigs fed a basal diet (CTRL) or a basal diet supplemented with either antibiotics (ATB), Pediococcus acidilactici (PA), Saccharomyces cerevisiae subsp. boulardii (SCB), or PA and SCB (PA+SCB)1. ... 91
Table 6. Proportion (%) of leukocyte populations in mesenteric lymph nodes after
S. Typhimurium DT104 challenge in pigs fed a basal diet (CTRL) or a basal diet supplemented
with either antibiotics (ATB), Pediococcus acidilactici (PA), Saccharomyces cerevisiae subsp.
boulardii (SCB), or PA and SCB (PA+SCB)1. ... 92
Table 7. Ileum cytokine mRNA relative levels normalized to ACTB in 24 hpc S. Typhimurium
DT104 pigs treated with probiotics or antibiotics1. ... 93
Table 8. Mesenteric lymph node (MLN) cytokine mRNA levels normalized to ACTB in 24 hpc
Liste des figures
Figure 1. Schéma de l’impact du sevrage sur la santé intestinale du porcelet. ... 5
Figure 2. Densité microbienne retrouvée selon les différents compartiments du tractus gastro-intestinal porcin exprimée en unité formatrice de colonies par gramme de contenu (UFC/g). ... 8
Figure 3. Principales voies d’entrée des antigènes dans le tissu intestinal. ... 12
Figure 4. Différenciation des cellules T effectrices. ... 16
Figure 5. Réponses immunitaires mucosales typiques engendrées par les pathogènes entériques. ... 18
Figure 6. Infection par voie orale par les salmonelles... 23
Figure 7. Schéma illustrant les mécanismes potentiels et connus par lesquels les bactéries probiotiques influencent le microbiote et la santé intestinale en général. ... 30
Figure 8. Réponses immunitaires mucosales induites par les bactéries probiotiques et commensales. ... 38
Chapitre 1 : Analyse par T-RFLP des effets chez le porcelet de Pediococcus acidilactici et Saccharomyces cerevisiae ssp. boulardii sur le microbiote fécal lors de la lactation et sur le microbiote fécal, iléal et du côlon suite au sevrage Figure 1. Influence of dietary treatments on densities (Log10 cfu/g sample) of selected bacterial groups in (a) feces of piglets at day 10 of lactation, (b) in feces one week (d28) post-weaning, (c) in the ileum and (d) colon contents two weeks post-weaning (d37). ... 58
Figure 2. NMS triplot representation of T-RFLP fingerprints from the 16S rDNA of the bacterial community in (a) feces on d10, (b) feces on d28, (c) ileal contents and (d) colon contents from d37. ... 65
Liste des abréviations
ACTB = Beta-actin gene;
ADN = Acide désoxyribonucléique; ANOVA = Analysis of variance; ARNr = Acide ribonucléique ribosomal;
ATB = Groupe recevant des antibiotiques dans leur alimentation (groupe de référence), Reference group in which antibiotics were added to weanling feed;
BAMP = Motif moléculaire associé aux bactéries; bp = Base pairs;
BSA = Bovine serum albumin;
CARD = Domaine de recrutement et d’activation de caspase, Caspase activation and recruitment domain; CCAC = Conseil Canadian de protection des animaux, Canadian council on animal care;
CD = Cellules dendritiques; cDNA = Complementary DNA; cfu = Colony forming unit; Ch = Challenge;
CMH = Complexe majeur d'histocompatibilité; CPA = Cellules présentatrices d’antigène; CpG = Cytosine polyguanine;
Cq = Quantification cycle; CT = Threshold cycle;
CTRL = Groupe contrôle, Control group;
DGGE = Électrophorèse sur gel en gradient dénaturant; DNA = Deoxyribonucleic acid;
DSS = Dioctylsulfosuccinate de sodium; DT = Type définitif, Definitive type;
ELISA = Enzyme-linked immunosorbent assay;
ETEC = Escherichia coli entérotoxigénique, Enterotoxigenic Escherichia coli; FAM = Carboxyfluorescein;
FITC = Fluoreccein;
GALT = Tissue lymphoïde associé à l’intestin, Gut-associated lymphoid tissue; GAPDH = Glyceraldehyde-3-phosphate dehydrogenase gene;
GM = Ganglions mésentériques;
HACCP = Système d'analyse des dangers - points critiques, Hazard Analysis Critical Control Point; HBSS = Hank’s basal salt solution;
hpc = Hour post-challenge;
IFN-γ = Interféron gamma, Interferon-gamma; Ig = Immunoglobuline;
IL = Interleukine;
ISA = Indicator species analysis; IV = Indicator value;
LAMVAB = Lactobacillus Anaerobic MRS with Vancomycin and Bromocresol green; LB = Luria-Bertani;
LPS = Lipopolysaccharide;
MANOVA = Multivariate analysis of variance; MiCA = Microbial Community Analysis; MLN = Mesenteric lymph nodes; mRNA = Messenger RNA;
MRPP = Multi-Response Permutation Procedure; NK = Natural killer cell;
NMS = Non-metric Multidimensional Scaling;
NOD = Domaine d’oligomérisation et de liaison des nucléotides, Nucleotide-binding oligomerization domain; OMS = Organisation mondiale de la santé;
OTU = Operational taxonic units;
PA = Pediococcus acidilactici MA18/5 M;
PAMP = Motif moléculaire associé aux bactéries pathogènes, Pathogen associated molecular pattern; PBMC = Peripheral blood mononuclear cell;
PBS = Phosphate buffered saline;
PCR = Réaction en chaîne par polymérase, Polymerase chain reaction; PE = Phycoerythrin;
PMN = Leucocytes polymorphonucléaires; PPIA = Cyclophilin A gene;
RDML = Real-time PCR data markup language; rDNA = Ribosomal DNA;
RDP = Ribosomal database project;
RFLP = Restriction fragment length polymorphism; rfu = Relative fluorescent units;
SCB = Saccharomyces cerevisiae ssp. boulardii CNCM I-1079; SCV = Vacuole contenant Salmonella, Salmonella containing vacuole; SEM = Pooled standard error of the mean;
sIgA = Secretory Immunoglobulin A; SPI = Îlots de pathogénicité Salmonella; spp = Espèces, species;
ssp = Sous-espèces; subsp = Sub-species;
SST3 = Système de sécrétion de type III; ST = Salmonella Typhimurium Dt104; Tfh = Cellule T effectrice folliculaire; TG = Target gene;
TGF-β = Facteur de croissance transformant bêta, Transforming growth factor-beta; Th = Cellule T effectrice;
TLR = Récepteur de type Toll, Toll-like receptor;
TP = Type phagique; Treg = Cellule T régulatrice;
T-RF = Terminal restriction fragment;
T-RFLP = Polymorphisme de longueur des fragments terminaux, Terminal restriction fragment length polymorphism;
TRT = Treatment;
UFC = Unité formatrice de colonies; USP = United States Pharmacopeia unit; ZO = Zona occludens;
Remerciements
Franchir des étapes importantes de notre vie ne s’effectue pas seul, mais nécessite des gens qui nous aident à passer au travers pour accomplir nos objectifs. J’aimerais remercier les personnes suivantes et bien d’autres encore :
Pour avoir accepté de me prendre sous sa tutelle, pour ses commentaires éclairants et son esprit critique, mon directeur de recherche, le Dr Denis Roy;
Pour m’avoir accepté et accompagné pendant toutes ces années, pour son indéfectible disponibilité, son encadrement et sa confiance, mon codirecteur, le Dr Martin Lessard; Pour leurs encouragements, leurs grands professionnalismes et leurs toujours judicieux conseils, mes collègues et amis, Karoline Lauzon et Frédéric Beaudoin;
Pour leur indispensable aide tout au long des analyses, Steve Methot et la Dre Guylaine Talbot;
Pour leurs travaux acharnés, mes stagiaires, Guillaume Huftier, Guillaume St-Pierre, David Roy… et les autres qui n’ont été que de passage;
Pour toute l’aide reçu lors des différentes étapes des projets, les indispensables travailleurs du complexe porcin du CRDBLP et plus particulièrement, Justin, Mélanie, Dominique et France;
Pour les belles valeurs qu'ils m'ont transmises, leur inconditionnel soutien et leurs encouragements, mes parents, Louise et Jean;
Et parce que, sans son constant support et son amour ce mémoire aurait été insurmontable, un merci particulier à ma conjointe Dominic.
Avant-propos
Ce mémoire est présenté sous forme d’articles scientifiques pour soumission à des revues avec comité de lecture. Afin de respecter les normes de la Faculté des études supérieures, les sections rédigées en anglais sont précédées d’un résumé en français et les références bibliographiques des sections sont présentées à la fin du document pour éviter la redondance. Les tableaux présentés dans les articles sont désignés par l’appellation « T a b l e » et sont insérés dans le texte tout comme les figures (lorsque présente), pour faciliter la fluidité de la lecture et la compréhension par le lecteur.
Le manuscrit débute par une courte introduction qui est suivie d’une section, intitulée « Revue de la littérature ». Cette première section donne une vue d'ensemble des connaissances actuelles sur le microbiote et le système immunitaire du porcelet; sur l’importance des infections entériques causées par Salmonella Typhimurium DT104 chez le porcelet; et, finalement, sur les connaissances entourant les mécanismes d’actions des probiotiques sur l’hôte. Subséquemment, le but, les hypothèses et les objectifs de recherche sont posés. Le manuscrit est par la suite divisé en trois chapitres.
Le premier chapitre, intitulé « Analyse par T-RFLP des effets chez le porcelet de Pediococcus acidilactici et Saccharomyces cerevisiae ssp. boulardii sur le microbiote fécal lors de la lactation et sur le microbiote fécal, iléal et du côlon suite au sevrage », évalue par T-RFLP la composition bactérienne du microbiote intestinal de porcelets recevant des probiotiques, des antibiotiques ou aucun supplément. Les résultats de ce travail seront soumis au journal Applied and Environmental Microbiology. Pour la réalisation de cet article scientifique, j’ai mis au point et validé la technique T-RFLP, j’ai participé aux différents aspects des phases animales, et à la collecte des échantillons. J’ai réalisé presque entièrement l’analyse des échantillons et l’interprété des résultats des tests microbiologiques et de T-RFLP. Assisté de David Roy, un stagiaire COOP de l’Université de Sherbrooke, j’ai mis sur pied une banque de clones du gène de l’ARN ribosomal 16S et effectué l’analyse et la compilation des résultats de séquençage. Finalement, j’ai conçu les figures et tableaux, et rédigé le manuscrit. Frédéric Beaudoin a supervisé les phases animales, participé aux différentes collectes d’échantillon, à la mise au point de la technique T-RFLP et de la banque de clones, et à l’interprétation des résultats. Karoline
Lauzon a activement participé aux phases animales, à la collecte d’échantillon, aux analyses microbiologiques et à la compilation de données. J’ai aussi bénéficié de l’aide précieuse et des judicieux conseils du Dr Guylaine Talbot pour le traitement et l’interprétation des résultats obtenus par T-RFLP. Finalement, le Dr Denis Roy a participé à la conceptualisation du projet de recherche et à l’interprétation des résultats. Toutes ces personnes ont de plus révisé le manuscrit dont ils sont coauteurs.
Le second chapitre, intitulé « Effets de Pediococcus acidilactici et Saccharomyces cerevisiae ssp. boulardii sur l’immunité intestinale et systémique du porc suite à une infection expérimentale à Salmonella Typhimurium DT104 », détermine chez le porc l’efficacité de traitements probiotiques à prévenir la colonisation de l’intestin par Salmonella Typhimurium DT104. De plus, cette section caractérise par PCR en temps réel l’influence des différents traitements probiotiques sur l’expression de gènes du système immunitaire, et par cytométrie de flux la concentration des différentes populations de cellules immunes retrouvées dans différents tissus avant et 24 h après l’infection. Les résultats de ce travail seront soumis au Journal of Animal Science. Pour la réalisation de cet article scientifique, j’ai participé aux différents aspects des phases animales, à la collecte des échantillons. J’ai effectué les analyses de cytométrie de flux, la quantification des anticorps et j’ai assisté Guillaume St-Pierre, stagiaire COOP de l’Université de Sherbrooke, lors des analyses de PCR en temps réel. Finalement, j’ai fait l’interprétation des résultats, conçu les figures et tableaux, et rédigé le manuscrit. Frédéric Beaudoin a supervisé les phases animales, participé aux différentes collectes d’échantillon, à l’analyse de ces derniers par PCR en temps réel et par cytométrie de flux et, finalement, à la compilation et à l’interprétation des résultats. Karoline Lauzon a activement participé aux phases animales, à la collecte d’échantillon, aux analyses par PCR en temps réel et par cytométrie de flux, et à la compilation des données. Le Dr Ann Lettelier a participé à la conceptualisation du projet de recherche et aux activités entourant les infections expérimentales des porcs. Finalement, le Dr Denis Roy a participé à la supervision du projet de recherche. Les personnes ici mentionnées ont aussi révisé le manuscrit dont ils sont coauteurs.
Pour ces deux chapitres, le Dr Martin Lessard a supervisé de façon attentive et a participé activement aux phases animales, aux collectes et aux traitements des échantillons. Il est à
l’origine de la conceptualisation des projets de recherche et il a contribué à encadrer l’analyse et l’interprétation des résultats. Il a de surcroît orienté et révisé les manuscrits afin d’en augmenter la fluidité et la valeur scientifique.
Finalement, le troisième chapitre présente une discussion des résultats les plus importants de cette étude, les perspectives pour des travaux futurs et une conclusion générale.
Introduction générale
La production porcine constitue un levier économique important pour différentes régions du Québec. Fortement intégrée au milieu rural, elle est aussi, de par son rôle et son importance, un élément stabilisateur de l’économie régionale. Elle façonne en fait une chaîne d’activités reliant les consommateurs, les commerçants, les transformateurs et les producteurs. En 2002, selon le ministère de l’Agriculture, des Pêcheries et de l’Alimentation du Québec, les recettes de l’industrie porcine, tous secteurs confondus, étaient de 3,4 milliards de dollars et fournissaient près de 29 000 emplois directs et indirects. En 2003, l’élevage porcin était la deuxième plus grande industrie bioalimentaire du Québec après l’élevage laitier.
Chez les éleveurs de porcs, il est reconnu que la période de sevrage (passage de la lactation (alimentation liquide) à une alimentation solide) est une période très critique pour les porcelets puisqu’ils sont soumis à plusieurs stress tels, la séparation brusque de leur mère et du reste de la portée, un changement d’environnement et une modification drastique de l’alimentation. Cela entraîne un ralentissement de la croissance, une plus grande susceptibilité aux maladies et une plus grande morbidité (92, 166).
Au Canada, les éleveurs ont recours aux aliments médicamentés contenant des antibiotiques afin d’améliorer les performances de croissance des porcelets et diminuer les effets néfastes du sevrage. Cependant, cet usage des antimicrobiens est sévèrement critiqué dû à la possible acquisition de résistances par les microorganismes pathogènes et par les bactéries composant la flore commensale (microbiote). Le développement de résistances aux antimicrobiens constitue un phénomène inquiétant et lourd de conséquences pour le traitement et la prévention des maladies infectieuses tant chez l’animal que chez l’humain. Pour empêcher que les producteurs subissent une augmentation du coût de production causée par une abolition des antibiotiques comme facteurs de croissance, de nouvelles alternatives plus naturelles doivent être adoptées. Les additifs et les ingrédients susceptibles de remplacer les antibiotiques sont nombreux, mais pour plusieurs leur efficacité reste à démontrer.
Parmi ces produits, les probiotiques suscitent beaucoup d’intérêt. Le terme « probiotique » est utilisé pour définir les préparations de microorganismes vivants qui sont ajoutées aux aliments pour améliorer la santé intestinale de l’hôte en agissant positivement sur la balance microbienne du tractus gastro-intestinal (273). Bien que plusieurs études suggèrent que les probiotiques améliorent les performances des porcelets après le sevrage (1, 132, 291), les mécanismes d’action sont toujours inconnus. Un certain nombre de mécanismes biologiques plausibles ont été suggérés pour expliquer les effets bénéfiques sur la santé, cependant les données scientifiques disponibles ne sont pas toujours suffisantes pour les supporter. Malgré tout, plusieurs études ont démontré que l’ingestion de probiotiques durant la période néonatale et de sevrage aurait comme effet de promouvoir un meilleur développement, d’influencer l’activité du microbiote et de stimuler la réponse immunitaire (1, 56, 132, 172, 176, 278, 281, 291). Plusieurs travaux ont aussi été effectués dans le but de comprendre et d’expliquer comment les probiotiques influencent le microbiote du tractus gastro-intestinal (3, 25, 36, 94). Par contre, très peu d’études ont porté leur attention sur l’impact des probiotiques, premièrement, au niveau de l’établissement du microbiote intestinal du porcelet, deuxièmement, au niveau de la modulation de cette flore à la suite du sevrage et troisièmement, au niveau des effets modulatoires des probiotiques sur le système immunitaire inné et acquis lors d’une infection entérique chez le porcelet sevré.
Le projet vise à évaluer, l’influence d’administrer seul ou en combinaison, deux probiotiques disponibles commercialement, Pediococcus acidilactici MA18/5 M (PA) et Saccharomyces cerevisiae ssp. boulardii CNCM I-1079 (SCB), à des truies (fin de gestion et lactation) et aux porcelets dès la naissance. Le but étant d’améliorer la santé intestinale des porcelets dès la naissance et d’augmenter leur résistance aux infections en modulant le microbiote et le système immunitaire des porcelets.
Revue de la littérature
1. Le microbiote intestinal du porcelet
1.1. Établissement et développement du microbiote intestinal porcin
L’établissement du microbiote intestinal chez le porcelet est un évènement complexe qui implique une succession de phases où divers groupes bactériens s’implantent dans le tractus gastro-intestinal, pour éventuellement devenir à l’âge adulte un écosystème dynamique et unique à chaque individu (149).
Dans une étude pionnière, Swords et ses collègues (302) ont étudié l’évolution du microbiote fécal porcin lors des quatre premiers mois de vie. Ils ont conclu que l’établissement de la flore fécale adulte est un processus complexe qui peut-être divisé en trois phases marquées par la dominance de différents groupes bactériens. La première phase correspond à la première semaine de vie, la deuxième correspond aux jours restant de lactation et la troisième, du sevrage jusqu’à l’adaptation à l’alimentation solide.
1.1.1. La colonisation primaire
À la naissance, le porcelet entre dans un nouveau monde en passant d’un milieu stérile à un environnement extrêmement contaminé. Le contact avec le vagin, les fèces ainsi que la peau de la mère débutent la colonisation du tractus gastro-intestinal du porcelet (48). En fait, ce sont principalement les fèces de cette dernière qui jouent un rôle clé dans l’établissement et le développement futur du microbiote avec une consommation par les porcelets allant jusqu’à 85 g par jour selon l’estimation effectuée par Sansom et Gleed (276).
Les premiers genres bactériens détectés dans le tube digestif des porcelets, trois heures à la suite de leur naissance, sont à 80% des bactéries aérobies et anaérobies facultatives provenant de la truie (302). Ces premiers colonisateurs utiliseront l’oxygène rendant ainsi l’environnement intestinal favorable à la colonisation par les bactéries anaérobies. Un autre élément qui influence grandement les antigènes qui entrent dans le tube digestif provient du colostrum ingurgité par les porcelets, qui est riche en immunoglobulines (28).
Graduellement, les bactéries aérobies et anaérobies facultatives sont remplacées par des bactéries anaérobies strictes (302).
À la fin de la première semaine de vie des porcelets, les genres microbiens les plus adaptés aux nutriments contenus dans le lait, principalement des lactobacilles et des streptocoques, deviennent les groupes bactériens dominants et le resteront durant toute la durée de la lactation avec des dénombrements allant de 107-109 unité formatrice de colonies par gramme (UFC/g) de matière fécale (81, 302).
1.1.2. De la fin de la 1ere semaine au sevrage
Durant la seconde phase, les bactéries anaérobies se diversifient (135) éliminant presque totalement les bactéries aérotolérantes (302). Habituellement, dans cette phase, des bactéries des genres Clostridium, Bacteroides, Bifidobacterium, et en plus faible quantité, Eubacterium, Fusobacterium, Propionibacterium et Streptococcus sont isolées (253, 302). Ce microbiote, instauré pendant la lactation, demeure relativement stable quant à sa composition en espèce, et ce, tant que le porcelet se nourrit du lait maternel (325).
1.1.3. Le sevrage et l’adaptation à l’alimentation solide
En Amérique du Nord, les producteurs de porcs effectuent le sevrage des porcelets tôt dans leur vie, soit habituellement entre deux et trois semaines d’âge, et de façon très brusque. Le changement d’alimentation provoque d’importantes perturbations au niveau du microbiote intestinal en diminuant la diversité microbienne (333) avec des changements quantitatifs et qualitatifs majeurs observés immédiatement à la suite du sevrage (141, 187). Les glucides devenant la principale source énergétique au lieu des lipides, il est logique que le microbiote soit grandement affecté.
1.1.3.1. Le sevrage commercial des porcelets
Cette étape dans la vie du porcelet engendre des stress de nature physiologique et psychologique qui provoquent une diminution de la prise alimentaire (166), d’importantes modifications structurelles et fonctionnelles au niveau intestinal (122), une perturbation du microbiote (135) et finalement, une plus grande morbidité et une plus grande susceptibilité aux infections (92). L’immunité passive due aux anticorps du lait n’étant plus disponible et
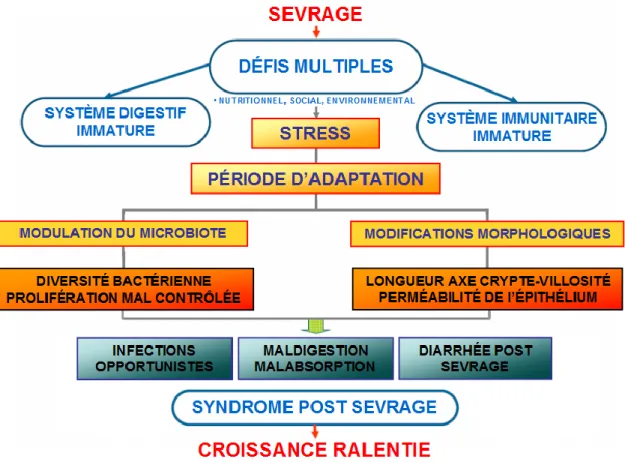
leur système immunitaire n’étant pas encore mature (11), les porcelets deviennent effectivement plus vulnérables aux infections entériques. Ces changements au sein de l’intestin sont aussi responsables de réactions inflammatoires intestinales caractérisées par une augmentation de l’expression de cytokines pro-inflammatoires (248). Concrètement, le sevrage provoque un ralentissement de la croissance des porcelets (Figure 1) (191, 192). Dans l’industrie porcine Nord Américaine, pour atténuer les effets néfastes du sevrage, il est coutume de supplémenter la moulée avec de faibles doses d’antibiotiques.
Figure 1. Schéma de l’impact du sevrage sur la santé intestinale du porcelet. (Modifié de Castillo-Gomez, (36))
1.1.3.2. L’utilisation d’antibiotiques comme facteurs de croissance
L’incorporation de faible dose d’antibiotiques dans l’alimentation a démontré, depuis plus de 50 ans, qu’elle favorise le gain de poids des animaux sevrés et qu’elle vient prévenir, quoique très faiblement, le développement de bactéries pathogènes (49, 50). Globalement,
beaucoup d’arguments étayent l’hypothèse que le microbiote intestinal est impliqué dans les effets observés (88, 90). Les antibiotiques réduiraient certains effets nutritionnels négatifs du microbiote sur l’animal tels que la compétition avec l’hôte pour les nutriments et la production de métabolites microbiens affectant la croissance (259, 275, 331), ce qui augmente la disponibilité des nutriments et donc l’énergie disponible pour le développement de l’animal (328). Cet effet d’épargne est particulièrement net pour les acides aminés, et se traduit par une amélioration de la rétention d’azote (65, 89, 205, 259). Cependant, l’utilisation souvent injustifiée de certains antibiotiques, pour le traitement des maladies humaines et animales ou encore en prophylaxie, serait selon la communauté scientifique, la cause du développement de résistances chez les bactéries. L’utilisation d’antibiotiques comme facteur de croissance pour les animaux d’élevage est aussi sévèrement critiquée (295).
1.1.4. Perturbation puis stabilisation du microbiote suite au sevrage
La troisième phase de colonisation du tractus gastro-intestinal du porcelet est directement liée au sevrage et est caractérisée par une diminution des bactéries anaérobies à Gram positif au profit d’espèces à Gram négatif du genre Bacteroides (140, 302). Une diminution des lactobacilles en parallèle avec une augmentation des entérobactéries a aussi été observée (91, 140, 187, 302). En fait, le sevrage commercial a été associé avec une diminution d’un facteur 100 du nombre de lactobacilles dans l’intestin et une augmentation de 50 fois du nombre d’Escherichia coli (133).
Deux à trois semaines à la suite du sevrage, chez les individus en santé, le microbiote se stabilise et devient caractéristique de chacun (293). Les différents genres et espèces microbiens cultivables sont présentés dans le tableau 1 (300), tandis que les principales lignées phylogénétiques, identifiées en séquençant le gène de l’acide ribonucléique ribosomal (ARNr) 16S, sont présentées dans le tableau 2 (169). Selon l’étude effectuée par Leser et ses collègues en 2002, 83% des séquences amplifiées correspondent à des genres ou espèces bactériens inconnus, ces séquences ayant une homologie plus petite que 97% avec toutes les séquences de microorganismes qui étaient connues à ce jour. Globalement, deux Phyla prédominent; les Firmicutes et les Bacteroidetes qui regroupent approximativement 80% des phylotypes identifiés (74, 169, 175)
Tableau 1. Types bactériens cultivables provenant du tractus gastro-intestinal porcin. (Adapté de Stewart et al. (300))
Tableau 2. Principales lignées phylogénétiques associées aux phylotypes identifiés dans le tractus gastro-intestinal du porc. (Adapté de Leser et al. (169))
a Groupe phylogénétique selon le Ribosomal Database Project
b Homologie moyenne des phylotypes associés au groupe phylogénétique
Bactéries
Le long du tube digestif d’un animal adulte, la densité bactérienne augmente pour atteindre au niveau du côlon une concentration d’environ 1011-1012 UFC/g (Figure 2) (81). On retrouve plus de 500 différentes espèces bactériennes indigènes dans la portion terminale du tractus gastro-intestinal d’un porc adulte (326), avec au total approximativement 1014 bactéries, ce qui est dix fois plus élevées que le nombre total de cellules formant l’hôte (179).
Figure 2. Densité microbienne retrouvée selon les différents compartiments du tractus gastro-intestinal porcin exprimée en unité formatrice de colonies par gramme de contenu (UFC/g). (Modifié de Kamel et Gasa (147))
1.2. Effets bénéfiques du microbiote sur l’hôte
L’écosystème du tube digestif des mammifères joue un rôle important pour l’hôte en lui fournissant des produits essentiels (digestion de nutriments) (346), en diminuant la susceptibilité aux infections entériques (282), en agissant sur le développement de la paroi intestinale (43) et du système immunitaire (241) et même en modulant, chez l’hôte, l’expression de certains gènes (131). Le tractus gastro-intestinal offre des niches stables pour les bactéries et, en retour, le microbiote influence la physiologie intestinale de l’hôte.
La relation entre l’hôte et le microbiote peut donc être caractérisée comme étant du mutualisme et non du commensalisme (54). Même que selon O’Hara et Shanahan le microbiote peut être considéré comme un organe à l’intérieur d’un organe (229).
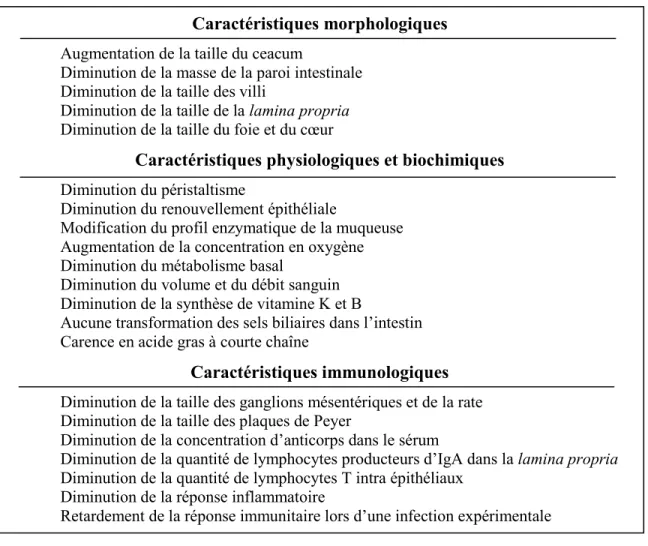
Les effets observés sur l’hôte sont directement liés à la présence de bactéries commensales. Cette affirmation a été démontrée en comparant des animaux axéniques, animaux accouplés et gardés dans un environnement stérile, à des animaux de la même espèce élevés de façon traditionnelle (Tableau 3) (21, 323, 347). Ces effets sont appelés : caractéristiques associées au microbiote (207). En fait, le microbiote intestinal agit en contribuant au développement des trois lignes principales de défense; par exemple, les bactéries peuvent entrer en compétition avec les pathogènes, stimuler la fonction de barrière de l’épithélium et moduler l’immunité intestinale.
Tableau 3. Caractéristiques des animaux axéniques lorsque comparés aux animaux de la même espèce possédants un microbiote intestinal typique.
Caractéristiques morphologiques
Augmentation de la taille du ceacum
Diminution de la masse de la paroi intestinale Diminution de la taille des villi
Diminution de la taille de la lamina propria Diminution de la taille du foie et du cœur
Caractéristiques physiologiques et biochimiques
Diminution du péristaltisme
Diminution du renouvellement épithéliale
Modification du profil enzymatique de la muqueuse Augmentation de la concentration en oxygène Diminution du métabolisme basal
Diminution du volume et du débit sanguin Diminution de la synthèse de vitamine K et B
Aucune transformation des sels biliaires dans l’intestin Carence en acide gras à courte chaîne
Caractéristiques immunologiques
Diminution de la taille des ganglions mésentériques et de la rate Diminution de la taille des plaques de Peyer
Diminution de la concentration d’anticorps dans le sérum
Diminution de la quantité de lymphocytes producteurs d’IgA dans la lamina propria Diminution de la quantité de lymphocytes T intra épithéliaux
Diminution de la réponse inflammatoire
2. Le système immunitaire intestinal
Le but du système immunitaire consiste à reconnaître les molécules et les organismes étrangers agressifs, d’empêcher leur propagation et finalement de les éliminer. Ce système est composé de milliards de cellules différentes qui proviennent, à quelques exceptions près, de la moelle osseuse et qui interagissent pour combattre les infections.
Le système immunitaire intestinal est géré par ce qu’on nomme les tissus lymphoïdes associés à l’intestin ou GALT (gut-associated lymphoid tissue) qui à son tour fait partie du système immunitaire mucosal. Ce dernier est en quelque sorte indépendant du système immunitaire systémique bien que ces deux systèmes utilisent les mêmes acteurs et qu’ils soient en constante interaction. Cette démarcation vient du fait que le système immunitaire intestinal a deux fonctions majeures : premièrement, il doit reconnaître et éliminer les pathogènes et, deuxièmement, il doit établir une tolérance face aux antigènes alimentaires et aux bactéries commensales. C’est par cette dernière fonction que le GALT se démarque particulièrement. En tout temps, il doit y avoir un étroit contrôle de la réaction immunitaire pour prévenir l’inflammation et les allergies alimentaires, sans toutefois empêcher l’établissement d’une réponse contre les pathogènes et les molécules toxiques. Ce système est un des plus complexes et des moins bien compris, encore de nos jours, par les scientifiques.
Les prochaines sections décriront le développement du système immunitaire intestinal chez le porcelet, les différentes voies d’entrées des antigènes et leur reconnaissance par le système immunitaire, l’activation des lymphocytes T auxiliaires et B, et finalement les réponses faces aux pathogènes entériques.
2.1. Développement du système immunitaire intestinal du porcelet
Il y a deux périodes importantes durant lesquelles le jeune animal est exposé à plusieurs nouveaux antigènes soit; immédiatement après la naissance et suite au sevrage. Lors de ces deux périodes, les antigènes du contenu intestinal peuvent changer soudainement dû à la modification de la diète et à l’introduction de nouvelles espèces et souches bactériennes (12).
À la naissance et lors des premières semaines de vie chez les mammifères, le système immunitaire intestinal est immature. Tel que mentionné précédemment, le porcelet est immunodéficient durant les 4 à 7 premières semaines de sa vie, mais, lors des deux ou trois premières semaines, cette déficience est balancée par le colostrum et le lait obtenu de la mère qui sont riches en plusieurs molécules permettant au nouveau-né de se protéger des infections (99). On retrouve notamment plusieurs cytokines et immunoglobulines, dont les IgA et les IgG, ainsi que différents facteurs de croissance qui améliorent le développement précoce du porcelet. La compétence immunitaire du porcelet se développera progressivement jusqu’à atteindre sa maturité. Ce processus de développement est séparé en quatre phases qui furent établies par Bailey et ses collègues (11-13). Ces étapes du développement sont présentées dans le tableau 4.
Tableau 4. Stades de développement du système immunitaire mucosal du porcelet nouveau-né.
2.2. Voies d’entrées et reconnaissance des antigènes intestinaux
Les mammifères, au cours de leur évolution, ont développé des portes d’entrée spécifiques ainsi qu’un mécanisme complexe de reconnaissance des différents antigènes présents dans la lumière intestinale.
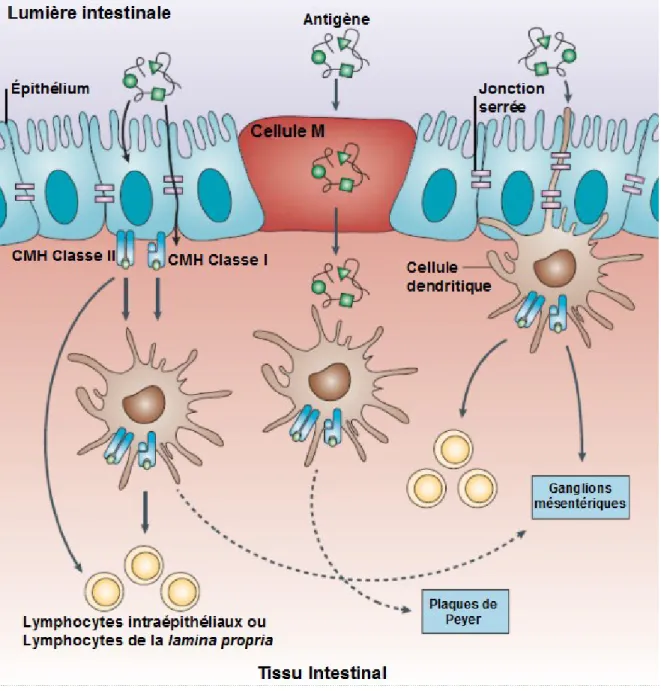
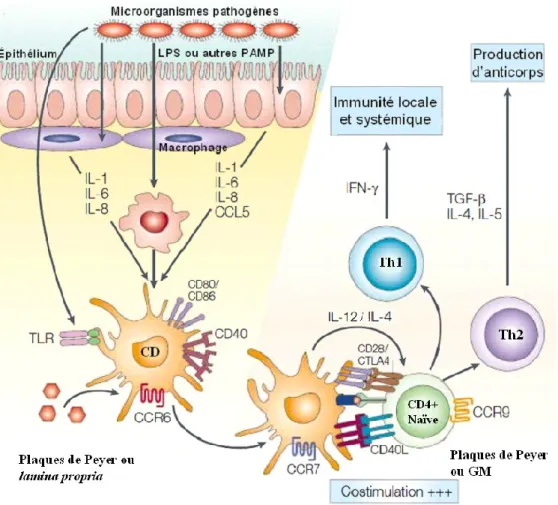
Figure 3. Principales voies d’entrée des antigènes dans le tissu intestinal. Les cellules M captent et transportent activement des antigènes pour les transférer aux cellules présentatrices d’antigène (CPA), c’est-à-dire aux cellules dendritiques (CD) présentes au niveau des plaques de Peyer. Les cellules épithéliales peuvent effectuer de l’endocytose, puis apprêter et présenter les antigènes captés via leurs complexes majeurs d’histocompatibilité (CMH) de classe I et de classe II aux lymphocytes intraépithéliaux ou de la lamina propria, ou encore transférer les antigènes apprêtés aux CD de la muqueuse. Les CD peuvent aussi directement échantillonner les antigènes de la lumière intestinale en faufilant leurs dendrites entre les cellules épithéliales, et ce, sans perturber l’intégrité de l’épithélium. (Adapté de Cheroutre et Madakamutil (39))
De nos jours, trois routes principales d’entrées des antigènes ont été élucidées. La première voie d’entrée est formée de cellules spécialisées nommées cellules micropuits ou, de façon plus courante, cellules M. Ces cellules sont retrouvées au niveau de l’épithélium qui recouvre les plaques de Peyer et les follicules lymphoïdes. Ces portails stratégiquement situés permettent un échantillonnage contrôlé des antigènes de la lumière intestinale et une livraison directe de ces antigènes aux cellules immunitaires localisées dans les plaques de Peyers, la lamina propria et les organes lymphoïdes sous-jacents (225), ce phénomène est appelé la transcytose. Les cellules dendritiques (CD), sont des cellules présentatrices d’antigène (CPA) dites professionnelles, et sont abondantes dans la région basale des cellules M des plaques de Peyer. Ces CD apprêtent les antigènes captés puis les présentent aux cellules T pour induire une réponse immune.
Les cellules absorbantes de l’épithélium peuvent aussi participer activement à la réponse immunitaire (Figure 3). Ces cellules peuvent capter des macromolécules et les présenter, via le complexe majeur d'histocompatibilité (CMH) de classe I ou de classe II, directement aux cellules T activées intraépithéliales ou encore transférer l’antigène aux CD immatures de la lamina propria (39). Ces CPA mobiles vont ensuite passer par une étape de maturation et migrer vers les ganglions drainants où elles pourront présenter l’antigène aux cellules T naïves.
Finalement, les CD, équipées de longues dendrites, peuvent échantillonner directement les antigènes de la lumière intestinale (260). De façon similaire aux cellules absorbantes, les CD épithéliales produisent des protéines retrouvées au niveau des jonctions serrées qui leur permettent de former des connexions avec les cellules de l’épithélium conservant ainsi l’intégrité de la barrière cellulaire de l’épithélium (Figure 3) (260).
Pour reconnaître adéquatement les différents antigènes, deux principales classes de récepteurs existent chez les mammifères. Les récepteurs de type Toll (TLR) qui sont principalement retrouvés associés à la membrane cellulaire. Ces récepteurs possèdent un domaine externe riche en leucine et un domaine intracellulaire qui permet la transduction du signal d’activation vers l’intérieur de la cellule (304). L’autre type de molécule, nommé, domaine d’oligomérisation et de liaison des nucléotides ou NOD (nucleotide-binding oligomerization domain), est retrouvé dans le cytosol des cellules épithéliales et des
cellules du système immunitaire. Ces protéines ont aussi un domaine riche en leucine, en C-terminal, et un domaine CARD (caspase activation and recruitment domain) en N-terminal (134). Récemment, une autre protéine intracellulaire, nommée Ipaf, a été décrite (86, 204). Cette protéine reconnaît la flagelline cytoplasmique et on la retrouve entre autres dans les macrophages.
Tableau 5. Ligands des différents récepteurs de type Toll (TLR) présents dans l’intestin. (Adapté de Uematsu et Akira, (321))
Au niveau de l’intestin, les cellules épithéliales et immunitaires expriment certains TLR (TLR1, TLR2, TLR3, TLR4, TLR5 et TLR9) et Nod1 et Nod2 (2, 238, 247). Nod1 et Nod2 reconnaissent différents motifs dérivés du peptidoglycane des bactéries (247), ce qui suggère que ces protéines perçoivent les pathogènes intracellulaires (329). Les TLR, pour leur part, reconnaissent différentes composantes de bactéries, de virus, de protozoaires et de champignons (Tableau 5). Lorsqu’un microorganisme pathogène est détecté par les cellules épithéliales, ces dernières s’activent et libèrent diverses cytokines et chimiokines menant au recrutement et à l’activation de plusieurs cellules immunitaires, telles que les cellules dendritiques et les macrophages (265). La liaison d’un motif conservé des bactéries (BAMP) à un TLR ou Nod engendre une cascade de signalisation qui mène à : la prolifération des cellules épithéliales, la sécrétion d’IgA, la production de peptides
TLR TLR1 TLR2 TLR3 TLR4 TLR5 TLR9 Ligands
Triacyl des lipoprotéines bactériennes
Peptidoglycane des bactéries Gram +, lipoprotéines, lipopeptides, Lipopolysaccharides (LPS) atypiques (bactéries), glycoprotéines virales, zymosan et phospholipomannane des Fungi
ARN double brin d’origine virale ou parasitaire
LPS (bactérie), Mannane et glucuronoxylomannane (Fungi), Glycoinositolphospholipides (protozoaire), glycoprotéines virales Flagelline bactérienne
antimicrobiens, la maturation des CD et l’expression de cytokines et de chimiokines, permettant l’activation des cellules du système immunitaire inné et adaptatif (2, 134, 304). 2.3. Présentation des antigènes et activation des lymphocytes
Les lymphocytes sont les cellules responsables de la réponse immunitaire acquise. Étant donné qu’il y a deux formes principales de réponse immunitaire, humorale et cellulaire, deux grands types de cellules lymphocytaires sont requis soit les lymphocytes B et les lymphocytes T. Les lymphocytes sont principalement retrouvés dans les organes lymphoïdes, dans le sang et dispersés sous les surfaces mucosales (318).
La production de lymphocytes immatures s’effectue dans la moelle osseuse. Avant de devenir mature, les lymphocytes doivent franchir plusieurs étapes essentielles qui s’effectuent principalement dans les tissus lymphoïdes périphériques, tels la rate ou les ganglions mésentériques, pour les cellules B et dans le thymus pour les cellules T. Ces étapes de sélection sont essentielles pour empêcher le développement de cellules autoréactives. Une fois ces étapes effectuées les lymphocytes devront rencontrer leur antigène spécifique pour devenir des plasmocytes ou des cellules mémoires, dans le cas des lymphocytes B, et de puissantes cellules T effectrices CD4+ dans le cas des lymphocytes T. Dans les prochaines sections, les étapes de développement et les diverses propriétés des lymphocytes T CD4+ ainsi que leurs rôles lors d’une infection entérique seront abordés. 2.3.1. Les lymphocytes T CD4+ et la réponse immunitaire intestinale
Chaque année, les recherches effectuées pour mieux comprendre le système immunitaire dévoilent des nouvelles sous-populations de cellules et des nouvelles cytokines et chimiokines. Dans cette section, pour faciliter la compréhension, nous discuterons seulement les principaux éléments de la réponse immunitaire intestinale.
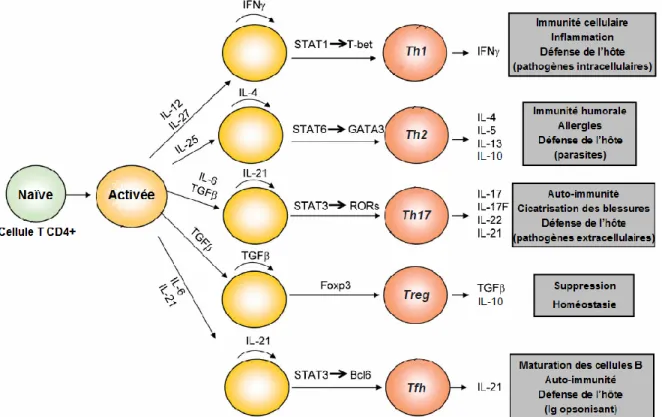
Au moment où les cellules T CD4+ naïves rencontrent leur antigène spécifique à la surface d’une CPA, un processus de différenciation s’entame. Selon l’environnement cytokinaire, les cellules T CD4+ activées peuvent se différencier en différentes sous-classes de cellules Th (Figure 4). Chaque sous-population possède des fonctions effectrices et migratoires uniques caractérisées selon : leurs récepteurs de surface pour les chimiokines, les cytokines
qu’elles sécrètent et le type de réponse immunitaire qu’elles engendrent (52, 66, 67, 109, 343).
Figure 4. Différenciation des cellules T effectrices. Au moment où les cellules T CD4+ naïves rencontrent leur antigène spécifique, présenté par les cellules présentatrices d’antigènes professionnels, elles s’activent et se différencient en différentes classes de cellules T effectrices (Th) (Th1, Th2, Th17, T régulatrice (Treg), Th folliculaire (Tfh)) caractérisées par l’expression de facteurs de transcription spécifiques, leur profil cytokinaire et leurs fonctions immunorégulatrices. (Adapté de Nurieva et Chung, (228))
En tout temps, les diverses sous-populations de lymphocyte T CD4+ travaillent en étroite collaboration pour permettre le maintien de l’homéostasie intestinale, mais aussi pour engendrer une réponse immunitaire adéquate selon le type d’intrus. En temps normal, les antigènes rencontrés proviennent de l’alimentation ou des bactéries peuplant la lumière intestinale. En présence de ces antigènes, les lymphocytes T CD4+ se différencient en cellules Treg qui produisent de l’IL-10 et/ou du TGF-β. Ces deux cytokines sont dites suppressives ou anti-inflammatoires, car elles génèrent la tolérance face aux bactéries commensales et aux antigènes alimentaires (85, 244). De plus, ces cytokines provoquent, chez les lymphocytes B matures, des réarrangements génétiques dans les loci de
l’immunoglobuline qui mènent à la production d’IgA (70). Ce type d’anticorps, produit en grande quantité dans l’intestin, a pour fonction de lier l’antigène avant que celui-ci n’adhère à la muqueuse intestinale. Un autre type de cellule T régulatrice est principalement retrouvé au niveau de la lamina propria. Ces cellules sont nommées cellules T γδ et induisent, lorsqu’injectées à des souris, la tolérance orale face à de nouveaux antigènes (150).
Lorsque des antigènes provenant de bactéries pathogènes sont détectés, une inflammation locale est induite par les cellules épithéliales et les cellules présentatrices d’antigènes. La production de cytokines et de chimiokines attire des CPA et d’autres types de cellules immunitaires au site d’infection (Figure 5). Ces cellules captent les antigènes, se différencient, puis migrent vers les plaques de Peyer et les ganglions mésentériques. En fonction du type de pathogènes rencontré et de l’état d’activation des CPA, ces dernières produiront diverses cytokines (137, 138). Cet environnement influencera les cellules T CD4+ naïves à se différencier pour ainsi induire une réponse immunitaire efficace contre le microorganisme envahisseur.
Dans un environnement inflammatoire constitué d’IL-12, de TNF-α et d’IFN-γ, la réponse immunitaire est de type cellulaire (Th1). Les cellules Th1 sécrètent de l’IFN-γ et de l’IL-2 et s’attaquent principalement aux pathogènes intracellulaires. Par contre, lorsque l’environnement est principalement constitué d’IL-4 et d’IL-10, la réponse est dirigée vers la voie Th2. Les cellules de la voie Th2 sécrètent plusieurs cytokines (4, 5, 6, IL-13 et IL-25) qui mènent à l’élimination des pathogènes extracellulaires (85, 2IL-13). Cette réponse induit principalement une immunité de type humorale, caractérisée par la production d’anticorps de type IgG1/IgE par les plasmocytes (198). Au niveau intestinal, il est bien connu que l’équilibre entre ces deux voies permet de maintenir l’homéostasie tout en permettant une réponse appropriée et efficace face aux antigènes étrangers agressifs. Deux autres sous-populations de cellules T effectrices ont été décrites dans la dernière décennie, celle des Tfh et des Th17. Les cellules Tfh jouent un rôle majeur dans le développement des centres germinatifs des organes lymphoïdes secondaires, comme les plaques de Peyer et les ganglions mésentériques. Ces cellules produisent de l’IL-21 qui régule directement la prolifération des cellules B ainsi que le réarrangement des gènes d’immunoglobuline (298). En ce qui concerne les Th17, c’est en présence d’IL-6, cytokine
pro-inflammatoire, et le TGF-β, cytokine anti-inflammatoire, qu’elles se différencient (23). Les cellules Th17 constituent une population distincte de cellules effectrices, avec comme fonctions principales l'induction de l'inflammation dans les tissus et la protection de l'hôte contre les pathogènes extracellulaires (24).
Figure 5. Réponses immunitaires mucosales typiques engendrées par les pathogènes entériques. Lorsque des molécules associées aux bactéries pathogènes (PAMP) sont détectées par les récepteurs de type Toll (TLR) présents sur les cellules épithéliales et les macrophages, une inflammation locale est induite. Après avoir capté des antigènes, les cellules dendritiques (CD) des plaques de Peyer et de la lamina propria vont passer par des étapes de maturation et de différenciation, puis migrer vers les ganglions mésentériques (GM) ou les plaque de Peyer. Les CD vont alors produire des cytokines telles que l’IL-12 et l’IL-4 et interagirent avec les cellules T CD4+ naïves pour les activer et provoquer leur différenciation en cellules Th1 et Th2. Les principaux récepteurs de chimiokines (CCR6, CCR7 et CCR9) ainsi que les diverses molécules essentielles à l’activation, la différenciation et la migration (CD80/CD86, CD40, CD40L, CD28 et CTLA4) sont représentées dans la figure pour les CD et les cellules CD4+ naïves. (Adapté de Mowat, (215))
En résumé, la conséquence majeure d’une infection intestinale est le développement d’une réponse inflammatoire. Les cytokines et chimiokines retrouvées lors de cette réponse sont la clé pour l’induction d’une réponse immunitaire adaptative. Ces protéines stimulent la différenciation des lymphocytes T CD4+ naïfs qui pourront répondre efficacement à la menace. Malgré tout, certains pathogènes entériques comme les salmonelles peuvent, grâce à leurs différents facteurs de virulence, contourner les défenses intestinales et causer une infection sévère qui peut, dans certains cas, causer la mort de l’hôte.
3. Salmonella
Au cours des dernières années, il a été de plus en plus question de la lutte aux salmonelles dans la filière porcine. Certaines souches de salmonelles peuvent causer des pertes significatives dans les élevages de porc (retard de croissance, mortalité, etc.). Cependant, la principale raison pour lutter contre elles tout le long de la filière, vient du fait que les salmonelles constituent une des principales causes de toxi-infections alimentaires chez l’humain. Meuniers, producteurs, abattoirs et transformateurs, tous sont concernés par cette problématique. En fait, elles sont le principal risque biologique associé à la viande de porc, faisant ainsi l’objet de contrôles dans le cadre du programme gouvernemental d’Analyse des dangers et maîtrise des points critiques (HACCP, de l’anglais; Hazard Analysis Critical Control Point).
3.1. Classification du genre Salmonella
Le genre Salmonella est composé de deux espèces, Salmonella bongori et l’espèce type S. enterica qui est divisée en 6 sous-espèces : enterica (sous-espèce I), arizonae (IIIa), diarizonae (IIIb), houtenae (IV), indica (VI), et salamae (II) (129, 317). Ces sous-espèces regroupent plus de 2500 sérovars (113, 115) qui sont sous-divisés selon la structure de leur flagelle (antigène H), de leurs lipopolysaccharides (LPS) (antigène O) et de leurs carbohydrates (capsule) (antigène K). En pratique, les différents sérovars sont distingués selon la variabilité des antigènes O et H.
En plus du sérotypage, d’autres méthodes telles que le lysotypage, le biotypage, l’antibiorésistance ou l’analyse du profil plasmidique, sont utilisées pour l’identification des salmonelles lors d’études épidémiologiques (15).
3.2. Caractéristiques générales des salmonelles
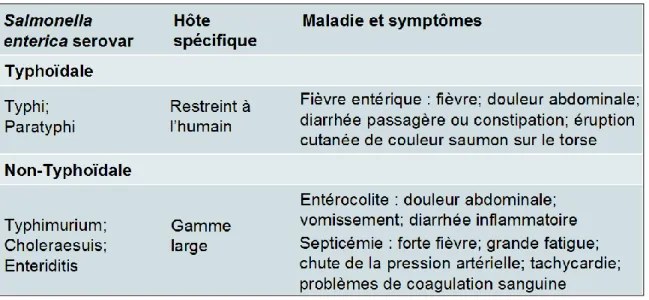
Cette bactérie est un bacille Gram négatif anaérobie facultatif appartenant à la famille des Enterobacteriaceae qui est mobile grâce à ces flagelles péritriches. Elle est intracellulaire facultative et certains sérovars sont spécifiques à un hôte ou restreints à un petit nombre d’hôtes (Tableau 6). Parmi celles-ci, certaines peuvent causer des infections autant chez les animaux que chez l’humain, mais avec des symptômes différents. Par exemple, le sérovar
Typhimurium cause une entérocolite chez l’humain et le porc, mais cause une fièvre de type typhoïdale chez la souris, tandis que le sérovar Choleraesuis cause, lui aussi, une entérocolite chez l’humain, mais une septicémie chez le porc (17).
Tableau 6. Exemples de sérovars de Salmonella enterica; leurs hôtes et leur maladie. (Adapté de Haraga et al. (124))
La salmonellose se développe habituellement suite à une ingestion de nourriture ou d’eau contaminée contenant de 105 à 1010 bactéries avec des symptômes apparaissant soudainement après environ 6 à 72 heures (55). L’infection se développe principalement au niveau de l’iléon et plus rarement au niveau du jéjunum, du duodénum et de l’estomac (27, 196). Habituellement, au bout d’environ 4 à 7 jours, les symptômes disparaissent aussi soudainement qu’ils sont apparus, et ce, sans aucun traitement.
Depuis quelques années, certaines souches de S. enterica sont devenues résistantes aux antibiotiques traditionnellement utilisés pour traiter la salmonellose. C’est le cas notamment des souches d’un sérovar qu’on retrouve aux quatre coins du monde : Salmonella enterica sous-espèce enterica serovar Typhimurium (S. Typhimurium).
3.2.1. Salmonella enterica sous-espèce enterica serovar Typhimurium
La salmonellose est considérée comme l’une des plus importantes zoonoses d’origine alimentaire. S. Typhimurium est parmi les sérovars les plus répandus à travers le monde, ce qui en fait une préoccupation majeure pour la santé publique et animale. Une souche en particulier est, depuis plusieurs années, couramment isolée lors d’épisodes de salmonellose d’origine alimentaire. Il s’agit du type phagique (TP) ou type définitif (DT) 104 de S. Typhimurium (314). Les souches isolées autant chez le porc que chez l’humain sont fréquemment résistantes à l’ampicilline, le chloramphénicol, la streptomycine, les sulfonamides et la tétracycline (249). Cette bactérie peut aussi acquérir d’autres résistances, comme c’est le cas pour certains isolats qui sont non seulement résistants aux antibiotiques mentionnés précédemment, mais aussi à la triméthoprime et/ou à la ciprofloxacine et/ou aux fluoroquinolones (antibiotiques utilisés en première instance pour traiter les complications intestinales et extra intestinales graves de la salmonellose chez l'Homme) (315, 316). Il n’est donc pas étonnant que S. Typhimurium DT104 soit une préoccupation majeure pour la santé publique de plusieurs pays dans le monde, dont le Canada.
3.3. Facteurs de virulence et pathogenèse moléculaire de Salmonella enterica 3.3.1. Mode d’infection
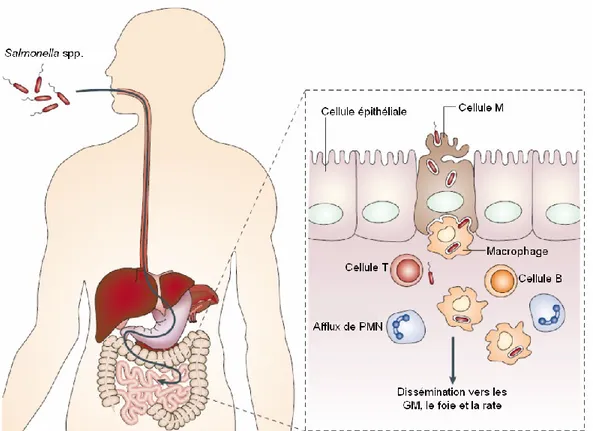
Typiquement, il existe 3 modes de transmission de la salmonelle; par contact direct avec un humain ou un animal infecté, par contact indirect c’est-à-dire via l’environnement ou la nourriture contaminée et finalement, par contact avec un vecteur, qui propage l’agent pathogène d’animal en animal ou de l’animal à l’Homme (301). Le plus couramment, la contamination s’effectue par voie orale (Figure 6). Bien que le passage dans l’estomac diminue à ≈1% la quantité ingérée de bactéries vivantes (32), les salmonelles peuvent s’adapter aux conditions acides de l’estomac et ainsi augmenter leur chance de survie (96). Une fois cet obstacle franchi, les salmonelles se rendent à l’iléon où elles traversent la couche de mucus pour atteindre le feuillet de cellules épithéliales, tout en évitant d’être éliminées par les enzymes digestives, les sels biliaires, les IgA sécrétoires et les peptides antimicrobiens composant la barrière mucosale (206, 251, 280). Une fois adhéré aux cellules de la paroi intestinale, grâce à diverses adhésines, les salmonelles ont la capacité d’induire leur endocytose par les cellules épithéliales. Cette bactérie perturbe la bordure en
brosse des entérocytes et provoque un repliement de la membrane cellulaire qui permet l’engouffrement de la bactérie (18, 305). En fait, les salmonelles pénètrent l’épithélium préférentiellement via les cellules M qui les transportent directement aux cellules immunitaires des plaques de Peyer (144).
Figure 6. Infection par voie orale par les salmonelles. Autant chez l’homme que chez le porc, suite à l’ingestion d’eau ou d’aliments contaminés, les salmonelles qui survivent au pH acide de l’estomac et qui évitent les multiples défenses du petit intestin vont se diriger vers l’épithélium. Ce pathogène, pénètre préférentiellement les cellules M qui les transportent directement vers les cellules immunitaires. Les salmonelles induisent alors une inflammation locale qui attire au site et dans la lumière intestinale, des PMN (leucocytes polymorphonucléaires), ce qui engendre une diarrhée. Certaines salmonelles peuvent aussi survivre à l’intérieur des macrophages et ainsi permettre la propagation de l’infection vers d’autres organes tels que les ganglions mésentériques (GM), le foie et la rate. (Adapté de Haraga et al. (124))