HAL Id: dumas-01657486
https://dumas.ccsd.cnrs.fr/dumas-01657486
Submitted on 6 Dec 2017HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Comparaison des performances de la scintigraphie aux
leucocytes marqués et de la tomographie par émission
de positons au 18F-FDG dans le diagnostic des
infections de prothèses vasculaires : étude prospective
menée au CHU de Bordeaux portant sur 34 patients
inclus sur une période de 3 ans
Mathilde Puges
To cite this version:
Mathilde Puges. Comparaison des performances de la scintigraphie aux leucocytes marqués et de la tomographie par émission de positons au 18F-FDG dans le diagnostic des infections de prothèses vasculaires : étude prospective menée au CHU de Bordeaux portant sur 34 patients inclus sur une période de 3 ans. Médecine humaine et pathologie. 2017. �dumas-01657486�
Année 2017 Thèse n° 3048
UNIVERSITE DE BORDEAUX – U.F.R. SCIENCES MEDICALES
Thèse pour l’obtention du
Diplôme d’état de Docteur en Médecine – Diplôme d’études spécialisées de Médecine Interne Présentée et soutenue publiquement le 2 Juin 2017 par
Mathilde PUGES, née le 18 Novembre 1987 à Rennes (35)
C
omparaison des performances de la scintigraphie
aux leucocytes marqués et de la tomographie par
émission de positons au
18F-FDG dans le diagnostic
des infections de prothèses vasculaires
Etude prospective menée au CHU de Bordeaux portant sur
34 patients inclus sur une période de 3 ans
Rapporteur
Monsieur le Docteur Hervé DUTRONC
Membres du jury
Monsieur le Professeur Michel DUPON Président du jury Madame le Professeur Laurence BORDENAVE Membre du jury Monsieur le Professeur Didier NEAU Membre du jury Monsieur le Professeur Xavier BERARD Membre du jury Monsieur le Professeur Charles CAZANAVE Co-directeur de thèse Monsieur le Docteur Jean-Baptiste PINAQUY Co-directeur de thèse
REMERCIEMENTS
Au président du jury,
Monsieur le Professeur Michel DUPON
Merci de me faire l’honneur de présider ce jury. J’ai pour votre jugement, vos connaissances et votre expérience un profond respect. J’ai beaucoup appris à votre contact. J’espère être à la hauteur de la confiance que vous m’avez accordée.
Aux membres du jury,
Monsieur le Professeur Didier NEAU,
Merci de me faire l’honneur de participer à ce jury. Ce premier contact téléphonique alors que je n’étais encore qu’externe à Rennes a décidé ma venue à Bordeaux. Il m’avait suffi pour vous faire confiance, et cela ne s’est jamais démenti au fil des années. Votre sens clinique, votre humanité et votre bienveillance m’ont beaucoup marqué. J’ai appris mon métier à vos côtés et je suis très heureuse d’avoir à nouveau l’opportunité de travailler avec vous.
Monsieur le Professeur Xavier BERARD
Merci de me faire l’honneur de participer à ce jury. Ton enthousiasme, ta disponibilité et ton enthousiasme sont un moteur et ont permis cette dynamique autour de la prise en charge des infections de prothèses vasculaires à Bordeaux. Tu m’as permis de mieux comprendre leur prise en charge chirurgicale en assistant à tes opérations au début de mon Master 2 et je t’en remercie. Avec toi la coopération médico-chirurgicale prend tout son sens.
Madame le Professeur Laurence BORDENAVE
Merci de me faire l’honneur de participer à ce jury. Votre grande expertise dans le domaine de la médecine nucléaire nous a paru indispensable pour juger de ce travail. Cette discipline prend une part grandissante dans le domaine des maladies infectieuses et je suis très contente d’avoir pu m’y intéresser plus avant à l’occasion de ma thèse.
Au rapporteur
Monsieur le Docteur Hervé DUTRONC
Merci de me faire l’honneur d’être le rapporteur de ce travail. Tes connaissances et ton expérience n’ont d’égal que ton humilité et ta gentillesse. Tu es pour moi un exemple et j’ai pour toi un profond respect. Je mesure, novembre approchant, l’immense chance que j’ai de travailler à nouveau avec toi. Tu as encore tant à m’apprendre !
A mes directeurs de thèse
Monsieur le Professeur Charles CAZANAVE
Les mots ne suffisent pas pour t’exprimer ma profonde reconnaissance, Charles. Tu m’as toujours soutenu, tu m’as littéralement porté pendant tout mon internat en m’offrant des opportunités incroyables. Ta disponibilité, ta bonne humeur et ton humour rendent le travail très agréable et j’ai beaucoup de chance de travailler avec toi. J’ai pour toi le plus grand respect et la plus grande admiration. J’espère que je serais à la hauteur de tes attentes, je ferai tout pour.
Monsieur le Docteur Jean-Baptiste PINAQUY
Merci d’avoir accepté d’être mon directeur de thèse. J’ai beaucoup appris à tes côtés, le monde obscur et très technique de la médecine nucléaire s’est nettement éclairé grâce à toi. Ton implication dans le domaine des infections de prothèses vasculaires, tes idées et ta motivation pour en améliorer le diagnostic m’ont inspiré. Je te remercie de m’avoir donné l’opportunité de travailler avec toi sur ce sujet.
A ma famille,
A ma sœur, Diane, mon rayon de soleil. Je suis très fière du petit bout de femme, petit génie des mathématiques, pompom-girl trompettiste que tu es devenue.
A mon frère, l’huluberlu qui me ramène souvent les pieds sur terre. Ton intelligence, ta curiosité sans bornes et ton côté baroudeur de l’extrême m’ont toujours impressionné. J’ai parfois l’impression que tu vis sur une autre planète, mais elle a l’air plutôt chouette !
A mon père, tu m’as tant appris. Je suis encore impressionnée par l’étendue de tes connaissances quasi encyclopédiques, et ces histoires que tu me racontes depuis toute petite constituent probablement la majeure partie de la modeste culture générale à laquelle je peux prétendre. Par ces histoires, tu nous as donné une ouverture sur le monde d’une incroyable richesse et je t’en remercie.
A ma mère, tu m’as toujours soutenu et encouragé, avec bienveillance. Tu as toujours eu confiance en moi et tu m’as donné confiance en moi, un bien précieux qui me permet d’affronter les épreuves sans véritables craintes.
A ma tante et marraine, Anne. Ta constante bonne humeur, ta jovialité, et ta générosité sont un exemple pour moi. A mes oncles et tantes, Gitoune, Jean-Pierre pour être venus de si loin aujourd’hui, à tous les autres et à mes cousins.
A mes grands-parents bretons, Mamig et Tadig, partis trop tôt. J’aurais aimé que vous soyez là en ce jour. Votre volonté de voir vos enfants puis vos petits-enfants faire des études nous ont toujours inspiré, je vous dois en grande partie d’être arrivée jusque-là.
A mes grands-parents parisiens, Jean et Jeannine, vous avez toujours eu confiance en moi et vous m’avez conforté dans tous mes choix.
A mes amis,
Aux vieux briscards bretons. Depuis la maternelle jusqu’au lycée, on ne s’est jamais perdus de vue. Vous êtes ma bouffée d’air frais, mon oxygène.
A Daminou, Duldul, Manoul, j’en passe et des meilleures. L’homme aux milles surnoms, mon meilleur et plus vieux ami. De nos premiers pas thoréfoléens à ton arrivée à Bordeaux, on en a vécu des choses ! Je suis très fière de notre amitié et j’ai beaucoup de chance de t’avoir. A Pico, « El piquillo », tu me feras toujours pleurer de rire. Toutes ces années d’étude, je les ai faites pour toi, pour essayer un jour de répondre à cette question que tu me poses si souvent : « J’ai mal là, c’est quoi ? » Je m’en approche de jour en jour…
A Aurore, Brendouille la fripouille, mon empêcheuse de tourner en rond, ma tornade. De Tizé à Bordeaux en passant par la fac à Rennes, on ne s’est jamais vraiment quittées et ça n’est pas prêt de changer !
A ma Mathoulde, boule d’énergie, de bonne humeur et de générosité, je t’adore. Tu fais de chaque moment que l’on partage un instant exceptionnel. De Rennes à Londres en passant par
New York, qu’est-ce qu’on a pu rigoler ! J’aime ta folie géniale, elle me permet d’exprimer la mienne.
A Tomtom, le prof de philo DJ à ses heures perdues, le GPS officiel de mes soirées parisiennes.
A Got, le bourlingueur d’Amérique centrale. Reviens vite tu nous manques !
A Ginger, je suis très contente que l’on ait appris à se connaître ces dernières années. Tu es une chouette fille, pleine d’intelligence et de bonne humeur avec un grain de folie que j’adore ! Je suis ravie que tu restes à Bordeaux pour compléter notre team bretonne !
A Elise, pour les chouettes moments passés ensemble et pour le calme olympien avec lequel tu gères ce grand enfant qu’est PY. A Samy, Blond, Chito, Alexandra, et tous les autres.
Aux rennais, compagnons d’externat, mes racines.
A Lena, malgré notre éloignement géographique, tu restes la personne dont je suis la plus proche. Tu as toujours été là pour moi, je n’ai pas besoin de parler, tu me comprends. Notre amitié est l’une des choses les plus précieuses que j’aie.
A Francis la malice, mon frère de coeur. Je suis très fière de ce que notre amitié est devenue depuis notre arrivée à Bordeaux. Tu es toujours là quand j’ai besoin de toi, une petite perle ! Et j’ai finalement appris à aimer cet humour qui n’appartient qu’à toi ! Un jour, je te le promets, tu arriveras à déclencher des salves d’applaudissements dans les amphis…
A mon Kéké d’amour, que de moments de légende partagés avec toi… Je rigole souvent en repensant à nos soirées endiablées ! Le haka poil, les soirées faluche au Manureva, ton amour pour le ménage en sous-vêtements comestibles… on en a fait des bêtises !
A mon Guigui préféré. Je garde des souvenirs émus de nos fous rires sur les bancs de la fac, de tes étranges addictions culinaires, de nos soirées ciné parfois éprouvantes (Saucisse et chaussette, jamais plus jamais…). Je ne suis que trop heureuse que tu aies fini par basculer du côté bordelais au moment de ce choix de l’ECN si riche en émotions !
A Johan, notre bouffée d’air frais dans ce monde de médecine ! C’est toujours un bonheur de parler avec toi. A Eva, A Marie.
Aux bols-de-lait, ma famille.
A la merveilleuse Anne-Lise. Je t’adore, tu es la personne la plus attentionnée et la plus gentille que je connaisse. Je suis on ne peut plus heureuse de t’avoir rencontrée et de continuer à te voir aussi souvent, et que viva la fiesta!
Au fantasque Julien, que ferais-je sans toi ? Toujours sur le pont pour faire la fête, et toujours disponible pour aider les copains, tu es un véritable amour, plein de générosité et d’enthousiasme !
A Naig, j’adore passer des moments avec toi, tu me fais découvrir tellement de choses ! Entre la BD, les concerts, les expo…et les bières en terrasse, la vie est belle !
A Etienne, le petit dernier. Enthousiaste, attentionné, jamais le dernier pour faire la fête, il ne m’a pas fallu longtemps pour t’adorer !
A Charlie. Sous tes dehors extravertis tu caches un cœur d’or. J’adore toujours autant les chouettes moments que l’on passe ensemble ! A Arnaud, ta constante bonne humeur et ta jovialité sont un vrai bonheur !
A Gary. Des soirées endiablées au service de réa, j’ai toujours adoré ta bonne humeur et ton sens de l’humour. Nos petits moments « M. Ribot ? Dr. Puges… » en Réa me manquent… mais les soirées endiablées vont continuer !
A Kikichou, le dieu de la salsa à la barbe fleurie, vive les midis-après-midis-soirées dans ton beau jardin !
A Pedro, le dinguo, le roi du paquito. Compte sur moi pour continuer à écumer les voies de tram !
A mes co-internes et amis.
A Mathilde, nos premiers pas en gériatrie ont scellé une solide amitié qui n’a fait que se renforcer au fil des années. J’apprécie toujours autant les moments passés avec toi et ta petite famille, des après-midi où le temps est comme suspendu…Ton calme et ta sérénité m’apaisent, tu me permets de garder les pieds sur terre.
A Camille, par où commencer ? Le twist, la sortie d’autoroute puis la piscine à boules (ou à balles ?), les bains glacés du 1er janvier en plein tempête… Du 2e semestre à l’Hôpital Bichat, que d’aventures ! Je te retourne le compliment, je t’ai adorée à l’hôpital mais je t’aime encore plus en robe (de bal) et en terrasse !
A Emma, j’adore les moments que l’on passe ensemble. Toujours à l’écoute, je peux tout te confier, tu es ma bouée de sauvetage les jours nuageux… et jamais la dernière pour faire la fête !
A Pauline, j’adore par-dessous tout ton enthousiasme de tous les instants ! Même quand ton métier t’obliges à explorer les endroits les plus sombres…
A Caroline, j’ai adoré travailler avec toi, mais j’aime encore plus lorsque l’on refait le monde autour d’un bon verre de vin !
A Léa, du G2 à la médocaine, que d’aventures ! J’ai toujours adoré ton calme, ta constante bonne humeur, une co-interne en or !
A Célia, la Couze, la machine. Mon phare, mon poisson pilote lors des premières semaines en bactériologie. Quel plaisir de travailler avec toi, dommage que tu ne sois pas restée dans le coin. Mais compte sur moi pour venir te voir dans ton pays loin là-bas.
A Chloé. Dr Combe, j’ai adoré travailler à vos côtés. Ton franc-parler, nos fous rires, les Marrakech tea et les goûters-craquage-dévalisage du rayon chocolat au relais H me manquent déjà !
A Maeva. Dr Bello, j’admire ton calme et ta sérénité qui rendent les journées de travail agréables…pas facile pourtant avec les engins que tu t’es coltinée pendant 6 mois !
A Alex, le cardiologue torturé-réanimateur, je n’aurais jamais imaginé que l’on pouvait faire autant de choses avec des masques chirurgicaux avant de te connaitre. Je ne compte plus les moments, pendant ce semestre, ou l’on a pleuré de rire grâce à tes frasques. Et encore merci de m’avoir appris à faire mes QCM de maladies infectieuses !
A Stéphanie, j’adore ta fantaisie et ton franc-parler ! Entre le travail et les terrasses, on se recroisera encore souvent j’en suis convaincue. Et toujours avec grand plaisir !
A la Scotto. Tes compétences et tes connaissances m’impressionnent beaucoup, elles n’ont d’égal que ton humilité. J’ai beaucoup aimé travailler avec toi, tu m’as beaucoup appris. A Lisa, de Thorigné-Fouillard à l’internat à Bordeaux en passant par l’externat à Rennes, il aura fallu attendre la réanimation de Libourne pour que l’on se rencontre enfin !
A Arnaud, j’ai beaucoup de chance de t’avoir bientôt comme co-chef. Ultra-compétent, toujours de bonne humeur, drôle… un vrai bonheur !
A Ben Viot, Urko (vive le cidre breton !), Didier Brownie-man et sa géniale fantaisie, Anne-So, Salman, Céline, Virginie et tous les autres.
A mes chefs qui m’ont tant appris, à la fois sur le plan professionnel et humain.
Au Dr Marc-Olivier Vareil. Tu m’as tant appris, à commencer par mon métier. Tu nous as formé avec patience et rigueur, et je mesure maintenant à quel point tu as influé sur ma manière d’exercer la médecine.
Au Pr Estibaliz Lazaro, la magicienne. Travailler à tes côtés a été un réel bonheur. Tes connaissances, ton intelligence, ton humilité et ton humanité m’ont beaucoup impressionné. Je t’admire, tu es un véritable exemple pour moi.
A l’équipe de réanimation médical de l’hôpital Pellegrin. Au Pr Didier Gruson. J’ai adoré mon semestre dans votre service, et votre curiosité et votre bienveillance y sont pour beaucoup ! Au Pr Alexandre Boyer, ta confiance m’a beaucoup touché. Au Dr Benjamin Clouzeau, quel bonheur de travailler avec toi ! Ton calme, tes compétences et ton humour rendent le travail tellement agréable. A Aurélie, une CCA en or. Toujours disponible, curieuse et de bonne humeur… travailler à tes côtés était vraiment chouette ! A Tonio, un CCA en or. Ton intelligence et ta curiosité sans bornes sont des plus agréables. Tu m’as fait découvrir des choses incroyables parmi lesquelles la pneumopathie du joueur de cornemuse ou de l’adepte des jacuzzis, toujours à la pointe de l’actualité scientifique.
A l’équipe de réanimation de Libourne. Au Dr Bernard Gauche, votre sens clinique et votre dynamisme incroyable m’ont beaucoup impressionné, votre bienveillance m’a beaucoup aidé pour mes premiers pas en réa. A Jean-François, Chouchou, Claire, Naima, Hubert et Carmen. A l’équipe de bactériologie de l’Hôpital Pellegrin. Au Pr Cécile Bébéar, merci de m’avoir accueilli dans votre laboratoire. Votre disponibilité et votre implication lors de mon Master 2 m’ont beaucoup touché. Au Dr Sabine Pereyre, toujours à l’écoute et disponible pendant mon
Master 2, je t’en remercie. A Chloé, keep calm and redo PCR. Sans toi mon Master 2 n’aurait pas été possible. Tu m’as tout appris, avec beaucoup de pédagogie, de patience et de bonne humeur ! A Arabella, du labo aux soirées « Allez les filles », j’espère que l’on aura encore beaucoup d’occasions de se croiser ! Au Dr Bertille de Barbeyrac, pour votre bonne humeur et votre sens de l’humour, au Pr Philippe Lehours, au Pr Megraud.
Au Dr Laurent Stecken, sans toi je n’aurais sans doute pas pu faire ce sujet de thèse. Tu as initié cette dynamique autour de la prise en charge des infections de prothèses vasculaires à Bordeaux.
Au Dr Cedric Carrie, tu as pris le temps à Libourne de m’expliquer la réanimation, avec une grande pédagogie et je t’en remercie. Ton intelligence et ta curiosité m’ont beaucoup
impressionnée. J’espère que nous aurons à nouveau l’occasion de travailler ensemble. Au Dr Heidi Wille, j’ai beaucoup appris à tes côtés, de par tes connaissances et ta détermination.
A l’équipe de maladies infectieuses de l’hôpital Bichat qui m’a beaucoup appris pendant mon interCHU. Au Pr Yazdan Yazdanapanah, merci pour votre accueil et pour l’occasion que vous m’avez donnée de venir apprendre dans votre service. Votre humanité, votre bienveillance et votre humour m’ont beaucoup touché. Au Dr Claire Tantet. J’ai adoré travailler avec toi. Ton enthousiasme, ta bonne humeur et ta disponibilité ont illuminé mes journées, parfois bien remplies, dans le service. Au Dr Sylvie Lariven, au Dr Paul Loubet et à tous les autres.
Aux équipes paramédicales que j’ai croisé tout au long de mon internat. Vous m’avez énormément appris et j’ai grandi à vos côtés.
Aux infirmières et aides-soignantes du 4e aile 3. Vous m’avez marqué plus que vous ne l’imaginez, j’ai appris chaque jour à vos côtés. Votre bienveillance et votre confiance m’ont porté tout au long de mon internat. A Martine et sa constante bonne humeur, à la grande Mylène, l’écrivaine, à la petite Mylène avec qui on a tant rigolé, à Magalie, Sophie, Kathy, Véro, Marina et ses veillées nocturnes, Cathie, Béa… j’en passe et des meilleures !
Aux infirmières et aides-soignantes du 4e aile 1. A Stéphanie, ta confiance m’a beaucoup touché, à Stéphanie, du service à la coloc, je suis très contente qu’on ait gardé contact, à Floriane, Marie et toutes les autres… A Mme Reimel et son approvisionnement quasi hebdomadaire en bonbons remonte-moral.
A Mme Dejeans, vous avez été plus que ma cadre de service. Vos petites attentions et votre bienveillance m’ont beaucoup touché. Je garde une pensée émue pour vos tibias qui ont tant souffert pendant les staffs du mardi.
Aux infirmières et aides-soignantes de la réanimation de Libourne et de Pellegrin. Votre professionnalisme, votre motivation et votre bonne humeur ont adouci des journées parfois difficiles, c’était un vrai bonheur de travailler avec vous.
Table des matières Page | 1
TABLE DES MATIERES
LISTE DES ABREVIATIONS ... 4
INTRODUCTION ... 5
CONTEXTE ... 6
I. Les infections de prothèses vasculaires (IPV) ... 6
1. Généralités ... 6
1.1. Définitions ... 6
1.2. Classifications ... 7
1.3. Particularités des infections d’anse d’hémodialyse ... 7
1.4. Epidémiologie ... 7
1.5. Physiopathologie ... 10
1.6. Facteurs de risque d’IPV... 12
1.7. Micro-organismes en cause dans les IPV... 12
2. Prise en charge diagnostique ... 14
2.1. Présentations cliniques ... 14
a. Infections précoces et tardives ... 14
b. Infections d’endoprothèses aortiques ... 14
c. Fistules prothéto-digestives (FPD) ou aorto-digestives secondaires (FADS) ... 14
2.2. Critères biologiques ... 15
2.3. Examens d’imagerie ... 16
a. L’angio-tomodensitométrie (angio-TDM) ... 16
b. Examens de médecine nucléaire ... 17
c. Autres examens ... 17
2.4. Diagnostic microbiologique ... 18
2.5. Critères diagnostiques ... 20
3. Prise en charge thérapeutique ... 24
3.1. Prise en charge multidisciplinaire ... 24
3.2. Traitement chirurgical... 24
a. Procédure chirurgicale ... 24
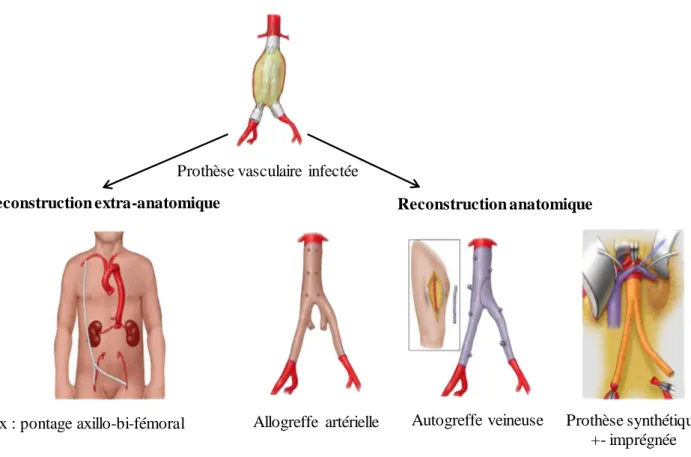
b. Substituts vasculaires utilisés pour la revascularisation ... 25
c. Problématique des déposes partielles et du traitement conservateur ... 27
3.3. Traitement médical ... 28
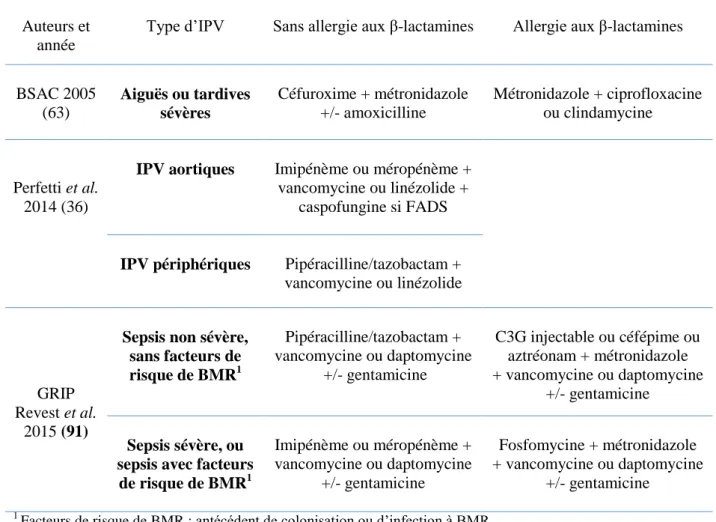
a. L’antibiothérapie probabiliste ... 28
Table des matières Page | 2
c. L’antibiothérapie suppressive ... 30
d. En cas de bactériémie issue d’un autre site ... 30
e. Le traitement antifongique ... 30
3.4. Modalités du suivi et critères de guérison ... 31
3.5. Particularités de la prise en charge thérapeutique des infections d’anse d’hémodialyse .. 32
II. Examens d’imagerie nucléaire ... 33
1. Tomographie par émission de positons (TEP) ... 33
1.1. Mécanisme d’action... 33
a. Principes généraux de la TEP ... 33
b. Utilisation combinée de la TEP et de la TDM... 34
c. Métabolisme du FDG ... 35
1.2. Déroulement de l’examen ... 36
1.3. Indications de la TEP ... 37
1.4. Utilisation de la TEP dans le diagnostic des IPV ... 37
a. Indications ... 37
b. Critères utilisés : critères visuels ou semi-quantitatifs ... 37
c. Performances ... 41
d. Causes de faux négatifs ... 47
e. Causes de faux positifs ... 48
2. Scintigraphie ... 49
2.1. Mécanismes d’action et différents types de scintigraphie ... 49
a. L’avidine couplée à la biotine marquée à l’111 In... 50
b. La scintigraphie aux leucocytes marqués (SLM) ... 50
c. La scintigraphie aux anticorps anti-granulocytes ... 52
d. La tomographie par émission monophotonique couplée à la tomodensitométrie (TEMP-TDM) ... 52
2.2. Déroulement de l’examen ... 53
2.3. Indications de la scintigraphie aux leucocytes marqués ... 53
2.4. Utilisation de la scintigraphie dans le diagnostic des IPV ... 54
a. Critères utilisés ... 54
b. Performances ... 56
c. Causes de faux positifs ... 59
d. Causes de faux négatifs ... 60
3. Quel examen de médecin nucléaire prescrire et dans quelle indication ? ... 61
3.1. Avantages de la TEP ... 61
Table des matières Page | 3
3.3. Evaluation comparative des deux examens ... 62
a. Dans les IPV ... 62
b. Dans les autres infections ... 63
OBJECTIFS DE L’ETUDE ... 64
ARTICLE ... 65
DISCUSSION COMPLEMENTAIRE ... 84
I. Résumé des principaux résultats de l’étude ... 84
II. Discussion des cas discordants ... 86
1. Faux positifs en TEP ... 86
2. Faux positifs en TEP et en SLM ... 89
3. Faux négatifs en TEP et en scintigraphie aux leucocytes marqués ... 91
CONCLUSION ET PERSPECTIVES ... 93
Liste des abréviations Page | 4
LISTE DES ABREVIATIONS
AMM : autorisation de mise sur le marché ASC : aire sous la courbe
BDG : (1 → 3)-β-D-glucane BGN : bacille à Gram négatif
BLSE : béta-lactamase à spectre élargi BMR : bactéries multi-résistantes CGP : cocci Gram positif
CRP : C-reactive protein
EFS : établissement français du sang FADS : fistule aorto-digestive secondaire FPD : fistule prothéto-digestive
GRIP : groupe de réflexion sur les infections de prothèses vasculaires HMPAO : hexaméthylpropylèneamine oxime
IC 95% : intervalle de confiance à 95%
111
In : Indium 111
IPV : infections de prothèses vasculaires IQR : intervalle inter-quartile
IRC : insuffisance rénale chronique
IRM : imagerie par résonnance magnétique ISO : infection du site opératoire
IV : intraveineux
NADPH : nicotinamide adénine dinucléotide phosphate PCR : polymerase chain reaction
PLP : protéine liant la pénicilline PNN : polynucléaires neutrophiles
RCP : réunion de concertation pluridisciplinaire ROC : receiver-operating characteristic
SARM : Staphylococcus aureus résistant à la méticilline SAMS : Staphylococcus aureus méticillino-sensible SCN : staphylocoque à coagulase négative
SUV : standardized uptake value
99m
Tc : Technétium 99m USI : unité de soins intensifs TBR : tissue-to-background ratio TDM : tomodensitométrie
TEMP : tomographie par émission monophotonique TEMP-TDM : TEMP couplée à la TDM
TEP : tomographie par émission de positons TEP-TDM : TEP couplée à la TDM
VPP : valeur prédictive positive VPN : valeur prédictive négative
Introduction Page | 5
INTRODUCTION
Les infections de prothèses vasculaires (IPV) sont des infections graves, dont le pronostic est grevé d’une forte morbi-mortalité. Leur diagnostic, en particulier dans les infections latentes, est parfois difficile et les critères diagnostiques actuellement utilisés ne permettent pas toujours un diagnostic de certitude.
A l’instar d’autres infections comme l’endocardite et les infections de matériel orthopédique, de nombreuses études ont évalué les techniques de médecine nucléaire, scintigraphie aux leucocytes marqués (SLM) et tomographie par émission de positons (TEP), dans le diagnostic des IPV. Cependant, il n’existe à ce jour qu’une seule étude, de faible effectif, ayant comparé les performances de ces deux techniques.
Nous avons ainsi mené une étude prospective monocentrique au CHU de Bordeaux chez des patients suspects d’IPV afin de comparer les performances de la TEP et de la SLM dans le diagnostic des IPV.
Pour en comprendre les grandes problématiques, nous développerons dans une première partie les principaux enjeux des IPV, en termes d’épidémiologie, de présentation clinique et paraclinique, de méthodes diagnostiques et de stratégies thérapeutiques.
Nous détaillerons également les principales caractéristiques de la TEP et de la SLM, en insistant sur leurs particularités dans le diagnostic des infections, et en particulier des IPV. Nous présenterons ensuite l’article correspondant à notre étude, pour finir sur une discussion plus approfondie de nos résultats.
Contexte : les infections de prothèses vasculaires. Généralités. Page | 6
CONTEXTE
I. Les infections de prothèses vasculaires (IPV)
1. Généralités
1.1. Définitions
Les IPV correspondent à l’infection desubstituts synthétiques endovasculaires. Elles sont classées selon :
Leur localisation
- « IPV aortiques », comportant au moins une anastomose aortique, les prothèses aorto-iliaques et aorto-fémorales sont donc incluses dans ce groupe
- « IPV périphériques » : artères des membres inférieurs, accès d’hémodialyse
Le délai de survenue par rapport à l’implantation de la prothèse
- « IPV précoces » : dans les 4 mois suivant l’implantation - « IPV tardives » : au-delà de 4 mois après l’implantation
Le mode d’implantation
- Prothèses implantées chirurgicalement, par laparotomie ou thoracotomie au niveau aortique, ou après incision locale pour les prothèses périphériques
- Endoprothèses posées par voie endovasculaire
Le matériel de la prothèse
- Polyétrafluoroéthylène (PTFE) textile ou microporeux
- Polyéthylène téréphtalate (PET) aussi connu sous le nom de « Polyester Dacron », imprégnées ou non de substances antimicrobiennes, antibiotiques (rifampicine ou mupirocine), argent et/ou triclosan. Elles peuvent également être recouvertes de collagène ou gélatine d’origine animale (bovine ou ovine).
- Stents ou endoprothèses, constitués de différents matériaux : titane, nitinol (alliage nickel-titane), acier, alliage chrome-cobalt ou carbone. Ils peuvent être couverts de PTFE ou de polyester tissé, ou non couverts.
Contexte : les infections de prothèses vasculaires. Généralités. Page | 7
1.2. Classifications
Il existe plusieurs classifications, dont celles de Szilagyi en 1972 (1) et de Samson en 1988 (2) basées sur la profondeur de l’infection, et celles de Goeau-Brissonière en 1996 (3) et de Johnson en 1988 (4) basées sur l’aspect local. La classification de Bunt modifiée en 1994 est actuellement la plus communément admise (5, 6) :
P0 : IPV profondes intracavitaires aortiques, abdominales et thoraciques
Infections de stents endovasculaires intracavitaires aortiques et coronariens, infections de prothèses aorto-bi-iliaques
P1 : IPV superficielles exclusivement extra-cavitaires
Infections de stents endovasculaires extra-cavitaires, infections de fistules artério-veineuses prothétiques et infections de prothèses périphériques (fémorales, poplitées…)
P2 : IPV superficielles des prothèses intracavitaires aortiques (portion extra-cavitaire) Infections de pontages aorto-bi-fémoraux
P3 : IPV de patchs d’angioplastie
Les érosions et fistules aorto-digestives secondaires (FADS) et aorto-urétérales sont considérées comme des entités séparées.
1.3. Particularités des infections d’anse d’hémodialyse
Chez certains patients, le réseau veineux ne permet pas ou plus la confection d’une fistule artério-veineuse. Des anses prothétiques d’hémodialyse peuvent alors être créées chirurgicalement par l’interposition d’une prothèse vasculaire, le plus souvent en PTFE, entre une veine et une artère pour créer une fistule artério-veineuse (5). Des prothèses en Dacron et des bioprothèses, veine mésentérique bovine par exemple, peuvent également être utilisées (6). Cela permet de connecter une artère et une veine potentiellement trop éloignés, constitue un abord vasculaire de forte capacité pour l’insertion des cathéters d’hémodialyse. Ces anses sont préférentiellement situées au niveau des membres supérieurs, mais lorsque le réseau veineux y est devenu insuffisant, elles peuvent également être insérées au niveau des membres inférieurs malgré un risque infectieux plus élevé (6).
1.4. Epidémiologie
Incidence des IPV
L’incidence globale des IPV se situe entre 0,5 à 6 % selon les études, variant selon leur localisation, aorte rénale < 1 %, localisation aorto-fémorale 1 à 2 %, localisation sous-inguinale 6 % (7). L’incidence cumulée des IPV aortiques deux ans après l’implantation d’une prothèse aortique par voie chirurgicale varie entre 0,19 et 4,5 % selon les études (8, 9). L’incidence des infections d’endoprothèses aortiques varie entre 0,2 et 5 % selon les études,
Contexte : les infections de prothèses vasculaires. Généralités. Page | 8 0,2 à 0,7 % pour les endoprothèses de l’aorte abdominale et jusqu’à 5 % pour les endoprothèses de l’aorte thoracique (10, 11).
Selon le rapport de 2011 du registre ISO-Raisin (Réseau d’alerte, d’investigation et de surveillance des infections nosocomiales), le taux d’incidence cumulée des infections du site opératoire (ISO) en France de 2007 à 2011 (ISO survenant dans les 30 jours post-opératoires) varie selon la localisation de la prothèse (12) :
- Chirurgie des artères périphériques : 204 ISO sur 11 009 opérations soit un taux d’incidence de 1,9 % (IC 95 % [1,6-2,1])
- Chirurgie des gros vaisseaux intra-abdominaux et pelviens : 51/2 429 soit un taux d’ISO de 2,1 % (IC 95 % [1,5-2,7])
- En comparaison, les taux d’incidence d’ISO en chirurgie orthopédique étaient un peu plus faibles, de 0,2 à 2,4 %
A noter que la surveillance des ISO survenant après pose de prothèse vasculaire ne rentre pas dans la liste des interventions prioritaires du réseau ISO-Raisin dans le rapport de 2014.
Délai de survenue selon le type et la localisation de la prothèse
Le délai de survenue des IPV, peu décrit dans les études, varie selon leur localisation. Les IPV sont plus fréquemment précoces, en particulier au niveau périphérique et thoracique. Dans l’étude de Erb et al., le délai de survenue des IPV était de 37 jours (IQR 11-131) au niveau de l’aorte thoracique, de 40 jours (IQR 6-440) au niveau de l’aorte abdominale et de 15 jours (IQR 6-26) au niveau périphérique (13). Dans l’étude de Berger et al., le délai de survenue des IPV aortiques abdominales était de 83 jours (9). Les infections d’endoprothèses aortiques surviennent en moyenne vers 22 mois (extrêmes 0,2-158 mois) sans différence significative entre l’aorte thoracique ou abdominale (14).
Concernant les infections d’anses prothétiques d’hémodialyse, leur incidence est en augmentation, probablement en lien avec l’augmentation du nombre d’implantations (15). Ces infections surviennent le plus fréquemment dans le mois après l’implantation ou la réintervention chirurgicale (47 %), puis dans les 2 à 6 mois (39,3 %) et plus rarement au-delà de 6 mois (17 %) (16).
Mortalité et facteurs prédictifs de mortalité
La mortalité précoce est définie comme survenant dans les 30 jours, la mortalité tardive au-delà de 30 jours.
Selon les séries publiées et la localisation de l’infection, la mortalité globale varie de 15 à 75 % (7), essentiellement précoce, et en particulier en post-opératoire immédiat. Dans une étude prospective publiée en 2012, la mortalité intra-hospitalière était de 22,2 % pour les IPV aortiques et de 6,5 % pour les IPV périphériques. Seuls deux facteurs étaient associés à un sur-risque de mortalité intra-hospitalière, les IPV aortiques (OR = 5,6 ; IC 95 % [1,1-28,7],
Contexte : les infections de prothèses vasculaires. Généralités. Page | 9 p = 0,037) et l’âge supérieur à 70 ans (OR = 9,1 ; IC 95% [1,83-45,43], p = 0,007) (17). Dans une étude publiée en 2006 sur 37 patients admis en unité de soins intensifs (USI) pour une IPV suspectée ou certaine, la mortalité était de 33 % en USI, et le seul facteur de risque indépendant de mortalité était la survenue d’un état de choc (OR = 16,3 ; IC 95% [1,7-152,1], p = 0,01) (18). Un seul facteur protecteur a été retrouvé en analyse multivariée dans la littérature, la prescription de rifampicine dans les IPV aortiques (Hazard ratio [HR] = 6,88, IC 95% [1,33-35,4], p = 0,021), sans précision sur les bactéries ciblées (13). Dans une étude menée chez 82 patients atteints d’IPV dont 65 infectés à Staphylococcus aureus, la prescription de rifampicine était un facteur associé à la guérison à un an (Odds ratio [OR] = 0,32, IC 95 % [0,1-0,96], p = 0,04) (19).
Une étude a comparé le taux de mortalité globale à un an après la chirurgie selon la localisation de la prothèse infectée. Les IPV de l’aorte abdominale ont la mortalité la plus élevée, 55,6 % des patients. Viennent ensuite les IPV périphériques avec 30 % de mortalité, puis les IPV de l’aorte thoracique avec une mortalité de 12,5 % (13). La mortalité à cinq ans des IPV aortiques varie entre 46 et 64 % dans la littérature (20, 21).
La mortalité augmente lorsque l’IPV se complique d’une FADS (20, 22). La mortalité précoce varie entre 18,2 et 57 % (23). Une étude publiée en 2011 a ainsi décrit une mortalité précoce de 43 %, avec pour seul facteur de risque de mortalité indépendant un âge supérieur à 75 ans (24). Selon une revue récente de la littérature (25), la mortalité globale atteignait 61 % avant 1990, et 31 % en moyenne après 1990 avec des variations entre les études. La mortalité globale, évaluée en moyenne deux ans après le traitement chirurgical, mais parfois plus précocement, varie entre 27,3 et 58 % (25–28).
Le taux de mortalité des infections d’endoprothèses aortiques varie selon les études, avec une mortalité précoce entre 4 et 28 % et une mortalité tardive entre 18 et 38,9 % (10, 11, 29– 33). Les facteurs de risque de mortalité sont la présence d’une FADS, les infections d’endoprothèses de l’aorte thoracique, une hypertension artérielle non contrôlée, une insuffisance rénale, une infection chronique, une endofuite sans réintervention, une durée d’intervention supérieure à 540 minutes, des pertes sanguines supérieure à 8 L et les infections polymicrobiennes (14). En présence d’une FADS, la mortalité tardive peut atteindre 83 % (31), supérieure après un traitement conservateur par rapport à une dépose prothétique (30). Dans l’étude la plus récente sur les infections d’endoprothèses aortiques, la mortalité à 30 jours était de 11 %, et de 49 % à cinq ans. La survie à cinq ans était significativement plus élevée après revascularisation par allogreffe artérielle ou autogreffe veineuse comparativement aux prothèses en Dacron imprégnées ou non d’antibiotiques (respectivement 75%, 65%, 53% et 12% de survie à 5 ans).
Le taux de mortalité lié à aux infections d’anse d’hémodialyse est peu renseigné dans les études. L’étude de Tabbara et al., publiée en 1995, trouvait une mortalité précoce de 12 % (34). Elle est essentiellement liée aux complications systémiques du sepsis.
Contexte : les infections de prothèses vasculaires. Généralités. Page | 10
Morbidité
En dehors des complications liées au sepsis à proprement parler, et digestives lors des FADS, la nécessité d’une amputation est une complication majeure qui survient dans 5 à 70 % des cas selon les séries.
Taux de récidive
Il est élevé et peut concerner jusqu’à 27 % des patients ayant survécu à la prise en charge d’une première IPV aortique (20, 35). Le taux de récidive augmente en présence d’une FADS, jusqu’à 47 % des patients survivants avec une médiane de survenue de 9,3 mois (3-24 mois) et une mortalité de 100 % (24). Dans les études menées sur les infections d’endoprothèses aortiques, cette donnée est peu renseignée, il varie entre 4 % (médiane de suivi de 14 mois) (10) et 6% (dont un tiers à long-terme) (14). Ce taux de réinfection varie également avec le type de substitut utilisé et semble plus élevé avec les prothèses synthétiques. Il augmente également lorsque la dépose n’a pu être réalisée, ou uniquement de façon partielle.
Epidémiologie au CHU de Bordeaux
Sur une cohorte rétrospective comprenant 102 patients inclus entre 2008 et 2014, la mortalité des IPV aortiques était de 30,6 %, de 14,2 % pour les IPV aortiques non compliquées de FADS, et de 39 % en présence d’une FADS. La médiane de décès était de 10 jours (2,5-18,5 jours). La mortalité des IPV périphériques était de 10,7 %. Les facteurs de risque de mortalité indépendants en analyse multivariée étaient l’âge supérieur ou égal à 65 ans (OR = 6,76 ; IC 95 % [1,85-24,65], p = 0,0038) et la présence d’une FADS (OR = 5,86 ; IC 95 % [1,31-26,06], p = 0,02) (36).
1.5. Physiopathologie
La contamination peut se faire par voie locale ou hématogène. La contamination locale est soit directe lors de l’opération, soit par contiguïté à partir d’un foyer infectieux adjacent qui infecte la paroi artérielle, une plaque d’athérome ou un thrombus intra-anévrysmal. Elle peut aussi se faire par voie hématogène, par le biais d’une bactériémie provenant d’un autre site, surtout dans le mois post-opératoire.
La physiopathologie des FADS est complexe. Lorsqu’elles surviennent précocement après la pose de la prothèse, elles peuvent être liées à une plaie digestive lors de la chirurgie initiale, à une inflammation du tube digestif au contact des sutures ou d’un pseudo-anévrysme au niveau de l’anastomose chirurgicale, ou à une infection précoce. Lorsqu’elles surviennent tardivement, les fistules peuvent être secondaires à une infection de la prothèse, ou aux adhérences fibreuses entre la prothèse et le tube digestif et à une inflammation locale liée à la présence de matériel étranger. Tout cela est favorisé par le traumatisme pulsatile permanent exercé par les battements aortiques sur le tube digestif (25, 37, 38). La fistule se forme le plus
Contexte : les infections de prothèses vasculaires. Généralités. Page | 11 souvent au niveau de l’anastomose proximale, parfois au niveau du corps prothétique et plus rarement au niveau de l’anastomose distale (25). Les FADS peuvent également se former en présence d’une endoprothèse aortique, dans 0,3 à 27 % des cas (10, 14). Ce phénomène est favorisé par une éventuelle migration de l’endoprothèse, mais également par les frottements de la prothèse contre la paroi aortique, et par les crochets de fixation de la prothèse qui favorisent l’érosion et la fissuration de la paroi.
La constitution du biofilm par les bactéries et les levures à la surface de la prothèse vasculaire est un élément majeur de leur pathogénie, en particulier décrite pour S. aureus, Pseudomonas spp. et Candida spp. (39, 40). Ce phénomène a été décrit initialement dans les infections de prothèses ostéo-articulaires, puis dans les endocardites. Les bactéries adhèrent à la surface de la prothèse grâce à des adhésines de surface, puis synthétisent une matrice extracellulaire composée d’exopolysaccharides, le tout constituant le biofilm. Dans le biofilm, les micro-organismes ont un métabolisme réduit, ils sont moins sensibles aux anti-infectieux actifs sur les bactéries en division et leurs profils de résistance peuvent être différents. Le biofilm constitue également une barrière physique diminuant la pénétration des anti-infectieux et permettant l’échappement au système immunitaire.
Ceci explique que les IPV, en particulier tardives, puissent évoluer à bas bruit, avec des bactéries quiescentes à la surface du matériel. En outre, ni les anti-infectieux, ni les lavages chirurgicaux ne peuvent détruire le biofilm. Le traitement curatif de ces infections ne peut donc passer que par l’ablation du matériel infecté. De par l’adhésion des micro-organismes au matériel, leur enchâssement dans la matrice extracellulaire et leur quiescence, la sensibilité des cultures microbiennes est diminuée (39). Des recommandations sur le diagnostic et la prise en charge des infections comportant du biofilm ont été publiées par l’ESCMID en 2014 (European Society of Clinical Microbiology and Infectious Diseases), dans lesquelles il n’est pas fait mention des IPV (39).
Concernant les infections d’anse d’hémodialyse, le risque infectieux est favorisé par l’immunodépression des patients hémodialysés, notamment par la dysfonction des polynucléaires neutrophiles (PNN) provoquée par l’hyperurémie (15). Les effractions fréquentes de la barrière cutanée par les cathéters d’hémodialyse favorisent la pénétration des bactéries, qui vont ensuite adhérer au matériel prothétique et persister grâce à la synthèse de biofilm (5). L’infection de l’anse se situe au niveau d’un point de ponction récent de cathéter d’hémodialyse dans 27,4 à 60 % des cas (5, 16). La formation d’un hématome au niveau d’un point de ponction peut favoriser l’infection (41). L’infection peut également se développer à partir de l’abord chirurgical de l’implantation ou d’une réintervention au niveau de la prothèse, parfois dans plus de la moitié des cas (16). La colonisation cutanée à S. aureus est un facteur de risque d’infection. L’anse peut également être infectée lors d’une bactériémie issue d’un autre site (41). Par ailleurs, les anses prothétiques non fonctionnelles ne sont pas systématiquement déposées mais peuvent également s’infecter, 23 % des 132 cas d’infections d’anses prothétiques dans l’étude de Schild et al. (42). Ces infections d’anses thrombosées sont souvent chroniques et asymptomatiques (41, 43, 44), et parfois responsables de bactériémies sans signes locaux au niveau de l’anse (44).
Contexte : les infections de prothèses vasculaires. Généralités. Page | 12
1.6. Facteurs de risque d’IPV
Les facteurs de risque indépendants en analyse multivariée de la survenue d’une IPV sont peu analysés dans la littérature, deux études rétrospectives s’y sont particulièrement intéressées. Pour les IPV aortiques, la survenue péri-opératoire d’une bactériémie (OR = 4,2, IC 95 % [1,5-11,8]) est associée à un sur-risque d’IPV. Il n’a pas été mis en évidence de différence de taux d’infection entre la pose d’endoprothèse et la chirurgie conventionnelle (8). Certaines études ont décrit des facteurs de risque spécifiques aux infections d’endoprothèse, notamment l’implantation dans un anévrysme infecté et/ou compliqué d’une FADS, une réintervention chirurgicale précoce (29), l’implantation en situation d’urgence (32) ou en radiologie interventionnelle par rapport à l’implantation au bloc opératoire (33).
Pour les IPV en général, sans distinction entre IPV périphériques et aortiques, une infection de la cicatrice (OR = 5,1 ; IC 95% [1,6-16,2], p = 0,005) et un abord chirurgical inguinal (OR = 4,1 ; IC 95% [1,6-10,7], p = 0,003) sont également des facteurs de risque indépendants en analyse multivariée (45).
Une étude rétrospective publiée en 2015 s’est intéressée aux facteurs prédictifs d’ISO après une pose d’endoprothèse. Sur 1 604 patients ayant bénéficié d’une pose d’endoprothèse, six patients ont présenté une ISO, dont cinq IPV dans l’année suivant l’intervention. Seule une analyse univariée a été réalisée, et deux facteurs semblent être prédictifs du risque d’infection : l’association de la pose d’endoprothèse à une autre procédure, comme la pose d’un pontage fémoro-fémoral, et l’embolisation par des coils (46).
Concernant les FADS, l’interposition du mur anévrysmal ou d’une partie de l’épiploon entre la prothèse et le tube digestif semble protéger la paroi digestive de l’érosion liée aux battements pulsatiles transmis par la prothèse aortique (47).
1.7. Micro-organismes en cause dans les IPV
Dans les dernières études, il n’a pas été montré de corrélation entre le site de l’infection, le délai de survenue et le type de micro-organisme en cause, en dehors d’une fréquence plus grande du S. aureus dans les IPV périphériques (42,5 % contre 18,7 % dans les IPV aortiques, p = 0,009) (17).
Les infections pluri microbiennes sont fréquentes, en particulier dans les IPV aortiques et notamment compliquées de FADS, entre 20 et 30 %. Elles peuvent être pluri bactériennes et/ou bactériennes et fongiques (10, 17, 29).
Dans les IPV aortiques, les bacilles à Gram négatif (BGN) sont aussi fréquemment isolés que les cocci à Gram positif (CGP), avec selon les séries de 31 à 55 % d’entérobactéries et de 11 à 34 % de staphylocoques avec une légère prédominance du S. aureus. Les infections à levures sont fréquemment isolées dans les IPV aortiques, entre 4,6 et 18 % selon les études
Contexte : les infections de prothèses vasculaires. Généralités. Page | 13 (17, 21, 48), particulièrement en cas de FADS. Dans l’étude de Batt et al. portant sur 37 patients atteints de FADS, une infection à Candida spp. était décrite dans 42 % des cas (24).
Dans les infections d’endoprothèses aortiques, les infections à staphylocoques semblent plus fréquentes (11), et en particulier à S. aureus (10, 33). Sont ensuite décrites des infections à streptocoque, à BGN, à anaérobies et à Candida spp. (10, 11).
Dans les IPV périphériques, S. aureus est le plus souvent isolé (42,5 % dans l’étude de Legout et al.), puis les entérobactéries et les staphylocoques à coagulase négative (SCN) (17). Les infections fongiques sont rares dans les IPV périphériques, autour de 2,5% (17).
Dans les infections d’anse d’hémodialyse, les staphylocoques sont majoritaires (entre 73,3 et 86,7 % selon les études), essentiellement S. aureus (entre 50 et 60 %). Les streptocoques, BGN et entérocoques sont moins fréquemment impliqués, et plus rarement encore les levures (5, 15, 16).
Sur la cohorte des patients atteints d’IPV du CHU de Bordeaux, entre 2005 et 2014, une infection fongique a été diagnostiquée dans 29 épisodes d’IPV chez 28 patients. Il s’agissait d’IPV aortiques dans 28 cas sur 29, et compliquée de FADS dans 25 cas sur 28. Sur les 57 IPV aortiques compliquées de FADS incluses dans la cohorte, 25 étaient infectées à Candida spp. (18 à Candida albicans, cinq à Candida glabrata, une à Candida tropicalis, une à Candida kefyr et une à Candida krusei) dont quatre avec une co-infection fongique (C. albicans était associé à C. tropicalis, C. krusei, C. kefyr ou Geotrichum candidum), soit 43,8 % des IPV aortiques compliquées de FADS.
Ces infections fongiques sont sévères, mais elles ne sont actuellement pas ciblées par le traitement probabiliste anti-infectieux préconisé dans les différentes recommandations. Par ailleurs, le délai de rendu des cultures fongiques est en moyenne plus long que pour les cultures bactériennes, dans des infections qui nécessiteraient un traitement curatif adapté rapide (36).
Des micro-organismes plus atypiques peuvent être responsables d’IPV. Des IPV à Listeria monocytogenes ont été décrites, neuf cas ont été publiées à ce jour dont huit chez des patients immunodéprimés, diabétiques, hémodialysés ou âgés. Ces infections sont volontiers récidivantes (49, 50). Un de ces cas a été diagnostiqué avec l’aide de la TEP-TDM (51). Il a également été décrit des cas d’IPV à Coxiella burnetii (73 cas dans la littérature) (52, 53), à Pasteurella multocida (54), à mycobactéries (Mycobacterium tuberculosis, Mycobacterium bovis dans le cadre de BCGites disséminées consécutives à des instillations intra-vésicales de BCG, Mycobacterium abcessus, Mycobacterium chimaera dans le cadre d’IPV post-opératoires de l’aorte thoracique) (55–58), Propionibacterium acnes (59), Cardiobacterium valvarum (60). De rares IPV à champignons filamenteux ont également été décrites (Aspergillus fumigatus, Fusarium spp.) (61, 62). Les techniques de médecine nucléaire, quoi que peu étudiées dans ces infections fongiques sur prothèses, pourraient également présenter un intérêt. En effet, un cas rapporté dans la littérature a montré une positivité de la TEP-TDM et de la SLM dans une IPV à A. fumigatus (61).
Contexte : les infections de prothèses vasculaires. Prise en charge diagnostique. Page | 14
2. Prise en charge diagnostique
2.1. Présentations cliniques
a. Infections précoces et tardives
Les infections précoces sont fréquemment accompagnées de signes infectieux locaux ou généraux (fièvre, frissons, douleurs abdominales ou lombaires, cicatrice inflammatoire ou désunie, écoulement séreux ou purulent, fistulisation cutanée, lymphocèle surinfecté). Des complications locorégionales sont fréquemment décrites, d’ordre infectieux (abcès du psoas, abcès de l’aine), ou d’ordre vasculaire (thrombose de la prothèse, ischémie, rupture d’anastomose, hémorragie).
La symptomatologie des infections tardives est souvent plus frustre et aspécifique (altération de l’état général, lombalgies, présence intermittente d’une fistule cutanée). L’apyrexie est fréquente. Elles sont volontiers compliquées au niveau aortique, notamment par des FADS, parfois compliquées d’une hémorragie digestive haute ou basse, mais également par une dilatation pyélocalicielle, une ostéite ou une spondylodiscite. La présence de faux anévrysmes est également régulièrement décrite (17, 63).
b. Infections d’endoprothèses aortiques
Elles se manifestent majoritairement par des douleurs abdominales ou lombaires, de la fièvre et dans environ un quart des cas par une FADS ou une endofuite (14).
c. Fistules prothéto-digestives (FPD) ou aorto-digestives secondaires (FADS) Les IPV aortiques se compliquent de FADS dans 20 à 25 % des cas dans la littérature (38). Leur délai médian de survenue est de deux ans, avec des extrêmes entre 1 semaine et 26 ans après l’implantation de la prothèse aortique. Les FADS surviennent au–delà de 5 ans après l’implantation dans 36 % des cas. Il s’agit le plus fréquemment d’une fistule entre l’aorte et le duodénum (Figure 1), mais elle peut également se former avec le jéjunum, l’iléon, le côlon ou le sigmoïde. Certains patients peuvent présenter simultanément plusieurs FADS.
Elles sont révélées le plus fréquemment par un saignement digestif, de type hématémèse, méléna et/ou rectorragies, selon la localisation de la fistule et l’abondance du saignement. Ce tableau est compliqué d’un choc hémorragique dans un tiers des cas. Les symptômes sont parfois frustres, entrainant un retard diagnostique. Un saignement minime peut ainsi être responsable d’une anémie ferriprive isolée (25). Les signes de sepsis sont plus rarement présents, isolés ou associés aux signes hémorragiques (25, 64).
Contexte : les infections de prothèses vasculaires. Prise en charge diagnostique. Page | 15 d. Infections d’anse d’hémodialyse
Elles se révèlent le plus fréquemment par la présence d’une inflammation locale ou d’une fistulisation cutanée, parfois associée à un écoulement. La douleur au niveau de l’anse est quasi systématiquement présente (16). La prothèse peut également être exposée à la peau. La fièvre et la présence d’un écoulement purulent sont plus rarement décrits (5, 16). Elles se compliquent fréquemment d’une bactériémie (65).
2.2. Critères biologiques
Les différents marqueurs biologiques évocateurs d’infection sont peu discriminants (7). Le taux de polynucléaires neutrophiles (PNN) et la C-reactive protein (CRP) peuvent en effet être normaux ou légèrement élevés chez des patients présentant des IPV confirmées. Par exemple, dans l’étude de Legout et al., la moyenne du taux de PNN était de 11,1 G/L avec un écart-type de 4,3, et la moyenne de la CRP était de 108 mg/L avec un écart-type de 106 (19). Ces paramètres biologiques sont possiblement normaux chez certains patients infectés. Leurs valeurs tendent à être plus élevées dans les infections précoces par rapport aux infections tardives, sans différence significative toutefois (17). Ils peuvent au contraire être augmentés en l’absence d’IPV. Par exemple, lors d’une rupture d’anastomose non septique, un hématome péri-prothétique peut entraîner un syndrome inflammatoire biologique. La procalcitonine n’a pas été évaluée à ce jour dans le diagnostic des IPV.
Contexte : les infections de prothèses vasculaires. Prise en charge diagnostique. Page | 16
2.3. Examens d’imagerie
a. L’angio-tomodensitométrie (angio-TDM)
L’angio-TDM est actuellement l’imagerie de référence mais son interprétation reste difficile dans certaines situations, notamment en période post-opératoire précoce. Sa sensibilité et sa spécificité sont élevées pour les fortes suspicions d’IPV, aux alentours de 95 %, cependant elle est moins fiable lors d’une infection de bas grade, avec une sensibilité de l’ordre de 55 % et une spécificité souvent forte avoisinant les 100 % (66). Sa disponibilité rapide en fait un examen morphologique de premier choix, cependant l’injection de produit de contraste iodé qui garantit la qualité de l’examen n’est pas toujours possible chez des patients fréquemment atteints d’insuffisance rénale (7). Dans certains cas, la TDM permet également de ponctionner des collections accessibles, dans le but d’obtenir une documentation microbiologique (63).
Différents signes évocateurs d’IPV peuvent être présents sur l’angio-TDM, comme la présence de bulles d’air prothétiques, un faux anévrysme, une infiltration péri-prothétique, ou une collection péri-prothétique qui peut correspondre à un abcès ou à un hématome surinfecté (Figure 2). Des complications locales de l’infection peuvent également être visualisées, telles que les ruptures du sac anévrysmal ou des anastomoses, les FADS et les thromboses de pontage (7, 67, 68), ainsi que des complications loco-régionales comme la dilatation pyélo-calicielle par compression des uretères, une ostéite ou une spondylodiscite de contiguité (69).
Certains signes restent cependant d’interprétation difficile en période post-opératoire précoce, en particulier la présence de bulles d’air ou d’un hématome péri-prothétique (7, 63). Selon les études, le délai post-opératoire de disparition des bulles d’air péri-prothétiques chez des patients non infectés varie. Certaines études trouvent une médiane de disparition de 52 jours (extrêmes 21-85 jours) (22), ou l’absence de bulles sur la TDM réalisée 6 mois après l’opération (70). La dernière classification publiée par un groupe d’experts anglais retient un délai de 7 semaines pour la disparition des bulles d’air physiologiques en post-opératoire, et un délai de 3 mois pour la disparition des collections liquidiennes péri-prothétiques (71).
Contexte : les infections de prothèses vasculaires. Prise en charge diagnostique. Page | 17 b. Examens de médecine nucléaire
Les examens d’imagerie nucléaire, la TEP-TDM et la SLM couplée à la TDM, n’ont actuellement pas l’AMM dans le diagnostic des IPV. Ils ont cependant un intérêt dans les IPV de diagnostic difficile, notamment dans les IPV tardives, souvent latentes et paucisymptomatiques (7). Ils peuvent alors conforter ou infirmer le diagnostic. L’indication de l’un et/ou de l’autre de ces examens ne fait actuellement l’objet d’aucun consensus. De nombreuses études ont cependant étudié leur utilité dans le diagnostic des IPV, elles sont détaillées dans le chapitre II.
c. Autres examens
L’IRM est actuellement peu utilisée dans le diagnostic d’IPV. Elle semble cependant avoir un intérêt par sa bonne sensibilité, supérieure à celle de la TDM dans une étude sur 12 patients (72). Cependant, son accès difficile, notamment dans un contexte d’urgence, limite son utilisation. La spécificité de l’IRM est faible en période post-opératoire précoce. En effet, il existe de nombreux faux positifs liés aux changements de densité des tissus adjacents à la prothèse, de nature non infectieuse (hématome, collection lymphatique ou fibrose), dont la distinction avec un processus infectieux est parfois difficile (7).
Figure 2 : Images tomodensitométriques évocatrices d’infections de prothèses vasculaires, images publiées dans les études de Orton et al. (67), N icolini et al. (68) et de patients pris en charge au CHU de Bordeaux. Présence de bulles d’air péri-prothétiques aortiques (1), d’une rupture prothétique aortique (2), d’un abcès du psoas droit (3), d’un abcès péri-prothétique fémoral droit (4), d’un faux anévrysme fémoral gauche (5), d’une fistule aorto-digestive (6), d’un infiltrat péri-prothétique fémoro-fémoral croisé (7), d’une fistule cutanée (8), d’une thrombose prothétique aortique (9).
1 3 5 4 2 3 5 4 7 6 9 8
Contexte : les infections de prothèses vasculaires. Prise en charge diagnostique. Page | 18 L’échographie-doppler artérielle est parfois utile dans les IPV périphériques où elle peut montrer la présence d’un faux-anévrysme, d’une thrombose, ou d’un abcès péri-prothétique, parfois accessible à la ponction sous échographie à visée de documentation microbiologique. La négativité de l’examen n’élimine en rien une IPV, sa sensibilité étant faible.
L’artériographie n’a plus d’indication dans les IPV, elle a été remplacée par les données fournies par l’angio-TDM (7).
2.4. Diagnostic microbiologique
Des hémocultures doivent être réalisées en cas de fièvre ou de frissons et en post-opératoire précoce, mais elles ne sont positives que dans environ 35 % des cas, en particulier dans les IPV aortiques et précoces. Dans l’étude de Legout et al., les hémocultures préopératoires étaient positives dans 32,6 % des IPV, sensiblement plus fréquemment dans les IPV précoces que dans les IPV tardives (respectivement 40,8 % et 25 %, p = 0,13) et dans les IPV aortiques par rapport aux IPV périphériques (respectivement 40,7 % et 22,6 %, p = 0,09) (17). Dans 13 % des cas, les prélèvements per-opératoires étaient négatifs mais les hémocultures positives.
Les prélèvements locaux ou loco-régionaux peuvent être pré et/ou post-opératoires (prélèvement stérile d’un écoulement purulent, d’une fistule cutanée, d’un abcès superficiel), chirurgicaux ou obtenus par ponction d’une collection sous TDM (7).
Les prélèvements chirurgicaux sont à la fois prothétiques et péri-prothétiques. Leur nombre est souvent compris entre trois et cinq par analogie avec les infections de prothèses ostéo-articulaires, afin d’augmenter la sensibilité et de diminuer le risque de prendre en compte un contaminant, sans recommandations précises toutefois. Le changement d’instrument à chaque prélèvement n’est pas détaillé dans les différents avis d’experts, mais semble pertinent pour diminuer le risque de prendre un compte un micro-organisme contaminant.
Les prélèvements doivent idéalement être réalisés après 15 jours de fenêtre antibiotique, ce qui n’est souvent pas possible dans ces infections sévères nécessitant un traitement chirurgical et anti-infectieux rapide. Dans l’étude de Legout et al., le taux de positivité des prélèvements n’était pas significativement différent si ceux-ci étaient réalisés avant ou après le début de l’antibiothérapie probabiliste, respectivement 95,2 % et 88,4 %, p = 0,4 (17). Cependant les durées d’antibiothérapie n’étaient pas précisées, or une antibiothérapie préopératoire prolongée n’a probablement pas le même impact qu’une antibiothérapie introduite la veille de l’opération. Dans une étude menée au CHU de Bordeaux portant sur 45 patients dont 25 avaient reçu des antibiotiques dans les sept jours précédents, le taux de cultures positives n’était pas significativement différent chez les patients ayant reçu des antibiotiques avant la dépose chirurgicale (73).
Contexte : les infections de prothèses vasculaires. Prise en charge diagnostique. Page | 19 La prothèse déposée est actuellement vortexée puis ensemencée sur plusieurs milieux bactériens, liquides et solides, et sur une gélose de Sabouraud et un milieu chromogène sélectif et différentiel pour l'isolement des Candida (CHROMagar®) pour la culture fongique. Les techniques telles que la sonication ou le broyage ne sont pas utilisées de manière systématique dans tous les laboratoires.
Les prélèvements pré- et per-opératoires péri-prothétiques gardent un intérêt, associés à la culture de la prothèse déposée. Ainsi, dans une étude bordelaise menée sur 45 patients, sur les 10 patients ayant bénéficié d’un prélèvement pré-opératoire (ponction d’une collection, prélèvement d’un écoulement purulent), neuf avaient des résultats positifs, dont sept avec un micro-organisme supplémentaire par rapport aux cultures per-opératoires. Les prélèvements per-opératoires péri-prothétiques (prélèvement profond à l’écouvillon d’un liquide purulent, biopsie tissulaire, thrombus) avaient été réalisés chez 21 patients, tous positifs en culture. Chez six patients, ces prélèvements ont permis l’identification d’un pathogène supplémentaire par rapport à la culture prothétique (73).
Le taux d’infections non documentées avec ces stratégies microbiologiques se situe entre 4 et 30 % (7, 36) mais peut atteindre 45 % dans certaines études. Ces fortes variations traduisent l’hétérogénéité des populations incluses, aussi bien en termes de pourcentages de patients sous antibiotiques au moment de la chirurgie, de délai d’infection et de localisation de l’IPV. Dans l’étude bordelaise présentée à la SFAR en 2014, menée entre 2008 et 2014, 30 infections non documentées sur 102 patients étaient rapportées soit 29,4 % de non-documentation avec la culture standard. Ce fort taux de cultures négatives peut s’expliquer d’une part par la fréquente antibiothérapie probabiliste à large spectre introduite en période pré-opératoire, et d’autre part par la présence de biofilm à la surface de la prothèse. Les micro-organismes sont enchâssés dans cette matrice et difficilement délogeables par les techniques microbiologiques classiques qui échouent à disloquer le biofilm.
De nouvelles stratégies microbiologiques ont été évaluées dans les IPV afin de diminuer le taux d’infections non documentées. Dans une étude prospective menée à Bordeaux sur 45 patients, la sonication n’a pas montré d’amélioration significative de la sensibilité par rapport aux cultures conventionnelles des prothèses vasculaires, y compris dans les groupe des patients préalablement traités par antibiotiques. Six micro-organismes supplémentaires chez quatre patients ont cependant pu être identifiés grâce à la sonication. Les PCR bactériennes spécifiques ont également été étudiées dans le cadre de cette étude et n’ont pas montré d’amélioration significative de la sensibilité par rapport aux cultures. Cependant, en associant culture avec sonication et PCR spécifiques de genre ou de groupe bactérien (entérobactéries, staphylocoques, streptocoques et entérocoques) sur le liquide de sonication, un diagnostic microbiologique a pu être obtenu pour les 45 patients inclus (73).