Métabolisme des glucocorticoïdes dans le poumon
murin en développement : la voie surrénalienne
Mémoire
Catherine Gilbert
Maîtrise en médecine moléculaire
Maitre ès sciences (M. Sc.)
Québec, Canada
iii
Résumé
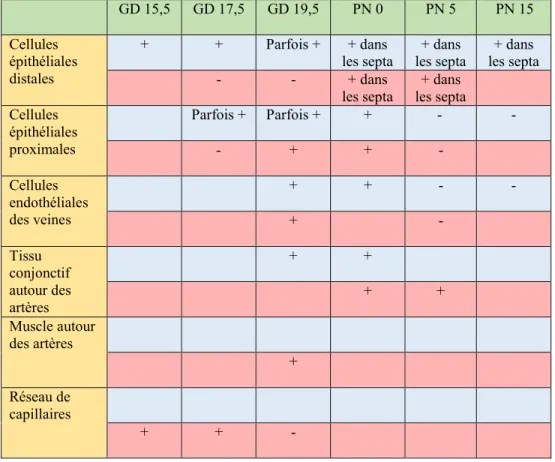
Lorsqu’une femme est à risque d’accoucher prématurément, des glucocorticoïdes lui seront administrés afin d’accélérer la maturation pulmonaire du bébé. Après la naissance, différents protocoles peuvent être mis en place pour aider l’enfant à respirer dont l’administration du surfactant et la ventilation. Les glucocorticoïdes ont un effet positif sur la maturation pulmonaire. Par contre, ils nuisent au processus de la septation après la naissance. Les glucocorticoïdes retrouvés dans le poumon en développement peuvent provenir de deux sources, soit de la voie classique de la synthèse des glucocorticoïdes par les surrénales, soit des gènes exprimés dans le poumon. Les sites d’expression des gènes codant pour les enzymes de la synthèse des glucocorticoïdes dans le poumon sont inconnus ainsi que le gène de la 20α-hydroxystéroïde déshydrogénase (20α-HSD). Cette dernière inactive le substrat et le produit de la 21-hydroxylase. Des poumons de fœtus de souris au jour de gestation 15,5, 17,5 et 19,5 ainsi que de souriceaux âgés de 0, 5 et 15 jours ont été utilisés pour des hybridations in situ. Cette étude a montré qu’avant la naissance, l’ARNm de la 21-hydroxylase est situé au niveau des cellules épithéliales distales alors que l’ARNm de la 20α-HSD se retrouve plutôt au niveau des capillaires. Les gènes de la 21-hydroxylase et de la 20α-HSD sont exprimés dans les cellules épithéliales proximales ainsi que dans les cellules endothéliales de veines dans la période entourant la naissance. À la fin du stade sacculaire et pendant le stade alvéolaire, le gène de la 21-hydroxylase est exprimé seulement dans les septa et les parois minces tout comme le gène de la 20α-HSD sauf dans le stade alvéolaire où il n’y avait pas de signal significatif. Ainsi, ces résultats suggèrent que la 20α-HSD pourrait participer au contrôle du niveau d’activité de la 21-hydroxylase en modulant la disponibilité de son substrat.
v
Summary
For many years, to reduce the risk of respiratory distress in newborns, antenatal glucocorticoids are administered to the mother about to deliver prematurely to accelerate fetal lung maturation. At birth, surfactant therapy can be used with several assisted ventilation strategies according to the morbidity of the neonate. Postnatal administration of glucocorticoids to the neonate is not recommended as they interfere with organ systems including the lung development process named septation. Previous studies performed in the Dr Tremblay’s laboratory have shown in the whole lung of the mouse: 1) the capability of the fetal lung to express several steroidogenic enzyme genes involved in glucocorticoid synthesis and; 2) the presence of a steroid-metabolizing activity compatible with the regulation of the substrate levels. The major enzymes involved in these processes are the 21-hydroxylase and the 20α-hydroxysteroid dehydrogenase, which are respectively encoded by Cyp21a1 and Akr1c18. The objective of my study was to find the sites of expression for these two genes. To do so, mouse fetal lungs isolated on gestation days 15.5, 17.5, and 19.5, and on postnatal days 0, 5, and 15 days were used for in situ hybridization with hydroxylase and 20α-HSD mRNAs. My results indicate that before birth, 21-hydroxylase mRNA is found in epithelial distal cells whereas the 20α-HSD gene is primarily expressed in capillaries. Around birth, 21-hydroxylase mRNA are associated with the proximal epithelium and endothelial cells of several veins. From the late saccular stage up to the half of the alveolar period, 21-hydroxylase mRNA is only associated with thin walls and septae. The situation was the same for 20α-HSD mRNA except for the alveolar stage during which no signal was detected. These results indicate that the expression profile of these two genes is compatible with the modulation of 21-hydroxylase substrates by the 20α-HSD.
vii
Table des matières
Résumé ... iii
Summary ... v
Liste des tableaux ... ix
Liste des figures ... xi
Liste des abréviations ... xiii
Remerciements ... xvii
Chapitre I : Introduction ... 1
1. Le poumon ... 1
1.1 Le développement pulmonaire ... 1
1.1.1 Le développement pulmonaire anténatal ... 2
1.1.2 Le développement pulmonaire postnatal ... 4
2. La prématurité ... 4
2.1 Le syndrome de détresse respiratoire ... 5
2.1.1 Les traitements du syndrome de détresse respiratoire ... 6
2.1.1.1 L’administration des glucocorticoïdes anténataux ... 6
2.1.1.2 Le surfactant postnatal ... 7
2.2 La dysplasie broncho-pulmonaire ... 7
3. Les glucocorticoïdes ... 8
3.1 La voie de synthèse des glucocorticoïdes ... 9
3.2 Action des glucocorticoïdes anténataux ... 10
4. Le gène de la 21-hydroxylase ... 11
4.1 Réaction catalytique de la 21-hydroxylase et structure de ses substrats et produits dans la production des glucocorticoïdes... 11
4.2 Action de la 21-hydroxylase ... 13
5. Le gène de la 20α-hydroxystéroïde déshydrogénase ... 13
5.1 Réaction catalytique de la 20α-hydroxystéroïde déshydrogénase et structure de ses substrats et produits ... 13
5.2 Action de la 20α-hydroxystéroïde déshydrogénase ... 14
6. Le projet de recherche ... 15
6.1 Hypothèse ... 15
viii
Chapitre II : Matériels et Méthodes ... 16
1. Animaux ... 16
1.1 Sexage des fœtus de souris par amplification PCR du gène Sry ... 16
2. Hybridation in situ ... 17
2.1 Fabrication de l’amplicon 20α-HSD ... 17
2.2 Sous-clonage de la 20α-HSD ... 18
2.2.1 Digestion et ligation de l’amplicon 20α-HSD et du vecteur de sous-clonage Pgem-3zf(-)... 18
2.2.2 Transformation des bactéries compétentes ... 18
2.2.3 Production de plasmide en petite quantité ... 19
2.2.4 Culture des clones en grande quantité ... 20
2.3 Préparation des sondes pour l’hybridation in situ ... 21
2.3.1 20α-HSD ... 21
2.3.2 21-hydroxylase ... 21
2.4 Protocole d’hybridation in situ ... 22
3. Immunohistochimie sur coupe en paraffine ... 23
3.1 Anticorps anti-Von Willebrand Factor (anti-VWF) ... 23
3.2 Anticorps anti-CD-31 ... 24
Chapitre III : Résultats ... 26
1. Localisation des ARN messagers de la 21-hydroxylase et de la 20α-hydroxystéroïde déshydrogénase par hybridation in situ sur des sections de poumons de souris en développement ... 26
Chapitre IV : Discussion ... 38
Chapitre V : Conclusion ... 43
ix
Liste des tableaux
Tableau 1 : Résumé des localisations des messagers de la 21-hydroxylase (rangées
bleues) et de la 20α-HSD (rangées rouges) dans le poumon de souris
xi
Liste des figures
Figure 1 : Stades du développement pulmonaire chez l’humain et chez la souris………….2 Figure 2 : Voie de synthèse des glucocorticoïdes chez les rongeurs et les autres
mammifères..………...…………...10
Figure 3 : Réaction catalytique de la 21-hydroxylase et structure de ses substrats et
de ses produits chez la souris et chez l’humain………...…………...12
Figure 4 :Réaction catalytique de la 20α-HSD et la structure de la progestérone
(substrat) et de la 20α-hydroxyprogestérone (produit)……..………...14
Figure 5 : Localisation des messagers de la 21-hydroxylase et de la 20α-HSD dans le
poumon de souris au jour de gestation 15,5 par hybridation in situ……...…….27
Figure 6 : Localisation des messagers de la 21-hydroxylase et de la 20α-HSD dans le
poumon de souris au jour de gestation 17,5 par hybridation in situ………...….29
Figure 7 : Localisation des messagers de la 21-hydroxylase et de la 20α-HSD dans le
poumon de souris au jour de gestation 19,5 par hybridation in situ...………….31
Figure 8 : Figure 4 : Localisation des messagers de la 21-hydroxylase et de la 20α-HSD
dans le poumon de souris au jour postnatal 0 par hybridation insitu……...…...33
Figure 9 : Localisation des messagers de la 21-hydroxylase et de la 20α-HSD dans le
poumon de souris au jour postnatal 5 par hybridation in situ…………...……...35
Figure 10 : Localisation des messagers de la 21-hydroxylase dans le poumon de souris
xiii
Liste des abréviations
ACTH ... Hormone adrénocorticotropine «Adrenocorticotropic hormone» AKR ... Aldo-céto réductase «Aldo-keto reductase»
ARNm ... Acide ribonucléique messager «Messenger ribonucleic acid» cDNA ... Acide désoxyribonucléique complémentaire «Complementary
deoxyribonucleic acid»
CBG ... Transcortine «Corticosteroid binding globulin»
CRH ... Corticolibérine «Corticotropin-releasing hormone»
DBP ... Dysplasie broncho-pulmonaire «Bronchopulmonary dysplasia» DEPC ... Pyrocarbonate d’éthyle «Diethylpyrocarbonate»
DHC ... Déhydrocorticostérone «Dehydrocorticosterone» EtOH ... Éthanol «Ethanol»
GD ... Jour de gestation «Gestational day»
HSD ... Hydroxystéroïde déshydrogénase «Hydroxysteroid dehydrogenase» IPTG ... Isopropyl β-D-1-thiogalactopyranoside
KO ... Déficience génique «Knock-out» LB ... Luria Bertani
NADP ... Nicotinamide adénine dinucléotide phosphate «Nicotinamide adenine
dinucleotide phosphate»
P450scc ... Enzyme de clivage de la chaîne latérale du cholestérol «P450 side
chain cleavage»
PAF ... Paraformaldéhyde «Paraformaldehyde»
PCR ... Réaction en chaine par polymérase «Polymerase chain reaction» PN ... Postnatal
PTI ... Pneumocyte de type I «Type I pneumocyte» PTII ... Pneumocyte de type II «Type II pneumocyte»
qPCR ... Réaction en chaine par polymérase quantitative «Real-time polymerase
chain reaction»
xv À ma famille, Merci pour votre soutien
xvi [ Attir ez
xvii
Remerciements
Tout d’abord, je voudrais remercier Dr. Yves Tremblay pour m’avoir permis de découvrir le monde de la recherche. Merci de m’avoir accueilli dans votre laboratoire à l’été 2012 et à l’été 2013 afin d’y faire mes premiers stages alors que j’étais au baccalauréat. Merci de m’avoir fait confiance en me permettant de faire ma maîtrise dans votre équipe. Je voudrais également remercier Dr. Pierre Provost qui m’a accompagné dans l’avancement de mon projet de recherche.
Je voudrais remercier toutes les autres étudiantes du laboratoire. Merci à Magaly Kaczmarczyk, Wafae Bouhaddioui et Céline Sallon pour votre disponibilité et vos conseils. Finalement, un grand merci à ma famille d’avoir été à mes côtés dans ce cheminement. Merci de m’avoir encouragée quand le moral était bas, mais surtout d’avoir été là pour partager avec moi mes moments de bonheur.
1
Chapitre I : Introduction
L’objectif de mon introduction est d’amener le lecteur vers mon sujet de recherche. Pour y arriver, je présente le poumon comme organe, en décrivant les principaux aspects de son développement pour focaliser sur la période néonatale, qui couvre la période de mon étude. Finalement je présente les gènes avec lesquels j'ai travaillé en les décrivant dans leur contexte pulmonaire.
1. Le poumon
1.1 Le développement pulmonaire
La durée de la grossesse et de la gestation sont de 40 semaines chez l’humain et entre 19 et 20 jours chez la souris Balb/C respectivement. Le poumon est l’un des derniers organes à terminer de se développer et le développement se poursuit après la naissance. Le développement pulmonaire peut aller jusqu’à 2 ans après la naissance pour l’humain (1) et à 30 jours après la naissance pour la souris. Le développement pulmonaire est divisé en cinq stades. Tout d’abord, il y a le stade embryonnaire suivi du stade pseudo-glandulaire, du stade canaliculaire, du stade sacculaire et finalement du stade alvéolaire (1, 2). Une différence entre l’humain et la souris concerne le niveau de développement du poumon lors de la naissance. Le poumon humain est au stade alvéolaire lors de la naissance alors qu’il est au stade sacculaire pour la souris (figure 1).
2
Figure 1 : Stades du développement pulmonaire chez l’humain et chez la souris. Tirée de Boucher et al., 2015.
1.1.1 Le développement pulmonaire anténatal
Le stade embryonnaire se termine à la septième semaine de gestation chez l’humain (3). Le début du développement pulmonaire est marqué par la formation d’un sillon laryngo-trachéal, qui est la trachée primitive. C’est à ce stade qu’il y a la formation de deux bourgeons bronchiques primaires. Ces bourgeons pulmonaires vont donner les lobes pulmonaires soit deux lobes à gauche et trois lobes à droite. L’épithélium n’est pas différencié et il est multipotent. C’est plus tard dans le développement que les types cellulaires spécialisés vont se différencier selon qu’ils soient situés dans la trachée et les bronches ou les bronchioles ou les alvéoles. Pour la souris, le stade embryonnaire se situe vers le neuvième jour de gestation. Les étapes du développement pulmonaire sont semblables à l’humain sauf que les deux bourgeons bronchiques primaires vont donner un lobe pulmonaire à gauche et quatre lobes à droite (4).
3
Le poumon est au stade pseudo-glandulaire de la septième à la 17e semaine de
gestation chez l’humain (5). Des voies aériennes se forment allant de la trachée jusqu’aux bronchioles terminales (1). À ce stade, l’arbre bronchique est formé de seize ramifications. Des types cellulaires commencent à se différencier comme les cellules épithéliales ciliées et les cellules sécrétrices comme les cellules de Clara au niveau des voies de conduction de l’air. Au niveau des parois bronchiques, c’est plutôt des cellules musculaires lisses et le cartilage qui se développent. D’autres régions ont encore un épithélium peu différencié. Pour la souris, le stade pseudo-glandulaire se situe entre le dixième et le seizième jour de gestation.
Le poumon est au stade canaliculaire de la 17e à la 27e semaine de gestation chez
l’humain (5). Ce stade est caractérisé par la différentiation des cellules épithéliales, par le début de la synthèse du surfactant vers la fin du stade canaliculaire et par l’apparition de l’acinus. C’est la division de la bronchiole terminale en bronchiole respiratoire qui forme l’acinus. C’est donc une structure pour les échanges gazeux. À ce stade, les cellules épithéliales se différencient. La différentiation se fait dans les parties les plus distales du poumon. Il y a deux types cellulaires soit les pneumocytes de type I (PTI) et les pneumocytes de type II (PTII). Les PTII commencent à sécréter le surfactant vers la fin du stade canaliculaire (1). Il y a également un réarrangement des capillaires dans le mésenchyme afin qu’ils viennent en contact avec l’épithélium soit au niveau des pneumocytes de type I pour créer une barrière air-sang. Pour la souris, le stade canaliculaire se situe entre le 16e et le 18e jour de gestation.
Le poumon est au stade sacculaire entre la 24e et la 38e semaine de gestation chez
l’humain (5). Le poumon se développe très rapidement. Il y a une augmentation de l’espace aérien. Les saccules, soit des sacs alvéolaires composés de PTI et de PTII, se forment. Les saccules sont séparés par des septa primaires qui sont encore épais puisqu’il y a la présence de deux réseaux capillaires ayant quelques connexions entre eux (1). La partie distale du poumon s’allonge puisque des ramifications font leur apparition afin de former les dernières générations bronchiques de l’arbre respiratoire. Le mésenchyme est moins présent. Il contient un bon nombre de cellules, soit les fibroblastes, mais peu de collagène et d’élastine. Les fibroblastes sont à l’origine de la production de la matrice extracellulaire. Ils
4
ont également un rôle dans la différentiation des cellules épithéliales. Le surfactant est sécrété en plus grande quantité, mais pas autant que le poumon mature. Pour la souris, le stade sacculaire se situe entre le 17e jour de gestation et va jusqu’à 5 jours après la
naissance.
1.1.2 Le développement pulmonaire postnatal
Le poumon est au stade alvéolaire entre la 36e semaine de gestation et va jusqu’à 2
ans après la naissance chez l’humain (5, 7). Les principales caractéristiques de ce stade sont le développement alvéolaire et la maturation pulmonaire. Les saccules continuent à prendre de l’expansion. Par la suite, des bourgeons se forment le long des septa primaires pour grossir et devenir les septa secondaires. Ces derniers séparent l’espace aérien afin de former les alvéoles. Les septa secondaires possèdent, comme les septa primaires, deux réseaux de capillaires. Les nouvelles alvéoles augmentent de volume et peuvent être sub-divisées par des nouveaux septa ce qui permet une plus grande surface alvéolaire et donc une plus grande surface pour les échanges gazeux. Les septations successives sont possibles aussi longtemps que le septum d’où le bourgeon se forme contient les deux réseaux de capillaires. Avec le temps, les septa épais possédant deux réseaux de capillaires vont se transformer en de petites parois où les deux capillaires vont se fusionner pour former un seul réseau vasculaire. Les septa sont alors matures. Ce processus marque la fin du développement du poumon. Le développement alvéolaire se fait principalement après la naissance. En effet, c’est 80 % des alvéoles qui se développent après la naissance (1).
2. La prématurité
Douze (12) à 13% des naissances sont prématurées aux États-Unis, 7% au Canada, 5 à 9% en Europe et jusqu’à 18% dans certaines régions de l’Afrique (5, 6). Un enfant est prématuré lorsqu’il nait avant la 37e semaine de gestation. Les enfants prématurés peuvent
être subdivisés en trois classes. Il y a les prématurés naissant avant la 37e semaine de
5
prématurés nés avant la 28e semaine de grossesse (8). Plus un enfant nait prématurément,
plus ses chances de survie sont diminuées. En effet, ses organes ne sont pas tous fonctionnels et rendus à maturité. Il aura besoin de soins particuliers. Les principaux problèmes liés à la prématurité sont la rétinopathie, l’entérocolite nécrosante, une hémorragie cérébrale pouvant causer des problèmes neurologiques, la dysplasie broncho-pulmonaire ainsi que le syndrome de détresse respiratoire (9). Différents facteurs peuvent augmenter le risque d’un accouchement prématuré. Entre autre, les femmes sont plus âgées au moment de leur grossesse ce qui augmente le risque de diabète de grossesse et la prééclampsie. Aussi, certaines femmes ont recours à la fécondation in vitro. Cette méthode peut favoriser la naissance de jumeaux ou de triplets (5). Les grossesses multiples sont une des causes de la prématurité. L’obésité, qui est de plus en plus présente dans certains pays, est aussi un facteur de risque de naissance prématurée. Le tabagisme, la consommation de drogues et l’excès d’alcool peuvent tous mener à une naissance avant terme (10).
2.1 Le syndrome de détresse respiratoire
Un accouchement avant terme réduit les chances de survie de l’enfant, car la maturité du poumon se fait dans les dernières semaines de gestation. Une des pathologies souvent observées chez les enfants prématurés est le syndrome de détresse respiratoire, aussi nommé maladie des membranes hyalines (5). Ce syndrome est dû à une insuffisance en surfactant (10). Le surfactant est un mélange hétérogène complexe liquide sécrété par des cellules spécialisées du poumon soit les pneumocytes de type II. Cette sécrétion empêche les alvéoles de collapser. Le surfactant est un mélange de 90% de phospholipides et de 10% de protéines (SP-A, SP-B, SP-C, SP-D) (5). Puisque le poumon d’un bébé prématuré est peu mature et qu’il y a peu de surfactant, le poumon collapse et l’enfant a de la difficulté à respirer. Le surfactant commence à être sécrété pendant le stade canaliculaire soit entre la 17e et la 28e semaine de gestation. Le risque diminue plus on approche du
terme de la grossesse. Il a été observé que les garçons prématurés sont plus à risque que les filles de faire un syndrome de détresse respiratoire (11). Il a été montré que les androgènes retardent la synthèse et la sécrétion du surfactant (12).
6
2.1.1 Les traitements du syndrome de détresse respiratoire
Depuis plusieurs années, il existe différentes thérapies pour assurer un meilleur taux de survie des enfants nés prématurément dont la corticothérapie anténatale, l’administration de surfactant exogène et la ventilation assistée (10, 13).
2.1.1.1 L’administration des glucocorticoïdes anténataux
C’est en 1969 que Liggins a montré que l’administration de glucocorticoïdes anténataux provoquait la maturation pulmonaire du bébé, c’est-à-dire une accélération de la production de surfactant (14). En 1972, Liggins et Howie ont fait un essai randomisé contrôlé sur l’administration de glucocorticoïdes anténataux (bétaméthasone) sur des femmes à risque d’accoucher prématurément. Ils ont montré que l’administration de glucocorticoïdes anténataux diminuait la morbidité et la mortalité chez les enfants prématurés à risque de développer le syndrome de détresse respiratoire (15). La corticothérapie anténatale consiste à administrer des glucocorticoïdes à la mère qui va accoucher prématurément (16, 17, 18). Ainsi, la maturation des poumons du fœtus est stimulée (19). Les glucocorticoïdes synthétiques sont dérivés de la structure moléculaire des prégnanes C21. Le cortisol est un glucocorticoïde actif. Le bétaméthasone et le dexaméthasone sont des glucocorticoïdes synthétiques utilisés en corticothérapie anténatale (20). On les administre quand la grossesse est entre 24 et 34 semaines et que la femme a un grand risque d’accoucher prématurément dans les sept jours suivant (21). En général, on administre deux doses de 12 mg séparées de 24 heures pour le bétaméthasone et quatre doses de 6 mg séparées par 12 heures pour le dexaméthasone (10, 21). Même après plus de quatre décennies, il existe encore un questionnement quant au meilleur choix de glucocorticoïde, la meilleure dose unique totale à administrer et la meilleure voie d’administration (22). Les glucocorticoïdes synthétiques ont l’avantage d’avoir une durée d’action plus longue et une meilleure affinité avec le récepteur des glucocorticoïdes que les glucocorticoïdes naturels (23). L’avantage de ce traitement est évident pour les gestations de moins de 32 semaines. Les meilleurs résultats sont quand l’accouchement se fait dans les 24 à 48 heures après l’administration des glucocorticoïdes puisque les risques d’infections
7
chez la mère sont diminués dans ces délais (21).
2.1.1.2 Le surfactant postnatal
Le surfactant est un mélange de 90% de phospholipides et de 10% de protéines (SP-A, SP-B, SP-C, SP-D) (5, 24). Le phospholipide ayant la fonction physiologique la plus importante présent dans le surfactant est le dipalmitoylphosphatidylcholine (19). Il réduit la tension de surface (26). L’administration de surfactant exogène à l’enfant prématuré permet de prévenir le collapsus pulmonaire (27). Il y a deux types de surfactant exogène. Il y a le surfactant naturel et le surfactant synthétique. Le surfactant naturel est à base d’extraits lipidiques provenant de tissus du poumon d’origine bovine ou porcine (28). Ce type de surfactant contient des phospholipides modifiés pour que ce type de surfactant soit homologue au surfactant humain. Il contient les protéines du surfactant (SP) B et C (29). Le surfactant synthétique n’est pas encore disponible. En fait, d’autres recherches doivent être faites afin que le surfactant synthétique soit équivalent ou supérieur au surfactant naturel modifié. Le surfactant synthétique ne contient pas de protéine, mais seulement des phospholipides. Le surfactant naturel a une action plus rapide que le surfactant synthétique (30). Par contre, l’administration de surfactant naturel peut causer des réactions immunologiques. C’est pourquoi des recherches sont en cours afin de produire un surfactant sécuritaire sans risque de transmission d’agents infectieux aux patients (31, 32).
2.2 La dysplasie broncho-pulmonaire
La dysplasie broncho-pulmonaire (DBP), introduite dans les années 60 par Northway, est une pathologie observée chez les prématurés (5, 33). Sa prévalence est proportionnelle avec l’âge gestationnel (34). Elle est souvent observée chez l'enfant immature ayant eu recours à de la ventilation suite à un syndrome de détresse respiratoire ainsi que chez les grands prématurés où il y a une simplification alvéolaire. Puisque le poumon est encore peu développé et que sa structure n’est pas encore en place pour l’expiration et l’inspiration, les alvéoles se déforment sous la pression de l'air de la ventilation positive. Cette pathologie affecte 30% des enfants nés prématurés avec un poids
8
à la naissance inférieur à 1500 g et 52% des bébés nés avant 28 semaines avec un poids à la naissance de 501 à 750 g (35).
La DBP existe sous deux formes soit la «classique» et la «nouvelle» (10). La «classique» survient à la suite d’un traitement prolongé à un niveau d’oxygène plus élevé que le niveau normal (21%) avec ou sans ventilation mécanique. Cette application augmente l’incidence d’une bronchopathie, d’une fibrose et d’une hyperplasie des fibres musculaires lisses (36, 37). Il existe maintenant d’autres traitements comme la corticothérapie anténatale, le surfactant exogène et la ventilation moins agressive. L’amélioration des soins néonataux a permis de sauver les bébés encore plus jeunes. Chez ces enfants, on peut observer la «nouvelle» BPD. La «nouvelle» BPD est caractérisée par un défaut d’alvéolisation, de septation et de vascularisation pulmonaire (38). À long terme, cet enfant pourra garder des séquelles cardio-respiratoires dont l’hypertension (39). De plus, des symptômes de l’asthme et un plus grand risque d’infection pulmonaire peuvent conduire vers une insuffisance respiratoire chronique chez ces individus (40).
3. Les glucocorticoïdes
Les glucocorticoïdes sont des hormones stéroïdiennes dérivées du cholestérol. Ils jouent un rôle dans le métabolisme du glucose, dans la réponse immunitaire et inflammatoire, dans la réponse au stress, dans le maintien de la pression sanguine ainsi que dans le développement du poumon et de la production du surfactant (41). En résumé, les glucocorticoïdes sont impliqués dans l’homéostasie du corps. Par contre, après la naissance, les glucocorticoïdes ont un effet néfaste sur le processus de la septation dans le poumon (42, 43). Le glucocorticoïde actif chez la souris est la corticostérone, alors que chez l’humain c’est le cortisol (44, 45). Ils sont synthétisés et sécrétés principalement par les glandes surrénales sous le contrôle de l’axe hypothalamo-hypophyso-surrénalien. Cet axe est modulé par le CRH (corticotropin-releasing hormone) produit par l’hypothalamus, puis par l’ACTH (adrenocorticotropic hormone) produite par l’hypophyse antérieure (46, 47). Dans les tissus périphériques, notamment le cerveau et le poumon, il est possible de retrouver une synthèse locale du glucocorticoïde actif par l’action de la
11β-9
hydroxystéroïde déshydrogénase de type 1 par conversion de la 11-DHC en corticostérone chez la souris et de la cortisone en cortisol chez l’humain (48, 49). Les glucocorticoïdes produits par la surrénale sont transportés vers les tissus via le sang, principalement par la transcortine (CBG en anglais) et l’albumine. Ces protéines transportent 90% des glucocorticoïdes dans le plasma (50). Le glucocorticoïde est dégradé par le foie lorsqu’il n’est pas lié (41). Il y a également un rétrocontrôle négatif du cortisol sur l’hypophyse et l’hypothalamus.
3.1 La voie de synthèse des glucocorticoïdes
La voie classique de la synthèse des glucocorticoïdes par les surrénales chez la souris est composée de la P450scc (enzyme de clivage de la chaîne latérale du cholestérol), de la 3β-hydroxystéroïde déshydrogénase (3β-HSD), de la 21-hydroxylase et de la 11β-hydroxylase (44, 51). Chez l’humain, la voie de synthèse est semblable sauf que le cytochrome P450c17 converti la prégnènolone en 17-OH-prégnènolone et la progestérone en 17-OH-progestérone (52) (figure 2). Le glucocorticoïde actif chez la souris est la corticostérone alors que chez l’humain c’est le cortisol (44). Dans les tissus périphériques, comme le poumon, il peut y avoir la conversion du glucocorticoïde inactif en glucocorticoïde actif. Chez la souris, la 11β-hydroxystéroïde déshydrogénase (11β-HSD) de type 1 permet de convertir la 11-déhydrocorticostérone (11-DHC) en molécule active, la corticostérone (53, 54). Chez l’humain, cette enzyme permet la réaction similaire, mais de la cortisone vers le cortisol. Pour les deux espèces, c’est le 11β-HSD de type 2 qui permet de revenir à la molécule inactive (55). Il a été montré que les gènes impliqués dans la voie classique de la synthèse des glucocorticoïdes, habituellement présents dans les surrénales, peuvent également être exprimés dans le poumon. L’ARNm de la 11β-hydroxylase a été détecté seulement au jour de gestation 15,5 (51) chez la souris alors que les messagers de la P450scc, la 3β-HSD et la 21-hydroxylase ont tous été détectés jusqu’au jour postnatal 15 (52).
10
Figure 2 : Voie de synthèse des glucocorticoïdes chez les rongeurs et les autres mammifères. Tirée de Boucher et al., 2014
3.2 Action des glucocorticoïdes anténataux
Les glucocorticoïdes ont un rôle essentiel dans le développement pulmonaire. En effet, ils participent entre autres à l’augmentation du nombre de pneumocytes de type I et à la stimulation de la synthèse et de la sécrétion du surfactant (56, 57). Les glucocorticoïdes jouent également un rôle dans la réabsorption du liquide pulmonaire avant la naissance (58, 59, 60, 61). Par contre, une étude a montré que lorsque le poumon est au stade canaliculaire, l’administration de cortisol (glucocorticoïde actif), n’augmente pas le niveau d’expression des gènes impliqués dans la réabsorption du liquide pulmonaire comparativement à ce qui est observé lorsque le fœtus est plus âgé. Ainsi, au stade canaliculaire, le poumon répond différemment à l’augmentation de la concentration des glucocorticoïdes (62). Plusieurs travaux impliquant le récepteur des glucocorticoïdes chez la souris ont démontré le rôle essentiel des glucocorticoïdes dans le poumon. Les souris qui
11
avaient un récepteur des glucocorticoïdes déficient décédaient d’un arrêt respiratoire dans les heures suivant la naissance (63) et avaient une malformation du poumon résultant en de sévères problèmes respiratoires (64). Une autre étude a été faite avec un modèle de souris KO pour le CRH (corticotropin-releasing hormone). Cette étude a révélé que les fœtus, dont les mères étaient KO pour le CRH, naissaient à terme, mais décédaient quelques jours plus tard dû à une malformation du poumon (56, 65). Cette malformation était définie par une hyper-prolifération du mésenchyme (66). Des glucocorticoïdes ont été administrés aux souris gestantes de cette lignée avant la naissance des bébés. Ces souriceaux sont nés à terme et n’ont pas eu de malformation du poumon et de problème respiratoire. Ces études montrent bien l’importance des glucocorticoïdes dans le développement du poumon.
4. Le gène de la 21-hydroxylase
4.1 Réaction catalytique de la 21-hydroxylase et structure de ses substrats et produits dans la production des glucocorticoïdes
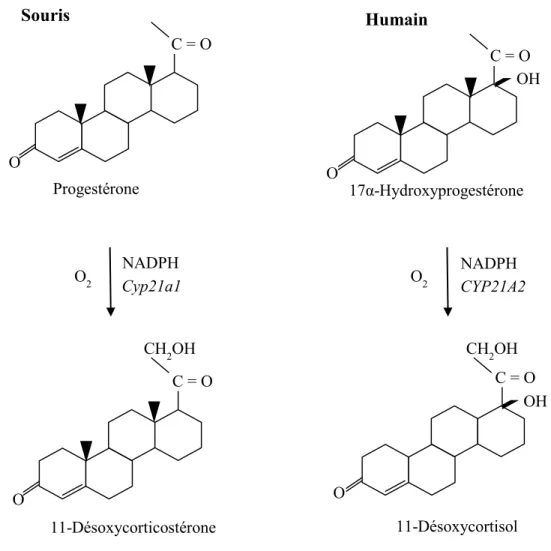
Chez la souris, la 21-hydroxylase utilise la progestérone comme substrat et produit la 11-désoxycorticostérone. Chez l’humain, le substrat est le 17α-hydroxyprogestérone et le produit, le 11-désoxycortisol (67). Cette réaction se fait dans le réticulum endoplasmique. Elle utilise une molécule d’oxygène et une molécule de NADPH (68, 69).
12
Figure 3 : Réaction catalytique de la 21-hydroxylase et structure de ses substrats et de ses produits
chez la souris et chez l’humain.
Il y a deux gènes chez l’humain et chez la souris pour la 21-hydroxylase. Chez l’humain, il y a la CYP21A1 et la CYP21A2. Chez la souris, il y a la Cyp21a1 et la Cyp21a2. La CYP21A2 est le gène qui code pour l’enzyme fonctionnel chez l’humain et le CYP21A1 est un pseudogène (70). Chez la souris, c’est plutôt le gène Cyp21a1 qui code pour l’enzyme fonctionnel et le Cyp21a2 est un pseudogène (71). La 21-hydroxylase fait partie de la famille des enzymes P450. Ce sont des hémoprotéines, c’est-à-dire des protéines qui utilisent l’hème comme cofacteur. Les enzymes P450 font des réactions d’oxydoréduction et sont retrouvées dans des bactéries, des plantes et des animaux. Son
C = O O Souris Progestérone C = O OH O Humain 17α-Hydroxyprogestérone O2 NADPH O2 NADPH Cyp21a1 CYP21A2 C = O O CH2OH 11-Désoxycorticostérone C = O O OH CH2OH 11-Désoxycortisol
13
nom vient du fait qu’il y a un changement d’absorbance de la lumière de 420 nm à 450 nm (68, 69). La réaction générale est :
4.2 Action de la 21-hydroxylase
L’hyperplasie congénitale des surrénales est une maladie génétique autosomale récessive qui touche une personne sur 18 000 (72). L’individu possédant cette maladie a une déficience du gène de la 21-hydroxylase. La 21-hydroxylase convertie la progestérone en désoxycorticostérone, précurseur de l’aldostérone, ainsi que la 17-hydroxyprogestérone en 11-désoxycortisol, précurseur du cortisol chez l’humain (73, 74). Étant donné que l’enzyme de la 21-hydroxylase n’est pas fonctionnelle chez l’individu atteint de l’hyperplasie congénitale des surrénales, il y a une diminution du niveau de cortisol et d’aldostérone. Puisqu’il y a une accumulation des précurseurs du cortisol, la voie de synthèse des androgènes est engagée. Ainsi, chez le bébé de sexe féminin, il y aura une virilisation de ses parties génitales (75, 76). La voie de synthèse des minéralocorticoïdes est également affectée. La diminution des minéralocorticoïdes a pour effet de provoquer la déshydratation chez la personne atteinte de la maladie et peut mener jusqu’au décès de l’individu. Des traitements sont disponibles (72).
5. Le gène de la 20α-hydroxystéroïde déshydrogénase
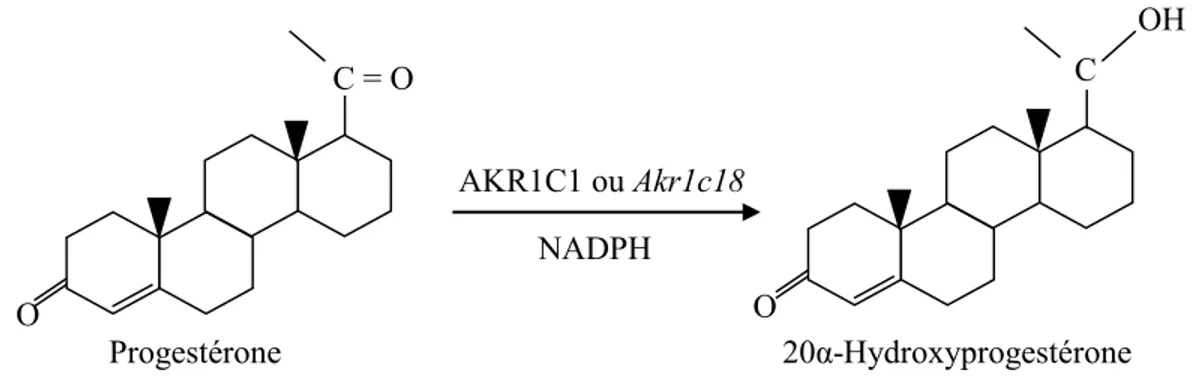
5.1 Réaction catalytique de la 20α-hydroxystéroïde déshydrogénase et structure de ses substrats et produits
La 20α-hydroxystéroïde déshydrogénase (20α-HSD), dont le gène est Akr1c18 chez la souris (51) et AKR1C1 chez l’humain (69), fait partie de la famille des aldo-céto réductase (aldo-keto reductase AKR, en anglais) (77, 78). Leurs cofacteurs sont le NADH et préférentiellement le NADPH (80). Les AKRs ont la capacité de faire, par une réaction bidirectionnelle, la réduction des cétones et l’oxydation des alcools (81). Les substrats de la 20α-HSD sont la progestérone et la désoxycorticostérone. Ces deux substrats possèdent des
14
groupes carbonyles. Les produits sont respectivement le progestérone et le 20αOH-désoxycorticostérone. La réduction par les AKRs se fait en deux étapes. Premièrement, un ion est transféré du NAD(P)H au substrat carbonylé. Deuxièmement, un proton présent dans le solvant vient réduire le groupe carbonyle en groupement hydroxyle (-OH) (81).
Figure 4 : Réaction catalytique de la 20α-HSD et la structure de la progestérone
(substrat) et de la 20α-hydroxyprogestérone (produit).
5.2 Action de la 20α-hydroxystéroïde déshydrogénase
Une étude a montré que les souris KO pour la 20α-HSD avaient une diminution du nombre de souriceaux vivants et que la durée du cycle œstral était prolongée (82). La 20α-HSD est donc importante pour la survie des nouveau-nés. La gestation est maintenue par la présence de la progestérone qui est synthétisée par les ovaires. La progestérone se lie aux récepteurs présents dans l’utérus et permet d’inhiber les contractions utérines. Dans les 24 à 36 heures avant la parturition, il y a une augmentation de l’activité de la 20α-HSD et une diminution du niveau de progestérone (83, 84, 85). Elle joue un rôle dans la régulation de la concentration de la progestérone (86). C = O O Progestérone AKR1C1 ou Akr1c18 NADPH H C 20α-Hydroxyprogestérone O OH O O H
15
6. Le projet de recherche
6.1 Hypothèse
Il a été montré que la voie de synthèse des glucocorticoïdes retrouvée dans les surrénales peut également se faire dans le poumon murin. En effet, les messagers de la P450scc, de la 3β-HSD et de la 21-hydroxylase ont tous été détectés du jour de gestation 15,5 au jour postnatal 15 dans le poumon de la souris (52), alors que l’ARNm de la 11β-hydroxylase a été détecté seulement au jour de gestation 15,5 (51). La présence de l’ARNm de la 20α-HSD dans le poumon murin a aussi été démontrée (52). Cependant, les sites précis d’expression des gènes de la 21-hydroxylase et de la 20α-HSD sont encore inconnus. Les structures présentes dans le poumon en développement varient en fonction du temps. C’est pourquoi nous avons posé l’hypothèse que les sites d’expression de la 21-hydroxylase et de la 20α-HSD varient en fonction du stade du développement pulmonaire. Pour valider cette hypothèse, nous devons identifier les sites d’expression de ces deux gènes par hybridation in situ à différents stades du développement pulmonaire.
6.2 Objectifs
L’objectif de cette recherche est d’identifier les sites d’expression de la 21-hydroxylase et de la 20α-HSD dans le poumon murin en développement. Pour y arriver, des hybridations in situ ont été faites sur des poumons de souris à différents âges, soit au jour de gestation 15,5, 17,5 et 19,5 (juste avant la naissance) ainsi qu’au jour postnatal 0, 5 et 15. Puisque les glucocorticoïdes sont impliqués dans la maturation pulmonaire et qu’après la naissance ils nuisent au processus de la septation, nous avons voulu couvrir tous les stades dont fait partie ces processus. Cette étude a donc couvert le stade pseudo-glandulaire jusqu’au stade alvéolaire. Les sites d’expressions ont ensuite été identifiés afin de mieux comprendre les rôles joués par la 21-hydroxylase et la 20α-HSD dans la production des glucocorticoïdes par le poumon.
16
Chapitre II : Matériels et Méthodes
1. Animaux
Tous les animaux ont été gardés dans une pièce dont la lumière a été contrôlée à 12 heures de noirceur et 12 heures de clarté. Les femelles Balb/C en oestrus ont été mises en accouplement pendant la nuit (16 heures). Le lendemain matin, celles qui avaient un bouchon vaginal ont été placées séparément dans une nouvelle cage pour la poursuite de la gestation. Cette journée est considérée comme le jour de gestation (GD) 0,5. La naissance des souris se fait pendant le jour de gestation 19,5 et correspond au jour postnatal 0 (PN 0). Les sacrifices ont été fait en GD 15,5, GD 17,5 , GD 19,5 , PN 0, PN 5 et PN 15. Les femelles gestantes ont été endormies avec de l’isoflurane puis euthanasiées par inhalation du dioxyde de carbone. Ce sacrifice a été utilisé pour les souris au jour de gestation 15,5 jusqu’au jour 19,5. Les souriceaux âgés entre 0 et 5 jours ont été sacrifiés sur glace par hypothermie et ceux âgés de 15 jours ont été sacrifiés par une injection d’euthanyl intra-péritonéale. Le sexage des fœtus au jour de gestation 15,5 a été fait par une amplification PCR du gène Sry (voir la section 1.1). De GD17,5 à PN15, le sexage a été fait visuellement en observant la distance ano-génitale, puis par la présence/absence des testicules et des cornes utérines. Les poumons en GD 15,5 jusqu’en PN 5 ont été prélevés puis ont été mis dans la solution de paraformaldéhyde (PAF) 4% (paraformaldéhyde (Sigma) et tétraborate de sodium décahydraté 0,01 M (Sigma) dans de l’eau) et ils ont été fixés à 4°C pendant un minimum de 48 heures. Les poumons en PN 15 ont été quant à eux instillés pendant 15 minutes à pression constante avec le PAF 4% puis ils ont été prélevés et gardés dans le PAF 4% à 4°C pendant un minimum de 48 heures. Ensuite, les poumons ont été mis en bloc de paraffine.
1.1 Sexage des fœtus de souris par amplification PCR du gène Sry
Avant de faire le PCR du gène Sry, il a fallu isoler l’ADN de la queue du fœtus. La queue de la souris doit être conservée sur glace sèche ou à -80°C en tout temps avant
17
l’étape d’extraction de l’ADN pour éviter que l’ADN ne se dégrade. Pour l’extraction de l’ADN, 50 µl de l’Extraction Reagent (Quanta, BioSciences) ont été ajoutés dans le tube contenant la queue du fœtus à sexer. Le tube a été mis dans un bloc chauffant à 95°C pendant 20 minutes, puis incubé à la température de la pièce pendant 15 minutes. 50 µl de la solution de stabilisation (Quanta, BioSciences) ont été ajoutés. Le PCR du gène Sry a été fait en utilisant la paire d’amorces suivante : 5’-TAT-GGT-GTG-GTC-CCG-TGG-TG-3’ et 5’-ATG-TGA-TGG-CAT-GTG-GGT-TCC-3’. L’instrument utilisé était le Bio-Rad T100 Thermal Cycler et le kit utilisé pour l’amplification était l’AccuStart II GelTrack PCR Super Mix (Quanta, BioSciences). Le programme utilisé pour la réaction PCR était le suivant : 1) 5 minutes à 94°C, 2) 10 minutes à 72°C, 3) 1 minute à 94°C, 4) 1 minute à 65°C, 5) 1 minute à 72°C, 6) revenir à l’étape 3 34 fois, 7) 10 minutes à 72°C, 8) à 20°C jusqu’à la récupération des échantillons. Les échantillons ont été analysés par électrophorèse sur gel d’agarose 1,5% dans du tampon TAE 1X (tampon TAE 50X : Tris 2 M, Na acétate 1 M, EDTA 50 mM, pH 8,3). La détection d’une bande aux alentours de 300 pb indiquait que le fœtus était de sexe masculin puisqu’il y a eu amplification du gène Sry (chromosome Y présent seulement chez le mâle).
2. Hybridation in situ
2.1 Fabrication de l’amplicon 20α-HSD
Un amplicon spécifique à la 20α-HSD chez la souris (NM_134066.2) (nucléotides 375 à 686) a été produit à partir de cDNA de poumon de souris en PN 15 avec la paire d’amorces suivante : 5’-GGG-GGA-ATT-CTC-TCA-TTC-ATT-TCC-CAG-TGT-CTC-3’ et 5’-GGG-AAG-CTT-GCA-CCA-TAG-GCA-ACC-AGA-AC-3’. Les sections en gras sont les sites de restriction utilisés pour le sous-clonage. G/AATTC correspond au site de restriction d’EcoRI. La coupure se fait entre le G et le A sur chaque brin (extension 5’). A/AGCTT correspond au site de restriction de HindIII. La coupure se fait entre les deux A. Ces deux enzymes ont été utilisées car leurs sites de restriction sont présents dans le vecteur de sous-clonage pGEM-3zf(-) (Promega). Les réactions PCR ont été effectuées dans un Bio-Rad T100 Thermal Cycler avec le kit Expand Long Template PCR System (Roche). Le
18
programme qui a été utilisé pour faire la réaction PCR est le suivant : 1) 5 minutes à 95°C, 2) 10 minutes à 72°C, 3) 1 minute à 95°C, 4) 1 minute à 55°C, 5) 45 secondes à 72°C, 6) revenir à l’étape 3 34 fois, 7) 10 minutes à 72°C, 8) à 18°C jusqu’à la récupération des échantillons. Les échantillons ont été analysés par électrophorèse sur gel d’agarose 1,8%. La bande attendue de 312 pb pour la 20α-HSD a été observée.
2.2 Sous-clonage de la 20α-HSD
2.2.1 Digestion et ligation de l’amplicon 20α-HSD et du vecteur de sous-clonage Pgem-3zf(-)
Afin d’insérer l’amplicon dans le vecteur pGEM-3zf(-), une digestion de l’insert et du vecteur a été faite préalablement avec les enzymes de restriction EcoRI-HF (20 U/µl) (New England BioLabs) et HindIII-HF (20 U/µl) (New England BioLabs) dans du tampon CutSmart (10X) (New England BioLabs). La solution de digestion comprend une concentration finale de 1 U/µl de chaque enzyme, le vecteur ou l’amplicon (20α-HSD), le tampon CutSmart à une concentration finale de 1X et de l’eau. L’incubation a été faite à 37°C pendant 3 heures. Un gel d’agarose 1,8% dans du tampon TAE 1X a été préparé afin de vérifier que la digestion était complète. Par la suite, l’ADN digéré a été purifié avec le QIAquick PCR Purification Kit (Qiagen). La ligation du vecteur et de l’insert (20α-HSD) a été faite avec la ligase T7 (New England BioLabs) et le tampon de ligation commercial (1X) (New England BioLabs) pendant 2 heures à 25°C.
2.2.2 Transformation des bactéries compétentes
Du milieu de culture LB (Luria Broth) (10 g BACTO-Tryptone (Fisher), 5 g extrait de levures (Fisher) et 10 g NaCl dans un volume final de 1 litre à un pH final de 7,0) a été préparé, puis autoclavé. De l’agar (5 g Agar (Fisher) et 300 ml de LB-medium) a également été préparé et envoyé à l’autoclave. De l’ampicilline (0,1 mg/ml) a été ajoutée à l’agar avant de le verser dans les boîtes de Pétri. Avant de faire la transformation des bactéries compétentes, 40 µl d’IPTG 100 mM ont été étalés sur l’agar dans les boîtes de Pétri. Une
19
fois séchés, 40 µl de X-Gal (40 mg/ml dans le diméthylformamide) ont été étalés sur l’agar, puis ont été laissés diffuser dans l’agar pendant une heure à la température de la pièce, puis 30 minutes à 37°C. La transformation des bactéries compétentes a débuté en dégelant sur glace un tube de One Shot® OmniMAXTM 2-T1R (Invitrogen). Par la suite, 1µl de la
réaction de ligation a été ajouté au tube de bactéries E. coli, puis a été mélangé doucement. Ce tube a ensuite été incubé sur glace pendant 30 minutes, puis dans un bain-marie à 42°C pendant 30 secondes et finalement sur glace pendant deux minutes. 250 µl de milieu de culture S.O.C. (invitrogen) à la température de la pièce ont été ajoutés au tube de bactéries. Ce tube a été incubé à 37°C pendant une heure sous une agitation de 150 rpm. Une dilution 1:50 a été faite. À partir de ce tube (tube X), des dilutions 1/2 et 1/5 ont été faites. 150 µl de chacune de ces dilutions (tube X, 1/2, 1/5) ont été étalés sur l’agar contenant l’IPTG et le X-Gal. Ces boîtes de Pétri ont été incubées à 37°C pendant la nuit. Après l’incubation, des colonies blanches et bleues ont été aperçues. S’il y a l’insertion d’un fragment d’ADN dans le vecteur qui a été inséré dans la cellule compétente, la colonie sera blanche. Par contre, en absence d’insertion d’un fragment d’ADN dans le vecteur, la colonie sera bleue. La présence de la coloration bleue est due par l’hydrolysation du X-Gal par la β-galactosidase. La formation du peptide LacZ (dans la cellule bactérienne) est arrêtée lorsqu’un fragment d’ADN est inséré dans le vecteur. Ainsi, la cellule bactérienne n’aura plus d’activité β-galactosidase et elle ne pourra pas hydrolyser le X-Gal présent sur les boîtes de Pétri lorsqu’un segment d’ADN est inséré dans le vecteur.
2.2.3 Production de plasmide en petite quantité
Les colonies blanches, donc celles ayant une insertion d’ADN, ont été sélectionnées pour faire la production de plasmide en petite quantité. La production de plasmide en petite quantité permet de déterminer lesquels des clones contiennent le fragment d’ADN (20α-HSD). Chacune des colonies blanches sélectionnées a été déposée dans 140 ml de milieu de culture LB contenant 140 µl d’ampicilline (1000X) et a été incubée à 37°C pendant 16 heures sous une agitation de 125 rpm, le tube incliné à 45º. Ensuite, 1,5 ml de la culture bactérienne ont été centrifugés. Le surnageant a été enlevé et 200 µl de tampon STET (sucrose 8% (wt/vol), Tris 50 mM pH 8,0, EDTA 50 mM pH 8,0, Triton X-100 5%
20
(vol/vol)) ont été ajoutés pour y resuspendre le culot. Vingt (20) µl de lysozyme (10 mg/ml dans Tris-HCl 10 mM, pH 7,8) ont été ajoutés à la solution avant de chauffer le tout à 100°C pendant 40 secondes, puis de centrifuger à 20°C pendant 10 minutes. Le culot a été enlevé. 14 µl de NaCl 5M et 240 µl d’isopropanol ont été ajoutés au surnageant. Le surnageant a été mis sur glace sèche pendant 10 minutes. Il a ensuite été dégelé et centrifugé pendant 15 minutes. Le culot a été complètement séché avant d’être resuspendu dans l’eau distillée. Une double digestion des clones a été faite avec les enzymes de restriction HindIII-HF (High Fidelity) (20 U/µl) et NdeI (20 U/µl) (New England BioLabs). HindIII a été utilisé parce que cette enzyme peut couper le site de restriction présent à la jonction du vecteur et de l’insert (20α-HSD) et NdeI a été utilisé parce que l’enzyme coupe seulement dans le vecteur. Ainsi, la bactérie qui contient le bon insert a un nombre de paires de bases connu. La solution de digestion comprend une concentration finale de 1,33 U/µl de chaque enzyme, l’ADN du clone, le tampon CutSmart à une concentration finale de 1X, de la RNAse A (dégrade les brins d’ARN simples brins) et de l’eau. Le tout a été incubé à 37°C pendant deux heures. Les digestions ont été analysées par électrophorèse et le clone retenu donnait un fragment de 1000 pb, tel qu’attendu.
2.2.4 Culture des clones en grande quantité
Ce clone a été mis en culture en grande quantité. Tout d’abord, la colonie sélectionnée a été piquée et mise en culture dans 20 ml de milieu de culture LB et 20 µl d’ampicilline 1000X. L’incubation a été de 7 heures à 37°C dans un incubateur rotatif à 240 rpm. Par la suite, la culture a été transférée dans 350 ml de milieu frais et 35 µl d’ampicilline 1000X. L’incubation s’est poursuivie pendant 18 heures à 37°C dans un incubateur rotatif à 220 rpm. Pour purifier le plasmide, une maxiprep (Qiagen Plasmid Maxi Kit (Qiagen)) a été faite en suivant le protocole de cette compagnie.
21
2.3 Préparation des sondes pour l’hybridation in situ 2.3.1 20α-HSD
Ce clone purifié a été utilisé pour une amplification PCR afin de produire une matrice sans vecteur pour la synthèse des sondes ARN. Les amorces SP6 et T7 utilisées étaient respectivement : 5’-ATT-TAG-GTG-ACA-CTA-TAG-AAT-AC-3’ et 5’-TGT-AAT-ACG-ACT-CAC-TAT-AGG-G-3’. L’instrument qui a été utilisé est le Bio-Rad T100 Thermal Cycler et l’ensemble qui a été utilisé pour l’amplification est l’Expand Long Template PCR System (Roche Diagnostics). Le programme qui a été utilisé pour faire la réaction PCR est le suivant : 1) 5 minutes à 95°C, 2) 10 minutes à 72°C, 3) 1 minute à 95°C, 4) 1 minute à 55°C, 5) 1 minute à 72°C, 6) revenir à l’étape 3 34 fois, 7) 10 minutes à 72°C, 8) à 18°C jusqu’à la récupération des échantillons. Les sondes RNA ont été préparées avec 2 μl de NTP labeling mix (contenant le DIG-UTP (Roche)), 1 μg d’ADN, 2 μl de tampon de transcription 10X (Roche), 20 U de RNAse inhibitor (Promega), 40 U de SP6 (sonde antisens) ou T7 (sonde sens) RNA polymerase (Roche) dans un total de 20 μl. L’ADN matrice a été éliminé par une réaction avec la DNAse 1 exempte de RNAse (Roche). Les réactions enzymatiques ont été arrêtées par l’ajout d’EDTA 0.2M. Les sondes ont été précipitées pendant la nuit avec du tRNA (Roche) 10 mg/ml, du LiCl 4 M et de l’éthanol 95% puis lavées avec de l’éthanol 70%. Après centrifugation, le culot a été resuspendu avec du SDS 1% dans de l’eau traité au DEPC. La sonde a été validée sur un gel d’agarose 1,2%.
2.3.2 21-hydroxylase
Une sonde avec le gène de la 21-hydroxylase chez l’humain était disponible dans le laboratoire (NM_000500.7) (nucléotides 736 à 902 de la séquence d’ARNm). Il était possible de faire une hybridation in situ avec la sonde de la 21-hydroxylase humaine puisqu’il y avait 80% d’homologie entre les séquences humaines et de souris. Nous avons donc utilisé ce clone (87).
22
2.4 Protocole d’hybridation in situ
La procédure générale pour l’hybridation in situ est la suivante. Le tissu de 5 μm d’épaisseur a été déparaffiné et réhydraté avant d’être fixé pendant 5 minutes dans le paraformaldéhyde 4% préparé dans du PBS 1X. Par la suite, les lames ont été trempées dans un mélange éthanol : acide acétique glacial (95 :5) pendant 10 minutes à -20°C pour faire précipiter les protéines. Elles ont été réhydratées, équilibrées dans du PBS 1X puis incubées à 37°C pendant 15 minutes dans la chambre humide avec de la protéinase K (10 μg/ml dans du PBS 1X) (Roche) préchauffée à 37°C. L’activité de la protéinase a été arrêtée avec de la glycine (2 mg/ml) dans du PBS 1X. Après le lavage au PBS 1X, le tissu a été refixé dans le paraformaldéhyde 4% pendant 5 minutes à la température de la pièce. Après un autre lavage au PBS 1X, les lames ont été incubées dans du triéthanolamine 100 mM à pH 8.0 pendant 10 minutes à la température de la pièce, puis lavées dans du PBS 1X. Elles ont été pré-hybridées avec la solution d’hybridation pendant deux heures dans la chambre humide à 42°C (0,3 M NaCl, 10 mM Tris-HCl pH 7,5, 1 mM EDTA, 1X Denhart’s (Sigma), 250 μg/ml tRNA, 5% dextran sulfate, 0,02% SDS, 50% formamide, ADN de sperme d’hareng (0,25 mg/ml)). Les sondes ont été dénaturées, puis diluées dans la solution d’hybridation à une concentration finale de 5 μg/ml. L’hybridation a été faite à 42°C dans la chambre humide pendant la nuit. Par la suite, les lames ont été lavées deux fois pendant 5 minutes dans du SSC 2X (SSC 20X : 262,95 g NaCl et 132,3 g Na citrate 2H2O dissout dans 800 ml H2O DEPC, pH ajusté à 7,0) à la température de la pièce. Il s’en
est suivi d’un lavage à 42°C dans du SSC 2X, deux fois dans du SSC 1X et deux autres lavages dans du SSC 0,2X toujours à 42°C. Le tissu a été équilibré deux fois dans du tampon de détection #1 (200 mM Tris-HCl pH 7,5, 200 mM NaCl). Les liaisons non spécifiques ont été bloquées avec la solution de blocage (pour 10 ml : 9,3 ml de Triton-X-100 0,3%, 500 μl de sérum de mouton, 200 μl de lévamisole Triton-X-100 mM) pendant une heure dans la chambre humide à la température de la pièce. Ensuite, les lames ont été incubées avec l’anti-DIG-AP (Roche) (dilution 1/1000) pendant 2 heures dans la chambre humide à la température de la pièce. Elles ont été lavées deux fois pendant 10 minutes dans le tampon de détection #1 et une fois dans le tampon de détection #2 (100 mM Tris-HCl pH 9,5, 100 mM NaCl, 10 mM MgCl2). Les lames ont été incubées avec la solution de substrat (pour
23
(produit acheté en liquide), 20 μl de lévamisole 100 mM) jusqu'à l’apparition de la réaction. Cette réaction a été arrêtée avec une solution d’arrêt contenant 0,2 M d’EDTA et 1 M Tris-HCl pH 7,5. La contre-coloration a été faite avec le rouge neutre dilué à 1%. Les lames ont ensuite été lavées dans l’eau puis rapidement déshydratées dans l’éthanol puis mises dans le xylène. Les lames ont été montées avec du Permount (Fisher) pour la conservation.
3. Immunohistochimie sur coupe en paraffine
3.1 Anticorps anti-Von Willebrand Factor (anti-VWF)
Le tissu de 5 μm d’épaisseur a été déparaffiné et réhydraté avant d’être traité contre les peroxydases endogènes (3% H2O2 dans du MeOH) pendant 30 minutes. Les lames ont
été lavées dans de l’éthanol 95% puis dans de l’eau distillée chacunes pendant cinq minutes. Ensuite, le démasquage de l’antigène (favorise l’antigénicité) a été fait dans le micro-ondes. Les lames ont été trempées dans du tampon citrate (0,1 M acide citrique et 0,1 M citrate de sodium). La solution contenant les lames et sortant du micro-ondes a été refroidie avant de laver les lames à l’eau distillée pendant cinq minutes, puis dans du PBS 1X pendant cinq minutes. Par la suite, les liaisons non spécifiques ont été bloquées avec du sérum de singe (10%) dans la solution de couplage (PBS 1X, 0,1% BSA fraction V, 0,4% triton X-100). Il faut bloquer les liaisons non spécifiques parce que c’est ce qui cause les bruits de fond. Le blocage a été fait pendant 10 minutes à la température de la pièce. L’anticorps VWF (Von Willebrand Factor antibody ab11713 (Abcam)) a été dilué dans la solution de couplage à 1:1000. L’incubation a été poursuivie à 4°C pendant la nuit. Le lendemain, les lames ont été lavées dans du PBS 1X trois fois pendant cinq minutes. L’anticorps secondaire (biotinylated anti-sheep IgG (H+L) affinity purified (Vector Laboratories)) a été dilué 1:200 dans la solution de couplage. L’incubation a été faite pendant une heure à la température de la pièce. Pendant ce temps, la solution ABC (Vectorstain Elite ABC Kit (Vector Laboratories)) a été préparée, car elle doit être agitée pendant 30 minutes avant son utilisation. On prépare cette solution en ajoutant une goutte de la solution A et une goutte de la solution B dans 2,5 ml de PBS 1X. Les solutions A et B proviennent de l’ensemble ABC Elite. Après l’incubation de l’anticorps secondaire, les
24
lames ont été lavées dans du PBS 1X trois fois pendant cinq minutes. Ensuite, les lames ont été incubées avec la solution ABC pendant 30 minutes à la température de la pièce puis lavées trois fois dans du PBS 1X pendant cinq minutes. La révélation AEC a été faite entre 30 et 45 minutes. Tout d’abord, la solution AEC a été préparée en mettant une pastille d’AEC (Sigma) dans 2,5 ml de diméthylformamide. La pastille a été dissoute. Ensuite, 500 µl de la solution AEC ont été ajoutés à 7 ml de tampon acétate, puis 7,5 µl de H2O2 (30%)
ont été ajoutés à la dernière minute, soit juste avant de faire la révélation AEC. Le tampon acétate est un mélange de 7,4 ml de solution A, 2,6 ml de solution B et de 40 ml d’eau. La solution A a été préparée en mettant 1,7 g d’acétate de sodium dans 50 ml d’eau et la solution B a été préparée en mettant 750 µl d’acide acétique glacial dans 50 ml d’eau. Les lames ont été lavées à l’eau distillée deux fois pendant cinq minutes puis elles ont été montées avec une solution contenant 15% glycérol et 0,1% d’azoture de sodium dans du PBS 1X.
3.2 Anticorps anti-CD-31
Le tissu de 5 μm d’épaisseur a été déparaffiné, réhydraté et lavé deux fois dans de l’eau distillée. Par la suite, le démasquage de l’antigène a été fait avec la protéinase K (10 mg/ml dans de l’eau distillée) (Roche) pendant 20 minutes puis les lames ont été lavées dans de l’eau distillée pendant cinq minutes. Le tissu a été traité contre les peroxydases endogènes (3% H2O2 dans H2O) pendant 30 minutes. Les lames ont été lavées dans de l’eau
distillée cinq minutes puis dans du PBS 1X–Tween 20 (0,1%) pendant cinq minutes. Les liaisons non spécifiques ont été bloquées avec du sérum de chèvre (25%) dans du PBS 1X– Tween 20 (0,1%) pendant 10 minutes. L’anticorps anti-CD-31 (Rat anti-mouse CD31 (PECAM-1) (BD Biosciences Pharmingen)) a été dilué 1:10 dans du PBS 1X–Tween 20 (0,1%). L’incubation a été faite à 4°C pendant la nuit. Les lames ont ensuite été lavées dans du PBS 1X–Tween 20 (0,1%) trois fois pendant cinq minutes. L’anticorps secondaire (goat anti-rat IgG-B (Santa Cruz Biotechnology)) a été dilué 1:1000 dans le PBS 1X–Tween 20 (0,1 %). L’incubation a été faite pendant une heure à la température de la pièce. La suite du protocole est identique à celui de l’anticorps anti-VWF. Par contre, plutôt que de laver les
25
lames dans du PBS 1X comme dans le protocole de l’anticorps anti-VWF, les lames ont été lavées dans du PBS 1X–Tween 20 (0,1%) pour le protocole de l’anticorps anti-CD31.
26
Chapitre III : Résultats
1. Localisation des ARN messagers de la 21-hydroxylase et de la
20α-hydroxystéroïde déshydrogénase par hybridation in situ sur des sections
de poumons de souris en développement
Les hybridations in situ faites sur des coupes de poumons de souris au jour de gestation 15,5 avec la sonde de la hydroxylase montrent que le gène de la 21-hydroxylase est exprimé au niveau des cellules épithéliales distales (figure 5A). Le mésenchyme, quant à lui, est négatif. Par la même technique avec la sonde de la 20α-HSD, nous observons un marquage dans le mésenchyme qui semble être associé aux capillaires (figure 5B). Les cellules épithéliales proximales sont négatives. Le contrôle négatif de la 21-hydroxylase (figure 5C) ainsi que celui de la 20α-HSD (figure 5D) ne possèdent pas de marquage significatif. Pour arriver à ces conclusions, deux fœtus de deux portées différentes ont été utilisés pour l’observation des hybridations in situ pour le gène de la 21-hydroxylase. De plus, un même individu a été utilisé pour deux hybridations in situ faites lors de protocoles différents. Ces deux résultats étaient identiques. Par ailleurs, tous les fœtus observés étaient des femelles. Ainsi, il n’est pas possible de confirmer s’il y a une différence sexuelle. Deux individus de la même portée et de sexe différent ont été utilisés pour l’observation des hybridations in situ pour le gène de la 20α-HSD. Puisque les résultats étaient identiques chez le mâle et la femelle, nous concluons qu’il n’y a pas de différence sexuelle quant à l’expression du gène de la 20α-HSD dans les structures du poumon au jour de gestation 15,5.
27
Figure 5 : Localisation des messagers de la 21-hydroxylase et de la 20α-HSD dans le poumon de souris au jour de gestation 15,5 par hybridation in situ. L’hybridation in situ (marquage bleu) de la
21-hydroxylase a été faite avec une sonde anti-sens (A) et une sonde sens (contrôle négatif) (C). L’hybridation in situ de la 20α-HSD a été faite avec une sonde anti-sens (B) et une sonde sens (contrôle négatif) (D). La barre d’échelle est de 50 µm (A-D). C, capillaires; D, épithélium distal; M, mésenchyme; P, épithélium proximal.
Au jour de gestation 17,5, la 21-hydroxylase est encore exprimée au niveau des cellules épithéliales distales (figure 6A). Nous pouvons même observer un marquage dans les cellules épithéliales distales sans lumière, donc en formation (figure 6C). Les cellules épithéliales proximales, quant à elles, sont parfois positives (figure 6B). L’hybridation in-situ avec la sonde de la 20α-HSD montre un marquage dans le mésenchyme qui semble être associé à un réseau de capillaires (figure 6G). C’est une continuité avec ce qui est observé au jour de gestion 15,5. Une immunohistochimie avec l’anticorps anti-CD31 montre les réseaux de capillaires (figure 6H). Ces derniers ont une disposition similaire à ce qui est observé avec l’hybridation in-situ avec la sonde de la HSD. La sonde sens de la 20α-HSD montre quelques signaux diffus qui ne semblent pas être spécifiques. Pour arriver à ces conclusions, deux fœtus de la même portée et de sexe différent ont été utilisés pour
28
l’observation des hybridations in situ pour le gène de la 21-hydroxylase. L’observation des hybridations in situ pour le gène de la 20α-HSD a été faite avec deux individus de la même portée et de sexe différent. De tous ces individus, un seul a été utilisé pour l’hybridation in situ pour le gène de la 21-hydroxylase et pour le gène de la 20α-HSD. Nous concluons qu’il n’y a pas de différence sexuelle autant pour le gène de la 21-hydroxylase que pour le gène de la 20α-HSD quant à leur expression dans les structures du poumon au jour de gestation 17,5.
29
Figure 6 : Localisation des messagers de la 21-hydroxylase et de la 20α-HSD dans le poumon de souris au jour de gestation 17,5 par hybridation in situ. L’hybridation in situ (marquage bleu) de la
21-hydroxylase a été faite avec une sonde anti-sens (A-C) et une sonde sens (contrôle négatif) (D-F). L’hybridation in situ de la 20α-HSD a été faite avec une sonde anti-sens (G) et une sonde sens (contrôle négatif) (I). Une immunohistochimie a été faite avec l’anticorps anti-CD31 (marquage rouge) (H).Les barres d’échelle sont de 25 µm (A,B,D,E,H) et de 50 µm (C,F,G,I). C, capillaires; D, épithélium distal; M, mésenchyme; P, épithélium proximal.