Validation de la contribution en alcalis des granulats à
la solution interstitielle du béton et effet possible sur la
réaction alcalis-silice
Mémoire
Cédric Drolet
Maîtrise interuniversitaire en sciences de la terre
Maître ès sciences (M. Sc.)
Québec, Canada
© Cédric Drolet, 2017
Validation de la contribution en alcalis des granulats à
la solution interstitielle du béton et effet possible sur la
réaction alcalis-granulats.
Mémoire
Cédric Drolet
Sous la direction de :
Josée Duchesne, directrice de recherche
Benoit Fournier, codirecteur de recherche
Résumé
La réaction alcalis-granulats touche beaucoup de structures très importantes au Québec et aussi à travers le monde. Pour que cette dernière se produise, trois conditions essentielles doivent être remplies : les granulats utilisés doivent contenir des phases réactives, la teneur en alcalis du béton doit être suffisamment élevée et l’humidité relative à laquelle le béton est exposé doit être de plus de 85%.
Il a été observé par le passé que lorsqu’un ciment à basse teneur en alcalis est utilisé en combinaison avec certains types de granulats réactifs, le développement de la réaction est grandement limité. Or, cette méthode préventive n’est pas efficace pour tous les types de granulats et une hypothèse expliquant ce phénomène stipule que les alcalis permettant à la réaction de subsister à travers le temps sont libérés dans la solution interstitielle par les granulats eux-mêmes. Beaucoup d’études ont été menées par le passé afin de tenter de confirmer ou d’infirmer cette affirmation. Les expériences, consistant à immerger des granulats dans des solutions d’attaque de composition se rapprochant de celle de la solution interstitielle du béton, ont montrées que les matériaux granulaires sont bien susceptibles de libérer des alcalis à travers le temps lorsqu’ils sont en présence d’un milieu fortement basique. Or, très peu d’expériences ont été menées afin de vérifier la véracité des résultats dans un béton réel.
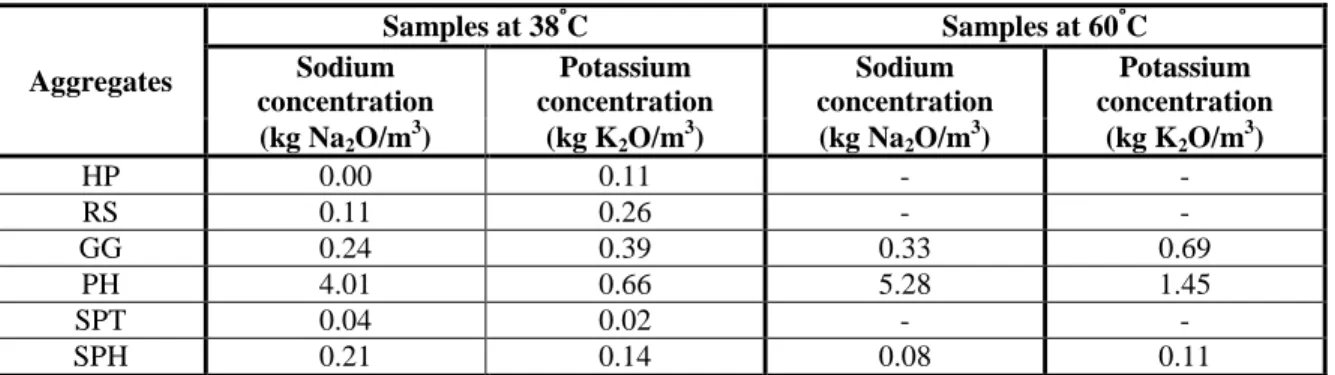
Ainsi, dans la présente étude, des échantillons de mortier et de béton ont été confectionnés en utilisant six différentes sources granulaires. Parmi celles-ci, quatre sont non réactives et possèdent des teneurs variées en alcalis. Ces dernières ont été utilisées de façon à déterminer la contribution réelle des granulats à la solution interstitielle du béton à travers le temps. Aussi, deux granulats réactifs, possédant des teneurs variées en alcalis, ont été utilisés de façon à déterminer l’influence d’un relâchement d’alcalis par les granulats sur l’évolution de l’alcalinité de la solution interstitielle à mesure que la réaction alcalis-granulats progresse. Afin de déterminer l’avancement de la réaction alcalis-alcalis-granulats dans le temps, l’expansion des échantillons confectionnés avec les granulats réactifs a été mesurée tout au long de l’expérimentation. Deux méthodes ont été utilisées en vue de déterminer le contenu en alcalis des échantillons à travers le temps, soit la méthode d’extraction sous haute pression et la méthode espresso. Afin de comparer les résultats avec les études antérieures, les granulats ont également été soumis à un essai d’immersion en solution alcaline. Au final, un granulat a été clairement identifié comme source potentielle de Na+ à la solution interstitielle. En effet, les résultats obtenus ont permis de constater qu’un granulat riche en alcalin peut libérer jusqu’à 1,75 kg Na2O/m3 de béton lorsqu’utilisé comme un sable et jusqu’à 0,24 kg Na2O/m3 de béton lorsqu’utilisé comme fraction grossière après un an à 38ᵒC, démontrant clairement que la fraction fine est beaucoup plus susceptible de libérer des alcalis. Par contre, aucune contribution claire en ion K+ n’a pu être observée. Aussi, bien qu’un faible relâchement de sodium a été observé dans les échantillons confectionnés avec l’un des granulats réactifs, aucun effet n’a été observé sur la progression de l’expansion engendré par le développement de la réaction alcalis-granulats sur les échantillons de béton et de mortier associés. Il a été possible d’évaluer la quantité de sodium incorporée dans les produits de réaction à près de 0,20 kg Na2O/m3 de mortier pour une expansion de 0,08%.
Abstract
Alkali-aggregate reaction affects many important concrete structures in Québec and also around the world. This reaction needs three essential conditions to occur: Aggregates used in the manufacture of concrete contains reactive phases, the alkali content of the concrete is high enough and the concrete is exposed to more than 85% relative humidity conditions. In the past, it was found that when low alkali cement was used in combination with some types of aggregates, the progression of the reaction is greatly restrained. However, the efficacy of this preventive method varies greatly from one aggregate to another. Thus, a hypothesis explaining this phenomenon states that alkalis allowing triggering the reaction can be leached into the pore solution of concrete from aggregates themselves. Many studies were conducted in the past in order to confirm or dismiss this hypothesis. Experiments, consisting in an immersion of aggregates in attack solutions of a chemical composition comparable to the pore solution of concrete, showed that aggregates can release alkalis through time in high pH environment. However, very few experiments were conducted in real concrete in order to verify the veracity of the results obtained.
Thus, in the present study, mortar and concrete samples were made using six different aggregate sources. Four of these aggregates are non-reactive and contain various amounts of alkalis. Those were used in order to determine the real alkali contribution by aggregates to the pore solution of concrete through time. Also, two reactive aggregates, containing various amounts of alkalis, were used to determine the influence of an alkali release by aggregates on the evolution of the alkalinity of the pore solution along with the development of the alkali-aggregate reaction. In order to determine the progression of the alkali-aggregate reaction through time, the expansion of specimens made with reactive aggregates was monitored. Two methods were used to determine the alkali content of mortar and concrete samples through time: the high pressure extraction and the espresso extraction method. To compare results with those of previous studies, aggregates were also submitted to an immersion in alkaline solutions.
One aggregate was clearly identified as a potential source of Na+ to the pore solution of concrete. Indeed, results obtained showed that rich alkali-bearing aggregate can release up to 1.75 kg Na2O/m3 of concrete if used as fine fraction and up to 0.24 kg Na2O/m3 of concrete if used as coarse fraction after one year at 38ᵒC. These results show that the fine fraction used in the concrete manufacturing is more susceptible to release alkali through time than the coarse one. However, no clear contribution in K+ ion was observed. Also, even if a small sodium release was observed in specimens made with one of the reactive aggregates, there is no evidence that this release affected the expansion caused by the progression of the alkali-aggregate reaction on associated concrete and mortar specimens. It was also possible to evaluate the amount of sodium trapped into reaction products to approximately 0.20 kg Na2O/m3 of mortar for a 0.08% expansion.
Table des matières
Résumé ... iii
Abstract ... iv
Liste des tableaux et figures ... vii
Remerciements ... x Avant-propos ... xii 1 Introduction ... 1 1.1 Contexte de l’étude ... 2 2 Revue de la littérature ... 4 2.1 Introduction ... 4 2.2 La réaction alcalis-granulats ... 4 2.2.1 Mécanismes ... 4
2.2.2 Réaction alcalis-silice (RAS)... 5
2.2.3 Réaction alcalis-carbonates (RAC) ... 6
2.3 Les alcalis dans le béton ... 7
2.3.1 Le ciment ... 7
2.3.2 Les ajouts cimentaires ... 8
2.3.3 Les sources externes ... 9
2.3.4 Les granulats ... 9
2.4 Essai de libération d’alcalis des granulats ... 11
2.4.1 Van Aardt et Visser (1977a, 1977b, 1978) ... 12
2.4.2 Stark et Bhatty (1986) ... 12 2.4.3 Kawamura et al. (1989) ... 13 2.4.4 French (1992) ... 14 2.4.5 St-John et Goguel (1992) ... 14 2.4.6 Bérubé et Duchesne (1996) ... 15 2.4.7 Le Roux et al. (1997) ... 17 2.4.8 Ouali (1997) ... 18 2.4.9 Lu et al. (2006) ... 20 2.4.10 Wang et al. (2008) ... 21 2.4.11 Locati et al. (2010) ... 22 2.4.12 Berra et al. (2014) ... 22 2.4.13 Soares et al. (2016) ... 23 2.4.14 Ajouts ... 24
2.5 Alcalinité de la solution interstitielle du béton ... 26
2.5.1 Extraction sous haute pression ... 26
2.5.2 Extraction à l’eau chaude ou « Hot water extraction »... 28
2.5.3 Méthode « Espresso » ... 30
2.5.4 Extraction à l’eau froide ou « ex situ leaching » ... 30
2.6 Alcalis lessivés ... 31
2.7 Conclusion ... 33
3 Problématique et objectifs ... 35
4 Cœur du mémoire – articles scientifiques ... 36
4.1 Article 1: Validation of the alkali contribution by aggregates to the concrete pore solution ... 36
5 Article 1: VALIDATION OF THE ALKALI CONTRIBUTION BY AGGREGATES
TO THE CONCRETE PORE SOLUTION ... 38
6 Article 2: EFFECT OF ALKALI RELEASE BY AGGREGATES ON ALKALI-SILICA REACTION ... 72
7 Conclusion ... 106
8 Bibliographie ... 109
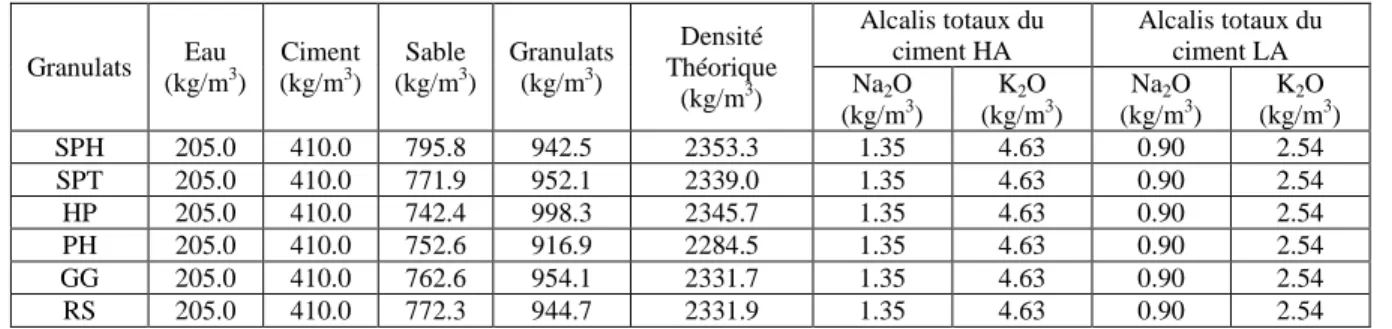
Annexe A – Formulation de mortier et de béton ... 116
Annexe B – Mortiers scellés : Résultats complets ... 117
Annexe C – Béton scellés: Résultats complets ... 121
Annexe D – Extraction d’alcalis par immersion des granulats dans des solutions alcalines : Résultats complets ... 127
Annexe E – Données complètes d’expansion mesurées ... 129
Annexe F – Mortiers en expansion : Résultats complets... 132
Annexe H – Bétons en expansion : Résultats complets ... 136
Liste des tableaux et figures
Tableau 1 - Principaux minéraux alcalins (données tirées de Roubault (1982)) ... 10
Tableau 2 - Description pétrographique des matériaux testés (Stark et Bhatty 1986) ... 13
Tableau 3 - Différents granulats utilisés pour les essais d’extraction et teneurs en alcalis obtenues (Bérubé et Duchesne 1996) ... 16
Tableau 4 - Résultats obtenus lors des expériences menées par Le Roux et al. (1997) et Ouali (1997) (tiré de Bérubé et Fournier (2004)) ... 18
Tableau 5 - Libération d'alcalis à 80ᵒC (tiré de Lu et al., 2006) ... 21
Tableau 6 - Résumé des procédures utilisées pour évaluer la contribution en alcalis des granulats et résultats obtenus ... 25
Tableau 7 - Formulation théorique et contenu en alcalis des échantillons de mortier ... 116
Tableau 8 - Formulation et contenu théorique en alcalis des échantillons de mortier ... 116
Tableau 9 - Mortier scellés à 28 jours: Extraction sous haute pression ... 117
Tableau 10 - Mortier scellés à 28 jours: Extraction Espresso ... 117
Tableau 11 - Mortier scellés à 91 jours: Extraction sous haute pression ... 118
Tableau 12 - Mortier scellés à 91 jours: Extraction Espresso ... 118
Tableau 13 - Mortier scellés à 168 jours: Extraction sous haute pression ... 119
Tableau 14 - Mortier scellés à 168 jours: Extraction Espresso ... 119
Tableau 15 - Mortier scellés à 365 jours: Extraction sous haute pression ... 120
Tableau 16 - Mortier scellés à 365 jours: Extraction Espresso ... 120
Tableau 17 – Béton scellés avec ciment à haute teneur en alcalis à 28 jours: Extraction sous haute pression ... 121
Tableau 18 - Béton scellés avec ciment à haute teneur en alcalis à 28 jours: Extraction Espresso ... 121
Tableau 19 – Béton scellés avec ciment à haute teneur en alcalis à 91 jours: Extraction sous haute pression ... 122
Tableau 20 - Béton scellés avec ciment à haute teneur en alcalis à 91 jours: Extraction Espresso ... 122
Tableau 21 – Béton scellés avec ciment à haute teneur en alcalis à 168 jours: Extraction sous haute pression ... 123
Tableau 22 – Béton scellés avec ciment à haute teneur en alcalis à 168 jours: Extraction Espresso ... 123
Tableau 23 – Béton scellés avec ciment à haute teneur en alcalis à 365 jours: Extraction sous haute pression ... 124
Tableau 24 – Béton scellés avec ciment à haute teneur en alcalis à 365 jours: Extraction Espresso ... 124
Tableau 25 - Béton scellés avec ciment à basse teneur en alcalis à 168 jours: Extraction sous haute pression ... 125
Tableau 26 - Béton scellés avec ciment à basse teneur en alcalis à 168 jours: Extraction Espresso ... 125
Tableau 27 – Béton scellés avec ciment à basse teneur en alcalis à 365 jours: Extraction sous haute pression ... 126
Tableau 28 - Béton scellés avec ciment à basse teneur en alcalis à 365 jours: Extraction Espresso ... 126
Tableau 31 - Extraction d'alcalis par immersion dans des solutions alcalines à 91 jours .. 127
Tableau 32 - Extraction d'alcalis par immersion dans des solutions alcalines à 182 jours 128 Tableau 33 - Extraction d'alcalis par immersion dans des solutions alcalines à 365 jours 128 Tableau 34 - Expansion des échantillons de mortier ... 129
Tableau 35 - Expansion des échantillons de béton avec ciment à haute teneur en alcalis . 130 Tableau 36 - Expansion des échantillons de béton avec ciment à basse teneur en alcalis . 131 Tableau 37 - Mortier en expansion à 28 jours: Alcalis lessivés ... 132
Tableau 38 - Mortier en expansion à 28 jours: Extraction sous haute pression ... 132
Tableau 39 - Mortier en expansion à 28 jours: Extraction Espresso ... 132
Tableau 40 - Mortier en expansion à 91 jours: Alcalis lessivés ... 133
Tableau 41 - Mortier en expansion à 91 jours: Extraction sous haute pression ... 133
Tableau 42 - Mortier en expansion à 91 jours: Extration Espresso ... 133
Tableau 43 - Mortier en expansion à 168 jours: Alcalis lessivés ... 134
Tableau 44 - Mortier en expansion à 168 jours: Extraction sous haute pression ... 134
Tableau 45 - Mortier en expansion à 168 jours: Extraction Espresso ... 134
Tableau 46 - Mortier en expansion à 365 jours: Alcalis lessivés ... 135
Tableau 47 - Mortier en expansion à 365 jours: Extraction sous haute pression ... 135
Tableau 48 - Mortier en expansion à 365 jours: Extraction espresso ... 135
Tableau 49 - Béton en expansion avec ciment à haute teneur en alcalis à 28 jours: Alcalis lessivés ... 136
Tableau 50 - Béton en expansion avec ciment à haute teneur en alcalis à 28 jours: Extraction sous haute pression ... 136
Tableau 51 - Béton en expansion avec ciment à haute teneur en alcalis à 28 jours: Extraction Espresso ... 136
Tableau 52 - Béton en expansion avec ciment à haute teneur en alcalis à 91 jours: Alcalis lessivés ... 137
Tableau 53 - Béton en expansion avec ciment à haute teneur en alcalis à 91 jours: Extraction sous haute pression ... 137
Tableau 54 - Béton en expansion avec ciment à haute teneur en alcalis à 91 jours: Extraction espresso ... 137
Tableau 55 - Béton en expansion avec ciment à haute teneur en alcalis à 168 jours: Alcalis lessivés ... 138
Tableau 56 - Béton en expansion avec ciment à haute teneur en alcalis à 168 jours: Extraction sous haute pression ... 138
Tableau 57 - Béton en expansion avec ciment à haute teneur en alcalis à 168 jours: Extraction espresso ... 138
Tableau 58 - Béton en expansion avec ciment à haute teneur en alcalis à 365 jours: Alcalis lessivés ... 139
Tableau 59 - Béton en expansion avec ciment à haute teneur en alcalis à 365 jours: Extraction sous haute pression ... 139
Tableau 60 - Béton en expansion avec ciment à haute teneur en alcalis à 365 jours: Extraction espresso ... 139
Tableau 61 - Béton en expansion avec ciment à basse teneur en alcalis à 168 jours: Alcalis lessivés ... 140
Tableau 62 - Béton en expansion avec ciment à basse teneur en alcalis à 168 jours: Extraction sous haute pression ... 140
Tableau 63 - Béton en expansion avec ciment à basse teneur en alcalis à 168 jours: Extraction espresso ... 140 Tableau 64 - Béton en expansions avec ciment à basse teneur en alcalis à 365 jours: Alcalis lessivés ... 141 Tableau 65 - Bétons en expansion avec ciment à basse teneur en alcalis à 365 jours: Extraction sous haute pression ... 141 Tableau 66 - Béton en expansion avec ciment à basse teneur en alcalis à 365 jours: Extraction espresso ... 141
Remerciements
En premier lieu, j’aimerais remercier sincèrement ma directrice prof. Josée Duchesne pour son appui, ses conseils et sa grande disponibilité tout au long de mon projet de recherche. J’aimerais par la même occasion remercier mon co-directeur prof. Benoit Fournier, également pour sa grande disponibilité, mais aussi pour son support et ses encouragements. J’ai eu la grande chance d’avoir des superviseurs à l’écoute et toujours présents pour répondre à mes nombreuses questions face à l’avancement du projet, et pour cela, je leur suis très reconnaissant.
J’aimerais également remercier les professionnels et le personnel technique de l’Université Laval, soit M. Mathieu Thomassin-Mailhot, M. Jean-Daniel Lemay, M. René Malo, M. Alain Melançon, M. Edmond Rousseau et M. Pierre-André Tremblay. J’aimerais aussi remercier plus particulièrement M. Martin Plante pour m’avoir beaucoup aidé dans la réalisation des nombreuses analyses chimiques que j’ai effectuées tout au long de mon projet.
Un merci particulier aussi aux chercheurs prof. Klaartje De Weerdt et M. Gilles Plusquellec de la Norwegian University of Science and Technology (NTNU) pour leurs conseils et soutien et aux professionnels du Ministère des transports, de la mobilité durable et de l’électrification des transports, soit M. Michel Paradis, M. Alain Hovington, Mme. Nadia Pouliot et leurs collègues, avec qui j’ai eu la chance d’effectuer un stage à l’été 2016. J’ai également eu la chance de rencontrer et de côtoyer les personnes exceptionnelles, étudiants et auxiliaires de recherche, qui constituent la « team béton » du département de Géologie et de Génie Géologique, soit mes amis et collègues Anthony Allard, Alexandre Rodrigue, Isabelle Fily-Paré, Andrea Rodriguez, Jean-Benoît Darveau, Frédéric Béland, Mathieu Champagne, Mélissa Roy-Tremblay, Alexis Gateau, Marc-André Gingras et Edgardo Alvarado. À tous, j’aimerais vous remercier pour votre participation, directe ou indirecte, à mon projet. Ce fut un réel plaisir de travailler avec vous.
Finalement, j’aimerais remercier les membres de ma famille, premièrement ma fiancée Jessica Allard pour son support, ses encouragements et son amour, et également mes
parents Gaston Drolet et Nadia Daigle, mon frère Yoan Drolet et mes deux sœurs Shana-Blanche Drolet et Maïka Drolet pour leur appui tout au long de mes études.
Avant-propos
Dans ce mémoire sont présentés les résultats d’une étude expérimentale effectuée par le présent auteur sur des échantillons de mortier et de béton confectionnés en laboratoire visant à déterminer la contribution potentielle en alcalis des granulats à la solution interstitielle du béton.
Le cœur du mémoire est constitué de deux différents articles scientifiques, rédigés en anglais, qui ont été élaborés de façon à couvrir adéquatement les deux principaux axes de la recherche. En collaboration avec ma directrice et mon co-directeur de recherche, j’ai participé à la définition des objectifs spécifiques et à l’élaboration du programme expérimental de l’étude. Ainsi, j’ai personnellement effectué ou supervisé les différents travaux de laboratoire et analyses chimiques menant à la réalisation de la présente étude, avec l’aide d’étudiants de premier cycle et des techniciens du Centre de recherche sur les infrastructures en béton (CRIB) et du département de Géologie et de Génie Géologique de l’Université Laval. J’ai également traité et analysé les résultats obtenus en vue d’écrire le premier brouillon des articles scientifiques (Section 5 et 6), desquels je suis l’auteur principal. Ces premiers brouillons ont par la suite été révisés par ma directrice et mon co-directeur de recherche, qui agissent tous deux à titre de co-auteurs, de façon à suggérer des recommandations ou améliorations nécessaires avant la soumission des articles aux revues scientifiques.
Le premier article (section 5) a été soumis à la revue Cement and Concrete Research le 21 février 2017. L’article a été révisé selon les commentaires reçus et publié le 18 avril 2017. Le second article (section 6) a été soumis à la revue Construction and Building Materials le 3 mars 2017. L’article a été révisé selon les commentaires reçus, avant de procéder à une nouvelle soumission le 5 juillet 2017. L’article est présentement toujours en évaluation.
1 Introduction
Lors de la construction d’ouvrages en béton d’envergure, le matériel granulaire utilisé provient généralement de sources situées à de faibles distances du chantier de construction, afin de minimiser les coûts le plus possible. Ceci est surtout vrai pour les barrages et les ouvrages routiers majeurs, car la quantité de matériel granulaire requise est très importante. Au Québec, beaucoup de granulats utilisés pour la fabrication de bétons sont extraits de carrières situées à proximité des grands centres urbains des Basses-Terres du St-Laurent. Parmi ceux-ci, on retrouve principalement des calcaires, des dolomies et des grès. Hydro-Québec a pour sa part construit de nombreux barrages dans le nord québécois en fabriquant les granulats à béton à partir des matériaux d’excavation comme des granites, gneiss granitiques, etc. Or, plusieurs travaux au cours des dernières années ont démontré que certains matériaux granulaires, lorsqu’utilisés dans le béton, engendrent une réaction nommée la réaction alcalis-granulats (RAG) (Bédard et Roux, 1986 ; Bérubé et al., 1993 ; Bérubé et al., 2000a), qui peut causer une détérioration prématurée des ouvrages atteints en réduisant certaines propriétés mécaniques du béton, notamment sa résistance en traction (Sanchez et al., 2017). Cette réaction touche un grand nombre de structures non seulement au Québec, mais aussi à travers le monde. Afin qu’un tel phénomène se produise, trois conditions essentielles doivent être remplies (Thomas et al., 2013) :
Les granulats utilisés doivent contenir des phases réactives;
La teneur en humidité du béton doit être suffisamment élevée (plus de 85% d’humidité relative);
Le béton doit contenir une quantité suffisante d’alcalis (permettant de conserver un pH élevé dans la solution interstitielle).
Le présent document porte sur ce dernier élément, en particulier sur la contribution potentielle en alcalis des granulats à la solution interstitielle du béton afin d’alimenter la RAG à plus ou moins long terme.
En tout premier lieu, le contexte de l’étude sera dressé, suivi d’une revue de la littérature, de la problématique et des objectifs. Le présent document sera par la suite divisé en deux axes principaux. Le premier axe traite de la contribution brute en alcalis par les granulats à
la solution interstitielle du béton, c’est-à-dire sans l’effet du développement de la RAG. Le second axe, lui, traite de l’influence du développement de la réaction sur le relâchement d’alcalis par les granulats et sur l’évolution de l’alcalinité de la solution interstitielle. Ces deux principaux axes feront donc l’objet des deux articles scientifiques et seront finalement liés lors d’une brève conclusion.
1.1 Contexte de l’étude
Comme il a été discuté plus haut, les granulats utilisés lors de la confection de grands ouvrages en béton, comme par exemple des barrages et d’importants ouvrages routiers, sont généralement extraits à proximité des chantiers auxquels ils sont destinés afin de minimiser les coûts. Si la source granulaire en question contient des horizons/bancs réactifs, les seuls moyens d’éviter que les structures de béton ne se détériorent prématurément à cause de la RAG sont de contrôler l’humidité, d’utiliser une quantité suffisante d’ajouts cimentaires efficaces ou encore de limiter la teneur en alcalis du béton (Thomas et al., 2013).
Sceller les éléments des structures permet de limiter les contacts avec l’humidité environnante, mais peut occasionner des coûts très élevés. Aussi, dans le cas de certaines structures d’envergure, comme par exemple les barrages, les techniques de scellement sont beaucoup plus difficiles, voire impossibles à mettre en œuvre. Dans le cas des ajouts cimentaires, ces derniers ne sont utilisés dans la confection du béton que depuis quelques décennies et ne sont toujours pas utilisés lors de la confection de tous les ouvrages de béton. Par exemple, Hydro Québec n’en utilise pas dans ses bétons, alors que c’est maintenant pratique courante au ministère des transports, de la mobilité durable et de l’électrification des transports. Par le passé, le contrôle des alcalis était donc le principal moyen utilisé afin d’éviter que la RAG ne se développe (Stanton, 1940). De nos jours, il est d’ailleurs toujours recommandé dans la norme canadienne CSA A23 de limiter la quantité d’alcalis par mètres cubes de béton lors de la construction de structures massives (CSA A23.1/A23.2-14, 2014).
Il a été observé sur le terrain que le développement de la RAG sur certaines structures atteintes ralentissait au fil des années. Ce phénomène peut, entre autres, être expliqué par une diminution de l’alcalinité de la solution interstitielle du béton alors que les cations alcalins sont consommés par la réaction. Or, dans certaines structures présentes au Québec
et aux États-Unis, notamment des barrages, la réaction est toujours aussi importante après de nombreuses années d’existence (Charlwood et al., 2014). Les principales hypothèses expliquant ce phénomène sont, d’une part, le recyclage progressif des alcalis du gel de silice à la solution interstitielle du béton lorsque celui-ci entre en contact avec les hydrates de la pâte de ciment, et, d’autre part, une contribution alcaline provenant des granulats. Cette deuxième hypothèse est appuyée par une observation intéressante. En effet, lors de ses recherches sur l’influence des alcalis sur la RAG, Stanton (1940) a observé que lorsqu’un ciment d’une teneur de moins de 0,6% en Na2Oeq est utilisé en combinaison avec des granulats réactifs, le béton ne subit pas de détérioration visible. Or, une fissuration importante, attribuée à la RAG, a été observée sur plusieurs ouvrages ayant été construits en suivant cette recommandation, après quelques années de service seulement (Stark, 1980). Bien qu’il soit maintenant connu que la teneur en alcalis limite au-dessus de laquelle la RAG se développe varie d’un granulat à un autre (Macdonald et al., 2012), un potentiel apport en alcalis à la solution interstitielle du béton au fil du temps pourrait également expliquer ce phénomène. Dans cet ordre d’idée, l’hypothèse la plus probable est que l’apport en alcalis à la solution interstitielle du béton provient des granulats.
2 Revue de la littérature
2.1 Introduction
La section 2 couvre les différents travaux ayant été réalisés afin de déterminer la contribution potentielle en alcalis provenant des granulats à la solution interstitielle du béton afin d’alimenter la réaction alcalis-granulats (RAG). En tout premier lieu, une revue de la RAG et de ses différentes formes d’occurrence sera effectuée, en insistant sur le rôle occupé par les alcalis dans ces réactions. Par la suite, les différentes sources des alcalis dans le béton seront passées en revue. Une attention particulière sera portée sur les granulats par une révision des différentes expériences ayant été effectuées afin de déterminer leur potentiel de relâchement d’alcalis dans la solution interstitielle du béton. Aussi, une caractérisation de la chimie de cette dernière sera effectuée, tout en révisant les différents essais utilisés pour y arriver. Finalement, comme certains échantillons sont conservés dans des conditions d’humidité élevée afin de favoriser le développement de la RAG, le lessivage d’alcalis dans l’humidité environnante sera également abordé.
2.2 La réaction alcalis-granulats
2.2.1 Mécanismes
La réaction alcalis-granulats consiste en une réaction chimique où les hydroxydes alcalins réagissent avec certaines phases présentes au sein des granulats fins et/ou grossiers (Diamond, 1975). Cette réaction cause une dégradation prématurée des ouvrages de béton, engendrée par l’expansion du matériel lui-même, qui mène au développement d’un réseau de fissuration important. Afin qu’un tel phénomène se produise, trois conditions essentielles doivent être remplies : les granulats utilisés dans la confection du béton doivent contenir des phases réactives, le béton doit contenir une quantité suffisante d’alcalis et la teneur en humidité du béton doit être suffisamment élevée (plus de 85% d’humidité relative) (Thomas et al., 2013). Les premiers signes de la réaction ont été découverts en Californie dans les années 1930 (Stanton, 1940). Depuis, bon nombre de structures affectées par la réaction ont été répertoriées au Canada ainsi que dans de nombreux autres pays. La RAG se divise en deux formes bien distinctes : la réaction alcalis-silice et la réaction alcalis-carbonates.
2.2.2 Réaction alcalis-silice (RAS)
Cette réaction se produit en tout premier lieu car le pH de la solution interstitielle du béton est très élevé (> 12,4), rendant certains minéraux des granulats instables, particulièrement ceux contenant de la silice de faible cristallinité. Cette silice entre en réaction avec les hydroxydes (OH-) associés aux alcalis (Na+, K+) de la solution interstitielle du béton (Thomas et al., 2013). Plus précisément, au départ, les anions OH- à l’origine du pH très élevé du béton sont libérés dans la solution interstitielle par la portlandite (Ca(OH)2) afin d’atteindre l’équilibre des charges avec les cations alcalins. La silice « réactive » (e.g. de faible cristallinité, micro- à cryptocristalline, tectoniquement déformée) réagit ensuite avec les hydroxydes présents dans la solution interstitielle, entraînant ainsi sa dissolution. Il se produit alors une réaction acido-basique entre les alcalis et la silice maintenant en solution qui résulte en la formation d’un gel expansif silico-calco-alcalin (Thomas, 2011). Ce gel, communément appelé gel de silice, va s’imbiber de l’eau contenue dans le béton, augmentant considérablement de volume et engendrant des contraintes internes qui vont éventuellement mener au gonflement et à la fissuration du béton.
Il est important de noter que la solubilité de la silice augmente avec le pH de la solution à laquelle elle est exposée (Iler, 1979). Plus précisément, la silice en surface des granulats est attaquée par les ions hydroxyles, ce qui produit des groupes (Si-O)-, dont la charge est contrebalancée par les ions alcalins. Dans des conditions où le pH atteint des valeurs de 13,5, la silice est libérée sous forme de H2SiO42- (Glasser et Kataoka, 1981). Finalement, si du calcium est ajouté dans le système (élément naturellement présent dans la solution interstitielle du béton) et que les conditions d’humidité sont favorables, un gel expansif de calcium et silice hydraté sera précipité (Glasser et Kataoka, 1982).
La réaction alcalis-silice est la forme la plus répandue de la RAG. Les formes de silice réactives se divisent en deux grandes catégories. La première contient les minéraux siliceux faiblement cristallins ou métastables et des verres volcaniques ou artificiels. La deuxième, quant à elle, contient les différentes variétés de quartz causant la réaction, c’est-à-dire la calcédoine, le quartz cryptocristallin à microcristallin, le quartz faiblement cristallisé aux
14). Les granulats contenant de telles phases minérales peuvent entraîner une détérioration du béton, même lorsque la concentration est très faible (1% en masse pour la première catégorie et 5% pour la deuxième). De façon générale, la fissuration des bétons présentant ces conditions peut apparaître aussi peu que 5 ans mais parfois plus de 20 ans suivant la construction de l’ouvrage (Annexe B, CSA A23.1-14).
2.2.3 Réaction alcalis-carbonates (RAC)
Cette variété de la RAG a été découverte par Swenson (1957) dans les années 1950 au Canada. L’expansion causée par la RAC est beaucoup plus rapide que celle de la RAS et la plupart des moyens de prévenir cette dernière s’avèrent non efficaces sur la réaction alcalis-carbonate (Jensen, 2012).
Les mécanismes de cette réaction ne sont pas encore totalement compris, mais nécessitent tout de même les trois conditions essentielles associées à la RAG, soit les granulats réactifs, une haute teneur en humidité et la présence d’alcalis. Les premières explications du phénomène ont été proposées dans les années 1960 par Gillott (1964), selon lequel l’expansion serait causée par deux réactions distinctes. La première de ces réactions est la dédolomitisation des granulats, qui en elle-même ne cause pas d’expansion, mais crée une porosité garantissant l’accès à l’humidité et favorisant la deuxième réaction, soit l’expansion de minéraux argileux. Ces derniers, lorsqu’ils entrent en contact avec l’humidité, absorbent l’eau environnante et augmentent en volume, menant ainsi à la fissuration du béton.
Par contre, d’autres théories ont également vu le jour afin d’expliquer la RAC. Suite à l’analyse de plusieurs éléments de structures affectées par cette réaction, Katayama (2010) a trouvé des traces de RAS, dont notamment la présence de gel de silice, et a conclu que l’expansion du béton était principalement due à cette réaction. Selon cet auteur, la réaction de dédolomitisation observée auparavant exposerait le quartz microcristallin des granulats à la solution interstitielle du béton et ainsi la RAS serait à l’origine de l’expansion du béton. Ceci expliquerait également le fait que la réaction est plus rapide que dans le cas où des granulats qui possèdent une structure microcristalline plus dense sont utilisés. Plusieurs études sont encore aujourd’hui en cours afin de mieux comprendre les mécanismes de cette réaction délétère.
Il est important de noter que, lors de la réaction de dédolomitisation des granulats, il se produit un recyclage des alcalis à la solution interstitielle du béton. Tout comme dans la RAS, il y aura libération d’ions OH- par la portlandite afin d’équilibrer les charges dans la solution, entraînant par la même occasion une augmentation du pH (Thomas et al., 2013).
2.3 Les alcalis dans le béton
Comme il a été discuté ci-haut, l’un des principaux éléments nécessaire à la réaction alcalis-granulats est la présence d’alcalis dans la solution interstitielle du béton. Ces derniers peuvent provenir de différentes sources. La plus connue d’entre elles est le ciment portland, qui a longtemps été considéré comme la seule source de ces ions dans la solution interstitielle du béton. Par contre, des observations sur le terrain effectuées au fil des années ont révélé que les alcalis peuvent également provenir d’autres matériaux utilisés lors de la confection du béton. En effet, ces ions peuvent également provenir des ajouts cimentaires, de l’eau de gâchage, de sources externes ou encore des granulats à béton (Broekmans, 2012).
2.3.1 Le ciment
La source la plus importante d’alcalis à la solution interstitielle est le ciment portland lui-même. En effet, le ciment contient des teneurs en alcalis dont l’ampleur peut varier en fonction de la composition des matériaux bruts utilisés à sa confection, c’est-à-dire argiles, schistes argileux, calcaires, etc. Ces matériaux contiennent tous, en différentes proportions, des alcalis (K et Na). Lors du chauffage du cru pour former le clinker, les alcalis se lient en premier lieu à des sulfures. Ceux-ci proviennent de certains minéraux indésirables constituant les shales et les argiles, soit la pyrite, les sulfates ou encore des composés organiques. Si la quantité de sulfate présente dans le cru n’est pas suffisante pour lier tous les alcalis, ces derniers sont incorporés dans la composition du C3A, du C2S et, dans une moindre mesure, dans le C3S et le C4AF (Jawed et Skalny, 1977). Par contre, tous les alcalis du ciment ne sont pas solubles dès leur premier contact avec l’eau de gâchage. En effet, McCoy et Eshenour (1968) ont montré que seulement 10 à 60% du contenu total en sodium et en potassium du ciment passe en solution suite au contact avec l’eau. En effet, les alcalis liés au sulfates sont considérés comme étant totalement solubles, alors que ceux liés
du moins jusqu’à l’hydratation de ces phases (Diamond, 1975). Il est également connu que les alcalis peuvent être liés lors de l’hydratation des grains de ciment. En effet, un faible ratio Ca/Si et un fort contenu en aluminium des C-S-H favorisent l’incorporation d’alcalis dans les gels d’hydratation (Hooton et al., 2010).
2.3.2 Les ajouts cimentaires
Les ajouts cimentaires peuvent également contenir une quantité non négligeable d’alcalis, en particulier en ce qui a trait à la cendre volante. Dans le cas de certains ajouts cimentaires, la teneur en alcalis est même significativement plus importante que celle du ciment portland. Par exemple, plus d’une centaine de sources différentes de cendres volantes produites en Amérique du Nord ont fait l’objet d’analyses chimiques (Shehata et Thomas, 2006); il en résulte que la teneur en alcalis-équivalents (Na2Oeq) de ces matériaux varie de moins de 1,0% jusqu’à près de 10%, pour une valeur moyenne de 2,44%.
Il est important de noter que plusieurs ajouts cimentaires, comme par exemple la fumée de silice, les laitiers de haut fourneau ou encore les cendres volantes, sont utilisés dans les bétons afin de réduire les effets de la RAS. En effet, il a été démontré que ces matériaux mènent généralement à une réduction de la concentration en hydroxydes alcalins de la solution interstitielle du béton, ce qui permet au final de réduire considérablement, et ce à un niveau acceptable, l’expansion subie par le béton lorsque des quantités suffisantes de ces matériaux sont utilisées (Duchesne et Bérubé, 1994). Ce phénomène peut être expliqué par la composition chimique de ces ajouts cimentaires. En effet, les plus efficaces d’entre eux contiennent beaucoup de silice et peu d’alcalis. Les ajouts cimentaires contenant beaucoup d’alcalis sont en général moins efficaces pour enrayer la RAS. Une relation empirique a été établie suite à différentes études (Thomas, 2011) montrant que l’efficacité d’une cendre volante à contrecarrer la RAS est fonction du produit de la teneur en alcalis-équivalents et en calcium divisé par la teneur en silice au carré (Na2Oeq × CaO)/(SiO2)2. Dans la pratique normalisée CSA A23.2-27A, des « classes d’efficacité » des cendres volantes sont établies pour les cendres contenant de 0 à 3% Na2Oeq, 3 à 4,5% Na2Oeq, et >4,5% Na2Oeq. Le même document indique également que la teneur en fumée de silice permettant de contrecarrer la RAS devra être modulée en fonction de la teneur en alcalis du béton (calculée en kg/m3) (CSA A23.2-2014). Ainsi, bien que les ajouts cimentaires contiennent des alcalis, certains d’entre eux permettent tout de même de diminuer l’alcalinité de la solution interstitielle du
béton par leur grande capacité à incorporer des alcalis dans la structure des CSH pouzzolaniques (Thomas, 2011).
2.3.3 Les sources externes
Les sources externes, telles que l’eau de mer ou les sels déglaçants, peuvent également influencer l’alcalinité de la solution interstitielle du béton. Certains travaux ont montrés que le NaCl contribue à accélérer l’expansion de bétons confectionnés avec des granulats réactifs (Davies et Oberholster, 1989). Le pH de l’eau de mer, qui varie entre 7,5 et 8,4, est bien en deçà du pH de la solution interstitielle du béton. Bien que les sels ne semblent pas beaucoup contribuer à faire augmenter le pH de l’eau de mer, l’alcalinité de la solution interstitielle pourrait augmenter si les ions Cl- sont liés dans le béton (e.g. formation de chloroaluminates). Il y aura ainsi libération d’hydroxydes par la portlandite afin de balancer les charges des nouveaux cations en solution. Par contre, d’autres études ont montrées que l’immersion de mortiers dans de l’eau de mer fait chuter drastiquement la concentration en OH- de la solution interstitielle. Cette chute est causée par une dilution de la solution interstitielle par l’eau de mer et par une migration des ions par diffusion (Kawamura et Takeuchi, 1996). Ainsi, l’influence des sources externes est mitigée et fait toujours l’objet d’études de nos jours.
2.3.4 Les granulats
Une autre source potentielle d’alcalis à la solution interstitielle du béton réside dans les granulats eux-mêmes. On retrouve en effet des alcalis dans la composition chimique de plusieurs classes minérales, les plus importantes étant les feldspaths alcalins, feldspaths calcosodiques, feldspathoïdes, micas, pyroxènes alcalins, amphiboles monocliniques et certains minéraux accessoires (Roubault, 1982). Les principaux minéraux de ces classes sont énumérés dans le Tableau 1. Ceux-ci peuvent se retrouver dans bon nombre de gros granulats dérivés de roches de différentes origines et de types variés, de même que dans différents sables pouvant être utilisés à la confection du béton.
Tableau 1 - Principaux minéraux alcalins (données tirées de Roubault (1982))
Classe minérale Minéral Formule chimique
Néphéline Na3KAl4Si4O16
Zéolite Na2[Si3AlO10]
Microcline Orthose Sanidine Anorthose Albite Oligoclase Andésine Labrador Bytownite Anorthite
Leucite [Si2AlO6] K
Néphéline [SiAlO4]4 Na3K
Haüyne [(SiAlO4)6 | (SO4)2-1] (Na, Ca)5-4 Sodalite [(SiAlO4)6 | Cl2] Na8
Noséane [(SiAlO4)6 | SO4] Na8
Lazurite [(SiAlO4)6 | (SO4, S, Cl2)] (Na2, Ca)4 Cancrinite [(SiAlO4)3 | CO3] Na3Ca
Davyne [(SiAlO4)3 | SO4] (Na, K)3 Ca Wischnewite [(SiAlO4)3 | SO4] Na3K2 Microsommite [(SiAlO4)3 | (Cl, OH)2] Na3Ca
Kaliophilite [SiAlO4] K
Phlogopite [(Si3AlO10) | (OH, F)2] KMg3 Biotite [(Si3AlO10) | (OH, F)2] K (Mg, Fe)3 Lépidomélane [(Si3AlO10) | (OH, F)2] K (Fe, Mg)3
Annite [(Si3AlO10) | (OH, F)2] KFe3 Muscovite [(Si3AlO10) | (OH, F)2] KAl3
Phengite [(Si7AlO20) | (OH, F)4] K2 (Mg, Fe) Al3 Paragonite [(Si3AlO10) | (OH, F)2] NaAl2
Lépidolite [(Si3AlO10) | F2] KLi1,5Al1,5 (approx.) Zinnwaldite [(Si3AlO10) | (OH, F)2] KLiFeAl
Aegyrine [SiO3]2 NaFe3+
Jadéite [SiO3]2 NaAl
Richtérite Na2Ca (Mg, Fe, Mn)5 [Si8O22(OH)2] Série du Glaucophane Na2 (Mg, Fe2+)3 (Al, Fe3+)2 [Si8O22(OH)2] Série de l'Arfvedsonite Na3 (Fe
2+
, Mg)4 (Fe 3+
, Al)[Si8O22(OH)2] Série de la Katophorite Na2Ca (Mg, Fe2+)4 Fe3+ [AlSi7O22(OH)2]
Tourmaline ferrifères [(Si6O18) | (BO3)3 | (OH, F)4] NaAl6(Fe, Mn)3 Tourmalines magnésiennes [(Si6O18) | (BO3)3 | (OH, F)4] NaAl6Mg3
Tourmalines lithinifères [(Si6O18) | (BO3)3 | (OH, F)4] NaAl6(Li, Al)3 Silicates
Feldspath alcalins [SiAlO8] (K, Na)
Feldspath calcosodiques (plagioclases) [SiAlO8] (Na, Ca)
Feldspathoïdes Minéraux accessoires Micas ferromagnésiens Micas alumineux Micas Lithinifères Pyroxènes alcalins Amphiboles sodiques
Dans des conditions extrêmes, comme par exemple dans le béton où la solution interstitielle possède un pH aux environs de 13,2 à 13,9, les alcalis contenus dans les minéraux de faible cristallinité peuvent être libérés par les granulats afin d’équilibrer les charges dans la solution interstitielle et ainsi potentiellement alimenter la RAG (Van Aardt et Visser, 1977a). En effet, les liens formés par les cations alcalins sont assez faibles étant donné leur nature monovalente, ce qui fait en sorte que ces ions sont plus favorablement libérés des structures cristallines que d’autres (Broekmans, 2012).
2.4 Essai de libération d’alcalis des granulats
Le premier essai d’évaluation de la libération d’alcalis par les granulats utilisés à la confection du béton a été effectué par Hansen (1959). Dans ses recherches, l’auteur a confectionné des barres de mortier à l’aide de sables normalement utilisés comme fraction fine dans les bétons. Parmi les matériaux utilisés, on retrouve un sable provenant de la rivière Kaw au Kansas (3,24% Na2Oeq), un autre provenant de Old Lytle Creek en Californie (5.19% Na2Oeq), un ciment à haute teneur en alcalis (0,91% Na2Oeq) et un deuxième à basse teneur (0,20% Na2Oeq). L’expérimentation consistait à immerger les barres de mortier, 24 heure après leur confection, dans 200 ml d’eau distillée, le tout reposant dans un gobelet de 400 ml scellé et laissé à température pièce. Ensuite, la teneur en Na2O et K2O de l’eau était analysée périodiquement par absorption atomique à flamme. Pour le mortier fabriqué avec le sable du Kansas, le relâchement en alcalis (Na2Oeq) dans l’eau après un an pour les échantillons fabriqués avec les ciments à haute et à basse teneur en alcalis sont de 0,815% et 0,18% respectivement. Vis-à-vis du ciment, ces valeurs représentent respectivement 89% et 90% de la teneur initiale en alcalis. Il n’est donc pas possible d’affirmer que ce sable peut relâcher des alcalis dans la solution interstitielle du béton. Par contre, dans le cas du sable de Californie, le lessivage d’alcalis dans l’eau distillée après un an pour les mortiers fabriqués avec les ciments à haute et à basse teneur sont respectivement de 0,911% et 0,262%, soit 100,11% et 131% de la teneur en alcalis équivalents initiale des deux ciments. La principale hypothèse expliquant la provenance du surplus d’alcalis est une contribution du sable.
Depuis les premiers résultats de Hansen sur le sujet, bon nombre d’autres recherches ont été réalisées afin de caractériser le relâchement d’alcalis par les granulats dans la solution interstitielle du béton. Ceux-ci consistent en l’immersion de granulats dans une solution se rapprochant des conditions internes du béton afin de mesurer la quantité d’alcalis lessivés des granulats dans le temps. Ces expériences sont énumérées ici-bas. Afin de faciliter la comparaison entre les différentes études, tous les résultats obtenus dans les essais seront présentés ici sous la forme de pourcentages massiques, puis convertis en kg de Na2Oeq par mètre cube de béton, en supposant une quantité de matériaux granulaires équivalent à 1850 kg par mètre cube.
2.4.1 Van Aardt et Visser (1977a, 1977b, 1978)
Ces auteurs ont étudié le comportement six feldspaths et deux minéraux argileux, lorsque trempés dans des solutions d’hydroxyde de calcium. La procédure utilisée lors de leurs expérimentations consiste en l’immersion d’une poudre de 0,5 g du minéral à l’essai dans un contenant de polyéthylène avec 25 ml d’eau et 0,5 g de Ca(OH)2 (i.e. saturée avec de l’hydroxyde de calcium en excès). Les contenants sont par la suite scellés et entreposés à une température de 39°C durant une période de 250 jours. Au final, les auteurs ont observés que les roches feldspathiques sont enclines à libérer des alcalis dans la solution de chaux, appuyant ainsi l’hypothèse selon laquelle ces minéraux peuvent potentiellement augmenter la concentration de ces cations dans la solution interstitielle du béton. Les valeurs obtenues lors de cette expérience varient entre 0,02% et 2,38% Na2Oeq, soit entre 0,37 et 44,03 kg Na2Oeq/m3 de béton. Les valeurs maximales atteintes lors de cette expérience semblent anormalement élevées, ce qui peut être expliqué par la faible granulométrie (poudre) utilisées lors de l’expérience.
2.4.2 Stark et Bhatty (1986)
Ces auteurs ont réalisé des essais de lessivage d’alcalis dans une solution de Ca(OH)2. Leur travail inclue 10 différents matériaux granulaires. La liste complète de ces matériaux se trouve dans Tableau 2. Les auteurs ont réalisé une série de tests dans des conditions différentes. En tout premier lieu, 5 g de matériaux granulaires, ayant préalablement été broyés jusqu’à ce que la totalité du matériel traverse les mailles du tamis numéro 200 (74 µm), sont placés dans des bouteilles de polypropylène contenant 25 ml de solution saturée en hydroxyde de calcium qui sont par la suite scellées.
Tableau 2 - Description pétrographique des matériaux testés (Stark et Bhatty 1986)
Échantillon Description pétrographique
AB Albite. Maclé. Légère altération de minéraux secondaires. Non-réactif.
LB Labradorite. Jumelage grossier. Altération mineure de minéraux secondaires. Non-réactif. MC Microcline. Jumelage bien défini et intercroissances perthitiques. Traces d’altérations de
minéraux secondaires. Non-Réactif.
EA Andésite porphyrique. Cryptocristalline avec altération partielle. Réactif
SS 50% quartz, 20% cryptocristalline andésite rhyolite, 10-15% feldspath, 10-15% de matériaux granitiques, 5% quartzite, traces de calcite, grès et chert. Réactif
SG 45-50% andésite rhyolite, 30% quartzite, 15% matériaux granitiques, 5% quartz, traces de calcédoine, grès et chert. Réactif
AS 45-50% quartz, 20-25% andésite rhyolite, 10% feldspath, 5-10% matériaux granitiques, 5-10% quartzite, traces de chert et grès. Réactif
BG 90% andésite cristalline, 5-8% verre volcanique, 2% diorite, trace de chert. Réactif CG 45-50% feldspath, 40-50% quartz, 2-3% andésite rhyolite, 2-3% matériaux granitiques, traces
de grès et chert. Réactif.
ES 75% quartz et quartzite, 15% feldspath, 3-4% matériaux granitiques, 3-4% chert, 3-4% gneiss, traces de matériaux volcaniques. Non-réactif
Une première série d’essai se déroule à 38°C durant des périodes de 7, 28 et 90 jours. Les échantillons de cette série sont continuellement agités afin d’éviter la précipitation de matériaux secondaires. Une deuxième série est scellée pour 28 jours dans des contenants en acier inoxydable, immergés dans l’eau à une température constante de 80°C. Une série parallèle utilisant de l’eau distillée en remplacement de la solution d’hydroxyde de calcium est également scellée aux mêmes conditions. Ces deux dernières séries ne sont pas agitées. Aux échéances préétablies, les solutions sont filtrées avant d’être analysées par absorption atomique pour déterminer leur contenu en sodium et potassium. Après 90 jours pour les essais à 38°C, les valeurs d’extraction d’alcalis varient entre 0,26% et 1,99% Na2Oeq, soit 4,81 et 36,82 kg Na2Oeq/m3 de béton. Pour les essais à 80ᵒC, les valeurs varient entre 0,82% et 5,03% Na2Oeq (15,17 et 93,01 kg Na2Oeq/m3 de béton) dans la solution saturée en chaux et entre 0,03% et 0,13% Na2Oeq (0,56 et 2,41 kg Na2Oeq/m3 de béton) pour le trempage dans l’eau distillée. Encore une fois, ces résultats semblent anormalement élevés et la granulométrie peut ici aussi en être la cause.
2.4.3 Kawamura et al. (1989)
utilisée dans les bétons ou les mortiers, soit une granulométrie variant entre 0,15 et 5 mm. Afin de réaliser cette expérience, les auteurs ont immergé 100 g de matériel granulaire dans 200 ml de solution saturée en chaux à 40°C, et ce pour une période de 180 jours. Au final, il a été possible d’extraire des deux différents granulats 0,02 et 0,07% Na2Oeq respectivement, soit 0,37 et 1,30 kg Na2Oeq/m3 de béton.
2.4.4 French (1992)
Les différents matériaux étudiés par cet auteur sont un sable naturel, un gabbro altéré et une andésite. Le protocole expérimental employé consiste à immerger 5 g de matériel d’une granulométrie variant entre 0,05 et 0,15 mm, et ce dans deux solutions de 100 ml différentes, conservées à 23°C. La première solution est constituée d’eau distillée et la seconde contient 10% volumique de HNO3. Le tout est par la suite agité durant 3 jours. Les résultats obtenus varient de 0,008 à 0,021% Na2Oeq dans l’eau (pour une contribution potentielle au béton de 0,14 à 0,39 kg Na2Oeq/m3) et de 0,027 à 0,066% Na2Oeq dans la solution de HNO3 (pour une contribution potentielle au béton de 0,49 à 1,19 kg Na2Oeq/m3). Il est par contre important de noter que ces résultats, qui sont obtenus à partir d’une solution d’attaque très acide, ne sont pas représentatifs des conditions internes du béton, qui sont très basiques et alcalines. Les réactions s’y produisant ne sont donc forcément pas les mêmes.
2.4.5 St-John et Goguel (1992)
Ces auteurs ont travaillé sur un moyen de diagnostiquer la RAG sur les bétons existants. Pour ce faire, une méthode de dissolution du béton à l’aide de solutions de HNO3 et d’EDTA (acide éthylène diamine tétraacétique) est utilisée. Au début des années 90, ils ont également soumis un basalte à cette technique afin de mesurer le lessivage d’alcalis et d’autres éléments. Ainsi, l’expérience consiste en l’immersion de 0,25 g de poudre (<0,6 mm) de basalte, obtenue par concassage, dans 35 ml d’une solution de 0,2M NH4EDTA et de 1M HNO3 pour une période d’une heure. Les résultats d’alcalis lessivés sont de 0,015 et 2,482% Na2Oeq pour les solutions d’EDTA et HNO3 respectivement (pour une contribution potentielle au béton de 0,28 et 45,9 kg de Na2Oeq/m3 de béton). Tout comme pour l’expérience de French discutée ci-haut, il est important de noter que les solutions de lessivage utilisées ne sont pas représentatives des conditions internes du béton.
2.4.6 Bérubé et Duchesne (1996)
Lors de leurs travaux, les auteurs ont réalisé des essais d’extraction d’alcalis sur 17 différents granulats provenant du Québec et de l’Ontario en utilisant quatre solutions d’extraction différentes, soit de l’eau distillée, une solution de chaux saturée avec 1 g de chaux solide en excès, une solution contenant 0,7M NaOH (pour la libération du potassium) et une solution contenant 0,7M KOH (pour la libération du sodium). La procédure expérimentale prévoit l’immersion de 40 g de matériel possédant une granulométrie de 1,25 à 5 mm dans 40 ml de solution à l’intérieur d’un contenant de 60 ml. Par la suite, les contenants sont scellés, maintenus à 38°C et agités continuellement pendant 578 jours. Après 7, 28, 112, 335 et 578 jours, l’agitation est interrompue pendant une période de 24 heures afin de permettre aux particules en suspension de se déposer avant de prélever 10 ml de solution pour analyse chimique du sodium et du potassium par absorption atomique. Le volume de solution prélevé est par la suite remplacé par le même volume de solution initiale et l’échantillon est retourné aux conditions d’expérimentation. Les différents granulats utilisés lors de cette expérience sont énumérés dans Tableau 3. On y retrouve également l’ensemble des résultats obtenus après 578 jours. Les résultats de cette expérience montrent que, le plus souvent, les alcalis sont extraits en plus grande quantité dans les solutions alcalines que dans la solution saturée en chaux ou dans l’eau distillée. Ceci peut être expliqué par le fait que les solutions alcalines sont plus agressives (pH de 13,85) que les deux autres utilisées (pH de 12,32 pour la chaux et pH de 7 pour l’eau distillée), mais peut-être également par une précipitation des alcalis dans la solution de chaux. Aussi, il est possible de constater que le sodium et le potassium sont relâchés dans des proportions similaires dans les solutions alcalines et dans la solution de chaux.
Au final, les valeurs obtenues pour la contribution potentielle en alcalis par les granulats à la solution interstitielle du béton varient entre 0,1 et 12,65 kg/m3 de béton. Il est par contre important de noter que la valeur maximale est obtenue avec un granulat ayant une teneur initiale de 12,30% Na2Oeq, ce qui est très peu commun (granulat principalement composé de néphéline). Si l’on exclue cette valeur, la contribution maximale obtenue est de 3,45 kg/m3 de béton. Il est aussi important de noter que les résultats varient grandement d’un type de granulat à un autre.
Tableau 3 - Différents granulats utilisés pour les essais d’extraction et teneurs en alcalis obtenues (Bérubé et Duchesne 1996) Na2O K2O Na2Oeq Na2O K2O Na2Oeq Na2O K2O Na2Oeq Na2O2 K2O2 Na2Oeq (%) (%) (%) (%) (%) (%) (%) (%) (%) (%) (%) (%) (%/total)3 (kg/m3) Phonolite 9,09 4,88 12,30 0,13 0,031 0,151 0,1 0,015 0,11 0,56 0,189 0,684 5,56 12,65 Granite 3,50 4,83 6,68 0,024 0,045 0,053 0,026 0,084 0,081 0,059 0,192 0,185 2,77 3,43 Tuf Rhyolitique 5,25 1,70 6,37 0,053 0,01 0,059 0,065 0,018 0,077 >0,053 >0,022 >0,067 >1,24 >1,47 Sable granitique 2,85 3,65 5,25 0,013 0,022 0,028 0,019 0,016 0,03 0,01 0,031 0,03 0,75 0,73 Diorite 4,49 1,13 5,23 0,028 0,006 0,032 0,038 0,023 0,053 0,136 0,065 0,179 3,42 3,31 Gneiss-Granitique 3,57 2,01 4,89 0,021 0,022 0,036 0,027 0,038 0,052 0,076 0,095 0,139 2,84 2,57 Andésite 4,47 0,12 4,55 0,047 0,001 0,048 0,056 0,001 0,057 0,101 0,002 0,102 2,25 1,89
Gravier lithique (Sudbury) 3,01 2,03 4,35 0,033 0,006 0,036 0,042 0,014 0,052 0,146 >0,032 >0,166 >3,83 >3,08
Grauwacke 2,33 2,60 4,04 >0,026 0,015 >0,036 0,025 0,012 0,033 0,108 >0,055 >0,145 >3,58 >2,68
Shale 0,98 3,41 3,22 0,044 0,026 0,061 0,036 0,022 0,05 0,034 0,02 0,047 1,88 1,12
Dolomite (Beekmantown) 0,04 2,62 1,76 0,004 0,056 0,041 0,004 0,085 0,06 0,008 0,184 0,129 7,33 2,39
Calcaire dolomitique (Kingston) 0,06 0,30 0,26 0,004 0,01 0,011 0,007 0,016 0,017 0,018 0,059 0,057 21,97 1,05
Calcaire siliceux (Trenton) 0,11 0,24 0,27 0,009 0,003 0,01 0,012 0,002 0,013 0,011 0,003 0,013 5 0,25
Calcaire haute pureté (Trenton) <0,10 0,09 <0,16 0,003 0,003 0,005 0,013 0,01 0,019 0,007 0,015 0,017 14,41 0,42
Calcaire siliceux (Spratt) 0,04 0,08 0,09 0,003 0,003 0,005 0,003 0,003 0,004 0,006 0,005 0,009 9,24 0,16
Grès siliceux (Potsdam) 0,01 <0,05 <0,04 0,001 0,008 0,007 0,001 0,006 0,005 >0,002 >0,014 >0,011 >25,60 >0,20
Quartzite <0,01 <0,05 <0,04 0 0,001 0,001 0,001 0,001 0,002 >0,002 >0,002 >0,004 >8,05 >0,06
1. Contribution maximale en Na2O + K2O dans l'eau, la solution de chaux saturée ou les solutions alcalines 2. Na2O mesuré dans la solution de 0,7M K2O et K2O mesuré dans la solution de 0,7M Na2O
3. Pourcentage des alcalis totaux (Na2Oeq) dans le granulats
4. Basé sur un béton avec une teneur totale en granulats de 1850 kg/m3
Le signe > signifie que les analyses n'ont pas été effectuées jusqu'aux dernières échéances dû à la précipitation d'un gel de silice lorsque les solutions étaient acidifiées
Na2Oeq
Granulats
Alcalis totaux Alcalis solubles
D’autres études effectuées par le même groupe de recherche ont également montré qu’en faisant varier la granulométrie de 0,63/1,25 mm à 1,25/5 mm, le relâchement d’alcalis est seulement 15 à 20% moins élevé après trois mois, bien que la surface spécifique du granulat soit quatre fois moins importante.
2.4.7 Le Roux et al. (1997)
Les auteurs ont utilisé, à l’époque, le seul protocole expérimental d’extraction d’alcalis provenant des granulats faisant l’objet d’une normalisation. Cette norme est la procédure LCPC no.37 (LCPC, 1993), qui consiste en l’immersion de 500 g de matériel granulaire, possédant une distribution granulométrique entre 0,08 et 20 mm, dans 500 ml d’une solution saturée en chaux avec de la chaux en excès à une température de 100°C pour une période de 7 heures, sans agitation. Un des avantages de cette expérience est qu’elle utilise la même granulométrie que celle normalement utilisée lors de la confection d’un béton conventionnel.
Les auteurs ont soumis 8 différents granulats à l’étude. Parmi ceux-ci, on retrouve :
Un basalte, caractérisé par une structure microlitique porphyrique typique (pâte vitreuse, microlites de plagioclases et phénocristaux de clinopyroxènes et d’olivine). Un granite à texture de porphyroïde à gros cristaux d’orthose et renfermant des
inclusions de quartz, de feldspaths et de micas.
Une rhyolite, constituée de 30 à 40% de quartz, de 30 à 40% de feldspath potassiques altérés et de micas noirs extrêmement altérés et remplacés par de la chlorite.
Un gneiss-granitique, dont les principaux minéraux sont le quartz (30 à 40%), les plagioclases (30%) et la biotite (30%). Certains minéraux accessoires, tel que de la pyrite, du sphène et de l’apatite, sont également présents.
Une amphibolite, principalement composée de hornblende (40%), de plagioclases (30 à 40%), d’épidote (15 à 20%), de grenat (5%) et de clinopyroxènes.
Un calcaire siliceux, dont la matrice carbonatée est imprégnée d’une silice diagénétique qui peut représenter jusqu’à 20% de la roche.
Un quartzite, composé de quartz à extinction ondulante (95%) et de muscovite (5%).
Un calcaire de très haute pureté.
basalte alors que la plus faible est obtenue par le calcaire de haute pureté. Bien que le basalte ne soit pas le matériel possédant la plus grande concentration en alcalis, c’est tout de même celui qui en libère le plus. Les auteurs expliquent ceci par le faible degré de cristallinité du matériel. Il est également important de noter que les données varient entre les différents granulats utilisés. De façon générale, les matériaux vitreux ainsi que ceux contenant beaucoup de feldspaths sont plus enclins à libérer des alcalis que les granulats siliceux et carbonatés. Si l’on convertit les données obtenues afin de calculer l’apport potentiel en alcalis dans un béton, des valeurs variant entre 0,03 et 3,89 kg de Na2Oeq/m3 (moyenne de 0,94 kg Na2Oeq/m3) sont obtenues. Les résultats obtenus lors de cette expérience sont somme toute similaires à ceux obtenus dans l’étude de Bérubé et Duchesne (1996), bien que les conditions expérimentales soient différentes.
Tableau 4 - Résultats obtenus lors des expériences menées par Le Roux et al. (1997) et Ouali (1997) (tiré de Bérubé et Fournier (2004))
2.4.8 Ouali (1997)
L’auteur de cette recherche a utilisé 7 des 8 granulats sélectionnés par Le Roux et al. (1997) (en excluant le calcaire de haute pureté), mais dans des conditions d’extraction différentes. Contrairement à la procédure prescrite par la méthode LCPC numéro 37, seulement 120 g d’échantillon ayant une granulométrie variant entre 0,08 et 0,63 mm ont été utilisés. La masse de l’échantillon a été choisie de sorte que la surface spécifique du matériel à l’essai soit la même que celle des matériaux soumis à la méthode LCPC. De cette façon, les données obtenues dans les deux essais peuvent être comparées entre elles. Aussi, comme le fluide interstitiel du béton possède une faible teneur en calcium (qui se retrouve
Basalte 4,54 0,21 4,8 3,89 4,46 0,47 10,5 8,7 Granite 6,52 0,02 0,3 0,37 7 0,038 0,54 0,7 Rhyolite 5,5 0,036 0,64 0,67 5,92 0,041 0,69 0,76 Gneiss-Granitique 7,02 0,1 1,42 1,85 6,98 0,058 0,83 1,07 Amphibolite 3,67 0,02 0,5 0,37 3,37 0,03 0,89 0,56 Calcaire siliceux 0,42 0,009 2,1 0,17 0,84 0,014 1,6 0,26
Calcaire haute pureté 0,036 0,0014 3,8 0,03 - - -
-Quartzite 0,35 0,0085 1,8 0,16 0,9 0,008 0,8 0,15
3,51 0,051 1,92 0,94
4,01b 0,058b 1,65b 1,07b
a
Basé sur un béton avec une teneur totale en granulats de 1850 kg/m3
b
Moyenne excluant la valeur obtenue par le calcaire de haute pureté (pour comparaison entre les deux études) Moyenne % du granulat % des alcalis totaux 4,21 0,094 2,26 Granulats
Solution de chaux saturée (Le Roux et al, 1997) Solutions alcalines (Ouali, 1997) kg/m3 au bétona Total Na2Oeq (% du granulat) 1,74 Total Na2Oeq (% du granulat) % du granulat % des alcalis totaux kg/m3 au bétona
cristallisée dans la portlandite) et que l’attaque à l’eau de chaux peut entraîner la précipitation de minéraux néoformés pouvant perturber le dosage des alcalis libérés, la solution d’attaque a été remplacée par de la soude (NaOH) pour mesurer la libération de potassium et de la potasse (KOH) pour mesurer la libération du sodium. Encore une fois, afin de se rapprocher le plus possible des conditions internes du béton, la concentration des solutions d’attaques utilisées est de 0,7 mole/litre, pour un pH de 13,3.
L’expérience effectuée consiste à introduire 120 g d’échantillon et 500 ml de solution d’attaque dans un réacteur en acier inoxydable d’une capacité de 1000 ml. Ce dernier est placé dans un chauffe-réacteur réglé à 60°C. Par la suite, 10 ml de solution sont prélevés pour analyse par absorption atomique après 3, 7, 24, 48, 96, 192, 384, 768 et 1000 heures. Un volume équivalent de solution initiale préalablement chauffée à la même température est immédiatement introduit dans le réacteur après chaque prélèvement. Les résultats de relâchement d’alcalis par les granulats obtenus varient entre 0,008 et 0,47%, pour une moyenne de 0,094% Na2Oeq (contribution potentielle au béton de 0,15 à 8,70 kg Na2Oeq/m3, avec une moyenne de 1,74). Les résultats complets sont présentés dans le Tableau 4. Suite à l’analyse de ce dernier, il est possible de remarquer qu’en général, plus d’alcalis sont relâchés lorsque les granulats sont immergés dans des solutions alcalines plutôt que dans une solution saturée de chaux. Ces résultats sont en accord avec la précédente étude de Bérubé et Duchesne (1996). Par contre, il est important de noter que les conditions expérimentales utilisées dans l’étude de Ouali diffèrent beaucoup de celles prescrites par la méthode LCPC numéro 37 (rapport granulat-solution de 1:4,2 contre 1:1, température de 60°C contre 100°C et durée de l’essai de 1000 h contre 7 h, respectivement); une comparaison plus approfondie entre les résultats obtenus par les deux études ne peut donc pas être effectuée.
Ouali a également fait varier plusieurs paramètres d’entrée de l’expérimentation lors de ses travaux. Par exemple, à 20°C, le relâchement d’alcalis par les granulats diminue de 5 à 10 fois par rapport à 60°C. Aussi, l’auteur a fait varier le rapport granulat-solution utilisé. Il a observé qu’avec un rapport faible, la libération d’alcalis est plus élevée à court terme et plus faible à long terme. En comparaison, un rapport plus grand permettra la libération de