This manuscript has been reproduced from the- microfilm master. UMI films the text directly from the original or copy submitted. Thus,some thesis and dissertation copies areintypewriter face, while others may be from any type of computer printer.
The quality of this reproduction is dependent upon the quality of the cOPY submitted. Broken or indistinct print, colored or poor quality illustrations and photographs, print bleedthrough, substandard margins, and improper alignment can adversely affect reproduction.
ln the unlikely event that the author did not sand UMI a complete manuscr.pt and there are missing pages, these will be noted. Also, if unauthorizad copyright material had to be removed. a note will indicate the deletion.
Oversize materials (a.g., maps, drawings, charts) are reproduced by sectioning the original, beginning at the upper laft-hand camer and continuing from left to right in equal sectionswithsmall overlaps.
Photographs included in the original manuscript have been reproduced xerographically in this copy. Higher quality 6" x 9" black and white photographie prints are available for any photographs or illustrations appearing in this copy for an additional charge. Contact UMI directly to arder.
Bell& Howellinformatian and Leaming
300 North Zeeb Raad, Ann Arbor, MI 481œ-1346 USA 800-521-0600
•
•
•
Comparaison du profil inflammatoire des souris résistantes
et sensibles à une infection endobronchique
à
Pseudomonas aeruginosa
Caroline Francoeur,
M.Sc.
Département de Médecine ExpérimentaleUniversité McGill, Montréal Septembre 1999
Mémoire soumisàla Faculté des Études Supérieures et de la Recherche en vue de l'obtention du grade de Maîtrise ès Science
1+1
National Library of Canada Acquisitions and Bibliographie Services395 Wellington Street Ottawa ON K1AON4
canada Bibliothèque nationale du Canada Acquisitions et services bibliographiques 395. rue Wellington OttawaON K1A ON4 Canada
Yourfile VOIIlt,.ftirenœ
Our file Notre reférencs
The author has granted a non-exclusive licence a1lowing the National Library of Canada to reproduce, loan, distribute or sell
copies of this thesis
in
microfonn,paper or electronic formats.
The author retains ownership of the
copyright
in
this thesis. Neither thethesis nor substantial extractsfrOID it
may be printed or otherwise reproduced without the author' s penmSSlon.
L'auteur a accordé une licence non
exclusive pennettant
à
laBibliothèque nationale du Canada de reproduire, prêter, distribuer ou vendre des copies de cette thèse sous la fonne de microfiche/film, de
reproduction sur papier ou sur fonnat électronique.
L'auteur conserve la propriété du droit d'auteur qui protège cette thèse.
Ni la thèse
ni
des extraits substantielsde celle-ci ne doivent être imprimés ou autrement reproduits sans son autorisation.
0_612-55058-3
•
•
•
À
la mémoire de Marie Curie.
À cette femme de caractère
qui a ouvert les portes
du monde scientifique
auxfemmes des générations
présentes etfutures.
•
•
•
11
TABLE DES MATIÈRES
RÉS~ABSTRACT v
LISTE DES ABBRÉVIATIONS . . . .. vi I. INTRODUCTION . . . .. 1
1. 1Caractéristiques de la bactériePseudomonas aeruginosa . . . .. 1
1.2 Infections pulmonairesàPseudomonas aeruginosa 2 1.3 Modèlemurind'infection pulmonaireàPseudomonas 3 Tableau 1Étude dutauxde mortalité et de la prévalence de l'infection chez les sourisBALBlc et DBA/2 suite à une infection pulmonaire àP.
aenlginosa. . . . 5
1.4Résistance génétique aux infectionsàPseudomonas . . . . 5 1.5 Réponse inflammatoire . . . 7
1.6Hypothèses de travail 8
II. MATÉRIEL ET MÉTHODES 12
2. 1Animaux 12
2.2 Bactérie 12
2.3 Purification des macrophages interstitiels résidants et inflanunatoires 13 Figure 1. Courbe néphélémétrique du tsmPA dans un bouillon TSB. " 14 2.4 Isolation des macrophages péritonéaux. . . .. 15
2.5 Essai de bactéricidiein vitro 16
2.6 Élimination systémique deP. aeruginosa " 17 2.7 Instillation intra-trachéale dePseudomonas aeruginosa 17 2.8 Détermination de la population bactérienne dans les poumons 18 2.9 Lavage broncho-alvéolaire et numération cellulaire " 19
2.10 Purification des sumageants d'homogénats 19
2.11 Quantification de l'IFNy par ELISA 20
2. 12 Quantification du TNFex par ELISA . . . 21 2.13 Quantification del'IL-Ip, IL-4, IL-6, IL-I0, MCP-l etGM-CSF 22 2. 14 Mesure du nitrite/nitrate . . . 23 2. 15 Statistiques . . . _. . . 24
nI. RÉSULTATS 25
•
•
•
3.2 Élimination deP. aeruginosalors d'infections systémiques et pulmonaires . 26 Figure 2 Étude in vitro de l'implication des macrophages dans la défense
contrePseudomonas aeruginosa. 27
Figure 3. Clairance du tsmPA dans les tissus spléniques et hépatiques après une infection systémique par voie mtra-veineuse. . . 29
Figure 4. Étude in vivo de la réponse bactéricide des macrophages pulmonaires résidants suite à une infection endobronchique àtsmPA.
... ' 30
3.3 Étude du profil de la défense cellulaire lors d'une infection endobronchique ... 31 Figure 5. Étude du profil de la défense cellulaire lors d'une infection
endobronchiqueàtsmPA 32
3.4 Effet duTNPa sur la réponse inflammatoire chez les souris sensibles infectées ... 33 Tableau 2. Effet du traitement au TNFa sur l'infection endobronchiqueàP.
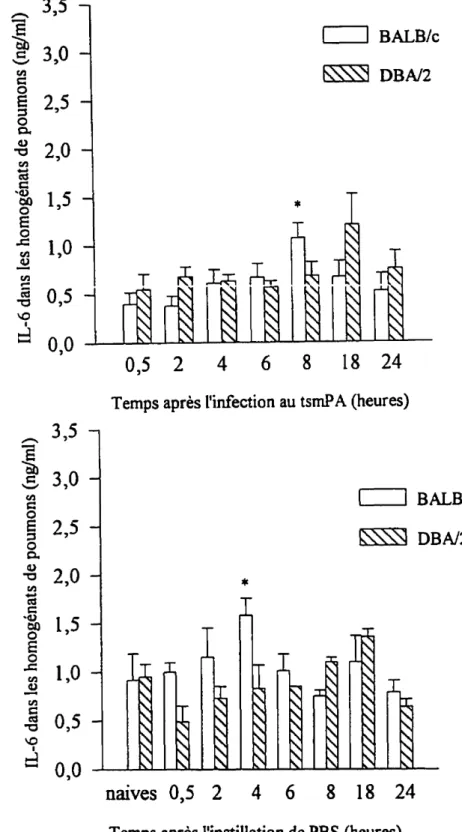
aeruginosa chez les souris sensibles DBA/2 34 3.5 Production duTNFadans les tissus pulmonaires 35 Figure 6. Production du TNFa dans les tissus pulmonaires des souris résistantes et sensibles infectées par le tsmPA. . . 36 3.6 Étude de la production des médiateurs impliqués dans la cascade du TNF . 37 3.6.1 Production de monoxyde d'azote dans les tissus pulmonaires .... 37 Figure 7. Production de nitrite/nitrate dans le tissu pulmonaire suite à une infection endobronchiqueàtsmPA. . . 38 3.6.2 Production d'IFNy dans les tissus pulmonaires 39 3.6.3 Production d'IL-lP dans les tissus pulmonaires 40 Figure 8. Production d'IL-lp dans les tissus pulmonaires de souris résistantes et sensibles infectées par le tsrnPApar voie intra-trachéale. .... 41 3.6.4 Production d'IL-6 dans les tissus pulmonaires 42 Figure 9. Production d'IL-6 dans le tissu pulmonaire de souris résistantes et sensibles suiteàune infection endobronchique avec le tsmPA. . . 43
•
•
•
iv
3.6.5 Production d'IL-4 dans les tissus pulmonaires 44
Figure 10. Production d'IL-4 dans les tissus pulmonaires des souris résistantes et sensibles infectées par voie intra-trachéale avec le
tsmPA. 45
3.6.6 Production d'IL..10dans les tissus pulmonaires 46 3.6.ï Production de MCP-I dans les tissus puJrnonaires 46
Figure II. Production d'IL-IO dans les tissus pulmonaires des souris résistantes et sensibles infectées par voie intra-trachéaIe avec le
tsmPA. 47
Figure 12. Production de MCP-I dans les tissus pulmonaires de souris résistantes et sensibles infectées avec le tsmPA. . . 49
3.6.8 Production de GM-CSF dans les tissus pulmonaires 50
Figure 13. Production de GM-CSF dans les tissus pulmonaires de souris résistantes et sensibles suite à une infection intra-trachéale avec le
tsmPA 51
Tableau 3 Comparaison du profil inflammatoire des souris résistantes et sensibles en réponseà une infection endobronchique autsmPA . 52
IV DISCUSSION 53
V CONCLUSION 75
Figure14.Représentation schematique du mécanisme de défense pulmonaire
-contrePseudomonas aeroginosa. 77
RE~RCIEMENTS 78
•
•
•
RÉsUMÉ
Dans un modèle murin de résistance et de sensibilitéà une infection pulmonaireà
Pseudomonas aeruginosa (PA), nous avons étudié le profil inflammatoire induit par la
bactérie au cours de la phase précoce de l'infection. Cette étude nous a permis d'identifier certains mécanismes pouvant être responsables du phénotype de résistanceàune infection endobronchique. Nous avons d'abord démontré que le recrutement neutrophilique dans l'espace alvéolaire joue un rôle crucial dans la défense contrePA. Cet influx de neutrophiles se produit plus rapidement chez les souris résistantes(BALB/c) que chez les souris sensibles (DBAJ2) et coïncide avec le début de la clairance de l'infection. De plus, la production de TNFa est plus grande chez les sourisBALB/c que chez les souris DBAJ2 et semble médier
l'expression de chirniokines responsables du recrutement des neutrophiles. Lorsque les souris sensibles sont traitées au TNF au moment de l'infection, on observe un recrutement accru de neutrophiles sans changement dans l'éradication bactérieJUle. La prduetion d'IL-IO et de GM-CSF semble aussi être augmentéedans les poumons des souris résistantes. Ces cytokines pourraient induire une meilleure activation des neutrophiles en les protégeant contre l'effet cytotoxique des exotoxines bactériennes et en retardant l'activation des gènes apoptotiques (voie de Fas). Le TNFct, Pa-lO et le GM-CSF pourraient devenir des cibles thérapeutiques intéressantes pour le traitement des infections àPA chez les patients répondant mal aux antibiotiques.
ABSTRACr
A mouse model of resistance and susceptibility to a pulmonary infection with
Pseudomonas aeruginosa
cP
A),wasused to study the inflammatory profile early foUowing infection. Tlûs study allowed the identification ofthe mechanisms responsible for the resistant phenotype. We have tirst determined the pivotai raIe of the neutrophil recruitment inthe alveolar space in the hast defense againstPA. This influx occurred earlierin the resistantBALB/c mice than in susceptible DBA/2 mice and occurred concommitantly with the
beginning of the bacterial clearance. Furthermore, leveIs ofTNFa were found to be higher -in BALB/c mice than in DBAl2 mice. TNFa appears ta mediate the production of chemokines responsible for neutrophil recruitment in the lungs. However, treatment of susceptible mice with TNPa Ied to an increase of neutrophil recruitment without any improvementinbacterial clearance. Lung homogenates from resistant mice also showed an increaseinIL-IO and GM-CSF content. This was not seen in susceptible mice. This may lead to a more efficient neutrophil activation due to their effect on bacterial exotoxins and apoptotic gene regulation (viaFas pathway). TNFa, IL-IO and GM-CSF may represent
valuable targets for treatment of Jung infection with PA in patients unresponsibe to antibiotherapy.
•
•
•
BSA: CFTR: CFU: ELISA~ PK: FLBA: GM..CSF: IFN: IL: LBA: MCP: MIP: NO: PBS: PlvlN: SVF: TNF: TSA: TSB: tsmPA:LISTE DES ABBRÉVIATIONS
bovine serum albumin
cystic fibrosis transmembrane conductance regu/ator colonyfonning unit
enzyme-linlœd immunosorbenl assay
~ucoviscidose ou fibrose kystique pulmonaire fluide des lavages broncho-alvéolaires
granu/ocyte-macrophages-colony stimulatingfactor
interféron interleukine
lavage broncho-alvéolaire
monocyte chemotactic protein macrophage inflammatory protein
monoxyde d'azote
phosphate buffered saline
cellule polymorphonucléaire sérum de veau foetal
tumor necrosisjactor trypticase soy agar trypticase soy broth
souche mutante thermosensible de Pseudomonas aeruginosa
•
•
•
l INTRODUCTION
1.1 Caractéristiques de la bactériePseudomonas aeruginosa
Pseudomor.asaerugino5aQ1;une bactériegramnégative dénitrifiante de la famille des
Enterobacteriacea. On la retrouve généralement dans le sol et eUe joue un rôle important
dans la fixation de l'azote atmosphérique. Toutefois, il s'agit aussi d'un pathogène
opportuniste pouvant êtreàl'origine d'infections sévères chez des sujets immuno·supprimés.
Danslemilieuhospitalier,Pseudomonos aeruginosapeut être la cause de pneumonies nosocomiales (BRYANetaI1984, HORANetaI1984, BODEYetaI 1993, FABEGASet
al 1996). De plus, cette même bactérie est hautement problématique chez les patients atteints de mucoviscidose. La colonisation des voies respiratoires par Pseudomonas
aeruginosaestpresque toujours secondaireàune infectionàStaphylococcusaureus. Chez ces patients, les infectionsàPseudomonassont récurrentes pendant les premières années de la maladie, Le. que les infections semblent clisparalùe puis réapparaissent périodiquement. Or,
la colonisation parP. aeruginosadevient éventuellement chronique et le patient subit des
périodes d'exacerbation sans jamais pouvoir éradiquer complètement l'infection.
n
faut préciser que l'infection est généralement non-mucoïde et qu'eUe est possiblement accéléréepar des infections croisées, soit virales, soit bactériennes. La mauvaise clairance est
partiellement dueàla conversion phénotypique deP.aeroginosade sa forme non-mucoïde à sa forme mucoïde (M.~TIN et al, 1993). Ce caractère mucoïde est associé à une diminution des facteurs de virulence classiques produits parP. aeruginosa. (ORNa et al
•
•
•
2
1992, PEDERSENetai 1992, WOODS et al 1991). Toutefois, cela permet à la bactérie de
croître, de se multiplier, et de persister en micro-colonies, enveloppées dans un biofilm
d'alginate. (KOCH et al 1993) La présence de Pseudomonas aenlginosa dans les voies
respiratoires entraîne une intense réaction inflammatoire chez les patients atteints de
mucoviscidose. Les hauts degrés de mortalité et de morbidité semblent être dus à la
bronchiectasie associée au relargage de protéases et d'oxydants par les neutrophiles lors des
processus d'activation et de phagocytose (BERGER 1991).
1.2 Infections pulmonairesàPseudomonas aeruginosa
Toutefois, chez ces patients, il semble que la propension à l'établissement d'une
infection chronique parPseudomonas soit indépendante de la nature de la mutation du gène
CFTR (cystic fibrosis transmembrane conductance regulator) responsable de la
mucoviscidose. En effet, si certains enfants développent une infection chronique dès l'âge de
deux ans, d'autres ne la développent que plus tardivement, vers l'âge de dix ans. Chez les
patients plus âgés et résistants à l'infection chronique à Pseudomonas aeruginosa, on a
rapporté la présence d'anticorps dirigés contre l'exopolysaccharide mucoïde. Ceci favorise
la phagoCYtose par le neutrophile en opsonisantP. aeruginosa(pIERet al1987). Cependant,
la protection par les anticorps opsoniques ou non opsoniques n'a pas été démontrée
clairement. La sensibilité croissante à Pseudomonas aeruginosa fi'est pas liée à une
•
•
•
poumons~ soit prédisposent ces patients à une infection particulière, soit empêchent l'éradication complète du pathogène des voies respiratoires (KONSTANet 011993).
1.3 Modèle murio d'infection pulmonaireà Pseudomonas
Des travaux de recherche effectués dans notre laboratoire parMORISSETTEetal (1995)ont montré qu'une telle dichotomie quantauphénotype de résistance ou de sensibilité auxinfectionsàPseudomonasexistaitchez la souris. Le modèle murin estapparu comme un excellent modèle pour l'étude des facteurs génétiques régulant la résistance naturelle à Pseudomonas aeruginosadans lescasd'infections péritonéales et cornéennes(BERKet al 1983, BERl< et al 1979, PENNINGTON et al 1992). En effet, les lignées de souris génétiquement définies sont sélectionnées selon la qualité et l'amplitude de leur réponseàun pathogène donné. En réduisant le nombre de variables, ildevient plus facile d'identifier le ou les gènes responsables de la résistance ou de la sensibilité à l'infection.
D'autres études ont été menées en induisant une infection pulmonaireàPseudomonas aeruginosa en utilisant une bactérie libre en aérosol ou en pratiquant une infection intra-trachéale chez la souris (CERQUETTIetal 1986, SORDELLI et al 1987, SORDELLI et al
1985). Un modèle d'infection pulmonaire chronique avec une souche de P. aeruginosa
enrobée d'agar a également été développée par le groupe de BAKER (STARIŒet al1987). Parailleurs~ ce modèle a été utilisé pour l'étude de la protection conférée par l'immunisation
•
•
•
4
Nous avons donc utilisé ce modèle d'infection endobronchique en utilisant des billes
d'agar contenant une souche dePseudomonas aeroginosa 508 afin d'étudier la réponse inflammatoireàPseudomonaschez différentes lignées de souris. L'enrobage de la bactérie dans l'agar présente l'avantage de réduire la rapidité de la clairance de la bactérie et ainsi
pernlettre l'étude des interactions bactérie/bôte suivant rinfeetion d'un animal
immunocompétent (MORISSETTEet al 1995).
Quatre lignées murines ont été soumises à une infection endobronchique à Pseudomonas aeruginosa508 enrobé dans des billes d'agar. Chaque souris a reçu une dose
initiale de 1 X 104 à 3 X 10 bactéries. Après trois jours d'infection, les lignées AlJ et C57BL/6 n'ont montré aucune modification notable de la population bactérienne dans les
poumons. Toutefois, les souris BALB/c ont montré une diminution significative de la
population bactérienne alors que les souris de la lignéeDBAl2ont, au contraire, montré une
augmentation appréciable de la charge bactérienne. Tel que le démontre le tableau 1, l'étude
de la mortalitéetde la prévalence de l'infection a démontré que le taux de mortalité imputable
à l'infectionàPseudomonasest supérieur chez les souris de la lignéeDBAl2que chez les sourisBALB/cet ce dès le troisième jour d'infection. De plus, après une semaine d'infection,
le pourcentage d'individus montrant une infection persistante est significativement supérieur
•
•
•
Tableau 1
Étude du taux de mortalité et de la prévalence de l'infection
chez les sourisBALB/cet DBAl2 suite à une infection pulmonaireàP. aeruginosa
Lignée % mortalité % individus montrant une
infection persistante 3 jours d'infection 7 jours 14 jours
BALBlc 1,7%(1/60)* 6% (1I16)t 13%(2115)
DBAl2 38%(38/101) 44%(7116) 11%(1/9)
*
Les chiffres entre parenthèses indiquent le nombre de souris mortes sur le nombre de sourisinfectées. .
t
Les chiffres entre parenthèses indiquent le nombre de souris infectées sur le nombre de souris testées.1.4 Résistance génétique aux infectionsàPseudomonas
De tels résultats permettent alors de concevoir un modèle murin de résistance génétiqueàPseudomonas aeruginosapuisque les souris de la lignée BALBlc se sont avérées résistantesàl'infection alors que les souris de la lignée DBAl2 se sont avérées sensibles. La différence est notable au cours de la première semaine d'infection.
n
s'agit donc d'un excellent modèle d'étude pour la phase précoce de ('infection présentant une inflammation -aiguë. Une différence génétique importante entre ces deux lignées est (' absence du facteur C5 du complément chez les souris DBAJ2. Cette lignée possède une mutation récessive autosomale du gène contrôlant l'activité hémolytique du sérum résultant ainsi en une déficience au niveau de la production du CS. Ce complément est connu pour participeràla défense de l'hôte contre les infections ainsi que dans la réponse inflammatoire en médiant plusieurs activités biologiques telles que le chimiotactisme, la stimulation de la phagocytose,•
•
•
6
le relargage de cytokines (notamment le TNF(tumor necrosisfactor) et l'interleukine-l), le relargage d'enzymes granulaires des neutrophilesetd'oxydants, de même que l'augmentation de la formation d'anticorps (JOHNSTONet a/1993).
Les effets de la déficience du facteur CS sur la morbidité et la mortalité lors d)infections à Pseudomonas aeruginosa ont été rapportés chez des lignées de souris congéniquesBI0.D2. La déficience du facteur CS entraînait une diminution de la clairance bactérienne et influençait le recrutement neutrophilique (CERQUETTIet a/ 1986, LARSON eta/1982). Cependant, chez la souris, l'effet du fàcteur CS sur la réponse de l'hôte peut être modulé par le bagage génétique. En effet, CERQUETTIetcoUaborateurs(1986) ont montré, en utilisant des lignées de souris présentant un certain profil génétique DBA/2, que la clairance du Pseudomonas en phase précoce était similaire chez les souris DBN2 CS-déficientesetchez les souris CS-compétentes de la lignéeDBAJI (CERQUETTIetal1986). Ces résultats appuient l'importance de l'implication de gènes contrôlant les mécanismes de défense lors d'une infection pulmonaire àPseudomonas aeruginosachez la souris DBAl2.
De plus, dans un modèle d'infection àListeria monocytogeneslorsque l'on compare une lignéeAlJC5-déficiente avec une lignéeAlJCS-compétente, aucune différence ne peut être observée quantà l'issue de l'infection (GERVAISet al 1984). Ces résultats indiquent que si le facteur CS peut jouer un rôle majeur dans la clairance dePseudomonas aeruginosadu tissu pulmonaire, d'autres mécanismes de défense sont impliqués dans le processus d'éradication.
Outre l'implication du facteur CS, il s'agÎt d'identifier les mécanismes responsables de la résistance ou de la sensibilité àPseudomonas aerugïllosa afin de cibler les gènes
•
•
•
responsables de l'éradication de l'infection. Le problème peut être étudié suivant deux
aspects: la défense cellulaire dans un premier temps, puis le profil d'expression des médiateurs
inflammatoires impliqués dans l'activation des phagocytes.
1.5 Réponse inflammatoire
Il a été démontré que la présence de Pseudomonas aeroginosa dans les voies
respiratoires des patients atteints de mucoviscidose induit une forte réponse inflammatoire
soutenue. Cette réponse est caractérisée par un fort recrutement de cellules
polymorphonucléaires (PMNs) dans l'espace broncho-alvéolaire (BERGER 1991). En
utilisant le modèle murin d'infection endobronchique, nous avons démontré que la résistance
des souris BALBlc et la sensibilité des souris DBAJ2 à l'établissement de l'infection à
Pseudomonas aeruginosacorrelait avec une différence notable dans l'amplitude de la réponse
inflamnlatoire du tissu endobronchique (MORISSETTE et al 1995). En effet, les souris
BALB/c ont montré un recrutement des cellules inflammatoires, Ph4Ns et macrophages, plus
rapide que chez les sourisDBAJ2. Laréponse inflammatoire précoce était caractérisée par un recrutement des PMNs survenant au cours des 24 premières heures de l'infection. Cette
réponse était suivie par un influx des macrophages inflammatoires dès le troisième jour
d'infection.
En utilisant le même modèle murin d'infection endobronchique, GOSSELIN et
collaborateurs (GOSSELIN et al 1995) ont analysé la production de plusieurs cytokines
inflammatoires, notamment l'interleukine 1a (IL-la), l'interleukine 1~ (IL-l P), le macrophage injlammatory protein la (MlP-la) et le TNFa, lors de la phase précoce de
•
•
•
8
l'infectionàP. aeruginosa. Ces cytokines ont pu être mesurées entre3et 6 heures suivant l'infection desanimaux.sensibles et résistants. Un point intéressant est que les taux de TNFa
mesurés dans les lavages broncho..a1véolaires (LBA) de même que ceux de l'expression du gène mesurés dans les cellules du LBA, étaient significativement supérieurs chez les souris résistantes BALB/cque chez les souris sensibles DBA/2. Toutefois, aucune différence n'a été notée quant aux niveaux d'expression et de synthèse des autres cytokines étudiées. Ces résultats semblent suggérer un rôle important duTNFa dans la réponse spécifique de l'hôte lors d'une infection pulmonaire.
Plusieurs études ont mis en lumière l'importance du recrutement des phagocytes au site de l'infection dans l'éradication de la bactériePseudomonas aeruginosa(AMURAet al 1994, BURETet al 1994, CROWELLet al1992). Ces études ont montré qu'un plus grand nombre de cellules inflammatoires et la présence de plus fortes concentrations de TNPa observées au site d'infection chez les souris résistantes peuvent refléter un processus inflanunatoire plus efficace menant à une meilleure bactéricidie etàla clairance de la bactérie. Puisque la production de cytokines varie dans les heures suivant l'infection, nous pouvons penser que le macrophage résidant puisse être impliqué dans le recrutement des PMNs au site d'infection.
1.6 Hypothèses de travail
Donc, en considérant les résultats obtenus avec une souche mucoïde dePseudomonas aenlginoso, nous avons tenté, de manière générale, de déterminer les mécanismes inflammatoires responsables de la clairance de la bactérie lors de la phase précoce de
•
•
•
l'infection. Des expériences in vitro et in vivo, ont été menées en utilisant une souche mutante thennosensible dePseudomonas aeroginosa. Cette souche, ne pouvant pas croître àdes températures supérieures à 30 oC otITe l'avantage d'étudier la phagocytose et l'activité bactéricide des phagocytes sans avoir àcompenser pour la multiplication bactérienne. Des souris résistantes et sensibles ont donc été infectées avec la souche de Pseudomonas aeruginosa(tsmPA) par voies Ïntra-trachéales afin de déterminer la cinétique, l'amplitude et la qualité de la réponse inflammatoire déterminant l'issue de Pinfection (résistance ou sensiblité àPseudomonas).
Dans un premier temps, des études in vitroont été menées dans le but de déterminer l'implication des macrophages pulmonaires résidants et inflammatoires dans la clairance de la bactérie. Pour ce faire, des études de phagocytose et de bactéricidie ont été effectuées sur des cultures en monocouche de macrophages alvéolaires ou interstitiels résidants ou inflammatoires.
Dans un deuxième volet d'expériences, nous avons étudié la dynamique de l'éradication de Pinfection in vivochez les sourisBALB/e résistantes et DBAl2 sensibles. Ces études avaient pour objectif de détenniner quels types cellulaires sont impliqués dans la défense de l'hôte contrePseudomonasainsi que la cinétique du recrutement des phagocytes lors de la phase précoce d'une infection pulmonaire. Ces études avaient également pour objectifd'étudier la réponse de l'hôte et sa capacitéàinduire un profil cytokinique particulier. En effet, l'hypothèse soulevée est que si la mutation du CFTR n'est pas responsable de la différence de la réponse immunitaire de l'hôte lors d'une infectionàPseudomonas,il est possible que l'expression des gènes codant l'expression de médiateurs cytokiniques puisse
•
•
•
10
différer chez un individu sensible comparativementàun individu résistant. Considérant les travaux de GOSSELIN et al mentionnant une expression de TNFa plus élevée chez les
animauxrésistants que chez les animaux sensibles, nous avons donc concentré notre étude sur la cascade impliquant leTNFa. fi semble évident que le TNFajoue un rôle important dans la défense de l'hôte. Toutefois, cette cytokine pro..inflammatoire ne possède pas de pouvoir chimiotactique direct sur les PMNs. Cependant, le TNFainduit la production de plusieurs cytokines pro..inf1ammatoires pouvant être responsables du recrutement des phagocytes au site de l'inflammation.
Afind'étudier le profil cytokinique induit lors de l'infection, des souris résistantes et sensibles ont été infectées avec une souche thermosensible dePseudomonas aeruginosa. Les cytokines pro-inflanunatoires (TI..1~, TNFex) ont été mesurées par enzyme-/inked-immunosorhent-assay(ELISA) dans le tissu pulmonaire. Lemonocyte..chemotactic..protein..l
(MCP.. l) a été étudié comme agent potentiellement chimiotaetique pour les macrophages inflammatoires. Un regard a été porté sur lemacrophage inflammatory protein-2(1\.1IP-2) comme agent chimiotaetique pour les neutrophiles. En effet, si l'interleukine-8 est la principale chimiokine chez l'humain, celle..ci est inexsistante chez la souris. Or le MIP-2 serait l'équivalent murin de l'interleukine-8 et agirait de manièreàinduire l'influx des PMNs au site de l'infection. Ainsi, nous étabHssons la cascade suivante:
IL-lp .... TNFa ...MIP..2 -+ recrutement des neutrophiles au site de l'infection ... MCP..1-+ recrutement des macrophages inflammatoires
•
•
•
Afinde vérifier si seul le recrutement des neutrophiles est détenninant dans l'issue de l'infection et si le rétablissement du niveau deTNFa est suffisant pour restaurer le phénotype de résistance àl'infectio~ des animaux sensibles ont été traités au TNFa au moment de l'infection.
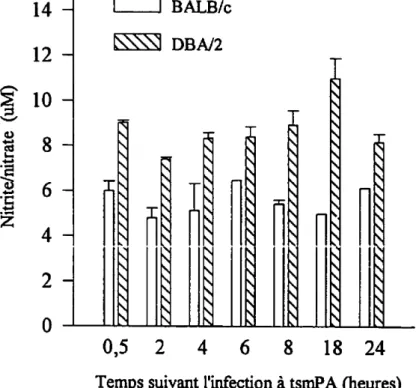
Une deuxième hypothèse a été soulevée à l'effet que la sensibilité à l'infection puisse être associée non seulementàun délai dans le recrutement des phagocytes mais égalementà une inhabilité à activer les neutrophiles. Afin de vérifier l'activation neutrophilique le monoxyde d'azote, l'interleukine-6 etlegranulocyte-macrophages-c%ny stimu/atingfactor (GM-CSF) ont été mesurés dans le tissu pulmonaire de souris résistantes et sensibles en cours d'infection àPseudomonas aeruginosa.
Par ailleurs, nous avons voulu détenniner si la faible production de TNFa observée chez les souris de la lignée sensible DBAJ2 est associée à une répression due àune sur-production de cytokines anti-inflammatoires. Nous avons donc vérifié l'hypothèse d'une répresssion par la mesure de l' interleukine-4 et de l'interleuk.ine-l 0 dans le tissu pulmonaire des sourisDBAl2infectées. Les résultats ont été comparés avec ceux observés dans le tissu pulmonaire des souris résistantes BALBle infectées.
•
•
•
12 II MATÉRIEL ET lvfÉIHODES 2.1 AnimauxDes souris mâles de souches BALBlc et DBA/2 prOVena!lt des laboratoires Taconic (Germantown, NY) ont été gardées dans un environnement stérile jusqu'au moment de l'infection avecPseudomonas aeruginosa. Les souris avaient accèsàde la moulée sèche (Purina) préalablement autoclavée etàde l'eau stérile. Les animaux infectés étaient gardés dans une pièce d'un niveau de confinement P3. Lesinfections avaient lieu alors que les souris étaient âgées de 10à16 semaines.
2.2Bactérie
Une souche mutante thermosensible de Pseudomonas aeruginosa, gracieusement fournie par Dr Anne Morris-Hooke (Miami University, Oxford, Ohio) (MORRIS-HOOIŒ, 1987), est bactériostatique à des températures supérieures à 36°C. Une suspension bactérienne en phase logarithmique de multiplication est obtenue à partir d'une colonie ensemencée en bouillon de culture "Trypticase Soy Broth" (TSB) (Beckton Dickinson, Cockeysville, h4D) à30°Csous agitation constante (agitateur-incubateur: Lab-ligne, modèle 3528, numéro de série 9469, MeIrose Park, Ill). Pour la conservation àlong terme, la suspension bactérienne en phase log a été aliquotée dans un mélange TSB/gIycérol 20% puis congeléeà -SO°C. Pour chacune des expériences subséquentes, un aliquot de 1mlde la suspension mère a été ensemencée dans 8mlde TSB puis diluée en série 1:4. La suspension
•
•
•
baetérielUle a par la suite été ajustée par néphélémétrie (néphélémètre: Bausch& Lomb Inc. Modèle 33.50.02, numéro de série 0315723, Richmond, Ontario, Canada) à une densité de
108CFU/ml avant une dernière dilution seNantàétablir la dose d'infection(À
= 600nm, voir courbe de néphélémétrie, figure 1).
2.3 Purification des macrophages interstitiels résidants et inflammatoires
Les macrophages interstitiels inflammatoires ont été obtenus 5 jours suivant l'instillation intra-trachéale de 50 J.ll de billes d'agar contenant une souche dePseudomonas
aeruginosa508tuéeàla chaleur. Les billes ont été faites en ajoutant de l'agar liquide et une suspension de Pseudomonas dans de l'huile minérale sous agitation tel que décrit par MORISSETTE et al 1995. Ces billes ont été utilisées dans une dilution 112 dans du PBS stérile. Les souris ont été sacrifiées par inhalation de CO2 • Pour chaque souris, la cavité
thoracique a été ouverte et la veine cave a été sectionnée. Les poumons ont alors été perfusés avec un volume total de PBS-EDTA de 10ml àtravers le plexus orbital ou le coeur. Les poumons ont été excisés suite au lavage bronchoalvéolaire dont la technique est décrite plus bas, et sectionnés en explants de 1àdeux millimètres. Pour chaque expérience, les explants pulmonaires obtenus de deux souris ont été taillés dans un milieu D-MEM (Gibco) contenant 5% SVP, 2mg/mlde collagénase (Sigma, St-Louis, Mo), 50 flglml de DNAse 1(Boehringer Mannheim, Laval, Québec, Canada), 1à2 U d'élastase (Boehringer Mannheim), et 25 mM de tampon HEPES (acide N-2-hydroxyéthylpiperazine-N'-2-éthanesulfonique) (ICN
•
1410
9 0, 00 -+---r--,-~~~_ ___,___r__r~...,...,....______r__.__,._.,.~_r_'I 1060,70
~
.' 0,60 ,-.. 0,50§
0 0 \0 0,40 "-" Q) ::s 0" ..c Q.. 0,30 0 "(1)...,
.-
en l:: Q)0 ,20
0
•
0,10CFUtsmPA
•
Figure 1. Courbe néphélémétrique du tsmPA dans un bouillon TSB. La densité optique de la suspension bactérienne a été mesurée à différents intervalles pendant la multiplication bactérienne (À = 600 nm). La courbe néphélémétrique a étédétenninée en comparant la densité optique au nombre de colonies bactériennes obtenues après ensemmencement sur TSA
•
•
•
BiochemicalsIne, Aurora Ohio). La suspension tissulaire a été agitée doucement pendant 90 minutes à 37°C. Les amas tissulaires ont été désagrégés en les faisant circuler à quelques reprises dans une pipette sérologique de lamlouis successivementà travers des aiguilles de 20,21 et 22 G. La suspension cellulaire a alors été récoltée et centrifugée à900 rpm pendant 10 minutes (centrifugeuse: Beckman CPR centrifuge, modèle 349702, no série 8k034, Paolo Alto, CA). Les érythrocytes ont été lysés par l'addition de 10 ml de tampon de lyse hypotonique (solution stérile de BSA 0.01%). Les cellules ont ensuite été lavées dans 30ml de D-MEM/gent8nÙcinel5% SVF et centrifugéesànouveau (900rpm, laminutes). Après avoir été resuspendus dans le milieu de culture, les macrophages ont été purifiés par centrifugation (25 min., 2500 rpm) sur gradient de densité autofonné (Lympholyte-M: Cedarlane Laboratories Limited, Homby, Ontario, Canada). Les cellules situées à l'interphase ont été récoltées et lavées 2 fois dans D-MEM/gentamicinel5% SVF et resuspendues dansD-~l()01O SVF. Une nouvelle étape de purification des macrophages aétéeffectuée en laissant adhérer les cellules sur une surface plastique (microplaques de 48 puits) pendant 2 heuresà37°Cdans un atmosphère humide contenant 5% CO2sous agitation
constante. Les cellules ont été simplement lavées et les macrophages adhérents ont été incubés de 12 à16 heures dans le D-MEM/IO% SVF avant l'essai de bactéricidie. Cette méthode permet d'obtenir une pureté de>99% de macrophages.
2.4 Isolation des macrophages péritonéaux
Les macrophages péritonéaux résidants ont été obtenus en perfusant la cavité intra-péritonéale avec 10mlde RPMIlgentamicine (50 flglml)110% SVP. La suspension cellulaire
•
•
•
16 a été centrifugée (900rpm, 10nùD.)et resuspenduedansRPMI/IO% SVF. Les macrophages ont été isolés par adhérence sur plastique (microplaques de 48 puits) suivie d'une incubation de 90 minutes à 37° C/5%C02• Les macrophages inflammatoires ont été récoltés 5 jours après une injection intra-péritonéale de 1mlde protéose-peptone 10%.
2.5 Essai de bactéricidiein vitro
La méthode de baetériciclie a été adaptée d'une procédure publiée précédemment (GERVAISetal1986). Les macrophages ont été distribués dans des plaques de culture de 48 puits (Fisher Scientific, Pittsburg, Pa) à raison de 5 X lOS cellules/puits. Les cellules adhérentes ont été infectées avec 2.5 X106bactéries tsmPA. Ces nombres ont été calculés de manièreàobtenir un ratio bactérie:cellule optimal de 5: 1. Suiteàl'exposition des cellules àtsmPA, les plaques ont été incubées 30 minutes à 37°C/5%C02 afin de permettre la phagocytose. Des puits contenant soit des cellules seules, soit des bactéries seules constituaient les témoins. Lapériode de phagocytose a été terminée en retirant les bactéries extra-cellulaires par 2 lavages consécutifs avec du RPMI maintenu à 37°C. L'activité bactéricide a été déterminée en incubant des cellules pour une période de90minutes suivant le retrait des bactéries extra-cellulaires. La phagocytose et l'activité bactéricide ont été déterminées en lysant les cellules soit immédiatement après la période d'exposition de30
minutes (phagocytose) soit90minutes après le retrait des bactéries (activité bactéricide). La lyse a été obtenue par ajout de 500 Ill/puits d'une solutionstéril~deBSA 0,01% (M/V)dans l'eau distillée. Des dilutions sériées 1110 des lysats cellulaires ont été étalées sur "Trypticase Soy Agar" (TSA) afin de permettre la numération bactérienne intracellulaire. L'activité
•
•
•
bactéricide estexpriméepar la différence entre le nombre de bactéries intracellulaires restantes après la période d'incubation de90minutes et le nombre de bactéries phagocytées pendant les30 premières nùflutes. L'activité bactéricide est exprimée en pourcentage.
2.6 Élimination systémique deP. aeruginosa
L'élimination systémique de la souche thermosensible de P. aeruginosa a été détennmée àla fois chez la souris sensible (DBAl2) et la souris résistante (BALB/c) à l'infection. Une suspension de lOs
cru/ml
dans0,2 Rd de PBS stérile a été injectée par voie intra-veineuse dans la veine latérale de la queue en utilisant des seringues intradermiques munies d'aiguilles 21G. Les souris ont été sacrifiées à30 minutes et 4 heures suivant l'administration de la dose bactérienne. Les animaux étaient d'abord anesthésiés par inhalation d'halothane en doses subléthales puis tués par dislocation cervicale. Le foie et la rate ont été prélevés dans respectivement 8mlet 9 mlde PBS stérile. Les organes étaient conservés sur glace pendant toute la durée de la procédure. Les tissus ont été homogénéisésà vitesse moyenne pendant 30 secondes (homogénéiseur: modèle PT 10/35, Brinkmann Instrument, Mississauga, Ontario, Canada). La population bactérienne contenue dans les tissus a donc été déterminée en étalant des dilutions 10g10 des homogénats sur TSA.
2.7 Instillation intra-trachéale dePseudomonas aeruginosa
Lessouris BALB/c et DBAl2 ont été anesthésiées par une injection intra-musculaire d'un mélange 1: 1 fraîchement préparé de xylazine 2 mg/ml (Rompun, Bayvet Divisio~ Chemogro Limited Etobicoke, Ontario, Canada) et de kétamine hydrochlorure 15 mg/ml
•
•
•
18 (Rogarsetic, Rogar/STB Inc, London, Ontario, Canada). L'anesthésique était administré à
raison de 0,24à0,3 ml(xylazineOA8 mg/20 g souris; kétamine 3.6 mg/20 g souris)àl'aide d'une seringue à insuline jetable. Les souris ont alors été rasées avec une lame de bistouri neuve, selon les recommandations du "Canadian Animal Care Committee" et la zone chirurgicale a été nettoyée par frictionàl'éthanol 70%. Latrachée a été exposée directement par une incision cervicale médiane. L'animal a été intubé par voie oro-trachéale en utilisant un cathéter intraveineux (22G) (Criticon, Tampa, Fla) relié à une seringue de 250 Jll (Hamilton Co, Reno, Nev). Un volume de 50 J.11 de suspension bactérienne a été injecté dans les voies aériennes, suivi immédiatement d'une ventilation d'un volume de 50 Jil. Après l'inoculation, le muscle a d'abord été suturé avec un noeud simple et l'incision a été refermée avec une suture double effectuée avec du fil monofilament de nylon [CE4] Dermalon 5.0; Davis &Geck, Cyanamid Canada Inc, Montréal, Québec, Canada. (MORISSETTEet al,
1995) La zone chirurgicale a ensuite été fiietionnée avec une solution de proviodine (Rougier, Chambly, Québec, Canada)afin d'éviter le développement d'une infection post-chirurgicale. Les animaux ont été enveloppés dans une gaze stérile de manière à éviter l'hypothermie causée par une réaction aux agents anesthésiants.
2.8 Détermination de la population bactérienne dans les poumons
Les poumons ont été excisés après 30 minutes, 2h,4 h , 6 h, 8h, 18 h et 24 h suivant l'infection intra..trachéale et placés immédiatement dans 9 mI de PBS stérile froid. Les poumons ont été homogénéisés et des dilutions 10g10 ont été étalées sur TSA tel que décrit plus haut pour le foie et la rate.
•
•
•
2.9 Lavage broncho-alvéolaire et numération ceUulaire
Lessouris ont été anesthésiées par inhalation d'halothane et sacrifiées par dislocation cervicale. Les souris ont alors été dénudées et la cavité thoracique a été ouverte. La trachée aétéligaturée et canulée avec un cathéter intraveineu.'C de 22G connectéàdeux seringues de
la
mlvia une valve à trois branches (Namic, Giens Falls, NY). Les poumons ont été lavés avec un volume total de 5 ml de PBSIEDTA 0,05% par aliquots de 1 ml. Les fluides de lavages broncho-alvéolaires (FLBA) ont été centrifugés à900 rpm pendant 10 minutes (centrifugeuse Beckman) et les cellules ont été resuspendues dans du PBS stérile, exempt d'endotoxine. Le nombre total de cellules a été déterminé par numération nucléaireà['aide de la solution de Turk. Les comptes différentiels ont été déterminés en faisant adhérer sur lame de verre 100 III de suspension cellulaire à l'aide d'une centrifugeuse Cytospin (Shanden Southem Products Limited, Cheshire, United Kingdom). Les types cellulaires ont été recensés par examen microscopique (microscope optique: Nikon Canadame., Mississauga, Ontario, Canada)àla suite d'une coloration différentielle (Diff-Quick, American Scientific Produets, McGraw Park, Dl).2.10 Purification des surnageants d'homogénats
Les cytokines ont été mesurées dans la phase soluble des homogénats de poumons. Les phases soluble des homogénats ont donc été purifiés par centrifugations et filtrations séquentielles de manière à éliminer les débris cellulaires. Dans un premier temps, les homogénats ont été centrifugésà2 000 rpm à 4°C pendant 30 minutes. Les sumageants ont
•
•
•
20
été transférés dans de nouveaux tubes et centrifugés à 2 500 rpm à 4°C pendant 30 minutes. Les sumageants ont alors été filtrés successivement sur des ultra-filtres d'acétate de cellulose Acrodisc (Gelman Science, AnnArbor, MI) deS1lIn, 0,45 Jlm et0,22 Ilm. Les sumageants ont été aliquotés et congelés à - 70°C jusqu'à la mesure des cytokines. Au moment de la quantification, des aliquots ont rapidement été dégelés dans un bain à 37°C puis centrifugés à vitesse maximale pendant 5 minutes à 40
C dans une microcentrifugeuse (Fisher Scientific, modèle 23 SC, Pittsburg, Pa).
2.11 Quantification de l'IFNy par ELISA
La concentration d'IFNy présente dans le tissu pulmonaire après infection endobronchique au tsmPA a été mesurée dans la phase soluble des homogénats de poumons par une méthode ELISA Des plaques ELISA de 96 puits (Immulon II, Fisher Scîentific, Pittsburg, Pa) àfond en U ont été recouvertes d'un anticorps monoclonal, anti-IFNyDB-lmAb de hamster (BioSource International, Camarillo, CA) à une concentration de 2 Jlglml PBS, 50 Ill/puits. Les plaques ont été incubées à4°C pendant 12 à 16 heures avant d'être rincées 3 fois avec un tampon de lavage composé de PBS additionné de 0,1% Tween 20 (pBSrr20). Les sites non adsorbés ont été bloqués avec une solution de blocage: PBSff20 +1%BSA Environ 250 JlIde cette solution ont été ajoutés à chaque puits et les plaques ont été incubées àla température de la pièce pendant 1 heure avant d'être lavées 3 fois avec
PBSrr20. Les standards ont été dilués dans la solution de blocage (pBSrr20/BSA). Pour les standards, un IFNy recombinant (Genzyme, Cambridge, MA) a été dilué de 64 U/mlà 0,25 U/ml en dilution doublante. Les sumageants des homogénats ont été utilisés tels quels,
•
•
•
sans dilution. CinquanteI.dde chaque standardetde chaque échantillon ont été disposés dans les puits en duplicata. Les plaques ont été incubées de 12à 16 heures à40
C. Après un lavage répété 3 fois avec PBSff20, 50 JlI d'une dilution 1/1800dansPBSrr20 d'une solution d'anticorps polyclonaux de lapin anti-IFNy de souris (gracieusement fournie par Dr M.M. Stevenson, MGH Research Institute, Montréal, Québec, Canada). Les plaques ont été incubées 1 heureàla température de la pièce. Trois lavages avec PBSrr20 ontànouveau précédé l'addition de 50 IlVpuits d'anti-IgG de lapin provenant de la chèvre et conjuguéàla peroxydase ''Horseradish'' (Biorad, Mississauga, Ontario, Canada). L'anticorps conjugué a étéutilisé dansune dilution 113000dansle PBS!f20. Lesplaques ontànouveau été incubées àla température de la pièce pendant une heure puis lavées 3 fois avec PBSrr20, 100 JlVpuits d'ABTS (Boehringer Mannheim,Laval,Québec, Canada) fraîchement préparéà1 mg/ml dans le tampon recommandé par le fabriquant (Boehringer Mannheim) ont été disposés dans les puits et les plaques ont été incubées à la température de la pièce à l'abri de la lumière, jusqu'au développement de la coloration verte. Ladensité optique a été lueàÂ= 405 nm
avec référence àÀ= 492 om.
2.12Quantificationdu TNFa parELISA
LeTNF" contenu dans la phase soluble des homogénats de poumons a été quantifié, d'abord par une méthode ELISA développée dans le laboratoire puis à l'aide d'une trousse commerciale (BioSource International, Camarillo, CA). Les puits des plaques ELISA ont été recouvertes d'un anti-TNFa de hamster monoclonal (Genzyme, Cambridge, ~fA) àune concentration de 2Ilglmlde PHS, 50 JlVpuits. Les plaques ont été incubées de 12à16 heures
•
•
•
22
à 4°C. Entre chaque étape, les puits ont été lavés 3 fois avec une solution de PBS additionnée de 0,05% Tween 20 (PBSrr20). Le standard deTNParecombinant (Genzyme,
Cambridge, MA) a été dilué en dilution doublante de 64li/ml à 0,5 U/ml dans PBSrr20. Les
échantillons ont été dilués 115 dans PBSrr20. Cinquante ,.11 de chaque échantillon et de
chaque standard ont été distribués en duplicata dans chaque puits et les plaques ont été
incubéesà 4 oC pendant 12 à 16 heures. Lessites non spécifiques ont été bloqués en incubant
les plaquesà la température de la pièce pendant 30 minutes avec une solution PBSff20+ 1% lactalbumine, 250 J1l1puits. Une solution 1/1800 d'anticorps polyclonaux anti-TNFŒ de lapin
(M.M. Stevenson, MGR Research Institute, Montréal, Québec, Canada) a été distribuéeà raison de 50 Ill/puits et les plaques ont été incubéesà la température de la pièce pendant 2
heures. Le signal a été amplifié de la même manière que pour l'IFNy. Les conditions du développement de la coloration et la lecture de la densité optique sont les mêmes que
mentionnées ci-haut pour la quantification de l'IFNy.
2.13Quantificationde l'IL-IJl, IL-4, IL-6, IL-IO, Mcp...l et GM-CSF
Lescytokines pro-infIammatoires:n..-l~, IL-6 et MCP-l, de même que les cytokines anti-inflammatoires: IL4 et IL... IO ont été mesurées à l'aide de trousses commerciales (BioSource, Camarillo, CA). Le GM-CSF a été mesuré en utilisant une trousse de la
compagnie Endogen, (Woburn, MA). Toutes ces cytokines ont été mesurées dans la phase
soluble des homogénats de poumons après infection au tsmPA suivant la procédure suggérée
•
•
•
2..14 Mesure du nitrite/nitrate
La production de monoxyde d'azote (NO) a été quantifiée en mesurant les intermédiaires réactifs dérivés de l'oxydation du radical libre, soit les ions nitrite(NO;)et nitrate (NO]-) par la méthode colorimétrique de Greiss. Cependant, puisque le réactif de Greiss ne réagit pas avec le nitrate et qu'en présence d'oxygène, le nitrite dérivé de
l'oxydation du NO subit une seconde oxydation qui conduit à la fonnation de nitrate, ilest
essentiel de réduire ce dernier selon un procédé enzymatique.
Dans un premier temps, 300 ,.Llde chaque échantillon ont été traités avec 30 IIIde
nitrate réductased'Aspergillus à une concentration de 0,01 U/ml (Sigma, St-Louis, Mo) et
30 fll de NADPH 100 flM (Sigma, St-Louis, Mo). Les tubes ont été incubés dans le noirà la température de la pièce pendant 12à16 heures. Par la suite, 600 III du réactif de Greiss (1% sulfanilamide dans l'acide acétique 30% et 0,1% de dihydrochlorure de
N-(I-naphtyl)éthylènediamine (tous de Sigma) dans l'acide acétique60% dans un ratio 1: 1) ont été ajoutés. L'absorbance a été mesuréeàÀ
=
570 nm. La concentration de nitrite/nitrate a été détenninéeà['aide d'une courbe standard de nitrate de sodium (Fisher Scientific, Pittsburg, Pa) traitéeàla nitrate réductase tel que mentionné ci-haut. La courbe standard s'est avérée linéaire de 0,64 flM à400 flM. Puisque le nitrite/nitrate a été mesuré dans les sumageants d'homogénats et que ceux-ci peuvent présenter une coloration de base variable d'un•
•
•
24
en contact avec le réactif sans toutefois avoir préalablement été traité avec la nitrate réductase, de la valeur de l'absorbance lue après la réaction de Greiss.
2.15 Statistiques
La portée de la différence entre les groupes de données a été analysée en utilisant le testtde Student. Lescalculsontétéeffectuésàpartir du chiffrier électronique SigmaPlot 1.0 de Jandel Scientific pour Windows et QuattroPro 5.0 pour Windows.
•
•
•
m.
RÉSULTATS3.1 Implication des cellules mononucléaires
Afin de vérifier l'implication des cellules mononucléaires dans l'élimination de la bactérie P. aeruginosa dans les voies respiratoires, nous avons exposé in vitro des macrophages résidants et inflammatoires à une souche thermosensible de Pseudomonas
aeruginosa. L'expérience a été répétée pour les macrophages pulmonaires alvéolaires et interstitiels. Les macrophages alvéolaires représentent la première ligne de défense contre l'infection par un pathogène pulmonaire. Nous avons donc vérifié si l'activité bactéricide du macrophage alvéolaire per se pouvait être responsable de la différence dans le contrôle de l'invasion par Pseudomonas chez les souris résistantes et sensibles, aussi bien au niveau de l'importance de la multiplication bactérierme que de la cinétique de prolifération bactérienne. Les macrophages alvéolaires résidants et inflammatoires ont été obtenus de chacune des lignées de souris résistantesetsensibles afin de détenniner,in vitro, leur fonction bactéricide en présence de tsmPA. Lafonction bactéricide des macrophages pulmonaires interstitiels a également été vérifiée. Les activités bactéricides des macrophages pulmonaires ont été comparées à celles des macrophages péritonéaux résidants et inflammatoires. Lafonction bactéricide d~jàbien connue de ces cellules pennet une référence fiable. L'utilisation d'une souche bactérienne thermosensible (ne se multipliant pasà 37°C) nous pennet de d'évaluer les premières étapes de phagocytose et de bactéricidie par les cellules phagocytaires, tels les macrophagesetles polymorphonucléaires, sans interférence avec la prolifération bactérienne qui se produirait nonnalement avec une souche sauvage.
•
•
•
26
Tel que présenté à la figure 2A, les macrophages alvéolaires résidants et inflammatoires obtenus des animaux résistants comme des animaux sensibles montrent une
phagocytose et une fonction bactéricide in vitro similaires. Le pouvoir bactéricide des
macrophages pulmonaires interstitiels, qu'ils soient résidants ou inflammatoires, est
comparable chez les souris résistantes et sensibles (Figure 2B). De plus, les macrophages
pulmonaires inflammatoires n'ont pas montré d'augmentation significative quant àleur activité bactéricide comparativement à celle observée pour les macrophages pulmonaires résidants. Toutefois lorsque l'on compare l'activité bactéricide des macrophages péritonéaux
inflammatoires et résidants, on voit une activité bactéricide accrue chez les macrophages
péritonéaux inflammatoires. De plus, les macrophages péritonéaux inflammatoires ont une
activité bactéricide significativement supérieure (P = 0,0001 à 0,015) à celle des macrophages pulmonaires inflammatoires lorsqu'ils sont exposésàtsmPA (Figure 2C). Ceci suggère fortement que la capacité des macrophages à tuerPseudomonas aeruginosavarie
selon leur site d'origine. Ceci a été démontré pour d'autres systèmes bactériens tels que
Listeria monocytogenes(GERVAIS et al, 1986). Cependant, aucune différence d'activité
bactéricide n'a été observée entre les animaux sensibles et résistants lorsque ['on comparait
un même type de macrophage.
3.2 Élimination deP. aeruginosalors d'infections systémiques et pulmonaires
Les résultats obtenus lors de la série d'expériencesin vitro suggèrent que l'activité
bactéricide des macrophages pulmonairesper se ne peut être responsable de la variation
Inflammatoires BALB/e DBAl2
o
--'---6 ~ 5.~
~
4 ~ 3Ëi
2 U ~ 1 ~ BALBle DBA/2 Résidants o~-6~
5 ·5 ~ 4~
~ 3~
2 U co ~ 1-•
B) MACROPHAGES INTERSTITIELS
Résidants Inflammatoires•
o~-BALB/e DBA/2 BALB/e DBAl2
C) MACROPHAGES INTRAPÉRITONÉAUX
Résidants Inflammatoires BALB/e DBA/2o
--'---BALB/e DBA/2 6•
•
•
27
Figure 2 Étude in vitro de l'implication des macrophages dans la défense contre
Pseudomonas aeruginosa. Les activités phagocytiques et bactéricides des macrophages alvéolaires (A) et interstitiels (B), résidants et inflammatoires, ont été déterminésin vitroà l'aide du tsmPA Les activités bactéricides ont été comparées avec celles des macrophages péritonéaux (C). Lesrésultats sont exprimés en valeurs moyennes ± déviation standard (n= 3). Chaque n a été mesuré en triplicata. Les chifües apparaissant au-dessus des barres représentent l'activité bactéricide exprimée selon la différence entre le nombre de bactéries restant dans la cellule après 90 minutes et le nombre de bactéries phagocytées pendant les 30 premières minutes. Les barres noires illustrent la phagocytose alors que les barres grises représentent le nombre de bactéries restantes (après 90 minutes).
•
•
•
aeruginosa. Cependant, ces études in vitro ne sont pas un corollaire exact de ce qui se produit in vivo où nombre de cytokines et de chimiokinesysont impliquées. Ces dernières modulent les fonctions phagocytiques et bactéricides des cellules inflammatoires. Nous avons donc déterminé in vivo l'activité bactéricide des cellules alvéolaires en mesurant l'efficacité des phagocytes àéradiquer une infection endobronchique à tsmPA. Les résultats ont été comparés entre les animaux résistants et sensibles. Puis, nous avons comparé l'activité bactéricide in vivo des phagocytes pulmonaires avec celle des macrophages du foie et de la rate suivant une infection intra-veineuse avec tsmPA. Cette comparaison nous a permis de déterminer si les mécanismes d'éradication de la bactérie diffèrent selon le type d'infection induite, systénùque ou locale. Encore une fois, la souche mutante thermosensible de PA a été choisieafin d'éviter la multiplication interne de la bactérie, pennettant ainsi une étude plus claire de l'efficacité de la phagocytose et de l'élimination de la bactérie sans avoir à compenser pour la multiplication normale de la bactérie.
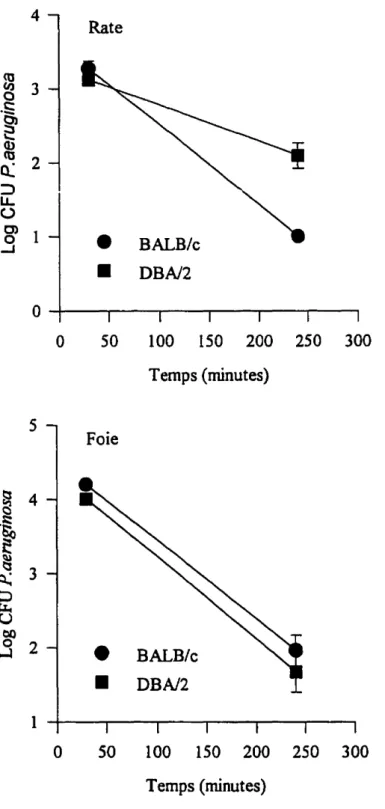
Tel que le démontre la figure 3, l'invasion du foie et de la rate par la bactérie est similaire chez les animaux résistants et sensibles 30 minutes suivant l'infection par injection intra-veineuse de tsmPA Dans le tissu hépatique, les souris résistantes et les souris sensibles ont montré une cinétique de clairance similaire. Par contre, dans le tissu splénique, une différence significative dans la vitesse d'élimination de l'agent pathogène a été observée entre les souris résistantes et sensibles. Les souris de la lignée BALB/c ont efficacement éliminé la bactérie en 4 heures alors que les souris DBAl2 se sont montrées moins efficaces quantà l'initiation de la bactéricidie(P=0,037). Lorsque les souris ont été infectées par voie intra-trachéale, les macrophages alvéolaires résidants des souris résistantes et sensibles n'ont pas
29
•
4 Ratem
3 0 .S ~ \.;. Q) <u 2 ct: :::> LL U CD 1 0•
BALB/c -J•
DBAJ2 0 0 50 100 ISO 200 250 300 Temps (minutes) 5 Foie•
~ 4 0 .~~
3 ~ ::J ~ U eo 0 2•
~ BALB/c•
DBA/2 1 0 50 100 150 200 250 300 Temps (minutes)Figure 3. Clairance du tsmPA dans les tissus spléniques et hépatiques après une infection systémique par voie intra-veineuse.
n
=
3, les résultats sont exprimés en valeurs moyennes ± déviation standard.•
•
5,5~
5,4 ~ C5 .~ 5,3t:
~ 5,2 ~~
U 5,1 00 0•
BALB/e ~ 5,0•
DBAl2 4,9 0 50 100 150 200 250 300•
Temps (minutes)Figure 4. Étude in vivo de la réponse bactéricide des macrophages pulmonaires résidents suite à une infection endobronchique à tsmPA.
n
=
3, les résultats sont exprimés en valeurs moyennes± déviation standard.•
•
•
31
montré d'activité bactéricidein vivo puisqu'aucune diminution de la population bactérienne
n'a été observée dans les 4 premières heures de l'infection (Figure 4). En contre-partie, lors
de l'infection systémique précoce, les phagocytes du foie et de la rate sont en mesure de tuer
la bactérie facilement (Figure 3). Ces résultats supportent les données obtenues lors des
essais in vitro suggérant que l'activité bactéricide des phagocytes varie selon le site
physiologique.
3.3 Étude du profil de la défense cellulaire lors d'une infection eodobronchique
Après l'infection des souris avec tsmPA par voie intra-trachéale, l'activité bactéricide
a été déterminée àdifférents intervalles de temps suivant l'instillation. Des intervalles précoces (30 minutes, 2 et 4 heures) ont été choisis afin de déterminer l'habilité des
macrophages alvéolaires résidantsà tuerPseudomonas aenlgfnosa, alors que des temps un
peu plus tardifs (6, 8, 18 et 24 heures) ont été ciblés afin de déterminer si le recrutement de
cellules polymorphonucIéaires (PMN) était responsable de la clairance de l'infection. Les
résultats de la figure 5 montrent que l'élimination du tsmPA a été initiée seulement après le
recrutement des PMNs dans l'espace alvéolaire. Labaetéricidie a été initiée entre 4 et 6
heures (Figure SA) suivant l'infection chez les sourisBALBlccorrespondant au moment du
recrutement des PMNs dans l'espace alvéolaire (Figure 5B). Toutefois, le recrutement de
PMNs dans l'espace alvéolaire a été retardé d'environ 2 heures chez les souris DBAl2
comparativement aux souris BALB/c. La population bactérienne contenue dans les voies
respiratoires des souris DBA/2 est donc demeurée inchangée durant les 6 premières heures
•
A) 6 ~ 5 <::) .~t:
4 ~...
~
...
-.-
.
~ 3fi
u ~... bQ 2 0 ~ 1•
0 0 10 20 30 40 50 100B)
... 80 ...•<
CQ•
~
60 fi) ~ fi) ;j 40 "0 fi) - - - - BALBle~
20....•...
Q.,. DBA/2 '$.. 0...•
o
10 20 30 40 50 Temps (heures)•
Figure 5. Étude du profd de la défense cellulaire lors d'une infection endobronchique
àtsmPA. Le panneauAreprésente la population bactérienne quantifiée dansdes homogénats
de poumons (n
=
10) de souris BALB/e et DBA/2 infectées par voie intra-trachéale avectsmPA. Le panneau B représente le recrutement neutrophilique à6, 8, 18 et 24 heures
•
•
•
33
vers 6 heures suivant l'instillation. Les courbes de numération bactérienne (Figure SA) montrent clairement que le profil de la défense anti-Pseudomonas diffère entre la lignée résistante (BALB/c) et la lignée sensible (DBA/2). Donc, de manière générale, les résultats montrent que le début de l'élilnination de la bactérie des voies respiratoires correspond à l'influx neutrophilique dans l'espace alvéolaire.
3.4 Effet du TNFœ sur la réponse inflammatoire chez les souris sensibles infectées
Le TNFa favorise le recrutement et l'activation des phagocytes inflammatoires. Gosselin et collaborateurs (GOSSELIN et al 1995) ont montré que les souris résistantes
(BALB/c) produisaient de plus fortes concentrations deTNFadans les fluides des LBA que celles retrouvées chez les souris sensibles DBA/2. Notre observation selon laquelle les souris DBA/2 montraient un délais de recrutement de P1vINs nous a amenésàvérifier si leTNFa joue un rôle dans l'amplitude de la réponse inflammatoire dans le poumon. Du TNFœ recombinant (500 U par souris, Genzyme, Cambridge, Ma) a été instillé par voie intratrachéale conjointement avec le tsmPA chez la souris sensible DBA/2 afin de déterminer si -la présence de TNFcx au site d'infection, etàune concentration similaireàce qui est observé chez les souris résistantes, peut affecter le recrutement précoce des PMNs dans les voies respiratoires. Les souris DBA/2 ayant reçu le TNFœ avec le tsmPA ont montré une infiltration de PMNs au site inflanunatoire plus élevée que les souris infectées sans traitement concomitant auTNFa.À8 heures suivant l'infection nous avons obtenu Il,3 X lOSet 3,9 X
•
Tableau 2Effet du traitement auTNFu sur l'infection endobroncb.iqueàP.
aeruginosa
chez les souris sensibles DBA/2·Lignéemurine
et traitement 30 min 6 h 8b 18 h 24 h
A) Suppression de la bactérie (diminution en loglo de la population bactérienne)
DBA/2 + tsmPA nab O.4±O.2 -O.5±O.4 -2.3±O.9 -3.0±O.3
DBA/2 + tsmPA
+
TNFa na O.3±O.1 -O.2±O.S -2.8±O.4 -3.9±O.3 BALB/c+
tsmPA na -O.5±O.1 -1.6±O.2 -4.0±O.4 éliminée B) Proille de la réponse inflammatoire (%Pl\fNs)a) Les souris ont été infectées par voie intra-trachéale avec 105bactéries/souris (tsmPA) et
ont été traitées ou non avec 500 U deTNFa. Lessouris (n=3 par groupe) ont été sacrifiées àdifférents intervalles. Lacinétique de l'éradication du tsmPA a été détenninée dans des homogénats de poumons et sont exprimés en variations 10g10 de CFU par rapport au compte obtenuà30min. Laréponse inflammatoire a été détenninée parallèlement sur une série de souris différentes (n=3 par groupe) Les fluides de LBA ont été récoltés et le pourcentage de PMNs dans les FLBA a été déterminé tel que décrit dans la section Matériel et méthodes. Les valeurs sont exprimées en moyennes± déviation standard.
b)na= non applicable
•
•
DBA/2 + tsmPA 0
DBA/2 + tsmPA
+
TNFa 0BALB/c +tsmPA 0
o
18±13 38±3 58±19 SO±17 83±3 93±1 85±16 91±1 89±5 89±5 87±2•
•
•
35 Dix-huit à 24 heures suivant l'infection, nous avons obtenus 29,4 X lOset 14,9 X lOscellules, respectivement (Tableau 2). L'amplitude de la réponse inflammatoire obtenue chez les souris DBAl2 traitées auTNFa était similaire à ceDe obtenue chez les sourisBALBlcnon traitées. Tel que présenté au Tableau 2, les souris DBAl2 inoculées avec tsmPA et le TNFa; ont montré un influx neutrophilique dans l'espace broncho-alvéolaire plus précoce. Fait surprenant, malgré que le traitement au TNPa favorise le recrutement, la bactéricidie n'en est pas davantage initiée. Elle demeure inchangée si on compare avec les souris DBAl2 normales. En effet, les souris infectées au tsmPA avec traitement auTNFŒ n'ont montré
qu'une légère augmentation de la clairance de la bactérie comparativement aux souris infectées sans traitement. Par ailleurs, les sourisBALB/cont initiée l'élimination bactérienne dès 6 heures suivant l'infection.
3.5 Production du TNFadans les tissus pulmonaires.
En nous appuyant sur les résultats obtenus lors du traitement des sourisDBAl2 avec leTNFa ainsi que des travaux de GOSSELIN et al (1995), nous avons voulu vérifier la
cinétique de même que l'amplitude de la production de TNFa dans le tissu pulmonaire lors d'uneinf~1ionà Pseudomonas aeroginosachez les souris sensibles et les souris résistantes. Des souris BALB/e (résistantes) et DBA/2 (sensibles) ont été infectées par voie intra-trachéale avec 105CFU/sourisde tsmPA selon la procédure décrite dans la section Matériel etméthodes. À différents intervalles dans la phase précoce de l'infection, les souris ont été sacrifiées et les poumons ont été excisés puis homogénéisés. Le TNFa; a été quantifié dans la phase soluble des homogénatsà l'aide d'une méthode ELISA. Les résultats montrent une
p==0,027 36 _______1 BALB/c ~ DBA/2
8
18
24
64
p=
0,118 p=
0,0160,5
2
0,0
~3,0
S
~2,5
"'0 ~c:2,0
1h
o]
1,5
en ~5
1,0
"'0~
0,5
A)•
Temps après l'infection au tsmPA (heures)
3,5
•
B)2,5
2,0
1,5
~1,0
"'0~
0,5
0,0
ncnves
0,5 2
4
6
c=J
BALB/c ~ DBA/28
18
24
Temps après ['instillation de PBS (heures)
•
Figure 6. Production du TNFu dans les tissus pulmonaires des souris résistantes et sensibles infectées parle tsmPA. Les souris(0
=
4 à n=
14) ont été infectées par voie intra-trachéale avec le tsmPA Les poumons ont été prélevés et homogénéisés et le TNF produit a été mesuré dans la phase soluble des homogénats. Les résultats sont comparés à ceux obtenusdansles tissus pulmonaires de souris instillés avec du PBS stérile (n= 2 à n=4). Les naïves (n= 4) n'ont été soumises à aucune procédure chirurgicale.•
•
•
37
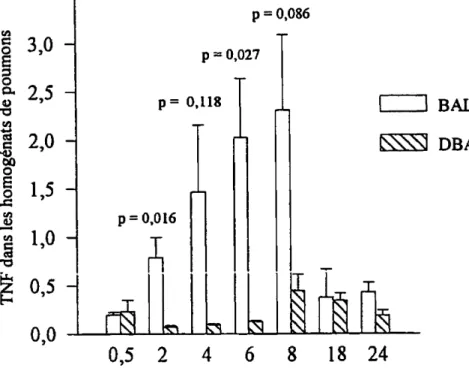
augmentation significative de la production de TNP dans le poumon chez la sourisBALB/c
(Figure 6). Cette production augmente graduellement pour atteindre un maximum après envirion 8 heures d'infection. LetauxdeTNFaretourne à la normale vers 18 heures suivant l'inoculation du tsmPA Lorsque l'on compare ces résultats avec les souris témoins qui n'ont reçu que50~Ide PBS stérile,ilapparaît clairement que cette augmentationestassociéeàla présence de la bactérie dans les voies respiratoires puisque la procédure chirurgicaleper se
n'induit pas la production de TNF chez la BALB/c. Par contre, les animaux sensibles (DBA/2) n'ont montré aucune production significative de TNFa en présence de tsmPA. Lorsque l'on compare les souris de la lignée BALB/c et DBA/2, la différence quant à 1)amplitude de la réponse au tsmPAeststatistiquement significative aussi tôt que 2 heures suivant l'infection (p
=
0,016)et demeure ainsi, jusqu'à 8 heures(p=
0,086).3.6 Étude de la production des médiateurs impliqués dans la cascade du TNF
3.6.1 Production de monoxyde d'azote dans les tissus pulmonaires
Il est connu que le TNP peut agir sur le recrutement et l'activation des cellules -immunitaires de manière indirecte par la stimulation de la production de chimiokines et de radicaux libres tels que le monoxyde d'azote (NO) (MONCADAet al1991). Le NO est un radical libre reconnu pour avoir des effets bactéricides.