ÉTUDE DU POTENTIEL NUTRACEUTIQUE DES FIBRES
DE CANNEBERGE ET DE BLEUET
Thèse
Jérémie Barchechath
Doctorat en sciences et technologie des aliments
Philosophiæ doctor (Ph.D.)
Québec, Canada
© Jérémie Barchechath, 2014
Résumé
Les résidus fibreux de canneberge et de bleuet issus du processus d’extraction des polyphénols ont été étudiés pour tenter de les valoriser pour des applications nutraceutiques. Ces travaux se sont plus précisément intéressés aux fibres alimentaires et à leurs polyphénols associés. Ces deux composantes sont reconnues pour leurs effets positifs sur le système digestif dont notamment le maintien de la santé de la flore intestinale. Les résidus fibreux de canneberge et de bleuet obtenus en laboratoire ont été caractérisés pour leurs contenus en polysaccharides non-amidonnés totaux (54,3% pour la canneberge et 46,5% pour le bleuet), solubles (respectivement 21,9% et 21,5%), insolubles (respectivement 32,4% et 25%) et leurs compositions respectives en monosaccharides. Les mesures rhéologiques des fibres (capacité de rétention d’eau, d’huile, capacité de gonflement et viscosité) ont montré des propriétés physiques avantageuses en comparaison à d’autres types de fibres. Le contenu en proanthocyanidines non-extractibles fut alors mesuré par lecture spectrophotométrique (1,3% pour les fibres de canneberge et 2,4% pour celles de bleuet). Une technique utilisant un agent chaotrope fut spécifiquement développée pour obtenir une fraction significativement réduite en polyphénols (contenant respectivement 0,6% et 0,9% de proanthocyanidines). Les fibres brutes et réduites en polyphénols ont alors été administrées à des souris pour tester leurs impacts respectifs sur la flore intestinale. L’ajout de fibres brutes a fait augmenter la concentration de Clostridium coccoides et de Clostridium leptum et diminuer le compte de Lactobacillus alors que celui de Faecalibacterium praunsnitzii a uniquement augmenté avec les fibres réduites en polyphénols mettant en avant un probable effet inhibiteur des polyphénols sur F. prausnitzii. Des souches probiotiques ont alors été cultivées in vitro avec des fibres natives et réduites en proanthocyanidines. Un effet bifidogène ainsi qu’une augmentation de la croissance de Lactobacillus salivarius ont été observés lors de l’ajout de fibres de canneberge et de bleuet. Selon le type de bactérie, les effets différentiels observés avec les fibres brutes ou réduites en proanthocyanidines montrent la capacité de la flore à métaboliser les polysaccharides et leurs polyphénols associés mais aussi un potentiel effet inhibiteur des composés phénoliques. Les fibres de canneberge et de bleuet pourraient ainsi constituer des prébiotiques favorisant indirectement la réduction du risque lié à certaines maladies chroniques intestinales.
Abstract
The process of polyphenol extraction from cranberry and blueberry yields a fibrous matter that was studied for a potential valorization in nutraceutical applications. More precisely, this work focuses on the dietary fiber content and its associated polyphenols. These two compounds were acknowledged for their positive effects over the gastro-intestinal tract including the preservation of a healthy colonic microbiota. The polyphenol extraction process was replicated in laboratory in order to obtain cranberry and blueberry fibrous matter. These extracts were analysed for their contents in total non-starch polysaccharides (NSP) (54,3% for cranberry and 46,5% for blueberry), soluble NSP (respectively 21,9% and 21,5%), insoluble NSP (respectively 32,4% and 25%) and their respective monosaccharides composition. Rheological measurements (water and oil retention capacities, swelling capacity and viscosity) showed advantageous physical properties compared to other types of fibers. Subsequently, the non-extractable proanthocyanidins contents were quantified by spectrophotometric reading (1,3% for cranberry fibers and 2,4% for blueberry fibers). A method, employing a chaotropic agent, was specifically designed to produce fibers with a significantly reduced content in non-extractable proanthocyanidins (respectively containing 0,6% and 0,9% of PAC). Both native and modified fibers were fed to mice in order to assess their respective impact on intestinal flora. The addition of native fibers was associated with an increase in the concentration of Clostridium coccoides and Clostridium leptum and a diminution of the count of Lactobacillus whereas the concentration of Faecalibacterium praunsnitzii was exclusively increased by the use of fibers reduced in polyphenols. This observation highlighted a potential inhibitory effect of polyphenols on F. prausnitzii. Probiotics strains were therefore cultured in vitro with native and modified fibers. A bifidogenic effect and an increase of the Lactobacillus salivarius concentration were observed when substrate was cranberry or blueberry fibers. According to the type of bacteria, the differential effect monitored between native and proanthocyanidins reduced fibers underlies the flora capacity to metabolize fibers and their associated polyphenols and also a potential inhibitory effect from phenolic compounds. The cranberry and blueberry fibers could therefore constitute prebiotics that favor indirectly the reduction of gastro-intestinal diseases risks.
Table des matières
RÉSUMÉ ... III ABSTRACT ... V TABLE DES MATIÈRES ... VII LISTE DES TABLEAUX ... XI LISTE DES FIGURES ... XIII LISTE DES ABREVIATIONS ... XVII REMERCIEMENTS ... XXI AVANT-PROPOS ... XXIII
INTRODUCTION ... 1
1 CHAPITRE I REVUE DE LITTÉRATURE ... 3
1.1 LES PAROIS VÉGÉTALES : SOURCES DE FIBRES ALIMENTAIRES ET DE POLYPHÉNOLS ... 3
1.1.1 Caractéristiques chimiques des parois cellulaires végétales ... 3
1.1.2 Le concept des fibres alimentaires ... 5
1.1.2.1 La définition controversée des fibres alimentaires ... 5
1.1.2.2 Quantifier les fibres alimentaires ... 6
1.1.3 Les composés phénoliques ... 8
1.1.4 Les polyphénols de la canneberge et du bleuet ... 9
1.1.5 Interactions fibres alimentaires - polyphénols ... 10
1.1.6 Polyphénols extractibles et non-extractibles ... 13
1.2 LES ACTIONS POLYVALENTES DES FIBRES ALIMENTAIRES ET DES POLYPHÉNOLS SUR LA SANTÉ ... 15
1.2.1 Effets et modes d’action des fibres alimentaires ... 15
1.2.1.1 Diabète et maladies cardiovasculaires ... 15
1.2.1.1.1 Diabète ... 15
1.2.1.1.2 Maladies cardio-vasculaires ... 16
1.2.1.2 Régulation du métabolisme des stérols ... 17
1.2.1.2.1 Effets observés des fibres alimentaires sur le cholestérol et les lipides ... 17
1.2.1.2.2 Mécanisme de la réduction du cholestérol et des lipides ... 18
1.2.1.3 Obésité ... 19
1.2.1.4 Maladies inflammatoires chroniques gastro-intestinales ... 21
1.2.1.5 Constipation et transit intestinal ... 21
1.2.1.6 Système immunitaire ... 22
1.2.1.7 Modification de la flore intestinale ... 23
1.2.1.8 Mesurer les caractéristiques physico-chimiques des fibres alimentaires ... 23
1.2.2 Influence générale des polyphénols sur la santé ... 24
1.2.2.1 Action des polyphénols ... 25
1.2.2.2 Maladies cardio-vasculaires ... 25
1.2.2.3 Inflammation et cholestérol ... 26
1.2.2.4 Maladies neuro-dégénératives ... 28
1.2.2.5 Effet anti-cancer ... 28
1.2.2.6 Effet anti-diabète ... 29
1.3.1 Prébiotiques et probiotiques : stratégies pour une flore intestinale équilibrée ... 30
1.3.1.1 Rappel des fonctions de la flore intestinale ... 30
1.3.1.2 Fonctions des probiotiques et implications sur la santé ... 31
1.3.1.3 Les prébiotiques, substrats des probiotiques ... 34
1.3.2 Effets des fibres alimentaires dans le côlon ... 37
1.3.2.1 Conditions environnementales du côlon ... 37
1.3.2.2 Facteurs influençant la fermentation des fibres alimentaires ... 38
1.3.2.3 Production et importance des SCFA ... 39
1.3.3 Interactions entre polyphénols et flore intestinale ... 40
1.3.3.1 Voies métaboliques ... 40
1.3.3.2 Effets des polyphénols sur la population bactérienne du côlon ... 42
1.3.4 Les fibres alimentaires antioxydantes : un concept en développement ... 43
1.3.4.1 Théorie de l’association des fibres alimentaires et des antioxydants ... 43
1.3.4.2 Implications industrielles ... 44
1.3.4.3 Le bleuet et la canneberge : deux matrices potentielles d’ADF ... 45
1.4 PROBLÉMATIQUE, HYPOTHÈSE ET OBJECTIFS ... 46
1.4.1 Problématique ... 46 1.4.2 Hypothèse... 47 1.4.2.1 Hypothèse générale ... 47 1.4.2.2 Hypothèses spécifiques ... 47 1.4.3 Objectifs ... 47 1.4.3.1 Premier objectifs ... 47 1.4.3.2 Second objectifs ... 47 1.4.3.3 Troisième objectifs ... 48
2 CHAPITRE II PHYSICAL AND CHEMICAL COMPARISON OF FIBER RICH FRACTIONS OF CRANBERRY, BLUEBERRY AND RESPECTIVE POMACES ... 49
2.1 RÉSUMÉ ... 51
2.2 ABSTRACT ... 53
2.3 INTRODUCTION ... 55
2.4 MATERIEL AND METHOD ... 55
2.4.1 Sample Preparation ... 55
2.4.2 Extraction and Chromatography ... 56
2.4.3 Chemical analysis ... 57
2.4.3.1 Measurement of total, soluble and non-soluble non–starch polysaccharides (NSP) by GC ... 57
2.4.3.2 Measurement of soluble sugars by HPLC ... 58
2.4.3.3 Measurement of organic acids by HPLC ... 58
2.4.4 Functional properties ... 58
2.4.4.1 Water Retention Capacity (WRC) ... 58
2.4.4.2 Oil Retention Capacity (ORC) ... 59
2.4.4.3 Swelling Capacity (SwC) ... 59
2.4.4.4 Viscosity ... 59
2.4.5 Statistics ... 59
2.5 RESULTS &DISCUSSION ... 59
2.5.1 Specific compositions of extracted fractions ... 59
2.5.1.1 Soluble compounds: sugars and organic acids ... 60
2.5.1.2 Dietary fiber (DF) as NSP ... 60
2.5.1.2.1 Dietary fiber contents ... 60
2.5.1.3 Dietary fiber composition ... 63
2.5.2 Functional properties ... 65
2.5.2.1 Water retention capacity (WRC) ... 65
2.5.2.2 Swelling capacity (SwC) ... 66
2.5.2.3 Viscosity ... 67
2.5.2.4 Oil Retention Capacity (ORC) ... 69
2.6 CONCLUSION ... 71
2.7 ACKNOWLEDGMENT ... 71
3 CHAPITRE III MICE GUT MICROBIOTA IS ALTERED BY BLUEBERRY AND CRANBERRY POLYPHENOLIC FIBERS ... 73
3.1 RÉSUMÉ ... 75
3.2 ABSTRACT ... 77
3.3 INTRODUCTION ... 79
3.4 MATERIAL AND METHODS ... 80
3.4.1 Fibers preparation and analysis ... 80
3.4.1.1 Extraction of dietary fibers from blueberry and cranberry ... 80
3.4.1.2 Extraction of proanthocyanidins from fiber fraction ... 80
3.4.1.3 Fiber quantification ... 80
3.4.1.4 Quantification of proanthocyanidins ... 81
3.4.1.5 Quantification of extracted polyphenols ... 81
3.4.2 Procedure for microbiota experiments ... 81
3.4.2.1 Animals and diets ... 81
3.4.2.2 DNA extraction ... 82
3.4.2.3 Quantitative analysis of fecal microbiota by real-time PCR ... 82
3.4.3 Statistical analysis ... 83
3.5 RESULTS ... 84
3.5.1 Fiber content ... 84
3.5.2 Polyphenols quantification ... 85
3.5.3 Modification of fecal flora by cranberry and blueberry fibers ... 86
3.6 DISCUSSION ... 88
3.6.1 DF composition ... 88
3.6.2 NEPA content ... 88
3.6.3 Effect of fibers fraction on mice microbiota ... 89
3.7 CONCLUSION ... 91
3.8 ACKNOWLEDGMENT ... 91
4 CHAPITRE IV DIFFERENTIAL INFLUENCE OF CRANBERRY AND BLUEBERRY NON-EXTRACTABLE PROCYANIDINS AND DIETARY FIBERS ON PROBIOTICS STRAINS ... 93
4.1 RÉSUMÉ ... 95
4.2 ABSTRACT ... 97
4.3 INTRODUCTION ... 99
4.4 MATERIAL AND METHODS ... 100
4.4.1 Fibers preparation and analysis ... 100
4.4.1.1 Extraction of dietary fibers from blueberry and cranberry ... 100
4.4.1.2 Extraction of proanthocyanidins from fiber concentrate ... 100
4.4.1.3 Quantification of dietary fibers and proanthocyanidins ... 101
4.4.2.1 Bacteria and growth conditions ... 101
4.4.2.2 Growth in MRS-fiber media and bacterial enumeration ... 101
4.4.2.3 qPCR enumeration of bacteria. ... 101 4.4.3 Statistical analysis ... 102 4.5 RESULTS ... 103 4.6 DISCUSSION ... 105 4.7 CONCLUSION ... 107 4.8 AKNOWLEDGMENT ... 108 5 CONCLUSION GÉNÉRALE ... 109
5.1 INTÉRÊTS DES RÉSULTATS ET APPORTS SCIENTIFIQUES ... 109
5.2 LIMITES DES RESULTATS ... 112
5.3 PORTEE DES DECOUVERTES ... 113
5.4 PERSPECTIVES ... 115
Liste des tableaux
Table 1-1 : Principaux polyphénols contenus dans la canneberge et le bleuet ... 9 Table 1-2 : Estimation des substrats fermentescibles atteignant le côlon humain. D’après Egert et al. (2006).35 Table 2-1 : Total NSP, organic acids and soluble sugars content (g/100 g DM of fruit material), and relative proportions of soluble (Sol) and insoluble (Ins) NSP (in weight % of total NSP) and Sol/Ins NSP ratio for NT, RAE and RAC fractions of cranberry, blueberry and their respective pomaces. Figures in brackets represent standard deviations. Similar letters in column indicate no significant difference between values using Fisher’s protected LSD test (p>0,05). Abbreviations: n.d. - not determined; tr. - trace amounts. ... 61 Table 2-2 : Composition of total, soluble and insoluble NSP of cranberry, blueberry and their respective pomaces (g/100 g DM of fruit material). Monosaccharides are expressed as percentage of total NSP (DM). Abbreviations: rha – rhamnose; fuc – fucose; ara – arabinose; xyl – xylose; man – mannose; gal – galactose; glu – glucose; UA – uronic acids; tr - traces amount. Figures in brackets represent standard deviations. Similar letters in column indicate no significant difference using LSD test (p>0,05)... 64 Table 2-3 : Quantity of oil absorbed per g of insoluble NSP for NT and RAE of cranberry, cranberry pomace, blueberry and blueberry pomace. Figures in brackets represent standard deviations. Similar letters in column indicate no significant difference using LSD test (p>0,05). ... 70 Table 3-1 : Group-specific primers for real-time PCR assays ... 83 Table 4-1 : Group-specific primers for real-time PCR assays ... 102 Table 5-1 : Comparaison du contenu en fibres alimentaires de canneberge et de bleuet selon la méthode d’Englyst et l’AOAC. Valeurs exprimées en g/100g de matière sèche. ... 111
Liste des figures
Figure 1-1 : Modèle de paroi cellulaire végétale de dicotylédone. D’après Hanlin, Hrmova et al. (2009) 3 Figure 1-2 : Schématisation des structures chimiques des principales chaînes polysaccharidiques de la paroi
cellulaire et de la lamelle moyenne. D’après Palin and Geitmann (2012). 5 Figure 1-3 : Relation entre les différentes façons de mesurer les fibres alimentaires. Les lignes en pointillés
représentent une limite non-absolue. D’après Plaami (1997). 7
Figure 1-4 : Arborescence des principales classes de polyphénols selon leurs structures chimiques. D’après
Puupponen-Pimia et al. (2004). 8
Figure 1-5 : Structures des principaux monomères de flavanols pouvant être polymérisés pour former des
proanthocyanidines. D’après Friedman et al. (2009). 11
Figure 1-6 : Représentation des liaisons hydrogène ( ) entre un polymère de catéchine et une chaîne
d’homogalacturonane. D’après Hanlin et al. (2009). 12
Figure 1-7 : Diagramme d’analyse des différentes fractions de polyphénols contenues dans les matrices
végétales. D’après Arranz et al. (2009). 14
Figure 1-8 : Effets à long terme des fibres de psyllium et de guar sur la variation du cholestérol. D’après
Anderson et al. (2009). 17
Figure 1-9 : Mécanismes d’actions potentiels des fibres alimentaires sur le métabolisme des stérols. 1 – Les fibres capturent une partie des lipides et des acides biliaires lors de leur passage dans l’intestin supérieur ; 2 – l’excrétion des acides biliaires est augmentée ; 3 – la quantité d’acides biliaires retournant au foie diminue ; 4 – le foie augmente en réponsé la production d’acides biliaires à partir du cholestérol ; 5 – le cholestérol du sérum diminue. D’après Guillon and Champ (2000). 18 Figure 1-10 : Comparaison des régimes turbulent (A) et laminaire (B) au niveau du petit intestin. Les lignes de
courant ne permettent pas de mélange radial dans le cas du régime laminaire et le profil de vitesse du flux dépend de la viscosité du mucus et du contenu du digesta. D’après Lentle and Janssen (2008). 20 Figure 1-11 : Aperçu des effets bénéfiques des polyphénols issus des végétaux comestibles sur la santé.
D’après Pandey and Rizvi (2009). 24
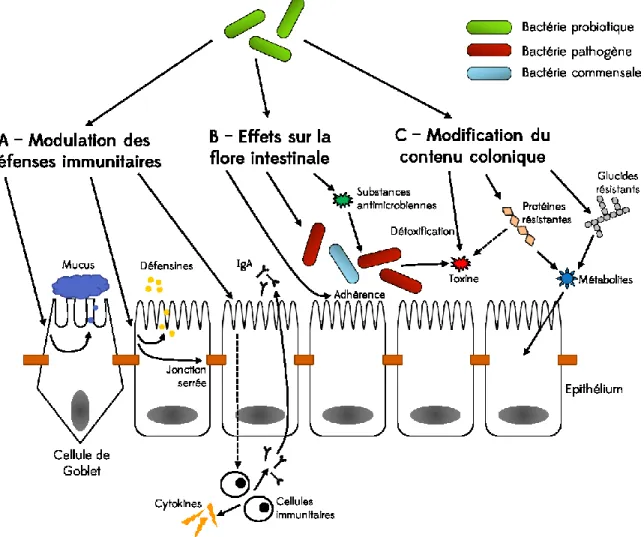
Figure 1-12 : Principaux effets des probiotiques dans le côlon. Toxines : ammoniaque, amines, phénols, thiols, indoles et substances carcinogènes ; substances antimicrobiennes : acides lactique et acétique, bactériocines, acides biliaires déconjugués ; glucides résistants : fibres alimentaires, amidons résistants, autres sucres et alcools non absorbés ; métabolites : acides gras à courtes chaînes, CH4 et autres gaz ;
IgA : immunoglobuline A. D’après Oelschlaeger (2010), Ohland and MacNaughton (2010), Wohlgemuth
et al. (2010). 34
Figure 1-13 : Exemple de décomposition de la (+)-catéchine en phloroglucinol et en acide 3-(dihydroxy phényl)-propionique, deux métabolites fréquemment retrouvées lors de la décomposition des polyphénols dans le tractus gastro-intestinal. D’après Selma et al. (2009). 41 Figure 2-1 : Scheme of the industrial process for polyphenol extraction from plant material. 56 Figure 2-2 : Water retention capacity (WRC) of NT ( ) and RAE ( ) for cranberry, cranberry pomace,
blueberry and blueberry pomace. Values are expressed as g of water retained per g of DM. Similar superscript letters indicate no significant difference using Fisher’s protected LSD test (p<0,05). 65 Figure 2-3 : Swelling capacity (SwC) of NT ( ) and RAE ( ) for cranberry, cranberry pomace, blueberry and
blueberry pomace. Values are expressed as ml of water occupied per g of DM. Similar superscript letters indicate no significant difference using Fisher’s protected LSD test (p<0,05). 67 Figure 2-4 : Viscosity(Pa/s) in function of shear rates (s-1) of 2% solutions of NT and RAE of cranberry (A); NT
and RAE of cranberry pomace (B); NT and RAE of blueberry (C); NT and RAE of blueberrypomace (D). Each sample was tested in triplicate. NT samples are represented by a grey line ( ) and RAE samples
by a black line ( ) 68
Figure 2-5 : Oil retention capacity (ORC) of NT ( ) and RAE ( ) for cranberry, cranberry pomace, blueberry and blueberry pomace. Values are expressed as g of oil retained per g of DM. Similar superscript letters indicate no significant difference using Fisher’s protected LSD test (p<0,05). 69 Figure 3-1 : Total, insoluble and soluble dietary fibers content of blueberry (A) and cranberry (B) before ( )
and after ( ) PAC extraction. Similar superscript letters indicate no significant difference using Fisher’s
protected LSD test (p<0,05). 84
Figure 3-2 : Non-extractable proanthocyanidins contents in cranberry and blueberry fibers fractions (on a dry matter basis) before ( ) and after ( ) PAC extraction. Similar superscript letters indicate no significant
difference using Fisher’s protected LSD test (p<0,05). 85
Figure 3-3 : Fecal bacterial content of mice for total bacteria (A), Clostridium coccoides group (B), Clostridium
leptum group (C), Lactobacillus spp. (D), Lactobacillus acidophilus group (E), Bacteroides fragilis group (F), Faecalibacterium praunsnitzii group (G), Bifidobacterium spp. (H), Enterococcus spp. (I) and Escherichia coli (F). Bacterial quantities are expressed as log 10 of bacteria cells / g of feces. Mice were fed with control diet (CT) or control diet supplemented with fibers of blueberry (B), blueberry with reduced
PAC (B(-)P), cranberry (C) or cranberry with reduced PAC (C(-)P). * - P<0.05, ** - P<0.01, *** - P<0.001
according to Tukey's multiple comparison test. 87
Figure 4-1 : Bacterial count of L. acidophilus (A), L. plantarum (B), L. reuteri (C), L. salivarius (D), B. longum (E) and B. bifidum (F) cultured with fibers of blueberry (B), blueberry with reduced PAC (B(-)P), cranberry (C), cranberry with reduced PAC (C(-)P), MRS (MRS–) as a negative control or MRS with glucose (MRS Glu) as a positive control at 10 g/L ( ) or 20 g/L ( ). Values are expressed as log10 of bacteria / ml. Means values with different letters are significantly different according to Fisher’s protected LSD test (P<0.05). For L. plantarum (fig. 4-1 B), values for B(-)P and C(-)P are triplicate of counts on Petri dishes; *: P<0.05 with regards to B and B(-)P; ◦ : with regards to C and C(-)P; - : with regards to MRS-; + : with
regards to MRS Glu according to Student’s t-test. 104
Figure 5-1 : Schéma récapitulatif de l’activité et des effets possibles des fibres de canneberge et de bleuet et
Liste des abréviations
(+)PAC représente C et B(-)PAC représente C(-)P et B(-)P
ADF – Antioxidant Dietary Fibers / Fibres alimentaire antioxydante AVC – Accident Vasculaire Cérébral
B – Blueberry fibers / Fibres de bleuet
B(-)P – Blueberry fibers with reduced proanthocyanidin / Fibres de bleuet réduites en proanthocyanidine C – Cranberry fibers / Fibres de canneberge
C(-)P – Cranberry fibers with reduced proanthocyanidins / Fibres de canneberge réduites en proanthocyanidine
CH4 - Méthane
CO2 – Dioxyde de carbone
DF – Dietary Fibers / Fibres alimentaire DM – Dry Matter / Matière sèche DSS – Dextran Sodium Sulfate
EPP – Extractable Polyphenols / Polyphénols extractibles GIT – Gastro Intestinal Tractus / Tractus gastro-intestinal H2 - Dihydrogène
HDL – High Density Lipoproteins / Lipoprotéines de haute densité
IBD - Inflammatory Bowel Disease / Maladie inflammatoire chronique intestinale IDF – Insoluble Dietary Fibers / Fibres alimentaires insolubles
LDL – Low Density Lipoproteins / Lipoprotéines de basse densité
NEPA – Non-Extractable Proanthocyanidins / Proanthocyanidines non-extractibles NEPP – Non-Extractable Polyphenols / Polyphénols non-extractibles
NO – Oxyde nitrique
NSP – Non-Starch Polysaccharide / Polysaccharide non-amidonné NT – Non Treated / Non traité
OHC – Oil Retention Capacity / Capacité de rétention de l’huile OMS – Organisation Mondiale de la Santé
PAC – Proanthocyanidines
qPCR – quantitative Polymerase Chain Reaction / Réaction en chaîne par polymérase quantitative RAC – Residue After Chromatography / Résidu après chromatographie
RAE - Residue After Extraction / Résidu après extraction RG - Rhamnogalacturonane
SCFA - Short Chain Fatty Acids / Acides gras à courtes chaînes SDF – Soluble Dietary Fibers / Fibres alimentaire solubles SDS – Sodium Dodecyl Sulfate
SwC – Swelling Capacity / Capacité de gonflement UA – Uronic Acids / Acides uroniques
« Aucune maladie qui peut être soigné par un
régime approprié ne devrait être soigné
autrement » Maïmonide (1138-1204).
Remerciements
Mes premiers remerciements vont à mon directeur de thèse, Dr. Paul Angers pour m’avoir accepté dans son équipe et m’avoir donné toute sa confiance au long de ces quatre années de recherche. Auprès de lui, j’ai appris l’autonomie. Il a généreusement partagé avec moi ses grandes connaissances en chimie et sa vision critique de mes travaux : il m’est arrivé d’être dans l’impasse, de discuter avec lui dans son bureau, et d’en repartir avec des nouvelles idées et perspectives. J’ai particulièrement apprécié sa capacité à dénicher les petits détails qui font la différence lors de l’interprétation de résultats complexes. Merci de m’avoir toujours challengé et d’avoir persisté à vouloir me montrer des pistes alternatives que pouvaient emprunter mes travaux.
Je voudrais aussi remercier mon co-directeur, Dr. André Gosselin, qui a rendu possible ma venue à l’Université Laval. Je me rappelle encore de notre première rencontre, empreinte de sa franchise et de son énergie habituelle. Son impressionnante efficacité m’a permis de trouver rapidement des solutions à mes moindres problèmes et son ingéniosité a souvent transformé un obstacle en levier vers le succès. Je veux surtout le remercier de m’avoir aidé à faire le lien entre mes recherches et l’industrie. André m’a permis d’ancrer mes travaux dans le concret en m’exposant les potentiels produits auxquels ils pourraient déboucher. Enfin, je veux le remercier pour la simplicité dans laquelle ont eu lieu tous nos échanges.
Je tiens aussi à souligner la chance d’avoir eu l’encadrement d’un troisième professeur, Dr. Yves Desjardins. Une grande partie de mes travaux n’aurait pas été possible sans son implication. Grâce à lui, j’ai pu obtenir une bourse dans le cadre du programme Samuel de Champlain et ainsi valider le concept que nous avions élaboré au laboratoire de microbiologie et de biochimie appliqué de Bordeaux Sciences Agro. Mais avant cela, je le remercie de m’avoir associé à son équipe, ouvert son laboratoire et d’avoir suivi régulièrement ma progression. Sans titre de directeur ni de co-directeur de thèse, je suis reconnaissant de sa présence pour me diriger, corriger, orienter et surtout structurer dans le complexe cheminement d’une thèse.
Je veux finalement remercier le quatrième professeur ayant participé à mes travaux, Dr. Maria Urdaci, responsable du laboratoire de microbiologie et de biochimie appliqué de Bordeaux Sciences Agro. Elle s’est impliquée dans mes recherches et a été un guide face à la complexité du monde de la microbiologie (j’ai l’âme d’un chimiste). Je la remercie de m’avoir accueilli à Bordeaux dans son laboratoire et de m’avoir donné tous les moyens humains et matériels pour effectuer mes tests. Son constant doute cartésien nous a amené à refaire nos tests pour assurer la rigueur scientifique de nos travaux. Au sein de son équipe, je veux remercier Claudine Jacquot et Anne-Marie Elie avec qui j’ai partagé les travaux expérimentaux. Je tiens ainsi à les remercier de s’être tant impliqué et d’avoir permis l’avancement de cette thèse.
Je voudrais remercier les professionnels de recherche de l’INAF, en particulier Pascal Dubé, Diane Gagnon, Ronan Corcuff et Mélanie Martineau. Je veux souligner l’aide précieuse que Pascal m’a apportée avec ses compétences et son expérience en chimie. Diane m’a aussi permis de réaliser de nombreux travaux en rendant simple ce qui paraissait être une montagne, mais surtout, de rendre si agréable le travail en laboratoire par son humour. Pascal et Diane ont toujours été présents pour trouver des solutions à mes problèmes techniques.
Je remercie aussi l’équipe de recherche avec laquelle j’ai partagé mes difficultés quotidiennes. Je pense en particulier à Sébastien Léonhart et Dr. Ayman Kamel qui m’ont guidé au jour le jour dans mes expérimentations. Je veux les remercier de m’avoir écouté et de m’avoir aidé dans l’élaboration de mes tests. Je tiens aussi à nommer les autres personnes de mon équipe, avec qui j’ai passé de bons moments au laboratoire et parfois aussi en dehors : les deux Benjamin, William, Stéphanie, Christiana. Je suis particulièrement reconnaissant de l’aide que m’ont apporté Caroline Bédard et Neda Aflaki dans mes travaux lorsque je les ai encadrées dans leurs stages.
Je tiens aussi à remercier Nutra Canada, le MAPAQ, les Fraises de l’Île d’Orléans et les Industries Lassonde qui ont permis le financement de ce projet Je remercie aussi les compagnies Fruit d’Or et Les Bleuets Sauvages du Québec pour leur contribution à ce projet en faisant don des matières premières.
Je remercie le Ministère des Relations Internationales qui a subventionné une partie de mon projet à travers le programme de financement croisé Samuel de Champlain.
Je tiens à remercier mes proches, ceux d’ici et ceux de France qui m’ont aidé à passer à travers certains moments plus difficiles. Je tiens aussi à mentionner Ceren et Ozan qui m’ont laissé passer de longues heures dans leur café à rédiger cette thèse. Je veux remercier Julie Dagenais pour le travail d’édition mais avant tout, de m’avoir écouté et soutenu dans ce projet de doctorat; sans elle, je n’aurais probablement jamais traversé l’Atlantique. J’ai finalement une pensée particulière pour Rébecca Labonté et Iraz Alper qui m’ont apporté un soutien moral et critique. Elles ont toujours généreusement donné leur point de vue sur mes présentations mais surtout, écouté mes lamentations pendant ces quatre années d’études.
Avant-Propos
Cette thèse a pour but de trouver des voies de valorisation possibles pour les fibres de canneberge et de bleuet. Cette étude s’intéresse notamment aux composés pouvant constituer des nutraceutiques. La problématique de départ est venue de l’entreprise Nutra Canada qui souhaitait valoriser des co-produits fibreux issus du procédé d’extraction des polyphénols de canneberge et de bleuet. Le procédé d’extraction des fibres reprend donc, à une échelle pilote, celui du procédé d’extraction des polyphénols. L’équipe de recherche d’Yves Desjardins, de Paul Angers et d’André Gosselin était particulièrement spécialisée dans l’analyse des polyphénols de fruits tandis que mon domaine d’étude se focalisait sur les fibres alimentaires. Or, ce n’est que récemment que des travaux scientifiques ont mis au jour les liens complexes et subtils entre fibres alimentaires et polyphénols. Les perspectives ouvertes par ces travaux concernant les effets sur la flore intestinal étaient très prometteurs et montraient l’engouement scientifique pour les prébiotiques. Disposant ainsi d’une matière première encore non-étudiée pour son contenu en fibres, mais largement documenté pour son contenu en polyphénols, les fibres alimentaires de canneberge et de bleuet constituaient un sujet d’étude particulièrement intéressant pour la caractérisation de leurs effets sur la flore intestinale. Cette thématique d’étude a néanmoins constitué un réel défi par rapport à mes compétences originales. Ma spécialisation en chimie alimentaire ne m’avait pas forcément préparé à exécuter des expériences en microbiologie. Ce projet rapproche ainsi le domaine de la chimie alimentaire par l’étude du contenu des fibres de canneberge et de bleuet et celui de la microbiologie par l’étude de leurs effets sur le microbiote intestinal.
La revue de littérature constitue le premier chapitre de cette thèse. Elle se concentre à mettre en contexte les connaissances actuelles sur les fibres alimentaires et sur les polyphénols, dont notamment les structures et les liens chimiques encadrants leurs interactions. Lorsque cela est possible, certaines descriptions sont plus spécifiquement présentées pour la canneberge et le bleuet. Cette partie est complétée par une explication de leurs effets sur la santé. Enfin, une description générale de la flore intestinale permet de mieux comprendre la portée des probiotiques et prébiotiques sur l’organisme et comment ces derniers peuvent modifier l’équilibre du microbiote. Ces éléments mènent aux hypothèses et aux objectifs de recherche qui sont répondus dans les trois articles scientifiques qui constituent cette thèse.
Le deuxième chapitre s’intitule « Physical and chemical comparison of fiber rich fractions of cranberry, blueberry and respective pomaces ». Il détaille pour la première fois la composition monosaccharidique des fibres alimentaires de bleuet et de canneberge et les compare à leurs marcs. Ce premier chapitre porte aussi sur l’étude des propriétés physiques et rhéologique des fibres. J’ai contribué à ce travail en réalisant la majorité des manipulations (sauf celles liées aux propriétés physiques, conjointement réalisées avec Caroline Bédard, stagiaire au baccalauréat) et en rédigeant entièrement l’article. Celui-ci a été corrigé par Dr. Paul
Angers et est cours de soumission à la revue Food Chemistry. Je tiens à souligner l’aide de Pascal Dubé pour les techniques chromatographiques.
Le troisième chapitre, intitulé « Mice gut microbiota is altered by blueberry and cranberry polyphenolic fibers » tente de faire la distinction entre les effets des fibres alimentaires de canneberge et de bleuet et ceux de leurs polyphénols non-extractibles sur la flore intestinale de souris. Les travaux ont été conjointement réalisés avec l’équipe du laboratoire de microbiologie et de biochimie appliquée de Bordeaux Sciences Agro dirigé par Dr. Maria Urdaci. J’ai réalisé l’ensemble des préparations des fractions fibreuses et leurs analyses ont été accomplies avec l’aide de Pascal Dubé. Les analyses des tests in vivo ont été exécutées en collaboration avec Claudine Jacquot, ingénieur de recherche. J’ai rédigé ce troisième chapitre sous forme d’article scientifique corrigé par Yves Desjardins et Maria Urdaci. L’article sera prochainement soumis à PlosONE. La coopération entre l’Université Laval et Bordeaux Sciences Agro a été rendue possible grâce aux fonds du Ministère des Relations Internationales dans le cadre du programme Samuel de Champlain.
Le quatrième chapitre, « Differential influence of cranberry and blueberry non-extractable procyanidins and dietary fibers on probiotics strains », a été rédigé sous forme d’article scientifique. Les fibres alimentaires de bleuet et de canneberge one été testées in vitro sur des souches probiotiques pour évaluer plus précisément leurs potentiels prébiotiques. Les travaux de ce chapitre ont aussi été réalisés en collaboration avec l’équipe du laboratoire de microbiologie et de biochimie appliquée de Bordeaux Sciences Agro. J’ai produit les fractions fibreuses tandis que les analyses microbiologiques ont été accomplies conjointement avec Anne-Marie Elie, ingénieur d’étude, qui a aussi effectué les analyses par PCR quantitative. Ce travail a aussi été rendu possible suite à la subvention du programme Samuel de Champlain.
Le cinquième chapitre constitue la conclusion et la discussion générale. Il reprend l’ensemble des conclusions et tente de faire la synthèse des résultats.
Introduction
Depuis une vingtaine d’années, les consommateurs ont modifié leurs habitudes alimentaires en considérant, au-delà des besoins nutritionnels de base, les effets bénéfiques ou négatifs de leur alimentation sur la santé. Dès 1994, l’industrie agroalimentaire avait mis en évidence que les consommateurs voyaient dans « leur armoire de cuisine une armoire à pharmacie » (Hasler 2002). Les vente d’aliments fonctionnels et de nutraceutiques ont ainsi progressivement augmenté jusqu’à atteindre un montant estimé à plus de 130 milliards US$ en 2015 (Ministère des Affaires étrangères 2012). Les consommateurs sont à la recherche d’aliments capables de réduire les risques de maladies chroniques tels que les cancers du côlon, les maladies cardio-vasculaires ou les maladies neuro-dégénératives (Agriculture and Agri-Food Canada 2012). Parmi ceux-ci, les superfruits, c'est-à-dire les fruits possédant une haute capacité antioxydante, un contenu élevé en polyphénols ou ayant des effets reconnus sur la santé, attirent une attention croissante de la part des consommateurs (Bradley 2007). Ces propriétés se retrouvent communément dans de nombreuses espèces de baies, dont notamment celles de canneberge et de bleuet (Hakkinen, Karenlampi et al. 1999).
Vaccinium macrocarpon Ait. et Vaccinium angustifolium Ait., correspondants respectivement à la canneberge et au bleuet nains, sont deux espèces endémiques de l’Amérique du Nord que l’on retrouve plus particulièrement des Grands Lacs jusqu’aux régions maritimes (USDA NRCS National Plant Data Team 2013; USDA NRCS National Plant Data Team 2013). Historiquement, la canneberge était utilisée en tant que nourriture, teinture, médicament (contre les infections urinaires et pour prévenir le scorbut) et agent de conservation (dans la préparation du pemmican en mélange avec de la viande de cerf) (Cape Cod Cranberry Growers'Association 2012). Le bleuet était aussi utilisé en tant que nourriture (des baies séchées étaient consommées à l’année longue ou servait dans l’élaboration de certains plats comme le Sautauthig), teinture et médicament (le jus était présumé bon contre la toux) (U.S. Highbush Blueberry Council 2013). Ces deux fruits ont ainsi toujours été associés avec des bienfaits sur la santé.
La production de ces deux baies s’est intensifiée depuis 1995 en s’accompagnant d’une hausse de leurs exportations. La production de canneberge aux Québec a augmenté d’environ 35,3% entre 2008 et 2011 tandis que celle de bleuet a augmenté de 10,2% sur la même période (MAPAQ) démontrant une demande croissante pour ces fruits. En 2011, 97% de la production mondiale de canneberge provenait de l’Amérique du Nord (dont 19% pour le Canada) et 87% pour le bleuet (dont 32% pour le Canada) (FAOSTAT 2011). La matière première est ainsi largement disponible dans nos régions et les acteurs industriels impliqués cherchent à trouver des débouchés pour tous les fruits qu’ils transforment.
L’intérêt scientifique s’est ainsi accru autour des baies du genre Vaccinium. Les preuves de leurs effets bénéfiques sur la santé se sont accumulées grâce à de nombreuses études épidémiologiques mettant en corrélation inverse leur consommation et la fréquence d’apparition des maladies dégénératives. Les recherches récentes mettent de l’avant les composés phytochimiques en lien avec les bienfaits sur la santé (Forney and Kalt 2011). Plus précisément, la canneberge et le bleuet regroupent de nombreux composés phénoliques associés à des fonctions positives sur la santé (Kalt, McDonald et al. 2000; Lowe and Fagelman 2001; Shmuely, Burger et al. 2004; Russell, Labat et al. 2007; Williams, El Mohsen et al. 2008; Borges, Degeneve et al. 2009; Basu, Du et al. 2010; Biswas, Wideman et al. 2012). D’autre part, ces baies, étant des végétaux, sont constituées par des fibres alimentaires, auxquelles on confère aussi des propriétés protectrices contre certaines maladies chroniques (Galvez, Rodríguez-Cabezas et al. 2005; Streppel, Arends et al. 2005; Schatzkin, Mouw et al. 2007; Anderson, Baird et al. 2009; Lattimer and Haub 2010). Les études récentes mettent de l’avant le rôle prébiotique de certaines fibres alimentaires dans le maintien de la santé dont notamment la gestion du poids, les effets anti-inflammatoires et les effets anti-cancers (Wong and Jenkins 2007; Flint, Scott et al. 2012).
L’objectif de cette revue de littérature est de faire un état des lieux du lien existant entre les fibres alimentaires, les composés phénoliques et leurs effets sur la santé en détaillant, quand cela est possible, les connaissances liées à la canneberge et au bleuet.
1 Chapitre I
Revue de littérature
1.1 Les parois végétales : sources de fibres alimentaires et de
polyphénols
1.1.1 Caractéristiques chimiques des parois cellulaires végétales
Les fibres alimentaires sont constituées en majeure partie de parois cellulaires végétales. Lors du développement, les plantes fabriquent des structures rigides constituées par un enchevêtrement complexes de polysaccharides. La composition des parois cellulaires varie selon la fonction (transport, maintien, stockage, etc…) et les types cellulaires; on retrouve une très grande variabilité de structures moléculaires. De plus, bien que les polysaccharides végétaux ne soient constitués que par 10 monosaccharides, chacun peut exister sous la forme pyrane ou furane, créer des liaisons glycosidiques par l’un de leur 3 à 5 groupements hydroxyle et selon une orientation α ou β. Il existe ainsi un nombre élevé de combinaisons possibles entre ces monosaccharides qui forment à leur tour une importante diversité de structures tridimensionnelles (McDougall, Morrison et al. 1996).
Figure 1-1 : Modèle de paroi cellulaire végétale de dicotylédone. D’après Hanlin, Hrmova et al. (2009)
Les quatre principaux constituants des parois végétales sont les composés cellulosiques (cellulose et certaines hémicelluloses), les polysaccharides non-cellulosiques (principalement les polysaccharides pectiques), les protéines et les composés polyphénoliques (Caffall and Mohnen 2009). La figure 1-1 schématise la structure de la paroi cellulaire végétale.
La cellulose est formée par un enchaînement de résidus D-glucopyranose relié entre eux par des liaisons covalentes en β (1-4). La conformation tridimensionnelle permet la formation de liaisons hydrogènes stabilisant la structure en microfibrilles, formant elles-mêmes des fibres très résistantes et disposées de façon organisée (Caffall and Mohnen 2009).
Les hémicelluloses sont des hétéropolymères composés d’une chaîne principale de xylose (ou plus rarement de mannose ou de glucose) qui est ramifiée par des résidus xylose, eux-mêmes substitués par des résidus galactose, arabinose ou fucose. Les hémicelluloses viennent s’intercaler et stabiliser la structure cellulosique au moyen de liaisons hydrogènes (Scheller and Ulvskov 2010).
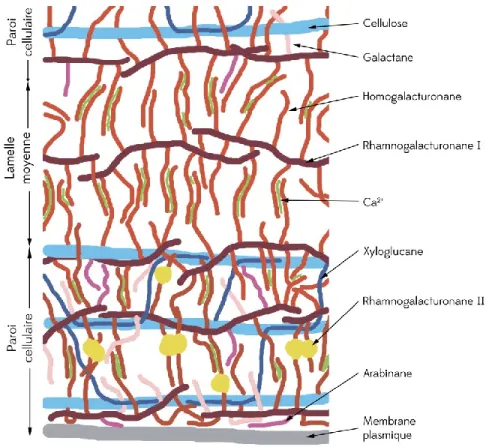
Les composés non-cellulosiques sont constitués de polysaccharides pectiques riches en acide galacturonique, en arabinose, en rhamnose et en galactose. Les principales chaînes polysaccharidiques sont présentées sur la figure 1-2. Ils sont formés par des rhamnogalacturonanes (RG I) substitués par des chaînes d’homogalacturonanes (Popper and Fry 2008). Des ions Ca2+ viennent s’intercaler entre les groupes carboxyliques pour stabiliser la structure. D’autres chaînes secondaires telles que des arabinanes, des galactanes ou des arabinogalactanes peuvent aussi s’intercaler sur la chaine principale de RG I, sans toutefois que les ions Ca2+ puissent interagir (Proseus and Boyer 2007). Les propriétés physico-chimiques de ce type de polysaccharides (hydrophobicité, capacité d’échange de cation,…) vont ainsi grandement dépendre du degré de méthylation ou des groupes carboxyliques (Hanlin, Hrmova et al. 2009). Ils existent aussi des rhamnogalacturanes II, plus rares, qui présentent une complexité importante dans leurs structures de par la diversité des monosaccharides et des multiples ramifications (Cumming, Rizkallah et al. 2005).
Enfin, la lignine est formée par la polymérisation d’unités alcools hydroxycinnamiques, coniféryliques et sinapiques, fréquemment accompagné d’une plus faible part d’alcool paracoumarilyque (Vanholme, Demedts et al. 2010). La polymérisation de ces phénols par estérification et liaisons carbone-carbone, permet la création d’une molécule très résistante. Lors du processus de lignification, les parois cellulaires sont renforcées par la réticulation de la lignine et des hémicelluloses via l’addition d’acide férulique, formant un alliage rigide et imperméable. Certains polyphénols (comme les tannins ou les anthocyanes) peuvent également se complexer avec les polysaccharides, au sein de la paroi, les rendant ainsi quasiment insolubles et inextractibles (Pinelo, Arnous et al. 2006). Il faut aussi noter que les parois cellulaires contiennent des
protéines dont la principale est l’extensine et dont le rôle est de maintenir les différents polysaccharides entre eux (Cosgrove 2001).
1.1.2 Le concept des fibres alimentaires
1.1.2.1 La définition controversée des fibres alimentaires
Jusqu’à aujourd’hui, la définition de ce que représentent les fibres alimentaires porte toujours à débat. Les auteurs n’arrivent pas à s’accorder sur la façon d’envisager les fibres alimentaires : doit-on les considérer d’un point de vue chimique, physique ou bien physiologique ? Plaami (1997) a établi un historique sur la façon dont la communauté scientifique a découvert et abordé les fibres alimentaires. C’est en 1953 que le terme dietary fiber est apparu dans une publication de Hipsley (1953) et fut associé à un effet sur la santé. Cet auteur s’était aperçu que les fibres alimentaires pouvaient protéger les femmes enceintes contre la toxémie. Dans les années 70, d’autres auteurs tels que Trowell (1972) ou Burkitt (1971) s’aperçoivent aussi du lien entre fibres alimentaires et santé par des études sur la diminution de l’obésité, du diabète, des maladies coronariennes ou de la diverticulose. En 1972, Trowell (1972) propose d’envisager les fibres alimentaires comme des « glucides non disponibles ». L’idée de créer une nouvelle définition pour une fraction végétale repose sur la volonté de rendre compte de ses effets bénéfiques sur la santé. Plus tard, Eastwood and Morris (1992) tentèrent d’approcher les fibres à la fois d’un point de vue chimique en tant que « glucides complexes issus des parois cellulaires végétales comprenant des quantités variées de cellulose, hémicellulose, pectine et lignine et
Homogalacturonane
Rhamnogalacturonane I
Rhamnogalacturonane II
Figure 1-2 : Schématisation des structures chimiques des principales chaînes polysaccharidiques de la paroi cellulaire et de la lamelle moyenne. D’après Palin and Geitmann (2012).
souvent accompagnées par de l’amidon » mais aussi physiologique en les définissant comme « le matériel végétal résistant à la digestion humaine ». Aujourd’hui la définition des fibres alimentaires est polarisée entre 2 approches : « les polysaccharides issus des parois cellulaires végétales » et « les glucides non-digestibles avec la lignine ». La nuance est importante puisque la première définition fait un lien clair entre fibres alimentaires et végétales tandis que la seconde permet d’y inclure un groupe plus large de molécules. La question repose alors sur la difficulté de mesurer chimiquement l’amalgame moléculaire dont sont constituées les fibres alimentaires. En effet, la première définition se concentre sur la quantification des sucres non amidonnés (Non-Starch Polysaccharides – NSP) représentant plus de 90% du matériel végétal non digestible et dont la mesure peut être effectuée de façon très précise par chromatographie liquide ou gazeuse (Englyst, Quigley et al. 1994). La seconde définition se base sur une méthodologie enzymatique-gravimétrique pour la quantification des fibres. Cette approche a ses limites car elle prend aussi en compte des artéfacts de glucides tels que l’amidon rétrogradé, certains polyphénols, les protéines résistantes et certains lipides résistants dont on ne connait pas forcément les effets physiologiques (Englyst, Liu et al. 2007).
De plus, les fructanes (fructo-oligosaccahrides), bien que possédant les mêmes propriétés physiologiques que les polysaccharides des fibres alimentaires, ne sont toujours pas considérés comme des fibres alimentaires. Cette classe de glucides n’est en effet pas quantifiée par les techniques classiques à cause de leur faible poids moléculaire et de leur haute solubilité dans l’éthanol (Roberfroid 1993; Flickinger, Van Loo et al. 2003). Cette particularité souligne la nécessité de faire clairement la distinction entre les fibres alimentaires et les techniques de détection.
Finalement, la définition retenue et qui semble la plus adaptée aux résultats présentés dans cette thèse est celle de l’American Association of Cereal Chemists, car elle englobe les deux approches énoncées plus tôt: « Les fibres alimentaires sont la partie comestible des plantes ainsi que leurs glucides analogues résistants à la digestion et à l’absorption dans le petit intestin de l’homme, mais qui subissent une fermentation complète ou partielle dans le gros intestin. Les fibres alimentaires comprennent les polysaccharides, les oligosaccharides, la lignine et leurs composés végétaux associés. Les fibres alimentaires promeuvent des effets physiologiques bénéfiques tels que la régulation du transit intestinal, l’atténuation du cholestérol sanguin et de la glycémie. » (AACC 2001).
1.1.2.2 Quantifier les fibres alimentaires
D’un point de vue fonctionnel, on distingue les fibres alimentaires solubles (e.g. pectine, mucilage, certaines hémicellulose) des fibres alimentaires insolubles (e.g. cellulose, certaines hémicelluloses et lignine) pour des raisons physico-chimiques et physiologiques. Selon la définition, les fibres ne sont pas digestibles, mais les fibres solubles peuvent être fermentées dans le côlon (Mehta and A. 1992).
La méthode de mesure officielle des fibres alimentaires est celle de l’AOAC (991.43) (Lee and Prosky 1992) qui permet de mesurer à la fois les fibres totales, solubles et insolubles. Cette mesure repose sur la définition conservatrice des fibres alimentaires en tant que glucides non digestibles. Après digestion de l’échantillon par des amylases, des protéases et des amyloglucosidases, les protéines et les cendres sont quantifiées. Les fibres alimentaires correspondent alors au matériel non digéré moins les protéines et les cendres.
Bien qu’elle ait subi de nombreuses modifications, cette méthode est assez vétuste, difficile à mettre en œuvre et demande une grande quantité de solvant. Elle permet la quantification du ratio de fibres solubles et insolubles mais ne permet pas d’obtenir de détails sur la composition en monosaccharides des fibres comme le montre la figure 1-3. Par ailleurs, d’autres composés non glucidiques sont aussi comptabilisés en tant que fibres alimentaires tels que des amidons, des protéines et des lipides résistants à la digestion ainsi que des produits de réaction de Maillard, des polyphénols non extractibles, de la cutine et des saponines (Roberfroid 1993).
Une autre approche a été développée par Englyst, Quigley et al. (1992) visant à mesurer la quantité de chaque monosaccharide dans les fractions solubles et insolubles par chromatographie. L’échantillon subit, comme dans l’AOAC, un traitement enzymatique avant que les fractions solubles et insolubles soient séparées puis analysées. Cette technique plus récente est plus précise et donne un niveau de détail supplémentaire. La figure 1-3 compare les différentes approches pour la quantification des fibres alimentaires.
Figure 1-3 : Relation entre les différentes façons de mesurer les fibres alimentaires. Les lignes en pointillés représentent une limite non-absolue. D’après Plaami (1997).
1.1.3 Les composés phénoliques
Les composés phénoliques constituent un groupe majeur de composés phytochimiques. Ils font partie des métabolites secondaires participant au système de défense et de survie des plantes. Leurs rôles principaux consistent à la protection de la plante contre le stress lumineux, le stress oxydatif et les prédateurs (insectes et herbivores). Les composés phénoliques sont caractérisés par une structure composée d’au moins un cycle aromatique hydrocarboné possédant un ou plusieurs groupes hydroxyles. À l’état naturel, les composés phénoliques et leurs dérivés sont souvent glycosylés et forment fréquem ment des polymères (Pandey and Rizvi 2009).
La figure 1-4 illustre les différentes familles de polyphénols. Les composés phénoliques sont divisés en plusieurs groupes allant du simple acide phénolique jusqu’au polymère de catéchine ou aux plus complexes lignanes (Puupponen-Pimia, Aura et al. 2004). Les flavonoïdes constituent le plus important groupe de composés phénoliques présent dans les végétaux alimentaires et comprennent les flavones, les flavonols, les isoflavones, les anthocyanidines, les flavanols, les flavanones et indirectement les proanthocynidines. La structure des flavonoïdes est basée sur la molécule de flavan, composée de 2 cycles aromatiques reliés par un pont de 3 carbones (Del Rio, Rodriguez-Mateos et al. 2012).
Figure 1-4 : Arborescence des principales classes de polyphénols selon leurs structures chimiques. D’après Puupponen-Pimia et al. (2004).
Tannins hydrolysables
Tannins non hydrolysables
Les flavonols (quercétine, kaempferol, myricétine, etc…) sont des composés que l’on retrouve fréquemment dans le règne végétal; on en retrouve par exemple une concentration importante dans les oignons rouges et jaunes (Del Rio, Rodriguez-Mateos et al. 2012). Les flavanols (ou flavan-3-ol) sont capables de former une multitude de structure allant du monomère (catéchine ou épicatéchine) aux polymères de proanthocyanidines, aussi appelés tannins condensés. Les anthocyanidines, sont plus faciles à identifier puisqu’elles apportent certaines couleurs rouge, bleue ou violette à de nombreuses baies (canneberge, bleuet, mûre) et permettent de favoriser la pollinisation. Les polyphénols se retrouvent principalement dans la vacuole sous leur forme glycosylée tandis que d’autres, lipophiles sont plus souvent retrouvées dans l’épiderme (Desjardins 2008; Jaganath and Crozier 2008).
1.1.4 Les polyphénols de la canneberge et du bleuet
Une comparaison des valeurs principales de polyphénols contenus dans la canneberge et le bleuet est donnée dans le tableau 1-1.
*ND - Non disponible
Le bleuet est reconnu pour son contenu en antioxydant qui varie d’une espèce à l’autre. Par exemple, les bleuets en corymbes (Vaccinium corymbosum L.) contiennent en moyenne 260,9 mg de composés phénoliques par 100 g matière fraîche (Prior, Cao et al. 1998). Parmi ces composés, 16 variétés d’anthocyanes ont été identifiées (Prior, Lazarus et al. 2001) et estimées à une concentration totale variant de 129,2 mg / 100 g à 280 mg / 100 g de fruit frais selon l’espèce (Prior, Cao et al. 1998), tandis que les flavonols ont été retrouvés à une concentration de 5 mg / 100 g de fruit frais (Hakkinen, Karenlampi et al. 1999). Entre 6 et 8 µg / g de matière sèche de procyanidines ont été détectées (Prior, Lazarus et al. 2001) ce qui correspond à environ 0,1 mg / 100 g de fruit frais. En comparaison, le bleuet sauvage (Vaccinium angustifolium Aiton) renferme 426 mg de composés phénoliques par 100 g de fruit frais dont 327 mg correspondent à des anthocyanes (Grace, Ribnicky et al. 2009).
Les canneberges contiennent plus d’acides phénoliques que les bleuets. Prior et al. (2001) donnent une valeur de 1720 mg de phénols totaux / 100 g de matière fraîche. Ces molécules ont une concentration de 17 µg / g
Table 1-1 : Principaux polyphénols contenus dans la canneberge et le bleuet Par 100g matière
fraîche phénoliques totaux Composés Anthocyanes Flavonols Proanthocyanidines Bleuet en
corymbes 260,9 mg 129,2 mg – 280 mg 5 mg 0,1 mg
Bleuet sauvage 426 mg 327 mg ND* ND*
de matière sèche (Prior, Lazarus et al. 2001) soit environ 0,23 mg / 100 g de fruit frais après calculs. Leur difficulté d’extraction peut s’expliquer par le fait que 63% des procyanidines sont des procyanidines polymérisés (Naczk and Shahidi 2006). La canneberge est aussi très intéressante de par son contenu en acides phénoliques, environ 570 mg / 100 g de fruit frais dont 474 mg / 100 g correspond à l’acide benzoïque. Entre 54% et 100% de ces acides seraient conjugués, ce qui explique que la forme libre est largement minoritaire et que l’on obtient un meilleur rendement d’extraction après hydrolyse (Zuo, Wang et al. 2002). En particulier, la couleur rouge de la canneberge serait due à 6 types d’anthocyanes dont les 4 principaux sont le cyanidin-3-galactoside, le peonidin-3-galactoside, le cyanidin-3-arabinoside et le peonidin-3-arabinoside (Prior, Lazarus et al. 2001). La concentration en anthocyanes est d’environ 360 mg / 100 g de matière fraîche. La concentration en flavonols varie quant à elle entre 15,7 et 26,3 mg / 100 g de fruit frais (Hakkinen, Karenlampi et al. 1999).
1.1.5 Interactions fibres alimentaires - polyphénols
Comme il a été mentionné plus tôt, les polyphénols sont des constituants de la matrice cellulaire végétale. Dans les travaux scientifiques récents, les bienfaits liés à la consommation de fruits et légumes sont fréquemment attribuées aux polyphénols (Amiot and Lairon 2008; Singh and Ramassamy 2008). Ils seraient impliqués entres autres dans l’équilibre du microbiote intestinal et dans la prévention contre les cancers du tractus intestinal. Certaines études minimiseraient cependant considérablement l’impact des polyphénols sur les fonctions intestinales car les méthodes actuelles d’extraction et de quantification ne permettent pas d’analyser l’ensemble des polyphénols inclus dans la matrice cellulaire. Certains proanthocyanidines, notamment les tannins de haut poids moléculaires, sont en effet insolubles dans les solvants aqueux et demeurent complexés dans la matrice végétale avec les protéines et les polysaccharides (Arranz, Saura-Calixto et al. 2009).
Lors de la digestion, les fibres protègent ainsi certains complexes polyphénoliques de sorte à ce qu’ils parviennent jusqu’au côlon où ils constitueraient un substrat fermentescible pour les bactéries. Les polymères sont alors dégradés en métabolites absorbables (acides gras à courtes chaînes, acides phenylacétique, phénylpropionique et phénylbutyrique) ou en métabolites antioxydants non-absorbables (Pérez-Jiménez, Arranz et al. 2009). Ces molécules sont capitales dans l’homéostasie du côlon où elles constituent à la fois un substrat pour les colonocytes et favorisent la bonne santé (effets anti-inflammatoires, effets anti-cancérigènes, effets antioxydants). En tant que composants imbriqués de façon intrinsèque aux fibres alimentaires et de par leurs effets sur la santé, nous allons tenter de décrire les liens chimiques entre les polyphénols et les fibres alimentaires.
Une grande partie des polyphénols contenus dans le fruit se lient aux protéines et aux polysaccharides structurels des parois, plus exactement au niveau des graines et de la peau et plus faiblement au niveau de la pulpe du fruit (Pinelo, Arnous et al. 2006). Trois groupes différents de polyphénols ont été identifiés : les polyphénols libres dans la vacuole, ceux liés aux protéines internes du tonoplaste et ceux liés aux polysaccharides de la paroi (Pinelo, Arnous et al. 2006). Une mesure de la quantité de tannins dans le moût de raisin avant et après vinification a permis de montrer que seuls 50% des tannins se retrouvent dans le vin (Adams and Scholz 2008). Les tannins sont des polymères de flavanols, plus particulièrement de catéchines et d’épicatéchines. Ces sous-unités forment des liaisons interflavanes généralement entre le C-4 et le C-8 et
plus rarement avec le C-6 (voir figure 1-5). Parmi les monomères impliqués, on retrouve aussi des gallate d’épicatéchines et des gallate d’épigallocatéchines qui sont des esters d’acide gallique. La longueur moyenne des polymères est d’environ 40 sous-unités dans la peau des raisins et environ 20 dans les pépins (Friedman, Levin et al. 2009). Plus la taille du polymère augmente plus il est difficile de l’extraire de sa matrice, à cause, entres autres, de son encombrement stérique (Feliciano, Shea et al. 2012).
L’extraction des polyphénols est aussi dépendante des différentes liaisons qu’ils forment avec les autres molécules structurelles de la plante tels que les polysaccharides et les protéines. Certains polyphénols, par leurs propriétés amphipatiques, ont la capacité de se lier à la paroi grâce à des liaisons hydrogènes et des interactions hydrophobes. Les liaisons hydrogènes se produiraient entre les nombreux groupements Figure 1-5 : Structures des principaux monomères de flavanols pouvant être polymérisés pour former des proanthocyanidines. D’après Friedman et al. (2009).
(-)-catéchine (+)-épicatéchine (+)-épigallocatéchine
hydroxyles des polyphénols et les atomes d’oxygène phénoliques ou glycosidiques des polysaccharides de la paroi. Par exemple, les groupements hydroxyles des cycles d’épicatéchines ou de l’acide gallique estérifié (groupement galloyle) se lieraient avec les atomes d’oxygène de la liaison glycosidique ou ceux des groupements hydroxyles et acétyles des polysaccharides (Hanlin, Hrmova et al. 2009) (voir figure 1-6). L’implication des liaisons hydrogènes a été prouvée au moyen de l’urée. Cette molécule est capable de former des liaisons hydrogènes permettant de dissocier les complexes paroi-tannins de pommes (Le Bourvellec, Guyot et al. 2004). D’autre part, les interactions hydrophobes sont favorisées par la force ionique du milieu. Ralet, Dronnet et al. (2001) ont en effet observé une augmentation de l’interaction des tannins et de la paroi avec l’augmentation de la force ionique, prouvant l’implication des interactions hydrophobes. L’utilisation de
solvant capable de diminuer la polarité, tel l’éthanol (diminuant aussi la force liée aux ponts hydrogènes), permet d’affaiblir les interactions hydrophobes ce qui entraine la dissociation des polyphénols de la paroi (Ralet, Dronnet et al. 2001).. Enfin, des tests in vitro avec des polysaccharides modèles possédant à la fois des sites hydrophobes et des groupements hydroxyles, comme les β-cyclodextrines, montrent une très forte interaction avec certaines proanthocyanidines (Le Bourvellec, Guyot et al. 2004). Dans la nature, l’affinité des polyphénols dépend aussi du type de polysaccharide impliqué. L’affinité des polyphénols pour la pectine est supérieure à celle pour l’hémicellulose, elle-même supérieure à celle pour la cellulose. En effet, la pectine est une molécule chargée capable de former des liaisons hydrogènes plus fortes que celles de l’hémicellulose, constituée de sucres neutres. Quant à la cellulose, l’enchevêtrement dense des fibrilles empêche la diffusion Figure 1-6 : Représentation des liaisons hydrogène ( ) entre un polymère de catéchine et une chaîne d’homogalacturonane. D’après Hanlin et al. (2009).
des polyphénols au sein de la matrice, à la différence de la structure hémicellulosique plus diffuse (Renard, Baron et al. 2001).
Concernant les liens avec les protéines, leurs interactions peuvent s’illustrer à travers le phénomène d’astringence. Celui-ci est lié à la précipitation des tannins condensés au contact de la salive. En effet, la salive est riche en protéines essentiellement constituées de proline dont la fonction amine forme des liaisons hydrogène avec les fonctions hydroxyles des polyphénols. La présence de polymères polyphénoliques (tannins, proanthocyanidines) augmente les possibilités d’interactions avec les protéines grâce à la multiplication des sites de contacts. Lorsque la concentration en polyphénols augmente ou bien en présence de proanthocyanidines de haut degrés de polymérisation, la complexation intensive des protéines et des polyphénols mènent à la formation de particules colloïdales et finalement à la précipitation des polyphénols. (Dangles, Dufour et al. 2006).
Selon le type de polyphénols impliqués dans l’interaction avec une molécule structurelle, la force de la liaison est modifiée. L’interaction est influencée par la longueur du polymère, le pourcentage de substitution par des acides galliques et par le nombre de sous-unités formés par des épigallocatéchines. En effet, plus le degré de polymérisation est élevé, plus le nombre de sites potentiels pouvant former des liaisons hydrogènes est important et donc plus l’interaction sera forte (Le Bourvellec, Guyot et al. 2009). De même, la galloylation augmente le nombre des sites d’interactions et les monomères d’épigallocatéchines présentent un groupement hydroxyle additionnel. En outre, les polymères de (-)-épicatéchines forment une hélice lévogyre à la différence des polymères de (+)-épicatéchines à hélice dextrogyre qui exposent plus facilement ses sites d’interaction et présente ainsi une meilleure interaction avec la paroi (Hanlin, Hrmova et al. 2009).
1.1.6 Polyphénols extractibles et non-extractibles
Bien que les polyphénols aient été largement étudiés, ce n’est que récemment qu’on commence à comprendre les liens qu’ils entretiennent avec les matrices végétales dont ils proviennent. Les expériences ont jusqu’ici mis en valeur les effets sur l’organisme des polyphénols extractibles, désignant la fraction accessible des polyphénols extraits par les techniques physico-chimiques les plus simples. Or, les travaux de Saura-Calixto (1998) et de Arranz, Saura-Saura-Calixto et al. (2009) ont démontré qu’une partie significative de polyphénols, dits non-extractibles, restent emprisonnés dans les parois végétales après extraction classique par solvant. Ces composés bioactifs sont ainsi passés sous silence dans de nombreuses études nutritionnelles car leur présence n’était pas soupçonnée jusque-là. On considère ainsi que la quantité de polyphénols non-extractibles peut être jusqu’à 5 fois supérieure à la quantité extractible. (Arranz, Saura-Calixto et al. 2009)
La figure 1-7 donne des indications sur la démarche de l’extraction des différentes fractions polyphénoliques. Généralement, la première extraction est effectuée au moyen d’un mélange polaire méthanol/eau (50:50) tandis que la deuxième extraction, utilisant un mélange composé d’acétone/eau (70:30), vient récupérer les polyphénols extractibles subsistants. Pour certains composés comme la canneberge, l’acidification de la
deuxième extraction permet d’obtenir de meilleurs rendements. Cette double extraction permet de retirer les polyphénols extractibles, composés principalement de flavan-3-ol (catéchine et épicatéchine), d’acides hydroxycinnamiques (acide chlorogénique), d’anthocyanes et de proanthocyanidines (de degré de polymérisation de 2 à 10) (Arranz, Saura-Calixto et al. 2009; Pérez-Jiménez, Arranz et al. 2009).
Le résidu contient alors les polyphénols non-extractibles qui peuvent être quantifiés par 2 techniques complémentaires. La butanolyse (voir figure 1-7), popularisée par Bates-Smith (Porter, Hrstich et al. 1985), permet le fractionnement des polymères de proanthocyanidines de haut poids moléculaire en anthocyanidines, extractibles et quantifiables. Les polymères les plus lourds sont néanmoins difficilement extractibles. Concernant les polyphénols hydrolysables, ils sont obtenus par hydrolyse acide des tannins. Ce traitement est nécessaire pour séparer les polyphénols de la paroi cellulaire qu’ils soient complexés avec des Figure 1-7 : Diagramme d’analyse des différentes fractions de polyphénols contenues dans les matrices végétales. D’après Arranz et al. (2009).