HAL Id: dumas-01741581
https://dumas.ccsd.cnrs.fr/dumas-01741581
Submitted on 23 Mar 2018HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Distributed under a Creative Commons Attribution - NonCommercial - NoDerivatives| 4.0 International License
Impact de la durée de l’antibiothérapie sur la durée des
symptômes dans les pneumopathies aiguës
communautaires prises en charge en ambulatoire : une
étude ancillaire de l’étude CAPA
Natacha Le Lamer
To cite this version:
Natacha Le Lamer. Impact de la durée de l’antibiothérapie sur la durée des symptômes dans les pneumopathies aiguës communautaires prises en charge en ambulatoire : une étude ancillaire de l’étude CAPA. Médecine humaine et pathologie. 2017. �dumas-01741581�
AVERTISSEMENT
Cette thèse d’exercice est le fruit d’un travail approuvé par le jury de soutenance et réalisé dans le but d’obtenir le diplôme d’Etat de docteur en médecine. Ce document est mis à disposition de l’ensemble de la communauté universitaire élargie.
Il est soumis à la propriété intellectuelle de l’auteur. Ceci implique une obligation de citation et de référencement lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite encourt toute poursuite pénale.
Code de la Propriété Intellectuelle. Articles L 122.4
UNIVERSITÉ PARIS DESCARTES
Faculté de Médecine PARIS DESCARTES
Année 2017
N° 95
THÈSE
POUR LE DIPLÔME D’ÉTAT
DE
DOCTEUR EN MÉDECINE
Impact de la durée de l’antibiothérapie sur la durée des symptômes
dans les pneumopathies aigues communautaires prises en charge
en ambulatoire : une étude ancillaire de l’étude CAPA
Présentée et soutenue publiquement
le 13 juin 2017
Par
Natacha LE LAMER
Née le 12 novembre 1987 à Pontoise (95)
Dirigée par Mme Le Docteur Céline Buffel du Vaure, MCU
Jury :
M. Le Professeur Henri Partouche, PU ……….. Président M. Le Professeur Pierre-Régis Burgel, PU-PH
2
Remerciements
A Monsieur le Professeur Henri PARTOUCHE qui me fait l’honneur de présider ce jury de thèse. Merci pour votre aide et vos précieux conseils pour l’écriture de cet article.
A Madame le Docteur Céline BUFFEL DU VAURE qui a dirigé ce travail. Merci pour ta patience, ton aide et ta disponibilité tout au long de ce travail. Ton expérience et ta méthodologie m’ont été précieuses. Ta présence dans ce jury est un honneur.
A Monsieur le Professeur Pierre-Régis BURGEL. Vous me faites l’honneur de siéger à ce jury, je vous remercie pour l’intérêt porté à ce travail.
A Madame le Docteur Fanny LANTERNIER. Vous avez accepté de juger ce travail. Votre présence est un honneur. A Monsieur le Professeur LANDAIS, Monsieur le Pr GILBERG et à Madame LE COSSEC. Votre savoir et votre aide m’ont été très précieux. Merci. A tous les médecins que j’ai rencontrés durant toutes ces années. Merci de m’avoir transmis votre savoir et votre amour pour la médecine. A Gabriel, mon mari. Merci pour ton soutien et ton amour durant toutes ces années. Sans toi, je n’en serais surement pas là. A Yoan, mon fils. Merci de m’apporter autant de rires et de bonheur chaque jour.
A Jacky et Armelle, mes parents. Votre tendresse et votre amour m’ont permis d’être la personne que je suis aujourd’hui. Merci d’avoir toujours cru en moi.
3 A Céline, Gérald et Mélody, ma sœur, mon frère et ma belle sœur. Merci d’être présents dans chaque moments importants de ma vie. A Léla, ma nièce. Merci pour tous ces moments de bonheur. A Mamie. Merci de toujours croire en moi A ma belle-famille. Merci de m’avoir acceptée comme un membre à part entière dans votre famille. Votre soutien est très précieux. A mes amis Lauriane, Aurélien, David, Amélie, Marie, Guillaume, Gwendoline, William. Merci d’avoir été là durant ces longues études. A Laëtitia, Jonathan, Laura, Guillaume, Floriane, Mehdi, Vincent, Marlaine et Robin. Merci pour votre soutien.
4
Table des matières
REMERCIEMENTS ... 2 TABLE DES MATIERES ... 4 INTRODUCTION ... 6 PREMIERE PARTIE : GENERALITES SUR LES PNEUMOPATHIES AIGUËS COMMUNAUTAIRES ... 7 I-DEFINITION ET EPIDEMIOLOGIE ... 7 1.1 DEFINITION ET PHYSIOPATHOLOGIE ... 7 1.2 INCIDENCE ... 8 1.3 MORTALITE ... 8 II-DIAGNOSTIC ... 9 2.1 CLINIQUE ... 9 2.2 RADIOLOGIQUE ... 9 2.2.1 RADIOGRAPHIE DE THORAX ... 9 2.2.2 REMISE EN CAUSE DE LA RADIOGRAPHIE ... 10 2.2.3 PLACE DU SCANNER THORACIQUE ... 11 2.3 MICROBIOLOGIQUE ... 11 2.3.1 LES GERMES EN CAUSES ... 11 2.3.2 LES ELEMENTS CLINIQUES D’ORIENTATION ... 12 2.3.3 LES RESISTANCES DU PNEUMOCOQUE ... 13 2.3.4 LES EXAMENS MICROBIOLOGIQUES ... 13 2.3.5 RECOMMANDATIONS ACTUELLES ... 14 2.4 PLACE DES AUTRES EXAMENS COMPLEMENTAIRES ... 15 2.5 EVALUATION INITIALE DE LA GRAVITE ET ORIENTATION ... 17 2.5.1 LES SIGNES DE GRAVITE ... 17 2.5.2 LES SCORES CLINIQUES ... 17 2.5.2.1 LE PSI ... 17 2.5.2.2 LE CURB 65 ET LE CRB 65 ... 18 2.5.2.3 COMPARAISON DES DIFFERENTS SCORES ... 19 2.5.3 ALGORITHME D’ORIENTATION ... 19 III-PRISE EN CHARGE THERAPEUTIQUE ... 215 3.1 RECOMMANDATIONS FRANÇAISES ... 21 3.2 AUTRES RECOMMANDATIONS ... 22 IV-PROBLEMATIQUE ... 24 DEUXIEME PARTIE : L’ETUDE : IMPACT DE LA DUREE DE L’ANTIBIOTHERAPIE SUR LA DUREE DES SYMPTOMES DANS LES PNEUMOPATHIES AIGUES COMMUNAUTAIRES PRISE EN CHARGE EN AMBULATOIRE ... 26 I-INTRODUCTION ... 26
II-MATERIELS ET METHODES ... 27
2.1 CRITERES D’INCLUSION ... 28 2.2 RECUEIL DES DONNEES ... 28 2.3 CRITERE DE JUGEMENT PRINCIPAL ... 29 2.4 METHODE STATISTIQUE ... 29 III-RESULTATS ... 29 3.1 POPULATION ... 29 3.2 CRITERE DE JUGEMENT PRINCIPAL ... 32 IV-DISCUSSION ... 33 CONCLUSION ... 36 BIBLIOGRAPHIE ... 37 ANNEXE 1 : ABREVIATIONS ... 45 ANNEXE 2 ... 46 ANNEXE 3 ... 47 ANNEXE 4 ... 48 ANNEXE 5 ... 49 ANNEXE 6 ... 51
6
Introduction
La pneumopathie est une infection du parenchyme pulmonaire. Elle représente la première cause de mortalité par maladie infectieuse dans le monde selon le dernier rapport de l’OMS, ce qui en fait un problème de santé public majeur (1). En France, sa fréquence est estimée entre 400000 et 600000 cas par an (2). Elle représente 5 à 10% des infections respiratoires basses (3).Un des enjeux du médecin généraliste est de différencier la bronchite aigue de la pneumopathie aigue. En effet, ces deux infections se présentent par des symptômes similaires mais leur étiologie et, par conséquent, leur prise en charge sont différentes. Si la bronchite aigue est d’origine virale dans la grande majorité des cas, les pneumopathies aigues sont plutôt d’origine bactérienne et le traitement repose sur l’antibiothérapie, probabiliste le plus souvent.
A l’heure où le développement des résistance bactériennes s’accroit, et notamment du fait d’une surconsommation d’antibiotiques, le choix de l’antibiothérapie probabiliste est donc primordial. Plusieurs sociétés savantes françaises (la SPILF, la SPLF et l’AFSSAPS) ont rédigé des recommandations afin d’aider le clinicien à choisir le bon antibiotique en fonction de la clinique et des comorbidités du patient (2,4,5). Mais, les durées de traitement recommandées de 7 à 14 jours restent imprécises et avec un niveau de preuve insuffisant. A travers ce travail, nous cherchons à mettre en évidence qu’une antibiothérapie longue, c’est-à dire-supérieur à 7 jours, ne serait pas plus efficace qu’un traitement plus court. Après avoir rappelé quelques généralités sur les pneumopathies aigues communautaires et présenté les recommandations concernant les traitements antibiotiques, nous présenterons notre étude centrée sur les durées de prescriptions de l’amoxicilline et l’amoxicilline-acide clavulanique chez des patients adultes présentant une pneumopathie aigue communautaire pris en charge en médecine générale.
7
Première partie : Généralités sur les pneumopathies aiguës
communautaires
I-Définition et épidémiologie
1.1 Définition et physiopathologie
La pneumopathie aigue est une infection du parenchyme pulmonaire. On distingue les pneumopathies aigues communautaires, acquises en milieu extra hospitalier ou dans les 48 premières heures de l’hospitalisation, des pneumopathies nosocomiales c’est-à-dire acquises après au moins 48 heures d’hospitalisation (2). Elle est à distinguer de la bronchite aigue qui est une inflammation aigue des bronches chez un sujet indemne de bronchite chronique, dont l’étiologie est virale dans la grande majorité des cas (3). Les poumons sont en relation directe et permanente avec l’extérieur. Afin de les protéger des agents infectieux, il existe plusieurs barrières de défense le long des voies respiratoires. Ce système comporte deux composantes :
-une composante mécanique, assurée par la toux, les éternuements et les cils de l’arbre respiratoire, qui empêche les fausses routes et expulse les particules inhalées ;
-une composante cellulaire spécifique (immunité humorale ou cellulaire) et aspécifique (macrophages, polynucléaires neutrophiles) (6,7). La moitié des adultes sains inhalent de faibles quantités de sécrétions oropharyngées la nuit mais la quantité de bactéries pathogènes reste faible et les mécanismes de défenses locaux agissent avant le développement de l’infection (6). Il existe plusieurs facteurs de risque de développer une pneumopathie : - l’existence de fausses routes - la diminution des défenses locales (tabac, BPCO, insuffisance cardiaque)
- la diminution des défenses générales (dénutrition, diabète non équilibré, insuffisance rénale, splénectomie, cirrhose, déficit immunitaire primitif ou secondaire).
8 Les sujets âgés sont plus à risque puisqu’ils cumulent plusieurs facteurs de risque (6).
1.2 Incidence
En France, le nombre de pneumopathies est estimé entre 400000 à 600000 cas par an et conduit à 800000 consultations par an en médecine générale (2).
Plusieurs études prospectives menées en Angleterre, en Finlande et aux Etats Unis ont estimé l’incidence des PAC de 5 à 11 pour 1000 habitants par an (8). La pneumopathie représente 5 à 12% des infections respiratoires basses prise en charge par les médecins généralistes en Angleterre (8). Cette incidence varie selon l’âge des patients : elle est plus élevée chez les sujets très jeunes et chez les personnes âgées. En effet, dans une étude finlandaise, l’incidence dans le groupe des 16-59 ans était de 6 pour 1000 adultes alors que chez ceux âgés de 60 ans et plus, elle était de 15,4 pour 1000 et de 34,2 pour 1000 chez les plus de 75 ans (9). Entre 22 et 42% des patients atteints de pneumopathie nécessitent une hospitalisation (8).
1.3 Mortalité
Les infections respiratoires basses sont la première cause de mortalité par maladie infectieuse dans le monde selon l’OMS, responsable de 3,2 millions de décès en 2015 (1). La mortalité chez les patients traités en ambulatoire en Angleterre est faible et estimé à moins de 1%. Pour les patients hospitalisés, cette mortalité varie de 5,7 à 14% (8). Selon une méta analyse européenne, la mortalité variait de moins de 1% à 48% et était associé à l’âge avancé, la présence de comorbidités et la sévérité de la pneumopathie (10). La mortalité à 30 jours était de 12,9% dans une récente étude menée en Allemagne, quelque soit le lieu de prise en charge. Elle était de 5% pour les patients ambulatoires et 21,9% pour les patients hospitalisés (11). La mortalité augmentait avec l’âge : elle était de 28% chez les patients de plus de 90 ans alors qu’elle était de 4% dans le groupe 50-59 ans.
9
II-Diagnostic
2.1 Clinique
Le diagnostic clinique de pneumopathie repose sur un faisceau d’arguments parmi : - une toux récente, - associée à des signes fonctionnels ou physiques d’atteinte respiratoire basse : • dyspnée • douleur thoracique • sifflements • expectorations - la présence de nouveaux signes auscultatoires focaux- et au moins un signe général suggérant une infection (fièvre, tachycardie, sueurs, céphalées, myalgies, tremblements) (3,8,12)
- l’absence d’autre explication évidente (8).
Un patient en ambulatoire présentant une fréquence respiratoire inférieure à 30/min, une fréquence cardiaque inférieure à 100/min et une température inférieure à 37,8°C a une probabilité de 1 à 13% d’avoir une pneumopathie. A l’inverse, un patient fébrile, tachycarde et présentant des crépitants à l’auscultation a une probabilité de 18 à 42% d’avoir une pneumopathie (13).
Cependant, chez le sujet âgé, les signes sont pauvres et atypiques (syndrome confusionnel, chutes,…) et la fièvre est souvent absente, ce qui rend le diagnostic plus difficile (3).
2.2 Radiologique
2.2.1 Radiographie de thorax
Selon la SPILF (2) et l’IDSA/ATS (14), la radiographie de thorax reste un examen essentiel pour le diagnostic de pneumopathie. Son intérêt est de différencier la pneumopathie d’une autre cause associant toux et fièvre comme la bronchite aigue. Les signes radiologiques sont très variés : il peut d’agir d’opacités alvéolaires uniques ou multiples à limites floues
10 évoluant vers une opacité systématisée segmentaire ou lobaire. D’autres aspects peuvent être retrouvé mais sont souvent méconnus ou mal interprétés : opacités interstitielles localisées ou diffuses, opacités alvéolaires multiples en motte de distribution péribronchiques réalisant la « bronchopneumonie » (2,6). Elle a un intérêt notamment chez les personnes âgées car les signes cliniques sont souvent trompeurs dans cette population et il existe un risque de complication plus important (6). Une étude israélienne a évalué la fiabilité du jugement des médecins à faire le diagnostic de pneumopathie seulement sur les signes cliniques comparée au résultat de la radiographie de thorax. Elle conclut que le jugement clinique du médecin est bon pour éliminer une pneumopathie mais la capacité du médecin à diagnostiquer une pneumopathie uniquement sur la clinique est faible et ne remplace pas la radiographie de thorax (15). Cette étude est en accord avec une méta analyse suisse qui confirme que la valeur prédictive positive des signes cliniques, seuls ou en combinaison, n’est pas suffisante pour le diagnostic positif de pneumopathie et la confirmation radiologique permettrait d’éviter une sur prescription d’antibiotique (16).
Cependant, l’interprétation de la radiographie peut parfois être difficile en cas d’insuffisance cardiaque ou de pathologie pulmonaire préexistante (BPCO, séquelle de tuberculose, dilatation des bronches) mais également chez les personnes âgées liée à la difficulté d’obtenir un cliché interprétable et à la présence d’une « toile de fond » faite d’opacités respiratoires ou cardiaques chroniques (2,17).
2.2.2 Remise en cause de la radiographie
Les recommandations anglaises de la BTS de 2009 donnent des instructions différentes sur la place de la radiographie de thorax. En ambulatoire, si l’interrogatoire et l’examen clinique laissent peu de doute au diagnostic de pneumopathie, la radiographie de thorax n’a pas d’intérêt à être réalisée puisqu’elle ne modifiera pas la prise en charge.En revanche, si le diagnostic est douteux et que la radiographie peut aider au diagnostic différentiel et à la prise en charge, si l’évolution sous traitement n’est pas satisfaisante ou si
11 le patient est à risque de présenter une pathologie pulmonaire sous-jacente, comme un cancer pulmonaire, la radiographie de thorax a donc un intérêt à être réalisée (8).
2.2.3 Place du scanner thoracique
La place du scanner thoracique est limitée aux pneumopathies de diagnostic difficile (2). Devant la difficulté d’interprétation de certains clichés radiographiques et le risque de sous- ou sur-diagnostiquer des pneumopathies, l’intérêt du scanner thoracique se pose. Une étude française a évalué l’impact du scanner thoracique sur le diagnostic et la prise en charge des patients se présentant aux urgences pour une suspicion de pneumopathie (18). Chaque patient a bénéficié d’une radiographie de thorax et d’un scanner thoracique. Le scanner thoracique a révélé un infiltrat parenchymateux chez 40 patients (30%) dont la radiographie de thorax n’avait pas retrouvé d’anomalie, et a permis d’exclure 56 (29,8%) diagnostics de pneumopathie sur les 188 radiographies ayant retrouvé un infiltrat parenchymateux, ce qui a entrainé une modification de prise en charge des patients. Un nouveau type de scanner délivrant de très faibles doses d’irradiation, le scanner thoracique ultra-basse dose ou ULD-CT, se développe actuellement. Même si la qualité d’image est dégradée par rapport au scanner traditionnel du fait de la diminution de la dose délivrée, il reste suffisamment performant pour visualiser les anomalies parenchymateuses retrouvées dans les pneumopathies tel que les condensations alvéolaires, les infiltrats nodulaires et les épaississements des parois bronchiques (19,20). Mais il est surtout plus performant que la radiographie de thorax. L’irradiation délivrée par cette nouvelle technique est abaissée à celle d’une radiographie de thorax en incidence face+profil ce qui la rend très intéressante dans les suspicions de pneumopathie.
2.3 Microbiologique
2.3.1 Les germes en causes
De nombreuses études se sont penchées sur l’étiologie des PAC (10,21–23). Dans la moitié des cas, aucun germe n’est mis en évidence.12 Il existe de nombreux pathogènes responsables et en Europe, le germe le plus fréquemment retrouvé est Streptococcus pneumoniae (10). Une co-infection bactérienne et virale peut également être retrouvée.
Les germes les plus fréquemment mis en évidence sont (10):
• Streptococcus pneumoniae. La proportion de pneumopathie attribuable au pneumocoque varie de 19,3 à 27,3% (24–26).
• Les bacilles gram négatifs. Leur incidence est plus importante chez les sujets de plus de 65 ans et est corrélée à l’inhalation, l’hospitalisation récente, la prescription préalable d’antibiotiques (30 jours) et la présence d’une comorbidité broncho-pulmonaire (2). • Haemophilus influenzae • Legionella • Mycoplasma pneumoniae • Les virus
Ceci est à nuancer avec une large étude récente réalisée aux Etats Unis dans laquelle les virus sont plus fréquemment mis en évidence (27). Un ou plusieurs virus ont été mis en évidence chez 23% des patients : Rhinovirus (9%) était le germe retrouvé le plus fréquemment, suivi par Influenza virus (6%). Une ou plusieurs bactéries ont été mis en évidence chez 13% des patients dont Streptococcus pneumoniae dans 5% des cas. Il faut noter que peu d’études sont réalisées en ambulatoire et surtout, dans la moitié des cas, aucun germe n’est mis en évidence.
2.3.2 Les éléments cliniques d’orientation
Certaines tableaux cliniques ou terrain particuliers permettent d’orienter vers une étiologie microbiologique (6) :• Un début brutal, une fièvre élevée dès le premier jour, un malaise général, une douleur thoracique et une opacité alvéolaire systématisée à la radiographie sont des éléments en faveur d’une infection à pneumocoque (5).
• Les bactéries anaérobies : chez les patients ayant des troubles de la déglutition ou un mauvais état bucco-dentaire
13 • Haemophilus influenzae : chez les patients atteints de BPCO
• Klebsiella pneumoniae : chez les patients éthyliques
• Mycoplasma pneumoniae : plutôt chez des patients de moins de 50 ans, sans comorbidité, associée à une infection des voies respiratoires supérieures, dont le début est progressif et avec une fièvre inférieure à 38,5°C (6).
2.3.3 Les résistances du pneumocoque
Le développement des résistances aux antibiotiques devient un réel problème de santé publique. En effet, en 2014, 20,7% des pneumocoques étaient de sensibilité diminuée à la pénicilline (CMI>0,064mg/l). Pour l’amoxicilline, les souches de sensibilité diminuée (CMI> 0,5mg/l) représentaient 6%. Le taux de résistance du pneumocoque aux macrolides était de 22,6%. Cette résistance était fréquemment associée à une résistance aux bêta-Lactamines : parmi les souches de sensibilité diminuée aux bêta-lactamines, 73,1% étaient résistantes aux macrolides. La résistance à la pristinamycine restait faible : seulement 2 souches étaient de sensibilité diminuée cette molécule en 2014. Concernant la télithromycine, 2 souches de pneumocoque, soit 0,3%, y étaient résistantes. La résistance aux fluoroquinolones concernait 0,7% des souches de pneumocoques étudiées en 2014 (28).
2.3.4 Les examens microbiologiques
Plusieurs examens microbiologiques permettent d’identifier les germes en cause : • Les hémocultures
• L’examen cytobactériologique des crachats (ECBC) : il existe une très grande variabilité de sensibilité allant de 15 à 100% et de spécificité de 11 à 100% du fait de difficulté de réalisation du prélèvement, du frottis et de la lecture (29). Mais l’intérêt de l’ECBC est limité car il s’agit le plus souvent d’un recueil salivaire et peut induire en erreur le médecin. Les critères témoignant d’une origine bronchique sont : plus de 25 polynucléaires neutrophiles et moins de 10 cellules épithéliales par champ. Le seuil de significativité est la prédominance d’une espèce à la coloration de gram et un taux supérieure ou égale à 10^7 UFC/ml à la culture.
14 • L’antigénurie pneumocoque permet de détecter de manière non invasive la présence d’antigènes anti-pneumococciques urinaires (par immunochromatographie). Cette technique a une sensibilité de 43 à 75% et une spécificité supérieure à 90% (3,12). Ce test reste positif 6 semaines après le début des symptômes, voire 3 mois chez certains malades, et même 7 jours après le début d’une antibiothérapie (2).
• L’antigénurie légionelle : elle ne concerne que Legionella pneumophila de sérogroupe 1. Sa sensibilité est de 85 à 90% et sa spécificité de 100% (3,30).
• Les sérologies : pour les germes atypiques comme Mycoplasma pneumoniae ou
Chlamydia pneumoniae. Mais en routine, son intérêt est limité car elle permet
seulement un diagnostic rétrospectif (3).
• La PCR sur prélèvements respiratoires : elle est utilisée pour les bactéries atypiques mais aussi pour les virus respiratoires. Il existe peu de données sur l’utilisation de la PCR pour les germes atypiques et sa sensibilité ne serait pas optimale sur les secrétions nasopharyngées (3). Cependant, pour la détection des virus respiratoires, les PCR sont plus sensibles que l’immunofluorescence et le délai pour obtenir le résultat est souvent très rapide. Il existe des kits PCR multiplex permettant de rechercher plusieurs pathogènes à la fois. Mais du fait du cout élevé, ces examens n’ont pas leur place en tant qu’examen de routine et sont limités aux patients hospitalisés ayant des signes cliniques en faveur d’une infection virale ou une atteinte radiologique diffuse (3).
2.3.5 Recommandations actuelles
La recherche du pathogène n’est pas recommandée dans les pneumopathies peu sévères mais est recommandée dans le cas des infections modérées à sévères car aucun signe clinique ni radiologique ne permet de prédire le germe en cause.
En effet, les recommandations françaises préconisent de ne pas réaliser de bilan microbiologique pour les pneumopathies ayant un PSI de I à II.
15 Pour les patients hospitalisés en dehors d’un service de réanimation (PSI de III à IV), il est recommandé de réaliser des hémocultures ainsi qu’un ECBC (examen direct, après coloration Gram, et culture) à condition d’être en présence d’une toux productive. La recherche d’antigène urinaire pneumocoque n’est pas recommandée mais la détection d’antigène urinaire de Legionella est justifiée chez les patients présentant des symptômes évocateurs de Légionellose ou en période épidémique.
Pour les patients hospitalisés en réanimation, les hémocultures, l’analyse cyto- bactériologique des sécrétions trachéobronchiques prélevées lors de l’intubation, et la détection d’antigènes urinaires pneumocoque et Legionella sont recommandées (2).
L’ATS/IDSA en 2007, la BTS en 2009 et l’ESCMID en 2011 recommandent également de ne pas réaliser d’investigations microbiologiques pour les patients ambulatoires (8,12,14). Cependant, en cas d’échec du traitement antibiotique, l’ECBC est indiqué (8). Pour les patients hospitalisés, il est recommandé de réaliser au minimum des hémocultures et un ECBC, à condition que l’on soit en présence d’une pneumopathie modérée à sévère (8,12,14,31).
2.4 Place des autres examens complémentaires
La réalisation d‘examens complémentaires dans les pneumopathies est nécessaire pour évaluer sa gravité et pour le calcul de certain scores de sévérité. Ils doivent donc être réalisés s’il existe des signes vitaux ou des comorbidités et doivent être faits en milieu hospitalier.
Dans les pneumopathies à pyogènes, les leucocytes et la CRP sont le plus souvent augmentés, mais ces examens ne sont ni assez sensibles ni spécifiques pour les différencier des pneumopathies virales (3).
La BTS en 2009 recommande de réaliser chez tous patients admis à l’hôpital pour une pneumopathie, un ionogramme sanguin avec urée pour évaluer la sévérité, une CRP, une NFS, un bilan hépatique mais aussi des gaz du sang artériel si la saturation en oxygène diminuée (8).
Par ailleurs, la présence d’une leucopénie<4000/mm3 ou à l’inverse d’une
16 coagulopathie sont des critères de gravité permettant d’aider à la bonne orientation du patient hospitalisé (2).
La réalisation de la PCT fait encore débat (32). Elle n’a pas d’intérêt dans le diagnostic clinique de la PAC mais pourrait être utile pour aider à la décision de débuter ou non une antibiothérapie ou de l’arrêter plus précocement. Une étude menée en Allemagne a évalué la corrélation entre la PCT et l’étiologie des pneumopathies (33). Il est conclut que la PCT est augmentée dans les pneumopathies bactériennes par rapport aux pneumopathies virales ou à germe atypique, mais ne permet pas de prédire de façon individuelle l’étiologie. Plusieurs études ont développé un algorithme basé sur les valeurs de PCT pour aider à l’initiation d’une antibiothérapie :
• PCT<0,1μg/l : antibiotique fortement contre indiqué • PCT entre 0,1 et 0,25μg/l : antibiotique contre indiqué • PCT entre 0,25 et 0,5μg/l : antibiotique recommandé • PCT>0,5μg/l : antibiotique fortement recommandé
Ces études montrent que la prescription d’antibiotiques est moins importante dans le groupe PCT et qu’il n’existe pas de différence significative sur le taux de guérison à 1 mois (34–36). D’autres études ont cherché à réduire la durée de l’antibiothérapie en surveillant la PCT suivant un algorithme similaire : • PCT<0,1μg/l : arrêt de l’antibiotique fortement recommandé • PCT entre 0,1 et 0,25μg/l : arrêt de l’antibiotique recommandé • PCT entre 0,25 et 0,5μg/l : maintien de l’antibiotique recommandé • PCT>0,5μg/l : maintien de l’antibiotique fortement recommandé
Cette stratégie a plusieurs limites. En effet, on s’aperçoit que, bien que les durées d’antibiotiques étaient plus courtes dans le groupe PCT, les durées d’hospitalisations ne différaient pas entre les deux groupes. De même, malgré le contrôle de la PCT, les durées d’antibiotiques restaient longues : supérieure à 7 jours pour plus de la moitié des patients. Par ailleurs, le dosage de la PCT par immunofluorescence n’est pas forcément disponible partout et représente un coût significatif. De même, dans le cas d’une infection récente, le taux peut être bas et l’examinateur pourrait ne pas tenir compte de la PCT pour initier une antibiothérapie (36).
17 L’utilisation de la PCT dans la décision de débuter une antibiothérapie dans les PAC est encore incertaine par crainte de ne pas initier à tort le traitement. Cependant, les recommandations européennes de 2011 mentionnent la réalisation de la PCT pour réduire la durée d’antibiotique (12).
La PCT a également été étudiée pour évaluer la sévérité des pneumopathies. Une étude a montré qu’il existait une corrélation entre la sévérité des PAC et le taux de PCT avec une aussi bonne performance que le score CRB65 (37).
2.5 Evaluation initiale de la gravité et orientation
2.5.1 Les signes de gravité
Après avoir fait le diagnostic de pneumopathie, il est essentiel de rechercher des signes de gravité qui justifieraient une hospitalisation du patient. L’atteinte des fonctions supérieures ou vitales (PAS<90mmHg, fréquence cardiaque>120/min, fréquence respiratoire>30/min), la température <35°C ou ≥40°C, une néoplasie associée ou une pneumopathie d’inhalation ou sur obstacle trachéobronchique sont des éléments justifiant l’hospitalisation du patient. Même en l’absence de ces signes, la présence d’une complication (épanchement pleural, abcès pulmonaire), de conditions socio-économiques défavorables, une inobservance prévisible ou l’incapacité de prendre un traitement per os sont des éléments en faveur d’une hospitalisation (2,5).2.5.2 Les scores cliniques
De nombreux scores cliniques existent afin d’aider le médecin à évaluer la sévérité et le lieu de prise en charge d’une PAC.2.5.2.1 Le PSI
Le PSI (Pneumonia Severity Index) ou score de Fine publié en 1997 (Annexe 2), permet de diviser les patients en 5 groupes à risque de mortalité (38). Il comporte 20 items basés sur les données démographiques, les comorbidités, les données de l’examen physique et les données radiologiques et biologiques : les trois premiers groupes ont un risque de mortalité faible ce qui permet une prise en charge ambulatoire alors que les groupes IV et V18 nécessitent une hospitalisation. Le calcul se fait en 2 temps : les patients de moins de 50 ans, n’ayant pas de comorbidité (maladie néoplasique, maladie hépatique, insuffisance cardiaque congestive, maladie cérébro-vasculaire ou maladie rénale) et dont l’examen clinique ne retrouve pas de signe de gravité sont classés dans le groupe I. Pour les autres patients, le score est calculé puis ils sont classés du groupe II à V en fonction du résultat. Ce score a été validé par de nombreuses études (39). La principale performance de ce score réside dans sa capacité à individualiser les patients à faible risque de mortalité et ainsi les traiter en ambulatoire. Mais, il n’est pas conçu pour orienter les patients dans les différents services une fois l’hospitalisation décidée. Par ailleurs, la présence des 20 items le rend difficile à utiliser dans la pratique courante notamment en ambulatoire puisqu’il est nécessaire d’avoir des données biologiques et radiologiques (39).
2.5.2.2 Le CURB 65 et le CRB 65
Le CURB 65 (Annexe 3) est un score simplifié qui permet d’évaluer le risque de mortalité et de diviser les patients en 3 groupes : mortalité faible (0-1 point) permettant un traitement ambulatoire, mortalité intermédiaire (2 points) nécessitant une hospitalisation courte et mortalité élevée (≥3 points) nécessitant une hospitalisation éventuellement en soins continus (40). Ce score permet également d’identifier les patients à faible risque de mortalité et a l’avantage d’être beaucoup plus simple à utiliser que le score de Fine. Cependant, la nécessité d’avoir l’urémie fait qu’il est peu utilisé en ville (39). Il a donc été simplifié par le CRB 65 (Annexe 4) plus facile d’utilisation, puisque tous les critères sont cliniques, et validés par plusieurs études (41,42). Si le résultat est supérieur ou égal à 1, une évaluation hospitalière est nécessaire.
Il existe quelques limites à ces 2 scores. Ils ne prennent pas en compte les comorbidités du patient. En effet, ces patients sont à risque de décompenser leur comorbidité et leur mortalité est donc plus élevée. De même, ils n’ont pas été conçus pour sélectionner les malades nécessitant une hospitalisation en soins continus.
19
2.5.2.3 Comparaison des différents scores
Le PSI, CURB65 et CRB65 ont été comparés dans plusieurs études. Il n’existe pas de différence significative entre ces 3 scores pour évaluer le risque de mortalité mais le PSI semble plus performant pour déterminer les patients à faible risque (43,44).
Par ailleurs, ces scores ne tiennent pas compte des facteurs sociaux et de l’environnement du patient. En effet, un patient sans domicile fixe ou en situation précaire sera difficilement traité en ambulatoire puisqu’il aura peu de chance de suivre son traitement : il sera donc hospitalisé quelque soit la sévérité de la pneumopathie. Le jugement clinique du médecin reste donc indispensable (39).
2.5.3 Algorithme d’orientation
L’orientation du patient se fait donc en plusieurs étapes :
-dans un premier temps, la recherche des éléments de gravité ou un contexte social défavorable justifiant une hospitalisation
-dans un second temps, le calcul des scores afin d’évaluer le risque de mortalité et la possibilité de prendre en charge le patient en ambulatoire (2,39).
On peut proposer le schéma suivant :
20 Hospitalisation Recherche de signe de gravité : • Atteinte des fonctions supérieures • Atteinte des fonction vitales : o PAS<90mmHg, o FC>120/min, o FR>30/min • Température<35 ou ≥40°C • Pneumopathie d’inhalation ou sur obstacle trachéo bronchique connu ou suspecté Présence de comorbidité : • Age ≥65 ans • Maladie cérébro-vasculaire • Insuffisance rénale ou hépatique • Insuffisance cardiaque congestive • Maladie néoplasique • Immunodepression • Vie en institution
Arbre décisionnel d’orientation des pneumopathies aiguë communautaires (Selon Bui HN et al. Où traiter une pneumopathie aiguë communautaire : évaluation de la sévérité ? Revue des Maladies Respiratoires, 2011) (39).
Oui Non
Oui Evaluation aux urgences
Calcul du score de Fine
Score I-III Score IV-V
Traitement
ambulatoire Hospitalisation Traitement ambulatoire
21
III-Prise en charge thérapeutique
3.1 Recommandations françaises
De nombreuses recommandations sur le traitement des pneumopathies existent. Les dernières recommandations françaises ont été réalisées en 2006 par la Société de Pathologies Infectieuses de la Langue Française avec une mise au point en 2010 par l’AFSSAPS, la SPILF et la SPLF (2,5).
Le traitement est probabiliste le plus souvent et notamment en ambulatoire et le 1er germe à prendre en compte est Streptococcus pneumoniae, ce d’autant que le début des symptômes est brutal, qu’il existe un malaise général, que la fièvre est élevée, qu’il existe un point douloureux thoracique et que la radiographie de thorax retrouve une opacité systématisée. En l’absence de comorbidité, pour les pneumopathies non sévères prises en charge en ambulatoire, le traitement de première intention est l’Amoxicilline à 1 gramme 3 fois par jour per os ou la Pristinamycine à 1 gramme 3 fois par jour per os ou la Télithromycine à 800mg par jour. En cas suspicion d’un germe atypique, on privilégiera un macrolide.
En présence de comorbidités, l’Amoxicilline associée à l’acide clavulanique sera privilégiée, et s’il s’agit de personnes vivant en institution, on pourra également utiliser l’amoxicilline-acide clavulanique ou la Ceftriaxone (1 gramme par jour IV, IM ou SC) ou une fluoroquinolone anti pneumococcique (Levofloxacine 500mg par jour ou Moxifloxacine 400mg par jour).
Une réévaluation au 2e ou 3e jour est nécessaire permettant de changer d’antibiothérapie en
cas de non amélioration voire d’aggravation.
En cas d’échec, une substitution d’antibiotique est nécessaire : en l’absence de comorbidités, on remplacera par un macrolide ou la Pristinamycine ou la Télithromycine, alors qu’en présence de comorbidité, on préfèrera une fluoroquinolone anti pneumococcique. Pour les personnes vivant en institution ou présentant des comorbidités, l’hospitalisation est alors nécessaire.
Dans le cadre de pneumopathie non sévère prise en charge en milieu hospitalier (SAU, service de médecine), s’il existe une forte suspicion de pneumocoque, le traitement de premier choix reste l’Amoxicilline à 3 grammes par jour per os ou IV. En l’absence d’argument pour une pneumocoque, l’Amoxicilline 3 grammes par jour per os ou IV ou la
22 Pristinamycine per os ou la Télithromycine per os sont recommandés et chez les sujets âgés ou présentant des comorbidités, l’Amoxicilline-Acide clavulanique à 3 grammes par jour, IV ou per os, ou la Ceftriaxone 1 gramme par jour IV ou une FQAP per os sont à privilégier. La durée de traitement est de 7 à 14 jours (10 jours en moyenne). Avec les kétolides et les FQAP, la durée peut être raccourcie mais sans plus de précision.
3.2 Autres recommandations
Des recommandations plus récentes ont été publiées en Grande Bretagne en 2014 par la NICE (31). Le choix de l’antibiotique de première intention pour les pneumopathies peu sévères traitées en ambulatoire reste l’Amoxicilline mais la différence est dans la durée du traitement : 5 jours si les symptômes et l’état clinique se sont améliorés après 3 jours d’antibiotique.
De même, les recommandations américaines publiées en 2007 par l’ATS/IDSA préconisent une antibiothérapie par un macrolide ou la Doxycycline pour une durée de 5 jours si la fièvre a régressé depuis 48-72 heures et s’il n’existe pas plus d’un signe d’instabilité clinique (fréquence cardiaque ≤100/min, fréquence respiratoire ≤24/min, pression artérielle systolique ≥90mmHg, saturation en oxygène ≥90%, absence de confusion, traitement oral possible) (14). Les recommandations hollandaises de 2011 préconisent également une antibiothérapie par Amoxicilline pour une durée de 5 à 7 jours pour les pneumopathies de sévérité faible à modérée (45). En Allemagne, il est également recommandé d’utiliser l’Amoxicilline en première intention pour une pneumopathie de faible sévérité sans facteur de risque (antibiothérapie récente, comorbidités, vie en institution) ou l’association Amoxicilline-Acide clavulanique en présence de facteur de risque, pour une durée de 5 à 7 jours (46). Les recommandations européennes de 2011 vont également dans ce sens en préconisant une antibiothérapie par Amoxicilline ou Tétracycline en première intention pour une durée ne devant pas excéder 8 jours si le patient répond au traitement (12).
Toutes ces recommandations préconisent des durées d’antibiotiques de 5 à 8 jours pour les pneumopathies de faible sévérité alors que les recommandations françaises donnent des instructions plus larges de 7 à 14 jours. Le tableau 1 (annexe 5) résume les différentes recommandations pour le traitement des pneumopathies en ambulatoire.
23
Ces recommandations sont en accord avec différentes études qui ont démontré qu’une antibiothérapie plus courte était aussi efficace qu’un long traitement. Une étude a comparé l’efficacité de 3 jours d’Amoxicilline en intra-veineux par rapport à 8 jours chez des patients hospitalisés : arrêter l’Amoxicilline après 3 jours de traitement n’est pas moins efficace qu’après 8 jours dans les pneumopathies de sévérité faible à modérée chez les patients dont l’état s’est amélioré après 3 jours (47). Des études réalisées chez des enfants ayant une pneumopathie non sévère ont conclu au même résultat : un traitement par Amoxicilline de 3 jours est aussi efficace que 5 jours (48,49). D’autres études se sont intéressées aux Fluoroquinolones. L’une a comparé l’efficacité de la Lévofloxacine à 750mg/jour pendant 5 jours par rapport à 500mg/jour pendant 10 jours dans le traitement des pneumopathies modérées à sévères : le traitement à 750mg pendant 5 jours est aussi efficace que celui de 500mg pendant 10 jours (50). Une autre étude a comparé l’efficacité et la sécurité de 5 et 7 jours de Gemifloxacine à 320mg par jour chez des patients adultes pris en charge en ambulatoire : aucune différence significative des taux de guérison clinique n’a été retrouvée entre les deux groupes (51). Une étude multicentrique de non infériorité menée en Espagne a validé les recommandations américaines de l’IDSA/ATS concernant l’arrêt de l’antibiothérapie après 5 jours si le patient est apyrétique depuis 48 heures et ne présente pas plus d’un élément d’instabilité clinique lié à la pneumopathie (52).
Plusieurs méta-analyses se sont intéressées à ces études comparant des traitements de courtes durées à des traitements plus longs (53–55). Elles concluent à l’absence de différence concernant l’efficacité des traitements de courtes durées par rapport aux traitements de longues durées dans les pneumopathies non sévères.
24
IV-Problématique
Les pneumopathies aigues communautaires représentent un enjeu majeur de santé publique. Selon l’OMS, les infections respiratoires basses représentent la première cause mondiale de mortalité par maladie infectieuse en 2015 (1). La prise en charge de cette infection doit donc être optimale afin de limiter cette mortalité. Elle repose essentiellement sur l’antibiothérapie. Cependant, cette prescription d’antibiotique doit être raisonnée et réfléchie. En effet, la France fait parti des plus gros consommateurs d’antibiotiques en Europe avec une consommation 30% supérieure à la moyenne européenne (28). En 2015, elle se situait au 4e rang derrière la Grèce, la Roumanie et Chypre. En volume, 93% de la consommation d’antibiotiques provient de prescriptions faites en ville et 25% concerne les infections respiratoires basses (56). Le mésusage des antibiotiques a des conséquences sur la résistance bactérienne et notamment du pneumocoque. En 2014, 20,7% des souches étudiées sont de sensibilité diminuée à la Pénicilline (CMI>0,064mg/l). Pour l’Amoxicilline, les souches de sensibilité diminuée représentent 6% (CMI>0,5mg/l) et 0,8% sont résistantes (CMI>2mg/l) (28). Le lien entre exposition aux antibiotiques et émergence de germes résistants a été démontré (57–60) : un moyen de diminuer cette pression de sélection serait de réduire les durées d’antibiothérapie. Cette réduction pourrait également avoir d’autres avantages comme améliorer l’observance thérapeutique, diminuer le risque iatrogène et diminuer les coûts (57).
Dans les pneumopathies, de nombreuses études se sont penchées sur la durée de traitement par antibiotiques et concluent qu’un traitement court est aussi efficace qu’un traitement long (47–49,51,61,62) en terme de guérison mais également en comparant les complications et la mortalité. Cependant, peu d’entre elles utilisent l’Amoxicilline et sont réalisées en ambulatoire.
A partir de ce constat, nous nous sommes interrogés sur la durée de prescription de l’amoxicilline et de l’amoxicilline-acide clavulanique dans les pneumopathies non sévères prise en charge en ambulatoire.
A partir des données l’étude CAPA menée par le Département de Médecine Générale de la faculté de Médecine Paris Descartes (63), nous avons comparé l’impact de la durée d’antibiotique par Amoxicilline ou Amoxicilline-Acide Clavulanique pendant ≤7 jours et
25 pendant >7 jours sur la durée des symptômes cliniques principaux de pneumopathie, c’est-à-dire la fièvre ≥38,5°C, la toux persistante, la douleur thoracique, la dyspnée et la fatigue avec un retentissement sur les activités de la vie quotidienne, chez des adultes pris en charge en ambulatoire.
26
Deuxième partie : L’étude
Impact de la durée de l’antibiothérapie sur la durée des symptômes
dans les pneumopathies aigues communautaires prise en charge en
ambulatoire
I-Introduction
Les pneumopathies aigues communautaires (PAC) sont une des plus importantes causes de mortalité et morbidité dans le monde (1). Des études prospectives réalisées au Royaume-Uni, en Finlande et en Amérique du nord ont reporté une incidence annuelle des pneumopathies diagnostiquées en ambulatoire chez des adultes entre 5 et 11 ‰(64). En France, la prévalence des pneumopathies aigues communautaires est estimé entre 400,000 et 600,000 cas par an et conduit à 800.000 consultations par an en médecine générale. En ambulatoire, les pneumopathies représentent 5% des infections respiratoires basses (2). La mortalité liée aux pneumopathies prises en charge en ambulatoire reste faible et est inférieur à 1% (8).Streptococcus pneumoniae est le premier pathogène responsable des PAC et serait en cause
dans environ 27% des pneumopathies (24,25). Compte tenu de sa fréquence et de sa gravité potentielle, il est le germe en prendre en compte prioritairement dans le choix du traitement. Plusieurs sociétés savantes ont développé des recommandations pour améliorer la prise en charge des pneumopathies aigues, cependant des divergences persistent notamment concernant la durée de l’antibiothérapie (2,8,12,14,31). En effet, les recommandations françaises de 2006 et 2010 préconisent un traitement de 7 à 14 jours (2,5), avec une moyenne de 10 jours, alors que la durée de l’antibiothérapie est plus courte dans les recommandations américaines et anglaises (14,31). Les dernières recommandations anglaises publiées en 2014 par la National Institute of Health and Care Excellence (NICE) préconisent 5 jours d’antibiotique (31) et les recommandations américaines préconisent un traitement d’au moins 5 jours pour les patients qui seraient apyrétique depuis 48-72 heures, et en l’absence de plus d’un signe clinique d’instabilité (c’est-à-dire PAS<90mmHg, fréquence cardiaque>100/min, fréquence respiratoire>24/min, saturation artérielle en
27 oxygène<90% ou une pression artérielle en oxygène<60mmHg en air ambiant, confusion) avant d’arrêter l’antibiotique (14). Plusieurs études suggèrent qu’une antibiothérapie plus courte, notamment pour l’amoxicilline, serait aussi efficace qu’un traitement long (47– 49,65). Mais peu d’entre elles ont été réalisées en chez des adultes et en ambulatoire (48,49). La durée optimale d’une antibiothérapie par amoxicilline et amoxicilline-acide clavulanique en ambulatoire dans le traitement des PAC reste inconnue. Par ailleurs, la sur-prescription d’antibiotiques et ses méfaits deviennent un réel problème de santé publique. En 2014 en France, 20.7% des pneumocoques étaient de sensibilité diminuée à la pénicilline (28). Plusieurs études ont démontré le lien entre l’exposition de la population aux antibiotiques et l’émergence des germes résistants (58,60,66). Réduire la durée de l’antibiothérapie, notamment l’amoxicilline, dans le traitement des pneumopathies aigues communautaires pourraient être un moyen de réduire la pression de sélection (57,58,60). Une étude prospective de cohorte de patients présentant une pneumopathie aigue communautaire et consultant un médecin généraliste a été menée entre septembre 2011 et Juillet 2012 (63). A partir de cette étude descriptive, nous avons comparé l’impact de la durée du traitement antibiotique par Amoxicilline ou Amoxicilline-Acide clavulanique prescrit pendant ≤7 jours et >7 jours sur la durée des symptômes cliniques principaux de pneumopathie chez des patients adultes pris en charge en ambulatoire.
II-Matériels et Méthodes
Il s’agit d’une étude ancillaire d’une étude de cohorte observationnelle prospective (CAPA Study), réalisée par le département de Médecine Générale de la Faculté Paris Descartes, menée de Septembre 2011 à Juillet 2012 par un réseau de 475 médecins généralistes répartis sur la France entière (63). Les médecins devaient inclure de façon consécutive tous patients présentant une pneumopathie communautaire aigue. La réalisation de la radiographie de thorax était laissée à leur appréciation.
L’objectif de cette étude était de comparer l’impact de la durée du traitement antibiotique par amoxicilline ou amoxicilline-acide clavulanique prescrit pendant ≤7 jours et >7 jours sur
28 la durée des symptômes cliniques principaux de pneumopathie chez des patients adultes pris en charge en médecine générale.
2.1 Critères d’inclusion
Les critères d’inclusion étaient : l’âge supérieur à 18 ans et présentant au moins un signe clinique suggérant une pneumopathie aigue : fièvre >38.5°C, toux, douleur thoracique, tachycardie> 100/minute, tachypnée >25/min et une impression globale de sévérité. Ces signes devaient être associés à la présence de crépitants unilatéraux récents à l’auscultation. En l’absence de crépitant, une radiographie de thorax mettant en évidence une nouvelle opacité pulmonaire était nécessaire pour inclure la patient. Les patients hospitalisés dans les mois précédents étaient exclus. Pour cette étude, nous avons ciblé les patients traités par amoxicilline ou amoxicilline-acide clavulanique en monothérapie, comme préconisé dans les recommandations françaises.
Les patients répondant à tous les critères d’inclusion devaient signer un formulaire de consentement avant le recueil des données lors de la première visite. Certains patients ont bénéficié d’une consultation intermédiaire laissée à l’initiative du médecin généraliste. Seule la visite finale était obligatoire, par téléphone ou en consultation, et devait avoir lieu entre la 4e et la 6e semaine après l’inclusion.
2.2
Recueil des données
Les données collectées incluaient la date de la visite, l’âge, le sexe, le mode de vie, les antécédents et les signes cliniques, les examens complémentaires réalisés et leurs résultats, les traitements, les motifs de reconsultation, la durée des principaux symptômes, la présence d’un arrêt de travail et sa durée, l’hospitalisation et le décès. Les données de chaque patient ont été dé-identifiées.
Deux attachés de recherche clinique ont réalisé un processus de contrôle de la qualité des données durant toute l’étude. Ils se sont également assurés que les critères d’inclusion étaient remplis afin d’éliminer les patients ayant une bronchite ou présentant des crépitants secondaire à une autre cause.
29
2.3 Critère de jugement principal
Le critère de jugement principal était un score composite dans lequel les durées des symptômes cliniques principaux de pneumopathie ont été additionnées. Ces symptômes étaient : la fièvre >38,5°C, la toux persistante, la douleur thoracique, la dyspnée et la fatigue avec retentissement sur les activités de la vie quotidienne.
2.4 Méthode statistique
Nous avons décrit les variables continues avec des moyennes (écart-type) et les variables qualitatives avec des pourcentages. Nous avons séparé notre population en deux groupes : les patients ayant reçu une antibiothérapie par amoxicilline ou amoxicilline-acide clavulanique pendant ≤7 jours et ceux ayant reçu une antibiothérapie par amoxicilline ou amoxicilline-acide clavulanique pendant >7 jours. Nous avons réalisé une analyse multivariée par régression linéaire afin de déterminer si la durée de l’antibiothérapie était associée à notre critère de jugement principal, c’est-à-dire la somme de la durée des symptômes cliniques principaux de pneumopathie (fièvre, toux persistante, douleur thoracique, dyspnée et fatigue avec retentissement sur la vie quotidienne) en ajustant avec les variables associées à ces symptômes.
Nous avons inclus dans notre modèle les variables associées de façon significative à notre critère de jugement principal lors d’analyses bivariées (p<0,1), ainsi que les variables associées à la guérison des pneumopathies selon la littérature médicale (67,68). Notre modèle a également été appliqué à chaque symptôme de notre score composite. Nous avons calculé la puissance a posteriori. Les analyses statistiques ont été réalisées avec le logiciel R 3.0.2 (69).
III-Résultats
3.1 Population
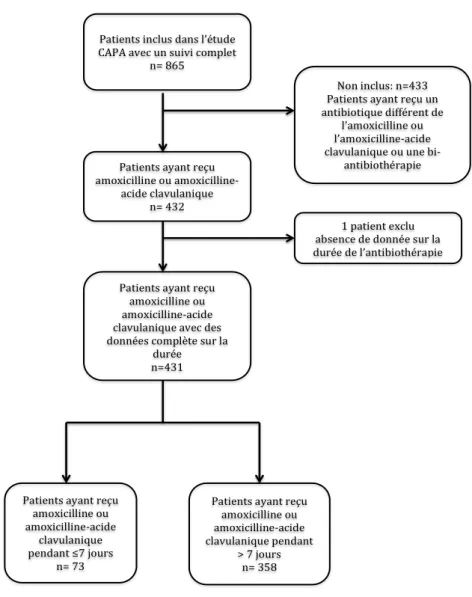
Parmi les 865 patients présentant une pneumopathie aigue communautaire inclus dans l’étude, 432 ont reçu de l’amoxicilline ou l’amoxicilline-acide clavulanique (Figure 1). Dans
30 cette population, 73 patients ont reçu ce traitement pour une durée ≤7 jours (traitement court) et 358 patients pendant >7 jours (traitement long). Un patient a été exclu puisque la durée de traitement n’était pas renseignée. L’âge moyen (Ecart-type) était de 53.4 ans (17) et 54 ans (18.7) respectivement dans le groupe traitement court et le groupe traitement long. Il y avait 37 femmes (50.7%) dans le groupe traitement court et 186 (52%) dans le groupe traitement long. Un seul patient est décédé durant l’étude. Les caractéristiques des patients sont décrites dans le Tableau 1. Figure 1. Diagramme de flux Patients inclus dans l’étude CAPA avec un suivi complet n= 865 Patients ayant reçu amoxicilline ou amoxicilline-acide clavulanique n= 432 Patients ayant reçu amoxicilline ou amoxicilline-acide clavulanique pendant ≤7 jours n= 73 Patients ayant reçu amoxicilline ou amoxicilline-acide clavulanique pendant > 7 jours n= 358 1 patient exclu absence de donnée sur la durée de l’antibiothérapie Patients ayant reçu amoxicilline ou amoxicilline-acide clavulanique avec des données complète sur la durée n=431 Non inclus: n=433 Patients ayant reçu un antibiotique différent de l’amoxicilline ou l’amoxicilline-acide clavulanique ou une bi-antibiothérapie
31
Patients traités par Amoxicilline ou Amoxicilline-acide clavulanique N= 431 Antibiothérapie pendant ≤7 jours N = 73 Antibiothérapie pendant >7 jours N = 358 n (%)a ou moyenne (ET)* NA b (%) n (%) a ou moyenne (ET)* NA b (%) n (%) a ou moyenne (ET)* NA b (%) Sexe féminin 223 (51.7) 37 (50.7) 186 (52) Age 53.9 (18.4)* 53.4 (17)* 54 (18.7)* IMC (kg/m2) 25.5 (5.1)* 19 (4.4) 26.3 (5.5)* 4 (5.5) 25.4 (5)* 15 (4.2) Lieu de vie : rural <5000 habc 166 (38.5) 28 (38.4) 142 (40)
Enfants<5 ans présent dans le foyer 84 (19.5) 6 (1.4) 7 (9.6) 2 (2.7) 77 (21.5) 4 (1.1) Patient dépendant au domicile 18 (4.2) 4 (5.5) 14 (3.9)
Vaccination Pneumo-23 40 (9.3) 18 (4.2) 8 (11) 1 (1.37) 32 (8.9) 17 (4.8) Vaccination anti grippale 94 (21.8) 26 (6) 15 (20.6) 4 (5.5) 79 (22.1) 22 (6.2) Fumeur 119 (27.6) 1 (0.2) 19 (26) 100 (27.9) 1 (0.3) Consommation excessive d’alcool 19 (4.4) 12 (2.8) 2 (2.7) 2 (2.7) 17 (4.8) 10 (2.8) Ouvrier 36 (8.4) 1 (0.2) 5 (6.85) 1 (1.4) 31 (8.7) Etudiant 11 (2.6) 1 (0.2) 1 (1.4) 1 (1.4) 10 (2.8) Cadre 50 (11.6) 1 (0.2) 9 (12.3) 1 (1.4) 41 (11.5) Retraité 140 (32.5) 1 (0.2) 22 (30.1) 1 (1.4) 118 (33) ANTECEDENTS Asthme 46 (10.7) 7 (9.6) 39 (10.9) BPCO 35 (8.2) 8 (11) 27 (7.5) Antécédent de pneumopathie 53 (12.3) 8 (11) 45 (12.6) Insuffisance respiratoire 56 (13) 12 (16.4) 44 (12.3) Insuffisance cardiaque 15 (3.5) 3 (4.1) 12 (3.4) Maladie des artères coronaires 20 (4.6) 4 (5.5) 16 (4.5) Diabète 30 (7) 6 (8.2) 24 (6.7) SYMPTOMES Température > 37.8°C 334 (77.5) 69 (16) 56 (76.7) 11 (15.1) 278 (77.7) 58 (16.2) Asthénie, courbatures/arthralgies 344 (79.8) 58 (79.5) 286 (79.9) Frissons 304 (70.5) 49 (67.1) 255 (71.2) Toux 405 (94) 68 (93.2) 337 (94.1) Crachats/Expectorations 247 (57.3) 1 (0.2) 43 (58.9) 204 (57) 1 (0.3) Rhinorrhée 134 (31.1) 21 (28.8) 113 (31.6) Dyspnée 198 (45.9) 33 (45.2) 165 (46.1)
Douleur thoracique unilatérale 170 (39.4) 1 (0.2) 27 (37) 143 (39.9) 1 (0.3) Douleur thoracique bilatérale 45 (10.4) 6 (8.2) 39 (10.9)
Sifflements respiratoires 89 (20.7) 1 (0.2) 19 (26) 70 (19.6) 1 (0.3) Température maximale déclarée (°C) 38.8 (0.8)* 67 (15.5) 38.6 (0.8)* 13 (17.8) 38.8 (0.8)* 54 (15.1) Température maximale mesurée lors
de la consultation (°C) 37.8 (0.9)* 277 (64.3) 37.8 (0.8)* 44 (60.3) 37.8 (0.9)* 233 (65.1) Tachycardie ≥ 100 beats/min 56 (13) 22 (5.1) 7 (9.6) 5 (6.9) 49 (13.7) 17 (4.8) Fréquence respiratoire ≥ 30/min 43 (10) 113 (26.2) 10 (13.7) 25 (34.3) 33 (9.2) 87 (24.3) Crépitants bilatéraux 11 (2.6) 0 11 (3.1)
Crépitants unilatéraux 145 (33.6) 26 (35.6) 119 (33.2) Diminution unilatérale du murmure
vésiculaire 120 (27.8) 23 (31.5) 97 (27.1) Délai entre le début des symptômes
et la consultation (jours) 5.8 (5.8)* 1 (0.2) 4.8 (4.8)* 6 (5.9)* 1 (0.3) Impression globale de sévérité 99 (23) 2 (0.5) 10 (13.7) 89 (24.9) 2 (0.6) Score CRB 65d=0 191 (44.3) 121 (28.1) 28 (38.4) 25 (34.3) 163 (45.5) 96 (26.8) CRB 65=1 98 (22.7) 13 (17.8) 85 (23.7) CRB 65=2 19 (4.4) 6 (8.2) 13 (3.6) CRB 65=3 2 (0.5) 1 (1.4) 1 (0.3) Décès 1 (0.2) 27 (6.3) 0 5 (6.9) 1 (0.3) 22 (6.2) RADIOGRAPHIE
Radiographie de thorax positive 249 (57.8) 39 (53.4) 210 (58.7) Radiographie de thorax négative 83 (19.3) 12 (16.4) 71 (19.8) Absence de radiographie 99 (23) 22 (30.1) 77 (21.5)
32 Tableau 1. Caractéristiques, symptômes et signes à l’inclusion de tous les patients et selon la durée de l’antibiothérapie.
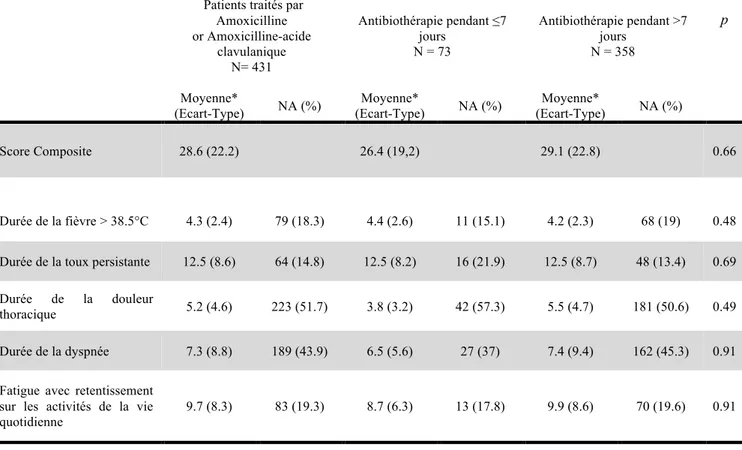
3.2 Critère de jugement principal
La durée moyenne (Ecart-type) des symptômes cliniques principaux de pneumopathie était de 26.4 jours (19.2) dans le groupe traité pendant ≤7 jours et 29.1 jours (22.8) dans le groupe traité pendant >7 jours. Le Tableau 2 résume la durée de chaque symptôme du score composite.Les analyses bivariées ont mis en évidence que l’âge supérieur à 65 ans, l’asthme, la vaccination anti pneumococcique, l’apparition brutale des symptômes, la présence de signes généraux, la sensation de fièvre, les frissons, la perte d’appétit, les courbatures et myalgies, la douleur thoracique bilatérale, les céphalées, l’hémoptysie, la dyspnée, les sibilants, la diarrhée, les douleurs abdominales, le délai entre le début des symptômes et la consultation, la fréquence cardiaque, l’impression globale de sévérité, les crépitants unilatéraux et bilatéraux étaient significativement associés à la durée des symptômes cliniques principaux de pneumopathie (p<0.1). Ces facteurs ont été introduit dans notre modèle ainsi que la confusion et la vaccination anti-grippale, variables associés à la guérison des pneumopathies selon la littérature (67,68). Concernant le critère de jugement principal, c’est-à-dire la somme des symptômes cliniques principaux de pneumopathie, il n’existait pas de différence significative entre les 2 groupes (p=0,66) (Tableau 2). La puissance calculée a posteriori était de 55% pour détecter une différence significative de 6 jours et de 80% pour détecter une différence significative de 8 jours.
Abréviations: IMC, indice de masse corporelle; BPCO, Bronchopneumopathie chronique obstructive ; ET, Ecart-type
aLes pourcentages sont calculés sur les données disponibles. bDonnées non disponibles.
cVivant dans une ville <5000 habitants (hab).
dScore : 1 point pour chaque élément: confusion, fréquence respiratoire≥30/min, pression artérielle systolique<90mmHg or pression
33
Patients traités par Amoxicilline or Amoxicilline-acide clavulanique N= 431 Antibiothérapie pendant ≤7 jours N = 73 Antibiothérapie pendant >7 jours N = 358 p Moyenne* (Ecart-Type) NA (%) Moyenne* (Ecart-Type) NA (%) Moyenne* (Ecart-Type) NA (%) Score Composite 28.6 (22.2) 26.4 (19,2) 29.1 (22.8) 0.66 Durée de la fièvre > 38.5°C 4.3 (2.4) 79 (18.3) 4.4 (2.6) 11 (15.1) 4.2 (2.3) 68 (19) 0.48
Durée de la toux persistante 12.5 (8.6) 64 (14.8) 12.5 (8.2) 16 (21.9) 12.5 (8.7) 48 (13.4) 0.69 Durée de la douleur
thoracique 5.2 (4.6) 223 (51.7) 3.8 (3.2) 42 (57.3) 5.5 (4.7) 181 (50.6) 0.49 Durée de la dyspnée 7.3 (8.8) 189 (43.9) 6.5 (5.6) 27 (37) 7.4 (9.4) 162 (45.3) 0.91 Fatigue avec retentissement
sur les activités de la vie
quotidienne 9.7 (8.3) 83 (19.3) 8.7 (6.3) 13 (17.8) 9.9 (8.6) 70 (19.6) 0.91
* Toutes les données sont exprimées en jours.
Tableau 2. Résultats de l’analyse multivariée évaluant l’association entre la durée de l’antibiothérapie et le critère de jugement principal et l’association entre la durée de l’antibiothérapie et la durée de chaque symptôme du score composite, après ajustement avec les variables significativement associées au critère de jugement principal.
IV-Discussion
Notre étude avait pour objectif d’évaluer l’impact de la durée de l’antibiothérapie par amoxicilline ou amoxicilline-acide clavulanique pendant ≤7 jours ou >7 jours sur la durée des symptômes cliniques principaux de pneumopathie chez des patients prise en charge en médecine générale. La durée moyenne (Ecart-type) des symptômes cliniques principaux de pneumopathie était de 26.4 jours (19.2) dans le groupe traité pendant ≤7 jours et 29.1 jours (22.8) dans le groupe traité pendant >7 jours. Aucune différence significative n’a été retrouvée entre les 2 groupes. La durée de l’antibiothérapie ne semble donc pas avoir d’impact sur la durée des symptômes cliniques principaux de pneumopathie, c’est-à-dire la
34 fièvre, la toux persistante, la douleur thoracique, la dyspnée et la fatigue avec retentissement sur les activités de la vie quotidienne.
Nos résultats sont en accord avec plusieurs études ayant démontré qu’une antibiothérapie de courte durée est aussi efficace qu'une antibiothérapie plus longue dans le traitement des PAC. Une étude multicentrique randomisée en double aveugle réalisée chez des patients hospitalisés présentant une PAC a mis en évidence qu’interrompre un traitement par amoxicilline après 3 jours chez des patients présentant une amélioration des symptômes serait aussi efficace qu’un traitement de 8 jours (47). Une autre étude réalisée chez des enfants en ambulatoire présentant une pneumopathie de faible sévérité avait conclu qu’une antibiothérapie par amoxicilline pendant 3 jours était aussi efficace que 5 jours (49). Une autre étude réalisée également chez des enfants concluait au même résultat (48). Une étude prospective observationnelle menée au Royaume Uni n’avait pas retrouvé de différence significative concernant la mortalité à 30 jours entre des patients traités pendant 7 jours pour une PAC sévère et ceux traités par une antibiothérapie prolongée (61). Plusieurs méta-analyses se sont intéressées à la réduction des durées d’antibiotiques dans les pneumopathies (53–55). Elles concluaient à l’absence de différence significative en terme de succès clinique et mortalité entre une antibiothérapie de courte durée par rapport à un traitement plus long. Les dernières recommandations anglaises développées par la NICE préconisent de traiter les pneumopathie de faible sévérité en ambulatoire avec l’amoxicilline pendant 5 jours chez des patients dont l’état clinique s’est amélioré dans les 3 jours (31). L’IDSA et l’ATS recommandent de traiter les patients présentant une PAC pendant au moins 5 jours ; l’antibiothérapie peut être interrompu si le patient est apyrétique depuis 48-72 heures et ne présentent pas plus d’un signe clinique d’instabilité (PAS<90mmHg, fréquence cardiaque>100/min, fréquence respiratoire>24/min, saturation artérielle en oxygène<90% ou une pression artérielle en oxygène<60mmHg en air ambiant, confusion)(14). Il en est de même aux Pays-Bas où l’antibiothérapie peut être arrêtée après 5 jours si l’état clinique du patient s’est amélioré dans les 3 jours (45). Toutes ces recommandations sont différentes des françaises.
Un raccourcissement de l’antibiothérapie pourrait avoir plusieurs avantages : diminuer l’émergence des résistances aussi bien au niveau de la flore commensale que des germes pathogènes, améliorer la compliance et réduire les effets secondaires ainsi que les coûts liés
35 au traitement (57,70). Une étude française a évalué le portage oropharyngé du Pneumocoque chez des enfants : elle a conclu qu’une dose faible quotidienne de Bêta-Lactamine et qu’un traitement de longue durée étaient des facteurs de risque d’avoir un Pneumocoque résistant à la pénicilline (71). Une autre étude a mis en évidence que le risque de portage du pneumocoque de sensibilité diminuée à la Pénicilline chez des enfants avec une infection respiratoire basse était plus faible si le patient bénéficiait d’une antibiothérapie de courte durée et avec de fortes doses comparé à un traitement standard (72).
A notre connaissance, il s’agit de la première étude menée en ambulatoire qui a comparé des durées différentes d’amoxicilline ou d’amoxicilline-acide clavulanique chez des patients adultes.
Notre étude a plusieurs limites. Tout d’abord, comme il s’agit d’une étude ancillaire observationnelle, il y avait peu de patients dans le groupe de traitement de courte durée. Deuxièmement, notre critère de jugement était un score composite qui additionnait les durées des principaux symptômes. En effet, les autres études utilisaient des scores complexes qui n’étaient pas applicable dans notre étude. D’autres utilisaient comme critère de jugement la mortalité à 30 jours, ce qui n’était également pas approprié pour notre étude. Troisièmement, notre étude ne concernait que les pneumopathies de faible sévérité. Le diagnostic reposait essentiellement sur la clinique et la radiographie de thorax n’était pas systématique. Cette prise en charge était en accord avec les recommandations anglaises de la BTS (8). Quatrièmement, nous ne pouvons pas exclure un biais d’indication. En effet, les patients qui continuaient de se plaindre avaient probablement une prolongation de leur traitement. Enfin, la puissance a posteriori de notre étude était de 55% pour détecter une différence de 6 jours entre les deux groupes. Cependant, puisque nous avons réalisé une étude observationnelle, nous n’avons pas pu inclure plus de patients afin d’augmenter notre puissance.